Распределение электронов по различным АО называют электронной конфигурацией атома . Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям .
Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронографических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например, для основного состояния атома водорода электронная формула: 1s 1 .
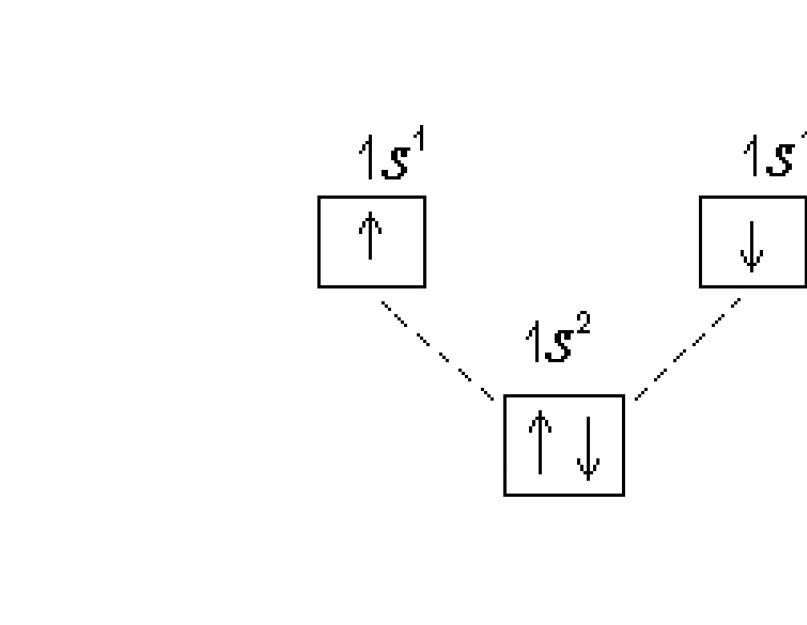
Более полно строение электронных уровней можно описать с помощью электронографических диаграмм, где распределение по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны изображаются стрелками или ↓ в зависимости от знака спинового квантового числа. Электронографическая диаграмма атома водорода:
Принцип построения электронных конфигураций многоэлектронных атомов состоит в добавлении протонов и электронов к атому водорода. Распределение электронов по энергетическим уровням и подуровням подчиняются рассмотренным ранее правилам: принципу наименьшей энергии, принципу Паули и правилу Хунда.
С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s -элементы, p -элементы, d -элементы, f -элементы.
В атоме гелия Не (Z=2) второй электрон занимает 1s -орбиталь, его электронная формула: 1s 2 . Электронографическая диаграмма:

Гелием заканчивается первый самый короткий период Периодической системы элементов. Электронную конфигурацию гелия обозначают .
Второй
период открывает литий Li
(Z=3),
его электронная формула:
 Электронографическая диаграмма:
Электронографическая диаграмма:

Далее приведены упрощенные электронографические диаграммы атомов элементов, орбитали одного энергетического уровня которых расположены на одной высоте. Внутренние, полностью заполненные подуровни, не показаны.
После лития следует бериллий Ве (Z=4), в котором дополнительный электрон заселяет 2s -орбиталь. Электронная формула Ве: 2s 2

В основном состоянии следующий электрон бора В (z=5) занимает 2р -орбиталь, В:1s 2 2s 2 2p 1 ; его электронографическая диаграмма:

Следующие пять элементов имеют электронные конфигурации:
С (Z=6): 2s 2 2p 2 N (Z=7): 2s 2 2p 3

O (Z=8): 2s 2 2p 4 F (Z=9): 2s 2 2p 5

Ne (Z=10): 2s 2 2p 6

Приведенные электронные конфигурации определяются правилом Хунда.
Первый и второй энергетические уровни неона полностью заполнены. Обозначим его электронную конфигурацию и будем использовать в дальнейшем для краткости записи электронных формул атомов элементов.
Натрий Na (Z=11) и Mg (Z=12) открывают третий период. Внешние электроны занимают 3s -орбиталь:
Na (Z=11): 3s 1

Mg (Z=12): 3s 2

Затем, начиная с алюминия (Z=13), заполняется 3р -подуровень. Третий период заканчивается аргоном Ar (Z=18):
Al (Z=13): 3s 2 3p 1

Ar (Z=18): 3s 2 3p 6

Элементы третьего периода отличаются от элементов второго тем, что у них имеются свободные 3d -орбитали, которые могут участвовать в образовании химической связи. Это объясняет проявляемые элементами валентные состояния.
В четвертом периоде, в соответствии с правилом (n +l ), у калия К (Z=19) и кальция Са (Z=20) электроны занимают 4s -подуровень, а не 3d . Начиная со скандия Sc (Z=21) и кончая цинком Zn (Z=30), происходит заполнение 3d -подуровня:
Электронные
формулы d
-элементов
можно представить в ионном виде: подуровни
перечисляются в порядке возрастания
главного квантового числа, а при
постоянном n
– в порядке увеличения орбитального
квантового числа. Например, для Zn
такая запись будет выглядеть так:
 Обе эти записи эквивалентны, но приведенная
ранее формула цинка правильно отражает
порядок заполнения подуровней.
Обе эти записи эквивалентны, но приведенная
ранее формула цинка правильно отражает
порядок заполнения подуровней.
В
ряду 3d
-элементов
у хрома Сr
(Z=24)
наблюдается отклонение от правила
(n
+l
).
В соответствии с этим правилом конфигурация
Сr
должна выглядеть так:
 Установлено, что его реальная конфигурация
-
Установлено, что его реальная конфигурация
-
 Иногда этот эффект называют «провалом»
электрона. Подобные эффекты объясняются
повышенной устойчивостью наполовину
(p
3 ,
d
5 ,
f
7)
и полностью (p
6 ,
d
10 ,
f
14)
заполненных подуровней.
Иногда этот эффект называют «провалом»
электрона. Подобные эффекты объясняются
повышенной устойчивостью наполовину
(p
3 ,
d
5 ,
f
7)
и полностью (p
6 ,
d
10 ,
f
14)
заполненных подуровней.
Отклонения от правила (n +l ) наблюдаются и у других элементов (табл. 2). Это связано с тем, что с увеличение главного квантового числа различия между энергиями подуровней уменьшаются.
Далее происходит заполнение 4p -подуровня (Ga - Kr). В четвертом периоде содержится всего 18 элементов. Аналогично происходит заполнение 5s -, 4d - и 5p - подуровней у 18-ти элементов пятого периода. Отметим, что энергия 5s - и 4d -подуровней очень близки, и электрон с 5s -подуровня может легко переходить на 4d -подуровень. На 5s -подуровне у Nb, Mo, Tc, Ru, Rh, Ag находится только один электрон. В основном состоянии 5s -подуровень Pd не заполнен. Наблюдается «провал» двух электронов.
Таблица 2
Исключения из (n +l ) – правила для первых 86 элементов
|
Электронная конфигурация |
||
|
по правилу (n +l ) |
фактическая |
|
|
4s 2 3d 4 4s 2 3d 9 5s 2 4d 3 5s 2 4d 4 5s 2 4d 5 5s 2 4d 6 5s 2 4d 7 5s 2 4d 8 5s 2 4d 9 6s 2 4f 1 5d 0 6s 2 4f 2 5d 0 6s 2 4f 8 5d 0 6s 2 4f 14 5d 7 6s 2 4f 14 5d 8 6s 2 4f 14 5d 9 |
4s 1 3d 5 4s 1 3d 10 5s 1 4d 4 5s 1 4d 5 5s 1 4d 6 5s 1 4d 7 5s 1 4d 8 5s 0 4d 10 5s 1 4d 10 6s 2 4f 0 5d 1 6s 2 4f 1 5d 1 6s 2 4f 7 5d 1 6s 0 4f 14 5d 9 6s 1 4f 14 5d 9 6s 1 4f 14 5d 10 |
|
В шестом периоде после заполнения 6s -подуровня у цезия Cs (Z=55) и бария Ba (Z=56) следующий электрон, согласно правилу (n +l ), должен занять 4f -подуровень. Однако у лантана La (Z=57) электрон поступает на 5d -подуровень. Заполненный на половину (4f 7) 4f -подуровень обладает повышенной устойчивостью, поэтому у гадолиния Gd (Z=64), следующего за европием Eu (Z=63), на 4f -подуровне сохраняется прежнее количество электронов (7), а новый электрон поступает на 5d -подуровень, нарушая правило (n +l ). У тербия Tb (Z=65) очередной электрон занимает 4f -подуровень и происходит переход электрона с 5d -подуровня (конфигурация 4f 9 6s 2). Заполнение 4f -подуровня заканчивается у иттербия Yb (Z=70). Следующий электрон атома лютеция Lu занимает 5d -подуровень. Его электронная конфигурация отличается от конфигурации атома лантана только полностью заполненным 4f -подуровнем.
В настоящее время в Периодической системе элементов Д.И. Менделеева под скандием Sc и иттрием Y располагаются иногда лютеций (а не лантан) как первый d -элемент, а все 14 элементов перед ним, включая лантан, вынося в особую группу лантаноидов за пределы Периодической системы элементов.
Химические свойства элементов определяются, главным образом, структурой внешних электронных уровней. Изменение числа электронов на третьем снаружи 4f -подуровне слабо отражается на химических свойствах элементов. Поэтому все 4f -элементы схожи по своим свойствам. Затем в шестом периоде происходит заполнение 5d -подуровня (Hf – Hg) и 6p -подуровня (Tl – Rn).
В седьмом периоде 7s -подуровень заполняется у франция Fr (Z=87) и радия Ra (Z=88). У актиния наблюдается отклонение от правила (n +l ), и очередной электрон заселяет 6d -подуровень, а не 5f . Далее следует группа элементов (Th – No) с заполняющимся 5f -подуровнем, которые образуют семейство актиноидов . Отметим, что 6d - и 5f - подуровни имеют столь близкие энергии, что электронная конфигурация атомов актиноидов часто не подчиняется правилу (n +l ). Но в данном случае значение точной конфигурации 5f т 5d m не столь важно, поскольку она довольно слабо влияет на химические свойства элемента.
У лоуренсия Lr (Z=103) новый электрон поступает на 6d -подуровень. Этот элемент иногда помещают в Периодической системе под лютецием. Седьмой период не завершен. Элементы 104 – 109 неустойчивы и их свойства малоизвестны. Таким образом, с ростом заряда ядра периодически повторяются сходные электронные структуры внешних уровней. В связи с этим следует ожидать и периодического изменения различных свойств элементов.
Периодическое изменение свойств атомов химических элементов
Химические свойства атомов элементов проявляются при их взаимодействии. Типы конфигураций внешних энергетических уровней атомов определяют основные особенности их химического поведения.
Характеристиками атома каждого элемента, которые определяют его поведение в химических реакциях являются энергия ионизации, сродство к электрону, электроотрицательность.
Энергия ионизации – это энергия, необходимая для отрыва и удаления электрона от атома. Чем ниже энергия ионизации, тем выше восстановительная способность атома. Поэтому энергия ионизации является мерой восстановительной способности атома.
Энергия ионизации, необходимая для отрыва первого электрона, называется первой энергией ионизации I 1 . Энергия, необходимая для отрыва второго электрона, называется второй энергией ионизации I 2 и т.д.. При этом имеет место следующее неравенство
I 1 < I 2 < I 3 .
Отрыв и удаление электрона от нейтрального атома происходит легче, чем от заряженного иона.
Максимальное значение энергии ионизации соответствует благородным газам. Минимальное значение энергии ионизации имеют щелочные металлы.
В пределах одного периода энергия ионизации изменяется немонотонно. Вначале она снижается при переходе от s-элементов к первым р-элементам. Затем у последующих р-элементов она повышается.
В пределах одной группы с увеличением порядкового номера элемента энергия ионизации уменьшается, что обусловлено увеличением расстояния между внешним уровнем и ядром.
Сродство к электрону – это энергия (обозначается через Е), которая выделяется при присоединении электрона к атому. Принимая электрон, атом превращается в отрицательно заряженный ион. Сродство к электрону в периоде возрастает, а в группе, как правило, убывает.
Галогены имеют самое высокое сродство к электрону. Присоединяя недостающий для завершения оболочки электрон, они приобретают законченную конфигурацию атома благородного газа.
Электроотрицательность – это сумма энергии ионизации и сродства к электрону
Электроотрицательность растёт в периоде и убывает в подгруппе.
Атомы и ионы не имеют строго определенных границ в силу волновой природы электрона. Поэтому радиусы атомов и ионов определяют условно.
Наибольшее увеличение радиуса атомов наблюдается у элементов малых периодов, у которых происходит заполнение только внешнего энергетического уровня, что характерно для s- и р-элементов. Для d- и f-элементов наблюдается более плавное увеличение радиуса с ростом заряда ядра.
В пределах подгруппы радиус атомов увеличивается, так как растёт число энергетических уровней.
Строение электронных оболочек атомов элементов первых четырех периодов: $s-$, $p-$ и $d-$элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. В $1891$ г. Стони предложил эти частицы назвать электронами , что по-гречески означает «янтарь».
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу $(–1)$. Томсон даже сумел определить скорость движения электрона (она равна скорости света - $300 000$ км/с) и массу электрона (она в $1836$ раз меньше массы атома водорода).
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами - катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами , а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве , в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
На рисунке показан «разрез» такой электронной плотности в атоме водорода, проходящей через ядро, а штриховой линией ограничена сфера, внутри которой вероятность обнаружения электрона составляет $90%$. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона - $10%$, вероятность обнаружения электрона внутри второго от ядра контура составляет $20%$, внутри третьего - $≈30%$ и т.д. В состоянии электрона есть некая неопределенность. Чтобы охарактеризовать это особое состояние, немецкий физик В. Гейзенберг ввел понятие о принципе неопределенности , т.е. показал, что невозможно определить одновременно и точно энергию и местоположение электрона. Чем точнее определена энергия электрона, тем неопределеннее его положение, и наоборот, определив положение, нельзя определить энергию электрона. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность нахождения электрона максимальна.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.

В нем заключено приблизительно $90%$ электронного облака, и это означает, что около $90%$ времени электрон находится в этой части пространства. По форме различают $4$ известных ныне типа орбиталей, которые обозначаются латинскими буквами $s, p, d$ и $f$. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.

Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой , или энергетический уровень . Энергетические уровни нумеруют, начиная от ядра: $1, 2, 3, 4, 5, 6$ и $7$.
Целое число $n$, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода - два; седьмого периода - семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
где $N$ - максимальное число электронов; $n$ - номер уровня, или главное квантовое число. Следовательно: на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором - не более $8$; на третьем - не более $18$; на четвертом - не более $32$. А как, в свою очередь, устроены энергетические уровни (электронные слои)?
Начиная со второго энергетического уровня $(n = 2)$, каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй - два; третий - три; четвертый - четыре. Подуровни, в свою очередь, образованы орбиталями.
Каждому значению $n$ соответствует число орбиталей, равное $n^2$. По данным, представленным в таблице, можно проследить связь главного квантового числа $n$ с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
| Энергетический уровень $(n)$ | Число подуровней, равное $n$ | Тип орбитали | Число орбиталей | Максимальное число электронов | ||
| в подуровне | в уровне, равное $n^2$ | в подуровне | на уровне, равное $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| $4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ | ||||
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: $s, p, d, f$. Так:
- $s$-подуровень - первый, ближайший к ядру атома подуровень каждого энергетического уровня, состоит из одной $s$-орбитали;
- $р$-подуровень - второй подуровень каждого, кроме первого, энергетического уровня, состоит из трех $р$-орбиталей;
- $d$-подуровень - третий подуровень каждого, начиная с третьего, энергетического уровня, состоит из пяти $d$-орбиталей;
- $f$-подуровень каждого, начиная с четвертого, энергетического уровня, состоит из семи $f$-орбиталей.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью .
Различают три вида радиоактивных лучей:
- $α$-лучи, которые состоят из $α$-частиц, имеющих заряд в $2$ раза больше заряда электрона, но с положительным знаком, и массу в $4$ раза больше массы атома водорода;
- $β$-лучи представляют собой поток электронов;
- $γ$-лучи - электромагнитные волны с ничтожно малой массой, не несущие электрического заряда.
Следовательно, атом имеет сложное строение - состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
В 1910 г. в Кембридже, близ Лондона, Эрнест Резерфорд со своими учениками и коллегами изучал рассеяние $α$-частиц, проходящих через тоненькую золотую фольгу и падаюших на экран. Альфа-частицы обычно отклонялись от первоначального направления всего на один градус, подтверждая, казалось бы, равномерность и однородность свойств атомов золота. И вдруг исследователи заметили, что некоторые $α$-частицы резко меняли направление своего пути, будто наталкиваясь на какую-то преграду.
Разместив экран перед фольгой, Резерфорд сумел обнаружить даже те редчайшие случаи, когда $α$-частицы, отразившись от атомов золота, летели в противоположном направлении.
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро - футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов - протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку $(+1)$, и массу, равную массе атома водорода (она принята в химии за единицу). Обо значаются протоны знаком $↙{1}↖{1}p$ (или $р+$). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона, т.е. $1$. Обозначают нейтроны знаком $↙{0}↖{1}n$ (или $n^0$).
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus - ядро).
Сумма числа протонов и нейтронов в атоме называется массовым числом . Например, массовое число атома алюминия:

Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают так: $e↖{-}$.
Поскольку атом электронейтрален, также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента , присвоенному ему в Периодической системе. Например, в ядре атома железа содержится $26$ протонов, а вокруг ядра вращается $26$ электронов. А как определить число ней тронов?
Как известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента $(Z)$, т.е. число протонов, и массовое число $(А)$, равное сумме чисел протонов и нейтронов, можно найти число нейтронов $(N)$ по формуле:
Например, число нейтронов в атоме железа равно:
$56 – 26 = 30$.
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos - одинаковый и topos - место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой $12, 13, 14$; кислород - три изотопа с массой $16, 17, 18$ и т. д.
Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому значения атомных масс довольно часто являются дробными. Например, атомы природного хлора представляют собой смесь двух изотопов - $35$ (их в природе $75%$) и $37$ (их $25%$); следовательно, относительная атомная масса хлора равна $35.5$. Изотопы хлора записываются так:
$↖{35}↙{17}{Cl}$ и $↖{37}↙{17}{Cl}$
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
$↖{39}↙{19}{K}$ и $↖{40}↙{19}{K}$, $↖{39}↙{18}{Ar}$ и $↖{40}↙{18}{Ar}$
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки: протий - $↖{1}↙{1}{H}$; дейтерий - $↖{2}↙{1}{H}$, или $↖{2}↙{1}{D}$; тритий - $↖{3}↙{1}{H}$, или $↖{3}↙{1}{T}$.

Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент - это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).

Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.

В атоме гелия первый электронный слой завершен - в нем $2$ электрона.
Водород и гелий - $s$-элементы, у этих атомов заполняется электронами $s$-орбиталь.
Элементы второго периода.
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют $s-$ и $р$-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала $s$, а затем $р$) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен - в нем $8$ электронов.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
У атома магния достраивается $3,5$-электронная орбиталь. $Na$ и $Mg$ - $s$-элементы.
У алюминия и последующих элементов заполняется электронами $3d$-подуровень.
| $↙{18}{Ar}$ Аргон |  |
$1s^2{2}s^2{2}p^6{3}s^2{3}p^6$ |  |
В атоме аргона на внешнем слое (третьем электронном слое) $8$ электронов. Как внешний слой завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными $3d$-орбитали.
Все элементы от $Al$ до $Ar$ - $р$-элементы.
$s-$ и $р$-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого периода.
У атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, т.к. он имеет меньшую энергию, чем $3d$-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода:
- обозначим условно графическую электронную формулу аргона так: $Ar$;
- не будем изображать подуровни, которые у этих атомов не заполняются.
$К, Са$ - $s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами 3d-подуровень. Это $3d$-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с $4s-$ на $3d$-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций $3d^5$ и $3d^{10}$:
$↙{24}{Cr}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{4} 4s^{2}…$ 
$↙{29}{Cu}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}4s^{2}…$ 
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙{19}{K}$ Калий |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1$ | |
| $↙{20}{C}$ Кальций |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2$ | |
| $↙{21}{Sc}$ Скандий |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^1$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^1{4}s^1$ |  |
| $↙{22}{Ti}$ Титан |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^2$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^2{4}s^2$ |  |
| $↙{23}{V}$ Ванадий |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^3$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^3{4}s^2$ |  |
| $↙{24}{Сr}$ Хром |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^5$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^5{4}s^1$ |  |
| $↙{29}{Сu}$ Хром |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^1$ |  |
| $↙{30}{Zn}$ Цинк |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^2$ |  |
| $↙{31}{Ga}$ Галлий |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^{1}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^{1}$ |  |
| $↙{36}{Kr}$ Криптон |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^6$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^6$ |  |
В атоме цинка третий электронный слой завершен - в нем заполнены все подуровни $3s, 3р$ и $3d$, всего на них $18$ электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, $4р$-подуровень. Элементы от $Ga$ до $Кr$ - $р$-элементы.
У атома криптона внешний (четвертый) слой завершен, имеет $8$ электронов. Но всего в четвертом электронном слое, как вы знаете, может быть $32$ электрона; у атома криптона пока остаются незаполненными $4d-$ и $4f$-подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: $5s → 4d → 5р$. И также встречаются исключения, связанные с «провалом» электронов, у $↙{41}Nb$, $↙{42}Мо$, $↙{44}Ru$, $↙{45}Rh$, $↙{46}Pd$, $↙{47}Ag$. В шестом и седьмом периодах появляются $f$-элементы , т.е. элементы, у которых идет заполнение соответственно $4f-$ и $5f$-подуровней третьего снаружи электронного слоя.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: $↙{55}Cs$ и $↙{56}Ва$ - $6s$-элементы; $↙{57}La ... 6s^{2}5d^{1}$ - $5d$-элемент; $↙{58}Се$ – $↙{71}Lu - 4f$-элементы; $↙{72}Hf$ – $↙{80}Hg - 5d$-элементы; $↙{81}Т1$ – $↙{86}Rn - 6d$-элементы. Но и здесь встречаются элементы, у которых нарушается порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных $f$-подуровней, т.е. $nf^7$ и $nf^{14}$.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
- $s$-элементы; электронами заполняется $s$-подуровень внешнего уровня атома; к $s$-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
- $р$-элементы; электронами заполняется $р$-подуровень внешнего уровня атома; к $р$-элементам относятся элементы главных подгрупп III–VIII групп;
- $d$-элементы; электронами заполняется $d$-подуровень предвнешнего уровня атома; к $d$-элементам относятся элементы побочных подгрупп I–VIII групп, т.е. элементы вставных декад больших периодов, расположенных между $s-$ и $р-$элементами. Их также называют переходными элементами;
- $f$-элементы; электронами заполняется $f-$подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.

Электронная конфигурация атома. Основное и возбужденное состояние атомов
Швейцарский физик В. Паули в $1925$ г. установил, что в атоме на одной орбитали может находиться не более двух электронов , имеющих противоположные (антипараллельные) спины (в переводе с английского - веретено), т.е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси по часовой стрелке или против. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным , если два, то это спаренные электроны , т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.

$s-$Орбиталь , как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула , или электронная конфигурация , записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий - это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s$-орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия $Не$, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий - это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s-$орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$. 
$р-$Орбиталь имеет форму гантели, или объемной восьмерки. Все три $р$-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с $n= 2$, имеет три $р$-орбитали. С увеличением значения $n$ электроны занимают $р$-орбитали, расположенные на больших расстояниях от ядра и направленные по осям $x, y, z$.
У элементов второго периода $(n = 2)$ заполняется сначала одна $s$-орбиталь, а затем три $р$-орбитали; электронная формула $Li: 1s^{2}2s^{1}$. Электрон $2s^1$ слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион лития $Li^+$.
В атоме бериллия Be четвертый электрон также размещается на $2s$-орбитали: $1s^{2}2s^{2}$. Два внешних электрона атома бериллия легко отрываются - $В^0$ при этом окисляется в катион $Ве^{2+}$.
У атома бора пятый электрон занимает $2р$-орбиталь: $1s^{2}2s^{2}2p^{1}$. Далее у атомов $C, N, O, F$ идет заполнение $2р$-орбиталей, которое заканчивается у благородного газа неона: $1s^{2}2s^{2}2p^{6}$.
У элементов третьего периода заполняются соответственно $3s-$ и $3р$-орбитали. Пять $d$-орбиталей третьего уровня при этом остаются свободными:
$↙{11}Na 1s^{2}2s^{2}2p^{6}3s^{1}$,
$↙{17}Cl 1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}$,
$↙{18}Ar 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}$.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
$↙{11}Na 2, 8, 1;$ $↙{17}Cl 2, 8, 7;$ $↙{18}Ar 2, 8, 8$.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно $4s-$ и $5s$-орбитали: $↙{19}K 2, 8, 8, 1;$ $↙{38}Sr 2, 8, 18, 8, 2$. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие $3d-$ и $4d-$орбитали соответственно (у элементов побочных подгрупп): $↙{23}V 2, 8, 11, 2;$ $↙{26}Fr 2, 8, 14, 2;$ $↙{40}Zr 2, 8, 18, 10, 2;$ $↙{43}Tc 2, 8, 18, 13, 2$. Как правило, когда будет заполнен предыдущий $d$-подуровень, начнет заполняться внешний (соответственно $4р-$ и $5р-$) $р-$подуровень: $↙{33}As 2, 8, 18, 5;$ $↙{52}Te 2, 8, 18, 18, 6$.
У элементов больших периодов - шестого и незавершенного седьмого - электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступают на внешний $s-$подуровень: $↙{56}Ba 2, 8, 18, 18, 8, 2;$ $↙{87}Fr 2, 8, 18, 32, 18, 8, 1$; следующий один электрон (у $La$ и $Са$) на предыдущий $d$-подуровень: $↙{57}La 2, 8, 18, 18, 9, 2$ и $↙{89}Ac 2, 8, 18, 32, 18, 9, 2$.
Затем последующие $14$ электронов поступят на третий снаружи энергетический уровень, на $4f$ и $5f$-орбитали соответственно лантоноидов и актиноидов: $↙{64}Gd 2, 8, 18, 25, 9, 2;$ $↙{92}U 2, 8, 18, 32, 21, 9, 2$.
Затем снова начнет застраиваться второй снаружи энергетический уровень ($d$-подуровень) у элементов побочных подгрупп: $↙{73}Ta 2, 8, 18, 32, 11, 2;$ $↙{104}Rf 2, 8, 18, 32, 32, 10, 2$. И, наконец, только после полного заполнения десятью электронами $d$-подуровня будет снова заполняться $р$-под уровень: $↙{86}Rn 2, 8, 18, 32, 18, 8$.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек - записывают так называемые графические электронные формулы . Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули , согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда , согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
Задача 1 . Напишите электронные конфигурации следующих элементов: N , Si , F е, Кr , Те, W .
Решение. Энергия атомных орбиталей увеличивается в следующем порядке:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d .
На каждой s -оболочке (одна орбиталь) может находиться не более двух электронов, на p -оболочке (три орбитали) - не более шести, на d -оболочке (пять орбиталей) - не более 10 и на f -оболочке (семь орбиталей) - не более 14.
В основном состоянии атома электроны занимают орбитали с наименьшей энергией. Число электронов равно заряду ядра (атом в целом нейтрален) и порядковому номеру элемента. Например, в атоме азота - 7 электронов, два из которых находятся на 1s -орбитали, два - на 2s -орбитали, и оставшиеся три электрона - на 2p -орбиталях. Электронная конфигурация атома азота:
7 N : 1s 2 2s 2 2p 3 . Электронные конфигурации остальных элементов:
14 Si: 1s 2 2s 2 2p 6 3s 2 3p 2 ,
26 F е: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 ,
36 Кr: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 ,
52 Те: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 4 ,
74 Те: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 .
Задача 2 . Какой инертный газ и ионы каких элементов имеют одинаковую электронную конфигурацию с частицей, возникающей в результате удаления из атома кальция всех валентных электронов?
Решение. Электронная оболочка атома кальция имеет структуру 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . При удалении двух валентных электронов образуется ион Са 2+ с конфигурацией 1s 2 2s 2 2р 6 Зs 2 Зр 6 . Такую же электронную конфигурацию имеют атом Ar и ионы S 2- , Сl — , К + , Sc 3+ и др.
Задача 3 . Могут ли электроны иона Аl 3+ находиться на следующих орбиталях: а) 2р; б) 1р; в) 3d ?
Решение. Электронная конфигурация атома алюминия: 1s 2 2s 2 2p 6 3s 2 3p 1 . Ион Al 3+ образуется при удалении трех валентных электронов из атома алюминия и имеет электронную конфигурацию 1s 2 2s 2 2p 6 .
а) на 2р-орбитали электроны уже находятся;
б) в соответствии с ограничениями, накладываемыми на квантовое число l (l = 0, 1,…n -1), при n = 1 возможно только значение l = 0, следовательно, 1p -орбиталь не существует;
в) на Зd -орбитали электроны могут находиться, если ион - в возбужденном состоянии.
Задача 4. Напишите электронную конфигурацию атома неона в первом возбужденном состоянии.
Решение. Электронная конфигурация атома неона в основном состоянии – 1s 2 2s 2 2p 6 . Первое возбужденное состояние получается при переходе одного электрона с высшей занятой орбитам (2р) на низшую свободную орбиталь (3s ). Электронная конфигурация атома неона в первом возбужденном состоянии – 1s 2 2s 2 2p 5 3s 1 .
Задача 5 . Каков состав ядер изотопов 12 C и 13 C , 14 N и 15 N ?
Решение. Число протонов в ядре равно порядковому номеру элемента и одинаково для всех изотопов данного элемента. Число нейтронов равно массовому числу (указываемому слева вверху от номера элемента) за вычетом числа протонов. Разные изотопы одного и того же элемента имеют разные числа нейтронов.
Состав указанных ядер:
12 С: 6р + 6n ; 13 С: 6р + 7n ; 14 N : 7p + 7n ; 15 N : 7p + 8n .
Электронная конфигурация - формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы .
Электронная конфигурация обычно записывается для атомов в их основном состоянии. Для определения электронной конфигурации элемента существуют следующие правила:
- Принцип заполнения . Согласно принципу заполнения, электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
- Принцип запрета Паули . Согласно этому принципу, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа).
- Правило Хунда . Согласно этому правилу, заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заполнение орбиталей парами электронов с противоположными спинами.
С точки зрения квантовой механики электронная конфигурация - это полный перечень одноэлектронных волновых функций , из которых с достаточной степенью точности можно составить полную волновую функцию атома (в приближении самосогласованного поля).
Если говорить в общем, атом, как составную систему, можно полностью описать только полной волновой функцией . Однако такое описание практически невозможно для атомов сложнее атома водорода - самого простого из всех атомов химических элементов. Удобное приближённое описание - метод самосогласованного поля . В этом методе вводится понятие о волновой функции каждого электрона. Волновая функция всей системы записывается как надлежащим образом симметризованое произведение одноэлектронных волновых функций. При вычислении волновой функции каждого электрона поле всех остальных электронов учитывается как внешний потенциал , зависящий в свою очередь от волновых функций этих остальных электронов.
В результате применения метода самосогласованного поля получается сложная система нелинейных интегродифференциальных уравнений , которая всё ещё сложна для решения. Однако уравнения самосогласованного поля имеют вращательную симметрию исходной задачи (то есть они сферически симметричны). Это позволяет полностью классифицировать одноэлектронные волновые функции, из которых составляется полная волновая функция атома.
Для начала, как в любом центрально симметричном потенциале, волновую функцию в самосогласованном поле можно охарактеризовать квантовым числом полного углового момента l {\displaystyle l} и квантовым числом проекции углового момента на какую-нибудь ось m {\displaystyle m} . Волновые функции с разными значениями m {\displaystyle m} соответствуют одному и тому же уровню энергии, т. е. вырождены. Также одному уровню энергии соответствуют состояния с разной проекцией спина электрона на какую-либо ось. Всего для данного уровня энергии 2 (2 l + 1) {\displaystyle 2(2l+1)} волновых функций. Далее, при данном значении углового момента можно перенумеровать уровни энергии. По аналогии с атомом водорода принято нумеровать уровни энергии для данного l {\displaystyle l} начиная с n = l + 1 {\displaystyle n=l+1} . Полный перечень квантовых чисел одноэлектронных волновых функций, из которых можно составить волновую функцию атома, и называется электронной конфигурацией. Поскольку всё вырождено по квантовому числу m {\displaystyle m} и по спину, достаточно только указывать полное количество электронов, находящихся в состоянии с данными n {\displaystyle n} , l {\displaystyle l} .
Энциклопедичный YouTube
-
1 / 5
По историческим причинам в формуле электронной конфигурации квантовое число l {\displaystyle l} записывается латинской буквой. Состояние с обозначается буквой s {\displaystyle s} , p {\displaystyle p} : l = 1 {\displaystyle l=1} , d {\displaystyle d} : l = 2 {\displaystyle l=2} , f {\displaystyle f} : l = 3 {\displaystyle l=3} , g {\displaystyle g} : l = 4 {\displaystyle l=4} и далее по алфавиту. Слева от числа l {\displaystyle l} пишут число n {\displaystyle n} , а сверху от числа l {\displaystyle l} - число электронов в состоянии с данными n {\displaystyle n} и l {\displaystyle l} . Например 2 s 2 {\displaystyle 2s^{2}} соответствует двум электронам в состоянии с n = 2 {\displaystyle n=2} , l = 0 {\displaystyle l=0} . Из-за практического удобства (см. правило Клечковского) в полной формуле электронной конфигурации термы пишут в порядке возрастания квантового числа n {\displaystyle n} , а затем квантового числа l {\displaystyle l} , например 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3 {\displaystyle 1s^{2}2s^{2}2p^{6}3s^{2}3p^{3}} . Поскольку такая запись несколько избыточна, иногда формулу сокращают до 1 s 2 2 s 2 p 6 3 s 2 p 3 {\displaystyle 1s^{2}2s^{2}p^{6}3s^{2}p^{3}} , т. е. опускают число n {\displaystyle n} там, где его можно угадать из правила упорядочения термов.
Периодический закон и строение атома
Все занимавшиеся вопросами строения атома в любых своих исследованиях исходят из инструментов, которые предоставлены им периодическим законом , открытым химиком Д. И. Менделеевым ; только в своём понимании этого закона физики и математики пользуются для истолкования зависимостей, показанных им, своим «языком» (правда, известен довольно ироничный афоризм Дж. У. Гиббса на этот счёт ), но, в то же время, изолированно от изучающих вещество химиков, при всём совершенстве, преимуществах и универсальности своих аппаратов ни физики ни математики, конечно, строить свои исследования не могут.
Взаимодействие представителей этих дисциплин наблюдается и в дальнейшем развитии темы. Открытие вторичной периодичности Е. В. Бироном (1915), дало ещё один аспект в понимании вопросов, связанных с закономерностями строения электронных оболочек. C. А. Щукарев , ученик Е. В. Бирона и
Электронная конфигурация атома – показывает распределение ē по энерг. уровням и подуровням.
1s 1 ←число ē с данной формой облака
↖ форма электронного облака
энерг.уровня
Графические электронные формулы (изображения электронной структуры атома) –
показывает распределение ē по энерг. уровням, подуровням и орбиталям.
I период: +1 Н
Где - ē, ↓ - ē с антипараллельными спинами, орбиталь.
При записи графической электронной формулы следует помнить правило Паули и правило Хундда « Если в пределах одного подуровня имеется несколько свободных орбиталей, то ē размещаются каждый на отдельной орбитали и лишь при отсутствии свободных орбиталей объединяются в пары».
(Работа с электронными и графическими электронными формулами).
Напр., H +1 1s 1 ; He +2 1s 2 ; Li +3 1s 2 2s 1 ; Na +11 1s 2 2s 2 2p 6 3s 1 ; Ar +18 1s 2 2s 2 2p 6 3s 2 3p 6 ;
I период: водород и гелий – s-элементы , у них заполняется электронами s-орбиталь.
II период: Li и Be – s-элементы
B, С, N, O, F, Ne – р-элементы
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на 4 электронных семейства или блока:
1) s-элементы– у них заполняется ē-ми s-подуровень внешнего слоя атома; к ним относятся водород, гелий и эл-ты гл.п/гр. I и IIгрупп.
2) р-элементы – у них заполняется электронамир-подуровень внешнего уровня атома; к ним относят элементы гл.п/гр. III - VIIIгрупп.
3) d-элементы – у них заполняется электронами d-подуровень предвнешнего уровня атома; к ним относятся эл-ты побоч.п/гр. . I- VIII групп,т.е. эл-ты вставных декад больших периодов, распложенные между s- и р-элементами, их также называют переходными элементами.
4) f-элементы - у них заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды (4f-элементы) и актиноиды (5f-элементы).
У атомов меди и хрома происходит «провал» ē с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d 5 и 3d 10:
29 Cu 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 24 Cr 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Экспериментально доказано, что состояния атомов, при которых p-, d-, f-орбитали заполнены наполовину (p 3 , d 5 , f 7), целиком (p 6 , d 10 , f 14) или свободны, обладают повышенной устойчивостью. Этим объясняются переходы – «провалы» - электронов между близкорасположенными орбиталями. Те же отклонения наблюдаются у аналога хрома – молибдена, а также у элементов подгруппы меди – серебра и золота. Уникален в этом отношении палладий, у атома которого 5s-электронывообще отсутствуют и который имеет след. Конфигурацию: 46 Pd 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 0 4d 10 .
Вопросы для самоконтроля
1. Что такое электронное облако?
2. Чем отличается 1s-орбиталь от 2s-орбитали?
3. Что такое главное квантовое число? Как оно соотносится с номером периода?
4. Что такое подуровень и как это понятие соотносится с номером периода?
5. Составить электронные конфигурации атомов элементов 4-6 периода ПСХЭ.
6. Составить электронную конфигурацию атомов магния и неона.
7. Определить какому атому принадлежит электронная конфигурация 1S 2 2S 2 2p 6 3S 1 , 1S 2 2S 2 2p 6 3S 2 , 1S 2 2S 2 2p 4 , 1S 2 2S 1
ПЛАН ЗАНЯТИЯ № 7
Дисциплина: Химия.
Тема:
Цель занятия: Изучить механизмы образования ионной и ковалентной связи, рассмотреть ионные, атомные и молекулярные кристаллические решетки.
Планируемые результаты
Предметные: владение основополагающими химическими понятиями: химическая связь, ионы, кристаллические решетки, уверенное пользование химической терминологией и символикой; сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
Метапредметные: использование различных видов познавательной деятельности и основных интеллектуальных операций: составление электронных конфигураций атомов химических элементов.
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1. Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления. Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.
2. Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки.
3. Ионные кристаллические решетки. Свойства веществ с ионным типом кристаллической решетки.
4. Механизм образования ковалентной связи (обменный и донорно-акцепторный).
5. Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи.
6. Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками.
Оснащение: Модели кристаллических решеток, учебник, периодическая система химических элементов Д.И.Менделеева.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Тема 7. Ионная и ковалентная химическая связь.
1) Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления. Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.
2) Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки.
3) Ионные кристаллические решетки. Свойства веществ с ионным типом кристаллической решетки.
4) Механизм образования ковалентной связи (обменный и донорно-акцепторный).
5) Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи.
6) Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками.
Катионы, их образование из атомов в результате процесса окисления. Анионы, их образование из атомов в результате процесса восстановления. Ионная связь, как связь между катионами и анионами за счет электростатического притяжения.
Химическая связь - это взаимодействие атомов, обусловливающее устойчивость химической частицы или кристалла как целого. Химическая связь образуется за счет электростатического взаимодействия между заряженными частицами: катионами и анионами, ядрами и электронами. При сближении атомов начинают действовать силы притяжения между ядром одного атома и электронами другого, а также силы отталкивания между ядрами и между электронами. На некотором расстоянии эти силы уравновешивают друг друга, и образуется устойчивая химическая частица.
При образовании химической связи может произойти существенное перераспределение электронной плотности атомов в соединении по сравнению со свободными атомами. В предельном случае это приводит к образованию заряженных частиц - ионов (от греческого "ион" - идущий).
Взаимодействие ионов:
Если атом теряет один или несколько электронов, то он превращается в положительный ион - катион (в переводе с греческого - "идущий вниз). Так образуются катионы водорода Н + , лития Li + , бария Ва 2+ . Приобретая электроны, атомы превращаются в отрицательные ионы - анионы (от греческого "анион" - идущий вверх). Примерами анионов являются фторид ион F − , сульфид-ион S 2− .
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
Ионная связь, как правило, возникает между атомами типичных металлов и типичных неметаллов. Характерным свойством атомов металлов является то, что они легко отдают свои валентные электроны, тогда как атомы неметаллов способны легко их присоединять.
Рассмотрим возникновение ионной связи, например, между атомами натрия и атомами хлора в хлориде натрия NaCl.
Отрыв электрона от атома натрия приводит к образованию положительно заряженного иона – катиона натрия Na + .
Присоединение электрона к атому хлора приводит к образованию отрицательно заряженного иона – аниона хлора Cl - .
Между образовавшимися ионами Na + и Cl - , имеющими противоположный заряд, возникает электростатическое притяжение, в результате которого образуется соединение – хлорид натрия с ионным типом химической связи.
Ионная связь – это химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов.
Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершенные электронные конфигурации внешних слоев.
1. Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы:
где n - число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
2. Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя , превращаются в отрицательные ионы:

3. Между разноимённо заряженными ионами возникает связь, которая называется ионной.

2. Классификация ионов: по составу, знаку заряда, наличию гидратной оболочки.
Классификация ионов:
1. По знаку заряда: катионы (положительные, K+, Ca2+, H+) и анионы (отрицательные, S2-, Cl-, I-).
2. По составу: сложные ( , ) и простые (Na+, F-)©2015-2019 сайт
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2017-12-12