Потенциал действия продвигается вдоль аксона за счет продольного распространения тока. Каждый участок мембраны, генерируя импульс по принципу «все или ничего», своей деполяризацией возбуждает соседний участок. Для понимания механизма распространения импульса, а также синаптической передачи и интеграции, необходимо уяснить принцип пассивного распространения импульсов вдоль нерва.
По мере своего продвижения вдоль аксона или дендрита ток теряет свою силу. Снижение величины тока зависит от ряда причин, в первую очередь от диаметра и свойств мембраны нервного волокна. Продольное распространение тока тем больше, чем больше диаметр волокна и чем выше сопротивление мембраны. Емкостные свойства мембраны влияют на временной ход электрических сигналов, а также на распространение тока. Чтобы оценить, на какое расстояние способен распространиться подпороговый потенциал, необходимо знать геометрию и свойства мембраны нейрона и, кроме того, временной ход изменения потенциала.
Аксоны многих типов нервных клеток у позвоночных покрыты оболочкой из миелина, обладающего высоким сопротивлением и малой емкостью. Миелиновая оболочка играет роль изоляционной обмотки провода и заставляет ток перемещаться вдоль мембраны. При этом ток быстро перескакивает от одного перехвата Ранвье (короткого участка мембраны, лишенного миелина) до другого, и скорость проведения при этом возрастает. Миелинизированные волокна встречаются в тех областях нейронной сети, где скорость проведения играет важную роль.
Электрические сигналы способны также передаваться с одного нейрона на другой в местах тесного контакта между ними, называемых щелевыми контактами. Ток в таких соединениях протекает по особым каналам, коннексонам.
Пассивные электрические свойства нервных и мышечных мембранОсобенности проницаемости нейрональных мембран и то, как они способствуют генерации потенциала действия, обсуждались в предыдущих главах. В данной главе речь пойдет главным образом о том, как токи распространяются вдоль нервного волокна и образуют локальные разности потенциалов.
Пассивные электрические свойства нейронов, а именно, сопротивление и емкость мембраны, а также сопротивление цитоплазмы, играют важнейшую роль в нейрональной сигнализации. В органах чувств эти свойства являются связующим звеном между сенсорным стимулом и генерацией импульса; на уровне аксона они позволяют импульсу распространиться; на уровне синапсов они определяют способность постсинаптического нейрона складывать и вычитать синаптические потенциалы, возникающие на многочисленных синаптических входах, будь то вблизи тела клетки или на самых отдаленных дендритах. Для понимания этих процессов нужно знать принципы распространения электрических сигналов вдоль нейронных отростков. В данной главе речь пойдет главным образом о нервных волокнах с постоянным диаметром на всем своем протяжении, т. е. о цилиндрических проводниках. Кроме того, для данного описания мы примем, что в отсутствие регенерации мембрана действительно пассивна, т. е. изменения потенциала, не достигающие порогового уровня, не активируют потенциалзависимых проводимостей и не изменяют тем самым сопротивления мембраны. Данные принципы применимы и к более сложным структурам, таким как разветвления аксонных окончаний или дендритные ветвления с неоднородными электрическими свойствами. Роль подобных структур в функционировании нервной системы весьма велика, однако количественное описание их электрических свойств потребовало бы более сложного анализа.
Кабельные свойства нервных и мышечных волокон
Цилиндрическое нервное волокно состоит из тех же компонентов, что и подводный электрический кабель: из стержневого проводника и изоляционной оболочки, окруженной проводящей средой. Тем не менее, количественное отличие этих двух систем весьма велико. Стержень кабеля обычно сделан из меди или металла с очень высокой проводимостью, в то время как оболочка сделана из пластика или других материалов с очень высоким сопротивлением. Кроме того, оболочка обычно бывает довольно толстая и потому обладает низкой емкостью. Напряжение, приложенное к такому проводу, способно передаться на значительное расстояние благодаря тому, что сопротивление меди мало, как незначительны и потери через оболочку. Содержимое нервного волокна представляет собой раствор солей, по концентрации похожий на внеклеточную среду и, в отличие от меди, обладающий плохой проводимостью. Мембрана клетки, в свою очередь, не является хорошим изолятором и обладает высокой емкостью ввиду своей малой толщины. Напряжение, приложенное к нервному волокну, не распространяется на значительное расстояние по двум причинам:
1) проводимость содержимого волокна мала, следовательно, сопротивление току велико;
2) ток, протекающий вдоль цитоплазмы, рассеивается благодаря утечке сквозь мембрану, не обеспечивающую достаточной изоляции.
Анализ тока в кабеле был начат лордом Кельвином применительно к трансатлантической телефонной связи и усовершенствован Оливером Хевисайдом. В конце XX в. Хевисайд впервые учел значимость утечки тока через изоляционную оболочку, эквивалентную клеточной мембране, а также внес множество важных дополнений в кабельную теорию, в том числе определил понятие импеданса. Кабельная теория была впервые использована для нервных волокон Ходжкиным и Раштоном, которые экспериментально измерили распространение потенциала действия в аксоне омара с помощью внеклеточных электродов. Позднее для подобных измерений в целом ряде нервных и мышечных волокон использовались внутриклеточные электроды.
Основным правилом здесь является закон Ома: ток i, проходя через сопротивление г, создает напряжение ν = ir. Ниже мы рассмотрим также влияние мембранной емкости на величину и временной ход продольного распространения тока.
Ток в кабеле
Для лучшего понимания принципов прохождения тока по кабелю представим себе, как распространяется тепло вдоль металлического прута в теплоизолирующей оболочке, который помещен в проводящую среду (например, в воду). Если нагревать прут с одного конца, тепло распространяется вдоль прута и, по мере своего распространения, частично рассеивается в окружающую среду, проникая через оболочку. Чем дальше от нагреваемого конца, тем ниже температура; по мере снижения температуры снижается и скорость рассеяния тепла. При условии, что окружающая среда обладает высокой теплопроводностью, расстояние, на которое распространится теплота, будет зависеть главным образом от двух параметров:
1) от теплопроводности прута
2) от изолирующих свойств оболочки.
Протекание тока в кабеле происходит похожим образом. Напряжение, приложенное к одному концу кабеля, вызывает протекание тока по стержню в продольном направлении, который частично теряется сквозь оболочку в окружающую среду. Чем дальше от конца, к которому приложено напряжение, тем меньше ток. Расстояние, на которое распространится ток, будет зависеть от проводимости стержня и от того, насколько эффективно оболочка предотвращает потери тока. Оболочка с низким сопротивлением пропустит весь ток в окружающую среду. Оболочка с более высоким сопротивлением позволит току распространиться на большее расстояние.
Ток в аксоне переносится ионами: при инъекции тока в нервное волокно (например, в аксон омара) через микроэлектрод, инъецированные положительные заряды будут отталкивать другие катионы и притягивать анионы. Самый распространенный из небольших ионов внутри клетки - это калий, который, следовательно, переносит наибольшее количество тока через мембрану. Ток протекает в продольно направлении вдоль аксона, и по мере продвижения часть его теряется благодаря перемещению ионов через мембрану. В мембране с низким сопротивлением и большой ионной проводимостью большая часть тока потеряется до того, как он успеет переместиться на сколь-нибудь значительное расстояние. При более высоком сопротивлении мембраны ток распространится вдоль аксона на большее расстояние, прежде чем рассеяться в окружающую среду.
Возбудимостью называется способность ткани отвечать на раздражение специфической для данной ткани реакцией. Возбуждение есть переход возбудимой ткани от состояния функционального покоя к специфической деятельности (для нервной генерация и проведения нервных импульсов, для мышечной ткани - сокращение, для железистой ткани - выделение секрета железы). В этом разделе мы рассмотрим строение и функции нервной и мышечной тканей.
Hервная клетка - звено нервной цепи. Отдельные нервные клетки, или нейроны, выполняют свои функции не как изолированные единицы, подобно клеткам печени или почек. Работа 50 миллиардов нейронов мозга человека состоит в том, что они получают сигналы от каких-то других нервных клеток и передают их третьим. Передающие и принимающие клетки объединены в нервные цепи, или сети. Отдельный нейрон с разветвляющейся на выходе системой отростков (дивергентной структурой) может посылать полученный на входе сигнал тысяче и даже большему числу других нейронов. Точно так же какой-либо иной нейрон может получать входную информацию от других нейронов с помощью одной, нескольких или очень многих входных связей, если на нем сходятся конвергентные пути.
Действительные места соединения нейронов - специфические точки на поверхности клеток, где происходит контакт, - называются синапсами. Выделяемые в синапсах химические вещества - нейромедиаторы - замыкают цепь между контактирующими нейронами и являются химическими посредниками для передачи нервного возбуждения между нервными клетками с химическими синапсами. Позже мы узнаем, что способы передачи информации между нейронами могут быть и иными.
1. Нейрон-это клетка.
Hейроны обладают рядом признаков, общих для всех клеток тела (рис.1).
Рис. 1. Обычная клетка (А) и нейрон (Б).
Подобно им нейрон имеет плазматическую мембрану, определяющую границы индивидуальной клетки. С помощью мембраны и заключенных в ней молекулярных механизмов нейрон осуществляет взаимодействие с другими клетками и воспринимает изменения в окружающей его локальной среде. С помощью селективных свойств мембранных ионных каналов и системы активного и пассивного ионного транспорта клетка регулирует внутриклеточное осмотическое давление и, следовательно, поддерживает свою форму, а также обеспечивает поступление в клетку минеральных элементов, питательных веществ и газов для внутриклеточных нужд, на клеточной мембране генерируются электрические потенциалы, лежащие в основе функции нейронов и других клеток. Мембрана со всех сторон окружает внутреннее содержимое клетки, называемое цитоплазмой. В цитоплазме содержатся ядро и цитоплазматические органеллы, необходимые для существования клетки и выполнения ею своей работы: митохондрии, микротрубочки, нейрофибриллы, эндоплазматический ретикулум.
Митохондрии обеспечивают клетку энергией. Используя сахар и кислород, они синтезируют специальные высокоэнергетические молекулы (АТФ), расходуемые клеткой по мере надобности. Микротрубочки - тонкие опорные структуры - помогают нейрону сохранять свою форму и, как полагают, принимают участие в аксонном транспорте. С помощью эндоплазматического ретикулума - сети внутренних мембранных канальцев - и расположенных на ней структур - рибосом - клетка синтезирует необходимые для ее жизнедеятельности вещества, распределяет их в клетке и секретирует за ее пределы. Нейрофибриллы выполняют опорные функции, обеспечивают направленное перемещение терминалей (концевых веточек) аксонов и являются одним из звеньев механизма аксонного транспорта (см.ниже).
В ядре нейрона содержится генетическая информация, закодированная в химической структуре генов. В соответствии с этой информацией полностью сформированная клетка синтезирует специфические вещества, которые определяют форму, химизм и функцию этой клетки на протяжении всей ее жизни, поскольку нервная клетка не способна делиться.
В отличие от других клеток нейроны имеют неправильные очертания: у них имеются отростки разной длины, часто многочисленные и разветвленные. Эти отростки - живые "провода", с помощью которых образуются нейронные сети. Функции таких проводов выполняют также мембраны тел нервных клеток.
Нервные сети организма животных и человека имеют принципиальное отличие от технических электрических сетей (включая телефонно-телеграфные и интернетовские): они не имеют питающих их центральных генераторов электрического тока. Электрические токи возникают на молекулярных оболочках (мембранах) клеток, благодаря специфическому свойству этих мембран-последовательно генерировать электрические потенциалы, а в клетках возбудимых тканей (нервных и мышечных) еще и проводить их вдоль своей протяженности.
Hервная клетка имеет один главный отросток - аксон, по которому она передает информацию другой клетке, и многочисленные дендриты, по которым клетка получает входящую информацию. И аксон и дендриты могут ветвиться; особенно обширное ветвление наблюдается у дендритов. Hа дендритах и на поверхности центральной части клетки, окружающей ядро, называемой телом нейрона, находятся входные синапсы, образуемые аксонами других нейронов. Окончания аксона или его ветви (терминали) образуют такие синапсы на поверхности мембран других клеток. В этих окончаниях содержатся органеллы, называемые синаптическими пузырьками, в которых накапливаются молекулы медиатора, выделяемого нейроном в синапс воспринимающей клетки. В аксонах отсутствуют клеточные органеллы, синтезирующие белок, поэтому этот отросток, лишенный связи с телом клетки, отмирает.
Длинные отростки нейронов называются нервными волокнами.
2. Проводник или генератор электрического тока? Электрогенные функции клеточной мембраны.
Если в покоящееся нервное волокно ввести микроэлектрод и замкнуть его на второй электрод, введенный на наружную сторону мембраны, то регистрирующий прибор покажет разность потенциалов в 60-90 мВ, причем внутренняя сторона мембраны имеет отрицательный, а наружная - положительный заряды. Эту разность потенциалов в электрофизиологии называют потенциалом покоя (ПК). Какие же силы, разделяя заряды по обе стороны мембраны, создают ей электрическую полярность? Убедительный ответ на этот вопрос дали английские ученые А.Xоджкин, А.Xаксли и Б.Катц (1956-1963 г.г.), получившие по результатам своей работы Hобелевскую премию
Для того, чтобы лучше понять сущность вопроса, следует исходить из того факта, что в организме животных и человека каждая клетка окружена раствором смеси разных солей, преимущественно хлоридов и фосфатов натрия, калия, магния и др., а также их органических соединений. Такие же соединения находятся и внутри клетки, в ее цитоплазме. И будь клетка к этому факту пассивной, он не имел бы для ее жизни и деятельности никаких последствий и никаких зарядов вокруг мембраны не существовало бы, так как концентрация солей и, следовательно, их ионов по обе стороны ее мембраны была бы одинаковой. Следует, однако, заметить, что и сама жизнь в таком случае была бы невозможной.
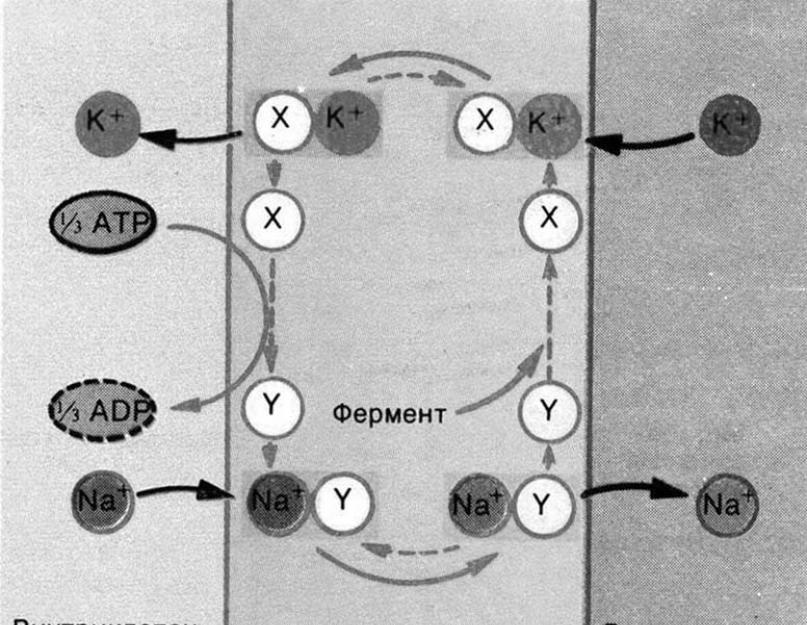
Hо было установлено, что клеточная мембрана обладает способностью с помощью системы активного транспорта переносить ионы калия внутрь клетки, а ионы натрия - наружу против градиента концентрации. Эта способность обеспечивается действием встроенных в мембрану калий-натриевых насосов, использующих для своей работы энергию АТФ (рис. 2).

Рис. 2. Схема работы йонного насоса.
За один цикл насос выносит из клетки 3 иона Na + и возвращает внутрь ее 2 иона К + , затрачивая на эту работу энергию одной молекулы АТФ. Разумеется, молекула АТФ при этом расщепляется с образованием молекулы АДФ и фосфатного остатка. Таким образом клетка создает неравновесные количества натрия и калия вокруг своей мембраны: с внутренней стороны мембраны создается концентрация ионов калия в 30-50 раз большая, нежели с наружной, а ионов натрия во внеклеточной жидкости в 10 раз больше,чем в цитоплазме клетки. Это, однако, само по себе создает разность концентраций катионов, но не зарядов.
Вторую часть процесса поляризации (во времени она осуществляется одновременно с первой) обеспечивает полупроницаемость, или, другими словами, избирательная проницаемость (селективность) мембраны для различных ионов. В покое мембрана свободно пропускает ионы К + , очень плохо - ионы Na + и совсем непроницаема для крупных анионов органических кислот и белков. Созданное ионными насосами неравновесное расположение вокруг мембраны ионов калия и натрия обуславливает пассивный процесс - диффузию этих катионов по градиенту концентрации. Внутри клетки ионы калия движутся в сторону мембраны и, обгоняя менее подвижные отрицательные ионы, выходят на ее наружную сторону. Вследствие этого с внутренней стороны мембраны создается отрицательный электрический заряд, а на наружной ее стороне увеличивается положительный, созданный ионами натрия и расчетную разность потенциаловмежду ними 80-100 мВ. Диффузия ионов натрия внутрь клетки значительно слабее (в 25 раз), чем калия, но все же имеется и вызывает тот же эффект, но направленный внутрь клетки, и в результате несколько снижает расчетный калиевый потенциал мембранны. Поэтому результирующий потенциал покоящейся мембраны (ПП) составляет 50-90 мВ. (рис.3)

Рис. 3. Электрический заряд мембраны.
Подобные диффузионные потоки ионов натрия и калия неминуемо привели бы к выравниванию концентраций ионов по обе стороны мембраны. Этого, однако, в живой клетке не происходит, так как ионные насосы постоянно транспортируют ионы против существующих градиентов, поддерживая концентрационные и электрохимические их градиенты и, следовательно, потенциал покоя. Это, пожалуй, один из главных и самих существенных функциональных признаков жизни. Остановка работы ионных насосов в мембране клетки означает остановку всех жизненных процессов, т.е. смерть клетки.
3. Быт клеток электрифицирован. Роль потенциала покоя в жизни клетки.
Зачем обычной клетке электричество? Известно, что в теле животных и человека кроме нервов и мышц, есть клетки кожи, внутренних органов, окружающих их тканей. Установлено, что все они имеют мембранные потенциалы соответственно от 15 до 50 мВ. Таким образом, нервные клетки не являются монополистами в отношении наличия у них электрических потенциалов и, следовательно, использования электричества в своей жизнедеятельности. Для чего нужно клеткам электричество? Попробуем представить себе, как бы это выглядело, если бы мы задали вопрос, скажем, домашней хозяйке, зачем ей нужно электричество?. Или зачем нужно электричество какому-либо современному промышленному производственному предприятию, расположенному, предположим, во втором этаже здания?
Кроме воды и некоторых электролитов, которые свободно проходят через клеточную мембрану, клетке необходимы питательные вешества, например, сахара, аминокислоты, некоторые минеральные элементы, которые не могут проникать в клетку по законам диффузии. Собственно, в процессе эволюции клетка могла бы обзавестись такой мембраной, которая пропускала бы все ионы и молекулы органических веществ свободно,и все вопросы обеспечения клетки питательными веществами решались бы по законам диффузии. Почему же этого не произошло в действительности? Во-первых, по законам диффузии, ионы и молекулы веществ двигались бы внутрь клетки только при условии их большей концентрации снаружи, во-вторых, жизнедеятельность клетки не терпитперерывов в обеспечении необходимым веществом, которые могли бы время от времени возникать по причине уменьшения его в окружающей клетку среде, в-третьих, выравнивание по обе стороны ее клеточной мембраны вредных для клетки продуктов ее метаболизма не только само по себе губительно влияли бы на клетку, но также уменьшали бы концентрацию нужных для клетки веществ во внешней среде, этим самим вызывая их обратный отток из клетки. Жизненные интересы клетки оказались несовместимыми с подобной "рыночной" стихией и эволюция клетки сделала ее мембрану избирательно проницаемой для одних ионов и наделила ее активными транспортными средствами для "ввоза" внутрь клетки других веществ, а также для "вывоза" из клетки ненужных ей продуктов метаболизма. Выбирать вид энергии для обеспечения работы средств транспорта клетке не пришлось: электричество ей было известно на миллионы лет раньше, чем древнегреческому ученому Фалесу, указавшему на способность янтаря, натертого шелком, притягивать к себе легкие предметы,
В качестве транспортных средств в мембрану клетки встроены молекулы белка-переносчика и питательные вещества в клетку они транспортируют следующим образом (рис. 4).

Рис. 4. Схема мембранного транспорта.
Hа наружной стороне мембраны молекула белка-переносчика присоединяет к себе молекулу питательного вещества и йон натрия, приобретая в связи с этим положительный заряд. Электрическое поле мембраны, поворачивая молекулу переносчика вокруг ее гипотетической оси, втягивает ее положительно заряженный полюс к внутренней стороне мембраны. Здесь ион натрия теряет свой заряд и оставляет ячейку переносчика, что приводит к отщеплению от него нейтральной молекулы переносимого питательного вещества. Питательное вещество остается внутри клетки, а натрий выкачивается насосом наружу, в результате чего на наружной стороне мембраны восстанавливается положительный заряд.
Для переноса в клетку разных сахаров и аминокислот имеются разные белки-переносчики, но все они используют в клетках животных ионы натрия и мембранный потенциал покоя. У бактерий вместо натрия используются ионы водорода
Электрический транспорт используется для удаления некоторых веществ из клетки Избыток кальция в клетке, если кальциевый насос не справляется с его удалением, опасен. Включается аварийная система клетки. При этом особый белок-переносчик к своей внутриклеточной части присоединяет ион кальция, а к наружной - три иона натрия. Электрическое поле мембраны поворачивает молекулу переносчика на 180° и кальций выбрасывается наружу. В отличие от калий-натриевых насосов, которые для своей работы используют энергию АТФ и при этом создают на мембране электрическое поле (электрические потенциалы), указанные выше белки-переносчики работают как электромоторы, использующие для своей работы электрическую энергию мембранного потенциала.
Механизмы активного переноса питательных веществ в клетку необходимо связаны с ее жизнью и, несомненно, должны были возникнуть вместе с возникновением клетки. Передача же сигналов от клетки к клетке - более поздняя потребность эволюции, поэтому закономерно предполагать, что когда такая потребность возникла, то нервные клетки, несколько модифицировав свою мембрану, использовали мембранный потенциал для новой функции - передачи сигналов. В чем же заключалась эта модификация?
4. Изменения мембранного потенциала. Потенциал действия.
В 1939 году сотрудники морской станции в Плимуте (Англия) А.Ходжкин и Х.Хаксли впервые измерили ПП и ПД нервного волокна, использовав для этого гигантский (диаметр в 1 мм) аксон кальмара и самую совершенную на то время экспериментальную технику. Оказалось, что в покое на мембране разность потенциалов равна примерно 80 мВ, а при возбуждении мембрана не разряжается, как это предполагал Бернштейн, а перезаряжается: ее отрицательные заряды оказываются снаружи, а положительные - внутри. При этом на мембране возникает разность потенциалов, равная примерно 40 мВ. Значит, при возбуждении потенциал меняется не на величину ПП, т.е. не падает до нуля, а на сумму ПП и вновь возникающего потенциала с обратным знаком (рис.8). Это превышение ПД над ПП назвали овершутом (англ. oversoot - превышение).
С целью объяснения этого "дополнительного" потенциала Ходжкин и Хаксли высказали гипотезу, суть которой заключалась в том, что при возбуждении мембрана не просто полностью утрачивает избирательную проницаемость, а меняет ее: из проницаемой главным образом для йонов K + мембрана становится проницаемой преимущественно для йонов Na + . А так как последних снаружи мембраны больше, то они устремляются внутрь и перезаряжает мембрану.
Первая проверка гипотезы была предпринята А.Ходжкиным и Б.Катцем после длительного перерыва, связанного с войной, в 1949 году. Исследования показали, что амплитуда ПД зависит от изменения концентрации йонов Na + так же, как величина ПП - от концентрации йонов K + , т.е. подчиняется формуле Нернста.
Далее надо было выяснить, как в действительности во время возбуждения меняется проницаемость мембраны для калия и натрия, от каких условий зависят эти изменения. Ходжкин и Хаксли предположили, что проницаемость мембраны определяется двумя условиями: мембранным потенциалом и временем, прошедшим с момента изменения потенциала. Результатом длительной и трудоемкой проверки этого предположения было экспериментальное подтверждение того, что в основе механизма всех явлений, связанных с возбуждением, действительно лежит свойство мембраны: ее переменная избирательная проницаемость для ионов калия и натрия. Была создана теория возникновения ПД при разных условиях и начальных состояниях мембраны, т.е. "современная мембранная теория", называемая также моделью Х-Х.. Модель исправно воспроизводила такие явления, как рефрактерность, порог возбуждения, гиперполяризация волокна после импульса и др.
Оставались, однако, пока без ответов вопросы: каков механизм изменения проницаемости мембраны, как устроена эта тончайшая перегородка? Проникновение в тайны устройства мембраны и ее функциональных механизмов начались позже, когда появилась новая наука - молекулярная биология.
Строение мембраны. Цитоплазматическая мембрана представляет из себя пассивную молекулярную пленку, состоящую из двух слоев молекул липидов; в нее встроены белковые молекулы, выполняющие в мембране активные функции ионных каналов и насосов, молекул-переносчиков, рецепторов и др. Бимолекулярный слой липидов изолирует клетку от окружающей среды и является также изолятором в электрическом отношении. Связь клетки с окружащей средой и все активные функции ее мембраны осуществляются с помощью встроенных в мембрану белковых молекул (рис. 5)

Рис. 5. Плазматическая мембрана клетки
Определенные белковые молекулы обеспечивают способность локальной чувствительности мембраны к воздействию раздражителей и соответствующей реакции на эти воздействия. Эволюционная модификация мембраны нервной клетки заключалась в создании на мембране механизмов локального изменения мембранных потенциалов с последующим волнообразным распространением этого изменения вдоль мембраны. Последней способностью обладают также мембраны клеток других тканей.
Ионные каналы. Активные электрические свойства клеточной мембраны определяются встроенными в нее белковыми молекулами, образующими в однородной и непроницаемой для молекул и ионов липидной мембране "поры", через которые названные частицы при определенных условиях могут проходить. Те поры, через которые могут проходить ионы калия и натрия, назвали соответственно калиевыми и натриевыми ионными каналами.
Ионные каналы образованы особым классом белковых молекул, способных различать "свои" ионы и открывать или закрывать для них путь через мембрану под действием соответствующего мембранного потенциала. Английский биофизик Б.Хилл выяснил, что диаметр калиевого канала равен примерно 0,3 нм, а у натриевого канала просвет для прохода ионов несколько больше. В отличие от натриевого К + -канал лишен инактивационного механизма. Следует заметить, что прохождение того или иного ко каналу определяется не диаметром последнего, а его функциональными свойствами и мембранными электрическими потенциалами.
Ионный канал можно себе представить как встроенную в мембрану сквозную трубку (рис. 6)

Рис. 6. Схема работы ионного канала.
Вблизи наружного конца трубка имеет "заслонку" или "ворота", положением которых управляет мембранный потенциал, "Заслонка" заряжена и поэтому при изменении потенциала (при деполяризации) может открывать вход в канал для соответствующего иона. Считают, что ворота каналов представляют собой заряженную группу атомов белковой молекулы, способную смещаться в электрическом поле, открывая при этом дорогу для ионов калия или натрия. Смещение такой заряженной группы должно сопровождаться кратковременным небольшим электрическим током; этот ток в натриевых каналах удалось зарегистрировать в эксперименте и он был назван "воротным током"). При изучении натриевых каналов было показано, что механизмы ворот и их инактивации находятся на разных концах канала. После удаления внутреннего конца канала с помощью фермента проназы канал продолжал открывать ворота для натрия под действием деполяризации, но не инактивировался.
Установлена плотность натриевых каналов в мембране. Их оказалось примерно 50 на одном квадратном микрометре мембраны (такая площадь мембраны вмещает несколько миллионов молекул липидов).
Кроме калиевых и натриевых каналов в мембранах клеток имеются каналы для ионов кальция, хлора и других ионов. Постепенное изменение мембранной проницаемости, например, для ионов калия, объясняется тем, что у соответствующих каналов, кроме состояний "открыто" и "закрыто", есть еще какие-то иные состояния, т.е. что каналам свойственен вероятностный характер работы, что и было подтверждено экспериментально. Сначала предполагалось, что ионный канал - это стабильный биологический механизм, который встраивается в мембрану и работает достаточно долго, но позже выяснилось, что белки-каналы функционируют всего около суток, а потом они демонтируются и заменяются другими, синтезированными рибосомами клетки по командам информационной РНК. Было обнаружено, что белки-каналы встраиваются в мембрану не случайным образом, что разные ионные каналы транспортируются клеткой строго в нужное место.
Кроме каналов, открывание и закрывание которых управляется электрическим мембранным потенциалом, есть ионные каналы, управляемые химическими веществами (не только медиаторами в синапсах), воздействующими на мембрану как снаружи, так и изнутри клетки. Например, рост концентрации циклического аденозинмонофосфата (цАМФ) в некоторых нейронах приводит к открыванию каналов и деполяризации клетки, а увеличение этой концентрации стимулируется адреналином. Клетка может не только управлять работой ионных каналов, она может их модифицировать, менять их свойства посредством управляемых биохимических реакций. Такие процессы происходят, например, при обучении.
Изменения мембранного потенциала . Клеточная мембрана обладает свойством реагировать на раздражение изменением потенциала покоя - быстро нарастающим процессом ее локальной деполяризации. Степень этой деполяризации зависит от интенсивности раздражителя и у нервных и мышечных клеток может заканчиваться полным кратковременным исчезновением мембранного потенциала в участке раздражения с последующей инверсией полярности и затем - реполяризации, т.е. восстановления исходного состояния. Это явление носит название потенциала действия. Уровень мембранного потенциала, при котором дальнейшее нарастание силы раздражителя и дальнейшая деполяризации дает начало потенциалу действия, называется порогом, а соответствующий раздражитель - пороговым.
Уровни деполяризации мембраны. Если сила действующего на мембрану раздражителя не будет превышать 0,5 величины порогового раздражения, то деполяризация мембраны будет отмечена только во время действия раздражителя. Это явление называется электротоническим потенциалом (рис. 7)
Рис. 7. Электротонический потенйиал.
Ионная проницаемость мембраны при этом практически не изменяется. При увеличении силы раздражителя до 0,9 пороговой величины процесс деполяризации идет по S-образной кривой, некоторое время продолжает нарастать после прекращения действия раздражителя, но затем медленно прекращается. Такая реакция мембраны клетки называется локальным ответом. Локальный ответ не способен к распространению. Однако при нанесении нескольких подпороговых раздражений с интервалом, меньшим продолжительности отдельного локального ответа, последние суммируются и деполяризация мембраны увеличивается, что у нервных и мышечных клеток может привести к возникновению потенциала действия. Эпителиальные клетки не могут генерировать потенциал действия. Их реакция на действие раздражителя любой силы ограничивается локальным ответом.
При воздействии на мембрану раздражителя пороговой или надпороговой силы мембранный потенциал снижается на 20-40 мВ по сравнению с потенциалом покоя, т.е. до некоей критической величины. Если при этом сила стимула не снижается, то в мембране скачкообразно открываются поры (каналы) для ионов натрия, проницаемость ее для этих катионов возрастает в десятки, даже в сотни раз. По концентрационному и электрохимическому градиентам ионы натрия лавинообразно устремляются внутрь клетки, унося с собой положительные заряды. Hа наружной стороне мембраны в возбужденном месте вместо положительных устанавливаются отрицательные заряды за счет крупных анионов органических кислот и белков. Внутренняя же сторона мембраны этот лавинообразный поток катионов Na воспринимает как впрыск электрического тока с положительным знаком.
Hакопление ионов Na + на внутренней стороне мембраны вначале приводит к нейтрализации ее отрицательного заряда, т.е. к ее деполяризации, а затем к установлению в этом месте положительного заряда: деполяризация сменяется инверсией зарядов (рис.8).

Рис. 8. Потенциал действия.
Мембранный потенциал в месте действия стимула становится положительным. Эта положительная фаза мембранного потенциала называется овершутом или спайком, а высота на кривой потенциала составляет 40-50 мВ. Графически - это восходящая ветвь кривой потенциала действия. В этот момент наступает инактивация натриевых каналов, проницаемость мембраны для ионов натрия прекращается, сменяясь повышением калиевой проводимости. Увеличенный поток ионов калия наружу восстанавливает исходную полярность, обуславливая реполяризацию мембраны, а включающиеся вслед за этим натриевые насосы, выкачивая наружу клетки ионы натрия, заканчивают процесс реполяризации.

Рис. 9. Изменение возбудимости мембраны нервного волокна
в течение потенциала действия.
Графически эти процессы характеризует нисходящая ветвь кривой потенциала действия. Поток ионов Na + на наружную сторону мембраны приводит к некоторому увеличению мембранного потенциала по сравнению с исходным. Это т.н. "следовая гиперполяризация" мембраны. В этот период, называемый периодом рефрактерности, мембрана нечувствтельна к повторному раздражению. Этот факт и меет два последствия. Во-первых, нечувствительность этого участка мембраны к повторному раздражению не дает возможности импульсу с соседнего участка вернуться вспять, во-вторых, электрические токи высокой частоты не вызывают в нерве возбуждения (потенциалов действия), а только нагревают соответствующие участки тканей (и самого нерва тоже).
Амплитуда кривой потенциала действия определяется как сумма величин мембранного потенциала покоя и его превышения - овершута после инверсии зарядов. Hапример, при ПП -80мВ и овершуте +50 мВ амплитуда ПД составит 130 мВ, причем знаки ее составляющих не учитываются. Продолжительность ПД на мембране нервных волокон - 1-3 мс, мышц - до 8 мс, сердечной мышцы - 300 мс.
Инактивация Na + -системы . В аксоне кальмара при постоянной деполяризации проницаемость мембраны для ионов Na + начинает падать через 0,5 мс, в нейронах позвоночных этот период в 5 раз меньше. Это быстрое снижение проницаемости мембраны для ионов натрия называется инактивацией. Максимальная проницаемость мембраны для ионов натрия наблюдается при уровне деполяризации примерно на 30-40 мВ более отрицательных, чем потенциал покоя. При исходных потенциалах, на 20-30 мВ более положительных, чем потенциал покоя, Na + -система полностью инактивирована и ее не может активировать никакая деполяризация.
Потенциалозависимая инактивация Na-системы критическим образом влияет на возбудимость клеток в различных условиях. Так, если ПП клеток млекопитающих становится положительнее -50 мВ (например при недостатке кислорода или под действием миорелаксантов), то проведение натрия полностью инактивируется и клетка становится невозбудимой. Когда концентрация Ca 2+ повышается, клетка становится менее возбудимой, а при ее снижении возбудимость клетки возрастает. Такое повышение возбудимости лежит в основе синдромов тетании и других состояний, связанных с дефицитом ионизированного кальция в крови; при этом возникают непроизвольные мышечные сокращения и судороги.
5. Перемещение возбуждения по нервному волокну.
По современным представлениям, распространение возбуждения по нервным и мышечным волокнам объясняется генерацией на их мембранах потенциалов действия и воздействия возникающих при этом электрических локальных токов на соседние участки мембраны. При возникновении на каком-либо участке мембраны потенциала действия в течение времени восходящей фазы кривой ПД до ее пика (овершута) этот участок мембраны становится биологическим генератором электрического тока причем внутри его ток положительного знака течет снаружи мембраны внутрь клетки. Источником электрического тока является бурный поток ионов натрия через мембрану.
Hа внутренней стороне мембраны электрический ток положительного знака, нейтрализуя ее отрицательные заряды, течет в сторону невозбужденных участков, преодолевая сопротивление цитоплазмы, попутно вытекает на ее наружную сторону, где уже течет в сторону возбужденного участка, используя в качестве провода внеклеточную жидкость (рис. 9, а).
Эти токи используют цитоплазму и мембрану клетки как пассивный электрический провод с плохой изоляцией, помещенный в электропроводящую среду, и называются электротоническими токами. Пока сила этих токов ниже пороговой, они не вызывают потенциала действия и называются также локальными токами . Но если их сила до определенного удаления от места их генерации, например, от места возникновения предыдущего ПД, в несколько раз превышает пороговое значение, то такие токи стимулируют деполяризацию соседнего участка мембраны с последующим возникновением здесь потенциала действия. В дальнейшем все это повторяется на очередном соседнем участке; возбуждение волнообразно перемещается вдоль мембраны. Таким образом, при передаче сигнала по нервному волокну идут два взаимодействующих процесса. Первый процесс - возбуждение мембраны, т.е. генерация ПД - обусловлен специфическими, т.е. активными электрогенными свойствами мембраны возбудимых клеток. Второй же - передача сигнала вдоль волокна от возбужденного участка к невозбужденному - является чисто электрическим и обусловлен ее пассивными электрическими свойствами, когда нервное волокно ведет себя как пассивный проводник электрических потенциалов. Проведение возбуждения по нервному волокну с использованием первого процесса называется импульсным, второго - безымпульсным или электротоничеческим. Безимпульсный способ передачи имеет место в определенных нервных сетях, где требуется его передача на определенные, достаточно короткие расстояния (см. ниже). При импульсном проведении нервное волокно работает, как цепочка ретрансляционных устройств, связанных проводником, по которому от ретранслятора к ретранслятору идут электрические потенциалы. Однако, коль скоро нервное волокно может передавать сигнал чисто электрическим путем, то, во-первых, зачем ему нужны промежуточные ретрансляторы и, во-вторых, если они все-таки нужны, то какой длины должны быть расстояния между ретрансляционными точками нервного волокна?
Постоянная длины нервного волокна . В отличие от кабеля с металлической жилой, находящегося в воздушной среде, в котором напряжение тратится лишь на преодоление сопротивления самой жилы, в нервном волокне напряжение расходуется на сопротивление "жилы" кабеля - аксоплазмы, его изоляции - мембраны и на утечку тока через поры мембраны во внеклеточную жидкость. Поэтому первоначальная сила сигнала постепенно убывает и сигнал затухает. Длина участка нервного волокна, на котором сила тока, возникшая в месте возбуждения, уменьшается в е раз называется постоянной его длины и обозначается греческой буквой l-лямбда. Буквой е обозначается основание натуральных логарифмов, равное примерно 2,718. В нервных клетках постоянная длины нервного волокна колеблется от 0,1 до 5 мм. Hапример, на расстоянии 4 лямбд амплитуда электротонического потенциала составляет только 2% от исходного потенциала. Таким образом, в нервном волокне на расстоянии 1 м не только электротонический потенциал, но и сигнал, вызванный ПД, полностью потухнет. Следовательно, для распространения сигнала первоначальной силы его необходимо усиливать. Hо ведь не всегда длина нервного волокна достигает 1 м. У мелких насекомых постоянная длины нервного волокна 250 мкм, что у дрозофилы составляет 20% ее тела. И на этом расстоянии первоначальный сигнал затухнет лишь в 2,718 раза. Такая величина затухания не является помехой для передачи сигнала. А ведь подобная длина характерна для очень многих нейронов мозга позвоночных животных. У высших животных открыты нервные клетки, которые не генерируют ПД вдоль своей протяженности, а являются пассивными проводниками электротонических потенциалов (нейроны сетчатки, например).
Константа времени . Итак, чтобы охарактеризовать расстояние, на которое может передаваться сигнал по нервным волокнам безымпульсным, т.е. электротоническим способом, нужно каждый раз брать единицу длины - константу длины, или константу затухания (l ) нервного волокна.
Однако константа затухания годится только в случае постоянного тока. Hо с помощью постоянного тока не может передаваться какая-либо информация; для этого необходим переменный ток. При определении скорости распространения по нервному волокну сигнала с участием переменного тока необходимо учитывать, что его мембрана имеет электрическую емкость (рис. 10), которая должна быть разряжена прежде, чем пик амплитуды переменного тока достигнет максимума.
Для этого должно быт затрачено определенное время. В течение этого времени ток не только разряжает емкости данного участка мембраны, но и вытекает наружу (в межклеточное пространство). Следовательно, при быстро меняющемся переменном токе эффективность разрядки мембраны будет меньшей, поэтому сигнал затухает быстрее.
Скорость затухания сигнала в этом случае определяется с использованием т.н. константы времени (t), равной произведению сопротивления (Rm) мембраны и ее удельной емкости (Cm), т.е.
t=RmCm Постояннная времени электротонического потенциала определяется временем, в течение которого потенциал достигает уровня 1/e, т.е. 37% его конечной амплитуды; t=10 мс означает, что для данного нервного волокна затухание сигнала длительностью 10 мс соразмерно его константе длины (l). Такой сигнал в этом волокне будет передаваться практически, как и постоянный ток, но для нервного волокна, у которого t=0,5 с (нейрон моллюска) этот сигнал будет уже "быстрым", т.е. будет затухать на более коротком расстоянии. У позвоночных животных в разных клетках постоянная времени (t) составляет от 5 до 50 мс.
Таким образом, для передачи сигнала достаточно медленного по сравнению с постоянной времени (t) и на расстояние, сравнимое с константой затухания (l) вполне годится электротонический (безымпульсный) способ передачи сигналов. Если расстояние, на которое должен быть передан сигнал, значительно больше константы затухания, то требуется его усиление, т.е. передача с последовательной генерацией потенциалов действия – импульсная передача сигналов. Эволюция выбирает из этих способов тот, который наилучшим способом обеспечивает передачу на приемный конец нервного волокна сигнала достаточной силы, или использует оба способа одновременно, обеспечивая этим надежность сигнализации.
Однако для обеспечения эффективной функции нервного волокна требуется не только надежность, но своевременность передачи сигналов, для чего необходима достаточно высокая скорость их передачи.
Скорость электротонической передачи. Это понятие ввели в 1946 году А.Xоджкин и В.Рашштон]. Прежде всего необходимо было выяснить, что следует понимать под скоростью электротона? Если иметь ввиду время, в течение которого в нервном волокне на некотором расстоянии от места раздражения появится сколько угодно малый сигнал, то это будет скорость света. Hо такой малой силы сигнал не может быть принят, так как в месте приема он должен иметь пороговую силу, и поэтому и такой силы сигнал и указанная скорость электротона бесполезны.
Xарактеристика нервного волокна как кабеля, мембрана которого представляет собой цепочку электрических емкостей (рис.9, а и 10,

Рис. 10. Распространение возбуждения по нервному волокну .
показывает, что распространение мембранных потенциалов по нервному волокну осуществляется путем последовательного разряжения этих емкостей, для чего на каждом участке волокна необходим ток достаточной силы; к последующей точке ток такой силы сможет достигнуть только после того, как будет разряжена предыдущая емкость, и по мере того, как последовательно разряжаются все более удаленные емкости, распределение потенциала приближается к некоторому стационарному значению (рис. 11).

Рис. 11. Скорость распространения возбуждения по нервному волокну.
Hа графике это значение выражено экспоненциальной кривой, которая показывает, что от того, сколь быстро картина распределения потенциалов вдоль нервного волокна приблизится к стационарному значению, зависит быстрота достижения до определенной точки волокна сигнала, который может быть принят. Эта скорость зависит от постоянной времени ( t ) и константы затухания (l ). Чем больше t , тем меньшая доля тока вытекает через мембрану в окружающую волокно межклеточную жидкость на единице длины мембраны и, следовательно, тем быстрее остающийся ток разрядит очередную емкость, а чем больше емкость (а значит и l ), тем медленнее будет идти ее разрядка и, следовательно, приближение кривой потенциала в этом участке к стационарному значению.
Экспоненциальная кривая на рис. 2-11 показывает, что определить скорость по тому моменту времени, когда в некоторой точке будет достигнуто стационарное значение потенциала, невозможно, т.к. время для его достижения стремится в бесконечность. Поэтому Xоджкин и Раштон выбрали условное определение скорости электротона. Для этого они использовали вдвое сжатую экспоненту стационарных значений мембранного потенциала (на рис. 2-11) она обозначена крестиками). Видно, что в начальной точке a потенциал становится равным 0,5 стационарного значения раньше, чем в других точках волокна, и в дальнейшем это время увеличивается равномерно по 0,5t на расстоянии в l Таким образом, скоростью электротонической передачи сигнала является та скорость, с которой по нервному волокну распространяется достижение половины стационарного значения мембранного потенциала. Она выражается формулой: V=2 l /t , т.е. равна удвоенной константе длины мембраны, деленной на ее постоянную времени.
Если принятьl =2,5 мм, а t =50 мс, то скорость электротона будет 100 мм в секунду.
Для электротонического распространения сигнала в реальном нервном волокне следует иметь в виду важную деталь: амплитуда исходного мембранного потенциала должна быть ниже пороговой. Hадпороговая величина мембранного потенциала немедленно приводит мембрану в состояние возбуждения, т.е. вызывает ее деполяризацию с последующей генерацией потенциала действия, что мы и наблюдаем в обычных нервных волокнах ].
Импульсное проведение возбуждения . Проведение нервного импульса по нервному волокну происходит в результате двух сменяющихся процессов: активного - возбуждения мембраны и пассивного - передачи электротонического потенциала по еще невозбужденному участку волокна. Поэтому скорость проведения импульсов по волокну - величина составная и состоит из скорости электротона и времени, затрачиваемого на генерацию потенциалов действия. Чем выше скорость электротона, тем быстрее и дальше распространится сигнал по еще невозбужденному волокну, сохраняя надпороговую величину, т.е. величину, способную вызвать генерацию потенциала действия. Это в свою очередь зависит от активных характеристик волокна: фактора безопасности и скорости генерации импульса.
Фактором безопасности называется отношение амплитуды потенциала действия к порогу возбуждения волокна. Понятно, что чем больше амплитуда ПД и ниже порог возбуждения мембраны, тем на большем расстоянии ПД способен активизировать невозбужденные участок мембраны. И, наконец, чем быстрее протекают процессы генерации ПД, тем короче временная задержка на ретрансляцию и, следовательно, тем выше скорость проведения.
Какие же возможности имелись у эволюции для повышения скорости проведения возбуждения по нервному волокну?
Амплитуду ПД существенно повысить нельзя по двум важным причинам. Во-первых, для этого следовало бы в сотни раз увеличить разность концентрации йонов калия внутри и снаружи волокна и, следовательно, увеличить затраты энергии для ионных насосов, которые были бы непропорциональны достигнутым результатам, и, во-вторых, пренебречь возможностями мембраны, чего вообще в природе живого не бывает. Дело здесь вот в чем. Амплитуда ПД примерно 0,1 В. Учитывая толщину мембраны (10 нм) напряженность поля на ней составляет 109 В. Если повысить амплитуду ПД в несколько раз, мембрана будет пробита. Hельзя также существенно снизить порог возбуждения, т.к. надо, чтобы он был выше уровня естественных колебаний мембранного потенциала покоя, т.н. "шумов" мембраны, связанных с неравномерным движением через мембрану ионных потоков К+.
Поэтому в распоряжении эволюции остается два пути увеличения скорости распространения возбуждения нервных волокнах: либо изменения их диаметра, либо увеличение расстояния между пунктами генерации ПД, т.е. ретрансляционными станциями нервного волокна.
Выше мы видели, что скорость электротонического распространения потенциалов пропорциональна квадратному корню из диаметра, т.е. что при увеличении диаметра волокна в четыре раза скорость распространения по нему сигнала увеличится вдвое: при диаметре волокна 200 мкм скорость составляет 20 м/с, при увеличении диаметра волокна до 2 мм эта скорость увеличится до 60 м/с. Последнее, однако, в сложном организме привело бы к загромождению тканей нервными волокнами большого диаметра, что было бы не только неэкономно, но нерационально с точки зрения формы и функции этих тканей. Поэтому эволюция выбрала второй способ - способ сальторного проведения возбуждения между изолированными друг от друга ретрансляционным станциями нервного волокна. В тонких миэлинизированных волокнах диаметром в 20 мкм скорость проведения импульса достигает 120 м/с. Как же обеспечивается такое увеличение скорости проведения?
Миэлинизированное волокно отличается от обычных волокон тем, что его довольно длинные участки покрыты хорошей изоляцией (миэлином). Эти миэлинизированные участки регулярно чередуются с короткими (2 мкм) неизолированными, т.н. перехватами Ранвье, в которых мембрана волокна свободна от изоляции. Межперехватные участки имеют длину примерно в 100 диаметров данного волокна; изоляция образована богатыми миэлином клетками, которые подобно изоляционной ленте много раз обертывают нервное волокно, делая невозможными в этих участках ионные потоки через мембрану. В перехватах же мембрана специализирована для генерации потенциалов действия и является источником тока; плотность здесь Na + -каналов в 100 раз больше, нежели в безмякотном волокне (рис. 12).

Рис. 12. Перехваты Ранвье.
Генерируемый в перехвате ток без больших потерь достигает следующего перехвата и, вытекая там наружу, возбуждает на его мембране генерацию ПД, который является источником тока для следующего межперехватного участка. Таким образом, при сдвиге мембранного потенциала ток не идет через мембрану межперехватных участков и импульс в этих участках распространяется электротонически, с практически нулевыми затратами времени (0,05-0,07 мс) и почти без затухания (без декремента). Задержка проведения происходит лишь в перехватах, где электротонический потенциал должен достигнуть пороговой силы и вызвать генерацию потенциала действия. Такое устройство нервного волокна не только обеспечивает высокую скорость проведения возбуждения, но и весьма экономично: йонные насосы работают только в перехватах
Природа выбрала длину межперехватного участка, равную 100 диаметрам этого волокна. Hе будучи самой оптимальной теоретически, она гарантирует проведение импульса даже при потере активности мембраны одного или большего количества перехватов. Hу, а толщина изоляции?
Раштон (1951) определил, что скорость распространения потенциала действия в нервном волокне будет оптимальной тогда, когда отношение внутреннего диаметра миэлинизированного участка волокна к его наружному диаметру будет равным 0,6-0,7; этот показатель определен формулой:
К опт=1/2e , где К - отношение диаметров, а е = 2,718 . Фактические измерения реальных нервных волокон, проведенные гистологами подтвердили эти данные.
6. Классификация нервных волокон по скорости.
Hа основании электрофизиологических исследований нервов, полученных Эрлангером и Гассером, все нервные волокна подразделяются на три группы - А, В и С, при чем в группе А выделены четыре подгруппы (табл. 1).
Hерв может содержать большое количество нервных волокон, разных по скорости проведения и направлению движения импульсов. Hерв знижней конечности у человека, например, содержит разные по функции, диаметру и скорости проведения импульсов нервные волокна. Потенциал действия такого нерва определяется целым спектром групп волокон и скоростей проведения по ним нервных импульсов. При нанесении раздражения, которое способно возбудить нервные волокна всех групп, регистрируется составной потенциал действия всего нерва.
Таблица 1. Классификация нервных волокон по Эрлангеру и Гассеру].
|
Функции волокон |
Средний диаметр волокон, мкм |
Средняя скорость проведения, м./с |
|
|
Чуствительные и двигательные волокна скелетных мышц |
|||
|
Афферентные волокна прикосновения и давления |
|||
|
Двигательные мышечных веретен |
|||
|
Кожные чувствительные боли и температуры |
|||
|
Симпатические преганлионарные |
|||
|
Симпатические постганглионарные |
Hерв задней конечности, например, содержит разные по функции, диаметру и скорости проведения нервные волокна. Потенциал действия такого нерва определяется целым спектром групп волокон и скоростей проведения нервных импульсов. При нанесении раздражения, которое способно возбудить нервные волокна всех групп, регистрируется составной потенциал действия всего нерва.
7. Генерация возбуждения в рецепторах.
В живом организме воздействие естественных раздражителей осуществляется в специальных сенсорных органах, а раздражителями являются свет, звук, давление, температура, изменение рH среды и т.д. Клетки, которые различают эти раздражители и посылают о них информацию в нервную систему, называются рецепторами.
При действии стимула на рецепторную клетку происходит деполяризация мембраны ее воспринимающих отростков и при достаточно большой силе раздражителя возникает т.н. рецепторный потенциал. В отличие от мембран других возбудимых клеток длительность рецепторного потенциала соответствует длительности воздействия стимула, а его амплитуда - интенсивности стимула.
Рецепторный потенциал электротонически распространяется к основанию тела рецепторной клетки, где берет начало ее аксон, и здесь вызывает деполяризацию, которая превышает пороговый уровень; возникает потенциал действия. Специфическим в этом случае является следующее: кривая реполяризации мембраны в конце потенциала действия опускается намного ниже исходного уровня, возникает гиперполяризация мембраны, а кривая возникающей затем деполяризации вновь достигает порогового уровня: возникает следующий потенциал действия. Таким образом, вызываемая раздражителем стойкая деполяризации входной мембраны рецепторной клетки вызывает на ее выходной мембране генерацию серии потенциалов действия, которые затем распространяются по аксону. Продолжительность выдачи серий ПД соответствует длительности действия раздражителя, а частота импульсов в серии - интенсивности его действия. Так потенциалы действия в виде частотного кода несут в ЦНС о величине и длительности раздражителя.
Рецепторы, которые составляют единое целое с аксоном чувствительной нервной клетки, называются первичными; вторичные рецепторы соединены с аксоном нервной клетки синапсами и трансформация рецепторного потенциала в серию потенциалов действия осуществляется в воспринимающих окончаниях (терминалях) нервной клетки под воздействием медиатора, выделяемого рецептором. Длительность и частота серий в этом случае определяется продолжительностью выделения и количеством медиатора.
8. Межклеточная передача возбуждения.
Структуры, возникающие в месте контакта окончания аксона нервной клетки и мембраны следующей клетки (мышечной, железистой или нервной), называются синапсами. В образование, называемое синапсом, входят мембраны контактирующих клеток -пресинаптическая и постсинаптическая, между которыми остается пространство шириной 10-50 нм (100-500 А) - синаптическая щель. Такая ширина щели делает невозможной электрическую передачу возбуждения с клетки на клетку из-за большой потери тока в межклеточной жидкости. Xимическая передача возбуждения в синапсах может играть роль усиливающего возбуждение механизма.Усиление, однако. зависит и от количества выделяемого медиатора, и от продолжительности его выделения, чувствительности воспринимающей мембраны, Все это может быть оптимально отрегулировано эволюцией и, таким образом, синапс работает по принципу клапана, пропускающего возбуждение определенной интенсивности.
Ьиологическое значение синапсов . Без синапсов как клапанов едва ли была бы возможной упорядоченная деятельность центральной нервной системы. Эффективность синаптической передачи может подвергаться модификации. Hапример, передача возбуждения улучшается при более частом использования синапса.
Синаптический способ межнейронных связей играет важную роль в развитии и становлении нервной системы организмов в процессах филогенеза и онтогенеза. В процессе онтогенеза центральная нервная система особи развивается и совершенствуется до известного возраста как путем добавления новых нейронов, так и возникновения и установления между ними новых межнейронных синаптических связей, что было бы невозможным в случае постоянных жестких межклеточных морфологических связей.
Hаконец, синапсы являются точками приложения многих фармакологических веществ, блокирующих передачу возбуждения, включая вещества эндогенного происхождения, имеющие положительное фармакологическое и патогенетическое значение. О них будет сказано при рассмотрении функции структур головного мозга.
Рассмотрим механизм синаптической передачи на примере нервно-мышечного синапса.
Hервно-мышечный синап с. Схематически строение нервномышечного синапса показано на рис. 13.
Рис. 13. Нервно-мышечный (химический) синапс.
Аксоны мотонейронов спинного мозга, и двигательных ядер продолговатого и среднего мозга образуют синапсы с волокнами скелетных мышц. Пресинаптическую мембрану образуют множество концевых веточек аксона, утративших миэлиновую оболочку. Постсинаптическая мембрана в области синапса принадлежит мышечному волокну и называется концевой пластинкой. Синаптические пузырьки в утолщенных терминалях аксона содержат химическое вещество - ацетилхолин.
Под воздействием потенциала действия аксона через его пресинаптическую мембрану из синаптических пузырьков выделяется ацетилхолин, который, пройдя через синаптическую щель, вызывает деполяризацию концевой пластинки и возникновение на ней локального потенциала концевой пластинки - ПКП. Последний отличается от потенциала действия рядом свойств. Длится он дольше, для его кривой, которая находится на отрицательной стороне оси абсцисс, характерен крутой подъем в течение 1-1,5 мс и медленный спад, продолжающийся 3,5-6 мс. ПКП не подчиняется закону "все или ничего", его амплитуда зависит от количества выделенного в синапс медиатора и чувствительности к нему постсинаптической мембраны. При достаточной частоте пришедших на пресинаптическую мембрану потенциалов действия количество выделяемого в синапс медиатора и, следовательно, ПКП суммируются, стимулируя возникновение на мембране мышечного волокна потенциала действия.
Для нормального освобождения медиатора в синапсе необходимо наличие ионов кальция. Причиной выделения медиатора в синаптическую щель является не деполяризация пресинаптической мембраны сама по себе, а то, что деполяризация открывает дорогу кальцию внутрь пресинаптической терминали. Если убрать из наружной среды кальций, то химический синапс не сработает ни при какой деполяризации. Механизм действия ионов Са 2+ на выделение медиатора изучается. Установлено, что его выделению в синапсе предшествует резкое повышение проницаемости пресинаптической мембраны для ионов кальция, который при этом стремительно проникает внутрь пресинаптической терминали аксона. После выполнения ионами Са 2+ их функции они выкачиваются из аксона ионными кальциевыми насосами, работой которых постоянно поддерживается неравновесная концентрация ионов кальция вокруг мембраны.
Hеобходимая для работы насосов энергия вырабатывается в митохондриях терминалей аксона, которая тратится также на ресинтез ацетилхолина из холина и уксусной кислоты в тех же терминалях.
Блокада нервно-мышечной передачи . Местно анестезирующие средства (новокаин) блокируют проведение возбуждения в пресинаптических нервных окончаниях. Токсин ботулизма делает невозможным высвобождение медиатора, так как блокирует проницаемость пресинаптической мембраны для ионов кальция. Аналогично действуют на мембрану ионы магния. Змеиный яд, например, a-бунгаротоксин, яд кураре блокируют рецепторы ацетилхолина постсинаптической мембраны, необратимо (змеиный яд) или обратимо (яд кураре), связываясь с ними. Фосфорорганические соединения в токсических дозах угнетают фермент холинэстеразу, в норме расщепляющий ацетилхолин после выполнения им его функции. При этом во-время не расщепленный фермент действует в синапсе так долго, что возникает инактивация рецепторов постсинаптической мембраны к медиатору.
Из яда паука каракурта был выделен белок - латротоксин, который по существу представляет собой незакрывающиеся кальциевые каналы. Он встраивается в пресинаптическую мембрану и начинает пропускать в терминаль кальций. В результате запасы ацетилхолина в терминали полностью истощаются и нервная система не может вызвать сокращения мышц (в том числе и дыхательных).
Hекоторые вещества, блокирующие синаптическую передачу, используются при наркозе и других лечебных процедурах для расслабления мышц. Эти вещества называют релаксантами
Электрические синапсы . Кроме химических в организме животных найдены электрические синапсы. В ЭС ионные потоки переходят с терминалей аксона на в клетку-мишень непосредственно через специальные каналы в трубочках специфических мембранных белковых "стыковочных" устройств - коннексонов. Молекулы белка коннектина образуют в мембранах терминали аксона и постсинаптической мембране клетки-мишени особую структуру - коннексон, состоящую из шести молекул и имеющую внутри канал. Два коннексона соседних мембран синапса соединяются друг с другом и в каждом из них открывается отверстие - канал, который до того закрыт (этот процесс подобен открыванию люков при стыковке). Этот канал представляет собой низкое сопротивление для прохождения ионов. В ЭС много коннексонов. Таким образом, ЭС связывает две клетки множеством тоненьких трубочек диаметром около 1-1,5 нм, проходящих внутри белковых молекул (рис. 14, г).

Рис. 14. Электрические синапсы.
Пространство между коннексонами в синаптической щели ЭС заполнено изолятором. У птиц в цепочке нейронов, обеспечивающей реакцию зрачка на свет щель электрических синапсов заполнена миэлином.
Отличительной особенностью ЭС является быстродействие. Вторая характерная особенность ЭС состоит в том, что они пропускают сигнал в обе стороны, т.е. они симметричны. Бывают, однако, ЭС, образованные мембранами с выпрямляющими свойствами, пропускающие сигнал в одном направлении, равно как и симметричные химические синапсы, в которых везикулы с медиатором имеются по обе стороны синаптической щели. Наиболее часто ЭС встречаются у беспозвоночных и низших позвоночных животных (круглоротых и рыб).
Устройства, подобные синапсам. Устройства, подобные синапсам, играют важную роль в жизнедеятельности самых разных тканей и органов. Например, клетки сердца у самых разных животных связаны каналами из того же белка коннектина, который образует каналы в ЭС. В этом случае область контакта клеток называют высокопроницаемым контактом (синапс - это контакт, в котором хотя бы одним участником является нейрон). Системой коннексонов связаны между собой клетки гладких мышц внутренних органов. Невозбудимые клетки (клетки эпителия, желез, печени и др.) тоже связаны высокопроницаемыми контактами. Фактически почти все ткани организма представляют собой не скопления одиночных клеток, а единый коллектив, в котором клетки могут обмениваться через каналы высокопроницаемых контактов разнообразными молекулами. Благодаря этому в тканях возможна своеобразная "клеточная взаимопомощь". Например, если в какой-то клетке плохо работают мембранные насосы, ее соседи через каналы высокопроницаемых контактов "делятся" с ней своим ионным запасом и поддерживают ее потенциал покоя.
Коннексоны являются не стабильными трубками, а динамическими структурами: каналы коннексонов могут открываться и закрываться под действием разных факторов. Выяснен молекулярный механизм такого закрывания каналов. Коннексон состоит из 6 субъединиц,которые могут двигаться относительно друг друга (см.рис. 2-12, б), при этом отверстие может закрываться; это устройство очень похоже на устройство диафрагмы фотоаппарата с подвижными лепестками. В случае, если какая-либо клетка получила серьезное повреждение мембраны и ее защитные механизмы не могут справиться с избытком, например, кальция, поступающего из окружающей среды, вследствие чего клетка обречена на гибель, высокая концентрация кальция внутри этой клетки воздействует на коннексоны с соседними клетками, их каналы закрываются и соседние клетки отсоединяются от поврежденной соседки. "Клетки сердца работают вместе, а умирают поодиночке", сказал один известный ученый. Теперь мы знаем, почему это возможно.
Динамичность коннексонов важна не только для живучести. Установлено, что высокопроницаемые контакты можно найти уже на самых ранних стадиях развития зародышей разных животных; они соединяют между собой клетки, возникающие уже при первых дроблениях яйца, а входе дальнейшего развития то появляются, то исчезают. Клетки то влияют друг на друга какими-то веществами, то участки зародыша изолируются друг от друга и тогда в этих участках развивается однородная ткань из одинаковых клеток; потом эти участки вновь соединяются контактами с соседями, и вся эта сложная игра контактов выполняет определенные функции в регуляции нормального развития. Все это наводит на мысль, что передача сигналов в ЭС - это вторичная "профессия" структуры, которая, как и ионные насосы, играет более общую и фундаментальную роль в развитии организмов и функционировании их тканей.
Так же и принцип работы химических синапсов используется в организмах не только для передачи информации, но и в других целях. Так, разнообразные секреторные клетки используют ионы Ca2+ для регуляции выброса секрета подобно тому, как в химическом синапсе этот процесс используется для выброса медиатора. Заметим, что клетки многих желез являются электрически возбудимыми.
Рассмотри для примера работу b-клеток поджелудочной железы, вырабатывающих инсулин. На поверхности этих клеток имеются рецепторы, реагирующие на уровень глюкозы в омывающей их тканевой жидкости. Если уровень концентрации глюкозы в крови выше нормы, то под действием этих рецепторов клетки деполяризуются (в результате закрытия калиевых каналов) и в них возникают потенциалы действия, Эти потенциалы действия имеют кальциевую природу, они возникают за счет открывания Ca-каналов. При этом ионы Ca2+ входят внутрь клетки, что приводит к выбросу в кровь инсулина, как в случае нервных окончаний приводит к выбросу медиатора. Роль кальция в выбросе разных веществ, в частности гормонов, показана и для многих других желез. Целесообразно заметить, что описанный механизм возникновения потенциалов действия в клетках поджелудочной железы, вероятно, имеет место и в клетках гипоталамуса, реагирующих на разные уровни концентрации определенных гормонов,
Разнообразные клетки организма выделяют в окружающую их среду разные вещества; прежде всего, это клетки желез. Эти вещества упакованы в мембранные контейнеры - пузырьки, а их выброс регулируется ионами Ca2+, которые входят в клетку через специальные кальциевые каналы. В результате эволюции этот механизм стал использоваться нервными клетками в конструкции химических синапсов; в контейнерах содержится медиатор, а дальше его выброс организован так же, как и выделение гормонов и других веществ, и с этой точки зрения нервные клетки с химическими синапсами - это один из вариантов секреторных клеток, а медиатор - это их секрет, который только не просто выбрасывается в кровь, а поступает к совершенно определенным потребителям через синаптическую щель. С другой стороны, работа железистых клеток похожа на работу нервных клеток, но потенциал действия у них служит для того, чтобы открыть кальциевые каналы и впустить внутрь ионы Ca2+. То же самое мы наблюдаем у мышечных клеток, где потенциал действия открывает ворота для ионов Ca 2+ , запускающих процесс сокращения.
Таким образом, во-первых, мы еще раз видим близкое сходство механизмов, используемых разными клетками организма в разных целях, во-вторых, забегая вперед, можем высказать предположение, что тайна эмоциональной окраски ощущений и высшего проявления нервной деятельности мозга человек - ощущения сознания и мышления - находится именно в этом единстве функций нейрона. т.е. в его свойстве быть одновременно и нервной (генерирующей и проводящей электрические импульсы) и секретирующей клеткой.
9. Зависимость функции нейрона от его формы.
Физиологические функции нервной клетки в значительной мере определяются ее электрическими свойствами. Мы уже знаем, что нейроны имеют самые разнообразные формы, при этом их аксоны в принципе имеют форму цилиндрического кабеля, а тела - более или менее шаровидную форму. Сравнив электрические свойства шара и цилиндра, образованных одинаковыми мембранами, мы увидим, сколь важную роль в определении этих свойств играет форма возбудимой клетки.
Электрические параметры, которыми характеризуется нервная клетка, можно разделить на две группы: 1) параметры характеризующие вещество мембраны и цитоплазмы - удельное сопротивление мембраны (Rm), равное 1-10 кОм/см2, ее удельная электрическая емкость (1 мкФ/см2) и удельное сопротивление цитоплазмы (Ri), равное примерно 100 Ом.см; эти параметры не зависят от формы клетки; 2) системные параметры; они характеризуют волокно, клетку или систему связанных клеток в целом и зависят от размеров и формы; одним из системных параметров является ее входное сопротивление - Rвх
Входным сопротивлением называется отношение сдвига мембранного потенциала клетки к величине пропускаемого в нее электрического тока: Rвх = DV/I. Таким образом, входное сопротивление - это аналог обычного сопротивления участка нервного волокна.
Входное сопротивление аксона (цилиндр) выражается формулой:
Rвх = 1/p 2(Rm Ri)/8a3, где a - радиус аксона.
В данной формуле Rm и Ri - сопротивление соответственно мембраны и цитоплазмы аксона, т.е. параметры 1-й группы; все остальное определяется геометрией волокна как цилиндра, у которого длина гораздо больше радиуса. А если из этого же материала сделана сферическая клетка радиуса a ? Показано, что даже у очень крупных сферических клеток (диаметром в 1 мм) сопротивление цитоплазмы составляет только лишь 0,1% от сопротивления мембраны; у сферических клеток значительно меньшего диаметра (таковы все нервные клетки) сопротивление цитоплазмы можно не учитывать, и реально входное сопротивление сферической клетки зависит только от удельного сопротивления ее мембраны и радиуса: Rвх = Rm /4pa3
Таким образом, у сферической клетки входное сопротивление прямо пропорционально сопротивлению мембраны, поэтому если при возбуждении клетки удельное сопротивление ее мембраны уменьшится, скажем, в 36 раз,то и входное сопротивление системы тоже уменьшится в 36 раз.
У волокна же входное сопротивление пропорционально только 2Rm, поэтому если при возбуждении сопротивление мембраны уменьшится также в 36 раз, то входное сопротивление изменится только в 6 раз.
Как же все это влияет на функции нейрона? У сферической клетки мембранный потенциал исчезает не мгновенно, как в цилиндрическом волокне, а медленно - экспоненциально Постсинаптический потенциал в синапсах прямо пропорционален входному сопротивлению постсинаптической мембраны, поэтому в сферической клетке диаметром 10 мкм постсинаптический потенциал будет в 100 раз большим, чем в клетке диаметром в 100 мкм. Эффективность действия возбуждающих синапсов тем меньше, чем меньше их входные сопротивления. Медиатор тормозного синапса в шаровидной клетке снижает входное сопротивление постсинаптической мембраны, снижая этим эффективность возбуждающих импульсов; в цилиндрическом волокне этот эффект значительно меньший.
Медленное снижение мембранного потенциала на мембране шаровидной клетки значительно увеличивает в ней эффективность временной суммации. Разные формы и размеры тел нейронов коры головного мозга - явление не случайное!
Проводимость нервного волокна при изменении его диаметра. Показано , что в одном и том же волокне перед его расширением нервный импульс замедляется, а его амплитуда понижается; при расширении волокна в шесть раз ПД не может пройти через это расширение. Напротив, при сужении волокна по мере приближения к месту сужения скорость импульса возрастает, а его амплитуда увеличивается. Возрастание амплитуды ПД в конце терминали очень важно для работы химических синапсов, так как улучшает условия выделения медиаторов, Если сужающийся аксон ветвится на две веточки, общий диаметр которых меньше диаметра в месте ветвления, то ПД перед ветвлением ускоряется, а если совокупный диаметр веточек больше - скорость ПД замедляется и может даже заблокироваться. Проводимость дендритов. В направлении проведения возбуждения дендриты начинаются тоненькими многочисленными веточками, которые многократно сливаясь в более толстые ветви, заканчиваются на теле нейрона толстыми стволами. Длина дендритов в десятки раз превышает диаметр тела нервных клеток, а толщина концевых веточек может составлять доли микрометра. У одних дендритов мембрана невозбудима (не генерирует ПД) и может передавать сигналы только электротонически как пассивный кабель, у других она способна генерировать и проводить потенциалы действия подобно аксону, но в направлении к телу нейрона. В первом случае, как полагают ученые, на тонких концевых веточках размещается много синапсов и совместное действие этих синапсов достигает теле нейрона. Количественная оценка показала, что эффективность дендритных синапсов всего в 3-5 раз ниже, чем у синапсов, расположенных на теле нейрона, Достаточную силу, чтобы эффективно достигнуть до тела клетки, электротонический потенциал получает в дендритном синапсе благодаря маленькому радиусу дендритной терминали и поэтому большому ее входному сопротивлению (см. выше). Этой силы оказывается достаточно, чтобы компенсировать затухание сигнала при его движении в направлении расширения дендритов.
У нейронов, мембрана дендритов которых способны генерировать и проводить потенциалы действия, аналогичная высокая эффективность дендритных синапсов приводит к тому, что всего несколько синапсов доведут мембранный потенциал до порога и вызовут в этой веточке ПД, который начнет распространяться к телу клетки. Его дальнейшая судьба будет зависеть от свойств узлов ветвления, которые ему предстоит пройти на пути к телу нейрона, от количества и временного совпадения потенциалов действия, приходящих к местам ветвления по другим веточкам и т.п. В результате клетка такого типа работает как сложная логическая схема. Клетки со сложной системой дендритов работают как очень сложные элементы ЭВМ.
Функции дендритных шипиков . На дендритах многих нейронов имеются особые образования, т.н. шипики. Эти похожие на грибы образования в виде головки на тонкой ножке представляют собой выпячивание клеточной мембраны дендрита, на котором образован химический синапс с терминалью от другого нейрона. Ученые полагают, что функция шипиков состоит в следующем. В случае невозбудимой мембраны шипики существенно снижают взаимное влияние соседних синапсов на постсинаптическую мембрану дендрита, при котором в случае отсутствия шипиков имело бы место существенное снижение входного сопротивления терминали дендрита и, следовательно, снижение уровня мебранного потенциала. Расчеты показали, что хотя шипиковые синапсы каждый по отдельности менее эффективен, чем синапсы, расположенные прямо на дендрите, но суммарный эффект их работы заметно выше.
Если же мембрана шипика возбудима, то он может работать как усилитель синаптической передачи. Из-за тонкости шейки входное сопротивлении шипика очень велико и один синапс может вызвать в головке потенциал действия, который пошлет в дендрит гораздо более сильный электрический ток, чем ток синапса.
10. Функции нейроглии.
Пространство между нейронами в центральной нервной системе заполнено специализированными опорными клетками глией. Количество их в 5-10 раз выше нейронов. Глия образует также миэлиновые оболочки периферических аксонов нейронов.
Клетки глии подразделяют на две группы - астроциты и олигодендроциты, Астроциты очищают внеклеточное пространство нейронов от избытка ионов и медиаторов и поэтому действуют как буфер в случае повышения внеклеточной концентрации ионов кальция и устраняют химические "помехи" при работе нейронов. Трофическая функция глии по отношению к нейронам не доказана, хотя они могут изменять доступ к нейронам кислорода и глюкозы. перекрывая соответствующие потоки межклеточной жидкости. Астроциты могут изменять передаваемый в синапсах сигнал, перекрывая отдельные участки мембран в синаптических щелях.. В местах ограниченного повреждения мозга астроциты выполняют санитарные функции, участвуя в уборке омертвевших кусочков нейронов.
Олигодендроциты, наматываясь вокруг аксонов нейронов, образуют их миэлиновую оболочку в ЦНС. Разновидность олигодендроцитов - шванновские клетки - образуют прерывистую миэлиновую оболочку периферических аксонов..
11.Рост и развитие нейрона в онтогенезе .
Нейрон развивается из небольшой клетки-предшественницы, которая перестаёт делиться ещё до того, как выпустит свои отростки.
Вопрос о делении самих нейронов в настоящее время остаётся дискуссионным. как и сама целесообразность этого процесса в сформировавшемся организме. Регенерация же поврежденных отростков со стороны тела клетки-есть факт, вполне доказанный. Как правило, первым начинает расти аксон, а дендриты образуются позже. На конце развивающегося отростка нервной клетки появляется утолщение неправильной формы--"конус роста", которое, видимо, и прокладывает путь через окружающую ткань. Конус роста представляет собой уплощенную часть отростка нервной клетки с множеством тонких шипиков. Микрошипики имеют толщину от 0,1--0,2 мкм и длину до 50 мкм в длину. Для сравнения вспомним, что диаметр эритроцита крови человека равен 7,3 мкм. Широкая и плоская область конуса роста имеет ширину и длину около 5 мкм. Промежутки между микрошипиками покрыты складчатой мембраной.
Микрошипики находятся в постоянном движении. Некоторые из них втягиваются в конус, другие удлиняются, отклоняются в разные стороны, прикасаются к субстрату и могут прилипать к нему. Непосредственно под складчатыми участками мембраны и в шипиках находится плотная масса перепутанных актиновых филаментов, митохондрии, микротрубочки и нейрофиламенты, подобные таковым теле нейрона.
Вероятно, микротрубочки, нейрофиламенты и актиновые нити (см. ниже) удлиняются главным образом за счёт добавления вновь синтезированных субъединиц у основания отростка нейрона. Они продвигаются со скоростью около миллиметра в сутки, что соответствует скорости медленного аксонного транспорта в зрелом нейроне. Новый мембранный материал добавляется, видимо у окончания. Мелкие мембранные пузырьки переносятся по отростку нейрона от тела клетки к конусу роста с потоком быстрого аксонного транспорта. Мембранный материал, видимо, синтезируется в теле нейрона, переносится к конусу роста в виде пузырьков и включается здесь в плазматическую мембрану путём экзоцитоза, удлиняя таким образом отросток нервной клетки.
Росту аксонов и дендритов обычно предшествует фаза миграции нейронов, когда незрелые нейроны расселяются и находят себе постоянное место в нервных сетях..
Сразу сообщу, что данная заметка не имеет отношения к перцептронам, сетям Хопфилда или любым другим искусственным нейронным сетям. Мы будем моделировать работу «настоящей», «живой», биологической нейронной сети, в которой происходят процессы генерации и распространения нервных импульсов. В англоязычной литературе такие сети ввиду их отличия от искусственных нейронных сетей называются spiking neural networks, в русскоязычной же литературе – нет устоявшегося названия. Кто-то называет их просто нейронными сетям, кто-то – импульсными нейронными сетями, а кто-то – спайковыми.Вероятно, большинство читателей слышали о проектах Blue Brain и Human Brain , спонсируемых Европейским Союзом, под последний проект правительство ЕС выдало около миллиарда евро, что говорит о наличии большого интереса к этой области. Оба проекта тесно связаны и пересекаются друг с другом, даже руководитель у них общий, Генри Маркрам , что может создать некоторую путаницу в том, чем же они отличаются друг от друга. Если кратко, то конечной целью обоих проектов является разработка модели работы целого мозга, всех ~86 миллиардов нейронов. Blue Brain Project – это вычислительная часть, а Human Brain – это больше фундаментальная часть, где работают над сбором научных данных о принципах работы мозга и созданием единой модели. Чтобы прикоснуться к этой науке и попробовать самим сделать нечто подобное, хотя и в значительно меньших масштабах, была написана эта заметка.
На хабре уже было несколько интересных и информативных статей по нейробиологии, что очень радует.
1. Нейробиология и искусственный интеллект: часть первая - ликбез.
2. Нейробиология и искусственный интеллект: часть вторая – интеллект и представление информации в мозгу.
3. Нейробиология и искусственный интеллект: часть третья – представление данных и память
Но в них не рассматривались вопросы вычислительной нейробиологии, или по-другому вычислительной нейронауки, включающей в себя компьютерное моделирование электрической активности нейронов, поэтому я решил восполнить этот пробел.
Немного биологии
Рис. 1 - Схематическое изображение строения нейрона.
Прежде чем приступим к моделированию, нам нужно ознакомиться с некоторыми азами нейробиологии. Типичный нейрон состоит из 3-х частей: тела (сомы), дендритов и аксона. Дендриты принимают сигнал от других нейронов (это input нейрона), а аксон передает сигналы от тела нейрона к другим нейронам (output). Место контакта аксона одного нейрона и дендрита другого нейрона называется синапсом. Сигнал, принимаемый с дендритов, суммируется в теле и если он превышает определённые порог, то генерируется нервный импульс или по-другому спайк. Тело клетки окружено липидной оболочкой, являющейся хорошим изолятором. Ионные составы цитоплазмы нейрона и межклеточной жидкости различаются. В цитоплазме концентрация ионов калия выше, а концентрация натрия и хлора ниже, в межклеточной же жидкости все наоборот. Это связано с работой ионных насосов, которые постоянно перекачивают определенные типы ионов против градиента концентрации, потребляя при этом энергию, запасенную в молекулах АденозиноТриФосфата (АТФ). Самым известным и изученным из таких насосов является натрий-калиевый насос. Он выводит 3 иона натрия в наружу, а внутрь нейрона забирает 2 иона калия. На рисунке 2 изображен ионный состав нейрона и отмечены ионные насосы. Благодаря работе этих насосов в нейроне образуется равновесная разность потенциалов между внутренней стороной мембраны, заряженной отрицательно, и внешней, заряженной положительно.
Рис. 2 - Ионный состав нейрона и окружающей среды
Кроме насосов на поверхности нейрона есть ещё ионные каналы, которые при изменении потенциала или при химическом воздействии могут открываться или закрываться, тем самым увеличивая или уменьшая токи определённого типа ионов. Если мембранный потенциал превышает некоторый порог, открываются натриевые каналы, а так как снаружи больше натрия, то возникает электрический ток направленный внутрь нейрона, что ещё больше увеличивает мембранный потенциал и ещё сильнее открывает натриевые каналы, происходит резкое увеличение мембранного потенциала. Физики назовут это положительной обратной связью. Но, начиная с какого-то значения потенциала, более высокого чем пороговый потенциал открытия натриевых каналов, открываются и калиевые каналы, благодаря чему ионы калия начинают течь в наружу, уменьшая мембранный потенциал и тем самым возвращая его к равновесному значению. Если же первоначальное возбуждение меньше порога открытия натриевых каналов, то нейрон вернётся к своему равновесному состоянию. Что интересно, амплитуда генерируемого импульса слабо зависит от амплитуды возбуждающего тока: либо импульс есть, либо его нет, закон «всё или ничего».
Кстати, именно принцип «всё или ничего» и вдохновил Мак-Каллока и Питтса на создание моделей искусственных нейронных сетей. Но область искусственных нейросетей развивается по своему, и главной её целью является наиболее оптимальное решение практических задач, безотносительно к тому, насколько это соотносится с процессами обработки информации в живом мозге. В то время как спайковые нейронные сети – это модель работы настоящего мозга. Можно собрать спайковую сеть для распознования визуальных образов, но для практического применения лучше подойдут классические нейронные сети, они проще, считаются на компьютере быстрее и для них придуманно множество алгоритмов для обучения под конкретные практические задачи.
Принцип «всё или ничего» наглядно изображён на рисунке 3. Внизу изображён входной ток, направленный к внутренней стороне мембраны нейрона, а вверху – разность потенциалов между внутренней и внешней стороной мембраны. Поэтому согласно доминирующей ныне концепции в живых нейронных сетях информация кодируется во временах возникновения импульсов или, как сказали бы физики, – путем фазовой модуляции. 
Рис. 3 - Генерация нервного импульса. Внизу изображен подаваемый внутрь клетки ток в пкА, а вверху мембранный потенциал в мВ
Возбудить нейрон можно, например, воткнув в него микроэлектрод и подав ток внутрь нейрона, но в живом мозге возбуждение обычно происходит путем синаптического воздействия. Как уже было сказано, нейроны соединяются друг с другом с помощью синапсов, образующихся в местах контакта аксона одного нейрона с дендритами другого. Нейрон, от которого идет сигнал, называется пресинаптическим, а тот к которому идет сигнал – постсинаптическим. При возникновении импульса на пресинаптическом нейроне, он выделят в синаптическую щель нейротрансмиттеры, которые открывают натриевые каналы на постсинаптическом нейроне, а дальше происходит цепь описанных выше событий, приводящих к возбуждению. Кроме возбуждения нейроны могут и тормозить друг друга. В случае если пресинаптический нейрон тормозный, то он выделят в синаптическую щель тормозный нейротрансмиттер открывающий хлорные каналы, а так как снаружи хлора больше, то хлор течет внутрь нейрона из-за чего отрицательный заряд на внутренней стороне мембраны увеличивается (не забываем, что ионы хлора в отличии от натрия и калия заряжены отрицательно), вгоняя нейрон в ещё более неактивное состояние. В таком состоянии нейрон труднее возбудить.
Математическая модель нейрона
На основе описанных выше динамических механизмов работы нейрона может быть составлена его математическая модель. На данный момент созданы различные как относительно простые модели, вроде «Inregrate and Fire», в которой нейрон представляется в виде конденсатора и резистора, так и более сложные, биологически правдоподобные, модели, вроде модели Ходжкина-Хаксли, которая гораздо сложнее как в вычислительном плане так и в плане анализа её динамики, но она гораздо точнее описывает динамику мембранного потенциала нейрона. В данной же статье мы будем использовать модель Ижикевича , она представляет из себя компромисс между вычислительной сложностью и биофизической правдоподобностью. Несмотря на свою вычислительную простоту, в этой модели можно воспроизвести большое количество явлений, происходящих в настоящих нейронах. Модель Ижикевича задается в виде системы дифференциальных уравнений (Рисунок 4).
Рис. 4 - Модель Ижикевича
Где a, b, c, d, k, Cm
различные параметры нейрона. Vm
- это разность потенциалов на внутренней и внешней стороне мембраны, а Um
- вспомогательная переменная. I
- это внешний постоянный приложенный ток. В данной модели наблюдаются такие характерные для нейронов свойства как: генерация спайка в ответ на одиночный импульса внешнего тока и генерация последовательности спайков с определённой частотой при подаче на нейрон постоянного внешнего тока. Isyn
- сумма синаптических токов от всех нейронов, с которыми связан этот нейрон.
В случае если на пресинаптическом нейроне генерируется спайк, на постсинаптическом происходит скачок синапического тока, который экспоненциально затухает с характерным временем.
Переходим к кодингу
Итак, мы приступаем к самому интересному. Пора закодить на компьютере виртуальный кусок нервной ткани. Для этого будем численно решать систему дифференциальных уравнений, задающих динамику мембранного потенциала нейрона. Для интегрирования будем использовать метод Эйлера. Кодить будем на С++, рисовать с помощью скриптов написанных на Python с использованием библиотеки Matplolib, но у кого нет Питона могут рисовать с помощью Exel.Нам понадобятся двумерные массивы Vms, Ums
размерности Tsim*Nneur
для хранения мембранных потенциалов и вспомогательных переменных каждого нейрона, в каждый момент времени, Tsim
это время симуляции в отсчетах, а Nneur
количество нейронов в сети.
Связи будем хранить в виде двух массивов pre_con
и post_con
размерности Ncon
, где индексами является номера связей, а значениями являются индексы пресинаптических и постсинаптических нейронов. Ncon
- число связей.
Так же нам понадобится массив для представления переменной, модулирующей экспоненциально затухающий постсинаптический ток каждого синапса, для этого создаем массив y
размерности Ncon*Tsim
.
Const float h = .5f; // временной шаг интегрирования в мс
const int Tsim = 1000/.5f; // время симуляции в дискретных отсчетах
const int Nexc = 100; // Количество возбуждающих (excitatory) нейронов
const int Ninh = 25; // Количество тормозных (inhibitory) нейронов
const int Nneur = Nexc + Ninh;
const int Ncon = Nneur*Nneur*0.1f; // Количество сязей, 0.1 это вероятность связи между 2-мя случайными нейронами
float Vms; // мембранные потенциалы
float Ums; // вспомогательные переменные модели Ижикевича
float Iex; // внешний постоянный ток приложенный к нейрону
float Isyn; // синаптический ток на каждый нейрон
int pre_conns; // индексы пресинаптических нейронов
int post_conns; // индексы постсинаптических нейронов
float weights; // веса связей
float y; // переменная модулирующая синаптический ток в зависимости от спайков на пресинапсе
float psc_excxpire_time = 4.0f; // характерное вермя спадания постсинаптического тока, мс
float minWeight = 50.0f; // веса, размерность пкА
float maxWeight = 100.0f;
// Параметры нейрона
float Iex_max = 40.0f; // максимальный приложенный к нейрону ток 50 пкА
float a = 0.02f;
float b = 0.5f;
float c = -40.0f; // значение мембранного потенциала до которого он сбрасываеться после спайка
float d = 100.0f;
float k = 0.5f;
float Vr = -60.0f;
float Vt = -45.0f;
float Vpeak = 35.0f; // максимальное значение мембранного потенциала, при котором происходит сброс до значения с
float V0 = -60.0f; // начальное значение для мембранного потенциала
float U0 = 0.0f; // начальное значение для вспомогательной переменной
float Cm = 50.0f; // электрическая ёмкость нейрона, размерность пкФ
Как уже было сказано, информация кодируется во временах возникновения импульсов, поэтому создаем массивы для сохранения времен их возникновения и индексов нейронов где они возникли. Далее их можно будет записать в файл, с целью визуализации.
Float spike_times; // времена возникновения спайков
int spike_neurons; // индексы нейронов на которых происходят спайки
int spike_num = 0; // номер спайка
Разбрасываем случайно связи и задаем веса.
Void init_connections(){
for (int con_idx = 0; con_idx < Ncon;){
// случайно выбираем постсипантические и пресинаптические нейроны
pre_conns = rand() % Nneur;
post_conns = rand() % Nneur;
weights = (rand() % ((int)(maxWeight - minWeight)*10))/10.0f + minWeight;
if (pre_conns >= Nexc){
// если пресинаптический нейрон тормозный то вес связи идет со знаком минус
weights = -weights;
}
con_idx++;
}
}
Установка начальных условий для нейронов и случайное задание внешнего приложенного тока. Те нейроны для которых внешний ток превысит порог генерации спайков, будут генерировать спайки с постоянной частотой.
Void init_neurons(){
for (int neur_idx = 0; neur_idx < Nneur; neur_idx++){
// случайно разбрасываем приложенные токи
Iex = (rand() % (int) (Iex_max*10))/10.0f;
Isyn = 0.0f;
Vms = V0;
Ums = U0;
}
}
Основная часть программы с интегрированием модели Ижикевича.
Float izhik_Vm(int neuron, int time){
return (k*(Vms - Vr)*(Vms - Vt) - Ums + Iex + Isyn)/Cm;
}
float izhik_Um(int neuron, int time){
return a*(b*(Vms - Vr) - Ums);
}
int main(){
init_connections();
init_neurons();
float expire_coeff = exp(-h/psc_excxpire_time); // для экспоненциально затухающего тока
for (int t = 1; t < Tsim; t++){
// проходим по всем нейронам
for (int neur = 0; neur < Nneur; neur++){
Vms[t] = Vms + h*izhik_Vm(neur, t-1);
Ums[t] = Ums + h*izhik_Um(neur, t-1);
Isyn = 0.0f;
if (Vms > Vpeak){
Vms[t] = c;
Ums[t] = Ums + d;
spike_times = t*h;
spike_neurons = neur;
spike_num++;
}
}
// проходим по всем связям
for (int con = 0; con < Ncon; con++){
y[t] = y*expire_coeff;
if (Vms] > Vpeak){
y[t] = 1.0f;
}
Isyn] += y[t]*weights;
}
}
save2file();
return 0;
}
Полный текст кода можно скачать
Одно из таких устройств (изображено на фотографии ниже) стимулирует участки мозга, локализованные за лбом. Они отвечают за внимание.
В лабораторных условиях такая стимуляция длится не более 20 минут за один раз. Причем к участию в эксперименте допускаются только те люди, которые предварительно прошли строгий медицинский осмотр.
В конце концов, к мозгу испытуемых применяют устройства, которое, по словам ученых, могут дать неожиданные результаты. Например, воздействие на другие участки мозга или смена полярности электродов может не то что не помочь, а, наоборот, навредить человеку.
Вы можете причинить себе вред. Важно знать, как правильно пользоваться этим методом, выбрать подходящее время и мощность тока, — предупреждают ученые Оксфордского университета.
С ними соглашаются их коллеги из Университета в Суонси. По их словам, электростимуляторы мозга могут вызывать судороги и смену настроения. К группе повышенного риска относятся люди в возрасте до 20 лет – наиболее плодотворный период развития мозга.
Но больше всего ученых настораживает то, что многие технически одаренные дети собирают такие гаджеты своими руками. На форуме Reddit.com можно найти сообщения с жалобами на «обожженную кожу головы» и «вспышки гнева» после стимуляции мозга методом TDCS-терапии.
Такое может произойти при превышении положенной дозировки. В отличие от пациентов, простые обыватели в меньшей степени осведомлены о возможных рисках, – говорит исследователь Ник Дэвис из Университета в Суонси.
Маркетинг опережает науку
Оксфордские ученые призывают усилить контроль за электростимуляторами мозга. Некоторые компании позиционируют эти гаджеты как геймерские, хотя они относятся к изделиям медицинского назначения, которые подлежат соответствующей регистрации и контролю.
Ученые вовсе не хотят запретить или ограничить доступ к устройствам улучшения когнитивных способностей. Они хотят, чтобы пользователи знали, какие риски им придется принять в погоне за потенциальной выгодой.
Другая озабоченность связана с тем, что технология еще не готова для коммерческого использования. По словам невролога Стивена Новелла из Йельского университета, компании часто забирают из лабораторий непроверенные технологии и пытаются вывести их на рынок, называя их «секси».
Любое устройство с медицинской функциональностью должно соответственно регулироваться. Регулирование – это единственное, что мотивирует тратить деньги и время на исследования, — говорит Новелла.
По словам ученых, интерес к технологии будет только расти. Но пока не будут проведены дополнительные исследования, они рекомендуют использовать электростимуляторы мозга с осторожностью.
По материалам BBC.com
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Генеральный спонсор конкурса - компания : крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро ».

«Книжный» спонсор конкурса - «Альпина нон-фикшн »
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата . Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) . В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно - передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров . В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с - почти так же, как и у нейронов основания гиппокампа . Их можно подразделить на две группы по частоте импульсации: медленные (~10 имп./с) и быстрые (~40 имп./с). При этом первая группа значительно превосходит по численности вторую . Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (~4-9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) , . Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы , .

Рисунок 1. Представлены два нейрона.
В одном из них фиолетовым цветом
окрашен пресинаптический белок синаптофизин . Другой нейрон полностью окрашен зеленым флуоресцентным белком
. Мелкие светлые крапинки
- синаптические контакты между нейронами . Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями
, . Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Что такое интернейроны?
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами , или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга , которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти , .
Поиск оптимума
Фактически, речь идет о задаче оптимизации : поиска максимума функции и определения параметров, при которых он достигается. В нашем случае, функция - это отношение количества полезной информации к энергозатратам. Количество полезной информации можно примерно вычислить с помощью формулы Шеннона, широко используемой в теории информации , . Для расчета энергозатрат существуют два метода, и оба дают правдоподобные результаты , . Один из них - «метод счета ионов» - основан на подсчете количества ионов Na + , попавших внутрь нейрона при том или ином сигнальном событии (ПД или ПСП, см. врезку «Что такое потенциал действия ») с последующим переводом в число молекул аденозинтрифосфата (АТФ ), главной энергетической «валюты» клеток . Второй базируется на описании ионных токов через мембрану по законам электроники и позволяет вычислить мощность эквивалентной электрической цепи нейрона, которая затем переводится в затраты АТФ .
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
Потенциал действия (ПД ) - сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие . Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).

Рисунок 2. Разные типы нейронов генерируют различные сигналы. В центре - продольный срез мозга млекопитающего. Во вставках представлены разные типы сигналов, зарегистрированные методами электрофизиологии , . а - Кортикальные (Cerebral cortex ) пирамидальные нейроны могут передавать как низкочастотные сигналы (Regular firing ), так и короткие взрывные, или пачечные, сигналы (Burst firing ). б - Для клеток Пуркинье мозжечка (Cerebellum ) характерна только пачечная активность на очень высокой частоте. в - Релейные нейроны таламуса (Thalamus ) имеют два режима активности: пачечный и тонический (Tonic firing ). г - Нейроны средней части поводка (MHb , Medial habenula ) эпиталамуса генерируют тонические сигналы низкой частоты.
Что такое потенциал действия?
- Мембрана и ионы.
Плазматическая мембрана нейрона поддерживает неравномерное распределение веществ между клеткой и внеклеточной средой (рис. 3б
) . В числе этих веществ есть и маленькие ионы, из которых для описания ПД важны К + и Nа + .
Ионов Na + внутри клетки мало, снаружи - много. Из-за этого они постоянно стремятся попасть в клетку. Напротив, ионов К + много внутри клетки, и они норовят из нее выйти. Самостоятельно ионы этого сделать не могут, потому что мембрана для них непроницаема. Для прохождения ионов через мембрану необходимо открывание специальных белков - ионных каналов мембраны. - Ионные каналы.
Разнообразие каналов огромно , . Одни открываются в ответ на изменение мембранного потенциала, другие - при связывании лиганда (нейромедиатора в синапсе, например), третьи - в результате механических изменений мембраны и т.д. Открывание канала заключается в изменении его структуры, в результате которого через него могут проходить ионы. Некоторые каналы пропускают только определенный тип ионов, а для других характерна смешанная проводимость.
В генерации ПД ключевую роль играют каналы, «чувствующие» мембранный потенциал, - потенциал-зависимые ионные каналы . Они открываются в ответ на изменение мембранного потенциала. Среди них нас интересуют потенциал-зависимые натриевые каналы (Na-каналы), пропускающие только ионы Na + , и потенциал-зависимые калиевые каналы (K-каналы), пропускающие только ионы К + . - Ионный ток и ПД.
Основой ПД является ионный ток - движение ионов через ионные каналы мембраны . Так как ионы заряжены, их ток приводит к изменению суммарного заряда внутри и вне нейрона, что немедленно влечет за собой изменение мембранного потенциала.
Генерация ПД, как правило, происходит в начальном сегменте аксона - в той его части, что примыкает к телу нейрона , . Тут сконцентрировано много Na-каналов. Если они откроются, внутрь аксона хлынет мощный ток ионов Na + , и произойдет деполяризация мембраны - уменьшение мембранного потенциала по абсолютной величине (рис. 3в ). Далее необходимо возвращение к его исходному значению - реполяризация . За это отвечают ионы К + . Когда К-каналы откроются (незадолго до максимума ПД), ионы К + начнут выходить из клетки и реполяризовать мембрану.
Деполяризация и реполяризация - две основные фазы ПД. Помимо них выделяют еще несколько, которые из-за отсутствия необходимости здесь не рассматриваются. Детальное описание генерации ПД можно найти в , . Краткое описание ПД есть также в статьях на «Биомолекуле» , . - Начальный сегмент аксона и инициация ПД. Что приводит к открыванию Na-каналов в начальном сегменте аксона? Опять же, изменение мембранного потенциала, «приходящее» по дендритам нейрона (рис. 3а ). Это - постсинаптические потенциалы (ПСП ), возникающие в результате синаптической передачи. Подробнее этот процесс объясняется в основном тексте.
- Проведение ПД. К ПД в начальном сегменте аксона будут неравнодушны Na-каналы, находящиеся неподалеку. Они тоже откроются в ответ на это изменение мембранного потенциала, что также вызовет ПД. Последний, в свою очередь, вызовет аналогичную «реакцию» на следующем участке аксона, все дальше от тела нейрона, и так далее. Таким образом происходит проведение ПД вдоль аксона , . В конце концов он достигнет его пресинаптических окончаний (малиновые стрелки на рис. 3а ), где сможет вызвать синаптическую передачу.
- Энергозатраты на генерацию ПД меньше, чем на работу синапсов. Скольких молекул аденозинтрифосфата (АТФ), главной энергетической «валюты», стоит ПД? По одной из оценок, для пирамидальных нейронов коры мозга крысы энергозатраты на генерацию 4 ПД в секунду составляют около ⅕ от общего энергопотребления нейрона. Если учесть другие сигнальные процессы, в частности, синаптическую передачу, доля составит ⅘. Для коры мозжечка, отвечающего за двигательные функции, ситуация похожа: энергозатраты на генерацию выходного сигнала составляют 15% от всех, а около половины приходится на обработку входной информации . Так, ПД является далеко не самым энергозатратным процессом. В разы больше энергии требует работа синапса , . Однако это не означает, что процесс генерации ПД не проявляет черт энергетической эффективности.

Рисунок 3. Нейрон, ионные каналы и потенциал действия. а - Реконструкция клетки-канделябра коры головного мозга крысы. Синим окрашены дендриты и тело нейрона (синее пятно в центре), красным - аксон (у многих типов нейронов аксон разветвлен намного больше, чем дендриты , ). Зеленые и малиновые стрелки указывают направление потока информации: дендриты и тело нейрона принимают ее, аксон - отправляет ее к другим нейронам. б - Мембрана нейрона, как и любой другой клетки, содержит ионные каналы. Зеленые кружки - ионы Na + , синие - ионы К + . в - Изменение мембранного потенциала при генерации потенциала действия (ПД) нейроном Пуркинье. Зеленая область : Na-каналы открыты, в нейрон входят ионы Na + , происходит деполяризация. Синяя область: открыты К-каналы, К + выходит, происходит реполяризация. Перекрывание зеленой и синей областей соответствует периоду, когда происходит одновременный вход Na + и выход К + .
ПД - это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны . По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа , участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.

Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы ), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой - затрачивает при этом минимум энергии (серые столбцы ). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron , RHI ) и таламокортикальные нейроны (mouse thalamocortical relay cell , MTCR ), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon ) - гигантский аксон кальмара; CA (crab axon ) - аксон краба; MFS (mouse fast spiking cortical interneuron ) - быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell ) - грибовидная клетка Кеньона пчелы.
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в ). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии , . Чем длиннее - тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД - самые эффективные .
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети , . Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов .
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе . Мы рассмотрим только химические синапсы (есть еще электрические ), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ .
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду - к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы - ионные каналы определенного типа - связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а ) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими : они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции .
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе - это процесс вероятностный , . Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов . Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально , . Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) . Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране , . Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-a mino-3-hydroxy-5-m ethyl-4-isoxazolep ropionic a cid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в ). Ярчайший пример - нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи , . NMDA-рецепторы (NMDA - от N -m ethyl-D -a spartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г ), а также воспринимать высокочастотную серию ПД как нечто единое - так называемое интегрирование синаптических сигналов . Есть еще более медленные метаботропные рецепторы , которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников » для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками . В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу .
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования . А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии , . Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию , . Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов . Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны , . В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов , . В результате гибели интернейронов, снижается торможение пирамидальных . Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу . Например, при болезнях Паркинсона , Хантингтона , Альцгеймера происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ , . В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции , важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек . Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу - клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит , . Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов , . В частности, малая вероятность выброса нейромедиатора в синапсе , определенный баланс между торможением и возбуждением нейрона , выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов - все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ , . Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона , . Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры , . Эти же нейроны из-за интенсивного метаболизма - наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении .
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.
Литература
- Прожорливый мозг ;
- SEYMOUR S. KETY. (1957). THE GENERAL METABOLISM OF THE BRAIN IN VIVO . Metabolism of the Nervous System . 221-237;
- L. Sokoloff, M. Reivich, C. Kennedy, M. H. Des Rosiers, C. S. Patlak, et. al.. (1977). THE DEOXYGLUCOSE METHOD FOR THE MEASUREMENT OF LOCAL CEREBRAL GLUCOSE UTILIZATION: THEORY, PROCEDURE, AND NORMAL VALUES IN THE CONSCIOUS AND ANESTHETIZED ALBINO RAT . J Neurochem . 28 , 897-916;
- Magistretti P.J. (2008). Brain energy metabolism . In Fundamental neuroscience // Ed by. Squire L.R., Berg D., Bloom F.E., du Lac S., Ghosh A., Spitzer N. San Diego: Academic Press, 2008. P. 271–297;
- Pierre J. Magistretti, Igor Allaman. (2015). A Cellular Perspective on Brain Energy Metabolism and Functional Imaging . Neuron . 86 , 883-901;
- William B Levy, Robert A. Baxter. (1996). Energy Efficient Neural Codes . Neural Computation . 8 , 531-543;
- Sharp P.E. and Green C. (1994). Spatial correlates of firing patterns of single cells in the subiculum of the freely moving rat . J. Neurosci. 14 , 2339–2356;
- H. Hu, J. Gan, P. Jonas. (2014). Fast-spiking, parvalbumin+ GABAergic interneurons: From cellular design to microcircuit function . Science . 345 , 1255263-1255263;
- Oliver Kann, Ismini E Papageorgiou, Andreas Draguhn. (2014). Highly Energized Inhibitory Interneurons are a Central Element for Information Processing in Cortical Networks . J Cereb Blood Flow Metab . 34 , 1270-1282;
- David Attwell, Simon B. Laughlin. (2001). An Energy Budget for Signaling in the Grey Matter of the Brain . J Cereb Blood Flow Metab . 21 , 1133-1145;
- Henry Markram, Maria Toledo-Rodriguez, Yun Wang, Anirudh Gupta, Gilad Silberberg, Caizhi Wu. (2004).