Carbonul este al șaselea element al tabelului periodic al lui Mendeleev. Greutatea sa atomică este de 12.
Carbonul se află în a doua perioadă a sistemului Mendeleev și în a patra grupă a acestui sistem.
Numărul perioadei ne spune că cei șase electroni ai carbonului sunt localizați în două niveluri de energie.
Iar al patrulea număr al grupului spune că carbonul are patru electroni la nivelul său exterior de energie. Două dintre ele sunt pereche s-electroni, iar ceilalți doi nu sunt perechi r-electroni.
Structura stratului de electroni exterior al atomului de carbon poate fi exprimată prin următoarele scheme:
Fiecare celulă din aceste diagrame înseamnă un orbital de electroni separat, săgeata înseamnă un electron situat în orbital. Două săgeți din interiorul unei celule sunt doi electroni situati în același orbital, dar cu spini opuși.
Când un atom este excitat (când îi este transmisă energie), unul dintre perechi S-electroni ocupati r-orbital.
Un atom de carbon excitat poate participa la formarea a patru legături covalente. Prin urmare, în marea majoritate a compușilor săi, carbonul prezintă o valență de patru.
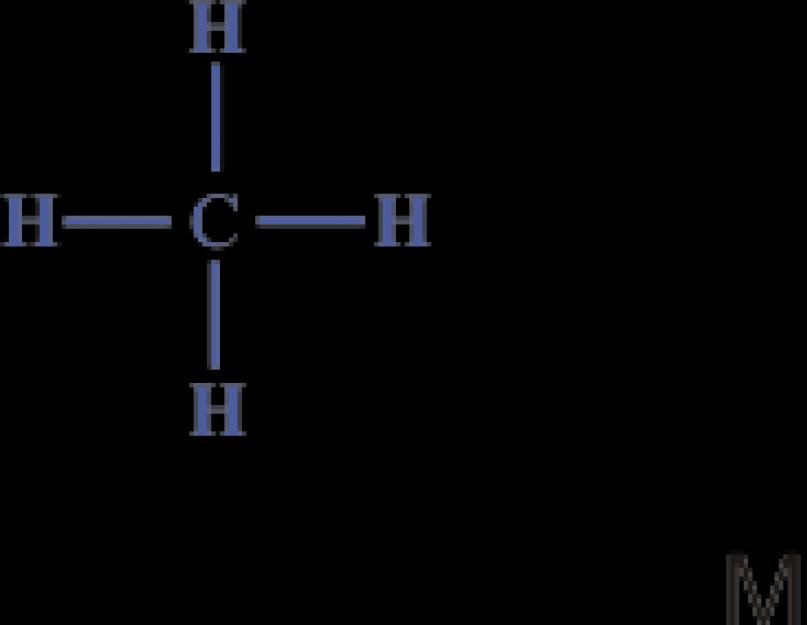
Astfel, cel mai simplu compus organic, metanul de hidrocarbură, are compoziția CH 4. Structura sa poate fi exprimată prin formule structurale sau electronice:

Formula electronica arată că atomul de carbon din molecula de metan are un înveliș exterior stabil de opt electroni, iar atomii de hidrogen au o înveliș stabil de doi electroni.
Toate cele patru legături de carbon covalent din metan (și în alți compuși similari) sunt echivalente și direcționate simetric în spațiu.

Atomul de carbon este situat, parcă, în centrul tetraedrului (piramidă patruunghiulară obișnuită), iar cei patru atomi legați de acesta (în cazul metanului, patru atomi de hidrogen) se află la vârfurile tetraedrului.
Unghiurile dintre direcțiile oricărei perechi de legături sunt aceleași și se ridică la 109 grade 28 de minute. s Acest lucru se explică prin faptul că într-un atom de carbon, atunci când formează legături covalente cu alți patru atomi, dintr-un - și trei p -orbitali ca urmare sp 3 -orbitali ca urmare-hibridizarea produce patru hibrizi situati simetric in spatiu

-orbitali alungiti spre varfurile tetraedrului.
Numărul de electroni din nivelul energetic exterior este principalul factor care determină proprietățile chimice ale unui element.
În partea stângă a tabelului periodic există elemente cu un nivel electronic exterior scăzut. Elementele din primul grup au un electron la nivelul exterior, elementele din al doilea grup au doi.
Elementele acestor două grupe sunt metale. Se oxidează ușor, adică. își pierd electronii exteriori și devin ioni pozitivi.
În partea dreaptă a tabelului periodic, dimpotrivă, există nemetale (agenți oxidanți). În comparație cu metalele, au un nucleu cu un număr mai mare de protoni. Un astfel de nucleu masiv oferă o atracție mult mai puternică din norul său de electroni.
Astfel de elemente își pierd electronii cu mare dificultate, dar nu sunt contrarii să atașeze electroni suplimentari de la alți atomi, de exemplu. le oxidează și, în același timp, se transformă într-un ion negativ.
Pe măsură ce numărul grupelor din tabelul periodic crește, proprietățile metalice ale elementelor slăbesc, iar capacitatea lor de a oxida alte elemente crește.
Carbonul se află în a patra grupă, adică. chiar la mijloc între metale, care renunță cu ușurință la electroni, și nemetale, care câștigă ușor acești electroni.
Din acest motiv carbonul nu are o tendință pronunțată de a dona sau de a câștiga electroni.
Lanțuri de carbon.
Proprietatea excepțională a carbonului, care determină diversitatea compuși organici, este capacitatea atomilor săi de a se conecta cu legături covalente puternice între ei, formând circuite de carbon de lungime practic nelimitată.

În plus față de carbon, lanțurile de atomi identici sunt formate de analogul său din grupa IV - siliciu. Cu toate acestea, astfel de lanțuri conțin nu mai mult de șase atomi de Si. Se cunosc lanțuri lungi de atomi de sulf, dar compușii care le conțin sunt fragili.
Valențele atomilor de carbon care nu sunt utilizate pentru conexiunea reciprocă sunt utilizate pentru adăugarea altor atomi sau grupări (în hidrocarburi - pentru adăugarea de hidrogen).
Deci hidrocarburi etan ( C2H6) și propan ( C3H8) conțin lanțuri de doi și, respectiv, trei atomi de carbon. Structura lor este exprimată prin următoarele formule structurale și electronice:

Sunt cunoscuți compuși care conțin sute sau mai mulți atomi de carbon în lanțurile lor.
Datorită orientării tetraedrice a legăturilor de carbon, atomii săi incluși în lanț nu sunt situați în linie dreaptă, ci într-un model în zig-zag. Mai mult, datorită posibilității de rotație a atomilor în jurul axei de legătură, un lanț în spațiu poate dura diverse forme(conformații):

Această structură a lanțurilor face posibil ca atomii de carbon terminali sau alți atomi de carbon neadiacenți să se apropie. Ca urmare a formării de legături între acești atomi, lanțurile de carbon se pot închide în inele (cicluri), de exemplu:

Astfel, diversitatea compușilor organici este determinată și de faptul că, cu același număr de atomi de carbon într-o moleculă, sunt posibili compuși cu un lanț deschis, deschis de atomi de carbon, precum și substanțe ale căror molecule conțin cicluri.
Conexiuni simple și multiple.
Legăturile covalente dintre atomii de carbon formați dintr-o pereche de electroni generalizați se numesc legături simple.

Legătura dintre atomii de carbon poate fi realizată nu de unul, ci de două sau trei perechi de electroni comuni. Apoi obținem lanțuri cu legături multiple – duble sau triple. Aceste conexiuni pot fi descrise după cum urmează:
Cei mai simpli compuși care conțin legături multiple sunt hidrocarburile etilenă(cu dublă legătură) și acetilenă(cu triplă legătură):

Hidrocarburile cu legături multiple se numesc nesaturate sau nesaturate. Etilena și acetilena sunt primii reprezentanți ai două serii omoloage - hidrocarburi de etilenă și acetilenă.
În acest articol ne vom uita la un element care face parte din tabelul periodic D.I. Mendeleev, și anume carbonul. În nomenclatura modernă, este desemnat prin simbolul C, este inclus în a paisprezecea grupă și este un „participant” al celei de-a doua perioade, are al șaselea număr de serie și a.u.m. = 12,0107.
Orbitalii atomici și hibridizarea lor
Să începem să privim carbonul cu orbitalii săi și hibridizarea lor - caracteristicile sale principale, datorită cărora încă uimește oamenii de știință din întreaga lume. Care este structura lor?
Hibridarea atomului de carbon este dispusă în așa fel încât electronii de valență să ocupe poziții în trei orbitali și anume: unul este în orbital 2s, iar doi sunt în orbitalii 2p. Ultimii doi dintre cei trei orbitali formează un unghi de 90 de grade unul față de celălalt, iar orbitalul 2s are simetrie sferică. Totuși, această formă de aranjare a orbitalilor luați în considerare nu ne permite să înțelegem de ce carbonul, la intrarea în compuși organici, formează unghiuri de 120, 180 și 109,5 grade. Formula pentru structura electronică a atomului de carbon se exprimă în următoarea formă: (He) 2s 2 2p 2.
Rezolvarea contradicției apărute s-a făcut prin introducerea în circulație a conceptului de hibridizare a orbitalilor atomici. Pentru a înțelege natura triunghiulară, variantă a lui C, a fost necesar să se creeze trei forme de reprezentare a hibridizării sale. Principala contribuție la apariția și dezvoltarea acestui concept a fost adusă de Linus Pauling.

Proprietăți fizice
Structura atomului de carbon determină prezența unui număr de caracteristici fizice. Atomii acestui element formează o substanță simplă - carbonul, care are modificări. Variațiile modificărilor structurii sale pot da substanței rezultate diferite caracteristici calitative. Motivul disponibilității cantitate mare modificările carbonului constă în capacitatea acestuia de a stabili și forma diferite tipuri de legături de natură chimică.
Structura atomului de carbon poate varia, permițându-i să aibă un anumit număr de forme izotopice. Carbonul găsit în natură se formează folosind doi izotopi în stare stabilă - 12 C și 13 C - și un izotop cu proprietăți radioactive - 14 C. Acest din urmă izotop este concentrat în straturile superioare ale scoarței terestre și în atmosferă. Datorită influenței radiațiilor cosmice, și anume a neutronilor săi, asupra nucleului atomilor de azot, se formează izotopul radioactiv 14 C După mijlocul anilor cincizeci ai secolului XX, acesta a început să intre în mediul înconjurător ca produs artificial format. în timpul exploatării centralelor nucleare și datorită utilizării unei bombe cu hidrogen. Pe procesul de dezintegrare a 14 C se bazează tehnica de datare cu radiocarbon, care și-a găsit aplicare largăîn arheologie şi geologie.
Modificarea carbonului în formă alotropică
Există multe substanțe în natură care conțin carbon. Omul folosește structura atomului de carbon în propriile sale scopuri atunci când creează diferite substanțe, inclusiv:
- Carboni cristalini (diamante, nanotuburi de carbon, fibre și fire, fulerene etc.).
- Cărbuni amorfi (cărbune activ și cărbune, diverse tipuri cocs, negru de fum, funingine, nanospumă și antracit).
- Forme de cluster de carbon (dicarboni, nanoconuri și compuși astraleni).
Caracteristicile structurale ale structurii atomice

Structura electronică a unui atom de carbon poate avea diferite geometrii, care depind de nivelul de hibridizare a orbitalilor pe care îi posedă. Există 3 tipuri principale de geometrie:
- Tetraedric - creat datorită deplasării a patru electroni, dintre care unul este electroni s, iar trei aparțin electronilor p. Atomul C ocupă o poziție centrală în tetraedru și este conectat prin patru legături sigma echivalente cu alți atomi care ocupă vârful acestui tetraedru. Acest aranjament geometric al carbonului poate produce alotropi precum diamantul și lonsdaleitul.
- Trigonal - își datorează aspectul deplasării a trei orbitali, dintre care unul este s- și doi sunt p-. Există trei legături sigma aici, care sunt într-o poziție echivalentă între ele; se află într-un plan comun și mențin un unghi de 120 de grade unul față de celălalt. Orbitalul p liber este situat perpendicular pe planul legăturii sigma. Grafitul are o geometrie structurală similară.
- Diagonala - apare datorita amestecarii electronilor s- si p (hibridarea sp). Norii de electroni se întind de-a lungul direcției generale și iau forma unei gantere asimetrice. Electronii liberi creează legături π. Această structură geometrică în carbon dă naștere apariției carbinei, o formă specială de modificare.
Atomi de carbon în natură
Structura și proprietățile atomului de carbon au fost mult timp luate în considerare de om și sunt folosite pentru a obține un număr mare de substanțe diferite. Atomii acestui element, datorită capacității lor unice de a forma diferite legături chimice și prezenței hibridizării orbitale, creează multe modificări alotropice diferite cu participarea unui singur element, din atomi de același tip - carbon.

În natură, carbonul se găsește în scoarta terestra; ia forma de diamante, grafit, diverse combustibili resurse naturale, de exemplu, petrol, antracit, cărbune brun, șist, turbă etc. O parte din gazele folosite de oameni în industria energetică. Carbonul din dioxidul său umple hidrosfera și atmosfera Pământului, ajungând până la 0,046% în aer și de până la șaizeci de ori mai mult în apă.
În corpul uman, C este conținut într-o cantitate aproximativ egală cu 21% și este excretat în principal prin urină și aerul expirat. Același element participă la ciclul biologic este absorbit de plante și consumat în timpul proceselor de fotosinteză.
Atomii de carbon, datorită capacității lor de a stabili diverse legături covalente și de a construi lanțuri și chiar cicluri din ele, pot crea o cantitate imensă de substanțe organice. În plus, acest element face parte din atmosfera solara, fiind în compuși cu hidrogen și azot.
Proprietăți de natură chimică

Acum să ne uităm la structura și proprietățile atomului de carbon din punct de vedere chimic.
Este important să știm că carbonul prezintă proprietăți inerte în condiții normale de temperatură, dar ne poate arăta proprietăți reducătoare sub influența temperaturi ridicate. Principalele stări de oxidare sunt: + - 4, uneori +2 și, de asemenea, +3.
Participă la reacții cu un număr mare de elemente. Poate reactiona cu apa, hidrogen, halogeni, metale alcaline, acizi, fluor, sulf etc.
Structura atomului de carbon dă naștere unui număr incredibil de mare de substanțe, separate într-o clasă separată. Astfel de compuși sunt numiți organici și au la bază C. Acest lucru este posibil datorită proprietății atomilor acestui element de a forma lanțuri polimerice. Printre cele mai cunoscute și extinse grupe se numără proteinele (proteinele), grăsimile, carbohidrații și compușii de hidrocarburi.
Metode de operare
Datorită structurii unice a atomului de carbon și proprietăților sale însoțitoare, elementul este utilizat pe scară largă de oameni, de exemplu, la crearea creioanelor, topirea creuzetelor metalice - aici este folosit grafitul. Diamantele sunt folosite ca abrazive, bijuterii, burghie etc.
Farmacologia și medicina se ocupă, de asemenea, de utilizarea carbonului într-o varietate de compuși. Acest element face parte din oțel, servește ca bază pentru fiecare substanță organică, participă la procesul de fotosinteză etc.
Toxicitatea elementului

Structura atomului elementului carbon implică prezența unui efect periculos asupra materiei vii. Carbonul intră în lumea din jurul nostru ca urmare a arderii cărbunelui la centralele termice, este inclus în gazele produse de mașini, în cazul concentratului de cărbune etc.
Procentul de conținut de carbon din aerosoli este mare, ceea ce presupune o creștere a procentului de persoane care se îmbolnăvesc. Cel mai adesea sunt afectate tractul respirator superior și plămânii. Unele boli pot fi clasificate ca profesionale, de exemplu, bronșita de praf și bolile din grupul pneumoconiozei.
14 C este toxic, iar puterea influenței sale este determinată de interacțiunea radiațiilor cu particulele β. Acest atom este inclus în compoziția moleculelor biologice, inclusiv a celor găsite în deoxi- și acizi ribonucleici. Cantitate acceptabilă de 14 C în aer zona de lucru nivelul este considerat a fi de 1,3 Bq/l. Cantitatea maximă de carbon care intră în organism în timpul respirației corespunde cu 3,2 * 10 8 Bq/an.
C – 1s 2 2s 2 2p 2 sau 1s 2 2s 2 2p x 1 2p y 1 2p z 0
În formă grafică:
Un atom de carbon în stare excitată are următoarea formulă electronică:
*C – 1s 2 2s 1 2p 3 sau 1s 2 2s 1 2p x 1 2p y 1 2p z 1
Sub formă de celule: 
Forma orbitalilor s și p


Orbital atomic- regiunea spațiului unde este cel mai probabil să se găsească un electron, cu numere cuantice corespunzătoare.
Este o „hartă de contur” tridimensională a electronilor în care funcția de undă determină probabilitatea relativă de a găsi un electron în acel punct anume al orbitalului.
Dimensiunile relative ale orbitalilor atomici cresc pe masura ce energiile lor cresc ( număr cuantic principal- n), iar forma și orientarea lor în spațiu este determinată de numerele cuantice l și m. Electronii din orbitali sunt caracterizați de un număr cuantic de spin. Fiecare orbital nu poate conține mai mult de 2 electroni cu spini opuși.
Atunci când formează legături cu alți atomi, atomul de carbon își transformă învelișul de electroni astfel încât se formează cele mai puternice legături și, în consecință, se eliberează cât mai multă energie, iar sistemul capătă cea mai mare stabilitate.
Schimbarea învelișului de electroni a unui atom necesită energie, care este apoi compensată prin formarea de legături mai puternice.
Transformarea învelișului de electroni (hibridarea) poate fi în principal de 3 tipuri, în funcție de numărul de atomi cu care atomul de carbon formează legături.
Tipuri de hibridizare:
sp 3 – Hibridare (starea de valență)– un atom formează legături cu 4 atomi vecini (hibridare tetraedrică):
Formula electronică a sp 3 – atom de carbon hibrid:
*С –1s 2 2(sp 3) 4 sub formă de celule ![]()

Unghiul de legătură dintre orbitalii hibrizi este de ~109°.
Formula stereochimică a atomului de carbon:
sp 2 – Hibridare (starea de valență)– un atom formează legături cu 3 atomi vecini (hibridare trigonală):
Formula electronică a sp 2 – atom de carbon hibrid:
*С –1s 2 2(sp 2) 3 2p 1 sub formă de celule 
Unghiul de legătură dintre orbitalii hibrizi este de ~120°.
Formula stereochimică a sp 2 - atom de carbon hibrid:
sp – Hibridarea (starea de valență) – un atom formează legături cu 2 atomi vecini (hibridare liniară):
Formula electronică a sp – atom de carbon hibrid:
*С –1s 2 2(sp) 2 2p 2 sub formă de celule
Unghiul de legătură dintre orbitalii hibrizi este de ~180°.
Formula stereochimică:
S-orbital este implicat în toate tipurile de hibridizare, deoarece are energie minimă.
Restructurarea norului de electroni permite formarea celor mai puternice legături posibile și interacțiunea minimă a atomilor din molecula rezultată. În același timp orbitalii hibrizi pot să nu fie identici, dar unghiurile de legătură pot fi diferite, de exemplu CH2CI2 şi CCl4
2. Clasificarea și nomenclatura compușilor organici. Tipuri de izomerie în molecule organice.
Clasificarea izomerilor
Structural (ordine diferită de conectare a atomilor)
Stereoizomerie (aranjare diferită a atomilor în spațiu)
Circuite 1. Poziții de conectare multiple
2. Dispoziții privind grupul funcțional
3. Configurare
4. Conformațional
2.Izomerie structurală.
Izomerii structurali sunt izomeri care au aceeași compoziție calitativă și cantitativă, dar diferă ca structură chimică.
Izomerismul structural determină diversitatea compușilor organici, în special alcani. Cu o creștere a numărului de atomi de carbon din molecule alcani, numărul de izomeri structurali crește rapid. Deci, pentru hexan (C 6 H 14) este 5, pentru nonan (C 9 H 20) - 35.
Atomii de carbon variază în locație în lanț. Atomul de carbon de la începutul lanțului este legat de un atom de carbon și se numește primar. Un atom de carbon legat de doi atomi de carbon - secundar, cu trei - terţiar, cu patru - cuaternar. Alcanii cu catenă liniară conțin doar atomi de carbon primari și secundari, în timp ce alcanii cu catenă ramificată conțin atât atomi de carbon terțiari, cât și cuaternari.
Tipuri de izomerie structurală.
- Izomeria lanțului de carbon:
- Izomerie de poziție a legăturilor multiple
Izomeria poziției grupului funcțional
Metameri– compuși aparținând aceleiași clase de compuși, dar având radicali diferiți:
H 3 C – O – C 3 H 7 – eter metilpropilic,
H 5 C 2 – O – C 2 H 5 – dietil eter
- Izomerie interclasă.În ciuda aceleiași compoziții calitative și cantitative a moleculelor, structura substanțelor este diferită.
H 2 C = CH – CH = CH 2 butadienă -1,3 HC = C - CH 2 – CH 3 – butină-1
Izomeria structurală determină și diversitatea radicalilor de hidrocarburi. Izomeria radicalilor începe cu propan, pentru care sunt posibili doi radicali. Dacă un atom de hidrogen este scăzut din atomul de carbon primar, radicalul rezultat este propil (n-propil). Dacă un atom de hidrogen este scăzut dintr-un atom de carbon secundar, radicalul rezultat este izopropil
Izomerie spațială (stereoizomerie)
Aceasta este existența izomerilor care au aceeași compoziție și ordine de conectare a atomilor, dar diferă în natura aranjamentului atomilor sau grupurilor de atomi în spațiu unul față de celălalt.
Acest tip de izomerie a fost descris de L. Pasteur (1848), J. Van't Hoff, Le Bel (1874).
În condiții reale, molecula în sine și părțile sale individuale (atomi, grupuri de atomi) se află într-o stare de mișcare vibrațional-rotațională, iar această mișcare modifică foarte mult aranjarea relativă a atomilor din moleculă. În acest moment, legăturile chimice sunt întinse și unghiurile de legătură se modifică și astfel apar diferite configurații și conformații ale moleculelor.
Prin urmare, izomerii spațiali sunt împărțiți în două tipuri: conformaționali și configuraționali.
Configurațiile sunt ordinea în care atomii sunt aranjați în spațiu fără a ține cont de diferențele care rezultă din rotația în jurul legăturilor simple. Acești izomeri există în diferite conformații.
Conformațiile sunt forme dinamice foarte instabile ale aceleiași molecule care apar ca urmare a rotației atomilor sau grupurilor de atomi în jurul unor legături simple, în urma cărora atomii ocupă poziții spațiale diferite. Fiecare conformație a unei molecule este caracterizată de o configurație specifică.
Legătura Ϭ permite rotația în jurul acesteia, astfel încât o moleculă poate avea multe conformații. Din multele conformaţii, doar şase sunt luate în calcul, deoarece Unghiul minim de rotație este considerat a fi un unghi egal cu 60°, care se numește unghi de torsiune.
Exista: conformatii eclipsate si inhibate.
Conformație eclipsată apare atunci când substituenți identici sunt localizați pe distanta minima forțe de repulsie reciproce iau naștere una din alta și între ele, iar molecula trebuie să aibă o cantitate mare de energie pentru a menține această conformație. Această conformație este nefavorabilă din punct de vedere energetic.
conformatie inhibata - apare atunci când substituenții identici sunt cât mai îndepărtați unul de celălalt și molecula are o rezervă minimă de energie. Aceasta conformatie este favorabila energetic.
P 
 Primul compus pentru care se cunoaște existența izomerilor conformaționali este etanul. Structura sa în spațiu este descrisă de formula perspectivei sau formula lui Newman:
Primul compus pentru care se cunoaște existența izomerilor conformaționali este etanul. Structura sa în spațiu este descrisă de formula perspectivei sau formula lui Newman:
C2H6
întunecat inhibat
conformatie conformatie
 Formulele de proiecție ale lui Newman.
Formulele de proiecție ale lui Newman.
Atomul de carbon cel mai apropiat de noi este desemnat printr-un punct în centrul cercului, cercul reprezintă atomul de carbon îndepărtat. Cele trei legături ale fiecărui atom sunt descrise ca linii divergente de la centrul cercului - pentru cel mai apropiat atom de carbon și cele mici - pentru atomul de carbon îndepărtat.
În lanțurile lungi de carbon, rotația este posibilă în jurul mai multor legături C-C. Prin urmare, întregul lanț poate accepta o varietate de forme geometrice. Conform datelor de difracție de raze X, lanțurile lungi de hidrocarburi saturate au o conformație în zig-zag și în formă de gheare. De exemplu: acizii palmitic (C 15 H 31 COOH) și stearic (C 17 H 35 COOH) în conformații în zig-zag fac parte din lipidele membranelor celulare, iar moleculele de monozaharide în soluție capătă o conformație în formă de gheare.
Conformațiile compușilor ciclici
Conexiunile ciclice sunt caracterizate de eforturi unghiulare asociate cu prezența unui ciclu închis.
Dacă considerăm că ciclurile sunt plate, atunci pentru multe dintre ele unghiurile de legătură se vor abate semnificativ de la normal. Stresul cauzat de deviația unghiurilor de legătură dintre atomii de carbon din inel de la valoare normală, numit colţ sau ale lui Bayer
De exemplu, în ciclohexan atomii de carbon sunt în starea hibridă sp 3 și, în consecință, unghiul de legătură ar trebui să fie egal cu 109 o 28 /. Dacă atomii de carbon se află în același plan, atunci în inelul plan unghiurile de legătură interne ar fi egale cu 120°, iar toți atomii de hidrogen ar fi într-o conformație eclipsată. Dar ciclohexanul nu poate fi plat din cauza prezenței unor tensiuni unghiulare și de torsiune puternice. Ea dezvoltă conformații neplanare mai puțin solicitate datorită rotației parțiale în jurul legăturilor ϭ, printre care conformațiile sunt mai stabile fotolii Şi băi.
Conformația scaunului este cea mai favorabilă din punct de vedere energetic, deoarece nu are poziții ocluse ale atomilor de hidrogen și carbon. Dispunerea atomilor de H ai tuturor atomilor de C este aceeași ca și în conformația inhibată a etanului. În această conformație, toți atomii de hidrogen sunt deschiși și disponibili pentru reacții.
Conformația băii este mai puțin favorabilă din punct de vedere energetic, deoarece 2 perechi de atomi de C (C-2 și C-3), (C-5 și C-6) aflați la bază au atomi de H într-o conformație eclipsată, prin urmare această conformație are mari dimensiuni. rezervă de energie și instabil.
C6H12 ciclohexan
Forma „scaunului” este mai benefică din punct de vedere energetic decât „cada”.
- Izomerie optică.
La sfârșitul secolului al XIX-lea, s-a descoperit că mulți compuși organici sunt capabili să rotească planul unui fascicul polarizat la stânga și la dreapta. Adică, un fascicul de lumină incident pe o moleculă interacționează cu învelișurile sale de electroni și are loc polarizarea electronilor, ceea ce duce la o schimbare a direcției oscilațiilor în câmpul electric. Dacă o substanță rotește planul de vibrație în sensul acelor de ceasornic, se numește dextrogir(+) dacă este în sens invers acelor de ceasornic - stângaci(-). Aceste substanțe au fost numite izomeri optici. Izomerii optic activi conțin un atom de carbon asimetric (chiral) - acesta este un atom care conține patru substituenți diferiți. A doua condiție importantă este absența tuturor tipurilor de simetrie (axă, plană). Acestea includ mulți hidroxi și aminoacizi
Studiile au arătat că astfel de compuși diferă în ordinea de aranjare a substituenților pe atomii de carbon în hibridizarea sp 3.
P  cel mai simplu compus este acidul lactic (acid 2-hidroxipropanoic)
cel mai simplu compus este acidul lactic (acid 2-hidroxipropanoic)
Stereoizomerii ale căror molecule sunt legate între ele ca obiect și imagine in oglindă incompatibilă sau ca mână stângă și dreaptă sunt numiți enantiomeri(izomeri optici, izomeri oglindă, antipozi, iar fenomenul se numește enantiomerism. Toate chimice și proprietăți fizice enantiomerii sunt aceiași, cu excepția a doi: rotația planului luminii polarizate (într-un dispozitiv polarimetru) și activitatea biologică.
Configurația absolută a moleculelor este determinată prin metode fizico-chimice complexe.
Configurația relativă a compușilor optic activi este determinată prin comparație cu un standard de gliceraldehidă. Substanțele optic active având configurația gliceraldehidei dextrogitoare sau levogitoare (M. Rozanov, 1906) sunt numite substanțe din seriile D și L. Un amestec egal de izomeri dextro și levorotari ai unui compus se numește racemat și este optic inactiv.
Cercetările au arătat că semnul rotației luminii nu poate fi asociat cu apartenența unei substanțe la seriile D și L este determinat doar experimental în instrumente - polarimetre; De exemplu, acidul L-lactic are un unghi de rotație de +3,8 o, acidul D-lactic - -3,8 o.
Enantiomerii sunt reprezentați folosind formulele lui Fischer.
- Lanțul de carbon este reprezentat de o linie verticală.
- Grupa funcțională senior este plasată în partea de sus, grupa funcțională juniori în jos.
- Un atom de carbon asimetric este reprezentat printr-o linie orizontală, la capetele căreia se află substituenți.
- Numărul de izomeri este determinat de formula 2 n, n este numărul de atomi de carbon asimetrici.

 Rând L-Rând D
Rând L-Rând D
Printre enantiomeri pot exista molecule simetrice care nu au activitate optică și sunt numite mezoizomerii.
 De exemplu: Casa de vinuri De exemplu: Casa de vinuri |

| D – (+) – rând L – (–) – rând | Mezovinnaya k-ta |
Racemate – suc de struguri
Izomerii optici care nu sunt izomeri în oglindă, care diferă în configurația mai multor atomi de C asimetrici, dar nu toți, având proprietăți fizice și chimice diferite, se numesc s- di-O-stereoizomerii.
P-Diastereomerii (izomerii geometrici) sunt stereomeri care au o legătură p în moleculă. Se găsesc în alchene, compuși nesaturați cu carbon superior, compuși dicarbonici nesaturați. De exemplu:

Cis-buten-2 Trans-buten-2
Activitatea biologică a substanțelor organice este legată de structura lor. De exemplu:

Acid cis-butenediic, acid trans-butenediic,
acid maleic - acid fumaric - netoxic,
foarte toxic găsit în organism
Toți compușii naturali nesaturați cu carbon superior sunt izomeri cis.
Conceptul de sisteme conjugate. Conceptul de aromaticitate a moleculelor organice. regula lui Hückel. Aromaticitatea compușilor benzenoizi (benzen și naftalină) și heterociclici (furan, tiofen, pirol, pirazol, imidazol, piridină, pirimidină, purină).
Teoria structurii chimice A.M. Butlerov. Structura electronică a atomului de carbon și tipurile de hibridizare.
În 1861 A.M. Butlerov a propus o teorie a structurii chimice a compușilor organici, care constă din următoarele principii de bază.
1. În moleculele substanțelor există o secvență strictă de legături chimice a atomilor, care se numește structură chimică.
2. Proprietăți chimice substanțele sunt determinate de natura componentelor lor elementare, cantitatea și structura lor chimică.
3. Dacă substanțele cu aceeași compoziție și greutate moleculară au structuri diferite, atunci apare fenomenul de izomerie.
4. Deoarece în reacțiile specifice se modifică doar unele părți ale moleculei, studierea structurii produsului ajută la determinarea structurii moleculei originale.
5. Natura chimică (reactivitatea) atomilor individuali dintr-o moleculă se modifică în funcție de mediu, adică. în funcţie de ce atomi ai altor elemente sunt conectate.
Un atom de carbon în stare excitată conține patru electroni nepereche la nivelul său de energie exterior și este capabil să formeze patru legături covalente.
Orbitii hibrizi participă la formarea legăturilor.
Prima stare de valență este hibridizarea sp3. Ca urmare a hibridizării cu participarea unui s și a trei orbitali p ai atomului de carbon, se formează patru orbitali sp3-hibrizi echivalenti, direcționați către vârfurile tetraedrului la unghiuri de 109,5°:
În starea de hibridizare sp3, atomul de carbon formează patru legături s cu patru substituenți și are o configurație tetraedrică cu unghiuri de legătură egale sau apropiate de 109,5°. (de exemplu metan)
A doua stare de valență este hibridizarea sp2. Ca urmare a hibridizării cu participarea unui orbital s și a doi p-orbitali ai unui atom de carbon, se formează trei orbitali hibrid sp2 echivalenti, situati în același plan la unghiuri de 120°, iar orbitalul p nu participă la hibridizarea este situată perpendicular pe planul orbitalilor hibrizi.
În starea de hibridizare sp2, atomul de carbon formează trei legături s datorită orbitalilor hibrizi și o legătură p datorită orbitalului p care nu participă la hibridizare și are trei substituenți. (de exemplu etilenă)
A treia stare de valență a carbonului este hibridizarea sp. Ca urmare a hibridizării cu participarea unui orbital s și a unui orbital p, se formează doi orbitali hibrid sp echivalenti, situati la un unghi de 1800, iar orbitalii p care nu participă la hibridizare sunt situați perpendicular pe planul lui. orbitalii hibrizi și unul față de celălalt. În starea de hibridizare sp, atomul de carbon formează două legături s datorită orbitalilor hibrizi și două legături p datorită orbitalilor p care nu participă la hibridizare și are doi substituenți. (de exemplu, acetilena)
Conceptul de configurație a moleculelor. Izomerie optică sau oglindă. Elemente de simetrie ale moleculelor (axa, planul, centrul). Atomul de carbon asimetric ca centru de chiralitate. Activitatea optică și rotația specifică a substanțelor.



Molecule cu un centru de chiralitate (enantiomerism). Gliceraldehida ca standard de configurare. Formule de proiecție Fischer. Configurație relativă și absolută. D-, L- și R-, S-sisteme. Conceptul de racemați.
Enantiomerii sunt stereoizomeri care sunt legați între ei, ca un obiect și o imagine în oglindă incompatibilă.
Doar moleculele chirale pot exista ca enantiomeri.
Chiralitatea este proprietatea unui obiect de a fi incompatibil cu el imagine în oglindă. Obiectele chirale (din grecescul cheir - mână) sau asimetrice sunt mâna stângă și dreaptă, precum și mănuși, cizme etc. Aceste obiecte pereche reprezintă un obiect și imaginea lui în oglindă (Fig. 7.1, a). Astfel de articole nu pot fi combinate complet între ele.
În același timp, în jurul nostru există multe obiecte care sunt compatibile cu imaginea lor în oglindă, adică sunt achirale (simetrice), de exemplu farfurii, linguri, pahare etc. Obiectele achirale au cel puțin un plan de simetrie, care împarte obiect în două părți identice în oglindă (vezi Fig. 7.1, b).
Relații similare sunt observate și în lumea moleculelor, adică moleculele sunt împărțite în chirale și achirale. Moleculele achirale au planuri de simetrie, dar moleculele chirale nu.
Moleculele chirale au unul sau mai mulți centri de chiralitate. În compușii organici, atomul de carbon asimetric acționează cel mai adesea ca centru al chiralității.
Un atom de carbon asimetric este unul care este legat de patru atomi sau grupuri diferite.
Când descrieți formula stereochimică a unei molecule, simbolul „C” pentru atomul de carbon asimetric este de obicei omis.

Pentru a descrie izomerii configuraționali pe un plan, puteți utiliza formule stereochimice. Cu toate acestea, este mai convenabil să utilizați mai simplu de scris Formule de proiecție Fischer(mai simplu - proiecții Fischer).
Modelul tetraedric al unuia dintre enantiomeri este poziționat în spațiu astfel încât lanțul de atomi de carbon să fie într-o poziție verticală, iar grupa carboxil este deasupra. Legăturile cu substituenți non-carboni (H și OH) la centrul chiral ar trebui să fie îndreptate către observator. După aceasta, modelul este proiectat pe un plan. Simbolul atomului asimetric este omis, este înțeles ca punct de intersecție a liniilor verticale și orizontale.
Modelul tetraedric al unei molecule chirale poate fi poziționat în spațiu în diferite moduri înainte de proiectare. Este necesar doar ca conexiunile care formează o linie orizontală pe proiecție să fie îndreptate către observator, iar conexiunile verticale - dincolo de planul desenului.
În formula de proiecție, este permisă schimbarea locurilor oricăror doi substituenți în același centru chiral de un număr par de ori (două permutări sunt suficiente);
Formula de proiecție poate fi rotită cu 180 în planul de desen? (care echivalează cu două permutări), dar nu cu 90?.
Pentru standard de configurare a fost luată gliceraldehidă. Enantiomerul său levogitor a fost arbitrar atribuite formulei (I). Această configurație a atomului de carbon a fost desemnată prin litera l (din lat. laevus- stânga). Enantiomerului dextrogiro i s-a atribuit în consecință formula (II), iar configurația a fost desemnată prin litera d (din latină. dexter- dreapta).
Rețineți că în formula standard de proiecție a l-gliceraldehidei grupa OH este în stânga, iar în d-gliceraldehidă este în dreapta.

Atribuirea la seriile d sau l a altor compuși optic activi înrudiți structural se face prin compararea configurației atomului lor asimetric cu configurația d- sau l-gliceraldehidei. De exemplu, într-unul dintre enantiomerii acidului lactic (I) din formula de proiecție, gruparea OH este în stânga, ca și în l-gliceraldehidă, prin urmare enantiomerul (I) este clasificat ca o serie l. Din aceleași motive, enantiomerul (II) este clasificat ca o serie d. Astfel, dintr-o comparație a proiecțiilor Fisher determinăm relativ configurație

Trebuie remarcat faptul că l-gliceraldehida are o rotație la stânga, iar acidul l-lactic are o rotație la dreapta (și acesta nu este un caz izolat). Mai mult, aceeași substanță poate fi fie stângaci, fie dreptaci, în funcție de condițiile de determinare (diferiți solvenți, temperatură).
Semnul de rotație al planului luminii polarizate nu este asociat cu apartenența la seria d- sau l-stereochimică.
Determinarea practică a configurației relative a compușilor optic activi se realizează folosind reacții chimice: fie substanța de testat este transformată în gliceraldehidă (sau altă substanță cu o configurație relativă cunoscută), fie, dimpotrivă, substanța de testat este obținută din d- sau l -gliceraldehida. Desigur, în timpul tuturor acestor reacții configurația atomului de carbon asimetric nu ar trebui să se schimbe.
Alocarea arbitrară a gliceraldehidei pentru stânga și dreapta la configurații convenționale a fost un pas forțat. La acel moment, configurația absolută nu era cunoscută pentru niciun compus chiral. Stabilirea configurației absolute a devenit posibilă numai datorită dezvoltării metodelor fizico-chimice, în special a analizei de difracție cu raze X, cu ajutorul căreia în 1951 a fost determinată pentru prima dată configurația absolută a unei molecule chirale - era o sare de (+) -acid tartric. După aceasta, a devenit clar că configurația absolută a d- și l-gliceraldehidelor este într-adevăr ceea ce le-a fost atribuită inițial.
Sistemul d,l este utilizat în prezent pentru α-aminoacizi, hidroxiacizi și (cu unele adaosuri) pentru carbohidrați
R,S-Sistem de desemnare a configurației. Sistemul d,L este de utilizare foarte limitată, deoarece este adesea imposibil să se coreleze configurația oricărui compus cu gliceraldehida. Sistemul universal pentru desemnarea configurației centrilor de chiralitate este sistemul R,S (din lat. drept- Drept, sinistru- stânga). Se bazează pe regula secvenței, pe baza vechimii substituenților asociați cu centrul chiralității.
Vechimea substituenților este determinată de numărul atomic al elementului asociat direct cu centrul de chiralitate - cu cât este mai mare, cu atât substituentul este mai vechi.
Astfel, gruparea OH este mai veche decât NH2, care, la rândul său, este mai veche decât orice grupare alchil și chiar COOH, deoarece în acesta din urmă un atom de carbon este legat de un centru asimetric. Dacă numerele atomice sunt aceleași, grupul al cărui atom de lângă carbon are un număr atomic mai mare este considerat senior, iar dacă acest atom (de obicei oxigen) este legat printr-o legătură dublă, se numără de două ori. Ca urmare, următoarele grupuri sunt aranjate în ordinea descrescătoare a priorității: -COOH > -CH=O > -CH2OH.
Pentru a determina configurația, modelul tetraedric al unui compus este poziționat în spațiu, astfel încât cel mai mic substituent (în majoritatea cazurilor acesta este un atom de hidrogen) să fie cel mai departe de observator. Dacă vechimea celor trei substituenți rămași scade în sensul acelor de ceasornic, atunci centrului chiralității i se atribuie configurația R (Fig. 7.4, a), dacă este în sens invers acelor de ceasornic. -S-configurarea (vezi Fig. 7.4, b), așa cum este văzută de șoferul aflat la volan (vezi Fig. 7.4, V).

Orez. 7.4. Determinarea configuraţiei enantiomerilor acidului lactic prin R,S- sistem (explicație în text)
Pentru a indica configurația conform sistemului RS, puteți utiliza proiecțiile Fisher. Pentru a face acest lucru, proiecția este transformată astfel încât
Întrebarea 9
Aciditatea și bazicitatea compușilor organici.
Pentru aprecierea acidității și bazicității compușilor organici, două teorii sunt de cea mai mare importanță - teoria Brønsted și teoria Lewis.
Conform teoriei lui Lewis, proprietățile acide și bazice ale compușilor sunt determinate de capacitatea lor de a accepta sau dona o pereche de electroni pentru a forma o legătură. Conform principiului Lewis, acizii și bazele sunt împărțite în tari și moi.
Acizii Lewis pot fi atomi, molecule sau cationi care au un orbital liber și sunt capabili să accepte o pereche de electroni pentru a forma o legătură covalentă.
Acizii Lewis sunt acceptori de perechi de electroni; Bazele Lewis sunt donatori de perechi de electroni. Bazele Lewis (atom, moleculă sau anion) trebuie să aibă cel puțin o pereche de electroni de valență pe care îi pot furniza unui partener pentru a forma o legătură covalentă. Toate bazele Lewis sunt reactivi nucleofili.
Conform teoriei Bronsted (teoria protolitică), aciditatea și bazicitatea compușilor este asociată cu transferul protonului H +. Un acid și o bază formează o pereche acid-bază conjugată, în care cu cât acidul este mai puternic, cu atât baza sa conjugata este mai slabă și, invers, cu cât baza este mai puternică, cu atât acidul conjugat este mai slab.
Acizii Bronsted (acizii protici) sunt molecule neutre sau ioni capabili să doneze un proton (donatori de protoni).
Bazele Bronsted sunt molecule neutre sau ioni care pot accepta un proton (acceptori de protoni).
Aciditatea și bazicitatea nu sunt absolute, ci proprietăți relative ale compușilor: proprietățile acide se găsesc numai în prezența unei baze; proprietăți de bază - numai în prezența acidului. Apa este de obicei folosită ca solvent atunci când se studiază echilibrul acido-bazic.
În funcție de natura elementului cu care este asociat protonul, există acizi OH (acizi carboxilici, fenoli, alcooli), acizi SH (tioli), acizi NH (amine, amide, imide), acizi CH (hidrocarburi și derivații acestora). ). Un element și atomul său de hidrogen asociat se numesc sit acid. În toate cazurile, există o schimbare a densității electronilor de la atomul de hidrogen la un atom mai electronegativ, protonul este mai mult sau mai puțin ușor de separat. Cu cât electronegativitatea elementului de care este legat protonul este mai mare, cu atât compusul este mai acid (astfel, acizii carboxilici sunt acizi mai puternici decât tiolii sau aminele).
Prezența grupurilor de atragere de electroni în moleculă, care au efecte electronice negative, crește sarcina pozitivă a protonului, ceea ce duce la creșterea proprietăților acide.
Pentru a forma o legătură covalentă cu un proton, bazele Brønsted trebuie să furnizeze fie o pereche de electroni, fie electroni de legătură p. În conformitate cu aceasta, fundațiile lui Bronsted sunt împărțite în n-baza si p-baza.
n-bazele pot fi neutre sau încărcate negativ. De regulă, anionii au un caracter mai puternic de bază decât substanțele neutre. Adică, ionul amidă NH 2 - sau ionul hidroxid HO - este superior ca bazicitate față de amoniacul NH 3 și apa H 2 O.
În bazele p, care includ alchene, alcadiene, arene, centrul bazicității, adică. Locul atașării protonilor este electronii legăturii p. Acestea sunt baze foarte slabe, deoarece perechile de electroni protonați nu sunt libere.
Prezența substituenților donatori de electroni crește bazicitatea compușilor organici.
1. Dependența acidității de heteroatom.
Natura unui heteroatom este înțeleasă ca electronegativitatea (E.O.) și polarizabilitatea sa. Cu cât (E.O.) este mai mare, cu atât apare mai ușor clivajul heterolitic în moleculă. În perioadele de la stânga la dreapta, pe măsură ce sarcina nucleului crește, (E.O) crește, adică. capacitatea elementelor de a păstra o sarcină negativă. Ca urmare a schimbării densității electronilor, legătura dintre atomi este polarizată. Cu cât sunt mai mulți electroni și cu cât raza atomului este mai mare, cu atât electronii nivelului de energie exterior sunt localizați mai departe de nucleu, cu atât polarizabilitatea este mai mare și aciditatea este mai mare.
Exemplu: CH- NH- OH- SH-
creșterea E.O. si aciditate
C, N, O sunt elemente din aceeași perioadă. E.O. crește pe parcursul perioadei, aciditatea crește. În acest caz, polarizabilitatea nu va afecta aciditatea.
Polarizabilitatea atomilor într-o perioadă se modifică ușor, astfel încât principalul factor care determină aciditatea este E.O.
Acum luați în considerare OH-SH-
aciditate crescută
O, S - sunt în același grup, raza în grup crește de sus în jos, prin urmare, polarizabilitatea atomului crește și ea, ceea ce duce la o creștere a acidității. S are o rază atomică mai mare decât O, astfel încât tiolii prezintă proprietăți acide mai puternice în comparație cu alcoolii.
2. Influența radicalului de hidrocarbură și a substituenților prezenți în acesta
Substituenți atrăgătoare de electroni (E.A.). contribuie la delocalizarea densității electronice, ceea ce duce la stabilitatea anionului și, în consecință, la o creștere a acidității.
Substituenți donatori de electroni (E.D.). dimpotrivă, ele contribuie la concentrarea densității electronilor în centrul acidului, ceea ce duce la scăderea acidității și la creșterea bazicității.
Efectul solventului.
Interacțiunea moleculelor sau ionilor unei substanțe dizolvate cu un solvent se numește proces solvatarea. Stabilitatea unui anion depinde în mod semnificativ de solvatarea acestuia în soluție: cu cât ionul este mai mult solvatat, cu atât este mai stabil și cu cât solvația este mai mare, cu atât este mai mică dimensiunea ionului și cu atât mai puțină delocalizare a sarcinii negative din el.
Proprietăți acide
1. C metale active:
HO-CH2-CH2-OH + 2Na → H2 + NaO-CH2-CH2-ONa (glicolat de sodiu)
2. Cu hidroxid de cupru (II) – reacție de înaltă calitate!

O reacție calitativă la alcoolii dihidric și polihidroxilic (fragment de diol) este reacția cu Cu(OH)2 într-un mediu alcalin, care are ca rezultat formarea unui compus complex de glicolat de cupru într-o soluție care dă culoarea albastră.
Diagrama simplificată

Proprietăți de bază
1. Cu acizi hidrohalici
HO-CH2-CH2-OH + 2HCI H+↔ CI-CH2-CH2-CI + 2H2O
Cu acid azotic

Trinitroglicerina - baza dinamitei
Etilenglicol toxic - otravă puternică! Deprimă sistemul nervos central și afectează rinichii.
Glicerina (propantriol-1,2,3)– nu otrăvitoare. Inodor. Se amestecă bine cu apă. Distribuit în fauna sălbatică. Joacă un rol important în procesele metabolice, deoarece face parte din grăsimile (lipidele) țesuturilor animale și vegetale. Folosit ca componentă a unguentelor pentru a înmuia pielea.
Alcool polihidric ciclic inozitol aparține compușilor asemănători vitaminelor (vitaminele B) și este o componentă structurală a lipidelor complexe - fosfatidilinositol.
Pentru obținere se folosește etilendiamina acid etilendiaminotetraacetic interactiunea cu acid cloracetic. Sărurile sale cu acizi grași utilizat ca agent de înmuiere în producție textile. În producție se folosește și etilendiamina coloranți,emulgatori, stabilizatori latexuri, plastifiantiŞi fungicide. Etilendiamină toxic; concentrația maximă admisă lui vaporiîn aer este de 0,001 mg/l.
Dintre poliamine, cea mai cunoscută este tetrametilendiamina sau putrescine H2N(CH2)4NH2 şi pentametilendiamină sau cadaverină H2N(CH2)5NH2. Multă vreme au fost considerate otrăvuri cadaverice, adică. substanțe formate în timpul decarboxilării diaminoacizilor și provocând toxicitatea proteinelor putrezite.
12. Fenolii. Caracteristici generale.

Structura electronică a grupării carbonil. Reacții de adiție nucleofilă a AN la gruparea carbonil. Reacții de adăugare de apă, acid cianhidric, alcooli, bisulfit de sodiu. Mecanismul de condensare aldolică și reacția Cannizzaro.

Structura grupării carbonil C=O.
· Proprietățile aldehidelor și cetonelor sunt determinate de structura grupării carbonil >C=O.
Legătura C=O este foarte polară. Momentul său dipol este semnificativ mai mare decât cel al legăturii C-O în alcooli. Electronii legăturii multiple C=O, în special electronii p mai mobili, sunt deplasați către atomul de oxigen electronegativ, ceea ce duce la apariția unei sarcini negative parțiale asupra acestuia. Carbonul carbonil capătă o sarcină pozitivă parțială.
· Prin urmare, carbonul este atacat de reactivii nucleofili, iar oxigenul este atacat de reactivii electrofili, inclusiv H +.
Moleculelor de aldehide și cetone le lipsesc atomi de hidrogen capabili să formeze legături de hidrogen. Prin urmare, punctele lor de fierbere sunt mai mici decât cele ale alcoolilor corespunzători. Metanalul (formaldehida) este un gaz, aldehidele C 2 -C 5 și cetonele C 3 -C 4 sunt lichide, substanțele superioare sunt solide. Omologii inferiori sunt solubili în apă datorită formării legăturilor de hidrogen între atomii de hidrogen ai moleculelor de apă și atomii de oxigen carbonil. Pe măsură ce radicalul de hidrocarbură crește, solubilitatea în apă scade.
Adăugarea nucleofilă
Pentru aldehide și cetone, reacțiile de adiție nucleofile sunt cele mai caracteristice A N.
Descriere generală mecanism de adiție nucleofilă A N
Ușurința atacului nucleofil asupra atomului de carbon al grupării carbonil a unei aldehide sau cetone depinde de magnitudinea parțială.
sarcina pozitivă asupra atomului de carbon, accesibilitatea sa spațială și proprietățile acido-bazice ale mediului.

Luând în considerare efectele electronice ale grupărilor asociate atomului de carbon carbonil, valoarea sarcinii parțiale pozitive δ+ asupra acestuia în aldehide și cetone scade în următoarele serii:

Accesibilitatea spațială a atomului de carbon carbonil scade atunci când hidrogenul este înlocuit cu radicali organici mai voluminosi, astfel încât aldehidele sunt mai reactive decât cetonele.

Schema generală a reacțiilor de adiție nucleofile A N la o grupare carbonil implică un atac nucleofil asupra atomului de carbon carbonil, urmat de adăugarea unui electrofil la atomul de oxigen.
Într-un mediu acid, activitatea grupării carbonil crește în general, deoarece protonarea atomului de oxigen creează o sarcină pozitivă asupra atomului de carbon. Cataliza acidă este utilizată de obicei atunci când nucleofilul atacator are activitate scăzută.
Un număr de reacții importante ale aldehidelor și cetonelor sunt efectuate prin mecanismul de mai sus.

Adaos de alcooli. Alcoolii, atunci când interacționează cu aldehidele, se formează ușor hemiacetale. Hemiacetalii nu sunt de obicei izolați din cauza instabilității lor. Când există un exces de alcool într-un mediu acid, hemiacetalii se transformă în acetalii.

Utilizarea unui catalizator acid în conversia hemiacetalului în acetal este clară din mecanismul de reacție prezentat mai jos. Locul central în acesta este ocupat de formarea unui carbocation (I), stabilizat datorită participării unei perechi singure de electroni ai unui atom de oxigen vecin (+efectul M al grupului C 2 H 5 O).

Reacțiile de formare a hemiacetalilor și acetalilor sunt reversibile, astfel încât acetalii și hemiacetalii sunt ușor hidrolizați prin excesul de apă într-un mediu acid. Hemiacetalii sunt stabili într-un mediu alcalin, deoarece alcoxidionul este o grupare mai dificilă de plecare decât ionul hidroxid.
Conectarea apei. Adăugarea de apă la o grupare carbonil - hidratare- reacție reversibilă. Gradul de hidratare al unei aldehide sau cetone într-o soluție apoasă depinde de structura substratului.

Aldehida tricloroacetică (cloral) este complet hidratată. Gruparea triclorometil atrăgătoare de electroni stabilizează atât de mult hidratul de cloral încât această substanță cristalină desprinde apa numai în timpul distilării în prezența substanțelor deshidratante - acid sulfuric etc.

Adăugarea de amine și derivați ai acestora. Aminele și alți compuși care conțin azot cu formula generală NH2X (X = R, NHR) reacționează cu aldehidele și cetonele în două etape. În primul rând, se formează produse de adiție nucleofile, care apoi, din cauza instabilității, elimină apa. În acest sens, acest proces este în general clasificat ca o reacție ataşament-eliminare.

În cazul aminelor primare, substituite imine(se mai numesc bazele lui Schiff).
Iminele sunt produse intermediare ale multor procese enzimatice. Producerea iminelor trece prin stadiul de formare a aminoalcoolilor, care sunt relativ stabili, de exemplu, atunci când formaldehida reacţionează cu α-aminoacizi (vezi 12.1.4).
Iminele sunt produse intermediare în prepararea aminelor din aldehide și cetone prin aminare reductivă. Acest metoda generala constă în reducerea unui amestec dintr-un compus carbonil cu amoniac (sau amină). Procesul decurge conform schemei de adăugare-eliminare cu formarea unei imine, care este apoi redusă la o amină.
Când aldehidele și cetonele reacţionează cu derivaţii de hidrazină, ele produc hidrazone. Această reacție poate fi utilizată pentru a izola aldehidele și cetonele din amestecuri și pentru a le identifica cromatografic.


Bazele Schiff și alți compuși similari sunt ușor hidrolizați prin soluții apoase de acizi minerali pentru a forma produsele inițiale.
Formarea compușilor bisulfiți Prin adăugarea unei molecule de sulfat de sodiu acid (bisulfit), se obțin așa-numiți compuși bisulfit, cu hidrogen adăugat la oxigenul grupării carbonil, iar restul de SO 2 ONa la atomul de carbon:
În compușii bisulfiți, atomul de sulf este legat direct de carbon.

REACȚIA CANIZZARO, oxido-reducere disproporționarea aldehidelor sub influența alcaline cu formarea de alcooli primari și acizi carbonici, de exemplu:

Mecanismul propus de Cannizzaro pentru reacția omogenă. mediu include o etapă de transfer de hidrură 
Pentru aromatice aldehide, nu poate fi exclusă posibilitatea participării la reacția Cannizzaro a anionilor radicali formați ca urmare a transferului unui electron. O reacție similară cu reacția Cannizzaro are loc cu intramol. disproporționarea a-cetoaldehidelor în prezență. alcalii (rearanjare Cannizzaro): 
Dezaminare,
Dezaminarea intramoleculară
R-CH 2 – CH(NH 2) - COOH→ R- CH=CH-COOH + NH 3
α,β – acid nesaturat
Dezaminare hidrolitică
R-CH(NH 2) – COOH +H 2 O → R – CH(OH) – COOH + NH 3
α - hidroxi acid
Dezaminarea oxidativă
R-CH(NH 2) – COOH +1/2 O 2 → R –C(O) – COOH + NH 3
α-cetoacid
Formarea de complexe cu metale.α-aminoacizii formează săruri intracomplexe cu cationi de metale grele. Cu hidroxid de cupru (II) proaspăt preparat, toți α-aminoacizii în condiții blânde dau săruri de cupru albastru (II) intracomplex (chelat) bine cristalizate:

În astfel de săruri, ionul de cupru este conectat prin legături de coordonare la grupările amino.
Formarea legăturii peptidice.
Interacțiunea intermoleculară a α-aminoacizilor duce la formarea de peptide. Când doi α-aminoacizi interacționează, se formează o dipeptidă.

Interacțiunea intermoleculară a trei α-aminoacizi duce la formarea unei tripeptide etc.

Fragmentele de molecule de aminoacizi care formează un lanț peptidic se numesc resturi de aminoacizi, iar legătura CO-NH se numește legătură peptidică.
22. Decarboxilarea α-aminoacizilor - formarea de amine biogene și bioregulatori (histamină, triptamina).
Unii aminoacizi și derivații lor pot suferi decarboxilare - îndepărtarea grupării oc-carboxil. În țesuturile mamiferelor, o serie de aminoacizi sau derivații acestora pot suferi decarboxilare: Tri, Tyr, Val, Gis, Glu, Cis, Apr, etc. Produșii de reacție sunt CO 2 și aminele, care au un efect biologic pronunțat asupra organismului. (amine biogene):

Reacțiile de decarboxilare sunt ireversibile și sunt catalizate de enzimele decarboxilază. Grupul protetic al decarboxilazelor din celulele animale este fosfatul de piridoxal.
Aminele formate prin decarboxilarea aminoacizilor sunt adesea substanțe biologic active. Aceștia funcționează ca neurotransmițători (serotonină, dopamină, GABA etc.), hormoni (norepinefrină, adrenalină) și factori locali de reglare (histamină, carnozină, spermină etc.).
Histamina se formează prin decarboxilarea aminoacidului histidină. Este sintetizat în mastocite, se acumulează în granule secretoare și este eliberat atunci când celulele sunt iritate.

Histamina are o varietate de efecte biologice: provoacă vasodilatație, reduce tensiunea arterială, crește permeabilitatea țesuturilor, provoacă edem local, stimulează secreția gastrică și are efect bronhospatic. În concentrații mari, este un mediator al reacțiilor inflamatorii și alergice.
Serotonina se formează prin decarboxilarea hidroxitriptofanului. Se sintetizează în celulele cromafine, în unele nuclee ale structurilor subcorticale și trombocite.

Efectele serotoninei: provoacă vasospasm, creșterea tensiunii arteriale, stimulează motilitatea intestinală, participă la termoreglarea, mecanismele de somn, este o sursă pentru sinteza hormonului melatonina, afectează reacțiile mentale ale omului. Astfel, în schizofrenie există o tulburare a metabolismului serotoninei.
Catecolaminele (dopamina, adrenalina, norepinefrina) sunt sintetizate din aminoacidul tirozina.
Dopamina este un neurotransmitator excitator cand este deficitara se dezvolta boala Parkinson (adinamie, rigiditate, tremor). Adrenalina provoacă vasospasm, crește tensiunea arterială, stimulează inima și este un hormon.
Noradrenalina îndeplinește în primul rând funcții de neurotransmițători.
Poliaminele (spermină, spermidină) sunt sintetizate din ornitină și metionină, fac parte din cromatina și sunt implicate în reglarea proceselor de translație, transcripție și replicare.
Deoarece aminele biogene sunt foarte active, ele sunt rapid inactivate în țesuturi. Descompunerea aminelor biogene efectuată în mai multe moduri: oxidare, metilare, dezaminare. Principala metodă de inactivare a aminelor biogene este dezaminare oxidativă sub influența enzimelor amino oxidaze (monoaminoxidaze, poliaminoxidaze).
![]()
Aminoacizii pot fi legați covalent unul de celălalt folosind legături peptidice. Gruparea carboxil a unui aminoacid este legată covalent de gruparea amino a altui aminoacid. Aceasta creează o legătură R-CO-NH-R, numită legătură peptidică. În acest caz, molecula de apă este divizată.
O- și N-glucozide. Hidroliza glucozidelor. Fosfații de monozaharide. Acilarea zaharurilor amino. Oxidarea monozaharidelor. Prepararea osazonelor de glucoză. Proprietățile restauratoare ale al-dozei. Xilitol, sorbitol. Acid ascorbic.
Glicozidele sunt derivați ai formelor ciclice de carbohidrați în care gruparea hemiacetal hidroxil este înlocuită cu o grupare OR.
Componentă non-carbohidrată – agliconă. Legătura dintre centrul anomeric și grupa –OR este glicozidică.
Furanozidele sunt împărțite în piranozide.
Glicozidele de glucoză se numesc glucozide, glicozidele de riboză se numesc ribozide etc.
GLICOZIDE
s a x a r aglicon
(de obicei o monozaharidă) (alcool, compuși aromatici, steroizi etc.)
Sinigrina glicozidă; hidroliză:
glicozidă de vanilină; hidroliză:
Fosfații sunt monozaharide.
Mare valoare au esteri ai acidului fosforic – fosfați. Se găsesc în toate organismele vegetale și animale și sunt forme active metabolic de monozaharide. Cel mai important rol îl au D-glucoză și D-fructoză fosfați.
Oxidarea glucozei într-un mediu neutru, ușor acid:

Oxidare cu un agent oxidant puternic:

Oxidarea glucozei într-un mediu alcalin.
Districtul Tollens:
Este un acid y-lactonă.
Conținut în fructe, în special citrice, fructe de pădure (măceșe, coacăze negre), legume, lapte.
Prezintă proprietăți acide puternice
datorită uneia dintre grupările hidroxil ale fragmentului de enediol.
Când se formează săruri, inelul y-lactonă nu se deschide.
Are proprietăți puternice de restaurare. Acidul dehidroascorbic format în timpul oxidării sale este ușor redus la acid ascorbic. Acest proces asigură o serie de reacții redox în organism.

Chimia organică este chimia atomului de carbon. Numărul compușilor organici este de zeci de ori mai mare decât al celor anorganici, ceea ce poate fi doar explicat caracteristicile atomului de carbon :
a) el este în mijlocul scării de electronegativitate iar a doua perioadă, prin urmare, nu este profitabil pentru el să-i dea pe ai săi și să accepte electronii altor oameni și să dobândească o sarcină pozitivă sau negativă;
b) structura specială a învelișului de electroni – nu există perechi de electroni și orbitali liberi (mai există un singur atom cu o structură similară - hidrogenul, motiv pentru care, probabil, carbonul și hidrogenul formează atât de mulți compuși - hidrocarburi).
Structura electronică a atomului de carbon
C – 1s 2 2s 2 2p 2 sau 1s 2 2s 2 2p x 1 2p y 1 2p z 0
În formă grafică:
Un atom de carbon în stare excitată are următoarea formulă electronică:
*C – 1s 2 2s 1 2p 3 sau 1s 2 2s 1 2p x 1 2p y 1 2p z 1
Sub formă de celule: 
Forma orbitalilor s și p


Orbital atomic - regiunea spațiului unde este cel mai probabil să se găsească un electron, cu numere cuantice corespunzătoare.
Este o „hartă de contur” tridimensională a electronilor în care funcția de undă determină probabilitatea relativă de a găsi un electron în acel punct anume al orbitalului.
Dimensiunile relative ale orbitalilor atomici cresc pe masura ce energiile lor cresc ( număr cuantic principal- n), iar forma și orientarea lor în spațiu este determinată de numerele cuantice l și m. Electronii din orbitali sunt caracterizați de un număr cuantic de spin. Fiecare orbital nu poate conține mai mult de 2 electroni cu spini opuși.
Atunci când formează legături cu alți atomi, atomul de carbon își transformă învelișul de electroni astfel încât se formează cele mai puternice legături și, în consecință, se eliberează cât mai multă energie, iar sistemul capătă cea mai mare stabilitate.
Schimbarea învelișului de electroni a unui atom necesită energie, care este apoi compensată prin formarea de legături mai puternice.
Transformarea învelișului de electroni (hibridarea) poate fi în principal de 3 tipuri, în funcție de numărul de atomi cu care atomul de carbon formează legături.
Tipuri de hibridizare:
sp 3 – un atom formează legături cu 4 atomi vecini (hibridare tetraedrică):
Formula electronică a sp 3 – atom de carbon hibrid:
*С –1s 2 2(sp 3) 4 sub formă de celule 

Unghiul de legătură dintre orbitalii hibrizi este de ~109°.
Formula stereochimică a atomului de carbon:

sp 2 – Hibridarea (starea de valență)– un atom formează legături cu 3 atomi vecini (hibridare trigonală):
Formula electronică a sp 2 – atom de carbon hibrid:
*С –1s 2 2(sp 2) 3 2p 1 sub formă de celule 
Unghiul de legătură dintre orbitalii hibrizi este de ~120°.
Formula stereochimică a sp 2 - atom de carbon hibrid:

sp– Hibridarea (starea de valență) – un atom formează legături cu 2 atomi vecini (hibridare liniară):
Formula electronică a sp – atom de carbon hibrid:
*С –1s 2 2(sp) 2 2p 2 sub formă de celule 
Unghiul de legătură dintre orbitalii hibrizi este de ~180°.
Formula stereochimică:

S-orbital este implicat în toate tipurile de hibridizare, deoarece are energie minimă.
Restructurarea norului de electroni permite formarea celor mai puternice legături posibile și interacțiunea minimă a atomilor din molecula rezultată. În același timp orbitalii hibrizi pot să nu fie identici, dar unghiurile de legătură pot fi diferite, de exemplu CH2CI2 şi CCl4
2. Legături covalente în compușii de carbon
Legături covalente, proprietăți, metode și motive de formare - programa școlară.
Lasă-mă să-ți amintesc doar:
1. Comunicarea Educației între atomi poate fi considerată ca urmare a suprapunerii orbitalilor lor atomici și cu cât este mai eficientă (cu cât integrala de suprapunere este mai mare), cu atât legătura este mai puternică.
Conform datelor calculate, eficiența de suprapunere relativă a orbitalilor atomici S rel crește după cum urmează:

Prin urmare, utilizarea orbitalilor hibrizi, cum ar fi orbitalii de carbon sp 3, pentru a forma legături cu patru atomi de hidrogen are ca rezultat legături mai puternice.
2. Legăturile covalente în compușii de carbon se formează în două moduri:
O)Dacă doi orbitali atomici se suprapun de-a lungul axelor lor principale, legătura rezultată se numește - legătura σ.
Geometrie. Astfel, atunci când se formează legături cu atomi de hidrogen din metan, patru orbitali hibrizi sp 3 ~ ai atomului de carbon se suprapun cu orbitalii s ai patru atomi de hidrogen, formând patru legături σ puternice identice situate la un unghi de 109°28" față de fiecare. altele (unghi tetraedric standard) O structură tetraedrică strict simetrică similară apare, de exemplu, în timpul formării CCl 4 dacă atomii care formează legături cu carbonul nu sunt aceiași, de exemplu în cazul CH 2 C1 2 ; structura va diferi ușor de cea complet simetrică, deși rămâne în esență tetraedrică.
lungimea legăturii σîntre atomi de carbon depinde de hibridizarea atomilor și scade în timpul trecerii de la sp 3 - hibridizare la sp. Acest lucru se explică prin faptul că orbitalul s este mai aproape de nucleu decât orbitalul p, prin urmare, cu cât ponderea sa în orbitalul hibrid este mai mare, cu atât este mai scurt și, prin urmare, legătura formată este mai scurtă.
B) Dacă doi atomici - și trei -orbitalii situati paralel intre ei realizeaza suprapunere laterala deasupra si sub planul in care se afla atomii, atunci legatura rezultata se numeste - π (pi) -comunicare


Suprapunere laterală orbitalii atomici este mai puțin eficient decât suprapunerea de-a lungul axei majore, deci π - conexiunile sunt mai puțin puternice decât σ - conexiuni. Acest lucru se manifestă, în special, prin faptul că energia unei legături duble carbon-carbon este mai mică de două ori energia unei legături simple. Astfel, energia legăturii C-C în etan este de 347 kJ/mol, în timp ce energia legăturii C = C în etenă este de numai 598 kJ/mol și nu ~ 700 kJ/mol.
Gradul de suprapunere laterală a doi orbitali atomici 2p , și deci puterea π -legăturile sunt maxime dacă sunt doi atomi de carbon și patru legați de ei atomii sunt localizați strict într-un singur plan, adică dacă ei coplanare , deoarece numai în acest caz orbitalii atomici 2p sunt exact paraleli unul cu celălalt și, prin urmare, sunt capabili de suprapunere maximă. Orice abatere de la starea coplanară din cauza rotației în jur σ -legătura care leagă doi atomi de carbon va duce la o scădere a gradului de suprapunere și, în consecință, la o scădere a rezistenței π -bond, care ajută astfel la menținerea planeității moleculei.
Rotaţieîn jurul unei duble legături carbon-carbon nu este posibilă.
Distributie π -electroni deasupra si sub planul moleculei inseamna existenta zone cu sarcină negativă, gata să interacționeze cu orice reactivi cu deficit de electroni.
Atomii de oxigen, azot etc. au, de asemenea, stări de valență diferite (hibridare), în timp ce perechile lor de electroni pot fi localizate atât în orbitali hibrizi, cât și în p-orbitali.