Distribuția electronilor pe diferite AO se numește configurația electronică a unui atom. Ii corespunde configuratia electronica cu cea mai mica energie stare de bază atom, configurațiile rămase se referă la stări excitate.
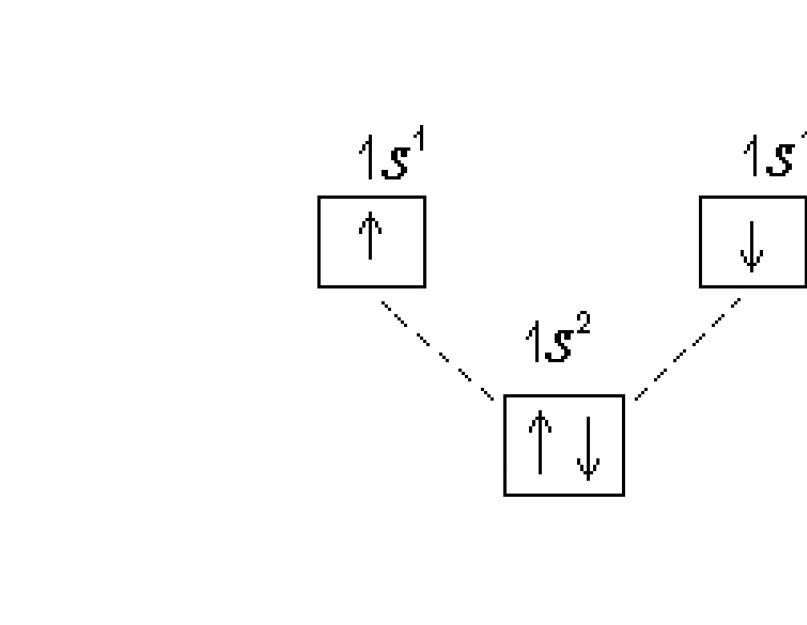
Configurația electronică a unui atom este descrisă în două moduri - sub formă de formule electronice și diagrame de difracție a electronilor. La scrierea formulelor electronice se folosesc numerele cuantice principale și orbitale. Subnivelul este notat cu numărul cuantic principal (numărul) și numărul cuantic orbital (litera corespunzătoare). Numărul de electroni dintr-un subnivel caracterizează superscriptul. De exemplu, pentru starea fundamentală a atomului de hidrogen, formula electronică este: 1 s 1 .
Structura nivelurilor electronice poate fi descrisă mai complet folosind diagrame de difracție a electronilor, unde distribuția pe subniveluri este reprezentată sub formă de celule cuantice. În acest caz, orbital este descris în mod convențional ca un pătrat, lângă care este atașată denumirea de subnivel. Sub-nivelurile de la fiecare nivel ar trebui să fie ușor compensate în înălțime, deoarece energia lor este oarecum diferită. Electronii sunt reprezentați prin săgeți sau ↓ în funcție de semnul numărului cuantic de spin. Diagrama de difracție a electronilor a atomului de hidrogen:
Principiul construirii configurațiilor electronice ale atomilor multielectroni este de a adăuga protoni și electroni la atomul de hidrogen. Distribuția electronilor pe niveluri și subniveluri de energie se supune regulilor considerate anterior: principiul energiei minime, principiul Pauli și regula lui Hund.
Luând în considerare structura configurațiilor electronice ale atomilor, toate elementele cunoscute, în conformitate cu valoarea numărului cuantic orbital al ultimului subnivel completat, pot fi împărțite în patru grupe: s-elemente, p-elemente, d-elemente, f-elemente.
Într-un atom de heliu He (Z=2) al doilea electron ocupă 1 s-orbital, formula sa electronică: 1 s 2. Diagrama electronografică:

Heliul încheie prima perioadă cea mai scurtă din Tabelul Periodic al Elementelor. Se notează configurația electronică a heliului.
A doua perioadă deschide litiu Li (Z=3), formula sa electronică:  Diagrama electronografică:
Diagrama electronografică:

Următoarele sunt diagrame simplificate de difracție de electroni ale atomilor elementelor ai căror orbiti de același nivel de energie sunt localizați la aceeași înălțime. Subnivelurile interne, complet completate, nu sunt afișate.
Litiu este urmat de beriliu Be (Z=4), în care un electron suplimentar populează 2 s-orbital. Formula electronică Be: 2 s 2

În starea fundamentală, următorul electron de bor B (z=5) ocupă 2 R-orbital, V:1 s 2 2s 2 2p unu ; modelul său de difracție a electronilor:

Următoarele cinci elemente au configurații electronice:
C (Z=6): 2 s 2 2p 2N (Z=7): 2 s 2 2p 3

O (Z=8): 2 s 2 2p 4 F (Z=9): 2 s 2 2p 5

Ne (Z=10): 2 s 2 2p 6

Configurațiile electronice date sunt determinate de regula lui Hund.
Primul și al doilea nivel de energie de neon sunt complet umplute. Să desemnăm configurația sa electronică și o vom folosi în continuare pentru concizia înregistrării formulelor electronice ale atomilor elementelor.
Sodiu Na (Z=11) și Mg (Z=12) deschid a treia perioadă. Electronii exteriori ocupă 3 s-orbital:
Na (Z=11): 3 s 1

Mg (Z=12): 3 s 2

Apoi, începând cu aluminiu (Z=13), 3 R-subnivel. A treia perioadă se termină cu argon Ar (Z=18):
Al (Z=13): 3 s 2 3p 1

Ar (Z=18): 3 s 2 3p 6

Elementele celei de-a treia perioade diferă de elementele celei de-a doua prin faptul că au liber 3 d-orbitalii care pot participa la formarea unei legaturi chimice. Aceasta explică stările de valență prezentate de elemente.
În a patra perioadă, în conformitate cu regula ( n+l), în potasiu K (Z=19) și calciu Ca (Z=20) electroni ocupă 4 s- subnivel, nu 3 d. Începând cu scandiu Sc (Z=21) și terminând cu zinc Zn (Z=30), 3 d- subnivel:
Formule electronice d-elementele pot fi reprezentate sub formă ionică: subnivelurile sunt enumerate în ordinea crescătoare a numărului cuantic principal, iar la o constantă n– în ordinea creșterii numărului cuantic orbital. De exemplu, pentru Zn o astfel de intrare ar arăta astfel:  Ambele intrări sunt echivalente, dar formula zincului dată mai devreme reflectă corect ordinea în care sunt completate subnivelurile.
Ambele intrări sunt echivalente, dar formula zincului dată mai devreme reflectă corect ordinea în care sunt completate subnivelurile.
Rândul 3 d-elemente în crom Cr (Z=24) există o abatere de la regulă ( n+l). Conform acestei reguli, configurația Cr ar trebui să arate astfel:  Se constată că configurația sa reală este
Se constată că configurația sa reală este  Uneori, acest efect este numit „eșecul” electronului. Efecte similare sunt explicate prin stabilitatea crescută la jumătate ( p
3 ,
d
5 ,
f
7) și complet ( p
6 ,
d
10 ,
f
14) subnivele finalizate.
Uneori, acest efect este numit „eșecul” electronului. Efecte similare sunt explicate prin stabilitatea crescută la jumătate ( p
3 ,
d
5 ,
f
7) și complet ( p
6 ,
d
10 ,
f
14) subnivele finalizate.
Abateri de la regula ( n+l) se observă și în alte elemente (Tabelul 2). Acest lucru se datorează faptului că pe măsură ce numărul cuantic principal crește, diferențele dintre energiile subnivelurilor scad.
Urmează umplerea 4 p-subnivel (Ga - Kr). A patra perioadă conține doar 18 elemente. În mod similar, umplerea 5 s-, 4d- și 5 p- subnivelurile a 18 elemente ale perioadei a cincea. Rețineți că energia 5 s- și 4 d-subnivelurile sunt foarte apropiate, iar un electron cu 5 s- subnivelul poate ajunge cu ușurință la 4 d-subnivel. Pe 5 s-subnivelul Nb, Mo, Tc, Ru, Rh, Ag are un singur electron. În stare de bază 5 s- subnivelul Pd nu este completat. Se observă o „scădere” a doi electroni.
masa 2
Excepții de la ( n+l) – reguli pentru primele 86 de elemente
|
Configuratie electronica |
||
|
conform regulii ( n+l) |
real |
|
|
4s 2 3d 4 4s 2 3d 9 5s 2 4d 3 5s 2 4d 4 5s 2 4d 5 5s 2 4d 6 5s 2 4d 7 5s 2 4d 8 5s 2 4d 9 6s 2 4f 1 5d 0 6s 2 4f 2 5d 0 6s 2 4f 8 5d 0 6s 2 4f 14 5d 7 6s 2 4f 14 5d 8 6s 2 4f 14 5d 9 |
4s 1 3d 5 4s 1 3d 10 5s 1 4d 4 5s 1 4d 5 5s 1 4d 6 5s 1 4d 7 5s 1 4d 8 5s 0 4d 10 5s 1 4d 10 6s 2 4f 0 5d 1 6s 2 4f 1 5d 1 6s 2 4f 7 5d 1 6s 0 4f 14 5d 9 6s 1 4f 14 5d 9 6s 1 4f 14 5d 10 |
|
În a șasea perioadă după completarea 6 s-subnivelul de cesiu Cs (Z=55) si bariu Ba (Z=56) urmatorul electron, conform regulii ( n+l), ar trebui să ia 4 f-subnivel. Cu toate acestea, în lantanul La (Z=57), un electron intră în 5 d-subnivel. Umplut pe jumătate (4 f 7) 4f-subnivelul are stabilitate crescută, prin urmare, gadoliniu Gd (Z=64), după europiu Eu (Z=63), cu 4 f-subnivelul reține numărul anterior de electroni (7), iar noul electron ajunge la 5 d-subnivel, încălcarea regulii ( n+l). În terbiu Tb (Z=65), următorul electron ocupă 4 f-subnivel și există o tranziție electronică de la 5 d- subnivel (configurația 4 f 9 6s 2). Umplere 4 f-subnivelul se termină la iterbiu Yb (Z=70). Următorul electron al atomului de lutețiu Lu ocupă 5 d-subnivel. Configurația sa electronică diferă de cea a atomului de lantan doar prin faptul că este complet umplută cu 4 f-subnivel.
În prezent, în Sistemul periodic de elemente D.I. Mendeleev, sub scandiu Sc și ytriu Y, lutețiul (mai degrabă decât lantanul) este uneori localizat ca primul d-element și toate cele 14 elemente din fața lui, inclusiv lantanul, punându-l într-un grup special lantanide dincolo de Tabelul Periodic al Elementelor.
Proprietățile chimice ale elementelor sunt determinate în principal de structura nivelurilor electronice exterioare. Modificarea numărului de electroni pe al treilea din exterior 4 f- subnivelul are un efect redus asupra proprietăților chimice ale elementelor. Deci toate 4 f elementele sunt similare în proprietățile lor. Apoi, în a șasea perioadă există o umplere de 5 d-subnivel (Hf - Hg) si 6 p-subnivel (Tl - Rn).
În a șaptea perioadă 7 s-subnivelul se umple pentru franciu Fr (Z=87) si radiu Ra (Z=88). Actiniul are o abatere de la regulă ( n+l), iar următorul electron populează 6 d- subnivel, nu 5 f. Acesta este urmat de un grup de elemente (Th - No) cu o umplutură 5 f-subniveluri care formează o familie actinide. Rețineți că 6 d- și 5 f- subnivelurile au energii atât de apropiate încât configurația electronică a atomilor de actinidă adesea nu respectă regula ( n+l). Dar în acest caz, valoarea exactă a configurației este 5 f t 5d m nu atât de important, deoarece are un efect destul de slab asupra proprietăților chimice ale elementului.
Lawrencium Lr (Z=103) are un nou electron la 6 d-subnivel. Acest element este uneori plasat în Tabelul Periodic sub lutețiu. A șaptea perioadă nu este finalizată. Elementele 104 – 109 sunt instabile și proprietățile lor sunt puțin cunoscute. Astfel, pe măsură ce sarcina nucleului crește, structurile electronice similare ale nivelurilor exterioare sunt repetate periodic. În acest sens, ar trebui să ne așteptăm și la schimbări periodice ale diferitelor proprietăți ale elementelor.
Schimbarea periodică a proprietăților atomilor elementelor chimice
Proprietățile chimice ale atomilor elementelor se manifestă în timpul interacțiunii lor. Tipurile de configurații ale nivelurilor energetice externe ale atomilor determină principalele caracteristici ale comportamentului lor chimic.
Caracteristicile atomului fiecărui element care îi determină comportamentul în reacțiile chimice sunt energia de ionizare, afinitatea electronică, electronegativitatea.
Energia de ionizare este energia necesară pentru a detașa și îndepărta un electron dintr-un atom. Cu cât energia de ionizare este mai mică, cu atât puterea reducătoare a atomului este mai mare. Prin urmare, energia de ionizare este o măsură a capacității reducătoare a unui atom.
Energia de ionizare necesară pentru a detașa primul electron se numește prima energie de ionizare I 1 . Energia necesară pentru a detașa al doilea electron se numește a doua energie de ionizare I 2 etc. În acest caz, are loc următoarea inegalitate
eu 1< I 2 < I 3 .
Desprinderea și îndepărtarea unui electron dintr-un atom neutru are loc mai ușor decât dintr-un ion încărcat.
Valoarea maximă a energiei de ionizare corespunde gazelor nobile. Metalele alcaline au valoarea minimă a energiei de ionizare.
Într-o perioadă, energia de ionizare variază nemonoton. Inițial, scade la trecerea de la elementele s la primele elemente p. Apoi, în elementele p ulterioare, crește.
În cadrul unui grup, cu creșterea numărului ordinal al elementului, energia de ionizare scade, ceea ce se datorează creșterii distanței dintre nivelul exterior și nucleu.
Afinitatea electronică este energia (notată cu E) care este eliberată atunci când un electron este atașat la un atom. Când un atom acceptă un electron, acesta devine un ion încărcat negativ. Afinitatea electronilor într-o perioadă crește, în timp ce într-un grup, de regulă, scade.
Halogenii au cea mai mare afinitate electronică. Prin atașarea electronului lipsă pentru a completa învelișul, aceștia dobândesc configurația completă a unui atom de gaz nobil.
Electronegativitatea este suma energiei de ionizare și a afinității electronice
Electronegativitatea crește cu o perioadă și scade cu un subgrup.
Atomii și ionii nu au limite strict definite din cauza naturii ondulatorii a electronului. Prin urmare, razele atomilor și ionilor sunt determinate condiționat.
Cea mai mare creștere a razei atomilor se observă în elementele cu perioade mici, în care este umplut doar nivelul de energie exterior, ceea ce este tipic pentru elementele s și p. Pentru elementele d și f, se observă o creștere mai lină a razei cu creșterea sarcinii nucleare.
În cadrul unui subgrup, raza atomică crește pe măsură ce crește numărul de niveluri de energie.
Structura învelișurilor de electroni ale atomilor elementelor primelor patru perioade: $s-$, $p-$ și $d-$elemente. Configurația electronică a atomului. Stările fundamentale și excitate ale atomilor
Conceptul de atom a apărut în lumea antică pentru a desemna particulele de materie. În greacă, atom înseamnă „indivizibil”.
Electronii
Fizicianul irlandez Stoney, pe baza unor experimente, a ajuns la concluzia că electricitatea este transportată de cele mai mici particule care există în atomii tuturor elementelor chimice. În 1891$, Stoney a propus să numească aceste particule electroni, care în greacă înseamnă „chihlimbar”.
La câțiva ani după ce electronul și-a primit numele, fizicianul englez Joseph Thomson și fizicianul francez Jean Perrin au demonstrat că electronii poartă o sarcină negativă. Aceasta este cea mai mică sarcină negativă, care în chimie este luată ca unitate $(–1)$. Thomson a reușit chiar să determine viteza electronului (este egală cu viteza luminii - $300.000$ km/s) și masa electronului (este de $1836$ ori mai mică decât masa atomului de hidrogen).
Thomson și Perrin au conectat polii unei surse de curent cu două plăci metalice - un catod și un anod, lipite într-un tub de sticlă, din care aerul a fost evacuat. Când s-a aplicat o tensiune de aproximativ 10 mii de volți plăcilor electrodului, o descărcare luminoasă a fulgerat în tub, iar particulele au zburat de la catod (polul negativ) la anod (polul pozitiv), pe care oamenii de știință l-au numit prima dată. raze catodice, și apoi a aflat că era un flux de electroni. Electronii, lovind substanțe speciale aplicate, de exemplu, pe un ecran de televizor, provoacă o strălucire.
S-a făcut concluzia: electronii scapă din atomii materialului din care este făcut catodul.
Electronii liberi sau fluxul lor pot fi obținuți și în alte moduri, de exemplu, prin încălzirea unui fir metalic sau prin căderea luminii asupra metalelor formate din elemente din subgrupul principal al grupei I a tabelului periodic (de exemplu, cesiu).
Starea electronilor într-un atom
Starea unui electron într-un atom este înțeleasă ca un set de informații despre energie electron specific în spaţiuîn care se află. Știm deja că un electron dintr-un atom nu are o traiectorie de mișcare, adică. pot vorbi doar despre probabilități găsindu-l în spaţiul din jurul nucleului. Poate fi situat în orice parte a acestui spațiu care înconjoară nucleul, iar totalitatea diferitelor sale poziții este considerată ca un nor de electroni cu o anumită densitate de sarcină negativă. Figurat, acest lucru poate fi imaginat după cum urmează: dacă ar fi posibil să se fotografieze poziția unui electron într-un atom în sutimi sau milionatimi de secundă, ca într-un finisaj foto, atunci electronul din astfel de fotografii ar fi reprezentat ca un punct. Suprapunerea a nenumărate astfel de fotografii ar avea ca rezultat o imagine a unui nor de electroni cu cea mai mare densitate acolo unde există majoritatea acestor puncte.
Figura prezintă o „tăiere” a unei astfel de densități de electroni într-un atom de hidrogen care trece prin nucleu, iar o sferă este delimitată de o linie întreruptă, în interiorul căreia probabilitatea de a găsi un electron este de $90%$. Conturul cel mai apropiat de nucleu acoperă regiunea spațiului în care probabilitatea de a găsi un electron este $10%$, probabilitatea de a găsi un electron în interiorul celui de-al doilea contur din nucleu este $20%$, în interiorul celui de-al treilea - $≈30 %$ etc. Există o oarecare incertitudine în starea electronului. Pentru a caracteriza această stare specială, fizicianul german W. Heisenberg a introdus conceptul de principiul incertitudinii, adică a arătat că este imposibil să se determine simultan și exact energia și locația electronului. Cu cât energia unui electron este determinată mai precis, cu atât poziția sa este mai incertă și invers, după ce s-a determinat poziția, este imposibil să se determine energia electronului. Regiunea cu probabilitate de detectare a electronilor nu are granițe clare. Cu toate acestea, este posibil să se evidențieze spațiul în care probabilitatea de a găsi un electron este maximă.
Spațiul din jurul nucleului atomic, în care electronul este cel mai probabil să se găsească, se numește orbital.

Conține aproximativ 90%$ din norul de electroni, ceea ce înseamnă că aproximativ 90%$ din timpul în care electronul se află în această parte a spațiului. După formă, se disting $4$ dintre tipurile de orbitali cunoscute în prezent, care sunt notați cu literele latine $s, p, d$ și $f$. O reprezentare grafică a unor forme de orbitali electronici este prezentată în figură.

Cea mai importantă caracteristică a mișcării unui electron pe o anumită orbită este energia conexiunii acestuia cu nucleul. Electronii cu valori energetice similare formează un singur stratul electronic, sau nivel de energie. Nivelurile de energie sunt numerotate începând de la nucleu: $1, 2, 3, 4, 5, 6$ și $7$.
Un număr întreg $n$ care indică numărul nivelului de energie se numește număr cuantic principal.
Caracterizează energia electronilor care ocupă un anumit nivel de energie. Electronii primului nivel energetic, cel mai apropiat de nucleu, au cea mai mică energie. În comparație cu electronii de la primul nivel, electronii de la nivelul următor sunt caracterizați de o cantitate mare de energie. În consecință, electronii de la nivelul exterior sunt cei mai puțin puternic legați de nucleul atomului.
Numărul de niveluri de energie (straturi electronice) dintr-un atom este egal cu numărul perioadei din sistemul lui D. I. Mendeleev, căruia îi aparține elementul chimic: atomii elementelor primei perioade au un singur nivel energetic; a doua perioadă - două; a șaptea perioadă - șapte.
Cel mai mare număr de electroni din nivelul de energie este determinat de formula:
unde $N$ este numărul maxim de electroni; $n$ este numărul de nivel sau numărul cuantic principal. În consecință: primul nivel de energie cel mai apropiat de nucleu nu poate conține mai mult de doi electroni; pe al doilea - nu mai mult de $8$; pe a treia - nu mai mult de $18$; pe a patra - nu mai mult de $32$. Și cum sunt, la rândul lor, aranjate nivelurile de energie (straturile electronice)?
Începând de la al doilea nivel energetic $(n = 2)$, fiecare dintre niveluri este subdivizat în subniveluri (substraturi), ușor diferite unele de altele prin energia de legare cu nucleul.
Numărul de subniveluri este egal cu valoarea numărului cuantic principal: primul nivel de energie are un subnivel; al doilea - doi; a treia - trei; al patrulea este patru. Subnivelurile, la rândul lor, sunt formate din orbitali.
Fiecare valoare de $n$ corespunde numărului de orbitali egal cu $n^2$. Conform datelor prezentate în tabel, este posibilă urmărirea relației dintre numărul cuantic principal $n$ și numărul de subniveluri, tipul și numărul de orbitali și numărul maxim de electroni pe subnivel și nivel.
Numărul cuantic principal, tipurile și numărul de orbitali, numărul maxim de electroni la subniveluri și niveluri.
| Nivel de energie $(n)$ | Numărul de subniveluri egal cu $n$ | Tip orbital | Numărul de orbitali | Numărul maxim de electroni | ||
| la subnivel | în nivel egal cu $n^2$ | la subnivel | la un nivel egal cu $n^2$ | |||
| $K(n=1)$ | $1$ | 1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | 2 s$ | $1$ | $4$ | $2$ | $8$ |
| 2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | 3 s$ | $1$ | $9$ | $2$ | $18$ |
| 3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | 4 s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| 4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ | ||||
Se obișnuiește să se desemneze subnivelurile cu litere latine, precum și forma orbitalilor din care sunt formați: $s, p, d, f$. Asa de:
- $s$-subnivel - primul subnivel al fiecărui nivel energetic cel mai apropiat de nucleul atomic, este format dintr-un $s$-orbital;
- $p$-subnivel - al doilea subnivel al fiecăruia, cu excepția primului, nivelul energetic, este format din trei $p$-orbitali;
- $d$-subnivel - al treilea subnivel al fiecăruia, începând cu al treilea nivel energetic, este format din cinci $d$-orbitali;
- Subnivelul $f$ al fiecăruia, începând de la al patrulea nivel de energie, este format din șapte $f$-orbitali.
nucleul atomic
Dar nu numai electronii fac parte din atomi. Fizicianul Henri Becquerel a descoperit că un mineral natural care conține sare de uraniu emite și radiații necunoscute, luminând filme fotografice care sunt închise de lumină. Acest fenomen a fost numit radioactivitate.
Există trei tipuri de raze radioactive:
- $α$-razele, care constau din $α$-particule având o sarcină de $2$ ori mai mare decât sarcina unui electron, dar cu semn pozitiv, și o masă de $4$ ori mai mare decât masa unui atom de hidrogen;
- Razele $β$ sunt un flux de electroni;
- Razele $γ$ sunt unde electromagnetice cu o masă neglijabilă care nu poartă o sarcină electrică.
În consecință, atomul are o structură complexă - constă dintr-un nucleu încărcat pozitiv și electroni.
Cum este aranjat atomul?
În 1910, la Cambridge, lângă Londra, Ernest Rutherford împreună cu studenții și colegii săi au studiat împrăștierea particulelor $α$ care treceau prin folie subțire de aur și cădeau pe un ecran. Particulele alfa au deviat de obicei de la direcția inițială doar cu un grad, confirmând, se pare, uniformitatea și uniformitatea proprietăților atomilor de aur. Și deodată, cercetătorii au observat că unele particule $α$ și-au schimbat brusc direcția traseului, ca și cum ar întâlni un fel de obstacol.
Prin plasarea ecranului în fața foliei, Rutherford a reușit să detecteze chiar și acele cazuri rare când particulele $α$, reflectate de atomii de aur, zburau în direcția opusă.
Calculele au arătat că fenomenele observate ar putea apărea dacă întreaga masă a atomului și toată sarcina lui pozitivă ar fi concentrate într-un nucleu central minuscul. Raza nucleului, după cum s-a dovedit, este de 100.000 de ori mai mică decât raza întregului atom, acea zonă în care există electroni care au o sarcină negativă. Dacă aplicăm o comparație figurativă, atunci întregul volum al atomului poate fi asemănat cu stadionul Luzhniki, iar nucleul poate fi asemănat cu o minge de fotbal situată în centrul terenului.
Un atom al oricărui element chimic este comparabil cu un sistem solar minuscul. Prin urmare, un astfel de model al atomului, propus de Rutherford, se numește planetar.
Protoni și neutroni
Se pare că micul nucleu atomic, în care este concentrată întreaga masă a atomului, este format din particule de două tipuri - protoni și neutroni.
Protoni au o sarcină egală cu sarcina electronilor, dar opus în semnul $(+1)$, și o masă egală cu masa unui atom de hidrogen (este acceptată în chimie ca unitate). Protonii sunt notați cu $↙(1)↖(1)p$ (sau $р+$). Neutroni nu poartă o sarcină, sunt neutre și au masa egală cu masa unui proton, adică. $1$. Neutronii sunt notați cu $↙(0)↖(1)n$ (sau $n^0$).
Protonii și neutronii sunt numiți în mod colectiv nucleonii(din lat. nucleu- nucleu).
Se numește suma numărului de protoni și neutroni dintr-un atom numar de masa. De exemplu, numărul de masă al unui atom de aluminiu:

Deoarece masa electronului, care este neglijabilă, poate fi neglijată, este evident că întreaga masă a atomului este concentrată în nucleu. Electronii se notează astfel: $e↖(-)$.
Deoarece atomul este neutru din punct de vedere electric, este, de asemenea, evident că că numărul de protoni și electroni dintr-un atom este același. Este egal cu numărul atomic al elementului chimic atribuite acestuia în Tabelul Periodic. De exemplu, nucleul unui atom de fier conține $26$ protoni, iar $26$ electroni se învârt în jurul nucleului. Și cum se determină numărul de neutroni?
După cum știți, masa unui atom este suma masei protonilor și neutronilor. Cunoscând numărul ordinal al elementului $(Z)$, i.e. numărul de protoni și numărul de masă $(A)$, egal cu suma numerelor de protoni și neutroni, puteți găsi numărul de neutroni $(N)$ folosind formula:
De exemplu, numărul de neutroni dintr-un atom de fier este:
$56 – 26 = 30$.
Tabelul prezintă principalele caracteristici ale particulelor elementare.
Caracteristicile de bază ale particulelor elementare.
izotopi
Varietățile de atomi ai aceluiași element care au aceeași sarcină nucleară, dar numere de masă diferite sunt numite izotopi.
Cuvânt izotop constă din două cuvinte grecești: isos- la fel și topos- loc, înseamnă „ocupând un loc” (celulă) în sistemul periodic de elemente.
Elementele chimice găsite în natură sunt un amestec de izotopi. Astfel, carbonul are trei izotopi cu masa de $12, 13, 14$; oxigen - trei izotopi cu o masă de $16, 17, 18$ etc.
De obicei dată în sistemul periodic, masa atomică relativă a unui element chimic este valoarea medie a maselor atomice ale unui amestec natural de izotopi ai unui element dat, ținând cont de abundența lor relativă în natură, prin urmare, valorile masele atomice sunt destul de des fracționate. De exemplu, atomii naturali de clor sunt un amestec de doi izotopi - $35$ (există $75%$ în natură) și $37$ (există $25%$); prin urmare, masa atomică relativă a clorului este de $35,5$. Izotopii clorului se scriu după cum urmează:
$↖(35)↙(17)(Cl)$ și $↖(37)↙(17)(Cl)$
Proprietățile chimice ale izotopilor de clor sunt exact aceleași cu izotopii majorității elementelor chimice, cum ar fi potasiul, argonul:
$↖(39)↙(19)(K)$ și $↖(40)↙(19)(K)$, $↖(39)↙(18)(Ar)$ și $↖(40)↙(18 )(Ar)$
Cu toate acestea, izotopii de hidrogen diferă foarte mult în proprietăți datorită creșterii dramatice a masei lor atomice relative; li s-au dat chiar denumiri individuale și semne chimice: protium - $↖(1)↙(1)(H)$; deuteriu - $↖(2)↙(1)(H)$, sau $↖(2)↙(1)(D)$; tritiu - $↖(3)↙(1)(H)$ sau $↖(3)↙(1)(T)$.

Acum este posibil să se dea o definiție modernă, mai riguroasă și științifică a unui element chimic.
Un element chimic este o colecție de atomi cu aceeași sarcină nucleară.
Structura învelișurilor de electroni ale atomilor elementelor primelor patru perioade
Luați în considerare maparea configurațiilor electronice ale atomilor elementelor după perioadele sistemului lui D. I. Mendeleev.
Elemente ale primei perioade.
Schemele structurii electronice a atomilor arată distribuția electronilor peste straturile electronice (nivelurile de energie).

Formulele electronice ale atomilor arată distribuția electronilor pe niveluri și subniveluri de energie.
Formulele electronice grafice ale atomilor arată distribuția electronilor nu numai în niveluri și subniveluri, ci și în orbiti.

Într-un atom de heliu, primul strat de electroni este complet - are $2$ electroni.
Hidrogenul și heliul sunt $s$-elemente, acești atomi au $s$-orbitali umpluți cu electroni.
Elemente ale perioadei a doua.
Pentru toate elementele din a doua perioadă, primul strat de electroni este umplut, iar electronii umplu orbitalii $s-$ și $p$ ai celui de-al doilea strat de electroni în conformitate cu principiul energiei minime (întâi $s$, apoi $ p$) si regulile lui Pauli si Hund.
În atomul de neon, al doilea strat de electroni este complet - are $8$ electroni.
Elemente ale perioadei a treia.
Pentru atomii elementelor din a treia perioadă, primul și al doilea strat de electroni sunt completați, astfel încât al treilea strat de electroni este umplut, în care electronii pot ocupa subnivelurile 3s, 3p și 3d.
Structura învelișurilor electronice ale atomilor elementelor din perioada a treia.
Un orbital $3,5$-electron este completat la atomul de magneziu. $Na$ și $Mg$ sunt elemente $s$.
Pentru aluminiu și elementele ulterioare, subnivelul $3d$ este umplut cu electroni.
| $↙(18)(Ar)$ Argon |  |
$1s^2(2)s^2(2)p^6(3)s^2(3)p^6$ |  |
Într-un atom de argon, stratul exterior (al treilea strat de electroni) are $8$ electroni. Pe măsură ce stratul exterior este completat, dar în total, în al treilea strat de electroni, după cum știți deja, pot exista 18 electroni, ceea ce înseamnă că elementele din a treia perioadă au $3d$-orbitali rămase neumplute.
Toate elementele de la $Al$ la $Ar$ - $p$ -elemente.
$s-$ și $r$ -elemente formă principalele subgrupuriîn sistemul periodic.
Elemente ale perioadei a patra.
Atomii de potasiu și calciu au un al patrulea strat de electroni, subnivelul $4s$ este umplut, deoarece are mai puțină energie decât subnivelul $3d$. Pentru a simplifica formulele electronice grafice ale atomilor elementelor din perioada a patra:
- notăm condiționat formula electronică grafică a argonului astfel: $Ar$;
- nu vom descrie subnivelurile care nu sunt umplute pentru acești atomi.
$K, Ca$ - $s$ -elemente, incluse în principalele subgrupe. Pentru atomii de la $Sc$ la $Zn$, subnivelul 3d este umplut cu electroni. Acestea sunt elemente de $3d$. Sunt incluși în subgrupuri laterale, stratul lor de electroni pre-extern este umplut, se face referire la ei elemente de tranziție.
Acordați atenție structurii învelișurilor de electroni ale atomilor de crom și cupru. În ele, un electron „cade” de la subnivelul $4s-$ la subnivelul $3d$, ceea ce se explică prin stabilitatea energetică mai mare a configurațiilor electronice rezultate $3d^5$ și $3d^(10)$:
$↙(24)(Cr)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(4) 4s^(2)…$ 
$↙(29)(Cu)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(9)4s^(2)…$ 
| Simbol element, număr de serie, nume | Diagrama structurii electronice | Formula electronica | Formula electronică grafică |
| $↙(19)(K)$ Potasiu |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1$ | |
| $↙(20)(C)$ Calciu |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2$ | |
| $↙(21)(Sc)$ Scandiu |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^1$ sau $1s^2(2)s^2(2)p ^6(3)p^6(3)d^1(4)s^1$ |  |
| $↙(22)(Ti)$ Titan |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^2$ sau $1s^2(2)s^2(2)p ^6(3)p^6(3)d^2(4)s^2$ |  |
| $↙(23)(V)$ Vanadiu |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^3$ sau $1s^2(2)s^2(2)p ^6(3)p^6(3)d^3(4)s^2$ |  |
| $↙(24)(Cr)$ Chrome |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^5$ sau $1s^2(2)s^2(2)p ^6(3)p^6(3)d^5(4)s^1$ |  |
| $↙(29)(Сu)$ Crom |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^(10)$ sau $1s^2(2)s^2(2) )p^6(3)p^6(3)d^(10)(4)s^1$ |  |
| $↙(30)(Zn)$ Zinc |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)$ sau $1s^2(2)s^2(2) )p^6(3)p^6(3)d^(10)(4)s^2$ |  |
| $↙(31)(Ga)$ Galiu |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^(1)$ sau $1s^2(2) s^2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^(1)$ |  |
| $↙(36)(Kr)$ Krypton |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^6$ sau $1s^2(2)s^ 2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^6$ |  |
În atomul de zinc, al treilea strat de electroni este complet - toate subnivelurile $3s, 3p$ și $3d$ sunt umplute în el, în total există $18$ de electroni pe ele.
În elementele care urmează zincului, al patrulea strat de electroni, subnivelul $4p$, continuă să fie umplut. Elemente de la $Ga$ la $Kr$ - $r$ -elemente.
Stratul exterior (al patrulea) al unui atom de cripton este completat, are $8$ de electroni. Dar doar în al patrulea strat de electroni, după cum știți, pot exista 32$ de electroni; atomul de cripton are încă subniveluri $4d-$ și $4f$ necompletate.
Elementele perioadei a cincea umple subnivelurile în următoarea ordine: $5s → 4d → 5р$. Și există și excepții legate de „eșecul” electronilor, pentru $↙(41)Nb$, $↙(42)Mo$, $↙(44)Ru$, $↙(45)Rh$, $↙( 46) Pd$, $↙(47)Ag$. $f$ apar în perioadele a șasea și a șaptea -elemente, adică elemente ale căror subniveluri $4f-$ și, respectiv, $5f$ ale celui de-al treilea strat electronic exterior sunt umplute.
$4f$ -elemente numit lantanide.
$5f$ -elemente numit actinide.
Ordinea de umplere a subnivelurilor electronice în atomii elementelor din perioada a șasea: $↙(55)Cs$ și $↙(56)Ba$ - $6s$-elemente; $↙(57)La ... 6s^(2)5d^(1)$ - $5d$-element; $↙(58)Ce$ – $↙(71)Lu - 4f$-elemente; $↙(72)Hf$ – $↙(80)Hg - 5d$-elemente; $↙(81)Т1$ – $↙(86)Rn - 6d$-elemente. Dar și aici există elemente în care ordinea de umplere a orbitalilor de electroni este încălcată, ceea ce, de exemplu, este asociat cu o mai mare stabilitate energetică a subnivelurilor $f$ pline la jumătate și complet, adică. $nf^7$ și $nf^(14)$.
În funcție de subnivelul atomului umplut cu electroni, toate elementele, așa cum ați înțeles deja, sunt împărțite în patru familii electronice sau blocuri:
- $s$ -elemente; subnivelul $s$ al nivelului exterior al atomului este umplut cu electroni; $s$-elementele includ hidrogenul, heliul si elementele principalelor subgrupe ale grupelor I si II;
- $r$ -elemente; subnivelul $p$ al nivelului exterior al atomului este umplut cu electroni; $p$-elementele includ elemente ale principalelor subgrupe ale grupelor III–VIII;
- $d$ -elemente; subnivelul $d$ al nivelului preextern al atomului este umplut cu electroni; $d$-elementele includ elemente ale subgrupurilor secundare ale grupelor I–VIII, i.e. elemente de decenii intercalate de perioade mari situate între $s-$ şi $p-$elemente. Se mai numesc si ei elemente de tranziție;
- $f$ -elemente;$f-$subnivelul celui de-al treilea nivel al atomului din exterior este umplut cu electroni; acestea includ lantanide și actinide.

Configurația electronică a atomului. Stările fundamentale și excitate ale atomilor
Fizicianul elvețian W. Pauli în $1925$ a stabilit că Un atom poate avea cel mult doi electroni într-un orbital. având rotiri opuse (antiparalele) (tradus din engleză ca ax), i.e. posedă astfel de proprietăți care pot fi imaginate condiționat ca rotația unui electron în jurul axei sale imaginare în sensul acelor de ceasornic sau în sens invers acelor de ceasornic. Acest principiu se numește principiul Pauli.
Dacă există un electron într-un orbital, atunci se numește nepereche, dacă doi, atunci asta electroni perechi, adică electroni cu spini opuși.
Figura prezintă o diagramă a împărțirii nivelurilor de energie în subniveluri.

$s-$ Orbitală, după cum știți deja, are o formă sferică. Electronul atomului de hidrogen $(n = 1)$ este situat pe acest orbital și este nepereche. Potrivit acestuia a lui formula electronica, sau configuratie electronica, este scris astfel: $1s^1$. În formulele electronice, numărul nivelului de energie este indicat de numărul din fața literei $ (1 ...) $, subnivelul (tipul orbital) este notat cu litera latină, iar numărul care este scris la dreapta literei (ca exponent) arată numărul de electroni din subnivel.
Pentru un atom de heliu He, care are doi electroni perechi în același $s-$orbital, această formulă este: $1s^2$. Învelișul de electroni a atomului de heliu este complet și foarte stabil. Heliul este un gaz nobil. Al doilea nivel de energie $(n = 2)$ are patru orbiti, unul $s$ și trei $p$. Electronii $s$-orbitali de nivel al doilea (orbitalii $2s$) au o energie mai mare, deoarece sunt la o distanță mai mare de nucleu decât electronii orbitalului $1s$ $(n = 2)$. În general, pentru fiecare valoare de $n$ există câte un $s-$orbital, dar cu o cantitate corespunzătoare de energie electronică pe el și, prin urmare, cu un diametru corespunzător, crescând cu valoarea de $n$.$s- $Creșterile orbitale, după cum știți deja, au o formă sferică. Electronul atomului de hidrogen $(n = 1)$ este situat pe acest orbital și este nepereche. Prin urmare, formula sa electronică, sau configurația electronică, este scrisă după cum urmează: $1s^1$. În formulele electronice, numărul nivelului de energie este indicat de numărul din fața literei $ (1 ...) $, subnivelul (tipul orbital) este notat cu litera latină, iar numărul care este scris la dreapta literei (ca exponent) arată numărul de electroni din subnivel.
Pentru un atom de heliu $He$, care are doi electroni perechi în același $s-$orbital, această formulă este: $1s^2$. Învelișul de electroni a atomului de heliu este complet și foarte stabil. Heliul este un gaz nobil. Al doilea nivel de energie $(n = 2)$ are patru orbiti, unul $s$ și trei $p$. Electronii $s-$orbitalii de al doilea nivel ($2s$-orbitalii) au o energie mai mare, deoarece sunt la o distanță mai mare de nucleu decât electronii orbitalului $1s$ $(n = 2)$. În general, pentru fiecare valoare de $n$ există câte un $s-$orbital, dar cu o cantitate corespunzătoare de energie electronică pe el și, prin urmare, cu un diametru corespunzător, crescând pe măsură ce valoarea lui $n$ crește. 
$r-$ Orbitală Are forma unei gantere, sau volumul opt. Toți cei trei $p$-orbitali sunt localizați în atom reciproc perpendicular de-a lungul coordonatelor spațiale trasate prin nucleul atomului. Trebuie subliniat din nou că fiecare nivel de energie (stratul electronic), începând de la $n= 2$, are trei $p$-orbitali. Pe masura ce valoarea lui $n$ creste, electronii ocupa $p$-orbitali situati la distante mari de nucleu si indreptati de-a lungul axelor $x, y, z$.
Pentru elementele din a doua perioadă $(n = 2)$, se umple mai întâi un $s$-orbital, apoi trei $p$-orbitali; formula electronică $Li: 1s^(2)2s^(1)$. Electronul $2s^1$ este mai puțin legat de nucleul atomic, așa că un atom de litiu îl poate da cu ușurință (după cum probabil vă amintiți, acest proces se numește oxidare), transformându-se într-un ion de litiu $Li^+$.
În atomul de beriliu Be, al patrulea electron este de asemenea plasat în orbital $2s$: $1s^(2)2s^(2)$. Cei doi electroni exteriori ai atomului de beriliu se desprind usor - $B^0$ este oxidat in cationul $Be^(2+)$.
Al cincilea electron al atomului de bor ocupă orbitalul $2p$: $1s^(2)2s^(2)2p^(1)$. În continuare, se umple orbitalii $2p$ ai atomilor $C, N, O, F$, care se termină cu gazul nobil de neon: $1s^(2)2s^(2)2p^(6)$.
Pentru elementele celei de-a treia perioade, sunt completați orbitalii $3s-$ și, respectiv, $3p$. Cinci $d$-orbitali de al treilea nivel rămân liberi:
$↙(11)Na 1s^(2)2s^(2)2p^(6)3s^(1)$,
$↙(17)Cl 1s^(2)2s^(2)2p^(6)3s^(2)3p^(5)$,
$↙(18)Ar 1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)$.
Uneori, în diagramele care înfățișează distribuția electronilor în atomi, este indicat doar numărul de electroni la fiecare nivel de energie, adică. scrieți formule electronice abreviate ale atomilor elementelor chimice, în contrast cu formulele electronice complete de mai sus, de exemplu:
$↙(11)Na 2, 8, 1;$ $↙(17)Cl 2, 8, 7;$ $↙(18)Ar 2, 8, 8$.
Pentru elementele de perioade mari (a patra și a cincea), primii doi electroni ocupă respectiv $4s-$ și $5s$-orbitali: $↙(19)K 2, 8, 8, 1;$ $↙(38)Sr 2 , 8, 18, 8, 2$. Pornind de la al treilea element al fiecărei perioade mari, următorii zece electroni vor merge la orbitalii anteriori $3d-$, respectiv $4d-$(pentru elementele subgrupurilor secundare): $↙(23)V 2, 8, 11 , 2;$ $↙( 26)Fr 2, 8, 14, 2;$ $↙(40)Zr 2, 8, 18, 10, 2;$ $↙(43)Tc 2, 8, 18, 13, 2$. De regulă, atunci când subnivelul $d$ anterior este completat, subnivelul exterior (respectiv $4p-$ și $5p-$) $p-$ va începe să fie completat: $↙(33)As 2, 8, 18, 5;$ $ ↙(52)Te 2, 8, 18, 18, 6$.
Pentru elemente de perioade mari - a șasea și a șaptea incompletă - nivelurile și subnivelurile electronice sunt umplute cu electroni, de regulă, după cum urmează: primii doi electroni intră în $s-$subnivelul exterior: $↙(56)Ba 2, 8 , 18, 18, 8, 2;$ $↙(87)Fr 2, 8, 18, 32, 18, 8, 1$; următorul electron (pentru $La$ și $Ca$) la subnivelul $d$ anterior: $↙(57)La 2, 8, 18, 18, 9, 2$ și $↙(89)Ac 2, 8, 18, 32, 18, 9, 2$.
Apoi, următorii electroni $14$ vor intra în al treilea nivel de energie din exterior, orbitalii $4f$ și $5f$ ai lantonidelor și, respectiv, actinidelor: $↙(64)Gd 2, 8, 18, 25, 9, 2 ;$ $↙(92 )U 2, 8, 18, 32, 21, 9, 2$.
Apoi, al doilea nivel de energie din exterior ($d$-subnivel) va începe să se acumuleze din nou pentru elementele subgrupurilor laterale: $↙(73)Ta 2, 8, 18, 32, 11, 2;$ $↙( 104) Rf 2, 8, 18 , 32, 32, 10, 2$. Și, în sfârșit, numai după ce subnivelul $d$ este complet umplut cu zece electroni, subnivelul $p$ va fi umplut din nou: $↙(86)Rn 2, 8, 18, 32, 18, 8$.
Foarte des, structura învelișurilor de electroni ale atomilor este descrisă folosind energie sau celule cuantice - ei notează așa-numitele formule electronice grafice. Pentru această înregistrare se folosește următoarea notație: fiecare celulă cuantică este notată cu o celulă care corespunde unui orbital; fiecare electron este indicat printr-o săgeată corespunzătoare direcției spinului. Când scrieți o formulă electronică grafică, trebuie reținute două reguli: principiul Pauli, conform căreia o celulă (orbital) nu poate avea mai mult de doi electroni, dar cu spin antiparalel, și F. regula lui Hund, conform căreia electronii ocupă celulele libere mai întâi unul câte unul și, în același timp, au aceeași valoare de spin și abia apoi pereche, dar spinii, conform principiului Pauli, vor fi deja direcționați opus.
Sarcina 1. Scrieți configurațiile electronice ale următoarelor elemente: N, Si, F e, Kr , Te, W .
Soluţie. Energia orbitalilor atomici crește în următoarea ordine:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d .
Pe fiecare shell s (un orbital) nu pot exista mai mult de doi electroni, pe shell-p (trei orbitali) - nu mai mult de șase, pe d-shell (cinci orbitali) - nu mai mult de 10 și pe f-shell (șapte orbitali) - nu mai mult de 14.
În starea fundamentală a unui atom, electronii ocupă orbitalii cu cea mai mică energie. Numărul de electroni este egal cu sarcina nucleului (atomul în ansamblu este neutru) și cu numărul atomic al elementului. De exemplu, un atom de azot are 7 electroni, dintre care doi sunt în orbitali 1s, doi sunt în orbitali 2s, iar restul de trei electroni sunt în orbitali 2p. Configurația electronică a atomului de azot:
7 N : 1s 2 2s 2 2p 3 . Configurații electronice ale altor elemente:
14 Si: 1s 2 2s 2 2p 6 3s 2 3p 2 ,
26 F e : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 ,
36 K r: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 ,
52 Aceia : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 4 ,
74 Aceia : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 .
Sarcina 2. Care gaz inert și ioni din care elemente au aceeași configurație electronică ca și particulele rezultate din îndepărtarea tuturor electronilor de valență din atomul de calciu?
Soluţie. Învelișul de electroni a atomului de calciu are structura 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . Când doi electroni de valență sunt îndepărtați, se formează un ion de Ca 2+ cu configurația 1s 2 2s 2 2p 6 3s 2 3p 6 . Un atom are aceeași configurație electronică Arşi ionii S2-, CI-, K+, Sc3+ etc.
Sarcina 3. Pot fi electronii ionului Al 3+ în următorii orbitali: a) 2p; b) 1r; c) 3d?
Soluţie. Configurația electronică a atomului de aluminiu: 1s 2 2s 2 2p 6 3s 2 3p 1 . Ionul Al 3+ se formează la îndepărtarea a trei electroni de valență dintr-un atom de aluminiu și are configurația electronică 1s 2 2s 2 2p 6 .
a) electronii sunt deja în orbital 2p;
b) în conformitate cu restricțiile impuse numărului cuantic l (l = 0, 1, ... n -1), la n = 1 este posibilă doar valoarea l = 0, prin urmare, orbitalul 1p nu există ;
c) electronii pot fi în orbital 3d dacă ionul este în stare excitată.
Sarcina 4. Scrieți configurația electronică a atomului de neon în prima stare excitată.
Soluţie. Configurația electronică a atomului de neon în starea fundamentală este 1s 2 2s 2 2p 6 . Prima stare excitată este obținută prin tranziția unui electron de la cel mai înalt orbital ocupat (2p) la cel mai jos orbital liber (3s). Configurația electronică a atomului de neon în prima stare excitată este 1s 2 2s 2 2p 5 3s 1 .
Sarcina 5. Care este compoziția nucleelor izotopilor 12 C și 13 C, 14 N și 15 N?
Soluţie. Numărul de protoni din nucleu este egal cu numărul atomic al elementului și este același pentru toți izotopii acestui element. Numărul de neutroni este egal cu numărul de masă (indicat în stânga sus a numărului elementului) minus numărul de protoni. Diferiți izotopi ai aceluiași element au un număr diferit de neutroni.
Compoziția acestor nuclee:
12 C: 6p + 6n; 13C: 6p + 7n; 14 N: 7p + 7n; 15N: 7p + 8n.
Configuratie electronica- formula pentru aranjarea electronilor în diferite învelișuri de electroni ale unui atom al unui element chimic sau moleculă.
Configurația electronică este de obicei scrisă pentru atomi în starea lor fundamentală. Pentru a determina configurația electronică a unui element, există următoarele reguli:
- Principiul de umplere. Conform principiului umplerii, electronii în starea fundamentală a unui atom umplu orbitele într-o succesiune de niveluri de energie orbitale crescânde. Cei mai mici orbitali de energie sunt întotdeauna umpluți primii.
- Principiul excluderii Pauli. Conform acestui principiu, nu pot fi mai mult de doi electroni în orice orbital și numai dacă au spini opuși (numere de spin inegale).
- regula lui Hund. Conform acestei reguli, umplerea orbitalilor unui subshell începe cu electroni unici cu spini paraleli (același semn) și numai după ce electronii unici au ocupat toți orbitalii, umplerea finală a orbitalilor cu perechi de electroni cu spini opuși. pot aparea.
Din punctul de vedere al mecanicii cuantice, configurația electronică este o listă completă de funcții de undă cu un electron, din care, cu un grad suficient de precizie, este posibil să se compună funcția de undă completă a unui atom (în aproximație a un domeniu auto-consistent).
În general, atomul, ca sistem compozit, poate fi descris pe deplin doar prin funcția completă de undă. Cu toate acestea, o astfel de descriere este practic imposibilă pentru atomii mai complecși decât atomul de hidrogen, cel mai simplu dintre toți atomii elementelor chimice. O descriere aproximativă convenabilă este metoda câmpului auto-consistent. Această metodă introduce conceptul de funcție de undă a fiecărui electron. Funcția de undă a întregului sistem este scrisă ca un produs simetrizat corespunzător al funcțiilor de undă cu un electron. Când se calculează funcția de undă a fiecărui electron, câmpul tuturor celorlalți electroni este luat în considerare ca potențial extern, care, la rândul său, depinde de funcțiile de undă ale acestor ceilalți electroni.
Ca urmare a aplicării metodei câmpului autoconsistent se obține un sistem complex de ecuații integro-diferențiale neliniare, care este încă greu de rezolvat. Cu toate acestea, ecuațiile de câmp auto-consistente au simetria de rotație a problemei inițiale (adică sunt simetrice sferic). Acest lucru face posibilă clasificarea completă a funcțiilor de undă cu un electron care alcătuiesc funcția de undă completă a unui atom.
Pentru început, ca în orice potențial simetric central, funcția de undă într-un câmp auto-consistent poate fi caracterizată prin numărul cuantic al momentului unghiular total l (\displaystyle l)și numărul cuantic al proiecției momentului unghiular pe o anumită axă m (\displaystyle m). Funcții de undă cu valori diferite m (\displaystyle m) corespund aceluiași nivel de energie, adică sunt degenerate. De asemenea, un nivel de energie corespunde stărilor cu proiecții diferite ale spinului electronului pe orice axă. Total pentru un anumit nivel de energie 2 (2 l + 1) (\displaystyle 2(2l+1)) funcții de undă. În plus, pentru o valoare dată a momentului unghiular, nivelurile de energie pot fi renumerotate. Prin analogie cu atomul de hidrogen, se obișnuiește să se numere nivelurile de energie pentru un anumit l (\displaystyle l) incepand cu n = l + 1 (\displaystyle n=l+1). O listă completă a numerelor cuantice ale funcțiilor de undă cu un electron, din care poate fi compusă funcția de undă a unui atom, se numește configurație electronică. Deoarece totul este degenerat în număr cuantic m (\displaystyle m) iar pe spin, este suficient să indicați numărul total de electroni în starea cu datele n (\displaystyle n), l (\displaystyle l).
YouTube enciclopedic
-
1 / 5
Din motive istorice, în formula de configurare electronică, numărul cuantic l (\displaystyle l) scris cu litere latine. Statul cu este notat cu litera s (\displaystyle s), p (\displaystyle p): l = 1 (\displaystyle l=1), d (\displaystyle d): l = 2 (\displaystyle l=2), f (\displaystyle f): l = 3 (\displaystyle l=3), g (\displaystyle g): l = 4 (\displaystyle l=4)și așa mai departe alfabetic. În stânga numărului l (\displaystyle l) scrie un număr n (\displaystyle n), și deasupra numărului l (\displaystyle l) este numărul de electroni în starea datelor n (\displaystyle n)și l (\displaystyle l). De exemplu 2 s 2 (\displaystyle 2s^(2)) corespunde la doi electroni într-o stare cu n = 2 (\displaystyle n=2), l = 0 (\displaystyle l=0). Datorită confortului practic (vezi regula Klechkovsky), în formula completă pentru configurația electronică, termenii sunt scriși în ordinea crescătoare a numărului cuantic n (\displaystyle n), iar apoi numărul cuantic l (\displaystyle l), de exemplu 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3 (\displaystyle 1s^(2)2s^(2)2p^(6)3s^(2)3p^(3)). Deoarece o astfel de notație este oarecum redundantă, uneori formula se reduce la 1 s 2 2 s 2 p 6 3 s 2 p 3 (\displaystyle 1s^(2)2s^(2)p^(6)3s^(2)p^(3)), adică omiteți numărul n (\displaystyle n) unde se poate ghici din regula de ordonare a termenului.
Legea periodică și structura atomului
Toți cei implicați în structura atomului în oricare dintre studiile lor provin din instrumentele care le sunt furnizate de legea periodică, descoperită de chimistul D. I. Mendeleev; numai în înțelegerea acestei legi, fizicienii și matematicienii își folosesc „limbajul” pentru a interpreta dependențele arătate de el (deși se cunoaște un aforism destul de ironic al lui J. W. Gibbs pe acest subiect), dar, în același timp, izolați de chimiștii care studiază. materia, cu toată perfecțiunea, avantajele și universalitatea aparatului lor, nici fizicienii, nici matematicienii, desigur, nu își pot construi propriile cercetări.
Interacțiunea reprezentanților acestor discipline se observă și în dezvoltarea ulterioară a temei. Descoperirea periodicității secundare de către E. V. Biron (1915) a dat un alt aspect în înțelegerea problemelor legate de regularitățile structurii învelișurilor de electroni. S. A. Shukarev, elev al lui E. V. Biron și
Configurația electronică a unui atom este arată distribuția energiei lui ē. niveluri și subniveluri.
1s 1 ←număr ē cu forma dată de nor
↖ forma norului de electroni
nivel de energie
Formule electronice grafice (imagini ale structurii electronice a unui atom) -
arată distribuția energiei lui ē. niveluri, subniveluri și orbitali.
I punct:+1 N
Unde - ē, ↓ - ē cu spin antiparalel, orbital.
Când scrieți o formulă electronică grafică, trebuie să vă amintiți regula Pauli și regula lui Hund „Dacă există mai mulți orbitali liberi într-un subnivel, atunci ē sunt plasați fiecare pe un orbital separat și numai în absența orbitalilor liberi sunt combinați în perechi.”
(Lucrul cu formule electronice și grafice electronice).
De exemplu, H+11s1; El +2 1s 2 ; Li +3 1s 2 2s 1 ; Na +11 1s 2 2s 2 2p 6 3s 1 ; Ar +18 1s 2 2s 2 2p 6 3s 2 3p 6 ;
I punct: hidrogen și heliu – elemente s, orbitalul lor s este umplut cu electroni.
perioada a II-a: Li și Be sunt elemente-s
B, C, N, O, F, Ne - p-elemente
În funcție de subnivelul atomului umplut cu electroni, toate elementele sunt împărțite în 4 familii sau blocuri electronice:
1) s-elemente – au subnivelul ē-mi s al stratului exterior al atomului; acestea includ hidrogen, heliu și e-you gl.p / gr. Grupele I și II.
2) elemente p - ele umplu subnivelul mondial de electroni al nivelului exterior al atomului; acestea includ elemente de gl.p / gr. III - VIII grupe.
3) elemente d -în ele, subnivelul d al nivelului preextern al atomului este umplut cu electroni; acestea includ e-you poboch.p / gr. . Grupele I-VIII, adică el-you plug-in decenii de perioade mari, situate între elementele s- și p, sunt numite și elemente de tranziție.
4) elemente f- subnivelul f al celui de-al treilea nivel al atomului din exterior este umplut cu electroni; acestea includ lantanide (elemente 4f) și actinide (elemente 5f).
Atomii de cupru si crom au „eșec” ē de la 4s- la 3d-subnivel, care se explică prin stabilitatea energetică mai mare a configurațiilor electronice rezultate 3d 5 și 3d 10:
29 Cu 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
S-a dovedit experimental că stările atomilor în care orbitalii p-, d-, f sunt pe jumătate umpluți (p 3 , d 5 , f 7 ), complet (p 6 , d 10 , f 14 ) sau liberi , au stabilitate sporită. Așa se explică tranzițiile – „cufundări” – ale electronilor între orbitalii strâns distanțați. Aceleași abateri se observă în analogul crom - molibden, precum și în elementele subgrupului de cupru - argint și aur. Unic în acest sens este paladiul, al cărui atom nu are deloc electroni 5s și care are o urmă. Configurare: 46 Pd 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10 .
Întrebări pentru autocontrol
1. Ce este un nor de electroni?
2. Care este diferența dintre orbital 1s și orbital 2s?
3. Care este numărul cuantic principal? Cum se raportează la numărul perioadei?
4. Ce este un subnivel și cum se raportează acest concept la numărul perioadei?
5. Alcătuiți configurații electronice ale atomilor elementelor 4-6 din perioada PSCE.
6. Compune configurația electronică a atomilor de magneziu și neon.
7. Determinați care atom aparține configurației electronice 1S 2 2S 2 2p 6 3S 1, 1S 2 2S 2 2p 6 3S 2, 1S 2 2S 2 2p 4, 1S 2 2S 1
PLANUL DE LECȚIE #7
Disciplina: Chimie.
Subiect:
Scopul lecției: Să studieze mecanismele de formare a legăturilor ionice și covalente, să ia în considerare rețelele cristaline ionice, atomice și moleculare.
Rezultate planificate
Subiect: posesia unor concepte chimice fundamentale: legătură chimică, ioni, rețele cristaline, utilizarea încrezătoare a terminologiei și simbolurilor chimice; formarea capacității de a da estimări cantitative și de a face calcule conform formulelor și ecuațiilor chimice;
Metasubiect: utilizarea diferitelor tipuri de activitate cognitivă și operații intelectuale de bază: compilarea configurațiilor electronice ale atomilor elementelor chimice.
Personal: capacitatea de a folosi realizările științei chimice moderne și tehnologiilor chimice pentru a crește propria dezvoltare intelectuală în activitatea profesională aleasă;
Norma de timp: 2 ore
Tipul clasei: Lectura.
Planul lecției:
1. Cationii, formarea lor din atomi ca urmare a procesului de oxidare. Anionii, formarea lor din atomi ca urmare a procesului de reducere. Legătura ionică, ca legătură între cationi și anioni datorită atracției electrostatice.
2. Clasificarea ionilor: după compoziție, semn de încărcare, prezența unei învelișuri de hidrat.
3. Rețele cristaline ionice. Proprietățile substanțelor cu rețea cristalină de tip ionic.
4. Mecanismul de formare a unei legături covalente (schimb și donor-acceptor).
5. Electronegativitatea. Legături polare și nepolare covalente. Multiplicitatea unei legături covalente.
6. Rețele cristaline moleculare și atomice. Proprietățile substanțelor cu rețele cristaline moleculare și atomice.
Echipament: Modele de rețele cristaline, manual, sistem periodic de elemente chimice de DIMendeleev.
Literatură:
1. Chimie clasa a 11-a: manual. pentru învăţământul general organizatii G.E. Rudzitis, F.G. Feldman. - M.: Iluminismul, 2014. -208 p.: Ill..
2. Chimie pentru profesii și specialități de profil tehnic: manual pentru studenți. instituții medii. prof. educație / O.S.Gabrielyan, I.G. Ostroumov. - Ed. a 5-a, șters. - M .: Centrul de Editură „Academia”, 2017. - 272 p., cu culoare. bolnav.
Lector: Tubaltseva Yu.N.
Subiectul 7. Legături chimice ionice și covalente.
1) Cationii, formarea lor din atomi ca urmare a procesului de oxidare. Anionii, formarea lor din atomi ca urmare a procesului de reducere. Legătura ionică, ca legătură între cationi și anioni datorită atracției electrostatice.
2) Clasificarea ionilor: după compoziție, semn de încărcare, prezența unei învelișuri hidratate.
3) Rețele cristaline ionice. Proprietățile substanțelor cu rețea cristalină de tip ionic.
4) Mecanismul de formare a unei legături covalente (schimb și donor-acceptor).
5) Electronegativitatea. Legături polare și nepolare covalente. Multiplicitatea unei legături covalente.
6) Rețele cristaline moleculare și atomice. Proprietățile substanțelor cu rețele cristaline moleculare și atomice.
Cationii, formarea lor din atomi ca urmare a procesului de oxidare. Anionii, formarea lor din atomi ca urmare a procesului de reducere. Legătura ionică, ca legătură între cationi și anioni datorită atracției electrostatice.
O legătură chimică este interacțiunea atomilor care determină stabilitatea unei particule chimice sau a unui cristal în ansamblu. O legătură chimică se formează datorită interacțiunii electrostatice dintre particulele încărcate: cationi și anioni, nuclei și electroni. Când atomii se apropie unul de celălalt, forțele atractive încep să acționeze între nucleul unui atom și electronii altuia, precum și forțe de respingere între nuclee și între electroni. La o anumită distanță, aceste forțe se echilibrează reciproc și se formează o particulă chimică stabilă.
Când se formează o legătură chimică, poate avea loc o redistribuire semnificativă a densității de electroni a atomilor din compus în comparație cu atomii liberi. În cazul limitativ, acest lucru duce la formarea de particule încărcate - ioni (din grecescul "ion" - merge).
Interacțiunea ionilor:
Dacă un atom pierde unul sau mai mulți electroni, atunci se transformă într-un ion pozitiv - un cation (tradus din greacă - „coborând). Așa se formează cationii de hidrogen H +, litiu Li +, bariu Ba 2+. Obținerea electronilor , atomii se transformă în ioni negativi - anioni (din grecescul "anion" - urcând) Exemple de anioni sunt ionul fluor F - , ionul sulfură S 2 - .
Cationii și anionii sunt capabili să se atragă unul pe altul. În acest caz, apare o legătură chimică și se formează compuși chimici. Acest tip de legătură chimică se numește legătură ionică:
O legătură ionică, de regulă, are loc între atomi de metale tipice și nemetale tipice. O proprietate caracteristică a atomilor de metal este că își donează cu ușurință electronii de valență, în timp ce atomii nemetalici sunt capabili să-i atașeze cu ușurință.
Luați în considerare apariția unei legături ionice, de exemplu, între atomii de sodiu și atomii de clor în clorură de sodiu NaCl.
Desprinderea unui electron de un atom de sodiu duce la formarea unui ion încărcat pozitiv - cationul de sodiu Na +.
Adăugarea unui electron la un atom de clor duce la formarea unui ion încărcat negativ - anionul de clor Cl - .
Între ionii formați Na + și Cl -, care au o sarcină opusă, apare o atracție electrostatică, în urma căreia se formează un compus - clorură de sodiu cu o legătură chimică de tip ionic.
Legătură ionică - Aceasta este o legătură chimică, care se realizează datorită interacțiunii electrostatice a ionilor încărcați opus.
Astfel, procesul de formare a unei legături ionice se reduce la tranziția electronilor de la atomii de sodiu la atomii de clor cu formarea de ioni încărcați opus cu configurații electronice complete ale straturilor exterioare.
1. Atomii metalelor, renunțând la electroni externi, se transformă în ioni pozitivi:
unde n este numărul de electroni din stratul exterior al atomului, corespunzător numărului de grup al elementului chimic.
2. Atomi de nemetale, care acceptă electronii lipsă înainte de finalizarea stratului exterior de electroni, sunt transformate în ioni negativi:

3. Între ionii încărcați opus apare o legătură, care se numește ionic.

2. Clasificarea ionilor: după compoziție, semn de încărcare, prezența unei învelișuri de hidrat.
Clasificarea ionilor:
1. După semnul de sarcină: cationi (pozitivi, K+, Ca2+, H+) și anioni (negativi, S2-, Cl-, I-).
2. După compoziție: complex ( , ) și simplu (Na +, F-)©2015-2019 site
Toate drepturile aparțin autorilor lor. Acest site nu pretinde autor, dar oferă o utilizare gratuită.
Data creării paginii: 2017-12-12