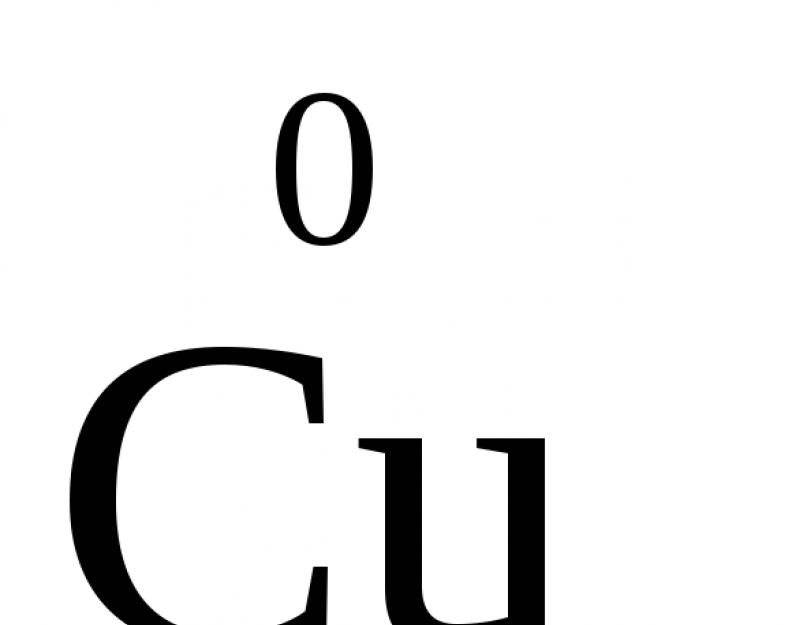Pentru a caracteriza capacitatea redox a particulelor, conceptul de grad de oxidare este important. GRADUL DE OXIDAȚIE este sarcina pe care un atom dintr-o moleculă sau ion ar avea-o dacă toate legăturile sale cu alți atomi ar fi rupte și perechile de electroni partajate ar avea mai multe elemente electronegative.
Spre deosebire de încărcăturile reale ale ionilor, starea de oxidare arată doar sarcina condiționată a unui atom dintr-o moleculă. Poate fi negativ, pozitiv sau zero. De exemplu, starea de oxidare a atomilor din substanțele simple este „0” (,  ,
, ,
, ). ÎN compuși chimici atomii pot avea grad constant oxidare sau variabilă. Pentru metalele principalelor subgrupe I, II și III ale grupelor din Tabelul periodic în compușii chimici, starea de oxidare este, de regulă, constantă și egală cu Me +1, Me +2 și, respectiv, Me +3 (Li + , Ca+2, Al+3). Atomul de fluor are întotdeauna -1. Clorul din compușii cu metale este întotdeauna -1. În majoritatea covârșitoare a compușilor, oxigenul are o stare de oxidare de -2 (cu excepția peroxizilor, unde starea sa de oxidare este -1) și hidrogenul +1 (cu excepția hidrurilor metalice, unde starea sa de oxidare este -1).
). ÎN compuși chimici atomii pot avea grad constant oxidare sau variabilă. Pentru metalele principalelor subgrupe I, II și III ale grupelor din Tabelul periodic în compușii chimici, starea de oxidare este, de regulă, constantă și egală cu Me +1, Me +2 și, respectiv, Me +3 (Li + , Ca+2, Al+3). Atomul de fluor are întotdeauna -1. Clorul din compușii cu metale este întotdeauna -1. În majoritatea covârșitoare a compușilor, oxigenul are o stare de oxidare de -2 (cu excepția peroxizilor, unde starea sa de oxidare este -1) și hidrogenul +1 (cu excepția hidrurilor metalice, unde starea sa de oxidare este -1).
Suma algebrică a stărilor de oxidare ale tuturor atomilor dintr-o moleculă neutră este zero, iar într-un ion este sarcina ionului. Această relație face posibilă calcularea stărilor de oxidare ale atomilor din compuși complecși.
În molecula de acid sulfuric H2SO4, atomul de hidrogen are o stare de oxidare de +1, iar atomul de oxigen are o stare de oxidare de -2. Deoarece există doi atomi de hidrogen și patru atomi de oxigen, avem doi „+” și opt „-”. Neutralitatea este la șase „+” distanță. Acest număr este starea de oxidare a sulfului -  . Molecula de dicromat de potasiu K 2 Cr 2 O 7 este formată din doi atomi de potasiu, doi atomi de crom și șapte atomi de oxigen. Potasiul are întotdeauna o stare de oxidare de +1, iar oxigenul are o stare de oxidare de -2. Aceasta înseamnă că avem două „+” și paisprezece „-”. Restul de doisprezece „+” sunt reprezentați de doi atomi de crom, fiecare având o stare de oxidare de +6 (
. Molecula de dicromat de potasiu K 2 Cr 2 O 7 este formată din doi atomi de potasiu, doi atomi de crom și șapte atomi de oxigen. Potasiul are întotdeauna o stare de oxidare de +1, iar oxigenul are o stare de oxidare de -2. Aceasta înseamnă că avem două „+” și paisprezece „-”. Restul de doisprezece „+” sunt reprezentați de doi atomi de crom, fiecare având o stare de oxidare de +6 (  ).
).
Agenți de oxidare și reducție tipici
Din definirea proceselor de reducere și oxidare rezultă că, în principiu, substanțe simple și complexe care conțin atomi care nu se află în cea mai scăzută stare de oxidare și, prin urmare, își pot scădea starea de oxidare pot acționa ca agenți de oxidare. În mod similar, substanțele simple și complexe care conțin atomi care nu sunt în cea mai mare stare de oxidare și, prin urmare, pot crește starea lor de oxidare pot acționa ca agenți reducători.
Cei mai puternici agenți oxidanți includ:
1) substanțe simple formate din atomi cu electronegativitate mare, adică nemetale tipice situate în principalele subgrupe ale grupelor a șasea și a șaptea ale tabelului periodic: F, O, Cl, S (respectiv F 2, O 2, Cl 2, S);
2) substanțe care conțin elemente în superioare și intermediare
stări pozitive de oxidare, inclusiv sub formă de ioni, atât simpli, elementali (Fe 3+), cât și oxoanioni cu conținut de oxigen (ion permanganat - MnO 4 -);
3) compuși peroxidici.
Substanțele specifice utilizate în practică ca agenți oxidanți sunt oxigenul și ozonul, clorul, bromul, permanganații, dicromații, oxiacizii de clor și sărurile acestora (de exemplu,  ,
, ,
, ), acid azotic (
), acid azotic (  ), acid sulfuric concentrat (
), acid sulfuric concentrat (  ), dioxid de mangan (
), dioxid de mangan (  ), peroxid de hidrogen și peroxizi de metal (
), peroxid de hidrogen și peroxizi de metal (  ,
, ).
).
Cei mai puternici agenți reducători includ:
1) substanțe simple ai căror atomi au electronegativitate scăzută („metale active”);
2) cationi metalici în stări de oxidare scăzută (Fe 2+);
3) anioni elementari simpli, de exemplu, ion sulfură S2-;
4) anioni care conțin oxigen (oxoanioni), corespunzând celor mai scăzute stări pozitive de oxidare ale elementului (nitrit  , sulfit
, sulfit  ).
).
Substanțele specifice utilizate în practică ca agenți reducători sunt, de exemplu, metalele alcaline și alcalino-pământoase, sulfurile, sulfiții, halogenurile de hidrogen (cu excepția HF), substanțele organice - alcooli, aldehide, formaldehidă, glucoză, acid oxalic, precum și hidrogen, carbon , monoxid de carbon (  ) și aluminiu la temperaturi ridicate.
) și aluminiu la temperaturi ridicate.
În principiu, dacă o substanță conține un element într-o stare intermediară de oxidare, atunci aceste substanțe pot prezenta atât proprietăți oxidante, cât și reducătoare. Totul depinde
„partener” în reacție: cu un agent de oxidare suficient de puternic poate reacționa ca agent reducător, iar cu un agent de reducere suficient de puternic - ca agent de oxidare. De exemplu, ionul nitrit NO 2 - într-un mediu acid acționează ca un agent oxidant în raport cu ionul I -:
2 +
2
+
2 + 4HCI→
+ 4HCI→  +
2
+
2 + 4KCI + 2H20
+ 4KCI + 2H20
și ca agent reducător în raport cu ionul permanganat MnO 4 -
5 +
2
+
2 + 3H2SO4 → 2
+ 3H2SO4 → 2  +
5
+
5 +K2S04 + 3H20
+K2S04 + 3H20
La școală, chimia ocupă încă locul uneia dintre cele mai dificile materii, care, datorită faptului că ascunde multe dificultăți, provoacă elevilor (de obicei în perioada de la clasele a VIII-a la a IX-a) mai multă ură și indiferență față de studiu decât interes. Toate acestea reduc calitatea și cantitatea cunoștințelor pe această temă, deși multe domenii necesită încă specialiști în acest domeniu. Da, momente dificile iar uneori există reguli chiar mai de neînțeles în chimie decât pare. Una dintre întrebările care îi îngrijorează pe cei mai mulți studenți este ce este numărul de oxidare și cum se determină numărul de oxidare al elementelor.
Regulă importantă – regula de plasare, algoritmi
Aici se vorbește mult despre compuși precum oxizii. Pentru început, orice student trebuie să învețe determinarea oxizilor- sunt compuși complecși din două elemente, conțin oxigen. Oxizii sunt clasificați ca compuși binari, deoarece oxigenul ocupă locul al doilea în algoritm. La determinarea unui indicator, este important să cunoașteți regulile de plasare și să calculați algoritmul.
Algoritmi pentru oxizi acizi
Stari de oxidare - Acestea sunt expresii numerice ale valenței elementelor. De exemplu, oxizii acizi se formează după un anumit algoritm: mai întâi vin nemetale sau metalele (valența lor este de obicei de la 4 la 7), apoi vine oxigenul, așa cum ar trebui să fie, al doilea în ordine, valența sa este egală cu două. Poate fi determinat cu ușurință folosind tabelul periodic elemente chimice Mendeleev. De asemenea, este important de știut că starea de oxidare a elementelor este un indicator care sugerează fie pozitive fie număr negativ .
La începutul algoritmului, de regulă, metalul este un nemetal, iar starea sa de oxidare este pozitivă. Oxigenul nemetalic din compușii de oxid are o valoare stabilă de -2. Pentru a determina acuratețea aranjamentului tuturor valorilor, trebuie să înmulțiți toate numerele disponibile cu indicii unui element specific dacă produsul, ținând cont de toate minusurile și plusurile, este egal cu 0, atunci aranjamentul este fiabil.
Aranjament în acizi care conțin oxigen
 Acizii sunt substanțe complexe, sunt asociate cu un rest acid și conțin unul sau mai mulți atomi de hidrogen. Aici, pentru a calcula gradul, sunt necesare abilități în matematică, deoarece indicatorii necesari pentru calcul sunt digitali. Pentru hidrogen sau proton este întotdeauna același – +1. Ionul negativ de oxigen are o stare de oxidare negativă de -2.
Acizii sunt substanțe complexe, sunt asociate cu un rest acid și conțin unul sau mai mulți atomi de hidrogen. Aici, pentru a calcula gradul, sunt necesare abilități în matematică, deoarece indicatorii necesari pentru calcul sunt digitali. Pentru hidrogen sau proton este întotdeauna același – +1. Ionul negativ de oxigen are o stare de oxidare negativă de -2.
După toți acești pași, puteți determina starea de oxidare a elementului central al formulei. Expresia pentru calcularea acesteia este o formulă sub forma unei ecuații. De exemplu, pentru acidul sulfuric, ecuația va avea o necunoscută.
Termeni de bază în OVR
ORR sunt reacții de reducere-oxidare.
- Starea de oxidare a oricărui atom caracterizează capacitatea acestui atom de a atașa sau de a ceda electroni de ioni (sau atomi) altor atomi;
- Este în general acceptat că agenții de oxidare sunt fie atomi încărcați, fie ioni neîncărcați;
- Agentul reducător în acest caz vor fi ionii încărcați sau, dimpotrivă, atomii neîncărcați care își pierd electronii în procesul de interacțiune chimică;
- Oxidarea implică pierderea de electroni.
Cum se atribuie numerele de oxidare în săruri
 Sărurile constau dintr-un metal și unul sau mai multe reziduuri acide. Procedura de determinare este aceeași ca și pentru acizii care conțin acid.
Sărurile constau dintr-un metal și unul sau mai multe reziduuri acide. Procedura de determinare este aceeași ca și pentru acizii care conțin acid.
Metalul care formează direct sarea este situat în subgrupul principal, gradul său va fi egal cu numărul grupului său, adică va rămâne întotdeauna un indicator stabil, pozitiv.
Ca exemplu, putem lua în considerare aranjarea stărilor de oxidare în azotatul de sodiu. Sarea se formează folosind un element din subgrupul principal al grupului 1, în consecință, starea de oxidare va fi pozitivă și egală cu unu; În nitrați, oxigenul are o valoare – -2. Pentru a obține o valoare numerică se întocmește mai întâi o ecuație cu o necunoscută, luând în considerare toate argumentele pro și contra valorilor: +1+X-6=0. După rezolvarea ecuației, puteți ajunge la faptul că indicatorul numeric este pozitiv și egal cu + 5. Acesta este un indicator al azotului. O cheie importantă pentru a calcula starea de oxidare este tabelul.
Regula de aranjare în oxizi bazici
- Oxizii metalelor tipice din orice compuși au un indice de oxidare stabil, acesta nu este întotdeauna mai mare de +1 sau, în alte cazuri, +2;
- Indicatorul digital al metalului este calculat folosind tabelul periodic. Dacă un element este conținut în subgrupul principal al grupului 1, atunci valoarea lui va fi +1;
- Valoarea oxizilor, ținând cont de indicii lor, după înmulțire și însumată, trebuie să fie egală cu zero, deoarece molecula din ele este neutră, o particulă lipsită de sarcină;
- Metalele din subgrupul principal al grupului 2 au, de asemenea, un indicator pozitiv stabil, care este egal cu +2.
Gradul de oxidare este o valoare convențională utilizată pentru înregistrarea reacțiilor redox. Pentru a determina gradul de oxidare se folosește tabelul de oxidare a elementelor chimice.
Sens
Starea de oxidare a elementelor chimice de bază se bazează pe electronegativitatea lor. Valoarea este egală cu numărul de electroni deplasați în compuși.
Starea de oxidare este considerată pozitivă dacă electronii sunt deplasați de la atom, adică. elementul donează electroni în compus și este un agent reducător. Aceste elemente includ metale starea lor de oxidare este întotdeauna pozitivă.
Când un electron este deplasat către un atom, valoarea este considerată negativă, iar elementul este considerat un agent oxidant. Atomul acceptă electroni până la atingerea nivelului de energie exterior. Majoritatea nemetalelor sunt agenți oxidanți.
Substanțele simple care nu reacționează au întotdeauna o stare de oxidare zero.

Orez. 1. Tabelul stărilor de oxidare.
Într-un compus, atomul nemetalic cu electronegativitate mai mică are o stare de oxidare pozitivă.
Definiţie
Puteți determina stările de oxidare maxime și minime (câți electroni poate da și accepta un atom) folosind tabelul periodic.
Gradul maxim este egal cu numărul grupului în care se află elementul sau cu numărul de electroni de valență. Valoarea minimă este determinată de formula:
Nr. (grupe) – 8.

Orez. 2. Tabel periodic.
Carbonul se află în a patra grupă, prin urmare, cea mai înaltă stare de oxidare este +4, iar cea mai scăzută este -4. Gradul maxim de oxidare al sulfului este +6, cel minim este -2. Majoritatea nemetalelor au întotdeauna o stare de oxidare variabilă - pozitivă și negativă. Excepția este fluorul. Starea sa de oxidare este întotdeauna -1.
Trebuie amintit că această regulă nu se aplică metalelor alcaline și alcalino-pământoase din grupele I și, respectiv, II. Aceste metale au o stare de oxidare pozitivă constantă - litiu Li +1, sodiu Na +1, potasiu K +1, beriliu Be +2, magneziu Mg +2, calciu Ca +2, stronțiu Sr +2, bariu Ba +2. Alte metale pot prezenta diferite grade oxidare. Excepția este aluminiul. În ciuda faptului că se află în grupa III, starea sa de oxidare este întotdeauna +3.

Orez. 3. Metale alcaline și alcalino-pământoase.
Din grupa VIII, numai ruteniul și osmiul pot prezenta cea mai mare stare de oxidare +8. Aurul și cuprul din grupa I prezintă stări de oxidare de +3 și, respectiv, +2.
Înregistra
Pentru a înregistra corect starea de oxidare, ar trebui să vă amintiți câteva reguli:
- gazele inerte nu reacţionează, deci starea lor de oxidare este întotdeauna zero;
- la compuși, starea de oxidare variabilă depinde de valența variabilă și de interacțiunea cu alte elemente;
- hidrogenul din compușii cu metale prezintă o stare de oxidare negativă - Ca +2 H 2 −1, Na +1 H −1;
- oxigenul are întotdeauna o stare de oxidare de -2, cu excepția fluorurii și peroxidului de oxigen - O +2 F 2 −1, H 2 +1 O 2 −1.
Ce am învățat?
Starea de oxidare este o valoare condiționată care arată câți electroni a acceptat sau a renunțat un atom dintr-un element dintr-un compus. Valoarea depinde de numărul de electroni de valență. Metalele din compuși au întotdeauna o stare de oxidare pozitivă, de exemplu. sunt agenți reducători. Pentru metalele alcaline și alcalino-pământoase, starea de oxidare este întotdeauna aceeași. Nemetalele, cu excepția fluorului, pot lua stări de oxidare pozitive și negative.
Starea de oxidare. Determinarea stării de oxidare a unui atom de element prin formula chimica conexiuni. Întocmirea formulei unui compus pe baza stărilor de oxidare cunoscute ale atomilor elementali
Starea de oxidare a unui element este sarcina condiționată a unui atom dintr-o substanță, calculată din ipoteza că este alcătuită din ioni. Pentru a determina starea de oxidare a elementelor, trebuie să vă amintiți anumite reguli:
1. Starea de oxidare poate fi pozitivă, negativă sau zero. Este desemnat Cifra arabă cu semnul plus sau minus deasupra simbolului elementului.
2. La determinarea stărilor de oxidare se pleacă de la electronegativitatea substanței: suma stărilor de oxidare ale tuturor atomilor din compus este zero.
3. Dacă un compus este format din atomi ai unui element (într-o substanță simplă), atunci starea de oxidare a acestor atomi este zero.
4. Atomilor unor elemente chimice li se atribuie de obicei stări de oxidare a oțelului. De exemplu, starea de oxidare a fluorului în compuși este întotdeauna -1; litiu, sodiu, potasiu, rubidiu și cesiu +1; magneziu, calciu, stronțiu, bariu și zinc +2, aluminiu +3.
5. Starea de oxidare a hidrogenului în majoritatea compușilor este +1, iar numai în compușii cu unele metale este egală cu -1 (KH, BaH2).
6. Starea de oxidare a oxigenului în majoritatea compușilor este -2 și numai la unii compuși i se atribuie o stare de oxidare de -1 (H2O2, Na2O2 sau +2 (OF2).
7. Atomii multor elemente chimice au stări de oxidare variabile.
8. Starea de oxidare a atomului de metal din compuși este pozitivă și este numeric egală cu valența acestuia.
9. Starea maximă de oxidare pozitivă a unui element este de obicei egală cu numărul grupului din tabelul periodic în care se găsește elementul.
10. Starea minimă de oxidare pentru metale este zero. Pentru nemetale, în cele mai multe cazuri, sub starea de oxidare negativă este egală cu diferența dintre numărul grupului și numărul opt.
11. Starea de oxidare a unui atom formează un ion simplu (constă dintr-un atom) și este egală cu sarcina acestui ion.
Folosind regulile de mai sus, vom determina stările de oxidare ale elementelor chimice din compoziția H2SO4. Acest compus, formată din trei elemente chimice - hidrogen H, sulf S și oxigen O. Să notăm stările de oxidare ale acelor elemente pentru care sunt constante. În cazul nostru, acestea sunt hidrogen H și oxigen O.
Să determinăm starea de oxidare necunoscută a sulfului. Fie numărul de oxidare al sulfului din acest compus x.
Să creăm ecuații înmulțind pentru fiecare element indicele său cu starea de oxidare și echivalând cantitatea extrasă cu zero: 2 (+1) + x + 4 (-2) = 0
2 + X – 8 = 0
x = +8 – 2 = +6
Prin urmare, numărul de oxidare al sulfului este de plus șase.
În exemplul următor, vom afla cum să creăm o formulă pentru un compus cu stări de oxidare cunoscute ale atomilor elementali. Să creăm formula pentru oxidul de fer (III). Cuvântul „oxid” înseamnă că în dreapta simbolului de fier trebuie să scrieți simbolul oxigenului: FeO.
Să notăm stările de oxidare ale elementelor chimice deasupra simbolurilor lor. Starea de oxidare a fierului este indicată în denumire între paranteze (III), prin urmare egală cu +3, starea de oxidare a oxigenului în oxizi este -2.
Să găsim cel mai mic multiplu comun al numerelor 3 și 2, acesta este 6. Împărțiți numărul 6 la 3, obținem numărul 2 - acesta este indicele pentru fier. Împărțiți numărul 6 la 2, obținem numărul 3 - acesta este indicele pentru oxigen.
În exemplul următor, vom afla cum să creăm o formulă pentru un compus cu stări de oxidare cunoscute ale atomilor elementului și sarcinile ionice. Să creăm formula pentru ortofosfat de calciu. Cuvântul „ortofosfat” înseamnă că în dreapta simbolului Calciu trebuie să scrieți reziduul acid al acidului ortofosfat: CaPO4.
Să notăm starea de oxidare a calciului (regula numărul patru) și sarcina reziduului acid (conform tabelului de solubilitate).
Să găsim cel mai mic multiplu comun al numerelor 2 și 3, acesta este 6. Împărțiți numărul 6 la 2, obținem numărul 3 - acesta este indicele pentru calciu. Împărțiți numărul 6 la 3, obținem numărul 2 - acesta este indicele pentru reziduul acid.
Pentru a caracteriza starea elementelor din compuși, a fost introdus conceptul de stare de oxidare.
DEFINIŢIE
Numărul de electroni deplasați de la un atom al unui element dat sau la un atom al unui element dat dintr-un compus se numește starea de oxidare.
O stare de oxidare pozitivă indică numărul de electroni care sunt deplasați de la un anumit atom, iar o stare de oxidare negativă indică numărul de electroni care sunt deplasați către un anumit atom.
Din această definiție rezultă că în compușii cu legături nepolare starea de oxidare a elementelor este zero. Exemple de astfel de compuși sunt moleculele formate din atomi identici (N2, H2, CI2).
Starea de oxidare a metalelor în stare elementară este zero, deoarece distribuția densității electronilor în ele este uniformă.
În compușii ionici simpli, starea de oxidare a elementelor lor constitutive este egală cu sarcina electrică, deoarece în timpul formării acestor compuși practic tranziție completă electroni de la un atom la altul: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F -1 3, Zr +4 Br -1 4.
La determinarea stării de oxidare a elementelor din compușii cu legături covalente polare, se compară valorile electronegativității acestora. Deoarece atunci când se formează o legătură chimică, electronii sunt deplasați către atomii mai multor elemente electronegative, acestea din urmă au o stare de oxidare negativă în compuși.
Cea mai înaltă stare de oxidare
Pentru elementele care se prezintă în compușii lor diverse grade oxidare, există concepte de stări de oxidare superioare (pozitive maxime) și inferioare (negative minime). Cea mai mare stare de oxidare a unui element chimic coincide de obicei numeric cu numărul grupului în Tabel periodic D. I. Mendeleev. Excepțiile sunt fluorul (starea de oxidare este -1, iar elementul este situat în grupa VIIA), oxigenul (starea de oxidare este +2, iar elementul este situat în grupul VIA), heliul, neonul, argonul (starea de oxidare este 0 și elementele sunt situate în grupa VIII), precum și elementele subgrupei cobalt și nichel (starea de oxidare este +2, iar elementele sunt situate în grupa VIII), pentru care cea mai mare stare de oxidare este exprimată printr-un număr a cărui valoare este mai mic decât numărul grupului din care fac parte. Elementele din subgrupa cuprului, dimpotrivă, au cea mai mare stare de oxidare mai mare decât unu, deși aparțin grupului I (starea maximă de oxidare pozitivă a cuprului și argintului este +2, aur +3).
Exemple de rezolvare a problemelor
EXEMPLUL 1
- În hidrogenul sulfurat, starea de oxidare a sulfului este (-2), iar în chestiune simplă- gri - 0:
Modificarea stării de oxidare a sulfului: -2 → 0, adică. al șaselea răspuns.
- Într-o substanță simplă - sulf - starea de oxidare a sulfului este 0, iar în SO 3 - (+6):
Modificarea stării de oxidare a sulfului: 0 → +6, adică. a patra variantă de răspuns.
- În acidul sulfuros, starea de oxidare a sulfului este (+4), iar într-o substanță simplă - sulf - 0:
1×2 +x+ 3×(-2) =0;
Modificarea stării de oxidare a sulfului: +4 → 0, adică a treia variantă de răspuns.
EXEMPLUL 2
| Exercita | Azotul prezintă valenţa III şi starea de oxidare (-3) în compusul: a) N2H4; b) NH3; c) NH4CI; d) N2O5 |
| Soluţie | Pentru a da răspunsul corect la întrebarea pusă, vom determina alternativ valența și starea de oxidare a azotului din compușii propuși. a) valența hidrogenului este întotdeauna egală cu I. Număr total unitățile de valență a hidrogenului este egală cu 4 (1×4 = 4). Să împărțim valoarea obținută la numărul de atomi de azot din moleculă: 4/2 = 2, prin urmare, valența azotului este II. Această opțiune de răspuns este incorectă. b) valența hidrogenului este întotdeauna egală cu I. Numărul total de unități de valență a hidrogenului este egal cu 3 (1 × 3 = 3). Să împărțim valoarea obținută la numărul de atomi de azot din moleculă: 3/1 = 2, prin urmare, valența azotului este III. Gradul de oxidare a azotului din amoniac este (-3): Acesta este răspunsul corect. |
| Răspuns | Opțiunea (b) |