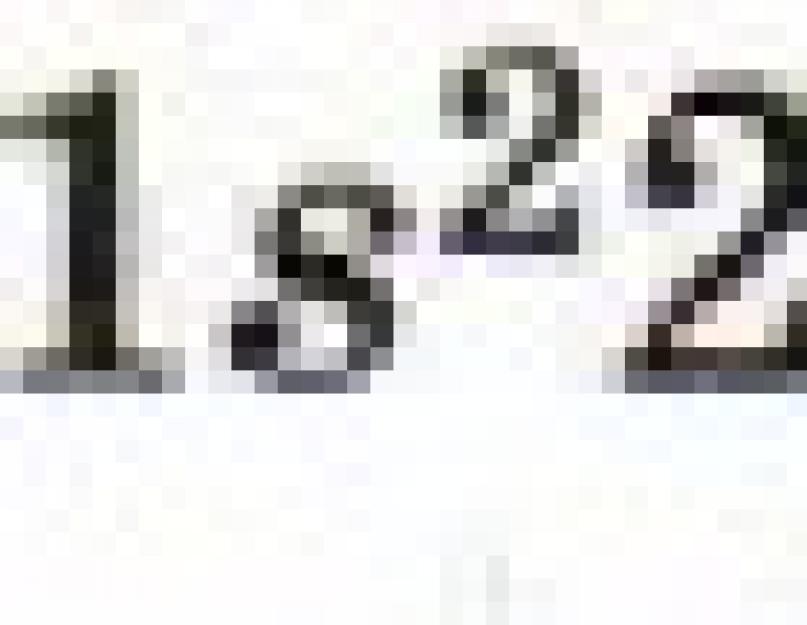Cunoașterea stărilor posibile ale unui electron dintr-un atom, regula lui Klechkovsky, principiul lui Pauli și regula lui Hund fac posibilă luarea în considerare a configurației electronice a unui atom. Pentru aceasta se folosesc formule electronice.
Formula electronică denotă starea unui electron dintr-un atom, indicând cu un număr numărul cuantic principal care caracterizează starea acestuia și cu o literă care indică numărul cuantic orbital. Un număr care indică câți electroni sunt această stare, sunt scrise în dreapta sus a literei care indică forma norului de electroni.
Pentru un atom de hidrogen (n = 1, l = 0, m = 0) formula electronică va fi: 1s 1. Ambii electroni ai următorului element heliu He sunt caracterizați de aceleași valori ale lui n, l, m și diferă doar în spini. Formula electronică a atomului de heliu este ls 2. Învelișul de electroni a atomului de heliu este complet și foarte stabil. Heliul este un gaz nobil.
Pentru elementele perioadei a 2-a (n = 2, l = 0 sau l = 1), mai întâi se umple starea 2s, iar apoi subnivelul p al celui de-al doilea nivel energetic.
Formula electronică a atomului de litiu: ls 2 2s 1. Electronul 2s 1 este legat mai slab de nucleul atomic (Fig. 6), astfel încât atomul de litiu poate renunța cu ușurință la el (după cum vă amintiți evident, acest proces se numește oxidare), transformându-se în ion Li +.
Orez. 6.
Secțiuni de nori de electroni 1s și 2s de către un plan care trece prin nucleu
În atomul de beriliu, al patrulea electron ocupă și starea 2s: ls 2 2s 2. Cei doi electroni exteriori ai atomului de beriliu sunt ușor separați - Be este oxidat în cationul Be 2+.
Atomul de bor are un electron în starea 2p: ls 2 2s 2 2p 1. În continuare, pentru atomii de carbon, azot, oxigen și fluor (în conformitate cu regula lui Hund), se umple subnivelul 2p, care se termină la neonul gazului nobil: ls 2 2s 2 2p 6.
Dacă vor să sublinieze că electronii de la un anumit subnivel ocupă celulele cuantice în mod individual, în formula electronică desemnarea subnivelului însoțește indicele. De exemplu, formula electronică a atomului de carbon
![]()
Pentru elementele perioadei a 3-a, starea Zs (n = 3, l = 0) și, respectiv, subnivelul Zp (n = 3, l - 1) sunt umplute. Subnivelul 3d (n = 3, l = 2) rămâne liber:
Uneori, în diagramele care descriu distribuția electronilor în atomi, este indicat doar numărul de electroni la fiecare nivel de energie, adică sunt scrise formule electronice abreviate ale atomilor elementelor chimice, spre deosebire de formulele electronice complete prezentate mai sus, de exemplu:
Pentru elementele de perioade mari (a 4-a și a 5-a), în conformitate cu regula Klechkovsky, primii doi electroni ai stratului de electroni exterior ocupă starea 4s (n = 4, l = 0) și stările 5s (n = 5, l = 0):
Pornind de la al treilea element al fiecărei perioade majore, următorii zece electroni intră în subnivelurile 3d și respectiv 4d anterioare (pentru elementele subgrupurilor laterale):
De regulă, atunci când subnivelul d anterior este umplut, atunci subnivelul exterior (4p- și 5p-respectiv) p va începe să se umple:
Pentru elementele perioadelor mari - al 6-lea și al 7-lea incomplet - nivelurile și subnivelurile de energie sunt umplute cu electroni, de regulă, astfel: primii doi electroni merg la subnivelul s exterior, de exemplu:
următorul electron (în La și Ac) trece la subnivelul d anterior:
Apoi următorii 14 electroni intră în al treilea nivel exterior de energie în subnivelurile 4f și 5f ale lantanidelor și, respectiv, actinidelor:
Apoi, al doilea nivel de energie exterior (subnivelul d) al elementelor subgrupurilor laterale va începe să se construiască din nou:
Numai după ce subnivelul d este complet umplut cu zece electroni, subnivelul exterior p va fi umplut din nou:
În concluzie, să ne uităm din nou moduri diferite afișând configurațiile electronice ale atomilor elementelor pe perioade ale tabelului lui D. I. Mendeleev.
Să luăm în considerare elementele primei perioade - hidrogen și heliu.

Formule electronice atomii arată distribuția electronilor între niveluri și subniveluri de energie.
Formulele electronice grafice ale atomilor arată distribuția electronilor nu numai între niveluri și subniveluri, ci și între celulele cuantice (orbitali atomici).

Într-un atom de heliu, primul strat de electroni este complet - are 2 electroni.
Hidrogenul și heliul sunt elemente s; subnivelul ls al acestor atomi este umplut cu electroni.
Pentru toate elementele din a doua perioadă, primul strat de electroni este umplut, iar electronii umplu stările 2s și 2p în conformitate cu principiul energiei minime (întâi S-, apoi p) și cu regulile lui Pauli și Hund (Tabelul 2). ).
În atomul de neon, al doilea strat de electroni este complet - are 8 electroni.
Tabelul 2
Structura învelișurilor electronice ale atomilor elementelor din perioada a 2-a


Litiu Li, beriliu Be - elemente s.
Borul B, carbonul C, azotul N, oxigenul O, fluorul F, neonul Ne sunt elemente p subnivelul p al acestor atomi este umplut cu electroni.
Pentru atomii elementelor din perioada a 3-a, primul și al doilea strat electronic sunt completați, deci este umplut al treilea strat electronic, în care electronii pot ocupa stări 3s, 3p și 3d (Tabelul 3).
Tabelul 3
Structura învelișurilor electronice ale atomilor elementelor din perioada a 3-a

Subnivelul 3s este finalizat la atomul de magneziu. Sodiu Na și magneziu Mg sunt elemente s.
În aluminiu și elementele care îl urmează, subnivelul 3p este umplut cu electroni.
Un atom de argon are 8 electroni în stratul său exterior (al treilea strat de electroni). Ca strat exterior, este complet, dar în total în cel de-al treilea strat de electroni, după cum știți deja, pot exista 18 electroni, ceea ce înseamnă că elementele din perioada a 3-a au o stare 3d neumplută.
Toate elementele de la aluminiu Al la argon Ar sunt elemente p.
Elementele s și p formează principalele subgrupe din Tabelul Periodic.
Pentru atomii elementelor din perioada a 4-a - potasiu și calciu - apare un al patrulea nivel de energie, al 48-lea subnivel este umplut (Tabelul 4), deoarece, conform regulii lui Klechkovsky, are o energie mai mică decât subnivelul 3d.
Tabelul 4
Structura învelișurilor electronice ale atomilor elementelor din perioada a IV-a


Pentru a simplifica formulele electronice grafice ale atomilor elementelor din perioada a 4-a:
Potasiul K și calciul Ca sunt elemente s incluse în principalele subgrupe. În atomii de la scandiu Sc la zinc Zn, subnivelul 3d este umplut cu electroni. Acestea sunt elemente 3D. Ele sunt incluse în subgrupuri secundare, stratul lor electronic cel mai exterior este umplut și sunt clasificate ca elemente de tranziție.
Acordați atenție structurii carcaselor electronice ale atomilor de crom și cupru. În ele, un electron „eșuează” de la nivelul 4 la subnivelul 3d, ceea ce se explică prin stabilitatea energetică mai mare a configurațiilor electronice rezultate 3d 5 și 3d 10:

În atomul de zinc, al treilea nivel de energie este complet, toate subnivelurile sunt umplute în el - 3s, 3p și 3d, cu un total de 18 electroni.
În elementele care urmează zincului, al patrulea nivel de energie, subnivelul 4p, continuă să fie umplut.
Elementele de la galiu Ga la kripton Kr sunt elemente p.
Atomul de krypton Kr are un strat exterior (al patrulea) care este complet și are 8 electroni. Dar în total în al patrulea strat de electroni, după cum știți, pot fi 32 de electroni; atomul de cripton are încă stările 4d și 4f necompletate.
Pentru elementele perioadei a 5-a, în conformitate cu regula lui Klechkovsky, subnivelurile sunt completate în următoarea ordine: 5s ⇒ 4d ⇒ 5r. Și există și excepții asociate cu „eșecul” electronilor în 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
În perioadele a 6-a și a 7-a apar elementele f, adică elemente pentru care sunt umplute subnivelurile 4f și, respectiv, 5f ale celui de-al treilea nivel energetic exterior.
Elementele 4f se numesc lantanide.
Elementele 5f se numesc actinide.
Ordinea de umplere a subnivelurilor electronice în atomi de elemente din perioada a 6-a: 55 Cs și 56 elemente Ba - bs; 57 La ...6s 2 5d 1 - 5d-element; 58 Ce - 71 Lu - 4f elemente; 72 Hf - 80 Hg - 5d elemente; 81 Tl - 86 Rn - br-elemente. Dar și aici există elemente în care ordinea de umplere a subnivelurilor de energie este „tulburată”, ceea ce, de exemplu, este asociat cu o mai mare stabilitate energetică a subnivelurilor f jumătate și complet umplute, adică nf 7 și nf 14.
În funcție de subnivelul atomului umplut cu electroni, toate elementele, așa cum ați înțeles deja, sunt împărțite în patru familii sau blocuri electronice (Fig. 7):

Orez. 7.
Împărțirea tabelului periodic (tabelului) în blocuri de elemente
- s-elemente; subnivelul s al nivelului exterior al atomului este umplut cu electroni; elementele s includ hidrogen, heliu și elemente din principalele subgrupe ale grupelor I și II;
- p-elemente; subnivelul p al nivelului exterior al atomului este umplut cu electroni; p-elementele includ elemente ale principalelor subgrupe ale grupelor III-VIII;
- d-elemente; subnivelul d al nivelului pre-extern al atomului este umplut cu electroni; Elementele d includ elemente ale subgrupurilor secundare ale grupelor I-VIII, adică elemente de plug-in decenii de perioade mari situate între elementele s și p. Se mai numesc si elemente de tranzitie;
- elemente f; subnivelul f al celui de-al treilea nivel exterior al atomului este umplut cu electroni; Acestea includ lantanide și actinide.
Întrebări și sarcini pentru § 3
- Faceți diagrame structura electronica, formule electronice și formule electronice grafice ale atomilor următoarelor elemente chimice:
- a) calciu;
b) fier de călcat;
c) zirconiu;
d) niobiu;
e) hafniu;
e) aur. - Scrieți formula electronică pentru elementul nr. 110 folosind simbolul pentru gazul nobil corespunzător.
- Ce este o „cufundare” a electronilor? Dați exemple de elemente în care se observă acest fenomen, notați-le formulele electronice.
- Cum se determină apartenența unui element chimic la o anumită familie de electroni?
- Comparați formulele electronice electronice și grafice ale atomului de sulf. Ce informații suplimentare conține ultima formulă?
>> Chimie: Configurații electronice atomi ai elementelor chimice
Fizicianul elvețian W. Pauli în 1925 a stabilit că într-un atom dintr-un orbital nu pot exista mai mult de doi electroni având spini opuși (antiparaleli) (tradus din engleză ca „fus”), adică având astfel de proprietăți care pot fi convenționale. s-a imaginat ca rotația unui electron în jurul axei sale imaginare: în sensul acelor de ceasornic sau în sens invers acelor de ceasornic. Acest principiu se numește principiul Pauli.
Dacă există un electron în orbital, atunci se numește nepereche dacă sunt doi, atunci aceștia sunt electroni perechi, adică electroni cu spini opuși;
Figura 5 prezintă o diagramă a împărțirii nivelurilor de energie în subniveluri.
S-orbital, după cum știți deja, are o formă sferică. Electronul atomului de hidrogen (s = 1) este situat în acest orbital și este nepereche. Prin urmare, formula sa electronică sau configurația electronică se va scrie după cum urmează: 1s 1. În formulele electronice, numărul nivelului de energie este indicat de numărul care precede litera (1 ...), Literă latină indică un subnivel (tip de orbital), iar numărul care este scris în dreapta sus a literei (ca exponent) arată numărul de electroni din subnivel.
Pentru un atom de heliu He, care are doi electroni perechi într-un orbital s, această formulă este: 1s 2.
Învelișul de electroni a atomului de heliu este complet și foarte stabil. Heliul este un gaz nobil.
La al doilea nivel de energie (n = 2) există patru orbiti: unul s și trei p. Electronii orbitali s de nivel al doilea (orbitalii 2s) au mai mulți energie mare, deoarece se află la o distanță mai mare de nucleu decât electronii orbitalului 1s (n = 2).
În general, pentru fiecare valoare a lui n există câte un orbital s, dar cu o sursă corespunzătoare de energie electronică și, prin urmare, cu un diametru corespunzător, crescând pe măsură ce valoarea lui n crește.
P-Orbitalul are forma unei gantere sau a unei figuri tridimensionale opt. Toți cei trei orbitali p sunt localizați în atom reciproc perpendicular de-a lungul coordonatelor spațiale trasate prin nucleul atomului. Trebuie subliniat încă o dată că fiecare nivel de energie (stratul electronic), începând de la n = 2, are trei p-orbitali. Pe măsură ce valoarea lui n crește, electronii ocupă orbitali p situati la distanțe mari de nucleu și direcționați de-a lungul axelor x, y, z.
Pentru elementele din a doua perioadă (n = 2), mai întâi este umplut un orbital b și apoi trei orbitali p. Formula electronică 1l: 1s 2 2s 1. Electronul este legat mai slab de nucleul atomului, astfel încât atomul de litiu poate renunța cu ușurință la el (după cum vă amintiți, acest proces se numește oxidare), transformându-se într-un ion Li+.
În atomul de beriliu Be 0, al patrulea electron este situat și în orbitalul 2s: 1s 2 2s 2. Cei doi electroni exteriori ai atomului de beriliu se desprind usor - Be 0 este oxidat in cationul Be 2+.
În atomul de bor, al cincilea electron ocupă orbitalul 2p: 1s 2 2s 2 2p 1. Apoi, atomii C, N, O, E sunt umpluți cu orbitali 2p, care se termină cu neonul de gaz nobil: 1s 2 2s 2 2p 6.
Pentru elementele perioadei a treia, orbitalii Sv și respectiv Sr sunt umpluți. Cinci d-orbitali ai celui de-al treilea nivel rămân liberi:
11 Na 1s 2 2s 2 Sv1; 17С11в22822р63р5; 18Аг П^Ёр^Зр6.
Uneori, în diagramele care descriu distribuția electronilor în atomi, este indicat doar numărul de electroni la fiecare nivel de energie, adică sunt scrise formule electronice abreviate ale atomilor elementelor chimice, spre deosebire de formulele electronice complete date mai sus.
Pentru elementele de perioade mari (a patra și a cincea), primii doi electroni ocupă orbitalii 4 și 5, respectiv: 19 K 2, 8, 8, 1; 38 Sr 2, 8, 18, 8, 2. Începând cu al treilea element al fiecărei perioade majore, următorii zece electroni vor intra în orbitalii anteriori 3d, respectiv 4d (pentru elementele subgrupurilor laterale): 23 V 2, 8, 11, 2; 26 Tr 2, 8, 14, 2; 40 Zr 2, 8, 18, 10, 2; 43 Tg 2, 8, 18, 13, 2. De regulă, atunci când subnivelul d anterior este umplut, subnivelul exterior (4p- și 5p-respectiv) p va începe să se umple.
Pentru elementele de perioade mari - al șaselea și al șaptelea incomplet - nivelurile și subnivelurile electronice sunt umplute cu electroni, de regulă, astfel: primii doi electroni vor merge la subnivelul exterior b: 56 Va 2, 8, 18, 18, 8, 2; 87Gg 2, 8, 18, 32, 18, 8, 1; următorul electron (pentru Na și Ac) față de cel anterior (subnivelul p: 57 La 2, 8, 18, 18, 9, 2 și 89 Ac 2, 8, 18, 32, 18, 9, 2.
Apoi următorii 14 electroni vor intra în al treilea nivel exterior de energie în orbitalii 4f și 5f ai lantanidelor și, respectiv, actinidelor.
Apoi, al doilea nivel de energie externă (subnivelul d) va începe să se acumuleze din nou: pentru elementele subgrupurilor laterale: 73 Ta 2, 8.18, 32.11, 2; 104 Rf 2, 8.18, 32, 32.10, 2, - și, în cele din urmă, numai după ce nivelul curent este complet umplut cu zece electroni va fi umplut din nou p-subnivelul exterior:
86 Rn 2, 8, 18, 32, 18, 8.
Foarte des, structura învelișurilor electronice ale atomilor este descrisă folosind energie sau celule cuantice - sunt scrise așa-numitele formule electronice grafice. Pentru această notație se folosește următoarea notație: fiecare celulă cuantică este desemnată de o celulă care corespunde unui orbital; Fiecare electron este indicat de o săgeată corespunzătoare direcției de spin. Când scrieți o formulă electronică grafică, ar trebui să vă amintiți două reguli: principiul Pauli, conform căruia nu pot exista mai mult de doi electroni într-o celulă (orbital), dar cu spin antiparalel, și regula lui F. Hund, conform căreia electronii ocupă celule libere (orbitali) și sunt situate în La început, sunt unul câte unul și au aceeași valoare de spin și abia apoi se perechează, dar spinurile vor fi direcționate invers conform principiului Pauli.
În concluzie, să considerăm încă o dată afișarea configurațiilor electronice ale atomilor elementelor în funcție de perioadele sistemului D.I. Diagramele structurii electronice a atomilor arată distribuția electronilor de-a lungul straturilor electronice (nivelurile de energie). 
Într-un atom de heliu, primul strat de electroni este complet - are 2 electroni.
Hidrogenul și heliul sunt elemente s; orbitalul s al acestor atomi este umplut cu electroni.
Elemente ale perioadei a doua
Pentru toate elementele din a doua perioadă, primul strat de electroni este umplut, iar electronii umplu orbitalii e și p ai celui de-al doilea strat de electroni în conformitate cu principiul energiei minime (întâi s-, apoi p) și Pauli și Reguli Hund (Tabelul 2).
În atomul de neon, al doilea strat de electroni este complet - are 8 electroni.
Tabelul 2 Structura învelișurilor electronice ale atomilor elementelor din a doua perioadă
Sfârșitul mesei. 2 
Li, Be - elemente b.
B, C, N, O, F, Ne sunt elemente p acești atomi au orbitali p umpluți cu electroni.
Elemente ale perioadei a treia
Pentru atomii elementelor din a treia perioadă, primul și al doilea strat electronic sunt completați, astfel încât al treilea strat electronic este umplut, în care electronii pot ocupa subnivelurile 3s, 3p și 3d (Tabelul 3).
Tabelul 3 Structura învelișurilor electronice ale atomilor elementelor din perioada a treia

Atomul de magneziu își completează orbitalul de electroni 3s. Elementele Na și Mg-s. 
Un atom de argon are 8 electroni în stratul său exterior (al treilea strat de electroni). Ca strat exterior, este complet, dar în total în al treilea strat de electroni, după cum știți deja, pot exista 18 electroni, ceea ce înseamnă că elementele din a treia perioadă au orbitali 3d neumpluți.
Toate elementele de la Al la Ar sunt elemente p. Elementele s și p formează principalele subgrupe din Tabelul Periodic.
Un al patrulea strat de electroni apare în atomii de potasiu și calciu, iar subnivelul 4s este umplut (Tabelul 4), deoarece are o energie mai mică decât subnivelul 3d. Pentru a simplifica formulele electronice grafice ale atomilor elementelor din perioada a patra: 1) să notăm formula electronică grafică convențională a argonului după cum urmează:
Ar;
2) nu vom descrie subniveluri care nu sunt umplute în acești atomi.
Tabelul 4 Structura învelișurilor electronice ale atomilor elementelor din perioada a patra


K, Ca - s-elemente incluse în principalele subgrupe. În atomii de la Sc la Zn, al treilea subnivel este umplut cu electroni. Acestea sunt elemente Zy. Ele sunt incluse în subgrupuri secundare, stratul lor electronic cel mai exterior este umplut și sunt clasificate ca elemente de tranziție.
Acordați atenție structurii carcaselor electronice ale atomilor de crom și cupru. În ele există o „eșec” a unui electron de la al 4-lea la al 3-lea subnivel, care se explică prin stabilitatea energetică mai mare a configurațiilor electronice rezultate Zd 5 și Zd 10: 
În atomul de zinc, al treilea strat de electroni este complet - toate subnivelurile 3s, 3p și 3d sunt umplute în el, cu un total de 18 electroni.
În elementele care urmează zincului, al patrulea strat de electroni, subnivelul 4p, continuă să fie umplut: Elementele de la Ga la Kr sunt elemente p. 
Atomul criptonului are un strat exterior (al patrulea) care este complet și are 8 electroni. Dar în total în al patrulea strat de electroni, după cum știți, pot fi 32 de electroni; atomul de cripton are încă subnivelurile 4d și 4f neumplute.
Pentru elementele din perioada a cincea, subnivelurile sunt completate în următoarea ordine: 5s-> 4d -> 5p. Și există și excepții asociate cu „eșecul” electronilor în 41 Nb, 42 MO etc.
În perioadele a șasea și a șaptea apar elemente, adică elemente în care subnivelurile 4f și, respectiv, 5f ale celui de-al treilea strat electronic exterior sunt umplute.
Elementele 4f se numesc lantanide.
Elementele 5f se numesc actinide.
Ordinea de umplere a subnivelurilor electronice în atomii elementelor din perioada a șasea: 55 Сs și 56 Ва - 6s elemente;
57 La... 6s 2 5d 1 - 5d element; 58 Ce - 71 Lu - elemente 4f; 72 Hf - 80 Hg - 5d elemente; 81 Tl- 86 Rn - 6p-elemente. Dar și aici există elemente în care ordinea de umplere a orbitalilor electronici este „încălcată”, ceea ce, de exemplu, este asociat cu o mai mare stabilitate energetică a subnivelurilor f jumătate și complet umplute, adică nf 7 și nf 14. .
În funcție de subnivelul atomului umplut cu electroni, toate elementele, așa cum ați înțeles deja, sunt împărțite în patru familii sau blocuri electronice (Fig. 7).
1) s-Elemente; subnivelul b al nivelului exterior al atomului este umplut cu electroni; elementele s includ hidrogen, heliu și elemente din principalele subgrupe ale grupelor I și II;
2) p-elemente; subnivelul p al nivelului exterior al atomului este umplut cu electroni; p elementele includ elemente ale principalelor subgrupe ale grupelor III-VIII;
3) d-elemente; subnivelul d al nivelului pre-extern al atomului este umplut cu electroni; Elementele d includ elemente ale subgrupurilor secundare ale grupelor I-VIII, adică elemente de plug-in decenii de perioade mari situate între elementele s și p. Se mai numesc si elemente de tranzitie;
4) elemente f, subnivelul f al celui de-al treilea nivel exterior al atomului este umplut cu electroni; acestea includ lantanide și actinide.
1. Ce s-ar întâmpla dacă principiul Pauli nu ar fi respectat?
2. Ce s-ar întâmpla dacă nu ar fi respectată regula lui Hund?
3. Realizați diagrame ale structurii electronice, formule electronice și formule electronice grafice ale atomilor următoarelor elemente chimice: Ca, Fe, Zr, Sn, Nb, Hf, Pa.
4. Scrieți formula electronică pentru elementul #110 folosind simbolul de gaz nobil corespunzător.
Conținutul lecției notele de lecție sprijinirea metodelor de accelerare a prezentării lecției cadru tehnologii interactive Practica sarcini și exerciții ateliere de autotestare, instruiri, cazuri, întrebări teme pentru acasă întrebări de discuție întrebări retorice de la elevi Ilustrații audio, clipuri video și multimedia fotografii, imagini, grafice, tabele, diagrame, umor, anecdote, glume, benzi desenate, pilde, proverbe, cuvinte încrucișate, citate Suplimente rezumate articole trucuri pentru pătuțurile curioși manuale dicționar de bază și suplimentar de termeni altele Îmbunătățirea manualelor și lecțiilorcorectarea erorilor din manual actualizarea unui fragment dintr-un manual, elemente de inovație în lecție, înlocuirea cunoștințelor învechite cu altele noi Doar pentru profesori lecții perfecte planul calendaristic pentru anul recomandări metodologice programe de discuții Lecții integrateFizicianul elvețian W. Pauli în 1925 a stabilit că într-un atom dintr-un orbital nu pot exista mai mult de doi electroni având spini opuși (antiparaleli) (tradus din engleză ca „fus”), adică având astfel de proprietăți care pot fi convenționale. s-a imaginat ca rotația unui electron în jurul axei sale imaginare: în sensul acelor de ceasornic sau în sens invers acelor de ceasornic. Acest principiu se numește principiul Pauli.
Dacă există un electron în orbital, atunci se numește nepereche dacă sunt doi, atunci aceștia sunt electroni perechi, adică electroni cu spini opuși;
Figura 5 prezintă o diagramă a împărțirii nivelurilor de energie în subniveluri.
S-Orbitalul, după cum știți deja, are o formă sferică. Electronul atomului de hidrogen (s = 1) este situat în acest orbital și este nepereche. Prin urmare, formula sa electronică sau configurația electronică se va scrie după cum urmează: 1s 1. În formulele electronice, numărul nivelului de energie este indicat de numărul care precede litera (1 ...), litera latină indică subnivelul (tipul de orbital), iar numărul scris în dreapta sus a literei (ca un exponent) arată numărul de electroni din subnivel.
Pentru un atom de heliu He, care are doi electroni perechi într-un orbital s, această formulă este: 1s 2.
Învelișul de electroni a atomului de heliu este complet și foarte stabil. Heliul este un gaz nobil.
La al doilea nivel de energie (n = 2) există patru orbiti: unul s și trei p. Electronii orbitalului s de al doilea nivel (orbitalii 2s) au o energie mai mare, deoarece se află la o distanță mai mare de nucleu decât electronii orbitalului 1s (n = 2).
În general, pentru fiecare valoare a lui n există câte un orbital s, dar cu o sursă corespunzătoare de energie electronică și, prin urmare, cu un diametru corespunzător, crescând pe măsură ce valoarea lui n crește.
R-Orbitalul are forma unei gantere sau a unei figuri tridimensionale opt. Toți cei trei orbitali p sunt localizați în atom reciproc perpendicular de-a lungul coordonatelor spațiale trasate prin nucleul atomului. Trebuie subliniat încă o dată că fiecare nivel de energie (stratul electronic), începând de la n = 2, are trei p-orbitali. Pe măsură ce valoarea lui n crește, electronii ocupă orbitali p situati la distanțe mari de nucleu și direcționați de-a lungul axelor x, y, z.
Pentru elementele din a doua perioadă (n = 2), mai întâi este umplut un orbital b și apoi trei orbitali p. Formula electronică 1l: 1s 2 2s 1. Electronul este legat mai slab de nucleul atomului, astfel încât atomul de litiu poate renunța cu ușurință la el (după cum vă amintiți, acest proces se numește oxidare), transformându-se într-un ion Li+.
În atomul de beriliu Be 0, al patrulea electron este situat și în orbitalul 2s: 1s 2 2s 2. Cei doi electroni exteriori ai atomului de beriliu sunt ușor separați - Be 0 este oxidat în cationul Be 2+.
În atomul de bor, al cincilea electron ocupă orbitalul 2p: 1s 2 2s 2 2p 1. Apoi, atomii C, N, O, E sunt umpluți cu orbitali 2p, care se termină cu neonul de gaz nobil: 1s 2 2s 2 2p 6.
Pentru elementele perioadei a treia, orbitalii Sv și respectiv Sr sunt umpluți. Cinci d-orbitali ai celui de-al treilea nivel rămân liberi:
Uneori, în diagramele care descriu distribuția electronilor în atomi, este indicat doar numărul de electroni la fiecare nivel de energie, adică sunt scrise formule electronice abreviate ale atomilor elementelor chimice, spre deosebire de formulele electronice complete date mai sus.
Pentru elementele de perioade mari (a patra și a cincea), primii doi electroni ocupă orbitalii 4 și 5, respectiv: 19 K 2, 8, 8, 1; 38 Sr 2, 8, 18, 8, 2. Începând cu al treilea element al fiecărei perioade majore, următorii zece electroni vor intra în orbitalii anteriori 3d, respectiv 4d (pentru elementele subgrupurilor laterale): 23 V 2, 8, 11, 2; 26 Tr 2, 8, 14, 2; 40 Zr 2, 8, 18, 10, 2; 43 Tg 2, 8, 18, 13, 2. De regulă, atunci când subnivelul d anterior este umplut, subnivelul exterior (4p- și 5p-respectiv) p va începe să se umple.
Pentru elementele de perioade mari - al șaselea și al șaptelea incomplet - nivelurile și subnivelurile electronice sunt umplute cu electroni, de regulă, astfel: primii doi electroni vor merge la subnivelul β exterior: 56 Va 2, 8, 18, 18, 8, 2; 87Gg 2, 8, 18, 32, 18, 8, 1; următorul electron (pentru Na și Ac) față de cel anterior (subnivelul p: 57 La 2, 8, 18, 18, 9, 2 și 89 Ac 2, 8, 18, 32, 18, 9, 2.
Apoi următorii 14 electroni vor intra în al treilea nivel exterior de energie în orbitalii 4f și 5f ai lantanidelor și, respectiv, actinidelor.
Apoi, al doilea nivel de energie externă (subnivelul d) va începe să se acumuleze din nou: pentru elementele subgrupurilor laterale: 73 Ta 2, 8.18, 32.11, 2; 104 Rf 2, 8.18, 32, 32.10, 2, - și, în cele din urmă, numai după ce nivelul curent este complet umplut cu zece electroni va fi umplut din nou p-subnivelul exterior:
86 Rn 2, 8, 18, 32, 18, 8.
Foarte des, structura învelișurilor electronice ale atomilor este descrisă folosind energie sau celule cuantice - sunt scrise așa-numitele formule electronice grafice. Pentru această notație se folosește următoarea notație: fiecare celulă cuantică este desemnată de o celulă care corespunde unui orbital; Fiecare electron este indicat de o săgeată corespunzătoare direcției de spin. Când scrieți o formulă electronică grafică, ar trebui să vă amintiți două reguli: principiul Pauli, conform căruia nu pot exista mai mult de doi electroni într-o celulă (orbital), dar cu spin antiparalel, și regula lui F. Hund, conform căreia electronii ocupă celule libere (orbitali) și sunt situate în La început, sunt unul câte unul și au aceeași valoare de spin și abia apoi se perechează, dar spinurile vor fi direcționate invers conform principiului Pauli.
În concluzie, să luăm din nou în considerare afișarea configurațiilor electronice ale atomilor elementelor în funcție de perioadele sistemului D.I. Diagramele structurii electronice a atomilor arată distribuția electronilor de-a lungul straturilor electronice (nivelurile de energie). 
Într-un atom de heliu, primul strat de electroni este complet - are 2 electroni.
Hidrogenul și heliul sunt elemente s; orbitalul s al acestor atomi este umplut cu electroni.
Elemente ale perioadei a doua
Pentru toate elementele din a doua perioadă, primul strat de electroni este umplut, iar electronii umplu orbitalii e și p ai celui de-al doilea strat de electroni în conformitate cu principiul energiei minime (întâi s-, apoi p) și Pauli și Reguli Hund (Tabelul 2).
În atomul de neon, al doilea strat de electroni este complet - are 8 electroni.
Tabelul 2 Structura învelișurilor electronice ale atomilor elementelor din a doua perioadă
Sfârșitul mesei. 2 
Li, Be sunt elemente b.
B, C, N, O, F, Ne sunt elemente p acești atomi au orbitali p umpluți cu electroni.
Elemente ale perioadei a treia
Pentru atomii elementelor din a treia perioadă, primul și al doilea strat electronic sunt completați, astfel încât al treilea strat electronic este umplut, în care electronii pot ocupa subnivelurile 3s, 3p și 3d (Tabelul 3).
Tabelul 3 Structura învelișurilor electronice ale atomilor elementelor din perioada a treia

Atomul de magneziu își completează orbitalul de electroni 3s. Na și Mg sunt elemente s. 
Un atom de argon are 8 electroni în stratul său exterior (al treilea strat de electroni). Ca strat exterior, este complet, dar în total în al treilea strat de electroni, după cum știți deja, pot exista 18 electroni, ceea ce înseamnă că elementele din a treia perioadă au orbitali 3d neumpluți.
Toate elementele de la Al la Ar sunt elemente p. Elementele s și p formează principalele subgrupe din Tabelul Periodic.
Un al patrulea strat de electroni apare în atomii de potasiu și calciu, iar subnivelul 4s este umplut (Tabelul 4), deoarece are o energie mai mică decât subnivelul 3d. Pentru a simplifica formulele electronice grafice ale atomilor elementelor din perioada a patra: 1) să notăm formula electronică grafică convențională a argonului după cum urmează:
Ar;
2) nu vom descrie subniveluri care nu sunt umplute în acești atomi.
Tabelul 4 Structura învelișurilor electronice ale atomilor elementelor din perioada a patra


K, Ca - s-elemente incluse în principalele subgrupe. În atomii de la Sc la Zn, al treilea subnivel este umplut cu electroni. Acestea sunt elemente Zy. Ele sunt incluse în subgrupuri secundare, stratul lor electronic cel mai exterior este umplut și sunt clasificate ca elemente de tranziție.
Acordați atenție structurii carcaselor electronice ale atomilor de crom și cupru. În ele există o „eșec” a unui electron de la al 4-lea la al 3-lea subnivel, care se explică prin stabilitatea energetică mai mare a configurațiilor electronice rezultate Zd 5 și Zd 10: 
În atomul de zinc, al treilea strat de electroni este complet - toate subnivelurile 3s, 3p și 3d sunt umplute în el, cu un total de 18 electroni.
În elementele care urmează zincului, al patrulea strat de electroni, subnivelul 4p, continuă să fie umplut: Elementele de la Ga la Kr sunt elemente p. 
Atomul criptonului are un strat exterior (al patrulea) care este complet și are 8 electroni. Dar în total în al patrulea strat de electroni, după cum știți, pot fi 32 de electroni; atomul de cripton are încă subnivelurile 4d și 4f neumplute.
Pentru elementele din perioada a cincea, subnivelurile sunt completate în următoarea ordine: 5s-> 4d -> 5p. Și există și excepții asociate cu „eșecul” electronilor în 41 Nb, 42 MO etc.
În perioadele a șasea și a șaptea apar elemente, adică elemente în care subnivelurile 4f și, respectiv, 5f ale celui de-al treilea strat electronic exterior sunt umplute.
Elementele 4f se numesc lantanide.
Elementele 5f se numesc actinide.
Ordinea de umplere a subnivelurilor electronice în atomi de elemente din perioada a șasea: 55 Сs și 56 Ва - 6s elemente;
57 La... 6s 2 5d 1 - 5d element; 58 Ce - 71 Lu - elemente 4f; 72 Hf - 80 Hg - 5d elemente; 81 Tl— 86 Rn—6p elemente. Dar și aici există elemente în care ordinea de umplere a orbitalilor electronici este „încălcată”, ceea ce, de exemplu, este asociat cu o mai mare stabilitate energetică a subnivelurilor f jumătate și complet umplute, adică nf 7 și nf 14. .
În funcție de subnivelul atomului umplut cu electroni, toate elementele, așa cum ați înțeles deja, sunt împărțite în patru familii sau blocuri electronice (Fig. 7).
1) s-Elemente; subnivelul b al nivelului exterior al atomului este umplut cu electroni; elementele s includ hidrogen, heliu și elemente din principalele subgrupe ale grupelor I și II;
2) p-elemente; subnivelul p al nivelului exterior al atomului este umplut cu electroni; p elementele includ elemente ale principalelor subgrupe ale grupelor III-VIII;
3) d-elemente; subnivelul d al nivelului pre-extern al atomului este umplut cu electroni; Elementele d includ elemente ale subgrupurilor secundare ale grupelor I-VIII, adică elemente de plug-in decenii de perioade mari situate între elementele s și p. Se mai numesc si elemente de tranzitie;
4) elemente f, subnivelul f al celui de-al treilea nivel exterior al atomului este umplut cu electroni; acestea includ lantanide și actinide.
1. Ce s-ar întâmpla dacă principiul Pauli nu ar fi respectat?
2. Ce s-ar întâmpla dacă nu ar fi respectată regula lui Hund?
3. Realizați diagrame ale structurii electronice, formule electronice și formule electronice grafice ale atomilor următoarelor elemente chimice: Ca, Fe, Zr, Sn, Nb, Hf, Pa.
4. Scrieți formula electronică pentru elementul #110 folosind simbolul de gaz nobil corespunzător.
5. Ce este o „cufundare” a electronilor? Dați exemple de elemente în care se observă acest fenomen, notați-le formulele electronice.
6. Cum se determină apartenența unui element chimic la o anumită familie electronică?
7. Comparați formulele electronice și grafice electronice ale atomului de sulf. Ce informații suplimentare conține ultima formulă?
6.6. Caracteristicile structurii electronice a atomilor de crom, cupru și alte elemente
Dacă te-ai uitat cu atenție la Anexa 4, probabil ai observat că pentru atomii unor elemente secvența de umplere a orbitalilor cu electroni este perturbată. Uneori, aceste încălcări sunt numite „excepții”, dar nu este așa - nu există excepții de la legile naturii!
Primul element cu această tulburare este cromul. Să aruncăm o privire mai atentă asupra structurii sale electronice (Fig. 6.16 O). Atomul de crom are 4 s-nu există două subniveluri, așa cum ne-am aștepta, ci doar un electron. Dar la 3 d-subnivelul are cinci electroni, dar acest subnivel este umplut după 4 s-subnivel (vezi Fig. 6.4). Pentru a înțelege de ce se întâmplă acest lucru, să ne uităm la ce sunt norii de electroni 3 d-subnivelul acestui atom.
Fiecare din cinci 3 d-norii in acest caz sunt formati dintr-un electron. După cum știți deja din § 4 al acestui capitol, norul de electroni total al acestor cinci electroni are o formă sferică sau, după cum se spune, simetric sferic. În funcție de natura distribuției densității electronilor în direcții diferite, aceasta este similară cu 1 s-EO. Energia subnivelului ai cărui electroni formează un astfel de nor se dovedește a fi mai mică decât în cazul unui nor mai puțin simetric. În acest caz, energia orbitală este 3 d-subnivelul este egal cu energia 4 s-orbitali. Când simetria este întreruptă, de exemplu, când apare un al șaselea electron, energia orbitalilor este 3 d-subnivelul devine din nou mai mare decât energia 4 s-orbitali. Prin urmare, atomul de mangan are din nou un al doilea electron la 4 s-AO.
Norul general al oricărui subnivel, umplut cu electroni fie pe jumătate, fie complet, are simetrie sferică. Scăderea energiei în aceste cazuri este caracter generalși nu depinde de faptul dacă orice subnivel este plin pe jumătate sau complet cu electroni. Și dacă da, atunci trebuie să căutăm următoarea încălcare a atomului în a cărui înveliș de electroni „ajunge” ultima. d-electron. Într-adevăr, atomul de cupru are 3 d-subnivelul are 10 electroni și 4 s- doar un subnivel (Fig. 6.16 b).
Scăderea energiei orbitalilor unui subnivel complet sau pe jumătate umplut provoacă o serie de fenomene chimice importante, dintre care unele vă veți familiariza.
6.7. Electroni exteriori și de valență, orbitali și subniveluri
În chimie, proprietățile atomilor izolați, de regulă, nu sunt studiate, deoarece aproape toți atomii, atunci când fac parte din diferite substanțe, formează legături chimice. Legăturile chimice se formează prin interacțiunea învelișurilor de electroni ale atomilor. Pentru toți atomii (cu excepția hidrogenului), nu toți electronii participă la formarea legăturilor chimice: borul are trei din cinci electroni, carbonul are patru din șase și, de exemplu, bariul are doi din cincizeci și șase. Acești electroni „activi” se numesc electroni de valență.
Electronii de valență sunt uneori confundați cu extern electroni, dar acesta nu este același lucru.
Norii electronici de electroni exteriori au o rază maximă (și o valoare maximă a numărului cuantic principal).

Electronii exteriori sunt cei care iau parte la formarea legăturilor în primul rând, chiar dacă numai pentru că atunci când atomii se apropie unul de altul, norii de electroni formați de acești electroni intră în contact în primul rând. Dar, împreună cu ei, și unii electroni pot lua parte la formarea unei legături. pre-externă(penultimul) strat, dar numai dacă au o energie nu foarte diferită de energia electronilor exteriori. Ambii electroni ai unui atom sunt electroni de valență. (În lantanide și actinide, chiar și unii electroni „exteriori” sunt de valență)
Energia electronilor de valență este mult mai mare decât energia altor electroni ai atomului, iar electronii de valență diferă semnificativ mai puțin în energie unul de celălalt.
Electronii externi sunt întotdeauna electroni de valență numai dacă atomul poate forma legături chimice. Astfel, ambii electroni ai atomului de heliu sunt externi, dar nu pot fi numiți valență, deoarece atomul de heliu nu formează deloc legături chimice.
Electronii de valență ocupă orbitali de valență, care la rândul lor formează subnivelurile de valență.

Ca exemplu, luați în considerare un atom de fier, a cărui configurație electronică este prezentată în Fig. 6.17. Dintre electronii unui atom de fier, numărul cuantic principal maxim ( n= 4) au doar două 4 s-electron. În consecință, ei sunt electronii exteriori ai acestui atom. Orbitii externi ai atomului de fier sunt toți orbitali cu n= 4, iar subnivelurile exterioare sunt toate subnivelurile formate de acești orbitali, adică 4 s-,
4p-, 4d- și 4 f-EPU.
Electronii externi sunt întotdeauna electroni de valență, deci 4 s-electronii atomului de fier sunt electroni de valență. Și dacă da, atunci 3 d-electronii cu energie ceva mai mare vor fi si electroni de valenta. La nivelul extern al atomului de fier, în plus față de 4 umplut s-AO mai sunt 4 gratuite p-, 4d- și 4 f-AO. Toate sunt externe, dar doar 4 dintre ele sunt de valență r-AO, deoarece energia orbitalilor ramasi este mult mai mare, iar aparitia electronilor in acesti orbitali nu este benefica atomului de fier.
Deci, atomul de fier
nivel electronic extern - al patrulea,
subniveluri externe – 4 s-, 4p-, 4d- și 4 f-EPU,
orbitalii externi - 4 s-, 4p-, 4d- și 4 f-AO,
electroni exteriori – doi 4 s-electron (4 s 2),
stratul electronic exterior - al patrulea,
nor de electroni extern – 4 s-EO
subnivele de valență – 4 s-, 4p- și 3 d-EPU,
orbitali de valență – 4 s-, 4p- și 3 d-AO,
electroni de valență – doi 4 s-electron (4 s 2) și șase 3 d-electroni (3 d 6).
Subnivelurile de valență pot fi umplute parțial sau complet cu electroni sau pot rămâne complet libere. Pe măsură ce sarcina nucleară crește, valorile energetice ale tuturor subnivelurilor scad, dar datorită interacțiunii electronilor între ei, energia diferitelor subniveluri scade la diferite „viteze”. Energie complet umplută d- Și f-subnivelurile scade atât de mult încât încetează să mai fie valență.
Ca exemplu, luați în considerare atomii de titan și arsen (Fig. 6.18).

În cazul atomului de titan 3 d-EPU este doar parțial umplut cu electroni, iar energia sa este mai mare decât energia 4 s-EPU și 3 d-electronii sunt valenta. Atomul de arsen are 3 d-EPU este complet umplut cu electroni, iar energia sa este semnificativ mai mică decât energia lui 4 s-EPU și, prin urmare, 3 d-electronii nu sunt valență.
În exemplele date, am analizat configurația electronilor de valență atomi de titan și arsen.
Configurația electronică de valență a unui atom este descrisă ca formula electronului de valență, sau sub formă diagrama energetică a subnivelurilor de valență.
ELECTRONI DE VALENTA, ELECTRONI EXTERNI, VALENCE EPU, VALENCE AO, VALENCE ELECTRON CONFIGURAREA UNUI ATOM, VALENCE ELECTRON FORMULA, VALENCE SCHEMA SUBNIVELELE.
1. Pe diagramele energetice pe care le-ați întocmit și în formulele electronice complete ale atomilor Na, Mg, Al, Si, P, S, Cl, Ar, indicați electronii exteriori și de valență. Scrieți formulele electronice de valență ale acestor atomi. Pe diagramele energetice, evidențiați părțile corespunzătoare diagramelor energetice ale subnivelurilor de valență.
2. Ce au în comun configurațiile electronice ale atomilor: a) Li și Na, B și Al, O și S, Ne și Ar; b) Zn şi Mg, Sc şi Al, Cr şi S, Ti şi Si; c) H și He, Li și O, K și Kr, Sc și Ga. Care sunt diferențele lor?
3. Câte subniveluri de valență sunt în învelișul electronic al unui atom al fiecărui element: a) hidrogen, heliu și litiu, b) azot, sodiu și sulf, c) potasiu, cobalt și germaniu
4. Câți orbitali de valență sunt complet umpluți în a) bor, b) fluor, c) atom de sodiu?
5. Câți orbitali cu un electron nepereche are un atom: a) bor, b) fluor, c) fier
6. Câți orbiti exteriori liberi are atomul de mangan? Câte valențe libere?
7.Pentru lecția următoare, pregătiți o bandă de hârtie de 20 mm lățime, împărțiți-o în celule (20 × 20 mm) și aplicați o serie naturală de elemente (de la hidrogen la meitnerium) pe această bandă.
8. În fiecare celulă, plasați simbolul elementului, numărul său atomic și formula electronului de valență, așa cum se arată în Fig. 6.19 (utilizați Anexa 4).

6.8. Sistematizarea atomilor în funcție de structura învelișurilor lor de electroni
Sistematizarea elementelor chimice se bazează pe seria naturală de elemente
Şi principiul asemănării învelișurilor de electroni atomii lor.
Sunteți deja familiarizat cu seria naturală de elemente chimice. Acum să ne familiarizăm cu principiul asemănării shell-urilor electronice.
Având în vedere formulele electronice de valență ale atomilor din ERE, este ușor de descoperit că pentru unii atomi diferă doar în valorile numărului cuantic principal. De exemplu, 1 s 1 pentru hidrogen, 2 s 1 pentru litiu, 3 s 1 pentru sodiu etc. Sau 2 s 2 2p 5 pentru fluor, 3 s 2 3p 5 pentru clor, 4 s 2 4p 5 pentru brom etc. Aceasta înseamnă că regiunile exterioare ale norilor de electroni de valență ai unor astfel de atomi sunt foarte asemănătoare ca formă și diferă doar în dimensiune (și, desigur, densitatea electronilor). Și dacă da, atunci pot fi numiți norii de electroni ai unor astfel de atomi și configurațiile de valență corespunzătoare asemănătoare. Pentru atomi de elemente diferite cu configurații electronice similare putem scrie formule electronice de valență generală: ns 1 în primul caz și ns 2 n.p. 5 în al doilea. Pe măsură ce vă deplasați prin seria naturală de elemente, puteți găsi alte grupuri de atomi cu configurații de valență similare.
Astfel, atomi cu configurații electronice de valență similare se găsesc în mod regulat în seria naturală de elemente.
Acesta este principiul asemănării shell-urilor electronice.
Să încercăm să identificăm tipul acestei regularități. Pentru a face acest lucru, vom folosi seria naturală de elemente pe care le-ați realizat.

ERE începe cu hidrogen, a cărui formulă electronică de valență este 1 s 1. În căutarea unor configurații de valență similare, tăiem seria naturală de elemente în fața elementelor cu o formulă electronică de valență comună ns 1 (adică înainte de litiu, înainte de sodiu etc.). Am primit așa-numitele „perioade” elementelor. Să adăugăm „perioadele” rezultate, astfel încât acestea să devină rânduri de tabel (vezi Fig. 6.20). Ca rezultat, numai atomii din primele două coloane ale tabelului vor avea configurații electronice similare.
Să încercăm să obținem similaritatea configurațiilor electronice de valență în alte coloane ale tabelului. Pentru a face acest lucru, decupăm din perioadele a 6-a și a 7-a elemente cu numerele 58 – 71 și 90 – 103 (ele umple 4 f- și 5 f-subniveluri) și așezați-le sub masă. Vom muta orizontal simbolurile elementelor rămase, așa cum se arată în figură. După aceasta, atomii elementelor situați în aceeași coloană a tabelului vor avea configurații de valență similare, care pot fi exprimate prin formule electronice de valență generale: ns 1 , ns 2 , ns 2 (n–1)d 1 , ns 2 (n–1)d 2 și așa mai departe până când ns 2 n.p. 6. Toate abaterile de la formulele generale de valență sunt explicate prin aceleași motive ca și în cazul cromului și cuprului (vezi paragraful 6.6).
După cum puteți vedea, utilizând ERE și aplicând principiul similarității învelișurilor de electroni, am reușit să sistematizăm elemente chimice. Un astfel de sistem de elemente chimice se numește natural, deoarece se bazează exclusiv pe legile Naturii. Tabelul pe care l-am primit (Fig. 6.21) este una dintre modalitățile de a descrie grafic un sistem natural de elemente și se numește tabel cu perioade lungi de elemente chimice.

PRINCIPIUL DE SIMILITATE AL COCHILEI ELECTRONICE, SISTEMUL NATURAL AL ELEMENTELOR CHIMICE (SISTEMUL „PERIODIC”), TABEL ELEMENTELOR CHIMICE.
6.9. Tabel cu perioade lungi de elemente chimice
Să aruncăm o privire mai atentă asupra structurii tabelului cu perioade lungi de elemente chimice.
Rândurile acestui tabel, după cum știți deja, sunt numite „perioade” de elemente. Perioadele sunt numerotate cifre arabe de la 1 la 7. Sunt doar două elemente în prima perioadă. Se numesc a doua și a treia perioadă, care conțin fiecare câte opt elemente scurt perioade. Se numesc perioadele a patra și a cincea, care conțin 18 elemente fiecare lung perioade. Se numesc perioadele a șasea și a șaptea, care conțin fiecare 32 de elemente extra lung perioade.
Se numesc coloanele acestui tabel grupuri elemente. Numerele grupelor sunt indicate prin cifre romane cu litere latine A sau B.
Elementele unor grupuri au propriile nume comune (de grup): elemente ale grupului IA (Li, Na, K, Rb, Cs, Fr) – elemente alcaline(sau elemente din metale alcaline); Elemente din grupa IIA (Ca, Sr, Ba și Ra) – elemente alcalino-pământoase(sau elemente de metal alcalino-pământos)(Nume " metale alcaline„și metalele alcalino-pământoase” se referă la substanțele simple formate din elementele corespunzătoare și nu trebuie folosite ca denumiri pentru grupuri de elemente); elemente din grupa VIA (O, S, Se, Te, Po) – calcogeni, elemente din grupa VIIA (F, Cl, Br, I, At) – halogeni, elemente din grupa VIII (He, Ne, Ar, Kr, Xe, Rn) – elemente de gaze nobile.(Numele tradițional „gaze nobile” se referă și la substanțe simple)
Elementele cu numerele de serie 58 – 71 (Ce – Lu) plasate de obicei în partea de jos a tabelului se numesc lantanide(„urmează lantanul”) și elemente cu numere de serie 90 – 103 (Th – Lr) – actinide(„în urma anemonei de mare”). Există o versiune a tabelului cu perioade lungi, în care lantanidele și actinidele nu sunt decupate din ERE, ci rămân la locul lor în perioade ultra-lungi. Acest tabel este uneori numit perioadă ultra-lungă.
Tabelul cu perioade lungi este împărțit în patru bloc(sau secțiuni).
s-Block include elemente ale grupurilor IA și IIA cu formule electronice de valență comune ns 1 și ns 2
(s-elemente).
r-Block include elemente din grupa IIIA la VIIIA cu formule electronice de valență comune din ns 2 n.p. 1 la ns 2 n.p. 6 (p-elemente).
d-Block include elemente din grupa IIIB la IIB cu formule electronice de valență comune din ns 2 (n–1)d 1 la ns 2 (n–1)d 10 (d-elemente).
f-Block include lantanide și actinide ( elemente f).

Elemente s- Și p-blocurile formează grupuri A și elemente d-bloc – grupa B a sistemului de elemente chimice. Toate f-elementele sunt incluse formal în grupa IIIB.
Elementele primei perioade - hidrogenul și heliul - sunt s-elemente şi pot fi încadrate în grupele IA şi IIA. Dar heliul este mai des plasat în grupa VIIIA ca element cu care se încheie perioada, ceea ce este pe deplin în concordanță cu proprietățile sale (heliul, ca toate celelalte substanțe simple format din elemente din acest grup este un gaz nobil). Hidrogenul este adesea plasat în grupa VIIA, deoarece proprietățile sale sunt mult mai apropiate de halogeni decât de elementele alcaline.
Fiecare perioadă a sistemului începe cu un element având o configurație de valență a atomilor ns 1, deoarece de la acești atomi începe formarea următorului strat electronic și se termină cu un element cu configurația de valență a atomilor ns 2 n.p. 6 (cu excepția primei perioade). Acest lucru îl face ușor de evidențiat diagrama energetică grupuri de subniveluri umplute cu electroni în atomii fiecărei perioade (Fig. 6.22). Faceți această lucrare cu toate subnivelurile afișate în copia pe care ați făcut-o din Figura 6.4. Subnivelurile evidențiate în Figura 6.22 (cu excepția celor complet umplute d- Și f-subnivelurile) sunt valența pentru atomii tuturor elementelor unei perioade date.
Apariția în perioade s-, p-, d- sau f-elementele corespund pe deplin secvenței de umplere s-, p-, d- sau f-subniveluri cu electroni. Această caracteristică a sistemului de elemente permite, cunoscând perioada și grupul din care face parte un anumit element, să se noteze imediat formula electronică de valență.
TABEL DE PERIOADA LUNGĂ AL ELEMENTELOR CHIMICE, BLOCURI, PERIOADE, GRUPURI, ELEMENTE ALCALINE, ELEMENTE ALCALINE PĂMÂNTERE, CALCOGENI, HALOGENI, ELEMENTE DE GAZ NOBILE, LANTANOIDE, ACTINOIDE.
Scrieți formulele electronice de valență generale ale atomilor elementelor a) grupărilor IVA și IVB, b) grupărilor IIIA și VIIB?
2. Ce au în comun configurațiile electronice ale atomilor elementelor grupelor A și B? Cum sunt ele diferite?
3. Câte grupuri de elemente sunt incluse în a) s-bloc, b) r-bloc, c) d-bloc?
4.Continuați Figura 30 în direcția creșterii energiei subnivelurilor și evidențiați grupuri de subniveluri pline cu electroni în perioadele a 4-a, a 5-a și a 6-a.
5. Enumerați subnivelurile de valență ale a) calciului, b) fosforului, c) titanului, d) clorului, e) atomilor de sodiu. 6. Precizați cum diferă elementele s-, p- și d-una de alta.
7.Explicați de ce apartenența unui atom în orice element este determinată de numărul de protoni din nucleu și nu de masa acestui atom.
8.Pentru atomii de litiu, aluminiu, stronțiu, seleniu, fier și plumb, compuneți formule electronice de valență, complete și abreviate și desenați diagrame energetice ale subnivelurilor de valență. 9. Care atomi de element corespund următoarelor formule electronice de valență: 3 s 1 , 4s 1 3d 1, 2s 2 2 p 6 , 5s 2 5p 2 , 5s 2 4d 2 ?
6.10. Tipuri de formule electronice ale atomului. Algoritm pentru compilarea lor
Pentru scopuri diferite, trebuie să cunoaștem configurația totală sau de valență a unui atom. Fiecare dintre aceste configurații electronice poate fi reprezentată fie printr-o formulă, fie printr-o diagramă energetică. adica configurația electronică completă a unui atom este exprimat formula electronică completă a unui atom, sau diagrama energetică completă a unui atom. La rândul său, configurația electronilor de valență a unui atom este exprimat valenţă(sau cum este adesea numit, " scurt") formula electronică a atomului, sau diagrama subnivelurilor de valență ale unui atom(Fig. 6.23).

Anterior, am făcut formule electronice pentru atomi folosind numerele atomice ale elementelor. În același timp, am determinat succesiunea de umplere a subnivelurilor cu electroni conform diagramei energetice: 1 s, 2s,
2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p,
6s, 4f, 5d, 6p, 7sși așa mai departe. Și doar notând formula electronică completă am putea scrie formula de valență.
Este mai convenabil să scrieți formula electronică de valență a unui atom, care este cel mai des folosită, pe baza poziției elementului în sistemul de elemente chimice, folosind coordonatele perioadei-grup.
Să aruncăm o privire mai atentă la modul în care se face acest lucru pentru elemente s-, p- Și d-blocuri
Pentru elemente s-bloc de valență formula electronică a unui atom este formată din trei simboluri. În general, se poate scrie după cum urmează:
În primul rând (în locul celulei mari) se plasează numărul perioadei (egal cu numărul cuantic principal al acestor s-electroni), iar pe al treilea (în superscript) - numărul grupului (egal cu numărul de electroni de valență). Luând atomul de magneziu (a treia perioadă, grupa IIA) ca exemplu, obținem:
Pentru elemente p- formula electronică de valență de bloc a unui atom constă din șase simboluri:
![]()
Aici, în locul celulelor mari, este plasat și numărul perioadei (egal cu numărul cuantic principal al acestor s- Și p-electroni), și numărul grupului ( egală cu numărul electroni de valență) se dovedește a fi egală cu suma superscriptelor. Pentru atomul de oxigen (a doua perioadă, grupa VIA) obținem:
2s 2 2p 4 .
Formula electronică de valență a majorității elementelor d-block poate fi scris astfel:
Ca și în cazurile anterioare, aici în locul primei celule se pune numărul perioadei (egal cu numărul cuantic principal al acestor s-electroni). Numărul din a doua celulă se dovedește a fi cu unul mai puțin, deoarece numărul cuantic principal al acestora d-electroni. Numărul grupului de aici este, de asemenea, egal cu suma indicilor. Exemplu – formula electronică de valență a titanului (perioada a 4-a, grupa IVB): 4 s 2 3d 2 .
Numărul grupului este egal cu suma indicilor pentru elementele grupului VIB, dar, după cum vă amintiți, în valența acestora s-subnivelul are un singur electron, iar formula electronică de valență generală este ns 1 (n–1)d 5. Prin urmare, formula electronică de valență, de exemplu, a molibdenului (perioada a 5-a) este 5 s 1 4d 5 .
De asemenea, este ușor să compuneți formula electronică de valență a oricărui element al grupului IB, de exemplu, aur (perioada a 6-a)>–>6 s 1 5d 10, dar în acest caz trebuie să vă amintiți asta d- electronii atomilor elementelor acestui grup rămân în continuare valenți, iar unii dintre ei pot participa la formarea legăturilor chimice.
Formula electronică de valență generală a atomilor elementelor din grupa IIB este ns 2 (n – 1)d 10. Prin urmare, formula electronică de valență, de exemplu, a unui atom de zinc este 4 s 2 3d 10 .
Formulele electronice de valență ale elementelor primei triade (Fe, Co și Ni) respectă și ele reguli generale. Fierul, un element din grupa VIIIB, are o formulă electronică de valență de 4 s 2 3d 6. Atomul de cobalt are unul d-electron mai mult (4 s 2 3d 7), iar pentru atomul de nichel - cu doi (4 s 2 3d 8).
Folosind doar aceste reguli pentru scrierea formulelor electronice de valență, este imposibil să compuneți formule electronice pentru atomii unora d-elemente (Nb, Ru, Rh, Pd, Ir, Pt), deoarece în ele, datorită dorinței de învelișuri de electroni foarte simetrice, umplerea subnivelurilor de valență cu electroni are unele caracteristici suplimentare.
Cunoscând formula electronică de valență, puteți nota formula electronică completă a atomului (vezi mai jos).
Adesea, în loc de formule electronice complete greoaie, ei scriu formule electronice prescurtate atomi. Pentru a le compila în formula electronică, toți electronii atomului, cu excepția celor de valență, sunt izolați, simbolurile lor sunt plasate între paranteze drepte, iar partea din formula electronică corespunzătoare formulei electronice a atomului ultimului element al perioada anterioară (elementul care formează un gaz nobil) este înlocuită cu simbolul acestui atom.
Exemple de formule electronice de diferite tipuri sunt date în Tabelul 14.
Tabelul 14. Exemple de formule electronice ale atomilor
Formule electronice |
|||
Abreviat |
Valenţă |
||
1s 2 2s 2 2p 3 |
2s 2 2p 3 |
2s 2 2p 3 |
|
1s 2 2s 2 2p 6 3s 2 3p 5 |
3s 2 3p 5 |
3s 2 3p 5 |
|
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 |
4s 2 3d 5 |
4s 2 3d 5 |
|
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 |
4s 2 4p 3 |
4s 2 4p 3 |
|
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 |
4s 2 4p 6 |
4s 2 4p 6 |
|
Algoritm pentru compilarea formulelor electronice ale atomilor (folosind exemplul atomului de iod)
№ |
Operațiunea |
Rezultat |
|
Determinați coordonatele atomului din tabelul elementelor. |
Perioada 5, grupa VIIA |
||
Scrieți formula electronului de valență. |
5s 2 5p 5 |
||
Completați simbolurile pentru electronii interiori în ordinea în care aceștia umplu subnivelurile. |
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 |
||
Având în vedere scăderea energiei de umplut complet d- Și f-subniveluri, notează formula electronică completă. |
|
||
Etichetați electronii de valență. |
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 |
||
Identificați configurația electronică a atomului de gaz nobil anterior. |
|||
Notați formula electronică prescurtată combinând totul între paranteze drepte nevalent electronii. |
5s 2 5p 5 |
Note
1. Pentru elementele perioadei a 2-a și a 3-a, a treia operație (fără a patra) duce imediat la formula electronică completă.
2. (n – 1)d 10 -Electronii rămân valenți pe atomii elementelor din grupa IB.
FORMULĂ ELECTRONICĂ COMPLETĂ, FORMULĂ ELECTRONICĂ VALENCE, FORMULĂ ELECTRONICĂ SCURTATĂ, ALGORITM PENTRU COMPILAREA FORMULELOR ELECTRONICE ALE ATOMILOR.
1. Alcătuiți formula electronică de valență a unui atom al elementului a) a doua perioadă a celui de-al treilea grup A, b) a treia perioadă a celui de-al doilea grup A, c) a patra perioadă a celui de-al patrulea grup A.
2. Faceți formule electronice abreviate pentru atomii de magneziu, fosfor, potasiu, fier, brom și argon.
6.11. Tabel cu perioade scurte de elemente chimice
De-a lungul celor peste 100 de ani care au trecut de la descoperirea sistemului natural de elemente, au fost propuse câteva sute de tabele diferite care reflectă grafic acest sistem. Dintre acestea, pe lângă tabelul cu perioade lungi, cel mai răspândit este așa-numitul tabel al elementelor cu perioade scurte de D. I. Mendeleev. Un tabel cu perioade scurte se obține dintr-un tabel cu perioade lungi dacă perioadele a 4-a, a 5-a, a 6-a și a 7-a sunt tăiate în fața elementelor grupului IB, depărtate și rândurile rezultate sunt pliate în același mod ca și anterior. pliat punctele. Rezultatul este prezentat în Figura 6.24.

Lantanidele și actinidele sunt, de asemenea, plasate sub tabelul principal aici.
ÎN grupuri Acest tabel conține elemente ai căror atomi același număr de electroni de valență indiferent de ce orbitali se află acești electroni. Astfel, elementele clor (un element tipic care formează un nemetal; 3 s 2 3p 5) și mangan (un element de formare a metalelor; 4 s 2 3d 5), neavând învelișuri de electroni similare, se încadrează aici în același al șaptelea grup. Necesitatea de a distinge astfel de elemente ne obligă să le distingem în grupuri subgrupuri: principal– analogi ai grupurilor A ale tabelului cu perioade lungi și lateral– analogi ai grupurilor B. În Figura 34, simbolurile elementelor subgrupurilor principale sunt deplasate la stânga, iar simbolurile elementelor subgrupurilor secundare sunt deplasate la dreapta.
Adevărat, această aranjare a elementelor din tabel are și avantajele sale, deoarece numărul de electroni de valență determină în primul rând capacitățile de valență ale unui atom.
Tabelul cu perioade lungi reflectă legile structurii electronice a atomilor, asemănările și modelele modificărilor proprietăților substanțelor și compușilor simpli între grupuri de elemente, modificările regulate ale unui număr de mărimi fizice care caracterizează atomii, substanțele simple și compușii. în întregul sistem de elemente și multe altele. Tabelul cu perioade scurte este mai puțin convenabil în acest sens.
TABEL DE SCURTĂ, SUBGRUPE PRINCIPALE, SUBGRUPE LATERALE.
1. Convertiți tabelul cu perioade lungi pe care l-ați construit dintr-o serie naturală de elemente într-unul cu perioade scurte. Faceți conversia inversă.
2. Este posibil să se alcătuiască o formulă electronică de valență generală pentru atomii elementelor unui grup din tabelul cu perioade scurte? De ce?
6.12. Dimensiuni atomice. Raze orbitale
.Atomul nu are limite clare. Care este dimensiunea unui atom izolat? Nucleul unui atom este înconjurat de un înveliș de electroni, iar învelișul este format din nori de electroni. Mărimea EO este caracterizată de o rază r eo. Toți norii din stratul exterior au aproximativ aceeași rază. Prin urmare, dimensiunea unui atom poate fi caracterizată prin această rază. Se numește raza orbitală a atomului(r 0).
Valorile razelor orbitale ale atomilor sunt date în Anexa 5.
Raza EO depinde de sarcina nucleului și de orbital în care se află electronul care formează acest nor. În consecință, raza orbitală a unui atom depinde de aceleași caracteristici.
Să luăm în considerare învelișurile electronice ale atomilor de hidrogen și heliu. Atât în atomul de hidrogen, cât și în atomul de heliu, electronii sunt localizați la 1 s-AO, iar norii lor ar avea aceeași dimensiune dacă încărcăturile nucleelor acestor atomi ar fi aceleași. Dar sarcina de pe nucleul unui atom de heliu este de două ori mai mare decât sarcina de pe nucleul unui atom de hidrogen. Conform legii lui Coulomb, forța de atracție care acționează asupra fiecăruia dintre electronii unui atom de heliu este de două ori mai mare decât forța de atracție a unui electron către nucleul unui atom de hidrogen. Prin urmare, raza atomului de heliu trebuie să fie mult mai mică decât raza atomului de hidrogen. Asta este adevărat: r 0 (El) / r 0 (H) = 0,291 E/0,529 E 0,55.
Atomul de litiu are un electron exterior la 2 s-AO, adică formează un nor al celui de-al doilea strat. Desigur, raza sa ar trebui să fie mai mare. Serios: r 0 (Li) = 1,586 E.
Atomii elementelor rămase din a doua perioadă au electroni exteriori (și 2 s, și 2 p) sunt situate în același al doilea strat de electroni, iar sarcina nucleară a acestor atomi crește odată cu creșterea număr de serie crește. Electronii sunt atrași mai puternic de nucleu și, în mod natural, razele atomilor scad. Am putea repeta aceste argumente pentru atomii elementelor din alte perioade, dar cu o clarificare: raza orbitală scade monoton doar atunci când fiecare dintre subniveluri este umplut.
Dar dacă ignorăm detaliile, natura generală a modificării dimensiunilor atomilor într-un sistem de elemente este următoarea: cu o creștere a numărului ordinal într-o perioadă, razele orbitale ale atomilor scad, iar într-un grup ele crește. Cel mai mare atom este un atom de cesiu, iar cel mai mic este un atom de heliu, dar dintre atomii elementelor care formează compuși chimici (heliul și neonul nu îi formează), cel mai mic este un atom de fluor.
Majoritatea atomilor elementelor din seria naturală după lantanide au raze orbitale oarecum mai mici decât ar fi de așteptat pe baza legilor generale. Acest lucru se datorează faptului că între lantan și hafniu în sistemul de elemente există 14 lantanide și, prin urmare, sarcina nucleului atomului de hafniu este de 14. e mai mult decât lantan. Prin urmare, electronii externi ai acestor atomi sunt atrași de nucleu mai puternic decât ar fi în absența lantanidelor (acest efect este adesea numit „contracția lantanidelor”).
Vă rugăm să rețineți că atunci când treceți de la atomii elementelor din grupa VIIIA la atomii elementelor din grupa IA, raza orbitală crește brusc. În consecință, alegerea noastră a primelor elemente ale fiecărei perioade (vezi § 7) s-a dovedit a fi corectă.
RAZA ORBITALĂ A UNUI ATOM, SCHIMBAREA SA ÎN SISTEMUL DE ELEMENTE.
1. Conform datelor din Anexa 5, desenați pe hârtie milimetrică un grafic al dependenței razei orbitale a unui atom de numărul atomic al elementului pentru elementele cu Z de la 1 la 40. Lungimea axei orizontale este de 200 mm, lungimea axei verticale este de 100 mm.
2. Cum puteți caracteriza aspectul liniei întrerupte rezultată?
6.13. Energia de ionizare atomică
Dacă oferiți unui electron dintr-un atom energie suplimentară (veți învăța cum se poate face acest lucru la un curs de fizică), atunci electronul se poate muta în alt AO, adică atomul va ajunge în stare de excitat. Această stare este instabilă, iar electronul va reveni aproape imediat la starea inițială, iar excesul de energie va fi eliberat. Dar dacă energia transmisă electronului este suficient de mare, electronul se poate desprinde complet de atom, în timp ce atomul ionizat, adică se transformă într-un ion încărcat pozitiv ( cation). Energia necesară pentru aceasta se numește energie de ionizare atomică(EŞi).
Este destul de dificil să scoți un electron dintr-un singur atom și să măsori energia necesară pentru aceasta, așa că este practic determinat și utilizat energia de ionizare molară(E și m).
Energia de ionizare molară arată care este energia minimă necesară pentru a elimina 1 mol de electroni dintr-un mol de atomi (un electron de la fiecare atom). Această valoare este de obicei măsurată în kilojuli pe mol. Valorile energiei de ionizare molară a primului electron pentru majoritatea elementelor sunt date în Anexa 6.
Cum depinde energia de ionizare a unui atom de poziția elementului în sistemul de elemente, adică cum se schimbă în grup și perioadă?
În sensul său fizic, energia de ionizare este egală cu munca care trebuie cheltuită pentru a depăși forța de atracție dintre un electron și un atom atunci când se deplasează un electron dintr-un atom la o distanță infinită de acesta.
Unde q- sarcina electronilor, Q este sarcina cationului rămasă după îndepărtarea unui electron și r o este raza orbitală a atomului.
ŞI q, Și Q– cantitățile sunt constante și putem concluziona că munca de îndepărtare a unui electron O, și odată cu ea și energia de ionizare Eși, sunt invers proporționale cu raza orbitală a atomului.
După ce am analizat valorile razelor orbitale ale atomilor diverse elementeși valorile corespunzătoare ale energiei de ionizare date în anexele 5 și 6, puteți vedea că relația dintre aceste cantități este apropiată de proporțională, dar diferă oarecum de aceasta. Motivul pentru care concluzia noastră nu este foarte de acord cu datele experimentale este că am folosit un model foarte brut care nu a ținut cont de mulți factori importanți. Dar chiar și acest model grosier ne-a permis să tragem concluzia corectă că odată cu creșterea razei orbitale, energia de ionizare a atomului scade și, dimpotrivă, odată cu scăderea razei aceasta crește.
Întrucât într-o perioadă cu creșterea numărului atomic raza orbitală a atomilor scade, energia de ionizare crește. Într-un grup, pe măsură ce numărul atomic crește, raza orbitală a atomilor, de regulă, crește, iar energia de ionizare scade. Cea mai mare energie de ionizare molară se găsește la cei mai mici atomi, atomii de heliu (2372 kJ/mol), iar dintre atomii capabili să formeze legături chimice, atomii de fluor (1681 kJ/mol). Cel mai mic este pentru cei mai mari atomi, atomii de cesiu (376 kJ/mol). Într-un sistem de elemente, direcția creșterii energiei de ionizare poate fi prezentată schematic după cum urmează: 
În chimie, este important ca energia de ionizare să caracterizeze tendința unui atom de a renunța la electronii „săi”: cu cât energia de ionizare este mai mare, cu atât atomul este mai puțin înclinat să cedeze electroni și invers.
STARE EXCITATĂ, IONIZARE, CATION, ENERGIE DE IONIZARE, ENERGIE DE IONIZARE MOLARĂ, MODIFICAREA ENERGIEI DE IONIZARE ÎNTR-UN SISTEM DE ELEMENTE.
1. Folosind datele din Anexa 6, determinați câtă energie trebuie cheltuită pentru a elimina un electron din toți atomii de sodiu cu o masă totală de 1 g.
2. Folosind datele din Anexa 6, determinați de câte ori mai multă energie este necesară pentru a elimina un electron din toți atomii de sodiu cu o greutate de 3 g decât din toți atomii de potasiu de aceeași masă. De ce diferă acest raport de raportul energiilor de ionizare molară ale acelorași atomi?
3. Conform datelor din Anexa 6, reprezentați grafic dependența energiei de ionizare molară de numărul atomic pentru elementele cu Z de la 1 la 40. Dimensiunile graficului sunt aceleași ca în atribuirea de la paragraful anterior. Verificați dacă acest grafic corespunde alegerii „perioadelor” sistemului de elemente.
6.14. Energia afinității electronice
.A doua cea mai importantă caracteristică energetică a unui atom este energie de afinitate electronică(E Cu).
În practică, ca și în cazul energiei de ionizare, se utilizează de obicei cantitatea molară corespunzătoare - energia afinității electronilor molare().
Energia afinității electronilor molare arată energia eliberată atunci când un mol de electroni este adăugat la un mol de atomi neutri (un electron pentru fiecare atom). La fel ca energia de ionizare molară, această cantitate este măsurată și în kilojuli pe mol.
La prima vedere, poate părea că energia nu ar trebui eliberată în acest caz, deoarece un atom este o particulă neutră și nu există forțe electrostatice de atracție între un atom neutru și un electron încărcat negativ. Dimpotrivă, apropiindu-se de un atom, un electron, s-ar părea, ar trebui respins de aceiași electroni încărcați negativ care formează învelișul de electroni. De fapt, acest lucru nu este în întregime adevărat. Amintiți-vă dacă ați avut vreodată de a face cu clorul atomic. Desigur că nu. La urma urmei, există doar la temperaturi foarte ridicate. Chiar și clorul molecular mai stabil, practic, nu apare în natură, dacă este necesar, trebuie obținut prin reacții chimice. Și trebuie să ai de-a face cu clorura de sodiu (sare de masă) în mod constant. La urma urmei, sarea de masă este consumată în fiecare zi de oameni cu alimente. Și în natură apare destul de des. Dar sarea de masă conține ioni de clorură, adică atomi de clor care au adăugat un electron „în plus”. Unul dintre motivele pentru care ionii de clor sunt atât de obișnuiți este că atomii de clor au tendința de a câștiga electroni, adică atunci când ionii de clorură se formează din atomii de clor și electroni, se eliberează energie.
Unul dintre motivele eliberării de energie vă este deja cunoscut - este asociat cu o creștere a simetriei învelișului de electroni a atomului de clor în timpul tranziției la încărcat individual. anion. În același timp, după cum vă amintiți, energia 3 p-scade subnivelul. Există și alte motive mai complexe.
Datorită faptului că valoarea energiei afinității electronilor este influențată de mai mulți factori, natura modificării acestei cantități într-un sistem de elemente este mult mai complexă decât natura modificării energiei de ionizare. Vă puteți convinge de acest lucru analizând tabelul din Anexa 7. Dar, deoarece valoarea acestei mărimi este determinată, în primul rând, de aceeași interacțiune electrostatică ca și valorile energiei de ionizare, atunci modificarea acesteia în sistemul de elemente (cel puțin în grupele A) în schiță generală similar cu o modificare a energiei de ionizare, adică energia afinității electronilor într-un grup scade, iar într-o perioadă crește. Este maxim pentru atomi de fluor (328 kJ/mol) și clor (349 kJ/mol). Natura modificării energiei afinității electronilor într-un sistem de elemente seamănă cu natura modificării energiei de ionizare, adică direcția de creștere a energiei afinității electronice poate fi prezentată schematic după cum urmează:
2. La aceeași scară de-a lungul axei orizontale ca în sarcinile anterioare, construiți un grafic al dependenței energiei molare a afinității electronice de numărul atomic pentru atomii elementelor cu Z de la 1 la 40 folosind aplicația 7.
3. Ce semnificație fizică au valorile energiei de afinitate electronică negativă?
4. De ce, dintre toți atomii elementelor din perioada a 2-a, numai beriliul, azotul și neonul au valori negative ale energiei molare a afinității electronice?
6.15. Tendința atomilor de a pierde și câștiga electroni
Știți deja că tendința unui atom de a renunța la propriii electroni și de a adăuga electronii altora depinde de caracteristicile sale energetice (energia de ionizare și energia de afinitate electronică). Care atomi sunt mai înclinați să-și renunțe la electroni și care sunt mai înclinați să-i accepte pe alții?
Pentru a răspunde la această întrebare, să rezumam în Tabelul 15 tot ceea ce știm despre schimbarea acestor înclinații în sistemul de elemente.
Tabelul 15. Modificări ale înclinației atomilor de a renunța la proprii lor electroni și de a câștiga electroni străini
Configuratie electronica un atom este o reprezentare numerică a orbitalilor săi de electroni. Orbitii de electroni sunt regiuni diverse forme situat în jur nucleul atomic, în care prezența unui electron este probabil matematică. Configurația electronică ajută rapid și ușor să spună cititorului câți orbitali de electroni are un atom, precum și să determine numărul de electroni din fiecare orbital. După ce ați citit acest articol, veți stăpâni metoda de întocmire a configurațiilor electronice.
Pași
Distribuția electronilor folosind sistemul periodic al lui D. I. Mendeleev
- De exemplu, un atom de sodiu cu sarcină -1 va avea un electron în plus in plus la numărul său atomic de bază 11. Cu alte cuvinte, atomul va avea un total de 12 electroni.
- Dacă despre care vorbim despre un atom de sodiu cu o sarcină de +1, un electron trebuie scăzut din numărul atomic de bază 11. Astfel, atomul va avea 10 electroni.
-
Amintiți-vă lista de bază a orbitalilor. Pe măsură ce numărul de electroni dintr-un atom crește, aceștia umplu diferitele subniveluri ale învelișului de electroni a atomului în conformitate cu o anumită secvență. Fiecare subnivel al învelișului de electroni, atunci când este umplut, conține un număr par de electroni. Sunt disponibile următoarele subniveluri:
Înțelegeți notația configurației electronice. Configurațiile electronice sunt scrise pentru a arăta în mod clar numărul de electroni din fiecare orbital. Orbitalii sunt scrisi secvenţial, cu numărul de atomi din fiecare orbital scris ca superscript în dreapta numelui orbitalului. Configurația electronică finalizată ia forma unei secvențe de denumiri de subnivel și superscripte.
- Iată, de exemplu, cea mai simplă configurație electronică: 1s 2 2s 2 2p 6 . Această configurație arată că există doi electroni în subnivelul 1s, doi electroni în subnivelul 2s și șase electroni în subnivelul 2p. 2 + 2 + 6 = 10 electroni în total. Aceasta este configurația electronică a unui atom de neon neutru (numărul atomic al neonului este 10).
-
Amintiți-vă ordinea orbitalilor. Rețineți că orbitalii electronilor sunt numerotați în ordinea creșterii numărului învelișului de electroni, dar aranjați în ordinea crescătoare a energiei. De exemplu, un orbital 4s 2 umplut are o energie mai mică (sau o mobilitate mai mică) decât un orbital 3d 10 parțial umplut sau umplut, astfel încât orbitalul 4s este scris primul. Odată ce cunoașteți ordinea orbitalilor, îi puteți umple cu ușurință în funcție de numărul de electroni din atom. Ordinea de umplere a orbitalilor este următoarea: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Configurația electronică a unui atom în care toți orbitalii sunt umpluți va fi următoarea: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 5d 107 6p 14 6d 10 7p 6
- Rețineți că intrarea de mai sus, când toți orbitalii sunt umpluți, este configurația electronică a elementului Uuo (ununoctium) 118, atomul tabel periodic cu cel mai mare număr. Prin urmare, această configurație electronică conține toate subnivelurile electronice cunoscute în prezent ale unui atom încărcat neutru.
-
Umpleți orbitalii în funcție de numărul de electroni din atomul dvs. De exemplu, dacă vrem să notăm configurația electronică a unui atom neutru de calciu, trebuie să începem prin a căuta numărul său atomic în tabelul periodic. Numărul său atomic este 20, așa că vom scrie configurația unui atom cu 20 de electroni în ordinea de mai sus.
- Umpleți orbitalii în ordinea de mai sus până ajungeți la al douăzecilea electron. Primul orbital 1s va avea doi electroni, orbitalul 2s va avea și doi, 2p va avea șase, cei 3 vor avea doi, 3p va avea 6 și cei 4 vor avea 2 (2 + 2 + 6 +2 + 6 + 2 = 20 .) Cu alte cuvinte, configurația electronică a calciului are forma: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
- Rețineți că orbitalii sunt aranjați în ordinea creșterii energiei. De exemplu, când sunteți gata să treceți la al 4-lea nivel de energie, notați mai întâi orbitalul 4s și apoi 3d. După al patrulea nivel de energie, treci la al cincilea, unde se repetă aceeași ordine. Acest lucru se întâmplă numai după al treilea nivel de energie.
-
Utilizați tabelul periodic ca indiciu vizual. Probabil ați observat deja că forma tabelului periodic corespunde ordinii subnivelurilor de electroni în configurațiile electronice. De exemplu, atomii din a doua coloană din stânga se termină întotdeauna cu „s 2”, iar atomii de pe marginea dreaptă a părții subțiri din mijloc se termină întotdeauna cu „d 10”, etc. Utilizați tabelul periodic ca ghid vizual pentru scrierea configurațiilor - modul în care ordinea în care adăugați la orbitali corespunde poziției dvs. în tabel. Vezi mai jos:
- Mai exact, cele două coloane din stânga conțin atomi ale căror configurații electronice se termină în orbitali s, blocul din dreapta al tabelului conține atomi ale căror configurații se termină în orbitali p, iar jumătatea inferioară conține atomi care se termină în orbitali f.
- De exemplu, atunci când notați configurația electronică a clorului, gândiți-vă astfel: „Acest atom este situat în al treilea rând (sau „perioada”) al tabelului periodic. De asemenea, este situat în a cincea grupă a blocului orbital p. a tabelului periodic, prin urmare, configurația sa electronică se va termina cu ..3p 5
- Rețineți că elementele din regiunea orbitală d și f a tabelului sunt caracterizate de niveluri de energie care nu corespund perioadei în care sunt situate. De exemplu, primul rând al unui bloc de elemente cu orbitali d corespunde orbitalilor 3d, deși este situat în a 4-a perioadă, iar primul rând de elemente cu orbitali f corespunde unui orbital 4f, deși se află în a 6-a. perioadă.
-
Aflați abrevieri pentru scrierea configurațiilor electronice lungi. Se numesc atomii de pe marginea dreaptă a tabelului periodic gaze nobile. Aceste elemente sunt foarte stabile din punct de vedere chimic. Pentru a scurta procesul de scriere a configurațiilor electronice lungi, pur și simplu scrieți simbolul chimic al celui mai apropiat gaz nobil cu mai puțini electroni decât atomul dvs. între paranteze drepte și apoi continuați să scrieți configurația electronică a nivelurilor orbitale ulterioare. Vezi mai jos:
- Pentru a înțelege acest concept, va fi util să scrieți un exemplu de configurare. Să scriem configurația zincului (numărul atomic 30) folosind abrevierea care include gazul nobil. Configurația completă a zincului arată astfel: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10. Totuși, vedem că 1s 2 2s 2 2p 6 3s 2 3p 6 este configurația electronică a argonului, un gaz nobil. Pur și simplu înlocuiți o parte din configurația electronică pentru zinc cu simbolul chimic pentru argon între paranteze drepte (.)
- Deci, configurația electronică a zincului, scrisă în formă prescurtată, are forma: 4s 2 3d 10 .
- Vă rugăm să rețineți că, dacă scrieți configurația electronică a unui gaz nobil, să spunem argon, nu o puteți scrie! Trebuie să folosiți abrevierea pentru gazul nobil care precede acest element; pentru argon va fi neon ().
Folosind tabelul periodic AOMAH
-
Stăpânește tabelul periodic AOMAH. Această metodă de înregistrare a configurației electronice nu necesită memorare, ci necesită un tabel periodic modificat, deoarece în tabelul periodic tradițional, începând din a patra perioadă, numărul perioadei nu corespunde învelișului de electroni. Găsiți tabelul periodic ADOMAH - un tip special de tabel periodic dezvoltat de omul de știință Valery Zimmerman. Este ușor de găsit cu o scurtă căutare pe internet.
- În tabelul periodic AOMAH, rândurile orizontale reprezintă grupuri de elemente precum halogeni, gaze nobile, metale alcaline, metale alcalino-pământoase etc. Coloanele verticale corespund nivelurilor electronice, iar așa-numitele „cascade” (linii diagonale care leagă blocurile s,p,dși f) corespund perioadelor.
- Heliul este mutat spre hidrogen, deoarece ambele elemente sunt caracterizate de un orbital 1s. Blocurile perioadelor (s,p,d și f) sunt afișate în partea dreaptă, iar numerele de nivel sunt date la bază. Elementele sunt reprezentate în casete numerotate de la 1 la 120. Aceste numere sunt numere atomice obișnuite, care reprezintă numărul total de electroni dintr-un atom neutru.
-
Găsiți-vă atomul în tabelul AOMAH. Pentru a scrie configurația electronică a unui element, căutați simbolul acestuia pe tabelul periodic ADOMAH și tăiați toate elementele cu un număr atomic mai mare. De exemplu, dacă trebuie să scrieți configurația electronică a erbiului (68), tăiați toate elementele de la 69 la 120.
- Notați numerele de la 1 la 8 din partea de jos a tabelului. Acestea sunt numere de nivele electronice sau numere de coloane. Ignorați coloanele care conțin numai elemente tăiate. Pentru erbiu rămân coloanele numerotate 1,2,3,4,5 și 6.
-
Numără subnivelurile orbitale până la elementul tău. Privind simbolurile bloc afișate în dreapta tabelului (s, p, d și f) și numerele coloanelor afișate la bază, ignorați liniile diagonale dintre blocuri și împărțiți coloanele în blocuri de coloane, listându-le în ordine de jos în sus. Din nou, ignorați blocurile care au toate elementele tăiate. Scrieți blocurile de coloane începând de la numărul coloanei urmat de simbolul blocului, astfel: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (pentru erbium).
- Vă rugăm să rețineți: configurația electronică de mai sus a lui Er este scrisă în ordinea crescătoare a numărului subnivelului de electroni. Poate fi scris și în ordinea umplerii orbitalilor. Pentru a face acest lucru, urmați cascadele de jos în sus, mai degrabă decât coloanele, când scrieți blocuri de coloane: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 .
-
Numărați electronii pentru fiecare subnivel de electroni. Numărați elementele din fiecare bloc de coloană care nu au fost tăiate, atașând câte un electron de la fiecare element și scrieți numărul lor lângă simbolul bloc pentru fiecare bloc de coloană astfel: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s 2 . În exemplul nostru, aceasta este configurația electronică a erbiului.
-
Fiți conștienți de configurațiile electronice incorecte. Există optsprezece excepții tipice care se referă la configurațiile electronice ale atomilor în starea cea mai scăzută de energie, numită și starea energiei fundamentale. Ei nu se supun regula generala numai în ultimele două-trei poziţii ocupate de electroni. În acest caz, configurația electronică reală presupune că electronii sunt într-o stare cu o energie mai mică în comparație cu configurația standard a atomului. Atomii de excepție includ:
- Cr(..., 3d5, 4s1); Cu(..., 3d10, 4s1); Nb(..., 4d4, 5s1); lu(..., 4d5, 5s1); Ru(..., 4d7, 5s1); Rh(..., 4d8, 5s1); Pd(..., 4d10, 5s0); Ag(..., 4d10, 5s1); La(..., 5d1, 6s2); Ce(..., 4f1, 5d1, 6s2); Gd(..., 4f7, 5d1, 6s2); Au(..., 5d10, 6s1); Ac(..., 6d1, 7s2); Th(..., 6d2, 7s2); Pa(..., 5f2, 6d1, 7s2); U(..., 5f3, 6d1, 7s2); Np(..., 5f4, 6d1, 7s2) și Cm(..., 5f7, 6d1, 7s2).
- Pentru a găsi numărul atomic al unui atom atunci când este scris în formă de configurație electronică, pur și simplu adunați toate numerele care urmează literelor (s, p, d și f). Acest lucru funcționează doar pentru atomi neutri, dacă aveți de-a face cu un ion, nu va funcționa - va trebui să adăugați sau să scădeți numărul de electroni în plus sau pierduți.
- Numărul care urmează după litere este un superscript, nu greșiți la test.
- Nu există stabilitate la subnivelul „pe jumătate plin”. Aceasta este o simplificare. Orice stabilitate care este atribuită subnivelurilor „pe jumătate umplute” are loc deoarece fiecare orbital este ocupat de un electron, astfel încât repulsia dintre electroni este redusă la minimum.
- Fiecare atom tinde spre o stare stabilă, iar cele mai stabile configurații au subnivelurile s și p umplute (s2 și p6). Gazele nobile au această configurație, așa că reacționează rar și sunt situate în partea dreaptă a tabelului periodic. Prin urmare, dacă o configurație se termină în 3p 4, atunci are nevoie de doi electroni pentru a ajunge la o stare stabilă (pentru a pierde șase, inclusiv electronii de subnivelul s, necesită mai multă energie, deci pierderea a patru este mai ușoară). Și dacă configurația se termină în 4d 3, atunci pentru a obține o stare stabilă trebuie să piardă trei electroni. În plus, subnivelurile pe jumătate umplute (s1, p3, d5..) sunt mai stabile decât, de exemplu, p4 sau p2; cu toate acestea, s2 și p6 vor fi și mai stabile.
- Când aveți de-a face cu un ion, aceasta înseamnă că numărul de protoni nu este egal cu numărul de electroni. În acest caz, sarcina atomului va fi reprezentată în dreapta sus (de obicei) a simbolului chimic. Prin urmare, un atom de antimoniu cu sarcină +2 are configurația electronică 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 . Rețineți că 5p 3 s-a schimbat în 5p 1 . Aveți grijă când configurația atomului neutru se termină în subniveluri altele decât s și p. Când luați electroni, îi puteți lua doar din orbitalii de valență (orbitalii s și p). Prin urmare, dacă configurația se termină cu 4s 2 3d 7 și atomul primește o sarcină de +2, atunci configurația se va termina cu 4s 0 3d 7. Vă rugăm să rețineți că 3d 7 Nu modificări, electronii din orbitalul s se pierd în schimb.
- Există condiții când un electron este forțat să „trece la un nivel de energie mai înalt”. Când un subnivel este cu un electron mai scurt decât să fie jumătate sau plin, luați un electron de la cel mai apropiat subnivel s sau p și mutați-l la subnivelul care are nevoie de electron.
- Există două opțiuni pentru înregistrarea configurației electronice. Ele pot fi scrise în ordinea crescătoare a numerelor nivelului de energie sau în ordinea umplerii orbitalilor electronilor, așa cum sa arătat mai sus pentru erbiu.
- De asemenea, puteți scrie configurația electronică a unui element scriind doar configurația de valență, care reprezintă ultimul subnivel s și p. Astfel, configurația de valență a antimoniului va fi 5s 2 5p 3.
- Ionii nu sunt la fel. Cu ei e mult mai greu. Omite două niveluri și urmează același model, în funcție de unde ai început și de cât de mare este numărul de electroni.
Găsiți numărul atomic al atomului dvs. Fiecare atom are un anumit număr electronii asociati cu acesta. Găsiți simbolul atomului dvs. în tabelul periodic. Numărul atomic este un număr întreg pozitiv care începe de la 1 (pentru hidrogen) și crește cu unul pentru fiecare atom ulterior. Numărul atomic este numărul de protoni dintr-un atom și, prin urmare, este și numărul de electroni ai unui atom cu sarcină zero.
Determinați sarcina unui atom. Atomii neutri vor avea același număr de electroni ca în tabelul periodic. Cu toate acestea, atomii încărcați vor avea mai mulți sau mai puțini electroni, în funcție de mărimea sarcinii lor. Dacă lucrați cu un atom încărcat, adăugați sau scădeți electroni după cum urmează: adăugați un electron pentru fiecare sarcină negativă și scădeți unul pentru fiecare sarcină pozitivă.