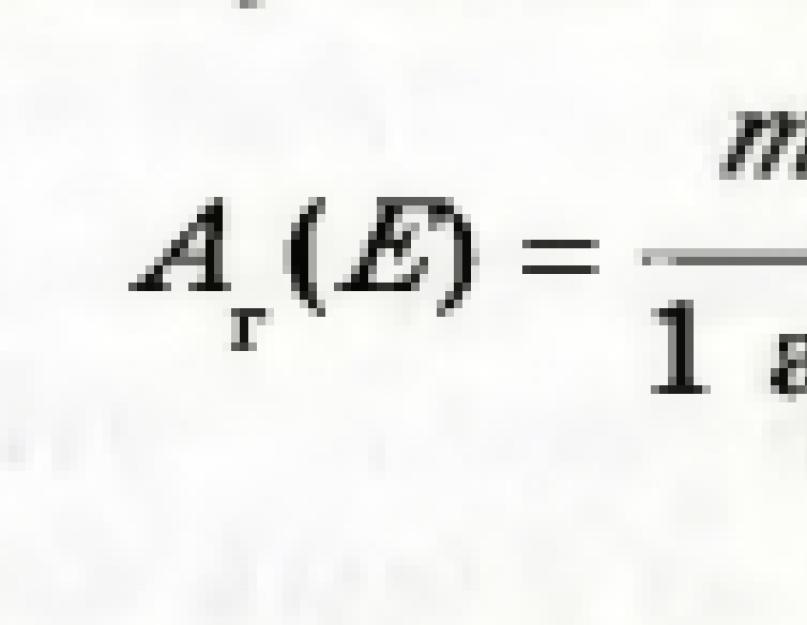>> Masa unui atom. Masa atomică relativă
Masă atomică. Masa atomică relativă
Materialul din acest paragraf vă va ajuta să vă dați seama:
> care este diferența dintre masa atomică și relativă masă atomică ;
> de ce este convenabil să se folosească mase atomice relative;
> unde se află masa atomică relativă a unui element.
Acest lucru este interesant
Masa unui electron este de aproximativ 9 10 -28 g.
Masă atomică.
O caracteristică importantă a unui atom este masa acestuia. Aproape toată masa unui atom este concentrată în nucleu. Electronii au o masă atât de mică încât sunt de obicei neglijați.
comparativ cu 1/12 - masa unui atom de carbon (este de aproape 12 ori mai greu decât un atom de hidrogen). Această masă mică a fost numită unitatea de masă atomică (abreviată ca a.m.u.):
1 a. e.m. = 1/12m a (C) = 1/12 1,994 10 -23 g = 1,662 10 -24 g.
Masa atomului de hidrogen aproape coincide cu unitatea de masă atomică: m a (H) ~ 1a. e.m. Masa atomului de uraniu este mai mare decât în
Acesta este
m a (U) ~ 238 a. mânca.
Numărul obținut prin împărțirea masei unui atom al unui element la unitatea de masă atomică se numește masa atomică relativă a elementului. Această valoare este notată cu A r (E):

Indexul de lângă litera A este prima literă din cuvânt latin relativus - relativ.
Masa atomică relativă a unui element arată de câte ori masa unui atom element mai mult de 1/12 din masa unui atom de carbon.
m a (N) = 1,673 10 -2 4 g
ma (H)= 1 a. mânca.
A r (H) = 1
Masa atomică relativă a unui element nu are dimensiune.
Primul tabel al maselor atomice relative a fost întocmit cu aproape 200 de ani în urmă de omul de știință englez J. Dalton.
Pe baza materialului prezentat se pot trage următoarele concluzii:
Masele atomice relative sunt proportionale cu masele atomilor;
rapoartele maselor atomice sunt aceleași cu masele atomice relative.
Masele atomice relative ale elementelor chimice sunt scrise în tabelul periodic .
John Dalton (1766-1844)

Engleză remarcabilă fizician si chimist. Membru al Societății Regale din Londra (Academia Engleză de Științe). El a fost primul care a prezentat o ipoteză despre diferitele mase și dimensiuni ale atomilor, a determinat masele atomice relative ale multor elemente și a întocmit primul tabel cu valorile acestora (1803). El a propus simboluri pentru elemente și denumiri pentru compușii chimici.
Făcând peste 200.000 observatii meteorologice, după ce a studiat compoziția și proprietățile aerului, a descoperit legile presiunilor parțiale (parțiale). gazele(1801), dilatarea termică a gazelor (1802), solubilitatea gazelor în lichide (1803).

Orez. 35. Celula elementului Uranus
Ele sunt definite cu foarte precizie ridicată; numerele corespunzătoare sunt în mare parte cinci și șase cifre (Fig. 35).
În calculele chimice obișnuite, masele atomice relative sunt de obicei rotunjite la numere întregi. Deci, pentru Hidrogen și Uranus
Ar (H) = 1,0079 ~ 1;
A r (U) = 238,029 ~ 238.
Doar masa atomică relativă a clorului este rotunjită la cea mai apropiată zecime:
A r (CI) = 35,453 ~ 35,5.
Găsiți masele atomice relative de litiu, carbon, oxigen, neon în tabelul periodic și rotunjiți-le la numere întregi.
De câte ori sunt masele atomilor de carbon, oxigen, neon și magneziu mai mari decât masa atomului de heliu? Pentru calcule, utilizați valori rotunjite ale maselor atomice relative.
Notă: elementele sunt dispuse în tabelul periodic în ordinea maselor atomice crescătoare.
concluzii
Atomii au o masă extrem de mică.
Pentru comoditatea calculelor, se folosesc mase relative de atomi.
Masa atomică relativă a unui element este raportul dintre masa unui atom al elementului și masa unui atom de carbon.
Valorile maselor atomice relative sunt indicate în tabelul periodic al elementelor chimice.
?
48. Care este diferența dintre conceptele „masă atomică” și masă atomică relativă?
49. Ce este o unitate de masă atomică?
50. Ce înseamnă intrările A r și A r?
51. Care atom este mai ușor - Carbon sau Titan? De câte ori?
52. Care are mai multă masă: un atom de fluor sau doi atomi de litiu; doi atomi de magneziu sau trei atomi de sulf?
53. Aflați în tabelul periodic trei sau patru perechi de elemente al căror raport de masă atomică este: a) 1: 2; b) 1:3.
54. Calculați masa atomică relativă a Heliului dacă masa unui atom al acestui element este 6,647 - 10 -24 g.
55. Calculați masa unui atom de beriliu.
Popel P. P., Kryklya L. S., Chimie: Pidruch. pentru clasa a VII-a zagalnosvit. navch. închidere - K.: VC „Academia”, 2008. - 136 p.: ill.
Conținutul lecției schița lecției și cadru de susținere a prezentării lecției tehnologii interactive metode de predare acceleratoare Practică teste, testare online sarcini și exerciții teme pentru acasă ateliere și întrebări de instruire pentru discuțiile la clasă Ilustrații materiale video și audio fotografii, imagini, grafice, tabele, diagrame, benzi desenate, pilde, proverbe, cuvinte încrucișate, anecdote, glume, citate Suplimente rezumate cheat sheets sfaturi pentru articolele curioase (MAN) literatură dicționar de bază și suplimentar de termeni Îmbunătățirea manualelor și lecțiilor corectarea erorilor din manual, înlocuirea cunoștințelor învechite cu altele noi Doar pentru profesori planuri calendaristice programe de învățare instrucțiuniYouTube enciclopedic
1 / 3
✪ Chimie| Masa atomică relativă
✪ Masa atomică relativă. Masa moleculara.
✪ 15. Masa atomică
Subtitrări
Informații generale
Una dintre proprietățile fundamentale ale unui atom este masa acestuia. Masa absolută a unui atom este o valoare extrem de mică. Astfel, un atom de hidrogen are o masă de aproximativ 1,67⋅10 -24 g. Prin urmare, în chimie (în scopuri practice) este preferenţial şi mult mai convenabil să se folosească o valoare relativă [convenţională], care se numeşte masa atomică relativă sau pur și simplu masă atomică si care arata de cate ori masa unui atom al unui element dat este mai mare decat masa unui atom al altui element, luata ca unitate de masura a masei.
Unitatea de măsură pentru masele atomice și moleculare este 1 ⁄ 12 parte din masa unui atom neutru al celui mai comun izotop al carbonului 12 C. Această unitate de măsură non-sistemică a masei se numește unitate de masă atomică (A. mânca.) sau Dalton (Da).
Diferența dintre masa atomică a unui izotop și numărul său de masă se numește exces de masă (exprimată de obicei în MeV). Poate fi fie pozitiv, fie negativ; Motivul apariției sale este dependența neliniară a energiei de legare a nucleelor de numărul de protoni și neutroni, precum și diferența dintre masele protonului și neutronului.
Dependența masei atomice a unui izotop de numărul de masă este următoarea: excesul de masă este pozitiv pentru hidrogen-1, cu creșterea numărului de masă scade și devine negativ până când se atinge un minim pentru fier-56, apoi începe să cresc și crește la valori pozitive pentru nuclizii grei. Acest lucru corespunde faptului că fisiunea nucleelor mai grele decât fierul eliberează energie, în timp ce fisiunea nucleelor ușoare necesită energie. Dimpotrivă, fuziunea nucleelor mai ușoare decât fierul eliberează energie, în timp ce fuziunea elementelor mai grele decât fierul necesită energie suplimentară.
Poveste
Când se calculează inițial masele atomice (cu începutul XIX secol, la sugestia lui J. Dalton; vezi teoria atomică a lui Dalton) masa unui atom de hidrogen ca element cel mai ușor a fost luată ca unitate de masă [relativă], iar masele atomilor altor elemente au fost calculate în raport cu acesta. Dar întrucât masele atomice ale majorității elementelor sunt determinate pe baza compoziției compușilor lor de oxigen, de fapt s-au făcut calcule (de facto) în raport cu masa atomică a oxigenului, care a fost luată egală cu 16; raportul dintre masele atomice de oxigen și hidrogen a fost considerat egal cu 16: 1. Ulterior, măsurători mai precise au arătat că acest raport este egal cu 15,874: 1 sau, ceea ce este același, 16: 1,0079, în funcție de ce atom - oxigen sau hidrogen - se referă la o valoare întreagă. O modificare a masei atomice a oxigenului ar presupune o modificare a maselor atomice ale majorității elementelor. Prin urmare, s-a decis să se lase masa atomică a oxigenului la 16, luând masa atomică a hidrogenului egală cu 1,0079.
Astfel, a fost luată unitatea de masă atomică 1 ⁄ 16 parte din masa unui atom de oxigen, numită unitate de oxigen. S-a descoperit ulterior că oxigenul natural este un amestec de izotopi, astfel încât unitatea de masă a oxigenului caracterizează masa medie a atomilor izotopilor naturali ai oxigenului (oxigen-16, oxigen-17 și oxigen-18), care s-au dovedit a fi instabile. datorită variaţiilor naturale ale compoziţiei izotopice oxigenului. Pentru fizica atomica o astfel de unitate sa dovedit a fi inacceptabilă, iar în această ramură a științei a fost adoptată unitatea de masă atomică 1 ⁄ 16 o parte din masa atomului de oxigen 16 O. Ca urmare, au luat forma două scale de mase atomice - chimică și fizică. Prezența a două scări de masă atomică a creat un mare inconvenient. Valorile multor constante calculate pe scara fizică și chimică s-au dovedit a fi diferite. Această poziție inacceptabilă a condus la introducerea scării de carbon a maselor atomice în locul scării de oxigen.
O scară unificată a maselor atomice relative și o nouă unitate de masă atomică au fost adoptate de Congresul Internațional al Fizicienilor (1960) și unificate de către Congresul Internațional al Chimielor (1961; la 100 de ani după primul Congres Internațional al Chimștilor), în loc de anterioare două unități de oxigen de masă atomică - fizică și chimică. Oxigen chimic unitate este egală cu 0,999957 nouă unitate de masă atomică de carbon. La scara modernă, masele atomice relative ale oxigenului și hidrogenului sunt, respectiv, 15,9994:1,0079... Deoarece noua unitate de masă atomică este legată de un anumit izotop și nu de masa atomică medie a unui element chimic, variațiile izotopice naturale nu nu afectează reproductibilitatea acelei unități.
Din materialele de lecție veți învăța că atomii unor elemente chimice diferă în masă de atomii altor elemente chimice. Profesorul vă va spune cum au măsurat chimiștii masa atomilor care sunt atât de mici încât nu îi puteți vedea nici măcar cu un microscop electronic.
Subiect: Idei chimice inițiale
Lecția: Masa atomică relativă a elementelor chimice
La începutul secolului al XIX-lea. (la 150 de ani după munca lui Robert Boyle), savantul englez John Dalton a propus o metodă de determinare a masei atomilor elementelor chimice. Să luăm în considerare esența acestei metode.
Dalton a propus un model conform căruia o moleculă a unei substanțe complexe conține doar un atom de elemente chimice diferite. De exemplu, el credea că o moleculă de apă este formată din 1 atom de hidrogen și 1 atom de oxigen. Parte substanțe simple conform lui Dalton, este inclus doar un atom dintr-un element chimic. Acestea. o moleculă de oxigen trebuie să fie formată dintr-un atom de oxigen.
Și apoi, cunoscând fracțiunile de masă ale elementelor dintr-o substanță, este ușor de determinat de câte ori diferă masa unui atom al unui element de masa unui atom al altui element. Astfel, Dalton credea că fracția de masă a unui element dintr-o substanță este determinată de masa atomului său.
Se știe că fracția de masă a magneziului în oxidul de magneziu este de 60%, iar fracția de masă a oxigenului este de 40%. Urmând calea raționamentului lui Dalton, putem spune că masa unui atom de magneziu este de 1,5 ori mai mare decât masa unui atom de oxigen (60/40 = 1,5):
Omul de știință a observat că masa atomului de hidrogen este cea mai mică, deoarece Nu există o substanță complexă în care fracția de masă a hidrogenului ar fi mai mare decât fracția de masă a altui element. Prin urmare, el a propus să compare masele atomilor elementelor cu masa unui atom de hidrogen. Și în acest fel a calculat primele valori ale maselor atomice relative (față de atomul de hidrogen) ale elementelor chimice.
Masa atomică a hidrogenului a fost luată ca unitate. Și sensul masa relativă sulful s-a dovedit a fi egal cu 17. Dar toate valorile obținute au fost fie aproximative, fie incorecte, deoarece tehnica experimentală de atunci era departe de a fi perfectă, iar presupunerea lui Dalton cu privire la compoziția substanței era incorectă.
În 1807 - 1817 Chimistul suedez Jons Jakob Berzelius a efectuat cercetări ample pentru a clarifica masele atomice relative ale elementelor. A reusit sa obtina rezultate apropiate de cele moderne.
Mult mai târziu decât lucrarea lui Berzelius, masele atomilor elementelor chimice au început să fie comparate cu 1/12 din masa unui atom de carbon (Fig. 2).

Orez. 1. Model pentru calcularea masei atomice relative a unui element chimic
Masa atomică relativă a unui element chimic arată de câte ori masa unui atom al unui element chimic este mai mare decât 1/12 din masa unui atom de carbon.
Masa atomică relativă se notează cu A r; nu are unități de măsură, deoarece arată raportul dintre masele atomilor.
De exemplu: A r (S) = 32, i.e. un atom de sulf este de 32 de ori mai greu decât 1/12 din masa unui atom de carbon.
Masa absolută a 1/12 dintr-un atom de carbon este o unitate de referință, a cărei valoare este calculată cu mare precizie și este de 1,66 * 10 -24 g sau 1,66 * 10 -27 kg. Această masă de referință se numește unitate de masă atomică (a.e.m.).
Nu este nevoie să memorați valorile maselor atomice relative ale elementelor chimice; acestea sunt date în orice manual sau carte de referință de chimie, precum și în tabelul periodic al D.I. Mendeleev.
Când se calculează, valorile maselor atomice relative sunt de obicei rotunjite la numere întregi.
Excepție este masa atomică relativă a clorului - pentru clor se folosește o valoare de 35,5.
1. Culegere de probleme și exerciții de chimie: clasa a VIII-a: la manualul de P.A. Orzhekovsky și alții „Chimie, clasa a VIII-a” / P.A. Orjekovski, N.A. Titov, F.F. Hegel. – M.: AST: Astrel, 2006.
2. Ushakova O.V. Caiet de chimie: clasa a VIII-a: la manualul de P.A. Orjekovski și alții „Chimie. clasa a VIII-a” / O.V. Ushakova, P.I. Bespalov, P.A. Orjekovski; sub. ed. prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (p. 24-25)
3. Chimie: clasa a VIII-a: manual. pentru învăţământul general instituții / P.A. Orjekovski, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005.(§10)
4. Chimie: inorg. chimie: manual. pentru clasa a VIII-a. educatie generala instituții / G.E. Rudzitis, Fyu Feldman. – M.: Educație, OJSC „Manuale de la Moscova”, 2009. (§§8,9)
5. Enciclopedie pentru copii. Volumul 17. Chimie / Capitolul. ed.V.A. Volodin, Ved. științific ed. I. Leenson. – M.: Avanta+, 2003.
Resurse web suplimentare
1. Colecție unificată de resurse educaționale digitale ().
2. Versiunea electronică a revistei „Chimie și viață” ().
Teme pentru acasă
p.24-25 Nr. 1-7 din Caietul de lucru la Chimie: clasa a VIII-a: la manualul de P.A. Orjekovski și alții „Chimie. clasa a VIII-a” / O.V. Ushakova, P.I. Bespalov, P.A. Orjekovski; sub. ed. prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006.
Masă atomică, masa atomică relativă(denumire învechită - greutate atomică) - valoarea masei unui atom, exprimată în unități de masă atomică. În prezent, unitatea de masă atomică este considerată egală cu 1/12 din masa unui atom neutru al celui mai comun izotop al carbonului 12C, deci masa atomică a acestui izotop prin definiție este exact 12. Pentru orice alt izotop, atomul masa nu este un număr întreg, deși este aproape de numărul de masă al acestui izotop (adică numărul total de nucleoni - protoni și neutroni - din nucleul său). Diferența dintre masa atomică a unui izotop și numărul său de masă se numește exces de masă (exprimată de obicei în MeVah). Poate fi fie pozitiv, fie negativ; Motivul apariției sale este dependența neliniară a energiei de legare a nucleelor de numărul de protoni și neutroni, precum și diferența dintre masele protonului și neutronului.
Dependența masei atomice de numărul de masă este următoarea: excesul de masă este pozitiv pentru hidrogen-1, cu creșterea numărului de masă scade și devine negativ până când se atinge un minim pentru fier-56, apoi începe să crească și crește la valori pozitive pentru nuclizii grei. Acest lucru corespunde faptului că fisiunea nucleelor mai grele decât fierul eliberează energie, în timp ce fisiunea nucleelor ușoare necesită energie. Dimpotrivă, fuziunea nucleelor mai ușoare decât fierul eliberează energie, în timp ce fuziunea elementelor mai grele decât fierul necesită energie suplimentară.
Masa atomică a unui element chimic (de asemenea „masa atomică medie”, „masa atomică standard”) este masa atomică medie ponderată a tuturor izotopilor stabili ai unui element chimic dat, ținând cont de abundența lor naturală în Scoarta terestra si atmosfera. Această masă atomică este prezentată în tabelul periodic și este utilizată în calculele stoichiometrice. Masa atomică a unui element cu un raport izotopic perturbat (de exemplu, îmbogățit cu un anumit izotop) diferă de cea standard.
Greutate moleculară mo component chimic este suma maselor atomice ale elementelor care o alcătuiesc, înmulțită cu coeficienții stoichiometrici ai elementelor după formula chimică a compusului. Strict vorbind, masa unei molecule este mai mică decât masa atomilor ei constitutivi cu o cantitate egală cu energia de legare a moleculei. Cu toate acestea, acest defect de masă este cu 9-10 ordine de mărime mai mic decât masa moleculei și poate fi neglijat.
Definiția unei mol (și numărul lui Avogadro) este aleasă astfel încât masa unui mol dintr-o substanță ( Masă molară), exprimată în grame, a fost numeric egală cu masa atomică (sau moleculară) a acestei substanțe. De exemplu, masa atomică a fierului este de 55,847. Prin urmare, un mol de atomi de fier (adică numărul lor, egală cu numărul Avogadro, 6.022 1023) conține 55.847 grame.
Compararea și măsurarea directă a maselor atomilor și moleculelor se realizează folosind metode spectrometrice de masă.
Poveste
Până în anii 1960, masa atomică a fost definită astfel încât izotopul oxigen-16 să aibă o masă atomică de 16 (scara de oxigen). Cu toate acestea, raportul dintre oxigen-17 și oxigen-18 din oxigenul natural, care a fost folosit și în calculele masei atomice, a dus la două tabele diferite de mase atomice. Chimiștii au folosit o scară bazată pe faptul că amestecul natural de izotopi de oxigen ar avea o masă atomică de 16, în timp ce fizicienii au atribuit același număr de 16 masei atomice a celui mai comun izotop de oxigen (care are opt protoni și opt neutroni). ).
Wikipedia
DEFINIȚIE
Fier- al douăzeci și șaselea element al Tabelului Periodic. Denumire - Fe din latinescul „ferrum”. Situat în a patra perioadă, grupul VIIIB. Se referă la metale. Sarcina nucleară este 26.
Fierul este cel mai comun metal de pe glob după aluminiu: reprezintă 4% (greutate) din scoarța terestră. Fierul se găsește sub formă de diverși compuși: oxizi, sulfuri, silicați. Fierul se găsește în stare liberă numai în meteoriți.
LA cele mai importante minereuri fierul include minereu de fier magnetic Fe 3 O 4 , minereu de fier roșu Fe 2 O 3 , minereu de fier brun 2Fe 2 O 3 × 3H 2 O și minereu de fier spart FeCO 3 .
Fierul este un metal ductil argintiu (Fig. 1). Se pretează bine la forjare, laminare și alte tipuri de prelucrare mecanică. Proprietăți mecanice fierul depinde foarte mult de puritatea sa - de conținutul chiar și în cantități foarte mici de alte elemente din el.
Orez. 1. Fierul de călcat. Aspect.
Masa atomică și moleculară a fierului
Greutatea moleculară relativă a substanței(M r) este un număr care arată de câte ori masa unei molecule date este mai mare decât 1/12 din masa unui atom de carbon și masa atomică relativă a unui element(A r) - de câte ori masa medie a atomilor unui element chimic este mai mare decât 1/12 din masa unui atom de carbon.
Deoarece în stare liberă fierul există sub formă de molecule de Fe monoatomic, valorile maselor sale atomice și moleculare coincid. Ele sunt egale cu 55.847.
Alotropia și modificările alotropice ale fierului
Fierul formează două modificări cristaline: α-fier și γ-fier. Primul dintre ele are o rețea cubică centrată pe corp, al doilea are o rețea cubică centrată pe față. α-Fierul este stabil termodinamic în două intervale de temperatură: sub 912 o C și de la 1394 o C până la punctul de topire. Punctul de topire al fierului este de 1539 ± 5 o C. Între 912 o C și de la 1394 o C γ-fierul este stabil.
Intervalele de temperatură ale stabilității fierului α și γ sunt determinate de natura modificării energiei Gibbs a ambelor modificări cu schimbări de temperatură. La temperaturi sub 912 o C și peste 1394 o C, energia Gibbs a fierului α este mai mică decât energia Gibbs a fierului γ, iar în intervalul 912 - 1394 o C este mai mare.
Izotopi de fier
Se știe că în natură fierul poate fi găsit sub formă de patru izotopi stabili 54 Fe, 56 Fe, 57 Fe și 57 Fe. Numerele lor de masă sunt 54, 56, 57 și, respectiv, 58. Nucleul unui atom al izotopului de fier 54 Fe conține douăzeci și șase de protoni și douăzeci și opt de neutroni, iar izotopii rămași diferă de acesta doar prin numărul de neutroni.
Există izotopi artificiali ai fierului cu numere de masă de la 45 la 72, precum și 6 stări izomerice ale nucleelor. Cel mai longeviv dintre izotopii de mai sus este 60 Fe cu un timp de înjumătățire de 2,6 milioane de ani.
Ioni de fier
Formula electronică care demonstrează distribuția orbitală a electronilor de fier este următoarea:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 .
Ca urmare a interacțiunii chimice, fierul renunță la electronii de valență, adică. este donatorul lor și se transformă într-un ion încărcat pozitiv:
Fe 0 -2e → Fe 2+ ;
Fe 0 -3e → Fe 3+.
Moleculă și atom de fier
În stare liberă, fierul există sub formă de molecule monoatomice de Fe. Iată câteva proprietăți care caracterizează atomul și molecula de fier:
Aliaje de fier
Până în secolul al XIX-lea, aliajele de fier erau cunoscute în principal pentru aliajele lor cu carbon, numite oțel și fontă. Cu toate acestea, mai târziu au fost create noi aliaje pe bază de fier care conțin crom, nichel și alte elemente. În prezent, aliajele de fier sunt împărțite în oțeluri carbon, fonte, oțeluri aliate și oțeluri cu proprietăți speciale.
În tehnologie, aliajele de fier sunt de obicei numite metale feroase, iar producția lor se numește metalurgie feroasă.
Exemple de rezolvare a problemelor
| Exercițiu | Compoziția elementară a substanței este următoarea: fracția de masă a elementului de fier este 0,7241 (sau 72,41%), fracția de masă a oxigenului este 0,2759 (sau 27,59%). Deduceți formula chimică. |
| Soluţie | Fracția de masă a elementului X dintr-o moleculă din compoziția NX se calculează folosind următoarea formulă: ω (X) = n × Ar (X) / M (HX) × 100%. Să notăm numărul de atomi de fier din moleculă cu „x”, numărul de atomi de oxigen cu „y”. Să găsim masele atomice relative corespunzătoare ale elementelor fier și oxigen (vom rotunji valorile maselor atomice relative luate din Tabelul periodic al lui D.I. Mendeleev la numere întregi). Ar(Fe) = 56; Ar(O) = 16. Împărțim conținutul procentual de elemente în masele atomice relative corespunzătoare. Astfel vom găsi relația dintre numărul de atomi din molecula compusului: x:y= ω(Fe)/Ar(Fe): ω(O)/Ar(O); x:y = 72,41/56: 27,59/16; x:y = 1,29: 1,84. Să luăm cel mai mic număr ca unul (adică, împărțim toate numerele la cel mai mic număr 1,29): 1,29/1,29: 1,84/1,29; În consecință, cea mai simplă formulă pentru combinația de fier și oxigen este Fe 2 O 3. |
| Răspuns | Fe2O3 |
Proprietățile fizice ale fierului depind de puritatea acestuia. Fierul pur este un metal destul de ductil, cu o culoare alb-argintie. Densitatea fierului este de 7,87 g/cm3. Punctul de topire este de 1539 ° C. Spre deosebire de multe alte metale, fierul prezintă proprietăți magnetice.
Fierul pur este destul de stabil în aer. ÎN activitati practice fierul este folosit care conține impurități. Când este încălzit, fierul este destul de activ față de multe nemetale. Să luăm în considerare proprietățile chimice ale fierului folosind exemplul de interacțiune cu nemetale tipice: oxigen și sulf.
Când fierul arde în oxigen, se formează un compus de fier și oxigen, care se numește solzi de fier. Reacția este însoțită de eliberarea de căldură și lumină. Să creăm o ecuație pentru o reacție chimică:
3Fe + 2O 2 = Fe 3 O 4
Când este încălzit, fierul reacționează violent cu sulful pentru a forma sulfură de fer (II). Reacția este însoțită și de eliberarea de căldură și lumină. Să creăm o ecuație pentru o reacție chimică:
Fierul este utilizat pe scară largă în industrie și în viața de zi cu zi. Epoca fierului este o epocă în dezvoltarea omenirii, care a început la începutul primului mileniu î.Hr. în legătură cu răspândirea topirii fierului și fabricarea uneltelor din fier și a armelor militare. Epoca fierului a înlocuit epoca bronzului. Oțelul a apărut pentru prima dată în India în secolul al X-lea î.Hr., fonta abia în Evul Mediu. Fierul pur este folosit pentru a face miezuri de transformatoare și electromagneți, precum și în producția de aliaje speciale. Cele mai frecvent utilizate aliaje de fier în practică sunt fonta și oțelul. Fonta este utilizată în producția de piese turnate și oțel, oțelul este folosit ca materiale structurale și pentru scule care sunt rezistente la coroziune.
Sub influența oxigenului atmosferic și a umidității, aliajele de fier se transformă în rugină. Produsul ruginii poate fi descris formula chimica Fe 2 O 3 · xH 2 O. O șesime din fonta topită moare din cauza ruginării, deci problema combaterii coroziunii este foarte relevantă. Metodele de protecție împotriva coroziunii sunt foarte diverse. Cele mai importante dintre ele: protejarea suprafeței metalice cu o acoperire, crearea de aliaje cu proprietăți anticorozive, agenți electrochimici, modificarea compoziției mediului. Straturile de protecție sunt împărțite în două grupe: metalice (acoperirea fierului cu zinc, crom, nichel, cobalt, cupru) și nemetalice (lacuri, vopsele, materiale plastice, cauciuc, ciment). Prin introducerea de aditivi speciali în compoziția aliajelor se obține oțel inoxidabil.
Fier. Apariția fierului în natură
Fier. Prevalența fierului în natură. Rolul biologic glandă
Al doilea element chimic important după oxigen, ale cărui proprietăți vor fi studiate, este Ferum. Fierul este un element metalic care formează substanța simplă fier. Fierul face parte din a opta grupă a subgrupului secundar al tabelului periodic. În funcție de numărul de grup, valența maximă a fierului ar trebui să fie opt, cu toate acestea, în compușii Ferum prezintă mai des valența doi și trei, precum și compuși cunoscuți cu o valență a fierului de șase. Masa atomică relativă a fierului este de cincizeci și șase.
În ceea ce privește abundența sa în scoarța terestră, Ferum ocupă locul al doilea în rândul elementelor metalice după aluminiu. Fracția de masă a fierului din scoarța terestră este de aproape cinci procente. Fierul se găsește foarte rar în starea sa nativă, de obicei doar sub formă de meteoriți. În această formă, strămoșii noștri au putut să se familiarizeze mai întâi cu fierul și să-l aprecieze ca fiind foarte material bun pentru fabricarea sculelor. Se crede că fierul este principalul constituent al nucleului glob. Ferum se găsește cel mai adesea în natură în minereuri. Cele mai importante dintre ele sunt: minereu de fier magnetic (magnetită) Fe 3 O 4, minereu de fier roșu (hematit) Fe 2 O 3, minereu de fier brun (limonit) Fe 2 O 3 nH 2 O, pirita de fier (pirită) FeS 2 , minereu de fier (siderit) FeСO3, goethit FeO (OH). În multe ape izvoare minerale conține Fe (HCO 3) 2 și alte câteva săruri de fier.
Fierul este un element vital. În corpul uman, ca și animalele, ferul este prezent în toate țesuturile, dar cea mai mare parte a acestuia (aproximativ trei grame) este concentrată în celulele sanguine. Atomii de fier ocupă o poziție centrală în moleculele de hemoglobină; hemoglobina își datorează culoarea și capacitatea de a le atașa și elimina oxigenul. Fierul este implicat în procesul de transport al oxigenului de la plămâni la țesuturile corpului. Necesarul zilnic al organismului de Ferum este de 15-20 mg. Cantitatea sa totală intră în corpul uman cu alimente vegetale si carne. Odată cu pierderea de sânge, nevoia de Ferum depășește cantitatea pe care o primește o persoană din alimente. Lipsa de fier în organism poate duce la o afecțiune caracterizată prin scăderea numărului de globule roșii și a hemoglobinei din sânge. Suplimentele de fier trebuie luate numai conform prescripției medicului.
Proprietățile chimice ale oxigenului. Reacții compuse
Proprietățile chimice ale oxigenului. Reacții compuse. Conceptul de oxizi, oxidare și ardere. Condiții pentru inițierea și încetarea arderii
Când este încălzit, oxigenul reacționează energic cu multe substanțe. Dacă adăugați cărbune fierbinte C într-un vas cu oxigen, acesta devine alb-încins și arde. Să creăm o ecuație pentru o reacție chimică:
C + ONaHCO2 = CONaHCO2
Sulful S arde în oxigen cu o flacără albastră strălucitoare pentru a forma o substanță gazoasă - dioxid de sulf. Să creăm o ecuație pentru o reacție chimică:
S + ONaHCO2 = SONaHCO2
Fosforul P arde în oxigen cu o flacără strălucitoare producând un fum alb gros, care constă din particule solide de oxid de fosfor (V). Să creăm o ecuație pentru o reacție chimică:
4P + 5ONaHCO2 = 2PNaHCO2ONaHCO5
Ecuațiile de reacție pentru interacțiunea oxigenului cu cărbunele, sulful și fosforul sunt unite de faptul că în fiecare caz se formează o substanță din două substanțe inițiale. Astfel de reacții, în urma cărora se formează o singură substanță (produs) din mai multe substanțe inițiale (reactivi), se numesc reacții de comunicare.
Produșii interacțiunii oxigenului cu substanțele considerate (cărbune, sulf, fosfor) sunt oxizi. Se numesc oxizi substanțe complexe conținând două elemente, dintre care unul este oxigen. Aproape toate elementele chimice formează oxizi, cu excepția unor elemente inerte: heliu, neon, argon, cripton și xenon. Sunt cateva elemente chimice, care nu se combină direct cu oxigenul, de exemplu, Aurum.
Reacțiile chimice ale substanțelor care interacționează cu oxigenul se numesc reacții de oxidare. Conceptul de „oxidare” este mai general decât conceptul de „combustie”. Arderea este o reacție chimică în care substanțele sunt oxidate, însoțite de eliberarea de căldură și lumină. Pentru ca arderea să aibă loc este necesar urmatoarele conditii: contact strâns al aerului cu o substanță inflamabilă și încălzire la temperatura de aprindere. Pentru diverse substante, temperatura de aprindere are sensuri diferite. De exemplu, temperatura de aprindere a prafului de lemn este de 610 ° C, sulf - 450 ° C, fosfor alb 45 - 60 ° C. Pentru a preveni apariția arderii, este necesar să excitați cel puțin una dintre condițiile specificate. Adică, este necesar să îndepărtați substanța inflamabilă, să o răciți sub temperatura de aprindere și să blocați accesul oxigenului. Procesele de ardere ne însoțesc în viața de zi cu zi, astfel încât fiecare persoană ar trebui să cunoască condițiile pentru apariția și încetarea arderii și, de asemenea, să respecte regulile necesare manipularea substantelor inflamabile.
Ciclul oxigenului în natură
Ciclul oxigenului în natură. Utilizarea oxigenului, rolul său biologic
Aproximativ un sfert din atomii întregii materie vii sunt oxigen. Deoarece numărul total de atomi de oxigen din natură este constant, deoarece oxigenul este eliminat din aer din cauza respirației și a altor procese, acesta trebuie completat. Cele mai importante surse de oxigen din natura neînsuflețită este dioxid de carbon și apă. Oxigenul pătrunde în atmosferă în principal prin procesul de fotosinteză, care implică acest-o-două. O sursă importantă de oxigen este atmosfera Pământului. O parte din oxigen se formează în părțile superioare atmosfera datorita disocierii apei sub influenta radiatie solara. O parte din oxigen este eliberat de plantele verzi în timpul procesului de fotosinteză cu al-două-o și acest-în-doi. La rândul său, acest-o-dou atmosferic se formează ca urmare a reacțiilor de ardere și respirație a animalelor. O-doi atmosferic este cheltuit pentru formarea ozonului în părțile superioare ale atmosferei, procesele oxidative ale intemperiilor rocilor, în procesul de respirație a animalelor și în reacțiile de ardere. Transformarea acestui-o-două în tse-o-dou duce la eliberarea de energie; în consecință, energia trebuie cheltuită pentru a transforma acest-o-doi în o-doi. Această energie se dovedește a fi Soarele. Astfel, viața pe Pământ depinde de ciclic procese chimice posibil datorită energiei solare.
Utilizarea oxigenului se datorează proprietăților sale chimice. Oxigenul este utilizat pe scară largă ca agent oxidant. Se foloseste pentru sudarea si taierea metalelor, in industria chimica- să se obţină diverşi compuşi şi să se intensifice unii Procese de producție. În tehnologia spațială, oxigenul este folosit pentru a arde hidrogenul și alte tipuri de combustibil, în aviație - când zboară altitudini mari, în chirurgie - pentru a sprijini pacienții cu dificultăți de respirație.
Rolul biologic al oxigenului este determinat de capacitatea sa de a susține respirația. O persoană, când respiră în decurs de un minut, consumă în medie 0,5 dm3 de oxigen, în timpul zilei - 720 dm3, iar în timpul anului - 262,8 m3 de oxigen.
1. Reacția de descompunere termică a permanganatului de potasiu. Să creăm o ecuație pentru o reacție chimică:
Substanța potasiu-mangan-o-four este distribuită pe scară largă în viața de zi cu zi sub denumirea de „permanganat de potasiu”. Oxigenul care se formează se manifestă printr-o așchie care mocnește, care clipește puternic la deschiderea tubului de evacuare a gazului al dispozitivului în care se efectuează reacția sau când este introdusă într-un vas cu oxigen.
2. Reacția de descompunere a peroxidului de hidrogen în prezența oxidului de mangan (IV). Să creăm o ecuație pentru o reacție chimică:
Peroxidul de hidrogen este, de asemenea, binecunoscut din viața de zi cu zi. Poate fi folosit pentru a trata zgârieturile și rănile minore (o soluție de trei procente în greutate ar trebui să fie în fiecare kit de urgență). Mulți reacții chimice accelerează în prezența anumitor substanțe. ÎN în acest caz, Reacția de descompunere a peroxidului de hidrogen este accelerată de mangan-o-two, dar mangan-o-two în sine nu este consumat și nu este inclus în produsele de reacție. Mangan-o-two este un catalizator.
Catalizatorii sunt substanțe care accelerează reacțiile chimice fără a fi consumate. Catalizatorii nu sunt doar folosiți pe scară largă în industria chimică, ci și joacă rol importantÎn viața umană. Catalizatori naturali, numiți enzime, implicați în reglarea proceselor biochimice.
Oxigenul, așa cum am menționat mai devreme, este puțin mai greu decât aerul. Prin urmare, poate fi colectat prin deplasarea aerului într-un vas plasat cu deschiderea în sus.
L-au restaurat cu cărbune într-o forjă (vezi), construită într-o groapă; au pompat burduf în forjă, produsul, kritsa, a fost separat de zgură prin lovituri și din ea erau forjate diverse produse. Pe măsură ce metodele de suflare s-au îmbunătățit și înălțimea vetrei a crescut, procesul a crescut și o parte din acesta a fost carburată, adică s-a obținut fontă; acest produs relativ fragil a fost considerat un deșeu de producție. De aici și numele de fontă „porc”, „porc” - fontă englezească. Mai târziu, s-a observat că atunci când încărcați fonta, mai degrabă decât fierul în forjă, se obține și aluat de fier cu emisii scăzute de carbon și un astfel de proces în două etape (vezi redistribuirea Krichny) s-a dovedit a fi mai profitabil decât procesul de suflare a brânzei. În secolele XII-XIII. metoda țipetelor era deja răspândită. În secolul al XIV-lea Fonta a început să fie topită nu numai ca semiprodus pentru prelucrare ulterioară, ci și ca material pentru turnarea diferitelor produse. Reconstrucția cuptorului într-o mină („casă”), apoi într-un furnal, datează și ea din aceeași perioadă. La mijlocul secolului al XVIII-lea. În Europa, a început să fie utilizat procesul de creuzet pentru producția de oțel, care era cunoscut în Siria perioada timpurie Evul Mediu, dar ulterior a devenit uitat. Cu această metodă, oțelul a fost produs prin topirea încărcăturilor metalice în mici (creuvete) dintr-o masă foarte refractară. ÎN ultimul sfert secolul al 18-lea Procesul de băltire de transformare a fontei într-un focar reflectorizant a început să se dezvolte (vezi Pudling). Revoluția industrială a secolului al XVIII-lea - începutul secolului al XIX-lea, invenția mașinii cu abur, construcția căi ferate, poduri mari și o flotă cu abur au creat o nevoie uriașă de el. Cu toate acestea, toate metodele de producție existente nu puteau satisface nevoile pieței. Producția de masă a oțelului a început abia la mijlocul secolului al XIX-lea, când s-au dezvoltat procesele Bessemer, Thomas și pe vatră deschisă. În secolul al XX-lea Procesul de topire a cuptorului electric a apărut și s-a răspândit, producând oțel de înaltă calitate.
Prevalența în natură. În ceea ce privește conținutul în litosferă (4,65% din masă) se află pe locul al doilea între (primul). Migrează viguros în scoarța terestră, formând aproximativ 300 (, etc.). participă activ la procesele magmatice, hidrotermale și supergene cu care este asociată formarea tipuri variate depozitele sale (vezi Fier). - adâncimi pământești, se acumulează pe primele etape magma, în ultrabazică (9,85%) și bazică (8,56%) (în granite este de doar 2,7%). B se acumulează în multe sedimente marine și continentale, formând depozite sedimentare.
Următoarele sunt proprietăți fizice legate în principal de cele cu un conținut total de impurități mai mic de 0,01% din masă:
O interacțiune deosebită cu. HNO 3 concentrat (densitate 1,45 g/cm 3 ) pasivează datorită apariţiei unei pelicule de oxid protector pe suprafaţa sa; HNO 3 mai diluat se dizolvă pentru a forma Fe 2+ sau Fe 3+, fiind redus la MH 3 sau N 2 O și N 2.
Chitanța și cererea. Pure se obține în cantități relativ mici de apos. Se dezvoltă o metodă pentru a obține direct de la. Producția de metale destul de pure crește treptat, fie direct din concentrate de minereu, fie din cărbune la niveluri relativ scăzute.
Cel mai important tehnologie moderna. ÎN formă pură datorită valorii sale scăzute, practic nu este folosit, deși în viața de zi cu zi produsele din oțel sau fontă sunt adesea numite „fier”. Vrac este utilizat sub formă de compoziții și proprietăți foarte diferite. Reprezintă aproximativ 95% din toate produsele metalice. Fontele bogate (peste 2% din greutate) sunt topite în furnal din fier îmbogățit (vezi Producția furnalelor). Oțelul de diferite grade (conținut mai mic de 2% din greutate) este topit din fontă în convertoare cu focar deschis și electrice prin (arderea) în exces, îndepărtarea impurităților dăunătoare (în principal S, P, O) și adăugarea de elemente de aliere (vezi Deschis). -vatră, Convertor). Oțelurile înalt aliate (cu un conținut ridicat de alte elemente) sunt topite în arc electric și inducție. Sunt utilizate procese noi pentru producerea oțelurilor și în scopuri deosebit de critice - vid, retopirea zgurii electros, topirea cu plasmă și fascicul de electroni etc. Se dezvoltă metode de topire a oțelului în unități care funcționează continuu care asigură calitatea înaltă și automatizarea procesului.
Pe baza acesteia, se creează materiale care pot rezista la efectele unor medii înalte și scăzute și înalte, agresive, tensiuni alternative ridicate, radiații nucleare etc. Producția sa este în continuă creștere. În 1971, URSS a produs 89,3 milioane de tone de fier și 121 de milioane de tone de oțel.
L. A. Shvartsman, L. V. Vanyukova.
Ca material artistic a fost folosit încă din antichitate în Egipt (pentru capul de la mormântul lui Tutankhamon de lângă Teba, mijlocul secolului al XIV-lea î.Hr., Muzeul Ashmolean, Oxford), Mesopotamia (pumnale găsite lângă Carchemish, 500 î.Hr., British Museum, Londra). ),