Aceștia sunt derivați ai hidrocarburilor în care un atom de hidrogen este înlocuit cu o grupare hidroxi. Formula generală a alcoolilor este CnH 2 n +1 OH.
Clasificarea alcoolilor monohidroxilici.
În funcție de poziția în care se află EL-grup, distinge:
Alcooli primari:
alcooli secundari:

Alcooli terțiari:
 .
.
Izomeria alcoolilor monohidroxilici.
Pentru alcooli monohidroxilici caracterizată prin izomerie a scheletului de carbon și izomerie a poziției grupării hidroxi.
Proprietățile fizice ale alcoolilor monohidroxilici.
Reacția urmează regula lui Markovnikov, astfel încât numai alcoolul cântec poate fi obținut din alchene primare.
2. Hidroliza halogenurilor de alchil sub influența soluțiilor apoase de alcalii:
Dacă încălzirea este slabă, atunci are loc deshidratarea intramoleculară, ducând la formarea de eteri:
B) Alcoolii pot reacționa cu halogenuri de hidrogen, alcoolii terțiari reacționând foarte rapid, în timp ce alcoolii primari și secundari reacţionează lent:

Utilizarea alcoolilor monohidroxilici.
Alcoolii utilizat în principal în sinteza organică industrială, în Industria alimentară, în medicină și farmacie.
Alcoolii sunt o clasă diversă și largă de compuși chimici.
Alcoolurile sunt compuși chimici, ale căror molecule conțin grupări hidroxil OH legate de un radical hidrocarburic.
Un radical de hidrocarbură este format din atomi de carbon și hidrogen. Exemple de radicali de hidrocarburi - CH3-metil, C2H5-etil. Adesea, un radical de hidrocarbură este pur și simplu notat cu litera R. Dar dacă diferiți radicali sunt prezenți în formulă, ei sunt notați cu R." R ", R """, etc.
Denumirile alcoolilor se formează prin adăugarea sufixului –ol la denumirea hidrocarburii corespunzătoare.
Clasificarea alcoolilor

Alcoolii sunt monohidric și polihidric. Dacă există o singură grupare hidroxil într-o moleculă de alcool, atunci un astfel de alcool se numește monohidric. Dacă numărul de grupări hidroxil este 2, 3, 4 etc., atunci este un alcool polihidroxilic.
Exemple de alcooli monohidroxilici: CH 3 -OH - metanol sau alcool metilic, CH 3 CH 2 -OH - etanol sau etanol.
În consecință, o moleculă de alcool dihidroxilic conține două grupări hidroxil, o moleculă de alcool trihidroxilic conține trei etc.
Alcooli monohidroxilici
Formula generală a alcoolilor monohidroxilici poate fi reprezentată ca R-OH.
Pe baza tipului de radical liber inclus în moleculă, alcoolii monohidroxilici sunt împărțiți în alcooli saturati (saturați), nesaturați (nesaturați) și aromatici.
În radicalii de hidrocarburi saturate, atomii de carbon sunt legați prin legături simple C – C. Radicalii nesaturați conțin una sau mai multe perechi de atomi de carbon legați prin legături duble C = C sau triple C ≡ C.
Alcoolii saturați conțin radicali saturați.
CH 3 CH 2 CH 2 -OH – alcool saturat propanol-1 sau alcool propilenic.
În consecință, alcoolii nesaturați conțin radicali nesaturați.
CH2 = CH-CH2-OH – alcool nesaturat propenol 2-1 (alcool alilic)
Și molecula de alcooli aromatici include un inel benzenic C 6 H 5.
C 6 H 5 -CH 2 -OH – alcool aromatic fenilmetanol (alcool benzilic).
În funcție de tipul de atom de carbon legat de gruparea hidroxil, alcoolii sunt împărțiți în alcooli primari ((R-CH2-OH), secundari (R-CHOH-R) și terțiari (RR"R""C-OH).
Proprietățile chimice ale alcoolilor monohidroxilici

1. Alcoolii ard pentru a forma dioxid de carbon și apă. La ardere, se eliberează căldură.
C2H5OH + 3O2 → 2CO2 + 3H2O
2. Când alcoolii reacţionează cu Metale alcaline Se formează alcoxid de sodiu și se eliberează hidrogen.
C2H5-OH + 2Na → 2C2H5ONa + H2
3. Reacția cu halogenură de hidrogen. Ca rezultat al reacției, se formează un haloalcan (brometan și apă).
C2H5OH + HBr → C2H5Br + H2O
4. Deshidratarea intramoleculară are loc la încălzire și sub influența acidului sulfuric concentrat. Rezultatul este hidrocarbură nesaturată și apă.
H3 – CH2 – OH → CH2 = CH2 + H2O
5. Oxidarea alcoolilor. La temperaturi obișnuite, alcoolii nu se oxidează. Dar cu ajutorul catalizatorilor și al încălzirii are loc oxidarea.
Alcooli polihidroxilici
Ca substanţe care conţin grupări hidroxil, alcoolii polihidroxilici au Proprietăți chimice, similar cu proprietățile alcoolilor monohidroxilici, dar reacția lor are loc la mai multe grupări hidroxil simultan.
Alcoolii polihidroxici reacţionează cu metale active, cu acizi hidrohalici, cu acid azotic.
Prepararea alcoolilor

Să luăm în considerare metodele de producere a alcoolilor folosind exemplul etanolului, a cărui formulă este C 2 H 5 OH.
Cea mai veche dintre ele este distilarea alcoolului din vin, unde se formează ca urmare a fermentației substanțelor zaharoase. Materiile prime pentru producerea alcoolului etilic sunt și produse care conțin amidon, care sunt transformate în zahăr prin procesul de fermentație, care este apoi fermentat în alcool. Dar producerea de alcool etilic în acest mod necesită un consum mare de materii prime alimentare.
O metodă de sinteză mult mai avansată pentru producerea alcoolului etilic. În acest caz, etilena este hidratată cu vapori de apă.
C2H4 + H20 → C2H5OH
Dintre alcoolii polihidroxici, cel mai cunoscut este glicerina, care se obține prin despicarea grăsimilor sau sintetic din propilenă, care se formează în timpul rafinării uleiului la temperatură înaltă.
Alcoolii sunt compuși care conțin una sau mai multe grupări hidroxil legate direct la un radical de hidrocarbură.
Clasificarea alcoolilor
Alcoolurile sunt clasificate în funcție de diferite caracteristici structurale.
1. Pe baza numărului de grupări hidroxil, alcoolii sunt împărțiți în
o monoatomic(un grup -OH)
De exemplu, CH 3 – OH metanol,CH 3 – CH 2 – OH etanol
o poliatomic(două sau mai multe grupe -OH).
Denumirea modernă pentru alcoolii polihidroxilici este polioli(dioli, trioli etc.). Exemple:
alcool dihidric -etilen glicol(etandiol)
HO–CH 2 –CH 2 -OH
alcool trihidroxilic -glicerol(propantriol-1,2,3)
HO–CH 2 –CH(OH)–CH 2 -OH
Alcoolii diatomici cu două grupe OH la același atom de carbon R–CH(OH) 2 sunt instabili și, eliminând apa, se transformă imediat în aldehide R–CH=O. Alcoolii R–C(OH) 3 nu există.
2. În funcție de ce atom de carbon (primar, secundar sau terțiar) este legată gruparea hidroxi, se disting alcoolii
o primar R–CH2-OH,
o secundar R2CH–OH,
o terţiar R3C-OH.
De exemplu:
La alcoolii polihidroxici se disting grupele de alcool primari, secundari si tertiari. De exemplu, o moleculă de alcool trihidroxilic glicerol conține doi alcooli primari (HO-CH2 –) și un alcool secundar (–CH(OH)–) grup.
3. După structura radicalilor asociați atomului de oxigen, alcoolii se împart în
o limită(de exemplu, CH3 – CH2 –OH)
o nelimitat(CH2 =CH–CH2–OH)
o aromatice(C6H5CH2-OH)
Alcoolii nesaturați cu o grupare OH la un atom de carbon conectat la un alt atom printr-o legătură dublă sunt foarte instabili și izomerizează imediat în aldehide sau cetone.
De exemplu,alcoolul vinilic CH 2 =CH–OH se transformă în acetaldehidăCH3 –CH=O
Alcooli monohidroxilici saturați
1. Definiție
ALCOOLI MONO-ACOLOGICI LIMITATI – substanțe organice care conțin oxigen, derivați ai hidrocarburilor saturate, în care un atom de hidrogen este înlocuit cu o grupare funcțională (- OH)
2. Serii omoloage
3. Nomenclatura alcoolilor
Denumirile sistematice sunt date de numele hidrocarburii cu adăugarea unui sufix -olși un număr care indică poziția grupării hidroxi (dacă este necesar). De exemplu:
Numerotarea se bazează pe capătul lanțului cel mai apropiat de grupul OH.
Numărul care reflectă locația grupului OH este de obicei plasat după sufixul „ol” în rusă.

Conform unei alte metode (nomenclatura radical-funcțională), denumirile alcoolilor sunt derivate din numele radicalilor cu adăugarea cuvântului " alcool„. În conformitate cu această metodă, compușii de mai sus se numesc: alcool metilic, alcool etilic, n-alcool propilic CH3-CH2-CH2-OH, alcool izopropilic CH3-CH(OH)-CH3.
4. Izomeria alcoolilor
Caracteristic alcoolilor izomerie structurală:
·
izomeria poziției grupului OH(începând de la C 3);
De exemplu:
· schelet de carbon(începând de la C 4);
De exemplu, izomerii scheletului de carbon pentruC4H9OH:

·
izomerie interclasă cu eterii
De exemplu,
etanol CH3CH2-OHşi dimetil eter CH 3 –O–CH 3
De asemenea, este posibil izomerie spațială- optic.
De exemplu, butanol-2 CH3CH(OH)CH2CH3, în molecula căreia al doilea atom de carbon (evidențiat) este legat de patru substituenți diferiți, există sub forma a doi izomeri optici.
5. Structura alcoolilor
Structura celui mai simplu alcool - metil (metanol) - poate fi reprezentată prin formulele:
Din formula electronica Se poate observa că oxigenul din molecula de alcool are două perechi singure de electroni.
Proprietățile alcoolilor și fenolilor sunt determinate de structura grupului hidroxil, natura legăturilor sale chimice, structura radicalilor de hidrocarburi și influența lor reciprocă.
Legăturile O–H și C–O sunt covalente polare. Aceasta rezultă din diferențele de electronegativitate ale oxigenului (3.5), hidrogenului (2.1) și carbonului (2.4). Densitatea electronică a ambelor legături este deplasată către atomul de oxigen mai electronegativ:
Atom de oxigen în alcooli caracterizată prin hibridizare sp 3. Doi orbitali atomici 2sp 3 participă la formarea legăturilor sale cu atomii C și H; unghiul de legătură C–O–H este apropiat de tetraedrul (aproximativ 108°). Fiecare dintre ceilalți doi orbitali 2 sp 3 ai oxigenului este ocupat de o singură pereche de electroni.Mobilitatea atomului de hidrogen în grupa hidroxil a alcoolului este puțin mai mică decât în apă. Alcoolul metilic (metanol) va fi mai „acid” în seria alcoolilor saturați monohidroxilici.
Radicalii din molecula de alcool joacă, de asemenea, un rol în manifestarea proprietăților acide. De obicei, radicalii de hidrocarburi reduc proprietățile acide. Dar dacă conțin grupuri de atragere de electroni, atunci aciditatea alcoolilor crește considerabil. De exemplu, alcoolul (CF 3) 3 C-OH din cauza atomilor de fluor devine atât de acid încât este capabil să înlocuiască acidul carbonic din sărurile sale.
Alcoolul etilic sau alcoolul de vin este un reprezentant larg răspândit al alcoolilor. Există multe substanțe cunoscute care conțin oxigen, împreună cu carbon și hidrogen. Dintre compușii care conțin oxigen, sunt interesat în primul rând de clasa alcoolilor.
Etanol
Proprietățile fizice ale alcoolului . Alcoolul etilic C 2 H 6 O este un lichid incolor cu un miros deosebit, mai ușor decât apa (gravitate specifică 0,8), fierbe la o temperatură de 78 °,3, dizolvă bine multe substanțe anorganice și materie organică. Alcoolul rectificat conține 96% alcool etilic și 4% apă.
Structura moleculei de alcool .În funcție de valența elementelor, formula C 2 H 6 O corespunde a două structuri:
Pentru a rezolva întrebarea care dintre formule corespunde de fapt alcoolului, să ne întoarcem la experiență.
Pune o bucată de sodiu într-o eprubetă cu alcool. Va începe imediat o reacție, însoțită de eliberarea de gaz. Nu este greu de stabilit că acest gaz este hidrogen.
Acum să organizăm experimentul astfel încât să putem determina câți atomi de hidrogen sunt eliberați în timpul reacției din fiecare moleculă de alcool. Pentru a face acest lucru, adăugați o anumită cantitate de alcool, de exemplu moleculă de 0,1 grame (4,6 grame), picătură cu picătură dintr-o pâlnie într-un balon cu bucăți mici de sodiu (Fig. 1). Hidrogenul eliberat din alcool înlocuiește apa din balonul cu două gâturi în cilindrul de măsurare. Volumul de apă deplasată în cilindru corespunde volumului de hidrogen eliberat.

Fig.1. Experiență cantitativă în producerea hidrogenului din alcool etilic.
Deoarece 0,1 grame de molecule de alcool au fost luate pentru experiment, a fost posibil să se obțină hidrogen (în termeni de conditii normale) aproximativ 1,12 litri Aceasta înseamnă că sodiul înlocuiește 11,2 dintr-o moleculă gram de alcool litri, adică o jumătate de moleculă de gram, cu alte cuvinte 1 atom de gram de hidrogen. În consecință, sodiul înlocuiește doar un atom de hidrogen din fiecare moleculă de alcool.
Evident, în molecula de alcool, acest atom de hidrogen se află într-o poziție specială față de ceilalți cinci atomi de hidrogen. Formula (1) nu explică acest fapt. Potrivit acestuia, toți atomii de hidrogen sunt legați în mod egal de atomii de carbon și, după cum știm, nu sunt înlocuiți de sodiu metalic (sodiul este stocat într-un amestec de hidrocarburi - în kerosen). Dimpotrivă, formula (2) reflectă prezența unui atom situat într-o poziție specială: acesta este legat de carbon printr-un atom de oxigen. Putem concluziona că acest atom de hidrogen este cel mai puțin strâns legat de atomul de oxigen; se dovedește a fi mai mobil și este înlocuit cu sodiu. Prin urmare, formula structurala Alcool etilic:

În ciuda mobilității mai mari a atomului de hidrogen al grupării hidroxil în comparație cu alți atomi de hidrogen, alcoolul etilic nu este un electrolit și nu se disociază în ioni într-o soluție apoasă.

Pentru a sublinia faptul că molecula de alcool conține o grupare hidroxil - OH, conectată la un radical de hidrocarbură, formulă moleculară alcoolul etilic se scrie astfel:

Proprietățile chimice ale alcoolului . Am văzut mai sus că alcoolul etilic reacţionează cu sodiul. Cunoscând structura alcoolului, putem exprima această reacție cu ecuația:

Produsul înlocuirii hidrogenului din alcool cu sodiu se numește etoxid de sodiu. Poate fi izolat după reacție (prin evaporarea excesului de alcool) ca solid.
Când este aprins în aer, alcoolul arde cu o flacără albăstruie, abia vizibilă, eliberând multă căldură:

Dacă încălziți alcoolul etilic cu un acid hidrohalic, de exemplu cu HBr, într-un balon cu frigider (sau un amestec de NaBr și H2SO4, care dă bromură de hidrogen în timpul reacției), atunci un lichid uleios va fi distilat. - bromură de etil C 2 H 5 Br:

Această reacție confirmă prezența unei grupări hidroxil în molecula de alcool.
Când este încălzit cu acid sulfuric concentrat ca catalizator, alcoolul se deshidratează ușor, adică desparte apa (prefixul „de” indică separarea a ceva):

Această reacție este folosită pentru a produce etilenă în laborator. Când alcoolul este încălzit mai slab cu acid sulfuric (nu mai mult de 140 °), fiecare moleculă de apă este separată din două molecule de alcool, rezultând formarea de dietil eter - un lichid volatil, inflamabil:
Eterul dietilic (uneori numit eter sulfuric) este folosit ca solvent (curățarea țesuturilor) și în medicină pentru anestezie. El aparține clasei eteri - substanțe organice ale căror molecule sunt formate din doi radicali de hidrocarburi legați printr-un atom de oxigen: R - O - R1
Utilizarea alcoolului etilic . Alcoolul etilic are o mare semnificație practică. Se consumă mult alcool etilic pentru a produce cauciuc sintetic folosind metoda academicianului S.V. Lebedev. Prin trecerea vaporilor de alcool etilic printr-un catalizator special, se obține divinil:
care se poate polimeriza apoi în cauciuc.
Alcoolul este folosit pentru a produce coloranți, eter dietilic, diverse „esențe de fructe” și o serie de alte substanțe organice. Alcoolul ca solvent este folosit pentru a face parfumuri și multe medicamente. Se prepară diferite lacuri prin dizolvarea rășinilor în alcool. Puterea calorică mare a alcoolului determină utilizarea lui ca combustibil ( combustibil pentru automobile= etanol).
Obținerea alcoolului etilic . Producția mondială de alcool este măsurată în milioane de tone pe an.
O metodă comună de producere a alcoolului este fermentarea substanțelor zaharoase în prezența drojdiei. Aceste organisme vegetale inferioare (ciuperci) produc substanțe speciale - enzime, care servesc drept catalizatori biologici pentru reacția de fermentație.
Semințele de cereale sau tuberculii de cartofi bogați în amidon sunt luați ca materii prime în producerea alcoolului. Amidonul este mai întâi transformat în zahăr folosind malț care conține enzima diastaza, care este apoi fermentat în alcool.
Oamenii de știință au muncit din greu pentru a înlocui materiile prime alimentare pentru producția de alcool cu materii prime nealimentare mai ieftine. Aceste căutări au fost încununate de succes.
ÎN În ultima vreme datorită faptului că la cracarea uleiului se formează multă etilenă, oțel
Reacția de hidratare a etilenei (în prezența acidului sulfuric) a fost studiată de A. M. Butlerov și V. Goryainov (1873), care au prezis și semnificația sa industrială. A fost dezvoltată și introdusă în industrie o metodă de hidratare directă a etilenei prin trecerea acesteia în amestec cu vapori de apă peste catalizatori solizi. Producerea alcoolului din etilenă este foarte economică, deoarece etilena face parte din gazele de cracare ale petrolului și ale altor gaze industriale și, prin urmare, este o materie primă disponibilă pe scară largă.
O altă metodă se bazează pe utilizarea acetilenei ca produs de pornire. Acetilena suferă hidratare conform reacției Kucherov, iar acetaldehida rezultată este redusă catalitic cu hidrogen în prezența nichelului în alcool etilic. Întregul proces de hidratare a acetilenei urmat de reducerea cu hidrogen pe un catalizator de nichel în alcool etilic poate fi reprezentat printr-o diagramă.
Serii omoloage de alcooli
Pe lângă alcoolul etilic, sunt cunoscuți și alți alcooli care îi sunt similari ca structură și proprietăți. Toate pot fi considerate ca derivați ai hidrocarburilor saturate corespunzătoare, în moleculele cărora un atom de hidrogen este înlocuit cu o grupare hidroxil:
Masa
|
Hidrocarburi |
Alcoolii |
Punctul de fierbere al alcoolilor în ºC |
| Metan CH4 | Metil CH30H | 64,7 |
| Etan C2H6 | Etil C2H5OH sauCH3-CH2-OH | 78,3 |
| Propan C3H8 | Propil C4H7OH sau CH3-CH2-CH2-OH | 97,8 |
| Butan C4H10 | Butii C4H9OH sauCH3-CH2-CH2-OH | 117 |
Fiind asemănători ca proprietăți chimice și diferiți unul de celălalt în compoziția moleculelor printr-un grup de atomi de CH 2, acești alcooli formează o serie omoloagă. Comparând proprietăți fizice alcooli, în această serie, precum și în seria hidrocarburilor, observăm trecerea modificărilor cantitative în modificări calitative. Formula generală a alcoolilor din această serie este R - OH (unde R este un radical de hidrocarbură).
Sunt cunoscuți alcooli ale căror molecule conțin mai multe grupări hidroxil, de exemplu:

Grupurile de atomi care determină proprietățile chimice caracteristice ale compușilor, adică funcția lor chimică, se numesc grup functional.
Alcoolii sunt substanțe organice ale căror molecule conțin una sau mai multe grupări hidroxil funcționale legate de un radical de hidrocarbură .
În compoziția lor, alcoolii diferă de hidrocarburile corespunzătoare acestora prin numărul de atomi de carbon prin prezența oxigenului (de exemplu, C 2 H 6 și C 2 H 6 O sau C 2 H 5 OH). Prin urmare, alcoolii pot fi considerați ca produse de oxidare parțială a hidrocarburilor.
Relația genetică dintre hidrocarburi și alcooli
Este destul de dificil să oxidezi direct hidrocarburile în alcool. În practică, este mai ușor să faci acest lucru printr-un derivat de halogen al unei hidrocarburi. De exemplu, pentru a obține alcool etilic pornind de la etan C 2 H 6, puteți obține mai întâi bromură de etil prin reacția:
și apoi transformă bromura de etil în alcool prin încălzire cu apă în prezența alcaline:
În acest caz, este nevoie de un alcalin pentru a neutraliza bromura de hidrogen rezultată și pentru a elimina posibilitatea reacției sale cu alcoolul, de exemplu. mutați această reacție reversibilă spre dreapta.
În mod similar, alcoolul metilic poate fi obținut conform următoarei scheme:
Astfel, hidrocarburile, derivații lor de halogen și alcoolii sunt într-o legătură genetică între ele (relație după origine).
Substanțele formate din hidrocarburi saturate și care conțin o grupare hidroxil (-OH) se numesc alcooli monohidroxilici saturați sau saturati. Denumirile alcoolilor coincid cu numele alcanilor din seria omoloagă cu sufixul „-ol”.
Structura
Formula generală a alcoolilor monohidroxilici saturați este C n H 2n+1 -OH. Hidroxilul este o grupare funcțională și determină proprietățile fizice și chimice ale alcoolilor.
Alcooli monohidroxilici principali (serie omoloagă de metanol):
- metanol sau alcool metilic - CH3OH;
- etanol sau alcool etilic - C2H5OH;
- propanol - C3H7OH;
- butanol - C4H9OH;
- pentanol - C5H11OH.

Orez. 1. Serii omoloage de alcooli monohidroxilici.
Alcoolii saturați se caracterizează prin izomerie structurală și interclasă. În funcție de locația grupării hidroxil în moleculă, substanțele se disting:
- alcooli primari- hidroxil este atașat de primul atom de carbon;
- alcooli secundari- hidroxil este situat la al doilea atom de carbon;
- alcooli terțiari- hidroxilul este legat de al treilea atom de carbon.
Începând cu butanol, se observă izomeria scheletului de carbon. În acest caz, numele alcoolului este scris cu două numere: primul indică poziția grupului metil, al doilea - hidroxil.

Orez. 2. Izomeria scheletului de carbon al alcoolilor saturați.
Alcoolii monohidric formează izomeri interclasă cu eteri - alcool etilic (CH 3 CH 2 -OH), dimetil eter (CH 3 -O-CH 3).
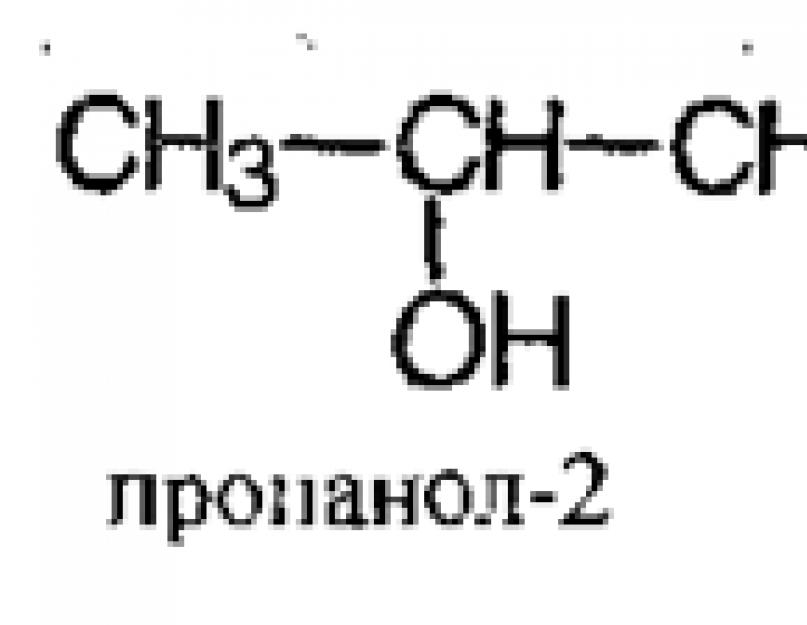
În ciuda faptului că propanolul conține trei atomi de carbon, poate forma doar doi izomeri la grupa hidroxil - propanol-1 și propanol-2.
Proprietăți
Variază în funcție de numărul de atomi de carbon starea de agregare alcooli monohidroxilici. Dacă există până la 15 atomi de carbon într-o moleculă, atunci aceasta este un lichid; mai mult de 15 este un solid. Primii doi alcooli din seria omoloagă, metanol și etanol, precum și izomerul structural propanol-2, se amestecă bine cu apă. Toți alcoolii se topesc și fierb la temperaturi ridicate.
Se explică activitatea alcoolilor prezența O-HȘi Conexiuni S-O, care se rup ușor. Principalele proprietăți chimice ale alcoolilor monohidroxilici sunt prezentate în tabel.
|
Reacţie |
Descriere |
Ecuația |
|
Cu metale |
Reacționează numai cu metale alcaline și alcalino-pământoase cu scindarea legăturii O-H |
2C 2 H 5 OH + 2K → 2C 2 H 5 OK + H 2 |
|
Cu oxigen |
Arsuri în prezență de permanganat sau dicromat de potasiu (KMnO 4, K 2 Cr 2 O 7) |
C2H5OH + 3O2 → 2CO2 + H2O |
|
Cu halogenuri de hidrogen |
Gruparea hidroxil este înlocuită cu un halogen |
C2H5OH + HBr → C2H5Br + H2O |
|
Cu acizi |
Reacționează cu acizii minerali și organici pentru a forma esteri |
C2H5OH + CH3COOH → CH3COOC2H5 |
|
Cu oxizi metalici |
Reacție calitativă cu formarea aldehidei |
C2H5OH + CuO → CH3COH + H2O + Cu |
|
Deshidratare |
Apare în prezența unui acid puternic la temperatură ridicată |
C2H5OH → C2H4 + H2O |
|
Cu acizi carboxilici |
Reacție de esterificare - formare de esteri |
C 2 H 5 OH + CH 3 COOH → CH 3 COOC 2 H 5 + H 2 O |

Orez. 3. Reacția calitativă a alcoolilor monohidroxilici.
Alcoolii monohidroxilici au aplicare largăîn industrie. Etanolul este cel mai utilizat. Se folosește la fabricarea de parfumuri, acid acetic, medicamente, lacuri, coloranți, solvenți și alte substanțe.
Ce am învățat?
Dintr-o lecție de chimie am învățat că alcoolii monohidroxilici saturați sau saturati sunt derivați ai hidrocarburilor saturate cu o grupă hidroxil (hidroxil). Sunt lichide sau solide în funcție de numărul de atomi de carbon. Alcoolii monohidroxilici formează izomeri la gruparea hidroxil, metil și cu eterii. Alcoolii monohidroxilici saturați reacționează cu metale alcaline, acizi și oxizi. Folosit pentru a face medicamente, solvenți, acizi.
Test pe tema
Evaluarea raportului
Rata medie: 4.6. Evaluări totale primite: 173.