Okula giden herkes zorunlu derslerden birinin kimya olduğunu hatırlar. Ondan hoşlanabilirsin ya da hoşlanmayabilirsin; önemli değil. Ve bu disiplindeki bilgilerin çoğunun zaten unutulmuş olması ve hayatta kullanılmaması muhtemeldir. Ancak tablo kimyasal elementler Herkes muhtemelen D.I. Mendeleev'i hatırlar. Birçoğu için, her kareye kimyasal elementlerin adlarını gösteren belirli harflerin yazıldığı çok renkli bir tablo olarak kaldı. Ancak burada kimyadan bu şekilde bahsetmeyeceğiz ve yüzlerce kimyasal reaksiyonu ve süreci anlatacağız, ancak size periyodik tablonun ilk etapta nasıl ortaya çıktığını anlatacağız - bu hikaye herhangi bir kişi ve aslında herkes için ilginç olacaktır. ilginç ve yararlı bilgilere açlar.
Biraz arka plan
1668'de, İrlandalı seçkin kimyager, fizikçi ve ilahiyatçı Robert Boyle, simyayla ilgili birçok efsanenin çürütüldüğü ve ayrışamayan kimyasal elementlerin araştırılmasının gerekliliğini tartıştığı bir kitap yayınladı. Bilim insanı bunların sadece 15 elementten oluşan bir listesini de verdi ancak daha fazla element olabileceği fikrini de kabul etti. bu hale geldi Başlangıç noktası sadece yeni unsurların araştırılmasında değil, aynı zamanda bunların sistemleştirilmesinde de.
Yüz yıl sonra Fransız kimyager Antoine Lavoisier şunları derledi: yeni liste zaten 35 öğe içeriyordu. Bunlardan 23'ünün daha sonra ayrıştırılamaz olduğu ortaya çıktı. Ancak dünya çapındaki bilim adamları tarafından yeni element arayışı devam etti. VE ana rolÜnlü Rus kimyager Dmitry Ivanovich Mendeleev bu süreçte rol oynadı; elementlerin atom kütlesi ile sistemdeki konumları arasında bir ilişki olabileceği hipotezini ilk ortaya atan kişi oydu.
Özenli çalışma ve kimyasal elementlerin karşılaştırılması sayesinde Mendeleev, elementler arasında bir olabilecekleri ve özelliklerinin kesin olarak kabul edilmediği, periyodik olarak tekrarlanan bir olguyu temsil ettiği elementler arasındaki bağlantıyı keşfetmeyi başardı. Sonuç olarak, Şubat 1869'da Mendeleev ilk periyodik yasayı formüle etti ve Mart ayında kimya tarihçisi N. A. Menshutkin tarafından "Özelliklerin elementlerin atom ağırlığı ile ilişkisi" raporu Rus Kimya Derneği'ne sunuldu. Daha sonra aynı yıl Mendeleev'in yayını Almanya'daki "Zeitschrift fur Chemie" dergisinde yayınlandı ve 1871'de başka bir Alman dergisi "Annalen der Chemie" bilim adamının keşfine adanmış yeni ve kapsamlı bir yayınını yayınladı.
Periyodik tablonun oluşturulması

1869'a gelindiğinde ana fikir Mendeleev tarafından oldukça hızlı bir şekilde oluşturulmuştu. Kısa bir zaman ancak uzun bir süre bunu neyin ne olduğunu açıkça gösteren düzenli bir sisteme yerleştiremedi. Meslektaşı A.A. Inostrantsev ile yaptığı görüşmelerden birinde, her şeyin kafasında zaten çözüldüğünü ancak her şeyi masaya koyamadığını bile söyledi. Mendeleev'in biyografi yazarlarına göre bundan sonra başladı. özenli çalışmaÜç gün boyunca uyku molası vermeden masasının başında oturdu. Elementleri bir tablo halinde organize etmek için her türlü yolu denediler ve o zamanlar bilimin henüz tüm kimyasal elementler hakkında bilgi sahibi olmaması nedeniyle iş karmaşıklaştı. Ancak buna rağmen yine de tablo oluşturuldu ve unsurlar sistemleştirildi.
Mendeleev'in rüyasının efsanesi
Birçoğu D.I. Mendeleev'in masasıyla ilgili hayalini kurduğu hikayeyi duydu. Bu versiyon, yukarıda adı geçen Mendeleev'in ortağı A. A. Inostrantsev tarafından aktif olarak dağıtıldı. Komik hikayeöğrencilerini eğlendiriyordu. Dmitry Ivanovich'in yatağa gittiğini ve bir rüyada tüm kimyasal elementlerin doğru sırayla düzenlendiği masasını açıkça gördüğünü söyledi. Bundan sonra öğrenciler 40° votkanın da aynı şekilde keşfedildiğine dair şaka bile yaptılar. Ancak uykulu hikayenin hâlâ gerçek önkoşulları vardı: Daha önce de belirtildiği gibi, Mendeleev uykusuz ve dinlenmeden masada çalışıyordu ve Inostrantsev bir keresinde onu yorgun ve bitkin bulmuştu. Mendeleev gün içinde kısa bir dinlenmeye karar verdi ve bir süre sonra aniden uyandı, hemen bir kağıt parçası aldı ve üzerine hazır bir masa çizdi. Ancak bilim adamının kendisi tüm bu hikayeyi bir rüyayla çürüttü ve şöyle dedi: "Belki de yirmi yıldır bunu düşünüyordum ve sen şöyle düşünüyorsun: Oturuyordum ve aniden... hazır oldu." Yani rüyanın efsanesi çok çekici olabilir ama masanın yaratılması ancak sıkı çalışmayla mümkün olmuştur.

Daha fazla çalışma
1869 ile 1871 yılları arasında Mendeleev, bilim camiasının yöneldiği periyodiklik fikirlerini geliştirdi. Ve biri önemli aşamalar Bu süreç, sistemdeki herhangi bir öğenin, diğer öğelerin özellikleriyle karşılaştırmalı olarak özelliklerinin bütünlüğüne dayalı olarak sahip olması gerektiği anlayışıydı. Buna dayanarak ve aynı zamanda cam oluşturucu oksitlerdeki değişikliklere ilişkin araştırma sonuçlarına da dayanarak kimyager, uranyum, indiyum, berilyum ve diğerleri de dahil olmak üzere bazı elementlerin atom kütlelerinin değerlerinde düzeltmeler yapabildi.
Mendeleev elbette tabloda kalan boş hücreleri hızla doldurmak istiyordu ve 1870'de atom kütlelerini ve özelliklerini hesaplayabildiği, bilim tarafından bilinmeyen kimyasal elementlerin yakında keşfedileceğini öngördü. Bunlardan ilki galyum (1875'te keşfedildi), skandiyum (1879'da keşfedildi) ve germanyum (1885'te keşfedildi) idi. Daha sonra tahminler gerçekleşmeye devam etti ve sekiz yeni element daha keşfedildi: polonyum (1898), renyum (1925), teknetyum (1937), francium (1939) ve astatin (1942-1943). Bu arada, 1900 yılında D.I. Mendeleev ve İskoç kimyager William Ramsay, tablonun sıfır grup elemanlarını da içermesi gerektiği sonucuna vardılar - 1962'ye kadar bunlara inert gazlar ve bundan sonra soy gazlar deniyordu.
Periyodik tablonun organizasyonu
D.I. Mendeleev'in tablosundaki kimyasal elementler kütlelerindeki artışa göre sıralar halinde düzenlenmiş ve sıraların uzunluğu, içindeki elementlerin benzer özelliklere sahip olması için seçilmiştir. Örneğin radon, ksenon, kripton, argon, neon ve helyum gibi soy gazların diğer elementlerle reaksiyona girmesi zordur ve ayrıca kimyasal reaktiviteleri düşüktür, bu nedenle en sağdaki sütunda yer alırlar. Ve sol sütundaki elementler (potasyum, sodyum, lityum vb.) diğer elementlerle iyi reaksiyona girer ve reaksiyonların kendisi patlayıcıdır. Basitçe söylemek gerekirse, her sütundaki öğeler, bir sütundan diğerine değişen benzer özelliklere sahiptir. 92 numaraya kadar olan tüm elementler doğada bulunur ve 93 numaradan sadece laboratuvar koşullarında oluşturulabilen yapay elementler başlar.
Orijinal halinde periyodik sistem yalnızca doğada var olan düzenin bir yansıması olarak anlaşılıyordu ve her şeyin neden bu şekilde olması gerektiğine dair bir açıklama yoktu. Ve ancak kuantum mekaniği ortaya çıktığında, gerçek anlam Tablodaki öğelerin sırası netleşti.
Yaratıcı süreçteki dersler
D. I. Mendeleev'in periyodik tablosunun yaratılışının tüm tarihinden yaratıcı süreçten hangi derslerin çıkarılabileceğinden bahsederken, yaratıcı düşünme alanındaki İngiliz araştırmacı Graham Wallace ve Fransız bilim adamı Henri Poincaré'nin fikirlerini örnek olarak verebiliriz. . Bunları kısaca verelim.
Poincaré (1908) ve Graham Wallace'ın (1926) çalışmalarına göre yaratıcı düşünmenin dört ana aşaması vardır:
- Hazırlık– ana sorunu formüle etme aşaması ve onu çözmeye yönelik ilk girişimler;
- Kuluçka– süreçten geçici olarak uzaklaşmanın olduğu ancak soruna çözüm bulma çalışmasının bilinçaltı düzeyde yürütüldüğü aşama;
- İç yüzü- Bulunduğu aşama sezgisel çözüm. Üstelik bu çözüm, sorunla tamamen ilgisi olmayan bir durumda da bulunabilir;
- Sınav– bu çözümün test edildiği ve olası daha fazla geliştirildiği bir çözümün test edilmesi ve uygulanması aşaması.
Gördüğümüz gibi Mendeleev tablosunu oluşturma sürecinde sezgisel olarak tam olarak bu dört aşamayı takip etti. Bunun ne kadar etkili olduğu sonuçlara göre değerlendirilebilir; tablonun oluşturulmuş olması nedeniyle. Ve yaratılışının sadece kimya bilimi için değil, aynı zamanda tüm insanlık için ileriye doğru büyük bir adım olduğu göz önüne alındığında, yukarıdaki dört aşama hem küçük projelerin uygulanmasına hem de küresel planların uygulanmasına uygulanabilir. Unutulmaması gereken en önemli şey, rüyada görmeyi ne kadar istesek de, ne kadar uyursak uyuyalım, hiçbir keşfin, hiçbir soruna tek bir çözümün tek başına bulunamayacağıdır. Bir şeyin işe yaraması için, ister kimyasal elementlerden oluşan bir tablo oluşturmak ister yeni bir pazarlama planı geliştirmek olsun, belirli bilgi ve becerilere sahip olmanızın yanı sıra potansiyelinizi ustaca kullanmanız ve çok çalışmanız gerekir.
Çalışmalarınızda başarılar dileriz ve başarılı uygulama planlandı!
Kimyasal element, bir dizi atomu tanımlayan kolektif bir terimdir. basit madde yani daha basit (moleküllerinin yapısına göre) bileşenlere bölünemeyen bir bileşen. Bir parça saf demir verildiğini ve kimyagerlerin icat ettiği herhangi bir cihaz veya yöntemi kullanarak onu varsayımsal bileşenlerine ayırmasının istendiğini hayal edin. Ancak hiçbir şey yapamazsınız; demir asla daha basit bir şeye bölünmez. Basit bir madde olan demir, Fe kimyasal elementine karşılık gelir.
Teorik tanım
Yukarıda belirtilen deneysel gerçek, aşağıdaki tanım kullanılarak açıklanabilir: Bir kimyasal element, karşılık gelen basit maddenin, yani aynı türden atomların atomlarının (moleküllerin değil!) soyut bir koleksiyonudur. Yukarıda bahsedilen saf demir parçasındaki atomların her birine ayrı ayrı bakmanın bir yolu olsaydı, o zaman bunların hepsi demir atomu olurdu. Buna zıt olarak, kimyasal bileşikörneğin demir oksit her zaman en az iki tane içerir çeşitli türler atomlar: demir atomları ve oksijen atomları.
Bilmeniz gereken terimler
Atom kütlesi: Bir kimyasal elementin atomunu oluşturan proton, nötron ve elektronların kütlesi.
Atomik numara: Bir elementin atomunun çekirdeğindeki proton sayısı.
Kimyasal sembol: harf veya çift Latin harfleri, bu elemanın tanımını temsil eder.
Kimyasal bileşik: İki veya daha fazla kimyasal elementin belli bir oranda bir araya gelmesinden oluşan madde.
Metal: Diğer elementlerle kimyasal tepkimelerde elektronlarını kaybeden element.
Metaloid: Bazen metal, bazen de ametal olarak reaksiyona giren element.
Metal olmayan: Elektron kazanmaya çalışan element kimyasal reaksiyonlar diğer unsurlarla.
Kimyasal Elementlerin Periyodik Tablosu: Kimyasal elementleri atom numaralarına göre sınıflandırmaya yarayan sistem.
Sentetik eleman: Laboratuvarda yapay olarak üretilen ve genellikle doğada bulunmayan şey.

Doğal ve sentetik elementler
Doksan iki kimyasal element Dünya'da doğal olarak bulunur. Geri kalanı laboratuvarlarda yapay olarak elde edildi. Sentetik bir kimyasal element genellikle parçacık hızlandırıcılardaki (elektronlar ve protonlar gibi atom altı parçacıkların hızını arttırmak için kullanılan cihazlar) nükleer reaksiyonların ürünüdür veya nükleer reaktörler(nükleer reaksiyonlar sırasında açığa çıkan enerjiyi kontrol etmek için kullanılan cihazlar). Atom numarası 43 olan ilk sentetik element, 1937'de İtalyan fizikçiler C. Perrier ve E. Segre tarafından keşfedilen teknetyumdu. Teknesyum ve prometyum dışında tüm sentetik elementlerin çekirdeği uranyumdan daha büyüktür. Adını alan son sentetik kimyasal element karaciğermoryumdur (116) ve ondan önce de flerovyumdur (114).

İki düzine ortak ve önemli unsur
| İsim | Sembol | Tüm atomların yüzdesi * | Kimyasal elementlerin özellikleri (normal oda koşullarında) |
|||
| Evrende | Yer kabuğunda | Deniz suyunda | İnsan vücudunda |
|||
| Alüminyum | Al | - | 6,3 | - | - | Hafif, gümüş metal |
| Kalsiyum | CA | - | 2,1 | - | 0,02 | Doğal minerallerde, kabuklarda, kemiklerde bulunur |
| Karbon | İLE | - | - | - | 10,7 | Tüm canlı organizmaların temeli |
| Klor | Cl | - | - | 0,3 | - | Zehirli gaz |
| Bakır | Cu | - | - | - | - | Yalnızca kırmızı metal |
| Altın | Au | - | - | - | - | Yalnızca sarı metal |
| Helyum | O | 7,1 | - | - | - | Çok hafif gaz |
| Hidrojen | N | 92,8 | 2,9 | 66,2 | 60,6 | Tüm unsurların en hafifi; gaz |
| İyot | BEN | - | - | - | - | Metal olmayan; antiseptik olarak kullanılır |
| Ütü | Fe | - | 2,1 | - | - | Manyetik metal; demir ve çelik üretiminde kullanılır |
| Yol göstermek | kurşun | - | - | - | - | Yumuşak, ağır metal |
| Magnezyum | Mg | - | 2,0 | - | - | Çok hafif metal |
| Merkür | Hg | - | - | - | - | Sıvı metal; iki sıvı elementten biri |
| Nikel | Hayır | - | - | - | - | Korozyona dayanıklı metal; madeni paralarda kullanılır |
| Azot | N | - | - | - | 2,4 | Havanın ana bileşeni olan gaz |
| Oksijen | HAKKINDA | - | 60,1 | 33,1 | 25,7 | Gaz, ikinci önemli olan hava bileşeni |
| Fosfor | R | - | - | - | 0,1 | Metal olmayan; bitkiler için önemli |
| Potasyum | İLE | - | 1.1 | - | - | Metal; bitkiler için önemli; genellikle "potas" denir |
* Değer belirtilmezse öğe yüzde 0,1'den azdır.
Madde oluşumunun temel nedeni olarak Büyük Patlama
Evrendeki ilk kimyasal element hangisiydi? Bilim insanları bu sorunun cevabının yıldızlarda ve yıldızların oluşma süreçlerinde yattığına inanıyor. Evrenin 12 ila 15 milyar yıl önce bir noktada ortaya çıktığına inanılıyor. Bu ana kadar enerji dışında var olan hiçbir şey düşünülmemektedir. Ancak bu enerjiyi büyük bir patlamaya (sözde Büyük Patlama) dönüştüren bir şey oldu. Sonraki saniyelerde büyük patlama madde oluşmaya başladı.
Maddenin ortaya çıkan ilk basit biçimleri protonlar ve elektronlardı. Bazıları birleşerek hidrojen atomlarını oluşturur. İkincisi bir proton ve bir elektrondan oluşur; var olabilecek en basit atomdur.

Yavaş yavaş, uzun süreler boyunca, hidrojen atomları uzayın belirli alanlarında bir araya gelerek yoğun bulutlar oluşturmaya başladı. Bu bulutlardaki hidrojen, yerçekimi kuvvetleri tarafından kompakt oluşumlara çekildi. Sonunda bu hidrojen bulutları yıldızları oluşturacak kadar yoğunlaştı.
Yeni elementlerin kimyasal reaktörleri olarak yıldızlar
Bir yıldız, nükleer reaksiyonlardan enerji üreten bir madde kütlesidir. Bu reaksiyonlardan en yaygın olanı, dört hidrojen atomunun bir helyum atomu oluşturmasını içerir. Yıldızlar oluşmaya başladıktan sonra helyum Evrende ortaya çıkan ikinci element oldu.
Yıldızlar yaşlandıkça hidrojen-helyum nükleer reaksiyonlarından diğer türlere geçerler. İçlerinde helyum atomları karbon atomlarını oluşturur. Daha sonra karbon atomları oksijen, neon, sodyum ve magnezyumu oluşturur. Daha sonra neon ve oksijen birbirleriyle birleşerek magnezyum oluşturur. Bu reaksiyonlar devam ettikçe giderek daha fazla kimyasal element oluşur.
Kimyasal elementlerin ilk sistemleri
200 yıldan fazla bir süre önce kimyagerler bunları sınıflandırmanın yollarını aramaya başladı. On dokuzuncu yüzyılın ortalarında yaklaşık 50 kimyasal element biliniyordu. Kimyagerlerin çözmeye çalıştığı sorulardan biri. özetlemek gerekirse: bir kimyasal element diğer elementlerden tamamen farklı bir madde midir? Veya bazı unsurlar başkalarıyla bir şekilde bağlantılı mı? Var olup olmadığı Genel hukuk onları birleştirmek mi?
Kimyagerler önerdi çeşitli sistemler kimyasal elementler. Örneğin, 1815'te İngiliz kimyager William Prout, eğer birliğe eşit alırsak, tüm elementlerin atom kütlelerinin hidrojen atomunun kütlesinin katları olduğunu, yani tamsayı olmaları gerektiğini öne sürdü. O zamanlar pek çok elementin atomik kütleleri J. Dalton tarafından hidrojenin kütlesine göre hesaplanmıştı. Ancak karbon, nitrojen ve oksijen için durum yaklaşık olarak buysa, 35,5 kütleli klor bu şemaya uymuyordu.
Alman kimyager Johann Wolfgang Dobereiner (1780 – 1849), 1829'da halojen grubu olarak adlandırılan üç elementin (klor, brom ve iyot) bağıl atom kütlelerine göre sınıflandırılabileceğini gösterdi. Bromun atom ağırlığının (79,9), klor (35,5) ve iyotun (127) atom ağırlıklarının neredeyse tam olarak ortalaması olduğu, yani 35,5 + 127 ÷ 2 = 81,25 (79,9'a yakın) olduğu ortaya çıktı. Bu, kimyasal element gruplarından birini oluşturmaya yönelik ilk yaklaşımdı. Dobereiner böyle iki element üçlüsü daha keşfetti, ancak genel bir periyodik yasa formüle edemedi.
Kimyasal elementlerin periyodik tablosu nasıl ortaya çıktı?
Erken sınıflandırma şemalarının çoğu pek başarılı değildi. Daha sonra, 1869 civarında, neredeyse aynı keşif iki kimyager tarafından hemen hemen aynı anda yapıldı. Rus kimyager Dmitri Mendeleev (1834-1907) ve Alman kimyager Julius Lothar Meyer (1830-1895), benzer fiziksel ve yapısal özelliklere sahip elemanların düzenlenmesini önerdiler. Kimyasal özellikler gruplardan, serilerden ve periyotlardan oluşan düzenli bir sisteme dönüştürür. Aynı zamanda Mendeleev ve Meyer, kimyasal elementlerin özelliklerinin atom ağırlıklarına bağlı olarak periyodik olarak tekrarlandığına dikkat çekti.
Bugün Mendeleev genellikle kaşif olarak kabul ediliyor periyodik yasaÇünkü Meyer'in atmadığı bir adımı attı. Periyodik tabloda tüm elementler sıralandığında bazı boşluklar ortaya çıktı. Mendeleev buraların henüz keşfedilmemiş elementlerin bulunduğu yerler olduğunu öngördü.
Ancak daha da ileri gitti. Mendeleev henüz keşfedilmemiş bu elementlerin özelliklerini tahmin etti. Periyodik tablonun neresinde olduklarını biliyordu, dolayısıyla özelliklerini tahmin edebiliyordu. Mendeleev'in öngördüğü her kimyasal elementin (galyum, skandiyum ve germanyum) periyodik yasasını yayınlamasından on yıldan kısa bir süre sonra keşfedilmesi dikkat çekicidir.
Periyodik tablonun kısa formu
Periyodik tablonun grafik gösterimi için farklı bilim adamları tarafından kaç seçeneğin önerildiği sayılmaya çalışıldı. 500'den fazla olduğu ortaya çıktı. Üstelik %80'i toplam sayısı seçenekler tablolardır ve geri kalanı geometrik şekiller, matematiksel eğriler vb. Sonuç olarak pratik kullanım dört tür masa buldu: kısa, yarı uzun, uzun ve merdivenli (piramidal). İkincisi, büyük fizikçi N. Bohr tarafından önerildi.
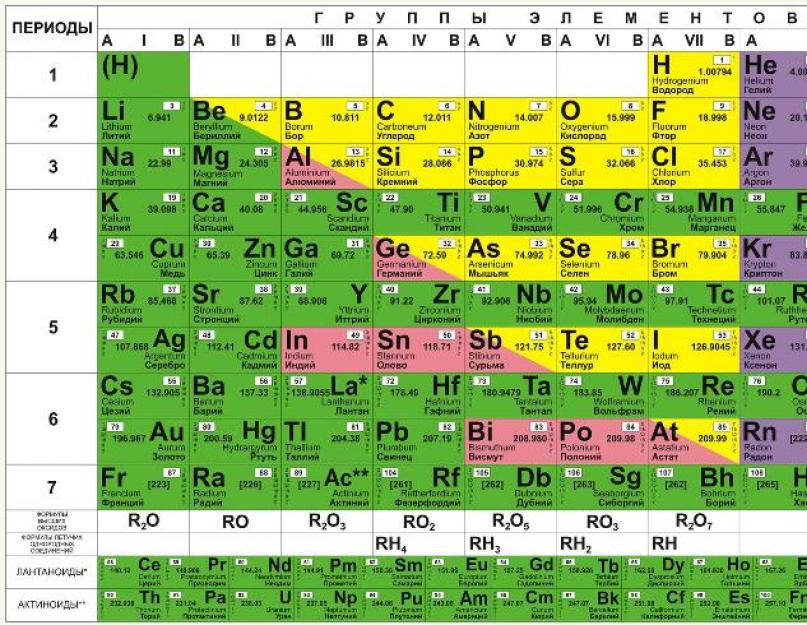
Aşağıdaki resim kısa formu göstermektedir.

İçinde kimyasal elementler atom numaralarına göre soldan sağa ve yukarıdan aşağıya artan sırada düzenlenmiştir. Böylece periyodik tablonun ilk kimyasal elementi olan hidrojen atom numarası 1'e sahiptir çünkü hidrojen atomlarının çekirdekleri bir ve yalnızca bir proton içerir. Benzer şekilde, tüm oksijen atomlarının çekirdekleri 8 proton içerdiğinden oksijenin atom numarası 8'dir (aşağıdaki şekle bakın).

Periyodik sistemin ana yapısal parçaları periyotlar ve element gruplarıdır. Altı periyotta tüm hücreler doldurulur, yedincisi henüz tamamlanmamıştır (113, 115, 117 ve 118. elementler laboratuvarlarda sentezlenmiş olmasına rağmen henüz resmi olarak tescil edilmemiştir ve isimleri yoktur).
Gruplar ana (A) ve ikincil (B) alt gruplara ayrılır. Her biri bir satır içeren ilk üç periyodun elemanları yalnızca A alt gruplarına dahil edilir. Geriye kalan dört periyot ise iki satırdan oluşmaktadır.
Aynı gruptaki kimyasal elementler benzer kimyasal özelliklere sahip olma eğilimindedir. Bu nedenle, birinci grup alkali metallerden, ikinci grup ise toprak alkali metallerden oluşur. Aynı periyotta bulunan elementler, alkali metalden soy gaza yavaşça değişen özelliklere sahiptir. Aşağıdaki şekil atom yarıçapı özelliklerinden birinin nasıl değiştiğini göstermektedir. bireysel unsurlar masada.
Periyodik tablonun uzun periyot formu
Aşağıdaki şekilde gösterilmiştir ve satırlar ve sütunlar olmak üzere iki yöne bölünmüştür. Kısa formda olduğu gibi yedi nokta satırı ve grup veya aile adı verilen 18 sütun vardır. Aslında grup sayısının kısa formda 8'den uzun formda 18'e çıkması, tüm elemanların 4'üncüden başlayarak periyotlara iki değil tek satıra yerleştirilmesiyle elde ediliyor.
İki farklı sistemler Numaralandırma, tablonun üst kısmında gösterildiği gibi gruplar için kullanılır. Romen rakamı sistemi (IA, IIA, IIB, IVB, vb.) geleneksel olarak Amerika Birleşik Devletleri'nde popülerdir. Başka bir sistem (1, 2, 3, 4 vb.) Avrupa'da geleneksel olarak kullanılmaktadır ve birkaç yıl önce ABD'de kullanılması önerilmiştir.

Periyodik tabloların yukarıdaki şekillerdeki görünümü, yayınlanmış herhangi bir tabloda olduğu gibi biraz yanıltıcıdır. Bunun nedeni tabloların alt kısmında gösterilen iki öğe grubunun aslında bunların içinde yer alması gerektiğidir. Örneğin lantanitler baryum (56) ve hafniyum (72) arasındaki 6. periyoda aittir. Ek olarak aktinitlerin radyum (88) ile rutherfordiyum (104) arasındaki 7. periyoda ait olduğu bilinmektedir. Bir masaya yerleştirilselerdi, bir kağıt parçasına veya bir duvar tablosuna sığamayacak kadar geniş olurdu. Bu nedenle bu elemanların tablonun altına yerleştirilmesi gelenekseldir.
Periyodik tablo bunlardan biridir en büyük keşiflerÇevremizdeki dünya hakkındaki bilgileri düzenlemeyi ve keşfetmeyi mümkün kılan insanlık yeni kimyasal elementler. Okul çocukları için olduğu kadar kimyayla ilgilenen herkes için de gereklidir. Ayrıca bu şema bilimin diğer alanlarında da vazgeçilmezdir.
Bu diyagram her şeyi içerir insanoğlunun bildiği elementler, özelliklerine göre gruplandırılmıştır. atom kütlesi ve seri numarası
. Bu özellikler elementlerin özelliklerini etkiler. Tablonun kısa versiyonunda toplamda 8 grup bulunmaktadır; bir grupta yer alan elementler birbirine çok benzer özelliklere sahiptir. Birinci grup hidrojen, lityum, potasyum, bakır içerir. Latince telaffuz Rusça'da cuprum anlamına gelir. Ve ayrıca argentum - gümüş, sezyum, altın - aurum ve francium. İkinci grupta berilyum, magnezyum, kalsiyum, çinko bulunur, ardından stronsiyum, kadmiyum, baryum gelir ve grup cıva ve radyumla sonlanır.
Üçüncü grup bor, alüminyum, skandiyum, galyumdan oluşmakta, bunu itriyum, indiyum, lantan takip etmekte ve grup talyum ve aktinyum ile son bulmaktadır. Dördüncü grup karbon, silikon, titanyum ile başlar, germanyum, zirkonyum, kalay ile devam eder ve hafniyum, kurşun ve rutherfordyum ile biter. Beşinci grupta nitrojen, fosfor, vanadyum gibi elementler bulunur, bunların altında arsenik, niyobyum, antimon gelir, ardından tantal, bizmut gelir ve grubu dubniyum ile tamamlar. Altıncısı oksijenle başlar, ardından kükürt, krom, selenyum, ardından molibden, tellür, ardından tungsten, polonyum ve denizborgyum gelir.
Yedinci grupta birinci element florin, ardından klor, manganez, brom, teknetyum, ardından iyot, ardından renyum, astatin ve bohrium gelir. Son grup ise en çok sayıda. Helyum, neon, argon, kripton, ksenon ve radon gibi gazları içerir. Bu grup aynı zamanda demir, kobalt, nikel, rodyum, paladyum, rutenyum, osmiyum, iridyum ve platin metallerini de içerir. Daha sonra hanniyum ve meitnerium gelir. Oluşumu oluşturan unsurlar Aktinit serisi ve lantanit serisi. Lantan ve aktinyum ile benzer özelliklere sahiptirler.

Bu şema 2'ye ayrılan her türlü öğeyi içerir büyük gruplar – metaller ve metal olmayanlar, sahip farklı özellikler. Bir elementin bir gruba mı yoksa diğerine mi ait olduğunun belirlenmesi, bordan astatine çekilmesi gereken geleneksel bir çizgiyle kolaylaştırılacaktır. Unutulmamalıdır ki böyle bir çizgi ancak tam versiyon tablolar. Bu çizginin üzerinde yer alan ve ana alt gruplarda yer alan tüm elementler metal olmayan olarak kabul edilir. Aşağıda ana alt gruplarda yer alanlar ise metallerdir. Metaller aynı zamanda doğada bulunan maddelerdir. yan alt gruplar. Bu unsurların konumunu ayrıntılı olarak öğrenebileceğiniz özel resimler ve fotoğraflar bulunmaktadır. Bu çizgide yer alan elementlerin hem metallerin hem de metal olmayanların aynı özelliklerini sergilediğini belirtmekte fayda var.
Ayrı bir liste, ikili özelliklere sahip olan ve reaksiyonlar sonucunda 2 tip bileşik oluşturabilen amfoterik elementlerden oluşur. Aynı zamanda hem temel hem de asit özellikleri. Belirli özelliklerin baskınlığı, reaksiyon koşullarına ve amfoterik elementin reaksiyona girdiği maddelere bağlıdır.

Geleneksel kaliteli tasarımıyla bu şemanın renkli olduğunu belirtmekte fayda var. burada farklı renkler yönlendirme kolaylığı için belirtilmiştir ana ve ikincil alt gruplar. Ayrıca elementler özelliklerinin benzerliğine göre gruplandırılır.
Ancak günümüzde renk şemasının yanı sıra Mendeleev'in siyah beyaz periyodik tablosu da oldukça yaygındır. Bu tür siyah beyaz yazdırma için kullanılır. Görünen karmaşıklığına rağmen, bazı nüansları hesaba katarsanız onunla çalışmak da aynı derecede kullanışlıdır. Dolayısıyla bu durumda, ana alt grubu ikincil alt gruptan, açıkça görülebilen renk farklılıklarıyla ayırt etmek mümkündür. Ek olarak, renkli versiyonda farklı katmanlarda elektron bulunan elementler belirtilmiştir. farklı renkler.
Tek renkli bir tasarımda şemada gezinmenin çok zor olmadığını belirtmekte fayda var. Bu amaçla, elemanın her bir hücresinde belirtilen bilgiler yeterli olacaktır.

Bugün Birleşik Devlet Sınavı okul sonundaki ana sınav türüdür, bu da buna hazırlık yapılması gerektiği anlamına gelir Özel dikkat. Bu nedenle seçim yaparken kimya final sınavı, geçmenize yardımcı olabilecek malzemelere dikkat etmeniz gerekiyor. Kural olarak, okul çocuklarının sınav sırasında bazı tabloları, özellikle de periyodik tabloyu kullanmalarına izin verilir. iyi kalite. Bu nedenle, yalnızca test sırasında fayda sağlayabilmesi için, yapısına ve elementlerin özelliklerinin yanı sıra sıralarının incelenmesine önceden dikkat edilmelidir. Ayrıca öğrenmeniz gerekiyor tablonun siyah beyaz versiyonunu kullanın Sınavda bazı zorluklarla karşılaşmamak için.

Elementlerin özelliklerini ve atom kütlesine bağımlılıklarını karakterize eden ana tabloya ek olarak, kimya çalışmalarına yardımcı olabilecek başka diyagramlar da vardır. Örneğin, var maddelerin çözünürlük ve elektronegatiflik tabloları. Birincisi, belirli bir bileşiğin normal sıcaklıkta suda ne kadar çözünür olduğunu belirlemek için kullanılabilir. Bu durumda, anyonlar yatay olarak yerleştirilir - negatif yüklü iyonlar ve katyonlar - yani pozitif yüklü iyonlar - dikey olarak yerleştirilir. Öğrenmek için çözünürlük derecesi bir veya başka bir bileşiğin bileşenlerini tabloyu kullanarak bulmak gerekir. Ve kesiştikleri yerde gerekli atama olacaktır.
"R" harfi ise, madde suda tamamen çözünür demektir. normal koşullar. Eğer “m” harfi varsa madde az çözünür, “n” harfi varsa ise neredeyse çözünmezdir. Eğer “+” işareti varsa bileşik çökelti oluşturmaz ve solvent ile kalıntı bırakmadan reaksiyona girer. Eğer "-" işareti mevcutsa böyle bir maddenin olmadığı anlamına gelir. Bazen tabloda “?” işaretini de görebilirsiniz, bu da bu bileşiğin çözünürlük derecesinin kesin olarak bilinmediği anlamına gelir. Elementlerin elektronegatifliği 1'den 8'e kadar değişebilir, bu parametrenin belirlenmesi için de özel bir tablo bulunmaktadır.
 Bir diğer yararlı tablo ise metal aktivite serisidir. Tüm metaller artan elektrokimyasal potansiyel derecelerine göre içinde bulunur. Metal voltaj serisi lityum ile başlar ve altın ile biter. Bir metalin belirli bir sıradaki yeri ne kadar solda işgal ederse, kimyasal reaksiyonlarda o kadar aktif olduğuna inanılmaktadır. Böylece, en çok aktif metal
Lityum alkali bir metal olarak kabul edilir. Element listesinin sonuna doğru hidrojen de yer alıyor. Ondan sonra bulunan metallerin pratik olarak etkisiz olduğuna inanılmaktadır. Bunlar bakır, cıva, gümüş, platin ve altın gibi elementleri içerir.
Bir diğer yararlı tablo ise metal aktivite serisidir. Tüm metaller artan elektrokimyasal potansiyel derecelerine göre içinde bulunur. Metal voltaj serisi lityum ile başlar ve altın ile biter. Bir metalin belirli bir sıradaki yeri ne kadar solda işgal ederse, kimyasal reaksiyonlarda o kadar aktif olduğuna inanılmaktadır. Böylece, en çok aktif metal
Lityum alkali bir metal olarak kabul edilir. Element listesinin sonuna doğru hidrojen de yer alıyor. Ondan sonra bulunan metallerin pratik olarak etkisiz olduğuna inanılmaktadır. Bunlar bakır, cıva, gümüş, platin ve altın gibi elementleri içerir.
Periyodik tablo resimleri iyi kalitede
Bu plan kimya alanındaki en büyük başarılardan biridir. burada bu tablonun birçok türü var– kısa versiyon, uzun ve ekstra uzun. En yaygın olanı kısa tablodur, ancak diyagramın uzun versiyonu da yaygındır. Devrenin kısa versiyonunun şu anda IUPAC tarafından kullanılması tavsiye edilmediğini belirtmekte fayda var.
Toplamda vardı Yüzden fazla tablo türü geliştirildi sunum, biçim ve grafiksel gösterim bakımından farklılık gösterir. Farklı bilim alanlarında kullanılırlar veya hiç kullanılmazlar. Halen araştırmacılar tarafından yeni devre konfigürasyonları geliştirilmeye devam edilmektedir. Ana seçenek mükemmel kalitede kısa veya uzun devredir.
Periyodik yasanın formülasyonunu bilen ve D.I. Mendeleev'in periyodik element sistemini kullanan kişi, herhangi bir kimyasal elementi ve onun bileşiklerini karakterize edebilir. Bir kimyasal elementin böyle bir özelliğini plana göre bir araya getirmek uygundur.
I. Bir kimyasal elementin sembolü ve adı.
II. Kimyasal elementin konumu periyodik tablo elementler D.I. Mendeleev:
- seri numarası;
- dönem numarası;
- grup numarası;
- alt grup (ana veya ikincil).
III. Kimyasal bir elementin atomunun yapısı:
- bir atomun çekirdeğinin yükü;
- akraba atom kütlesi kimyasal element;
- proton sayısı;
- elektron sayısı;
- nötron sayısı;
- Bir atomdaki elektronik seviye sayısı.
IV. Bir atomun elektronik ve elektron-grafik formülleri, değerlik elektronları.
V. Kimyasal elementin türü (metal veya metal olmayan, s-, p-, d- veya f-element).
VI. Bir kimyasal elementin en yüksek oksit ve hidroksit formülleri, özelliklerinin özellikleri (bazik, asidik veya amfoterik).
VII. Bir kimyasal elementin metalik veya metalik olmayan özelliklerinin periyot ve alt gruplara göre komşu elementlerin özellikleriyle karşılaştırılması.
VIII. Bir atomun maksimum ve minimum oksidasyon durumu.
Örneğin, seri numarası 15 olan bir kimyasal elementin ve bileşiklerinin, D.I. Mendeleev'in periyodik element tablosundaki konumlarına ve atomun yapısına göre bir tanımını sunacağız.
I. D.I. Mendeleev'in tablosunda kimyasal element sayısını içeren bir hücre buluyoruz, sembolünü ve adını yazıyoruz.
15 numaralı kimyasal element Fosfordur. Sembolü R'dir.
II. D.I. Mendeleev'in tablosundaki öğenin konumunu (dönem numarası, grup, alt grup türü) karakterize edelim.
Fosfor V. grubun ana alt grubunda 3. periyotta yer alır.
III. Bir kimyasal elementin atomunun bileşiminin genel bir tanımını yapacağız (nükleer yük, atom kütlesi, proton sayısı, nötron, elektron ve elektronik seviyeler).
Fosfor atomunun nükleer yükü +15'tir. Fosforun bağıl atom kütlesi 31'dir. Bir atomun çekirdeği 15 proton ve 16 nötron içerir (31 - 15 = 16). Fosfor atomunun 15 elektron içeren üç enerji seviyesi vardır.
IV. Değerlik elektronlarını işaretleyerek atomun elektronik ve elektron-grafik formüllerini oluşturuyoruz.
Fosfor atomunun elektronik formülü şöyledir: 15 P 1s 2 2s 2 2p 6 3s 2 3p 3.
Fosfor atomunun dış seviyesi için elektron-grafik formül: üçüncü enerji seviyesinde, 3s alt seviyesinde iki elektron vardır (bir hücrede zıt yönde iki ok yazılmıştır), üç p-alt seviyesinde üç tane vardır elektronlar (aynı yöne sahip üç hücre okunun her birine bir tane yazılmıştır).
Değerlik elektronları dış seviyedeki elektronlardır, yani. 3s2 3p3 elektronları.
V. Kimyasal elementin türünü belirleyin (metal veya metal olmayan, s-, p-, d-veya f-element).
Fosfor metal olmayan bir maddedir. Fosfor atomunun elektronlarla dolu olan son alt düzeyi p-alt düzeyi olduğundan, Fosfor, p-elementleri ailesine aittir.
VI. Fosforun daha yüksek oksit ve hidroksit formüllerini oluşturuyoruz ve özelliklerini (bazik, asidik veya amfoterik) karakterize ediyoruz.
Daha yüksek fosfor oksit P 2 O 5, asidik bir oksidin özelliklerini sergiler. Daha yüksek oksit olan H3P04'e karşılık gelen hidroksit, bir asidin özelliklerini sergiler. Bu özellikleri kimyasal reaksiyon türlerinin denklemleriyle doğrulayalım:
P 2 Ö 5 + 3 Na 2 Ö = 2Na 3 PO 4
H3P04 + 3NaOH = Na3P04 + 3H20
VII. Fosforun metalik olmayan özelliklerini periyot ve alt gruba göre komşu elementlerin özellikleriyle karşılaştıralım.
Fosforun alt grup komşusu nitrojendir. Fosforun dönem komşuları silikon ve kükürttür. Ana alt gruplardaki kimyasal elementlerin atomlarının metalik olmayan özellikleri, atom numarasının artmasıyla birlikte periyotlarda artar ve gruplarda azalır. Bu nedenle fosforun metalik olmayan özellikleri silikonunkinden daha belirgin, nitrojen ve kükürtünkinden daha az belirgindir.
VIII. Fosfor atomunun maksimum ve minimum oksidasyon durumunu belirleriz.
Maksimum pozitif derece ana alt grupların kimyasal elementlerinin oksidasyonu grup numarasına eşittir. Fosfor beşinci grubun ana alt grubunda yer alır, dolayısıyla fosforun maksimum oksidasyon durumu +5'tir.
Çoğu durumda ametaller için minimum oksidasyon durumu, grup numarası ile sekiz sayısı arasındaki farktır. Dolayısıyla fosforun minimum oksidasyon durumu -3'tür.
MENDELEEV'İN PERİYODİK TABLOSU
Mendeleev'in kimyasal elementlerden oluşan periyodik tablosunun yapısı, sayı teorisinin ve dik tabanların karakteristik dönemlerine karşılık gelir. Hadamard matrislerinin çift ve tek sıralı matrislerle eklenmesi, iç içe geçmiş matris elemanlarının yapısal temelini oluşturur: birinci (Odin), ikinci (Euler), üçüncü (Mersenne), dördüncü (Hadamard) ve beşinci (Fermat) derecelerin matrisleri.
4 sipariş olduğunu görmek kolaydır k Hadamard matrisleri, atom kütlesi dördün katı olan atıl elementlere karşılık gelir: helyum 4, neon 20, argon 40 (39,948), vb. ve aynı zamanda yaşamın ve dijital teknolojinin temelleri: karbon 12, oksijen 16, silikon 28 , germanyum 72.
Görünüşe göre mersenne matrisleri 4 ile k–1, aksine aktif, zehirli, yıkıcı ve aşındırıcı olan her şey birbiriyle bağlantılıdır. Ancak bunlar aynı zamanda radyoaktif elementlerdir - enerji kaynakları ve kurşun 207 (son ürün, zehirli tuzlar). Flor elbette 19'dur. Mersenne matrislerinin sıraları, aktinyum serisi adı verilen radyoaktif elementlerin dizisine karşılık gelir: uranyum 235, plütonyum 239 (uranyumdan daha güçlü bir atom enerjisi kaynağı olan bir izotop), vb. aynısı alkali metaller lityum 7, sodyum 23 ve potasyum 39.

Galyum – atom ağırlığı 68
Siparişler 4 k–2 Euler matrisleri (çift Mersenne), nitrojen 14'e (atmosferin temeli) karşılık gelir. Sofra tuzu iki "mersenne benzeri" sodyum 23 ve klor 35 atomundan oluşur; bu kombinasyon birlikte Euler matrislerinin karakteristiğidir. Ağırlığı 35,4 olan daha masif klor, Hadamard boyutu olan 36'nın hemen altına düşer. Sofra tuzu kristalleri: bir küp (! yani uysal bir karakter, Hadamard'lar) ve bir oktahedron (daha meydan okuyan, bu şüphesiz Euler'dir).
İÇİNDE atom fiziği geçiş demiri 56 - nikel 59, bu daha büyük bir çekirdeğin sentezi sırasında enerji sağlayan elementler arasındaki sınırdır ( Hidrojen bombası) ve çürüme (uranyum). Sıra 58, köşegeninde sıfır bulunan Belevich matrisleri biçiminde Hadamard matrislerinin analoglarına sahip olmamasıyla ünlüdür, aynı zamanda çok fazla ağırlıklı matrisi de yoktur - en yakın ortogonal W(58,53) 5'e sahiptir her sütun ve satırda sıfırlar (derin boşluk).
Fermat matrislerine karşılık gelen serilerde ve bunların 4. dereceden yer değiştirmelerinde k+1, kaderin iradesiyle Fermium 257'ye mal olur. Hiçbir şey söyleyemezsin, kesin bir isabet. Burada altın 197 var. Elektroniğin simgeleri olan bakır 64 (63.547) ve gümüş 108 (107.868) görüldüğü gibi altına ulaşmıyor ve daha mütevazı Hadamard matrislerine karşılık geliyor. Atom ağırlığı 63'ten fazla olmayan bakır kimyasal olarak aktiftir; yeşil oksitleri iyi bilinmektedir.

Yüksek büyütme altında bor kristalleri
İLE altın Oran bor bağlanır - diğer tüm elementler arasında atom kütlesi 10'a en yakın olanıdır (daha kesin olarak 10,8, atom ağırlığının tek sayılara yakınlığı da bir etkiye sahiptir). Bor oldukça karmaşık bir elementtir. Bor, yaşamın tarihinde karmaşık bir rol oynar. Çerçevenin yapılarındaki yapısı elmastan çok daha karmaşıktır. Borun her türlü yabancı maddeyi absorbe etmesini sağlayan benzersiz kimyasal bağ türü çok az anlaşılmıştır, ancak bununla ilgili araştırmalar vardır. çok sayıda bilim adamları zaten aldılar Nobel ödülleri. Bor kristalinin şekli, tepe noktasını oluşturan beş üçgenden oluşan bir ikosahedrondur.
Platin'in gizemi. Beşinci element ise hiç şüphesiz altın gibi asil metallerdir. Hadamard boyut 4 üzerindeki üst yapı k, 1 büyük.

Kararlı izotop uranyum 238
Ancak Fermat sayılarının nadir olduğunu (en yakını 257) unutmayalım. Yerli altının kristalleri küp benzeri bir şekle sahiptir, ancak pentagram da parıldar. En yakın komşusu, asil bir metal olan platin, altının 197 atom ağırlığından 4 atom ağırlığından daha azdır. Platinyumun atom ağırlığı 193 değil, biraz daha yüksek, 194'tür (Euler matrislerinin sırası). Bu küçük bir şey ama onu biraz daha saldırgan unsurların kampına getiriyor. İnertliği nedeniyle (belki de kral suyu içinde çözünür) platinin aktif bir katalizör olarak kullanıldığını hatırlamakta fayda var. kimyasal süreçler.
Süngerimsi platin oda sıcaklığında hidrojeni ateşler. Platinin karakteri hiç de barışçıl değil; iridyum 192 (191 ve 193 izotoplarının bir karışımı) daha barışçıl davranıyor. Daha çok bakıra benziyor ama ağırlığı ve altının karakterini taşıyor.
Neon 20 ile sodyum 23 arasında atom ağırlığı 22 olan bir element yoktur. Elbette atom ağırlıkları ayrılmaz bir özelliktir. Ancak izotoplar arasında, sayıların özellikleri ve ortogonal tabanların karşılık gelen matrisleri ile özellikler arasında ilginç bir korelasyon da vardır. Gibi nükleer yakıt en büyük uygulama kendi kendine devam eden bir nükleer zincir reaksiyonunun mümkün olduğu izotop uranyum 235'e (Mersenne matris düzeni) sahiptir. Doğada bu element kararlı formda uranyum 238 (Eulerian matris düzeni) halinde bulunur. Atom ağırlığı 13 olan element yoktur. Kaosa gelince, periyodik tablodaki kararlı elementlerin sınırlı sayıda olması ve on üçüncü dereceden matrislerde gözlenen engel nedeniyle yüksek dereceli matris bulmanın zorluğu birbiriyle ilişkilidir.

Kimyasal elementlerin izotopları, stabilite adası