Karbon, Mendeleev'in periyodik tablosunun altıncı elementidir. Atom ağırlığı 12'dir.
Karbon, Mendeleev sisteminin ikinci periyodunda ve bu sistemin dördüncü grubunda yer almaktadır.
Periyot numarası bize karbonun altı elektronunun iki enerji seviyesinde bulunduğunu söyler.
Dördüncü grup numarası ise karbonun dış enerji seviyesinde dört elektrona sahip olduğunu söylüyor. Bunlardan ikisi eşleştirilmiş S-elektronlar ve diğer ikisi eşlenmemiş R-elektronlar.
Karbon atomunun dış elektron katmanının yapısı aşağıdaki şemalarla ifade edilebilir:
Bu diyagramlardaki her hücre ayrı bir elektron yörüngesi anlamına gelir; ok, yörüngede yer alan bir elektron anlamına gelir. Bir hücrenin içindeki iki ok, aynı yörüngede bulunan ancak zıt dönüşlere sahip iki elektrondur.
Bir atom uyarıldığında (ona enerji verildiğinde), eşleştirilmiş atomlardan biri S-elektronlar işgal edildi R-orbital.
Uyarılmış bir karbon atomu dört kovalent bağın oluşumuna katılabilir. Bu nedenle bileşiklerinin büyük çoğunluğunda karbon, dört değerlik sergiler.
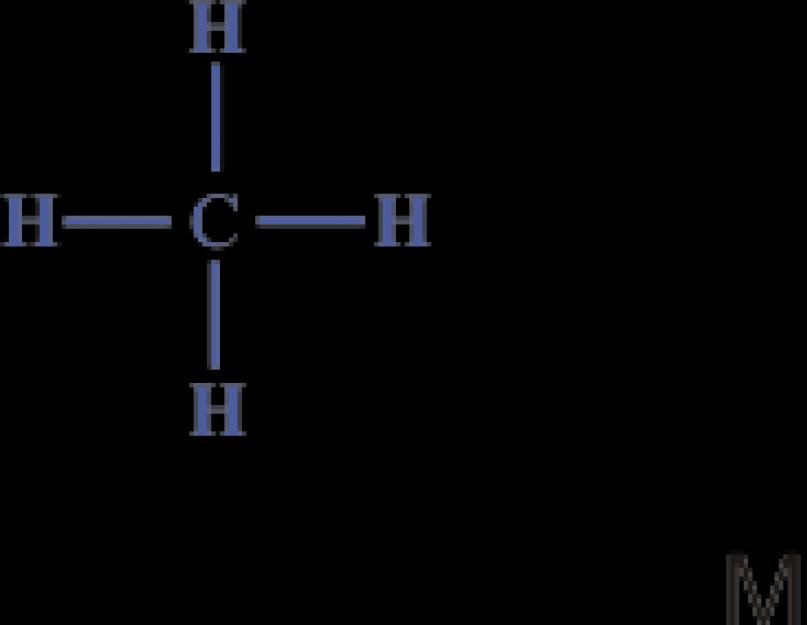
Böylece en basit organik bileşik olan hidrokarbon metan şu bileşime sahiptir: 4. Bölüm. Yapısı yapısal veya elektronik formüllerle ifade edilebilir:

Elektronik formül metan molekülündeki karbon atomunun kararlı sekiz elektronlu bir dış kabuğa sahip olduğunu ve hidrojen atomlarının kararlı iki elektronlu bir dış kabuğa sahip olduğunu gösterir.
Metandaki (ve diğer benzer bileşiklerdeki) dört kovalent karbon bağının tümü eşdeğerdir ve uzayda simetrik olarak yönlendirilmiştir.

Karbon atomu, tetrahedronun (düzenli dörtgen piramit) merkezinde bulunur ve ona bağlı dört atom (metan durumunda, dört hidrojen atomu), tetrahedronun köşelerinde bulunur.
Herhangi bir bağ çiftinin yönleri arasındaki açılar aynıdır ve 109 derece 28 dakikadır. S Bu, bir karbon atomunun diğer dört atomla kovalent bağ oluşturduğunda birinden - ve üç P - sonuç olarak yörüngeler sp3 - sonuç olarak yörüngeler Hibridizasyon, uzayda simetrik olarak konumlanmış dört melezin oluşmasıyla sonuçlanır.

-yörüngeler tetrahedronun köşelerine doğru uzanıyordu.
Dış enerji seviyesindeki elektron sayısı, bir elementin kimyasal özelliklerini belirleyen temel faktördür.
Periyodik tablonun sol tarafında, dış elektronik seviyesi düşük olan elementler bulunur. Birinci grubun elemanlarının dış seviyesinde bir elektronu, ikinci grubun elemanlarının ise iki elektronu vardır.
Bu iki grubun unsurları metaller. Kolayca oksitlenirler, yani. dış elektronlarını kaybederek pozitif iyon haline gelirler.
Periyodik tablonun sağ tarafında ise tam tersine metal olmayanlar (oksitleyici maddeler). Metallerle karşılaştırıldığında daha fazla sayıda proton içeren bir çekirdeğe sahiptirler. Böylesine büyük bir çekirdek, elektron bulutundan çok daha güçlü bir çekim sağlar.
Bu tür elementler elektronlarını büyük zorluklarla kaybederler, ancak diğer atomlardan ilave elektronların eklenmesinden de çekinmezler. onları oksitler ve aynı zamanda negatif iyona dönüşür.
Periyodik tablodaki grup sayısı arttıkça elementlerin metalik özellikleri zayıflar ve diğer elementleri oksitleme yetenekleri artar.
Karbon dördüncü gruptadır, yani. Kolayca elektron veren metaller ile bu elektronları kolayca kazanan metal olmayanların tam ortasında.
Bu nedenle karbonun elektron bağışlama veya kazanma konusunda belirgin bir eğilimi yoktur.
Karbon zincirleri.
Çeşitliliği belirleyen karbonun olağanüstü özelliği organik bileşikler, atomlarının birbirine güçlü kovalent bağlarla bağlanarak neredeyse sınırsız uzunlukta karbon devreleri oluşturma yeteneğidir.

Karbona ek olarak, aynı atom zincirleri, grup IV - silikondan gelen analogu tarafından oluşturulur. Ancak bu tür zincirler altıdan fazla Si atomu içermez. Uzun kükürt atomu zincirleri bilinmektedir, ancak bunları içeren bileşikler kırılgandır.
Karşılıklı bağlantı için kullanılmayan karbon atomlarının değerleri, diğer atomların veya grupların eklenmesi için (hidrokarbonlarda - hidrojen eklenmesi için) kullanılır.
Yani hidrokarbonlar etan ( C 2 H 6) ve propan ( C 3 H 8) sırasıyla iki ve üç karbon atomlu zincirler içerir. Yapıları aşağıdaki yapısal ve elektronik formüllerle ifade edilir:

Zincirlerinde yüzlerce veya daha fazla karbon atomu içeren bileşikler bilinmektedir.
Karbon bağlarının tetrahedral yönelimi nedeniyle, zincire dahil olan atomlar düz bir çizgide değil, zikzak şeklinde yerleştirilmiştir. Ayrıca atomların bağ ekseni etrafında dönme olasılığı nedeniyle uzayda bir zincir uzayda yer alabilir. çeşitli şekiller(yapımlar):

Zincirlerin bu yapısı, uçtaki veya bitişik olmayan diğer karbon atomlarının birbirine yaklaşmasını mümkün kılar. Bu atomlar arasında bağ oluşmasının bir sonucu olarak, karbon zincirleri halkalara (döngülere) yakınlaşabilir, örneğin:

Bu nedenle, organik bileşiklerin çeşitliliği aynı zamanda bir molekülde aynı sayıda karbon atomu ile açık, açık karbon atomu zincirine sahip bileşiklerin yanı sıra molekülleri döngü içeren maddelerin de mümkün olması gerçeğiyle belirlenir.
Basit ve çoklu bağlantılar.
Bir çift genelleştirilmiş elektronun oluşturduğu karbon atomları arasındaki kovalent bağlara basit bağlar denir.

Karbon atomları arasındaki bağ bir değil iki veya üç ortak elektron çifti tarafından gerçekleştirilebilir. Daha sonra çoklu çift veya üçlü bağ içeren zincirler elde ederiz. Bu bağlantılar şu şekilde gösterilebilir:
Çoklu bağ içeren en basit bileşikler hidrokarbonlardır etilen(çift bağ ile) ve asetilen(üçlü bağ ile):

Çoklu bağa sahip hidrokarbonlara doymamış veya doymamış denir. Etilen ve asetilen, iki homolog serinin (etilen ve asetilen hidrokarbonlar) ilk temsilcileridir.
Bu yazıda periyodik tablonun bir parçası olan D.I. elementine bakacağız. Mendeleev, yani karbon. Modern terminolojide C sembolü ile gösterilir, on dördüncü gruba dahil edilir ve ikinci dönemin “katılımcısıdır”, altıncı seri numarasına sahiptir ve a.u.m. = 12.0107.
Atomik yörüngeler ve hibridizasyonları
Karbona, dünya çapındaki bilim adamlarını hâlâ şaşırtan temel özellikleri olan yörüngeleri ve melezleşmeleriyle bakmaya başlayalım. Yapıları nedir?
Karbon atomunun hibridizasyonu, değerlik elektronlarının üç yörüngede konumlarını işgal edecek şekilde düzenlenir; yani biri 2s yörüngesinde ve ikisi 2p yörüngesindedir. Üç yörüngenin son ikisi birbirine göre 90 derecelik bir açı oluşturur ve 2s yörüngesi küresel simetriye sahiptir. Bununla birlikte, söz konusu yörüngelerin bu şekilde düzenlenmesi, karbonun organik bileşiklere girerken neden 120, 180 ve 109,5 derecelik açılar oluşturduğunu anlamamıza izin vermiyor. Karbon atomunun elektronik yapısına ilişkin formül şu şekilde ifade edilir: (He) 2s 2 2p 2.
Ortaya çıkan çelişkinin çözümü, atomik yörüngelerin hibridizasyonu kavramının dolaşıma sokulmasıyla yapıldı. C'nin üçgen, değişken doğasını anlamak için onun melezleşmesine ilişkin üç temsil biçimi oluşturmak gerekliydi. Bu kavramın ortaya çıkmasına ve gelişmesine asıl katkı Linus Pauling tarafından yapılmıştır.

Fiziksel özellikler
Karbon atomunun yapısı bir takım fiziksel özelliklerin varlığını belirler. Bu elementin atomları, modifikasyonları olan basit bir madde olan karbonu oluşturur. Yapısındaki değişikliklerdeki değişiklikler, ortaya çıkan maddeye farklı niteliksel özellikler verebilir. Kullanılabilirlik nedeni büyük miktar Karbonun modifikasyonları, kimyasal yapıda farklı türde bağlar kurma ve oluşturma yeteneğinde yatmaktadır.
Karbon atomunun yapısı, belirli sayıda izotopik forma sahip olmasına izin verecek şekilde değişebilir. Doğada bulunan karbon, iki kararlı izotop - 12 C ve 13 C - ve radyoaktif özelliklere sahip bir izotop - 14 C kullanılarak oluşturulur. İkinci izotop, yer kabuğunun üst katmanlarında ve atmosferde yoğunlaşmıştır. Kozmik radyasyonun, yani nötronlarının nitrojen atomlarının çekirdeği üzerindeki etkisi nedeniyle, radyoaktif izotop 14 C, yirminci yüzyılın ellili yıllarının ortalarından sonra oluşan insan yapımı bir ürün olarak çevreye girmeye başladı. nükleer santrallerin işletilmesi sırasında ve hidrojen bombasının kullanılması sonucunda. Radyokarbon tarihleme tekniğinin temeli, 14 C'nin bozunma sürecine dayanmaktadır. geniş uygulama arkeoloji ve jeolojide.
Allotropik formda karbonun modifikasyonu
Doğada karbon içeren birçok madde bulunmaktadır. İnsan, aşağıdakiler de dahil olmak üzere çeşitli maddeler oluştururken karbon atomunun yapısını kendi amaçları için kullanır:
- Kristal karbonlar (elmaslar, karbon nanotüpler, fiberler ve teller, fullerenler vb.).
- Amorf karbonlar (aktif karbon ve odun kömürü, çeşitli türler kok, karbon siyahı, is, nanoköpük ve antrasit).
- Karbonun küme formları (dikarbonlar, nanokonlar ve astralen bileşikleri).
Atom yapısının yapısal özellikleri

Bir karbon atomunun elektronik yapısı, sahip olduğu yörüngelerin hibridizasyon düzeyine bağlı olarak farklı geometrilere sahip olabilir. 3 ana geometri türü vardır:
- Tetrahedral - biri s-elektronları ve üçü p-elektronlarına ait olan dört elektronun yer değiştirmesi nedeniyle yaratılmıştır. C atomu tetrahedronda merkezi bir konuma sahiptir ve bu tetrahedronun tepe noktasını işgal eden diğer atomlara dört eşdeğer sigma bağıyla bağlanır. Karbonun bu geometrik düzeni elmas ve lonsdaleit gibi allotropları üretebilir.
- Üçgen - görünüşünü biri s- ve ikisi p- olmak üzere üç yörüngenin yer değiştirmesine borçludur. Burada birbiriyle eşdeğer konumda olan üç sigma bağı var; ortak bir düzlemde uzanırlar ve birbirlerine göre 120 derecelik bir açıyı korurlar. Serbest p-orbital, sigma bağ düzlemine dik olarak yerleştirilmiştir. Grafit benzer bir yapısal geometriye sahiptir.
- Çapraz - s- ve p-elektronlarının karıştırılması nedeniyle ortaya çıkar (sp hibridizasyonu). Elektron bulutları genel yön boyunca uzanır ve asimetrik bir dambıl şeklini alır. Serbest elektronlar π bağları oluşturur. Karbondaki bu geometri yapısı, özel bir modifikasyon şekli olan karbin görünümünün ortaya çıkmasına neden olur.
Doğadaki karbon atomları
Karbon atomunun yapısı ve özellikleri uzun zamandır insan tarafından dikkate alınmakta ve çok sayıda farklı maddenin elde edilmesinde kullanılmaktadır. Bu elementin atomları, farklı kimyasal bağlar oluşturma konusundaki benzersiz yetenekleri ve yörüngesel hibridizasyonun varlığı nedeniyle, aynı türdeki atomlardan (karbon) yalnızca bir elementin katılımıyla birçok farklı allotropik modifikasyon yaratır.

Doğada karbon bulunur yer kabuğu; elmas, grafit, çeşitli yanıcı maddeler şeklini alır doğal kaynaklarörneğin petrol, antrasit, kahverengi kömür, şist, turba vb. İnsanların kullandığı gazların bir kısmı enerji endüstrisi. Dioksitteki karbon, Dünya'nın hidrosferini ve atmosferini doldurarak havada %0,046'ya, suda ise altmış kata kadar ulaşır.
İnsan vücudunda C yaklaşık %21'e eşit bir miktarda bulunur ve esas olarak idrar ve solunan hava yoluyla atılır. Aynı element biyolojik döngüye katılır; bitkiler tarafından emilir ve fotosentez sırasında tüketilir.
Karbon atomları, çeşitli kovalent bağlar kurma ve bunlardan zincirler ve hatta döngüler oluşturma yetenekleri nedeniyle çok büyük miktarda organik madde oluşturabilir. Ayrıca bu öğenin bir parçası güneş atmosferi Hidrojen ve nitrojenle bileşik halinde bulunur.
Kimyasal doğanın özellikleri

Şimdi karbon atomunun yapısına ve özelliklerine kimyasal açıdan bakalım.
Karbonun normal sıcaklık koşulları altında inert özellikler sergilediğini, ancak etkisi altında bize indirgeyici özellikler gösterebileceğini bilmek önemlidir. yüksek sıcaklıklar. Ana oksidasyon durumları şunlardır: + - 4, bazen +2 ve ayrıca +3.
Çok sayıda elementle reaksiyonlara katılır. Su, hidrojen, halojenler, alkali metaller, asitler, flor, kükürt vb. ile reaksiyona girebilir.
Karbon atomunun yapısı, ayrı bir sınıfa ayrılmış, inanılmaz derecede büyük sayıda maddeye yol açar. Bu tür bileşiklere organik denir ve C'ye dayanır. Bu, bu elementin atomlarının polimer zincirleri oluşturma özelliği nedeniyle mümkündür. En ünlü ve kapsamlı gruplar arasında proteinler (proteinler), yağlar, karbonhidratlar ve hidrokarbon bileşikleri yer alır.
Operasyon yöntemleri
Karbon atomunun benzersiz yapısı ve ona eşlik eden özellikleri nedeniyle, element insanlar tarafından yaygın olarak kullanılmaktadır, örneğin kurşun kalem yapımında, metal potaların eritilmesinde - burada grafit kullanılmaktadır. Elmaslar aşındırıcı, mücevher, matkap ucu vb. olarak kullanılır.
Farmakoloji ve tıp aynı zamanda karbonun çeşitli bileşiklerde kullanımıyla da ilgilenir. Bu element çeliğin bir parçasıdır, her organik maddenin temelini oluşturur, fotosentez sürecine katılır vb.
Elementin toksisitesi

Karbon elementinin atomunun yapısı, canlı madde üzerinde tehlikeli bir etkinin varlığını ima eder. Karbon, termik santrallerde kömürün yanması sonucu çevremizdeki dünyaya giriyor, kömür konsantresi vb. durumunda otomobillerin ürettiği gazlara dahil ediliyor.
Aerosollerdeki karbon içeriği yüzdesi yüksektir, bu da hastalanan insan yüzdesinin artmasına neden olur. En sık üst solunum yolları ve akciğerler etkilenir. Bazı hastalıklar mesleki olarak sınıflandırılabilir; örneğin toz bronşiti ve pnömokonyoz grubu hastalıklar.
14C toksiktir ve etkisinin gücü, β parçacıklarıyla radyasyon etkileşimi ile belirlenir. Bu atom, deoksi ve ribonükleik asitler. Havada kabul edilebilir miktar 14 C çalışma alanı seviyenin 1,3 Bq/l olduğu kabul edilmektedir. Solunum sırasında vücuda giren maksimum karbon miktarı 3,2 * 10 8 Bq/yıl'a karşılık gelir.
C – 1s 2 2s 2 2p 2 veya 1s 2 2s 2 2p x 1 2p y 1 2p z 0
Grafiksel formda:
Uyarılmış durumdaki bir karbon atomu aşağıdaki elektronik formüle sahiptir:
*C – 1s 2 2s 1 2p 3 veya 1s 2 2s 1 2p x 1 2p y 1 2p z 1
Hücre şeklinde: 
S- ve p-orbitallerin şekli


Atomik yörünge- karşılık gelen kuantum sayılarıyla birlikte, bir elektronun bulunma olasılığının en yüksek olduğu uzay bölgesi.
Bu, dalga fonksiyonunun yörüngedeki belirli bir noktada bir elektron bulmanın göreceli olasılığını belirlediği üç boyutlu bir elektron "kontur haritasıdır".
Atomik yörüngelerin göreceli boyutları, enerjileri arttıkça artar ( baş kuantum sayısı- n) ve uzaydaki şekilleri ve yönelimleri l ve m kuantum sayılarıyla belirlenir. Orbitallerdeki elektronlar spin kuantum sayısıyla karakterize edilir. Her bir yörünge, zıt spinlere sahip en fazla 2 elektron içerebilir.
Diğer atomlarla bağ oluştururken, karbon atomu elektron kabuğunu dönüştürür, böylece en güçlü bağlar oluşur ve sonuç olarak mümkün olduğu kadar fazla enerji açığa çıkar ve sistem en yüksek stabiliteyi kazanır.
Bir atomun elektron kabuğunun değiştirilmesi enerji gerektirir ve bu daha sonra daha güçlü bağların oluşmasıyla telafi edilir.
Elektron kabuğu dönüşümü (hibridizasyon), karbon atomunun bağ oluşturduğu atom sayısına bağlı olarak temel olarak 3 tipte olabilir.
Hibridizasyon türleri:
sp 3 - Hibridizasyon (değerlik durumu)– bir atom 4 komşu atomla bağ oluşturur (tetrahedral hibridizasyon):
Sp 3 – hibrit karbon atomunun elektronik formülü:
*С –1s 2 2(sp 3) 4 hücre şeklinde ![]()

Hibrit yörüngeler arasındaki bağ açısı ~109°'dir.
Karbon atomunun stereokimyasal formülü:
sp 2 - Hibridizasyon (değerlik durumu)– bir atom 3 komşu atomla bağ oluşturur (üçgen hibridizasyon):
Sp 2 – hibrit karbon atomunun elektronik formülü:
*С –1s 2 2(sp 2) 3 2p 1 hücre şeklinde 
Hibrit yörüngeler arasındaki bağ açısı ~120°'dir.
Sp 2 - hibrit karbon atomunun stereokimyasal formülü:
sp - Hibridizasyon (değerlik durumu) – bir atom 2 komşu atomla bağ oluşturur (doğrusal hibridizasyon):
Sp – hibrit karbon atomunun elektronik formülü:
*С –1s 2 2(sp) 2 2p 2 hücre şeklinde
Hibrit yörüngeler arasındaki bağ açısı ~180°'dir.
Stereokimyasal formül:
S-orbital her türlü hibridizasyonda yer alır, çünkü minimum enerjiye sahiptir.
Elektron bulutunun yeniden yapılandırılması, mümkün olan en güçlü bağların oluşmasına ve ortaya çıkan moleküldeki atomların minimum etkileşimine olanak tanır. Aynı zamanda Hibrit yörüngeler aynı olmayabilir ancak bağ açıları farklı olabilir. örneğin CH2Cl2 ve CCl4
2. Organik bileşiklerin sınıflandırılması ve isimlendirilmesi. Organik moleküllerde izomerizm türleri.
İzomerlerin sınıflandırılması
Yapısal (atomların farklı bağlantı sırası)
Stereoizomerizm (uzayda atomların farklı düzenlenmesi)
Devreler 1. Çoklu bağlantı konumları
2. İşlevsel grup hükümleri
3. Yapılandırma
4. Konformasyonel
2.Yapısal izomerizm.
Yapısal izomerler, aynı niteliksel ve niceliksel bileşime sahip, ancak kimyasal yapıları farklı olan izomerlerdir.
Yapısal izomerizm organik bileşiklerin çeşitliliğini belirler, özellikle alkanlar. Moleküllerdeki karbon atomlarının sayısının artmasıyla alkanlarda yapısal izomerlerin sayısı hızla artar. Yani heksan için (C6H14) 5, nonan için (C9H20) - 35'tir.
Karbon atomlarının zincirdeki yerleri farklılık gösterir. Zincirin başlangıcındaki karbon atomu bir karbon atomuna bağlanır ve denir. öncelik.İki karbon atomuna bağlı bir karbon atomu – ikincil, üç ile – üçüncül, dörtlü – dördüncül. Düz zincirli alkanlar yalnızca birincil ve ikincil karbon atomlarını içerirken, dallı zincirli alkanlar hem üçüncül hem de dördüncül karbon atomlarını içerir.
Yapısal izomerizm türleri.
- Karbon zinciri izomerizmi:
- Çoklu bağ pozisyonu izomerizmi
Fonksiyonel grup pozisyonu izomerizmi
Metamerler– aynı bileşik sınıfına ait olan ancak farklı radikallere sahip olan bileşikler:
H 3 C – O – C 3 H 7 – metilpropil eter,
H 5 C 2 – O – C 2 H 5 – dietil eter
- Sınıflar arası izomerizm. Moleküllerin aynı niteliksel ve niceliksel bileşimine rağmen maddelerin yapısı farklıdır.
H 2 C = CH – CH = CH2 bütadien -1,3 HC = C - CH2 – CH3 – bütin-1
Yapısal izomerizm aynı zamanda hidrokarbon radikallerinin çeşitliliğini de belirler. Radikallerin izomerizmi, iki radikalin mümkün olduğu propanla başlar. Birincil karbon atomundan bir hidrojen atomu çıkarılırsa ortaya çıkan radikal propildir (n-propil). İkincil karbon atomundan bir hidrojen atomu çıkarılırsa ortaya çıkan radikal izopropildir.
Uzaysal izomerizm (stereoizomerizm)
Bu, aynı bileşime ve atomların bağlantı düzenine sahip olan, ancak atomların veya atom gruplarının uzayda birbirlerine göre düzenlenmelerinin doğasında farklılık gösteren izomerlerin varlığıdır.
Bu tür izomerizm L. Pasteur (1848), J. Van't Hoff, Le Bel (1874) tarafından tanımlanmıştır.
Gerçek koşullarda, molekülün kendisi ve tek tek parçaları (atomlar, atom grupları) titreşimsel-dönme hareketi halindedir ve bu hareket, moleküldeki atomların göreceli düzenini büyük ölçüde değiştirir. Bu sırada kimyasal bağlar gerilir ve bağ açıları değişir ve böylece moleküllerin farklı konfigürasyonları ve konformasyonları ortaya çıkar.
Bu nedenle uzaysal izomerler iki türe ayrılır: konformasyonel ve konfigürasyonel.
Konfigürasyonlar, tekli bağların etrafında dönmeden kaynaklanan farklar dikkate alınmaksızın atomların uzayda düzenlenme sırasıdır. Bu izomerler farklı konformasyonlarda bulunur.
Konformasyonlar, atomların veya atom gruplarının tekli bağlar etrafında dönmesi sonucu ortaya çıkan, aynı molekülün çok kararsız dinamik formlarıdır ve bunun sonucunda atomlar farklı uzaysal konumları işgal eder. Bir molekülün her bir konformasyonu spesifik bir konfigürasyonla karakterize edilir.
Ϭ bağı kendi etrafında dönmeye izin verir, böylece bir molekül birçok yapıya sahip olabilir. Birçok konformasyondan yalnızca altısı dikkate alınır, çünkü Minimum dönme açısı, 60°'ye eşit bir açı olarak kabul edilir. burulma açısı.
Şunlar vardır: gölgelenmiş ve engellenmiş konformasyonlar.
Tutulan konformasyon aynı ikame ediciler bulunduğunda meydana gelir minimum mesafe birbirlerinden ve aralarında karşılıklı itme kuvvetleri ortaya çıkar ve molekülün bu konformasyonu koruyabilmesi için büyük bir enerji kaynağına sahip olması gerekir. Bu konformasyon enerji açısından elverişsizdir.
Engellenmiş konformasyon –özdeş ikame ediciler birbirinden mümkün olduğu kadar uzakta olduğunda ve molekül minimum enerji rezervine sahip olduğunda meydana gelir. Bu konformasyon enerji açısından uygundur.
P 
 Konformasyonel izomerlerin varlığı bilinen ilk bileşik etandır. Uzaydaki yapısı perspektif formülü veya Newman formülü ile gösterilmektedir:
Konformasyonel izomerlerin varlığı bilinen ilk bileşik etandır. Uzaydaki yapısı perspektif formülü veya Newman formülü ile gösterilmektedir:
C 2 H 6
engellendi
konformasyon konformasyonu
 Newman'ın projeksiyon formülleri.
Newman'ın projeksiyon formülleri.
Bize en yakın karbon atomu dairenin ortasındaki bir nokta ile gösterilir, daire ise uzaktaki karbon atomunu temsil eder. Her atomun üç bağı, en yakın karbon atomu için ve uzaktaki karbon atomu için küçük olanlar için dairenin merkezinden ayrılan çizgiler olarak gösterilmektedir.
Uzun karbon zincirlerinde birden fazla C-C bağı etrafında dönüş mümkündür. Bu nedenle zincirin tamamı çeşitli ürünleri kabul edebilir. geometrik şekiller. X-ışını kırınım verilerine göre, uzun doymuş hidrokarbon zincirleri zikzak ve pençe şeklinde bir yapıya sahiptir. Örneğin: zigzag konformasyonlarındaki palmitik (C15H31COOH) ve stearik (C17H35COOH) asitler, hücre zarlarının lipitlerinin bir parçasıdır ve çözeltideki monosakkarit molekülleri, pençe şeklinde bir konformasyon alır.
Döngüsel bileşiklerin konformasyonları
Döngüsel bağlantılar, kapalı bir döngünün varlığıyla ilişkili açısal gerilim ile karakterize edilir.
Döngülerin düz olduğunu düşünürsek, çoğu için bağ açıları normalden önemli ölçüde sapacaktır. Halkadaki karbon atomları arasındaki bağ açılarının sapmasından kaynaklanan stres normal değer, isminde köşe veya Bayer'in
Örneğin sikloheksanda karbon atomları sp3 hibrit durumundadır ve buna göre bağ açısı 109 o 28 /'ye eşit olmalıdır. Karbon atomları aynı düzlemde yer alsaydı, düzlemsel halkada iç bağ açıları 120° olurdu ve tüm hidrojen atomları gölgelenmiş bir konformasyonda olurdu. Ancak güçlü açısal ve burulma gerilmelerinin varlığından dolayı sikloheksan düz olamaz. ϭ-bağları etrafındaki kısmi rotasyon nedeniyle daha az stresli düzlemsel olmayan konformasyonlar geliştirir, bunlar arasında konformasyonlar daha stabildir koltuklar Ve banyolar.
Sandalye konformasyonu, hidrojen ve karbon atomlarının kapalı pozisyonlarına sahip olmadığından enerji açısından en uygun olanıdır. Tüm C atomlarının H atomlarının düzeni, etanın engellenmiş konformasyonuyla aynıdır. Bu konformasyonda tüm hidrojen atomları açıktır ve reaksiyonlara hazırdır.
Banyo konformasyonu enerji açısından daha az elverişlidir, çünkü tabanda bulunan 2 çift C atomu (C-2 ve C-3), (C-5 ve C-6) gölgelenmiş konformasyonda H atomlarına sahiptir, bu nedenle bu konformasyonun büyük bir değeri vardır. enerji rezervi ve kararsız.
C 6 H 12 sikloheksan
"Sandalye" şekli enerji açısından "küvetten" daha faydalıdır.
- Optik izomerizm.
19. yüzyılın sonunda birçok organik bileşiğin polarize ışın düzlemini sola ve sağa döndürebildiği keşfedildi. Yani, bir moleküle gelen bir ışık ışını onun elektron kabuklarıyla etkileşime girer ve elektronların polarizasyonu meydana gelir, bu da elektrik alanındaki salınımların yönünün değişmesine yol açar. Bir maddenin titreşim düzlemini saat yönünde döndürmesine denir. sağa dönen(+) saat yönünün tersine ise – solak(-). Bu maddelere optik izomerler adı verildi. Optik olarak aktif izomerler bir asimetrik karbon atomu (kiral) içerir - bu, dört farklı ikame edici içeren bir atomdur. İkinci önemli koşul, her türlü simetrinin (eksen, düzlem) bulunmamasıdır. Bunlar arasında birçok hidroksi ve amino asit bulunur
Çalışmalar, bu tür bileşiklerin, sp3 hibridizasyonunda karbon atomları üzerindeki ikame edicilerin düzenlenme sırasına göre farklılık gösterdiğini göstermiştir.
P  en basit bileşik laktik asittir (2-hidroksipropanoik asit)
en basit bileşik laktik asittir (2-hidroksipropanoik asit)
Molekülleri birbirleriyle bir nesne ve uyumsuz bir ayna görüntüsü veya sol ve sağ el olarak ilişkili olan stereoizomerlere denir. enantiyomerler(optik izomerler, ayna izomerler, antipodlar ve bu olaya denir) enantiyomerizm. Hepsi kimyasal ve fiziksel özellikler enantiyomerler iki tanesi dışında aynıdır: polarize ışık düzleminin dönüşü (bir polarimetre cihazında) ve biyolojik aktivite.
Moleküllerin mutlak konfigürasyonu karmaşık fizikokimyasal yöntemlerle belirlenir.
Optik olarak aktif bileşiklerin göreceli konfigürasyonu, bir gliseraldehit standardı ile karşılaştırılarak belirlenir. Sağa dönen veya sola dönen gliseraldehit konfigürasyonuna sahip optik olarak aktif maddelere (M. Rozanov, 1906), D ve L serisinin maddeleri denir. Bir bileşiğin sağa ve sola dönen izomerlerinin eşit karışımına rasemat denir ve optik olarak aktif değildir.
Araştırmalar, ışığın dönme işaretinin bir maddenin D ve L serisine ait olmasıyla ilişkilendirilemeyeceğini, yalnızca polarimetre cihazlarında deneysel olarak belirlendiğini göstermiştir. Örneğin, L-laktik asitin dönme açısı +3,8 o, D-laktik asit - -3,8 o'dur.
Enantiyomerler Fischer formülleri kullanılarak gösterilmektedir.
- Karbon zinciri dikey bir çizgiyle temsil edilir.
- Kıdemli fonksiyonel grup en üstte, kıdemsiz fonksiyonel grup ise altta yer alır.
- Asimetrik bir karbon atomu, uçlarında ikame edicilerin bulunduğu yatay bir çizgiyle temsil edilir.
- İzomerlerin sayısı 2 n formülü ile belirlenir, n asimetrik karbon atomlarının sayısıdır.

 L-sıra D-sıra
L-sıra D-sıra
Enantiyomerler arasında optik aktiviteye sahip olmayan ve simetrik moleküller bulunabilir. mezoizomerler.
 Örneğin: Şarap evi Örneğin: Şarap evi |

| D – (+) – sıra L – (–) – sıra | Mezovinnaya k-ta |
Rasemat – üzüm suyu
Ayna izomerleri olmayan, asimetrik C atomlarının tamamı olmasa da birkaçının konfigürasyonunda farklılık gösteren, farklı fiziksel ve kimyasal özelliklere sahip optik izomerlere s- denir. di-A-stereoizomerler.
p-Diastereomerler (geometrik izomerler), molekülde bir p-bağı bulunan stereomerlerdir. Alkenlerde, doymamış yüksek karbonlu bileşiklerde, doymamış dikarbonik bileşiklerde bulunurlar. Örneğin:

Cis-buten-2 Trans-buten-2
Organik maddelerin biyolojik aktivitesi yapılarıyla ilgilidir. Örneğin:

Cis-butendiik asit, Trans-butendiik asit,
maleik asit - fumarik asit - toksik değildir,
vücutta bulunan çok toksik
Tüm doğal doymamış yüksek karbonlu bileşikler cis-izomerlerdir.
Eşlenik sistem kavramı. Organik moleküllerin aromatikliği kavramı. Hückel'in kuralı. Benzenoid (benzen ve naftalin) ve heterosiklik (furan, tiyofen, pirol, pirazol, imidazol, piridin, pirimidin, purin) bileşiklerinin aromatikliği.
Kimyasal yapı teorisi A.M. Butlerov. Karbon atomunun elektronik yapısı ve hibridizasyon türleri.
1861'de. Butlerov, organik bileşiklerin kimyasal yapısına ilişkin aşağıdaki temel ilkelerden oluşan bir teori önerdi.
1. Maddelerin moleküllerinde, kimyasal yapı adı verilen atomların katı bir kimyasal bağ dizisi vardır.
2. Kimyasal özellikler maddeler temel bileşenlerinin doğasına, miktarlarına ve kimyasal yapılarına göre belirlenir.
3. Aynı bileşime ve molekül ağırlığına sahip maddeler farklı yapılara sahipse izomerizm olgusu ortaya çıkar.
4. Spesifik reaksiyonlarda molekülün yalnızca bazı kısımları değiştiğinden, ürünün yapısının incelenmesi orijinal molekülün yapısının belirlenmesine yardımcı olur.
5. Bir moleküldeki tek tek atomların kimyasal doğası (reaktivite) çevreye bağlı olarak değişir; diğer elementlerin hangi atomlarına bağlı olduklarına bağlı olarak.
Uyarılmış durumdaki bir karbon atomu, dış enerji seviyesinde dört eşleşmemiş elektron içerir ve dört kovalent bağ oluşturma kapasitesine sahiptir.
Hibrit yörüngeler bağ oluşumuna katılır.
İlk değerlik durumu sp3 hibridizasyonudur. Karbon atomunun bir s ve üç p yörüngesini içeren hibridizasyon sonucunda, tetrahedronun köşelerine 109,5° açıyla yönlendirilen dört eşdeğer sp3-hibrit yörüngesi oluşur:
Sp3 hibridizasyonu durumunda, karbon atomu dört ikame edici ile dört s-bağı oluşturur ve bağ açıları 109,5°'ye eşit veya yakın olan tetrahedral bir konfigürasyona sahiptir. (örneğin metan)
İkinci değerlik durumu sp2 hibridizasyonudur. Bir karbon atomunun bir s- ve iki p-orbitalinin katılımıyla hibridizasyon sonucunda, aynı düzlemde 120°'lik açılarla uzanan üç eşdeğer sp2-hibrit yörüngesi oluşur ve p-orbitali buna katılmaz. hibridizasyon, hibrit yörüngelerin düzlemine dik olarak yerleştirilir.
Sp2-hibridizasyon durumunda, karbon atomu, hibrit yörüngeler nedeniyle üç s-bağı ve hibridizasyona dahil olmayan p-orbital nedeniyle bir p-bağı oluşturur ve üç ikame ediciye sahiptir. (örneğin etilen)
Karbonun üçüncü değerlik durumu sp-hibridizasyonudur. Bir s- ve bir p-orbitalinin katılımıyla hibridizasyon sonucunda, 1800 açıyla uzanan iki eşdeğer sp-hibrit yörüngesi oluşur ve hibridizasyona katılmayan p-orbitalleri düzlemine dik olarak yerleştirilir. hibrit yörüngeler ve birbirlerine. Sp-hibridizasyon durumunda, karbon atomu, hibrit yörüngeler nedeniyle iki s-bağı ve hibridizasyona katılmayan p-orbitaller nedeniyle iki p-bağı oluşturur ve iki ikame ediciye sahiptir. (örneğin asetilen)
Moleküllerin konfigürasyonu kavramı. Optik veya ayna izomerizmi. Moleküllerin simetri unsurları (eksen, düzlem, merkez). Kiralite merkezi olarak asimetrik karbon atomu. Maddelerin optik aktivitesi ve spesifik rotasyonu.



Tek kiralite merkezine sahip moleküller (enantiyomerizm). Bir konfigürasyon standardı olarak gliseraldehit. Fischer projeksiyon formülleri. Göreceli ve mutlak konfigürasyon. D-, L- ve R-, S-sistemleri. Rasemat kavramı.
Enantiyomerler, bir nesne ve uyumsuz bir ayna görüntüsü gibi birbiriyle ilişkili stereoizomerlerdir.
Enantiyomer olarak yalnızca kiral moleküller mevcut olabilir.
Kiralite, bir nesnenin kendi yapısıyla uyumsuz olma özelliğidir. ayna görüntüsü. Kiral (Yunanca cheir'den - el) veya asimetrik nesneler sol ve sağ elin yanı sıra eldivenler, botlar vb.'dir. Bu eşleştirilmiş nesneler bir nesneyi ve onun ayna görüntüsünü temsil eder (Şekil 7.1, a). Bu tür öğeler birbirleriyle tamamen birleştirilemez.
Aynı zamanda etrafımızda ayna görüntüsüyle uyumlu, yani akiral (simetrik) birçok nesne vardır; örneğin tabaklar, kaşıklar, bardaklar vb. nesneyi aynayla aynı iki parçaya bölün (bkz. Şekil 7.1, b).
Benzer ilişkiler moleküller dünyasında da gözlenir, yani moleküller kiral ve akiral olarak ikiye ayrılır. Akiral moleküllerin simetri düzlemleri vardır; kiral moleküllerin yoktur.
Kiral moleküllerin bir veya daha fazla kiralite merkezi vardır. Organik bileşiklerde asimetrik karbon atomu çoğunlukla kiralitenin merkezi olarak görev yapar.
Asimetrik bir karbon atomu, dört farklı atom veya gruba bağlı olan bir karbon atomudur.
Bir molekülün stereokimyasal formülünü tasvir ederken asimetrik karbon atomu için "C" sembolü genellikle atlanır.

Konfigürasyon izomerlerini bir düzlemde göstermek için stereokimyasal formülleri kullanabilirsiniz. Ancak daha basit yazmak daha uygundur Fischer projeksiyon formülleri(daha basit - Fischer projeksiyonları).
Enantiyomerlerden birinin tetrahedral modeli, karbon atomu zinciri dikey konumda olacak ve karboksil grubu üstte olacak şekilde uzayda konumlandırılmıştır. Kiral merkezde karbon olmayan ikame edicilere (H ve OH) sahip bağlar gözlemciye doğru yönlendirilmelidir. Bundan sonra model bir düzleme yansıtılır. Asimetrik atomun sembolü atlanmıştır; dikey ve yatay çizgilerin kesişme noktası olarak anlaşılmaktadır.
Kiral bir molekülün tetrahedral modeli, projeksiyondan önce uzayda farklı şekillerde konumlandırılabilir. Projeksiyon üzerinde yatay bir çizgi oluşturan bağlantıların gözlemciye doğru ve dikey bağlantıların çizim düzleminin ötesine yönlendirilmesi yeterlidir.
Projeksiyon formülünde, aynı kiral merkezdeki herhangi iki ikame edicinin yerlerinin çift sayıda değiştirilmesine izin verilir (iki permütasyon yeterlidir);
Projeksiyon formülünü çizim düzleminde 180 derece döndürmek mümkün müdür? (ki bu iki permütasyona eşdeğerdir), ancak 90? ile değil.
İçin konfigürasyon standardı gliseraldehit alındı. Onun sola dönen enantiyomeri keyfi olarak formül (I)'e atfedilir. Karbon atomunun bu konfigürasyonu l harfiyle (lat. laevus- sol). Sağa dönen enantiyomer buna göre formül (II) olarak atandı ve konfigürasyon d harfiyle (Latince'den. dexter- Sağ).
L-gliseraldehit için standart projeksiyon formülünde OH grubunun solda, d-gliseraldehit için ise sağda olduğuna dikkat edin.

Diğer yapısal olarak ilişkili optik olarak aktif bileşiklerin d- veya l-serisilerine atama, asimetrik atomlarının konfigürasyonunun d- veya l-gliseraldehit konfigürasyonuyla karşılaştırılması yoluyla yapılır. Örneğin, projeksiyon formülündeki laktik asit (I) enantiyomerlerinden birinde, OH grubu, l-gliseraldehitte olduğu gibi soldadır, dolayısıyla enantiyomer (I), bir L serisi olarak sınıflandırılır. Aynı nedenlerden dolayı enantiyomer (II) d serisi olarak sınıflandırılır. Böylece, Fisher projeksiyonlarının bir karşılaştırmasından şunu belirleriz: akraba konfigürasyon

L-gliseraldehitin sola doğru bir rotasyona sahip olduğu ve L-laktik asidin sağa doğru bir rotasyona sahip olduğu unutulmamalıdır (ve bu izole bir durum değildir). Ayrıca aynı madde, belirleme koşullarına (farklı çözücüler, sıcaklık) bağlı olarak sol veya sağ yönlü olabilir.
Polarize ışık düzleminin dönme işareti, d- veya l-stereokimyasal serilerdeki üyelikle ilişkili değildir.
Optik olarak aktif bileşiklerin göreceli konfigürasyonunun pratik olarak belirlenmesi, kimyasal reaksiyonlar kullanılarak gerçekleştirilir: ya test maddesi gliseraldehite (veya bilinen göreceli konfigürasyona sahip başka bir maddeye) dönüştürülür ya da tam tersine test maddesi d- veya l'den elde edilir. -gliseraldehit. Elbette tüm bu reaksiyonlar sırasında asimetrik karbon atomunun konfigürasyonunun değişmemesi gerekir.
Sol ve sağ elli gliseraldehitin geleneksel konfigürasyonlara keyfi olarak atanması zorunlu bir adımdı. O zamanlar herhangi bir kiral bileşiğin mutlak konfigürasyonu bilinmiyordu. Mutlak konfigürasyonun oluşturulması ancak fizikokimyasal yöntemlerin, özellikle de X-ışını kırınım analizinin geliştirilmesi sayesinde mümkün oldu; bunun yardımıyla 1951'de kiral bir molekülün mutlak konfigürasyonu ilk kez belirlendi - bu (+) tuzuydu. -tartarik asit. Bundan sonra, d- ve l-gliseraldehitlerin mutlak konfigürasyonunun aslında onlara atanmış olan şey olduğu açıkça ortaya çıktı.
d,l-Sistemi şu anda a-amino asitler, hidroksi asitler ve (bazı eklemelerle) karbonhidratlar için kullanılmaktadır.
R,S-Yapılandırma belirleme sistemi. Herhangi bir bileşiğin konfigürasyonunu gliseraldehit ile ilişkilendirmek genellikle imkansız olduğundan d,L-Sisteminin kullanımı çok sınırlıdır. Kiralite merkezlerinin konfigürasyonunu belirleyen evrensel sistem R,S sistemidir (enlem. rektus- dümdüz, uğursuz- sol). dayanmaktadır sıra kuralı, kiralite merkezi ile ilişkili ikame edicilerin kıdemine dayanmaktadır.
İkame edicilerin kıdemi, kiralite merkeziyle doğrudan ilişkili olan elementin atom numarasına göre belirlenir; ne kadar büyükse, ikame edici o kadar eskidir.
Bu nedenle, OH grubu NH2'den daha yaşlıdır ve bu da herhangi bir alkil grubundan ve hatta COOH'den daha yaşlıdır, çünkü ikincisinde bir karbon atomu asimetrik bir merkeze bağlıdır. Atom numaraları aynı ise, karbonun yanındaki atomu daha büyük atom numarasına sahip olan grup kıdemli olarak kabul edilir ve bu atom (genellikle oksijen) çift bağ ile bağlıysa iki kez sayılır. Sonuç olarak, aşağıdaki gruplar azalan öncelik sırasına göre düzenlenmiştir: -COOH > -CH=O > -CH2OH.
Konfigürasyonu belirlemek için, bir bileşiğin tetrahedral modeli, en düşük ikame edicinin (çoğu durumda bu bir hidrojen atomudur) gözlemciden en uzakta olacağı şekilde uzaya konumlandırılır. Kalan üç ikame edicinin kıdemi saat yönünde azalırsa, kiralite merkezine saat yönünün tersine ise R-konfigürasyonu atanır (Şekil 7.4, a). -S- direksiyonun arkasındaki sürücü tarafından görülen konfigürasyon (bkz. Şekil 7.4, b) (bkz. Şekil 7.4, V).

Pirinç. 7.4. Laktik asit enantiyomerlerinin konfigürasyonunun belirlenmesi R,S- sistem (metinde açıklama)
Yapılandırmayı RS sistemine göre belirtmek için Fisher projeksiyonlarını kullanabilirsiniz. Bunu yapmak için projeksiyon şu şekilde dönüştürülür:
Soru 9
Organik bileşiklerin asitliği ve bazlığı.
Organik bileşiklerin asitliğini ve bazlığını değerlendirmek için iki teori çok önemlidir: Brønsted teorisi ve Lewis teorisi.
Lewis teorisine göre bileşiklerin asidik ve bazik özellikleri, bir bağ oluşturmak için bir çift elektronu kabul etme veya verme yetenekleriyle belirlenir. Lewis prensibine göre asitler ve bazlar sert ve yumuşak olarak ikiye ayrılır.
Lewis asitleri, boş bir yörüngeye sahip olan ve bir kovalent bağ oluşturmak üzere bir çift elektronu kabul edebilen atomlar, moleküller veya katyonlar olabilir.
Lewis asitleri elektron çifti alıcılarıdır; Lewis bazları elektron çifti donörleridir. Lewis bazları (atom, molekül veya anyon), kovalent bir bağ oluşturmak için bir ortağa sağlayabilecekleri en az bir çift değerlik elektronuna sahip olmalıdır. Tüm Lewis bazları nükleofilik reaktiflerdir.
Bronsted teorisine (protolitik teori) göre bileşiklerin asitliği ve bazlılığı H + protonunun transferi ile ilişkilidir. Bir asit ve bir baz, bir konjuge asit-baz çifti oluşturur; burada asit ne kadar güçlü olursa, konjuge bazı da o kadar zayıf olur ve bunun tersine, baz ne kadar güçlü olursa, konjuge asidi de o kadar zayıf olur.
Bronsted asitleri (protik asitler), bir proton (proton donörleri) bağışlayabilen nötr moleküller veya iyonlardır.
Bronsted bazları, bir protonu (proton alıcıları) kabul edebilen nötr moleküller veya iyonlardır.
Asitlik ve bazlık mutlak değil, bileşiklerin göreceli özellikleridir: asidik özellikler yalnızca bir bazın varlığında bulunur; temel özellikler - yalnızca asit varlığında. Asit-baz dengesini incelerken genellikle çözücü olarak su kullanılır.
Protonun ilişkili olduğu elementin doğasına bağlı olarak OH asitleri (karboksilik asitler, fenoller, alkoller), SH asitleri (tioller), NH asitleri (aminler, amidler, imitler), CH asitleri (hidrokarbonlar ve türevleri) bulunur. ). Bir element ve onunla ilişkili hidrojen atomuna asit bölgesi denir. Her durumda elektron yoğunluğunda hidrojen atomundan daha elektronegatif bir atoma doğru bir kayma olur, protonun ayrılması az çok kolaydır. Protonun bağlı olduğu elementin elektronegatifliği ne kadar yüksek olursa bileşiğin asitliği de o kadar yüksek olur (örneğin karboksilik asitler, tiyollerden veya aminlerden daha güçlü asitlerdir).
Molekülde negatif elektronik etkiye sahip elektron çekici grupların varlığı, proton üzerindeki pozitif yükü artırarak asidik özelliklerin artmasına neden olur.
Bir protonla kovalent bağ oluşturmak için Brønsted bazlarının ya yalnız bir elektron çifti ya da p-bağ elektronları sağlaması gerekir. Buna göre Bronsted'in temelleri şu şekilde ayrılmıştır: N-tabanı ve p-tabanı.
N-bazlar nötr veya negatif yüklü olabilir. Kural olarak anyonlar nötr maddelere göre daha güçlü bir bazik karaktere sahiptir. Yani, amid iyonu NH2 - veya hidroksit iyonu HO - baziklik açısından amonyak NH3 ve su H20'dan üstündür.
Alkenleri, alkadienleri, arenleri içeren p-bazlarında bazlık merkezi, yani. Protonun bağlanma yeri p bağının elektronlarıdır. Protonlanmış elektron çiftleri serbest olmadığından bunlar çok zayıf bazlardır.
Elektron veren ikame edicilerin varlığı, organik bileşiklerin bazlığını arttırır.
1. Asitliğin heteroatoma bağımlılığı.
Bir heteroatomun doğası onun elektronegatifliği (E.O.) ve polarize edilebilirliği olarak anlaşılır. (E.O.) ne kadar büyük olursa, moleküldeki heterolitik bölünme o kadar kolay gerçekleşir. Soldan sağa doğru periyotlarda çekirdeğin yükü arttıkça (E.O) artar, yani. elementlerin negatif yük tutma yeteneği. Elektron yoğunluğunun değişmesi sonucunda atomlar arasındaki bağ polarize olur. Elektron sayısı arttıkça ve atomun yarıçapı büyüdükçe, dış enerji seviyesindeki elektronlar çekirdeğe ne kadar uzak olursa, polarizasyon yeteneği ve asitlik de o kadar yüksek olur.
Örnek: CH- NH- OH- SH-
E.O.'da artış ve asitlik
C, N, O aynı periyodun elemanlarıdır. E.O. dönem geçtikçe büyür, asitliği artar. Bu durumda polarize edilebilirlik asitliği etkilemeyecektir.
Bir periyotta atomların polarize edilebilirliği biraz değişir, dolayısıyla asitliği belirleyen ana faktör E.O.'dur.
Şimdi OH-SH-'yi düşünün
artan asitlik
O, S - aynı gruptadır, gruptaki yarıçap yukarıdan aşağıya doğru artar, dolayısıyla atomun polarize edilebilirliği de artar, bu da asitliğin artmasına neden olur. S, O'dan daha büyük bir atom yarıçapına sahiptir, bu nedenle tiyoller, alkollere kıyasla daha güçlü asidik özellikler sergiler.
2. Hidrokarbon radikalinin ve içinde bulunan ikame edicilerin etkisi
Elektron çeken (E.A.) ikame ediciler anyonun stabilitesine ve buna bağlı olarak asitliğin artmasına yol açan elektron yoğunluğunun delokalizasyonuna katkıda bulunur.
Elektron veren (E.D.) ikame ediciler aksine asit merkezindeki elektron yoğunluğunun konsantrasyonuna katkıda bulunurlar, bu da asitliğin azalmasına ve bazlığın artmasına neden olur.
Çözücünün etkisi.
Bir çözünenin moleküllerinin veya iyonlarının bir çözücü ile etkileşimine süreç denir. çözüm. Bir anyonun stabilitesi önemli ölçüde çözeltideki çözünmesine bağlıdır: iyon ne kadar çok çözülürse o kadar kararlı olur ve çözünme ne kadar büyük olursa iyonun boyutu o kadar küçük olur ve içindeki negatif yükün delokalizasyonu o kadar az olur.
Asit özellikleri
1.C aktif metaller:
HO-CH2-CH2-OH + 2Na → H2 + NaO-CH2-CH2-ONa (sodyum glikolat)
2. Bakır(II) hidroksit ile – yüksek kaliteli reaksiyon!

Dihidrik ve polihidrik alkollere (diol fragmanı) kalitatif bir reaksiyon, alkali bir ortamda Cu(OH)2 ile reaksiyondur ve bu, mavi renk veren bir çözelti içinde bir bakır glikolat kompleksi bileşiğinin oluşmasıyla sonuçlanır.
Basitleştirilmiş diyagram

Temel özellikler
1. Hidrohalik asitlerle
HO-CH2-CH2-OH + 2HCl H+↔ Cl-CH2-CH2-Cl + 2H20
Nitrik asit ile

Trinitrogliserin - dinamitin temeli
Etilen glikol toksik - güçlü zehir! Merkezi sinir sistemini baskılar ve böbrekleri etkiler.
Gliserin (propantriol-1,2,3)– zehirli değil. Kokusuz. Suyla iyice karışır. Yabani hayatta dağıtılır. Hayvan ve bitki dokularındaki yağların (lipitlerin) bir parçası olduğu için metabolik süreçlerde önemli bir rol oynar. Cildi yumuşatmak için merhemlerin bir bileşeni olarak kullanılır.
Polihidrik siklik alkol inositol vitamin benzeri bileşiklere (B vitaminleri) aittir ve karmaşık lipitlerin - fosfatidilinositollerin yapısal bir bileşenidir.
Etilendiamin elde etmek için kullanılır etilendiamintetraasetik asit ile etkileşim kloroasetik asit. Onun tuzları yağ asitleriÜretimde yumuşatıcı madde olarak kullanılır tekstil. Üretimde etilendiamin de kullanılıyor boyalar,emülgatörler, stabilizatörler lateksler, plastikleştiriciler Ve fungisitler. Etilendiamin zehirli; izin verilen maksimum konsantrasyon onun buharlar havada 0,001 mg/l'dir.
Poliaminler arasında en iyi bilineni tetrametilendiamindir veya putresin H2N(CH2)4NH2 ve pentametilendiamin veya kadaverin H2N(CH2)5NH2. Uzun bir süre kadavra zehirleri olarak kabul edildiler; Diamino asitlerin dekarboksilasyonu sırasında oluşan ve çürüyen proteinlerin toksisitesine neden olan maddeler.
12. Fenollerin genel özellikleri.

Karbonil grubunun elektronik yapısı. AN'nin karbonil grubuna nükleofilik eklenmesi reaksiyonları. Su, hidrosiyanik asit, alkoller, sodyum bisülfit ilavesinin reaksiyonları. Aldol yoğunlaşmasının mekanizması ve Cannizzaro reaksiyonu.

Karbonil grubunun yapısı C=O.
· Aldehit ve ketonların özellikleri karbonil grubunun >C=O yapısına göre belirlenir.
C=O bağı oldukça polardır. Dipol momenti, alkollerdeki C-O bağınınkinden önemli ölçüde daha yüksektir. C=O çoklu bağının elektronları, özellikle de daha hareketli p-elektronları, elektronegatif oksijen atomuna doğru kayar, bu da üzerinde kısmi bir negatif yükün ortaya çıkmasına neden olur. Karbonil karbon kısmi bir pozitif yük kazanır.
· Bu nedenle karbon, nükleofilik reaktifler tarafından saldırıya uğrar ve oksijen, H+ dahil olmak üzere elektrofilik reaktifler tarafından saldırıya uğrar.
Aldehit ve keton molekülleri, hidrojen bağları oluşturabilen hidrojen atomlarından yoksundur. Bu nedenle kaynama noktaları ilgili alkollerinkinden daha düşüktür. Metanal (formaldehit) bir gazdır, aldehitler C2-C5 ve ketonlar C3-C4 sıvıdır, yüksek maddeler katıdır. Düşük homologlar, su moleküllerinin hidrojen atomları ile karbonil oksijen atomları arasında hidrojen bağlarının oluşması nedeniyle suda çözünür. Hidrokarbon radikali arttıkça sudaki çözünürlük azalır.
Nükleofilik ekleme
Aldehitler ve ketonlar için nükleofilik katılma reaksiyonları en karakteristiktir. BİR.
Genel açıklama nükleofilik ekleme mekanizması BİR
Bir aldehit veya ketonun karbonil grubunun karbon atomuna nükleofilik saldırının kolaylığı, kısmi etkinin büyüklüğüne bağlıdır.
karbon atomundaki pozitif yük, mekansal erişilebilirliği ve ortamın asit-baz özellikleri.

Karbonil karbon atomuyla ilişkili grupların elektronik etkileri dikkate alındığında, aldehitler ve ketonlardaki kısmi pozitif yük δ+'nın değeri aşağıdaki sırayla azalır:

Hidrojenin yerini daha hacimli organik radikaller aldığında karbonil karbon atomunun mekansal erişilebilirliği azalır, dolayısıyla aldehitler ketonlardan daha reaktiftir.

Nükleofilik katılma reaksiyonlarının genel şeması BİR Bir karbonil grubuna bağlanma, karbonil karbon atomuna nükleofilik bir saldırıyı ve ardından oksijen atomuna bir elektrofilin eklenmesini içerir.
Asidik bir ortamda, karbonil grubunun aktivitesi genellikle artar çünkü oksijen atomunun protonlanması, karbon atomu üzerinde pozitif bir yük oluşturur. Asit katalizi genellikle saldıran nükleofilin düşük aktiviteye sahip olduğu durumlarda kullanılır.
Aldehitlerin ve ketonların bir dizi önemli reaksiyonu yukarıdaki mekanizma tarafından gerçekleştirilir.

Alkollerin eklenmesi. Alkoller aldehitlerle etkileşime girdiğinde kolayca oluşur hemiasetaller. Hemiasetaller genellikle kararsızlıkları nedeniyle izole edilmez. Asidik bir ortamda aşırı alkol olduğunda hemiasetaller dönüşür asetaller.

Hemiasetalin asetal'e dönüştürülmesinde asit katalizörünün kullanılması, aşağıda verilen reaksiyon mekanizmasından açıkça anlaşılmaktadır. İçindeki merkezi yer, komşu bir oksijen atomunun yalnız bir elektron çiftinin (C2H50 grubunun +M etkisi) katılımı nedeniyle stabilize edilen bir karbokatyonun (I) oluşumu tarafından işgal edilir.

Hemiasetallerin ve asetallerin oluşum reaksiyonları tersine çevrilebilir, dolayısıyla asetaller ve hemiasetaller asidik bir ortamda aşırı su ile kolayca hidrolize edilir. Alkoksidion, hidroksit iyonundan daha zor ayrılan bir grup olduğundan, hemiasetaller alkali bir ortamda stabildir.
Suyun bağlanması. Karbonil grubuna su eklenmesi - sıvı alımı- geri dönüşümlü reaksiyon. Bir aldehit veya ketonun sulu bir çözelti içindeki hidrasyon derecesi, substratın yapısına bağlıdır.

Trikloroasetik aldehit (kloral) tamamen hidratlanmıştır. Elektron çeken triklorometil grubu, kloral hidratı o kadar stabilize eder ki, bu kristalli madde, yalnızca dehidre edici maddelerin (sülfürik asit vb.) varlığında damıtma sırasında suyu ayırır.

Aminler ve türevlerinin eklenmesi. NH2X (X = R, NHR) genel formülüne sahip aminler ve diğer nitrojen içeren bileşikler, aldehitler ve ketonlarla iki aşamada reaksiyona girer. İlk olarak, nükleofilik ekleme ürünleri oluşur ve bu ürünler daha sonra kararsızlık nedeniyle suyu ortadan kaldırır. Bu bağlamda, bu süreç genel olarak bir reaksiyon olarak sınıflandırılır. bağlanma-ortadan kaldırma.

Birincil aminler durumunda, ikame edilmiş iminler(bunlara ayrıca denir Schiff'in üsleri).
İminler birçok enzimatik sürecin ara ürünleridir. İminlerin üretimi, örneğin formaldehitin a-amino asitlerle reaksiyona girmesi durumunda nispeten stabil olan amino alkollerin oluşumu aşamasından geçer (bkz. 12.1.4).
İminler, aldehitler ve ketonlardan aminlerin hazırlanmasında ara ürünlerdir. indirgeyici aminasyon. Bu genel yöntem bir karbonil bileşiği karışımının amonyak (veya amin) ile indirgenmesinden oluşur. İşlem, daha sonra bir amine indirgenen bir iminin oluşmasıyla birlikte ekleme-çıkarma şemasına göre ilerler.
Aldehitler ve ketonlar hidrazin türevleriyle reaksiyona girdiğinde hidrazonlar. Bu reaksiyon, aldehitleri ve ketonları karışımlardan izole etmek ve bunları kromatografik olarak tanımlamak için kullanılabilir.


Schiff bazları ve diğer benzer bileşikler, başlangıç ürünlerini oluşturmak üzere mineral asitlerin sulu çözeltileri ile kolayca hidrolize edilir.
Bisülfit bileşiklerinin oluşumu Bir molekül asidik sodyum sülfat (bisülfit) eklenerek, karbonil grubunun oksijenine hidrojen ve karbon atomuna SO2ONa kalıntısı eklenerek bisülfit bileşikleri adı verilen bileşikler elde edilir:
Bisülfit bileşiklerinde kükürt atomu doğrudan karbona bağlanır.

CANIZZARO REAKSİYONU, oksidasyon-redüksiyon alkalilerin etkisi altında aldehitlerin birincil alkollerin ve karbonik asitlerin oluşumuyla orantısızlığı, örneğin:

Cannizzaro'nun homojen reaksiyon için önerdiği mekanizma. ortam bir hidrit transfer aşaması içerir 
Aromatik için aldehitler, tek elektron transferi sonucu oluşan radikal anyonların Cannizzaro reaksiyonuna katılma olasılığı göz ardı edilemez. İntramol ile Cannizzaro reaksiyonuna benzer bir reaksiyon meydana gelir. a-ketoaldehitlerin varlığında orantısızlık. alkaliler (Cannizzaro yeniden düzenlemesi): 
Deaminasyon,
Molekül içi deaminasyon
R-CH2 – CH(NH2) - COOH→ R- CH=CH-COOH + NH3
α,β – doymamış asit
Hidrolitik deaminasyon
R-CH(NH2) – COOH +H2O → R – CH(OH) – COOH + NH3
α - hidroksi asit
Oksidatif deaminasyon
R-CH(NH2) – COOH +1/2 O2 → R –C(O) – COOH + NH3
α-keto asit
Metallerle kompleks oluşumu.α-Amino asitler, ağır metal katyonlarıyla kompleks içi tuzlar oluşturur. Taze hazırlanmış bakır(II) hidroksit ile, ılımlı koşullar altında tüm a-amino asitler, iyi kristalleşen kompleks içi (şelat) mavi bakır(II) tuzları verir:

Bu tür tuzlarda bakır iyonu, amino gruplarına koordinasyon bağları ile bağlanır.
Peptit bağı oluşumu.
α-amino asitlerin moleküller arası etkileşimi peptitlerin oluşumuna yol açar. İki a-amino asit etkileşime girdiğinde bir dipeptit oluşur.

Üç a-amino asidin moleküller arası etkileşimi bir tripeptit vb. oluşumuna yol açar.

Bir peptid zinciri oluşturan amino asit moleküllerinin parçalarına amino asit kalıntıları adı verilir ve CO-NH bağına denir. peptid bağı.
22. α-amino asitlerin dekarboksilasyonu - biyojenik aminlerin ve biyodüzenleyicilerin (histamin, triptamin) oluşumu.
Bazı amino asitler ve bunların türevleri, oc-karboksil grubunun çıkarılması anlamına gelen dekarboksilasyona uğrayabilir. Memeli dokularında bir dizi amino asit veya bunların türevleri dekarboksilasyona uğrayabilir: Tri, Tyr, Val, Gis, Glu, Cis, Apr, vb. Reaksiyon ürünleri, vücut üzerinde belirgin bir biyolojik etkiye sahip olan CO2 ve aminlerdir. (biyojenik aminler):

Dekarboksilasyon reaksiyonları geri döndürülemez ve dekarboksilaz enzimleri tarafından katalize edilir. Hayvan hücrelerindeki dekarboksilazların protez grubu piridoksal fosfattır.
Amino asitlerin dekarboksilasyonuyla oluşan aminler genellikle biyolojik olarak aktif maddelerdir. Nörotransmiterler (serotonin, dopamin, GABA vb.), hormonlar (norepinefrin, adrenalin) ve lokal düzenleyici faktörler (histamin, karnosin, spermin vb.) olarak işlev görürler.
Histamin, histidinin aminoasitinin dekarboksilasyonu ile oluşur. Mast hücrelerinde sentezlenir, salgı granüllerinde birikir ve hücreler tahriş olduğunda salınır.

Histaminin çeşitli biyolojik etkileri vardır: vazodilatasyona neden olur, kan basıncını düşürür, doku geçirgenliğini arttırır, lokal ödeme neden olur, mide sekresyonunu uyarır ve bronkospatik etkiye sahiptir. Yüksek konsantrasyonlarda inflamatuar ve alerjik reaksiyonların aracısıdır.
Serotonin, hidroksitriptofanın dekarboksilasyonuyla oluşur. Kromaffin hücrelerinde, subkortikal yapıların bazı çekirdeklerinde ve trombositlerde sentezlenir.

Serotoninin etkileri: vazospazma neden olur, kan basıncını arttırır, bağırsak hareketliliğini uyarır, termoregülasyona, uyku mekanizmalarına katılır, melatonin hormonunun sentezi için bir kaynaktır, insanın zihinsel reaksiyonlarını etkiler. Dolayısıyla şizofrenide serotonin metabolizmasında bir bozukluk vardır.
Katekolaminler (dopamin, adrenalin, norepinefrin) tirozin amino asidinden sentezlenir.
Dopamin uyarıcı bir nörotransmiterdir; eksik olduğunda Parkinson hastalığı gelişir (adinamiklik, sertlik, titreme). Adrenalin vazospazma neden olur, kan basıncını artırır, kalbi uyarır ve bir hormondur.
Norepinefrin öncelikle nörotransmiter fonksiyonlarını yerine getirir.
Poliaminler (spermin, spermidin) ornitin ve metioninden sentezlenir, kromatinin bir parçasıdır ve translasyon, transkripsiyon ve replikasyon işlemlerinin düzenlenmesinde rol oynar.
Biyojen aminler çok aktif olduklarından dokularda hızla inaktive olurlar. Biyojenik aminlerin ayrışmasıçeşitli yollarla gerçekleştirilir: oksidasyon, metilasyon, deaminasyon. Biyojenik aminlerin etkisizleştirilmesinin ana yöntemi oksidatif deaminasyon amin oksidaz enzimlerinin (monoamin oksidazlar, poliamin oksidazlar) etkisi altında.
![]()
Amino asitler, peptit bağları kullanılarak birbirlerine kovalent olarak bağlanabilir. Bir amino asidin karboksil grubu, başka bir amino asidin amino grubuna kovalent olarak bağlanır. Bu, peptid bağı adı verilen bir R-CO-NH-R bağı oluşturur. Bu durumda su molekülü parçalanır.
O- ve N-glikozitler. Glukozitlerin hidrolizi. Monosakkaritlerin fosfatları. Amino şekerlerin asilasyonu. Monosakkaritlerin oksidasyonu. Glikoz osazonlarının hazırlanması. Al-dozun onarıcı özellikleri. Ksilitol, sorbitol. Askorbik asit.
Glikozitler, hemiasetal hidroksil grubunun bir OR grubu ile değiştirildiği siklik karbonhidrat formlarının türevleridir.
Karbonhidrat olmayan bileşen – aglikon. Anomerik merkez ile –OR grubu arasındaki bağ glikosidiktir.
Furanosidler piranosidlere ayrılır.
Glikoz glikozitlerine glikozitler, riboz glikozitlerine ribozitler vb. denir.
GLİKOZİTLER
s a x a r aglikon
(genellikle bir monosakarit) (alkol, aromatik bileşikler, steroidler vb.)
Glikozit sinigrin; hidroliz:
Vanilin glikozit; hidroliz:
Fosfatlar monosakkaritlerdir.
Mükemmel değer fosforik asit esterleri - fosfatları vardır. Tüm bitki ve hayvan organizmalarında bulunurlar ve monosakkaritlerin metabolik olarak aktif formlarıdır. En önemli rolü D-glikoz ve D-fruktoz fosfatlar oynar.
Nötr, hafif asidik bir ortamda glikozun oksidasyonu:

Güçlü bir oksitleyici ajanla oksidasyon:

Alkali bir ortamda glikozun oksidasyonu.
Tollens bölgesi:
Bir γ-lakton asididir.
Meyvelerde, özellikle turunçgillerde, meyvelerde (kuşburnu, siyah kuş üzümü), sebzelerde, sütte bulunur.
Güçlü asidik özellikler sergiler
enediol fragmanının hidroksil gruplarından birine bağlı.
Tuz oluştuğunda γ-lakton halkası açılmaz.
Güçlü onarıcı özelliklere sahiptir. Oksidasyonu sırasında oluşan dehidroaskorbik asit kolaylıkla askorbik asite indirgenir. Bu süreç vücutta bir dizi redoks reaksiyonu sağlar.

Organik kimya karbon atomunun kimyasıdır. Organik bileşiklerin sayısı inorganik olanlardan onlarca kat daha fazladır ve bu ancak açıklanabilir karbon atomunun özellikleri :
a) o içeride Elektronegatiflik ölçeğinin ortası ve ikinci dönem, bu nedenle kendisininkini verip başkalarının elektronlarını kabul etmesi ve pozitif veya negatif bir yük alması onun için kârsızdır;
B) Elektron kabuğunun özel yapısı – elektron çiftleri ve serbest yörüngeler yoktur (benzer yapıya sahip yalnızca bir atom daha vardır - hidrojen, muhtemelen karbon ve hidrojenin bu kadar çok bileşik oluşturmasının nedeni budur - hidrokarbonlar).
Karbon atomunun elektronik yapısı
C – 1s 2 2s 2 2p 2 veya 1s 2 2s 2 2p x 1 2p y 1 2p z 0
Grafiksel formda:
Uyarılmış durumdaki bir karbon atomu aşağıdaki elektronik formüle sahiptir:
*C – 1s 2 2s 1 2p 3 veya 1s 2 2s 1 2p x 1 2p y 1 2p z 1
Hücre şeklinde: 
S- ve p-orbitallerin şekli


Atomik yörünge - karşılık gelen kuantum sayılarıyla birlikte, bir elektronun bulunma olasılığının en yüksek olduğu uzay bölgesi.
Bu, dalga fonksiyonunun yörüngedeki belirli bir noktada bir elektron bulmanın göreceli olasılığını belirlediği üç boyutlu bir elektron "kontur haritasıdır".
Atomik yörüngelerin göreceli boyutları, enerjileri arttıkça artar ( baş kuantum sayısı- n) ve uzaydaki şekilleri ve yönelimleri l ve m kuantum sayılarıyla belirlenir. Orbitallerdeki elektronlar spin kuantum sayısıyla karakterize edilir. Her bir yörünge, zıt spinlere sahip en fazla 2 elektron içerebilir.
Diğer atomlarla bağ oluştururken, karbon atomu elektron kabuğunu dönüştürür, böylece en güçlü bağlar oluşur ve sonuç olarak mümkün olduğu kadar fazla enerji açığa çıkar ve sistem en yüksek stabiliteyi kazanır.
Bir atomun elektron kabuğunun değiştirilmesi enerji gerektirir ve bu daha sonra daha güçlü bağların oluşmasıyla telafi edilir.
Elektron kabuğu dönüşümü (hibridizasyon), karbon atomunun bağ oluşturduğu atom sayısına bağlı olarak temel olarak 3 tipte olabilir.
Hibridizasyon türleri:
sp 3 – bir atom 4 komşu atomla bağ oluşturur (tetrahedral hibridizasyon):
Sp 3 – hibrit karbon atomunun elektronik formülü:
*С –1s 2 2(sp 3) 4 hücre şeklinde 

Hibrit yörüngeler arasındaki bağ açısı ~109°'dir.
Karbon atomunun stereokimyasal formülü:

sp 2 – Hibridizasyon (değerlik durumu)– bir atom 3 komşu atomla bağ oluşturur (üçgen hibridizasyon):
Sp 2 – hibrit karbon atomunun elektronik formülü:
*С –1s 2 2(sp 2) 3 2p 1 hücre şeklinde 
Hibrit yörüngeler arasındaki bağ açısı ~120°'dir.
Sp 2 - hibrit karbon atomunun stereokimyasal formülü:

sp– Hibridizasyon (değerlik durumu) – bir atom 2 komşu atomla bağ oluşturur (doğrusal hibridizasyon):
Sp – hibrit karbon atomunun elektronik formülü:
*С –1s 2 2(sp) 2 2p 2 hücre şeklinde 
Hibrit yörüngeler arasındaki bağ açısı ~180°'dir.
Stereokimyasal formül:

S-orbital her türlü hibridizasyonda yer alır, çünkü minimum enerjiye sahiptir.
Elektron bulutunun yeniden yapılandırılması, mümkün olan en güçlü bağların oluşmasına ve ortaya çıkan moleküldeki atomların minimum etkileşimine olanak tanır. Aynı zamanda Hibrit yörüngeler aynı olmayabilir ancak bağ açıları farklı olabilir. örneğin CH2Cl2 ve CCl4
2. Karbon bileşiklerindeki kovalent bağlar
Kovalent bağlar, özellikleri, oluşma yöntemleri ve nedenleri - okul müfredatı.
Hemen hatırlatmama izin verin:
1. Eğitim İletişimi Atomlar arasındaki etkileşim, atomik yörüngelerinin örtüşmesinin bir sonucu olarak düşünülebilir ve ne kadar etkili olursa (örtüşme integrali ne kadar büyükse), bağ o kadar güçlü olur.
Hesaplanan verilere göre Srel atomik yörüngelerinin bağıl örtüşme verimleri şu şekilde artmaktadır:

Bu nedenle, dört hidrojen atomuyla bağ oluşturmak için sp3 karbon yörüngeleri gibi hibrit yörüngelerin kullanılması, daha güçlü bağlarla sonuçlanır.
2. Karbon bileşiklerindeki kovalent bağlar iki şekilde oluşur:
A)İki atomik yörüngenin asal eksenleri boyunca örtüşmesi durumunda ortaya çıkan bağa denir. - σ bağı.
Geometri. Böylece, metandaki hidrojen atomlarıyla bağlar oluştuğunda, karbon atomunun dört hibrit sp3~ yörüngesi, dört hidrojen atomunun s-orbitalleriyle örtüşür ve her birine 109°28" açıyla konumlanmış dört özdeş güçlü σ bağı oluşturur. diğer (standart dört yüzlü açı) Benzer bir kesinlikle simetrik dört yüzlü yapı, örneğin CCl4'ün oluşumu sırasında, karbonla bağ oluşturan atomlar aynı değilse, örneğin CH2C12 durumunda, uzamsal olarak ortaya çıkar; yapı, esas olarak tetrahedral kalmasına rağmen, tamamen simetrik olandan biraz farklı olacaktır.
σ bağ uzunluğu karbon atomları arasındaki atomların hibridizasyonuna bağlıdır ve sp 3 - hibridizasyondan sp'ye geçiş sırasında azalır. Bu, s yörüngesinin çekirdeğe p yörüngesinden daha yakın olması, dolayısıyla hibrit yörüngedeki payı ne kadar büyük olursa o kadar kısa olması ve dolayısıyla oluşan bağın da o kadar kısa olmasıyla açıklanır.
B) İki atomlu ise - ve üç -birbirine paralel olarak yerleştirilmiş yörüngeler, atomların bulunduğu düzlemin üstünde ve altında yanal örtüşme gerçekleştirir, ardından ortaya çıkan bağa denir. - π (pi) -iletişim


Yanal örtüşme atomik yörüngeler ana eksen boyunca örtüşmekten daha az verimlidir, dolayısıyla π - bağlantılar daha az güçlü σ - bağlantılar. Bu, özellikle bir çift karbon-karbon bağının enerjisinin, tek bir bağın enerjisinin iki katından daha az olması gerçeğinde kendini gösterir. Dolayısıyla etandaki C-C bağ enerjisi 347 kJ/mol iken ettendeki C = C bağ enerjisi yalnızca 598 kJ/mol'dür ve ~ 700 kJ/mol değildir.
İki atomik 2p yörüngesinin yanal örtüşme derecesi ve dolayısıyla güç π -iki karbon atomu varsa ve bunlara dört bağlıysa bağlar maksimumdur atomlar kesinlikle tek bir düzlemde bulunur, yani eğer onlar eş düzlemli çünkü yalnızca bu durumda atomik 2p yörüngeleri birbirine tam olarak paraleldir ve bu nedenle maksimum örtüşme kapasitesine sahiptir. Etrafında dönme nedeniyle eş düzlemli durumdan herhangi bir sapma σ -iki karbon atomunu bağlayan bağ, örtüşme derecesinde bir azalmaya ve buna bağlı olarak mukavemette bir azalmaya yol açacaktır π -bağ böylece molekülün düzlüğünün korunmasına yardımcı olur.
Döndürme bir karbon-karbon çift bağı etrafında mümkün değildir.
Dağıtım π -Molekül düzleminin üstünde ve altında elektronların varlığı anlamına gelir Negatif yük alanları, elektron eksikliği olan reaktiflerle etkileşime girmeye hazır.
Oksijen, nitrojen vb. atomları da farklı değerlik durumlarına (melezleşme) sahipken, elektron çiftleri hem hibrit hem de p-orbitallerde bulunabilir.