Kimyasallar, çevremizdeki dünyayı oluşturan şeylerdir.
Her kimyasal maddenin özellikleri iki türe ayrılır: bunlar, diğer maddeleri oluşturma yeteneğini karakterize eden kimyasal ve nesnel olarak gözlemlenen ve kimyasal dönüşümlerden izole olarak kabul edilebilecek fizikseldir. Örneğin, bir maddenin fiziksel özellikleri, kümelenme durumu (katı, sıvı veya gaz), termal iletkenlik, ısı kapasitesi, çeşitli ortamlarda (su, alkol vb.), çözünürlük, yoğunluk, renk, tat vb. .
Bazı kimyasal maddelerin başka maddelere dönüşmesine kimyasal olaylar veya kimyasal reaksiyonlar denir. Açıkça, bir maddenin diğer maddelere dönüşmeden herhangi bir fiziksel özelliğindeki bir değişikliğin eşlik ettiği fiziksel fenomenlerin de olduğu belirtilmelidir. Fiziksel olaylar, örneğin, buzun erimesini, suyun donmasını veya buharlaşmasını vb. içerir.
Herhangi bir işlem sırasında kimyasal bir olayın meydana geldiği gerçeği, renk değişimi, çökelme, gaz oluşumu, ısı ve / veya ışık oluşumu gibi kimyasal reaksiyonların karakteristik belirtilerinin gözlemlenmesiyle sonuçlandırılabilir.
Bu nedenle, örneğin, aşağıdakileri gözlemleyerek kimyasal reaksiyonların seyri hakkında bir sonuç çıkarılabilir:
Günlük yaşamda ölçek olarak adlandırılan su kaynatıldığında tortu oluşumu;
Bir yangının yanması sırasında ısı ve ışığın serbest bırakılması;
Havada taze bir elma diliminin rengini değiştirmek;
Hamurun fermantasyonu sırasında gaz kabarcıklarının oluşması vb.
Kimyasal reaksiyonlar sürecinde pratik olarak değişime uğramayan, ancak yalnızca yeni bir şekilde birbirine bağlanan en küçük madde parçacıklarına atom denir.
Bu tür madde birimlerinin varlığı fikri, antik Yunanistan'da eski filozofların zihninde ortaya çıktı, bu da aslında "atom" teriminin kökenini açıklıyor, çünkü "atomos" kelimenin tam anlamıyla Yunanca'dan çevrilmiş "bölünemez" anlamına geliyor.
Ancak, eski Yunan filozoflarının düşüncesinin aksine, atomlar maddenin mutlak minimumu değildir, yani. kendileri karmaşık bir yapıya sahiptir.
Her atom, sırasıyla p + , n o ve e - sembolleriyle gösterilen atom altı parçacıklardan - protonlar, nötronlar ve elektronlardan oluşur. Kullanılan gösterimdeki üst simge, protonun bir birim pozitif yüke sahip olduğunu, elektronun bir birim negatif yüke sahip olduğunu ve nötronun yükünün olmadığını gösterir.
Atomun niteliksel yapısına gelince, her atom, elektronların bir elektron kabuğu oluşturduğu sözde çekirdekte yoğunlaşan tüm proton ve nötronlara sahiptir.
Proton ve nötron pratik olarak aynı kütleye sahiptir, yani. m p ≈ m n ve elektron kütlesi, her birinin kütlesinden neredeyse 2000 kat daha azdır, yani. m p / m e ≈ m n / m e ≈ 2000.
Bir atomun temel özelliği elektriksel nötrlüğü olduğundan ve bir elektronun yükü bir protonun yüküne eşit olduğundan, bundan herhangi bir atomdaki elektron sayısının proton sayısına eşit olduğu sonucuna varılabilir.
Örneğin, aşağıdaki tablo atomların olası bileşimini göstermektedir:
Aynı nükleer yüke sahip atomların türü, yani. Çekirdeklerinde aynı sayıda proton bulunan elementlere kimyasal element denir. Böylece yukarıdaki tablodan atom1 ve atom2'nin bir kimyasal elemente, atom3 ve atom4'ün başka bir kimyasal elemente ait olduğu sonucuna varabiliriz.
Her kimyasal elementin belirli bir şekilde okunan kendi adı ve bireysel sembolü vardır. Bu nedenle, örneğin, atomları çekirdekte sadece bir proton içeren en basit kimyasal element, "hidrojen" ismine sahiptir ve "kül" olarak okunan "H" sembolü ve kimyasal element ile gösterilir. +7 nükleer yüke sahip (yani 7 proton içeren) - "azot", "en" olarak okunan "N" sembolüne sahiptir.
Yukarıdaki tablodan da görebileceğiniz gibi, bir kimyasal elementin atomları, çekirdeklerdeki nötron sayısında farklılık gösterebilir.
Aynı kimyasal elemente ait, ancak farklı sayıda nötron ve sonuç olarak kütleye sahip atomlara izotop denir.
Bu nedenle, örneğin, hidrojen kimyasal elementinin üç izotopu vardır - 1 H, 2 H ve 3 H. H sembolünün üzerindeki 1, 2 ve 3 endeksleri, toplam nötron ve proton sayısı anlamına gelir. Şunlar. Hidrojenin, atomlarının çekirdeğinde bir proton olduğu gerçeğiyle karakterize edilen kimyasal bir element olduğunu bilerek, 1H izotopunda (1-1 = 0) hiç nötron olmadığı sonucuna varabiliriz. 2H izotopu - 1 nötron (2-1=1) ve izotop 3H'de - iki nötron (3-1=2). Daha önce de belirtildiği gibi, bir nötron ve bir proton aynı kütleye sahip olduğundan ve bir elektronun kütlesi onlarla karşılaştırıldığında ihmal edilebilir olduğundan, bu, 2H izotopunun, 1H izotopunun ve 3H izotopunun neredeyse iki katı olduğu anlamına gelir. izotop üç kat daha ağırdır. Hidrojen izotoplarının kütlesindeki bu kadar büyük bir yayılma ile bağlantılı olarak, 2H ve 3H izotoplarına, başka hiçbir kimyasal element için tipik olmayan ayrı ayrı isimler ve semboller bile verildi. 2H izotopuna döteryum adı verildi ve D sembolü verildi ve 3H izotopuna trityum adı verildi ve T sembolü verildi.
Proton ve nötronun kütlesini birlik olarak alırsak ve elektronun kütlesini ihmal edersek, aslında, atomdaki toplam proton ve nötron sayısına ek olarak sol üst indeks, kütlesi olarak kabul edilebilir ve bu nedenle bu indeks kütle numarası olarak adlandırılır ve A sembolü ile gösterilir. Herhangi bir protonun çekirdeğinin yükü atoma karşılık geldiğinden ve her protonun yükü şartlı olarak +1'e eşit olarak kabul edildiğinden, çekirdekteki proton sayısı şarj numarası (Z) olarak adlandırılır. Bir atomdaki nötron sayısını N harfi ile ifade ederek kütle numarası, yük sayısı ve nötron sayısı arasındaki ilişki matematiksel olarak şu şekilde ifade edilebilir:
Modern kavramlara göre, elektron ikili (parçacık-dalga) bir yapıya sahiptir. Hem parçacık hem de dalga özelliklerine sahiptir. Bir parçacık gibi, bir elektronun bir kütlesi ve bir yükü vardır, ancak aynı zamanda, bir dalga gibi elektronların akışı, kırınım yeteneği ile karakterize edilir.
Bir atomdaki bir elektronun durumunu tanımlamak için, elektronun belirli bir hareket yörüngesine sahip olmadığı ve uzayda herhangi bir noktada bulunabileceği, ancak farklı olasılıklarla bulunabileceği kuantum mekaniği kavramları kullanılır.
Bir elektronun bulunma olasılığının en yüksek olduğu çekirdeğin etrafındaki uzay bölgesine atomik orbital denir.
Bir atomik yörüngenin farklı bir şekli, boyutu ve yönü olabilir. Bir atomik yörüngeye elektron bulutu da denir.
Grafiksel olarak, bir atomik yörünge genellikle kare bir hücre olarak gösterilir:
Kuantum mekaniği son derece karmaşık bir matematiksel aygıta sahiptir, bu nedenle bir okul kimyası dersi çerçevesinde sadece kuantum mekanik teorisinin sonuçları dikkate alınır.
Bu sonuçlara göre, herhangi bir atomik yörünge ve üzerinde bulunan bir elektron tamamen 4 kuantum sayısı ile karakterize edilir.
- Ana kuantum sayısı - n - belirli bir yörüngedeki bir elektronun toplam enerjisini belirler. Ana kuantum sayısının değer aralığı tamamen doğal sayılardır, yani. n = 1,2,3,4, 5 vb.
- Yörünge kuantum sayısı - l - atomik yörüngenin şeklini karakterize eder ve 0'dan n-1'e kadar herhangi bir tamsayı değeri alabilir, burada n, hatırlama, ana kuantum sayısıdır.
l = 0 olan orbitallere denir s-orbitaller. s-yörüngeleri küreseldir ve uzayda bir yönü yoktur:
l=1 olan orbitallere denir. p-orbitaller. Bu yörüngeler, üç boyutlu sekiz rakamı şeklindedir, yani. sekiz rakamını simetri ekseni etrafında döndürerek elde edilen ve dışa doğru bir dambıl andıran şekil:
l = 2 olan orbitallere denir d-orbitaller, ve l = 3 ile – f-orbitaller. Yapıları çok daha karmaşıktır.
3) Manyetik kuantum sayısı - m l - belirli bir atomik yörüngenin uzaysal yönünü belirler ve yörünge açısal momentumunun manyetik alan yönündeki izdüşümünü ifade eder. Manyetik kuantum sayısı m l, yörüngenin dış manyetik alan kuvveti vektörünün yönüne göre yönüne karşılık gelir ve 0 dahil olmak üzere –l ila +l arasında herhangi bir tamsayı değeri alabilir, yani. olası değerlerin toplam sayısı (2l+1)'dir. Örneğin, l = 0 m l = 0 (bir değer), l = 1 m l = -1, 0, +1 (üç değer), l = 2 m l = -2, -1, 0, + 1 , +2 (manyetik kuantum sayısının beş değeri), vb.
Yani, örneğin, p-orbitaller, yani. “üç boyutlu sekiz rakamı” şeklinde olan l = 1 yörünge kuantum sayısına sahip orbitaller, sırayla karşılık gelen manyetik kuantum sayısının (-1, 0, +1) üç değerine karşılık gelir. uzayda birbirine dik üç yöne.
4) Spin kuantum sayısı (veya basitçe spin) - m s - bir atomdaki bir elektronun dönme yönünden koşullu olarak sorumlu olarak kabul edilebilir, değerler alabilir. Farklı dönüşlere sahip elektronlar, farklı yönleri gösteren dikey oklarla gösterilir: ↓ ve .
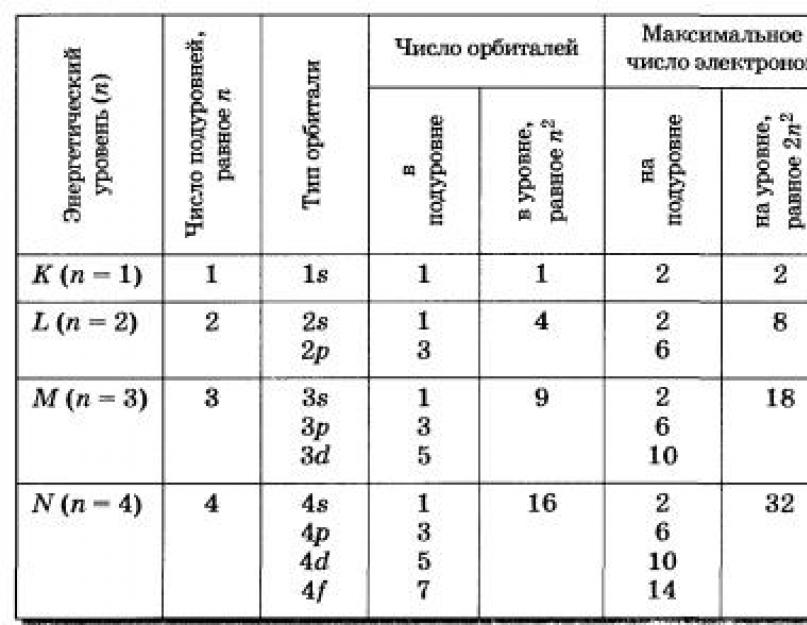
Bir atomdaki temel kuantum sayısıyla aynı değere sahip tüm orbitallerin kümesine enerji düzeyi veya elektron kabuğu denir. n sayısı olan herhangi bir keyfi enerji seviyesi, n 2 yörüngeden oluşur.
Temel kuantum sayısı ve yörünge kuantum sayısı ile aynı değerlere sahip yörüngeler kümesi bir enerji alt seviyesidir.
Ana kuantum sayısı n'ye karşılık gelen her enerji seviyesi, n alt seviye içerir. Sırasıyla, yörünge kuantum sayısı l olan her bir enerji alt düzeyi, (2l+1) orbitalden oluşur. Böylece, s-alt katman bir s-orbital, p-alt katman - üç p-orbital, d-alt katman - beş d-orbital ve f-alt katman - yedi f-orbitalden oluşur. Daha önce de belirtildiği gibi, bir atomik orbital genellikle bir kare hücre ile gösterildiğinden, s-, p-, d- ve f-alt seviyeleri aşağıdaki gibi grafiksel olarak gösterilebilir:
Her yörünge, kesin olarak tanımlanmış üç kuantum sayısı n, l ve m l kümesine karşılık gelir.
Elektronların yörüngelerdeki dağılımına elektron konfigürasyonu denir.
Atomik orbitallerin elektronlarla doldurulması üç koşula göre gerçekleşir:
- Minimum enerji ilkesi: Elektronlar, en düşük enerji alt seviyesinden başlayarak orbitalleri doldurur. Artan enerji sırasına göre alt seviyelerin sırası şöyledir: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Elektronik alt seviyelerin bu doldurma sırasını hatırlamayı kolaylaştırmak için aşağıdaki grafik çizim çok uygundur:
- Pauli prensibi: Her orbital en fazla iki elektron tutabilir.
Yörüngede bir elektron varsa eşleşmemiş, iki elektron varsa elektron çifti olarak adlandırılır.
- Hund kuralı: bir atomun en kararlı durumu, bir alt düzey içinde atomun mümkün olan maksimum sayıda eşleşmemiş elektrona sahip olduğu durumdur. Atomun bu en kararlı durumuna temel durum denir.
Aslında, yukarıdaki, örneğin, 1., 2., 3. ve 4. elektronların p-alt seviyesinin üç yörüngesine yerleştirilmesinin aşağıdaki gibi gerçekleştirileceği anlamına gelir:
Yük sayısı 1 olan hidrojenden yük sayısı 36 olan kriptona (Kr) atomik orbitallerin doldurulması şu şekilde yapılacaktır:
Atomik orbitallerin doldurulma sırasının benzer bir temsiline enerji diyagramı denir. Bireysel elemanların elektronik diyagramlarına dayanarak, onların sözde elektronik formüllerini (konfigürasyonları) yazabilirsiniz. Yani, örneğin, 15 protonlu ve sonuç olarak 15 elektronlu bir element, yani. fosfor (P) aşağıdaki enerji diyagramına sahip olacaktır:
Elektronik bir formüle çevrildiğinde, fosfor atomu şu şekli alacaktır:
15 P = 1s 2 2s 2 2p 6 3s 2 3p 3
Alt seviye sembolünün solundaki normal büyüklükteki sayılar, enerji seviyesinin sayısını gösterir ve alt seviye sembolünün sağındaki üst simgeler, ilgili alt seviyedeki elektronların sayısını gösterir.
Aşağıda, D.I.'nin ilk 36 elementinin elektronik formülleri bulunmaktadır. Mendeleyev.
| dönem | Eşya yok. | sembol | Başlık | elektronik formül |
| ben | 1 | H | hidrojen | 1s 1 |
| 2 | O | helyum | 1s2 | |
| II | 3 | Li | lityum | 1s2 2s1 |
| 4 | olmak | berilyum | 1s2 2s2 | |
| 5 | B | bor | 1s 2 2s 2 2p 1 | |
| 6 | C | karbon | 1s 2 2s 2 2p 2 | |
| 7 | N | azot | 1s 2 2s 2 2p 3 | |
| 8 | Ö | oksijen | 1s 2 2s 2 2p 4 | |
| 9 | F | flor | 1s 2 2s 2 2p 5 | |
| 10 | Ne | neon | 1s 2 2s 2 2p 6 | |
| III | 11 | Na | sodyum | 1s 2 2s 2 2p 6 3s 1 |
| 12 | mg | magnezyum | 1s 2 2s 2 2p 6 3s 2 | |
| 13 | Al | alüminyum | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| 14 | Si | silikon | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| 15 | P | fosfor | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| 16 | S | kükürt | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| 17 | Cl | klor | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| 18 | Ar | argon | 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| IV | 19 | K | potasyum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | CA | kalsiyum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | |
| 21 | sc | skandiyum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | |
| 22 | Ti | titanyum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | |
| 23 | V | vanadyum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | |
| 24 | cr | krom | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 süzerinde d alt düzey | |
| 25 | Mn | manganez | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | |
| 26 | Fe | ütü | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | |
| 27 | ortak | kobalt | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | |
| 28 | Ni | nikel | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | |
| 29 | Cu | bakır | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 süzerinde d alt düzey | |
| 30 | çinko | çinko | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | |
| 31 | ga | galyum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | |
| 32 | Ge | germanyum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | |
| 33 | Olarak | arsenik | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | |
| 34 | Gör | selenyum | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | |
| 35 | Br | brom | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | |
| 36 | kr | kripton | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
Daha önce de belirtildiği gibi, temel hallerinde, atomik orbitallerdeki elektronlar, en az enerji ilkesine göre düzenlenir. Bununla birlikte, bir atomun temel durumundaki boş p-orbitallerinin varlığında, genellikle ona fazla enerji verildiğinde, atom uyarılmış duruma aktarılabilir. Örneğin, temel durumundaki bir bor atomu, elektronik bir konfigürasyona ve aşağıdaki biçimde bir enerji diyagramına sahiptir:
5 B = 1s 2 2s 2 2p 1
Ve heyecanlı durumda (*), yani. bor atomuna bir miktar enerji verildiğinde, elektronik konfigürasyonu ve enerji diyagramı şöyle görünecektir:
5 B* = 1s 2 2s 1 2p 2
Atomdaki en son hangi alt seviyenin doldurulduğuna bağlı olarak, kimyasal elementler s, p, d veya f'ye ayrılır.
D.I tablosunda s, p, d ve f öğelerini bulma. Mendeleyev:
- s-elemanları doldurulacak son s-alt düzeyine sahiptir. Bu öğeler, grup I ve II'nin ana (tablo hücresinde solda) alt gruplarının öğelerini içerir.
- p-elemanları için, p-alt düzeyi doldurulur. p-elemanları, III-VIII gruplarının ana alt gruplarının unsurlarının yanı sıra, birinci ve yedinci hariç her dönemin son altı unsurunu içerir.
- d-elemanları büyük periyotlarda s- ve p-elemanları arasında yer alır.
- F elementlerine lantanitler ve aktinitler denir. D.I. tarafından masanın altına yerleştirilirler. Mendeleyev.
>> Kimya: Kimyasal elementlerin atomlarının elektronik konfigürasyonları
1925'te İsviçreli fizikçi W. Pauli, bir yörüngedeki bir atomda, zıt (antiparalel) dönüşlere sahip (İngilizce'den “iğ” olarak çevrilmiş) ikiden fazla elektron olamayacağını, yani, böyle özelliklere sahip olduklarını tespit etti. şartlı olarak, bir elektronun hayali ekseni etrafında dönüşü olarak temsil edilebilir: saat yönünde veya saat yönünün tersine. Bu ilkeye Pauli ilkesi denir.
Yörüngede bir elektron varsa, o zaman eşlenmemiş denir, eğer iki varsa, o zaman bunlar eşleştirilmiş elektronlardır, yani zıt dönüşlü elektronlardır.
Şekil 5, enerji seviyelerinin alt seviyelere bölünmesinin bir diyagramını göstermektedir.
Bildiğiniz gibi s-yörüngesi küreseldir. Hidrojen atomunun elektronu (s=1) bu yörüngede bulunur ve eşleşmemiştir. Bu nedenle elektronik formülü veya elektronik konfigürasyonu şu şekilde yazılacaktır: 1s 1. Elektronik formüllerde, enerji seviyesi numarası harfin önündeki sayı (1 ...), alt seviye (yörünge tipi) Latin harfi ile ve sağ üst köşeye yazılan sayı ile gösterilir. harf (üs olarak) alt seviyedeki elektron sayısını gösterir.
Aynı s-orbitalinde iki çift elektrona sahip bir helyum atomu için bu formül şöyledir: 1s 2 .
Helyum atomunun elektron kabuğu tamdır ve çok kararlıdır. Helyum asil bir gazdır.
İkinci enerji seviyesi (n = 2) dört yörüngeye sahiptir: bir s ve üç p. İkinci seviye s-orbital elektronlar (2s-orbital), çekirdekten 1s-orbital elektronlardan (n = 2) daha büyük bir mesafede oldukları için daha yüksek bir enerjiye sahiptir.
Genel olarak, her n değeri için bir s-yörüngesi vardır, ancak içinde buna karşılık gelen miktarda elektron enerjisi vardır ve bu nedenle, n'nin değeri arttıkça büyüyen karşılık gelen bir çapa sahiptir.
p-Orbital, bir dambıl veya sekiz hacimli bir şekle sahiptir. Her üç p-orbital, atomun çekirdeği boyunca çizilen uzaysal koordinatlar boyunca karşılıklı olarak dik olarak atomda bulunur. n = 2'den başlayarak her bir enerji seviyesinin (elektronik katman) üç p-yörüngesine sahip olduğu tekrar vurgulanmalıdır. n'nin değeri arttıkça elektronlar, çekirdekten büyük mesafelerde bulunan ve x, y ve z eksenleri boyunca yönlendirilen p-orbitallerini işgal eder.
İkinci periyodun elemanları (n = 2) için, önce bir β-orbital ve ardından üç p-orbital doldurulur. Elektronik formül 1l: 1s 2 2s 1. Elektron, atomun çekirdeğine daha zayıf bağlanır, bu nedenle lityum atomu onu kolayca verebilir (açıkça hatırladığınız gibi, bu işleme oksidasyon denir), bir Li + iyonuna dönüşebilir.
Berilyum atomu Be 0'da dördüncü elektron da 2s orbitalinde bulunur: 1s 2 2s 2 . Berilyum atomunun iki dış elektronu kolayca ayrılır - Be 0, Be2+ katyonuna oksitlenir.
Bor atomunda beşinci elektron bir 2p orbitalini işgal eder: 1s 2 2s 2 2p 1. Ayrıca, C, N, O, E atomları, soy gaz neon ile biten 2p orbitalleriyle doldurulur: 1s 2 2s 2 2p 6.
Üçüncü periyodun elemanları için sırasıyla Sv- ve Sp-orbitalleri doldurulur. Üçüncü seviyenin beş d-orbitali serbest kalır:
11 Na 1s 2 2s 2 Sv1; 17C11v22822r63r5; 18Ar P^Yor^3p6.
Bazen, elektronların atomlardaki dağılımını gösteren diyagramlarda, sadece her enerji seviyesindeki elektron sayısı belirtilir, yani, yukarıda verilen tam elektronik formüllerin aksine, kimyasal elementlerin atomlarının kısaltılmış elektronik formüllerini yazarlar. .
Büyük periyotların (dördüncü ve beşinci) elemanları için, ilk iki elektron sırasıyla 4. ve 5. orbitalleri işgal eder: 19 K 2, 8, 8, 1; 38 Sr 2, 8, 18, 8, 2. Her büyük periyodun üçüncü elementinden başlayarak, sonraki on elektron sırasıyla önceki 3d- ve 4d-orbitallerine gidecektir (ikincil alt grupların elementleri için): 23 V 2 , 8, 11, 2; 26 Tr 2, 8, 14, 2; 40 Zr 2, 8, 18, 10, 2; 43 Tr 2, 8, 18, 13, 2. Kural olarak, önceki d-alt düzeyi dolduğunda, dış (sırasıyla 4p- ve 5p) p-alt düzeyi dolmaya başlayacaktır.
Büyük periyotların elemanları için - altıncı ve eksik yedinci - elektronik seviyeler ve alt seviyeler, kural olarak aşağıdaki gibi elektronlarla doldurulur: ilk iki elektron dış β-alt seviyeye gidecek: 56 Ba 2, 8, 18, 18, 8, 2; 87Gr 2, 8, 18, 32, 18, 8, 1; sonraki elektron (Na ve Ac için) öncekine (p-alt seviye: 57 La 2, 8, 18, 18, 9, 2 ve 89 Ac 2, 8, 18, 32, 18, 9, 2.
Daha sonra sonraki 14 elektron, lantanitler ve aktinitler için sırasıyla 4f ve 5f orbitallerinde dışarıdan üçüncü enerji seviyesine gidecektir.
Ardından ikinci dış enerji seviyesi (d-alt seviye) yeniden oluşmaya başlayacaktır: ikincil alt grupların elemanları için: 73 Ta 2, 8.18, 32.11, 2; 104 Rf 2, 8.18, 32, 32.10, 2, - ve son olarak, sadece mevcut seviyenin on elektronuyla tamamen doldurulduktan sonra dış p-alt seviye tekrar doldurulacaktır:
86 Rn 2, 8, 18, 32, 18, 8.
Çoğu zaman, atomların elektron kabuklarının yapısı, enerji veya kuantum hücreleri kullanılarak tasvir edilir - sözde grafik elektronik formülleri yazarlar. Bu kayıt için aşağıdaki gösterim kullanılır: her kuantum hücresi, bir yörüngeye karşılık gelen bir hücre ile gösterilir; her elektron, dönüş yönüne karşılık gelen bir okla gösterilir. Grafiksel bir elektronik formül yazarken, iki kural hatırlanmalıdır: bir hücrede ikiden fazla elektron bulunamayacağına göre Pauli ilkesi (yörüngeler, ancak antiparalel dönüşlerle) ve F. Hund'un hangi elektronlara göre kuralı serbest hücreleri (yörüngeler) işgal eder, içinde bulunurlar, her seferinde bir tanedir ve aynı zamanda aynı dönüş değerine sahiptirler ve ancak o zaman eşleşirler, ancak bu durumda, Pauli ilkesine göre dönüşler zaten olacaktır. zıt yönlü.
Sonuç olarak, D. I. Mendeleev sisteminin periyotları boyunca elementlerin atomlarının elektronik konfigürasyonlarının haritalanmasını bir kez daha ele alalım. Atomların elektronik yapısının şemaları, elektronların elektronik katmanlar (enerji seviyeleri) üzerindeki dağılımını gösterir. 
Bir helyum atomunda ilk elektron katmanı tamamlanmıştır - 2 elektronu vardır.
Hidrojen ve helyum s elementleridir; bu atomların elektronlarla dolu bir s-yörüngesi vardır.
İkinci dönemin unsurları
İkinci periyodun tüm elemanları için, birinci elektron katmanı doldurulur ve elektronlar, ikinci elektron katmanının e- ve p-orbitallerini en az enerji ilkesine (önce s-, sonra p) ve kurallarına uygun olarak doldurur. Pauli ve Hund (Tablo 2).
Neon atomunda ikinci elektron katmanı tamamlandı - 8 elektronu var.
Tablo 2 İkinci periyottaki elementlerin atomlarının elektron kabuklarının yapısı
Masanın sonu. 2 
Li, Be - elementler.
B, C, N, O, F, Ne - p-elemanları, bu atomlar p-orbitalleri elektronlarla doldurulur.
Üçüncü periyodun unsurları
Üçüncü periyodun element atomları için, birinci ve ikinci elektron katmanları tamamlanır; bu nedenle, elektronların 3s, 3p ve 3d alt seviyelerini işgal edebileceği üçüncü elektron katmanı doldurulur (Tablo 3).
Tablo 3 Üçüncü periyodun elementlerinin atomlarının elektron kabuklarının yapısı

Magnezyum atomunda 3s elektronlu bir yörünge tamamlanır. Na ve Mg-s elementleri. 
Argon atomunda dış katmanda (üçüncü elektron katmanı) 8 elektron vardır. Dış katman olarak tamamlanmıştır, ancak toplamda, üçüncü elektron katmanında, zaten bildiğiniz gibi, 18 elektron olabilir, bu da üçüncü periyodun elemanlarının doldurulmamış 3d orbitallere sahip olduğu anlamına gelir.
Al'den Ag'ye kadar tüm elementler p elementleridir. s- ve p-elementleri Periyodik sistemdeki ana alt grupları oluşturur.
Potasyum ve kalsiyum atomlarında dördüncü bir elektron tabakası belirir ve 3d alt seviyesinden daha düşük bir enerjiye sahip olduğu için 4s alt seviyesi doldurulur (Tablo 4). Dördüncü periyodun elementlerinin atomlarının grafik elektronik formüllerini basitleştirmek için: 1) argonun koşullu grafik elektronik formülünü aşağıdaki gibi gösteririz:
Ar;
2) Bu atomlar için dolu olmayan alt seviyeleri tasvir etmeyeceğiz.
Tablo 4 Dördüncü periyodun elementlerinin atomlarının elektron kabuklarının yapısı


K, Ca - s elementleri ana alt gruplara dahildir. Sc'den Zn'ye kadar olan atomlar için 3d alt seviye elektronlarla doldurulur. Bunlar 3 boyutlu öğelerdir. İkincil alt gruplara dahildirler, ön-dış elektron katmanına sahiptirler, geçiş elementleri olarak adlandırılırlar.
Krom ve bakır atomlarının elektron kabuklarının yapısına dikkat edin. Onlarda, 4n-'den 3d alt seviyesine bir elektronun "arızası" meydana gelir, bu, ortaya çıkan 3d 5 ve 3d 10 elektronik konfigürasyonlarının daha yüksek enerji kararlılığı ile açıklanır: 
Çinko atomunda üçüncü elektron katmanı tamamlanır - tüm 3s, 3p ve 3d alt seviyeleri doldurulur, toplamda 18 elektron vardır.
Çinkoyu takip eden elementlerde dördüncü elektron tabakası, 4p alt seviyesi dolmaya devam eder: Ga'dan Kr'ye kadar olan elementler p elementleridir. 
Kripton atomunun dış tabakası (dördüncü) tamdır ve 8 elektrona sahiptir. Ama sadece dördüncü elektron katmanında bildiğiniz gibi 32 elektron olabilir; kripton atomunun 4d ve 4f alt seviyeleri hala doldurulmamış olarak kalır.
Beşinci periyodun unsurları alt seviyeleri şu sırayla dolduruyor: 5s-> 4d -> 5p. Ayrıca 41 Nb, 42 MO, vb.'de elektronların "arızası" ile ilgili istisnalar da vardır.
Altıncı ve yedinci periyotlarda, yani üçüncü dış elektronik katmanın sırasıyla 4f ve 5f alt seviyelerinin doldurulduğu elemanlar ortaya çıkar.
4f elementlerine lantanitler denir.
5f elementlerine aktinitler denir.
Altıncı periyodun elementlerinin atomlarında elektronik alt seviyelerin doldurulma sırası: 55 Сs ve 56 Ва - 6s-elemanları;
57 La... 6s 2 5d 1 - 5d eleman; 58 Ce - 71 Lu - 4f elemanları; 72 Hf - 80 Hg - 5d elementler; 81 Tl- 86 Rn - 6p elemanları. Ancak burada bile, elektronik yörüngelerin doldurulma sırasının “ihlal edildiği”, örneğin, yarı ve tamamen doldurulmuş f alt seviyelerinin, yani nf 7 ve nf 14'ün daha fazla enerji kararlılığı ile ilişkili olan unsurlar vardır.
Atomun hangi alt seviyesinin en son elektronlarla dolu olduğuna bağlı olarak, zaten anladığınız gibi tüm elementler dört elektronik aileye veya bloğa bölünmüştür (Şekil 7).
1) s-Elementler; atomun dış seviyesinin β-alt seviyesi elektronlarla doldurulur; s-elemanları arasında hidrojen, helyum ve grup I ve II'nin ana alt gruplarının elemanları bulunur;
2) p-elemanları; atomun dış seviyesinin p-alt seviyesi elektronlarla doldurulur; p elemanları, III-VIII gruplarının ana alt gruplarının elemanlarını içerir;
3) d-elemanları; atomun dış öncesi seviyesinin d-alt seviyesi elektronlarla doldurulur; d-elemanları, I-VIII gruplarının ikincil alt gruplarının elemanlarını, yani, s- ve p-elemanları arasında yer alan onyıllar arası büyük periyotların elemanlarını içerir. Bunlara geçiş elemanları da denir;
4) f-elemanları, atomun üçüncü dış seviyesinin f-alt seviyesi elektronlarla doldurulur; bunlara lantanitler ve aktinitler dahildir.
1. Pauli ilkesine saygı gösterilmeseydi ne olurdu?
2. Hund kuralına uyulmazsa ne olur?
3. Ca, Fe, Zr, Sn, Nb, Hf, Ra gibi kimyasal elementlerin atomlarının elektronik yapılarının, elektronik formüllerinin ve grafik elektronik formüllerinin diyagramlarını yapın.
4. İlgili soy gazın sembolünü kullanarak 110 numaralı elementin elektronik formülünü yazın.
ders içeriği ders özeti destek çerçeve ders sunum hızlandırıcı yöntemler etkileşimli teknolojiler Uygulama görevler ve alıştırmalar kendi kendine muayene çalıştayları, eğitimler, vakalar, görevler ödev tartışma soruları öğrencilerden retorik sorular İllüstrasyonlar ses, video klipler ve multimedya fotoğraflar, resimler grafikler, tablolar, mizah şemaları, fıkralar, şakalar, çizgi roman benzetmeleri, sözler, bulmacalar, alıntılar Eklentiler özetler makaleler meraklı hile sayfaları için çipler ders kitapları temel ve ek terimler sözlüğü diğer Ders kitaplarının ve derslerin iyileştirilmesiders kitabındaki hataları düzeltme ders kitabındaki bir parçanın güncellenmesi derste yenilik unsurlarının eskimiş bilgiyi yenileriyle değiştirmesi Sadece öğretmenler için mükemmel dersler tartışma programının metodolojik önerileri yıl için takvim planı Entegre DerslerAtomların elektronik konfigürasyonları
Bir atomdaki elektronlar, aşağıdaki kurallara göre seviyeleri, alt seviyeleri ve orbitalleri işgal eder.
Pauli'nin kuralı. Bir atomdaki iki elektron, dört özdeş kuantum sayısına sahip olamaz. En az bir kuantum sayısına göre farklılık göstermelidirler.
Yörünge, belirli sayılara sahip elektronlar içerir n, l, m l ve üzerindeki elektronlar, yalnızca +1/2 ve -1/2 olmak üzere iki değere sahip olan m s kuantum sayısında farklılık gösterebilir. Bu nedenle, bir yörüngede ikiden fazla elektron bulunamaz.
Alt düzeyde, elektronlar belirli n ve l'ye sahiptir ve m l ve m s sayıları bakımından farklılık gösterirler. m l 2l+1 ve m s - 2 değerleri alabildiğinden, alt düzey 2(2l+1)'den fazla elektron içeremez. Dolayısıyla, s-, p-, d-, f-alt düzeylerindeki maksimum elektron sayısı sırasıyla 2, 6, 10, 14 elektrondur.
Benzer şekilde, bir seviye 2n 2'den fazla elektron içermez ve ilk dört seviyedeki maksimum elektron sayısı sırasıyla 2, 8, 18 ve 32 elektronu geçmemelidir.
En az enerji kuralı. Seviyelerin sıralı olarak doldurulması, atomun minimum enerjisini sağlayacak şekilde gerçekleşmelidir. Her elektron en düşük enerjiye sahip bir serbest yörüngede yer alır.
Klechkovsky'nin kuralı. Elektronik alt seviyelerin doldurulması, toplamın artan sırasına göre (n + l) ve aynı toplam olması durumunda (n + l) - n sayısının artan sırasına göre gerçekleştirilir.
Klechkovsky kuralının grafik formu.
Klechkovsky kuralına göre, alt düzeyler şu sırayla doldurulur: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d , 7p, 8s, ...
Alt seviyelerin doldurulması Klechkovsky kuralına göre gerçekleşse de, elektronik formülde alt seviyeler seviyelere göre sırayla yazılır: 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, vb. Bunun nedeni, dolu seviyelerin enerjisinin kuantum sayısı n tarafından belirlenmesidir: n ne kadar büyükse, enerji de o kadar büyüktür ve tamamen dolu seviyeler için Е 3d'ye sahibiz. Daha küçük n ve daha büyük l'ye sahip alt seviyelerin enerjisinde bir azalma, eğer tamamen veya yarı doluysalar, Klechkovsky kuralı tarafından öngörülenlerden farklı olan bir dizi atomun elektronik konfigürasyonlarına yol açar. Yani Cr ve Cu için değerlik düzeyinde dağılımımız var: Cr(24e) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 ve Cu(29e) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 ve değil Cr(24e) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s 2 ve Cu(29e) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 . Gund'un kuralı. Belirli bir alt seviyenin yörüngeleri, toplam dönüş maksimum olacak şekilde doldurulur. Belirli bir alt seviyenin yörüngeleri önce bir elektron tarafından doldurulur. Örneğin, p 2 konfigürasyonu için, toplam dönüş s = 1/2 + 1/2 = 1 ile dolum p x 1 p y 1, toplam dönüş ile dolum p x 2'den tercih edilir (yani daha düşük bir enerjiye sahiptir). s = 1/2 - 1/2 = 0. - daha karlı, ¯ - daha az karlı. Atomların elektronik konfigürasyonları, seviyeler, alt seviyeler, orbitaller tarafından yazılabilir. İkinci durumda, yörünge genellikle bir kuantum hücresi ile gösterilir ve elektronlar, ms değerine bağlı olarak şu veya bu yöne sahip oklarla gösterilir. Örneğin, elektronik formül P(15e) yazılabilir: a) seviyelere göre)2)8)5 b) alt düzeylere göre 1s 2 2s 2 2p 6 3s 2 3p 3 c) yörüngelere göre 1s 2 2s 2 2p x 2 2p y 2 2p z 2 3s 2 3p x 1 3p y 1 3p z 1 veya ¯ ¯ ¯ ¯ ¯ ¯ Örnek. Ti(22e) ve As(33e) için elektronik formülleri alt düzeylere göre yazın. Titanyum 4. periyotta olduğu için 4p: 1s2s2p3s3p3d4s4p'ye kadar olan alt seviyeleri yazıp, doldurulmamış alt seviyeleri nihai formüle dahil etmeden toplam 22 sayısına kadar elektronlarla dolduruyoruz. Aldığımız. Başlangıçta, Kimyasal Elementlerin Periyodik Tablosundaki elementler D.I. Mendeleev, atom kütlelerine ve kimyasal özelliklerine göre düzenlenmiştir, ancak aslında belirleyici rolü oynayan atomun kütlesi değil, çekirdeğin yükü ve buna bağlı olarak elektronların sayısı olduğu ortaya çıktı. nötr atom. Bir kimyasal elementin atomundaki bir elektronun en kararlı durumu, enerjisinin minimumuna karşılık gelir ve elektronun kendiliğinden daha düşük bir enerjiye sahip bir seviyeye hareket edebildiği diğer herhangi bir duruma uyarılmış denir. Elektronların bir atomda yörüngeler boyunca nasıl dağıldığını düşünelim, yani. temel durumda çok elektronlu bir atomun elektronik konfigürasyonu. Elektronik bir konfigürasyon oluşturmak için orbitalleri elektronlarla doldurmak için aşağıdaki ilkeler kullanılır: - Pauli ilkesi (yasaklama) - bir atomda 4 kuantum sayısının tümüne sahip aynı kümeye sahip iki elektron olamaz; - en az enerji ilkesi (Klechkovsky'nin kuralları) - orbitaller, artan enerji sırasına göre elektronlarla doldurulur (Şekil 1). Pirinç. 1. Hidrojen benzeri bir atomun yörüngelerinin enerji dağılımı; n, ana kuantum sayısıdır. Bir yörüngenin enerjisi (n + l) toplamına bağlıdır. Yörüngeler, bu ortotaller için toplamın (n + l) artan düzeninde elektronlarla doldurulur. Böylece, 3d ve 4s alt seviyeleri için toplamlar (n + l) sırasıyla 5 ve 4'e eşit olacaktır, bunun sonucunda önce 4s orbitali doldurulacaktır. Toplam (n + l) iki yörünge için aynıysa, önce n'nin daha küçük değerine sahip yörünge doldurulur. Böylece, 3d ve 4p orbitalleri için toplam (n + l) her orbital için 5'e eşit olacaktır, ancak önce 3d orbital doldurulur. Bu kurallara göre orbitallerin doldurulma sırası şu şekilde olacaktır: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d<4f<6p<7s<6d<5f<7p Bir elementin ailesi, enerjiye göre elektronlarla dolu son yörünge tarafından belirlenir. Ancak elektronik formüller enerji serilerine göre yazılamaz. 41 Nb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 3 5s 2 doğru elektronik konfigürasyon girişi 41 Nb 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 3 hatalı elektronik konfigürasyon girişi İlk beş d-elemanı için, değerlik (yani, bir kimyasal bağın oluşumundan sorumlu elektronlar), en son elektronlarla dolu olan d ve s üzerindeki elektronların toplamıdır. p - elementleri için değerlik, s ve p alt seviyelerinde bulunan elektronların toplamıdır. S-elementleri için değerlikler, dış enerji seviyesinin s alt seviyesinde bulunan elektronlardır. - Hund kuralı - bir l değerinde, elektronlar yörüngeleri toplam spin maksimum olacak şekilde doldurur (Şekil 2) Pirinç. 2. Periyodik sistemin 2. periyodundaki atomların 1s -, 2s - 2p - orbitallerinde enerji değişimi. Atomların elektronik konfigürasyonlarının yapımına ilişkin örnekler Tablo 1'de verilmiştir. Tablo 1. Atomların elektronik konfigürasyonlarının yapımına ilişkin örnekler Elektronik konfigürasyon Uygulanabilir kurallar Pauli ilkesi, Klechkovsky kuralları Hund kuralı 1s 2 2s 2 2p 6 4s 1 Klechkovsky'nin Kuralları Bir elementin elektronik konfigürasyonu, atomlarındaki elektronların kabuk, alt kabuk ve yörüngelerdeki dağılımının bir kaydıdır. Elektronik konfigürasyon genellikle atomlar için temel durumlarında yazılır. Bir veya daha fazla elektronun uyarılmış durumda olduğu bir atomun elektronik konfigürasyonuna uyarılmış konfigürasyon denir. Temel durumdaki bir elemanın özel elektronik konfigürasyonunu belirlemek için aşağıdaki üç kural mevcuttur: Kural 1: Doldurma prensibi. Doldurma ilkesine göre, bir atomun temel durumundaki elektronlar, yörüngeleri artan yörünge enerji seviyeleri dizisinde doldurur. En düşük enerjili yörüngeler her zaman önce doldurulur. Hidrojen; atom numarası = 1; elektron sayısı = 1 Hidrojen atomundaki bu tek elektron, olası tüm yörüngeler arasında en düşük enerjiye sahip olduğundan, K-kabuğunun s-orbitalini işgal etmelidir (bkz. Şekil 1.21). Bu s orbitalindeki bir elektrona ls elektronu denir. Temel durumdaki hidrojen, Is1 elektronik konfigürasyonuna sahiptir. Kural 2: Pauli dışlama ilkesi. Bu ilkeye göre, herhangi bir yörüngede ikiden fazla elektron olamaz ve bu durumda ancak ters dönüşleri varsa (eşit olmayan dönüş sayıları). Lityum; atom numarası = 3; elektron sayısı = 3 En düşük enerjili yörünge 1s yörüngesidir. Sadece iki elektron alabilir. Bu elektronların farklı spinleri olmalıdır. +1/2'yi yukarıyı gösteren bir okla ve -1/2'yi aşağıyı gösteren bir okla gösterirsek, aynı yörüngede zıt (antiparalel) dönüşlere sahip iki elektron şematik olarak gösterimle temsil edilebilir (Şekil 1.27). ) Aynı (paralel) dönüşlere sahip iki elektron aynı yörüngede olamaz: Bir lityum atomundaki üçüncü elektron, enerji bakımından en düşük yörüngeden sonraki yörüngeyi işgal etmelidir, yani. 2c-yörünge. Bu nedenle, lityum bir Is22s1 elektronik konfigürasyonuna sahiptir. Kural 3: Gund'un kuralı. Bu kurala göre, bir alt kabuğun yörüngelerinin doldurulması, paralel (aynı işarette) dönüşlü tek elektronlarla başlar ve yalnızca tek elektronlar tüm yörüngeleri işgal ettikten sonra, yörüngelerin son olarak zıt dönüşlü elektron çiftleriyle doldurulması meydana gelebilir. Azot; atom numarası = 7; elektron sayısı = 7 Azot, ls22s22p3 elektronik konfigürasyonuna sahiptir. 2p alt kabuğunda bulunan üç elektron, üç 2p orbitalinin her birinde birer birer yerleştirilmelidir. Bu durumda, üç elektronun hepsinin paralel dönüşleri olmalıdır (Şekil 1.22). Masada. 1.6, atom numaraları 1'den 20'ye kadar olan elementlerin elektronik konfigürasyonlarını gösterir. Tablo 1.6. Atom numarası 1 ila 20 olan elementler için temel durum elektronik konfigürasyonları
Atomların elektronik konfigürasyonlarının yapımına örnekler