Elektronların çeşitli AO'lar üzerindeki dağılımına denir. bir atomun elektronik konfigürasyonu. En düşük enerjiye sahip elektronik konfigürasyon, temel durum atom, kalan konfigürasyonlar heyecanlı haller.
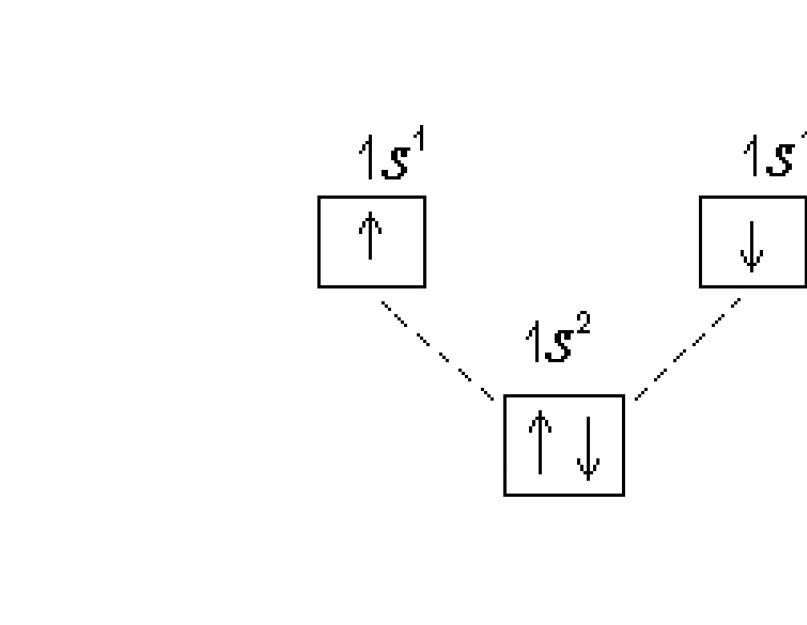
Bir atomun elektronik konfigürasyonu iki şekilde gösterilir - elektronik formüller ve elektron kırınım diyagramları şeklinde. Elektronik formüller yazılırken asal ve orbital kuantum sayıları kullanılır. Alt düzey, ana kuantum sayısı (sayı) ve yörünge kuantum numarası (karşılık gelen harf) ile gösterilir. Bir alt düzeydeki elektron sayısı üst simgeyi karakterize eder. Örneğin, hidrojen atomunun temel durumu için elektronik formül şöyledir: 1 s 1 .
Elektronik seviyelerin yapısı, alt seviyeler üzerindeki dağılımın kuantum hücreleri şeklinde temsil edildiği elektron kırınım diyagramları kullanılarak daha eksiksiz bir şekilde tanımlanabilir. Bu durumda, yörünge, geleneksel olarak, yanına alt seviye atamasının yapıştırıldığı bir kare olarak tasvir edilir. Enerjileri biraz farklı olduğundan, her seviyedeki alt seviyelerin yükseklikleri hafifçe dengelenmelidir. Elektronlar, spin kuantum sayısının işaretine bağlı olarak oklarla veya ↓ ile temsil edilir. Hidrojen atomunun elektron kırınım diyagramı:
Çok elektronlu atomların elektronik konfigürasyonlarını oluşturmanın ilkesi, hidrojen atomuna proton ve elektron eklemektir. Elektronların enerji seviyeleri ve alt seviyeleri üzerindeki dağılımı, daha önce düşünülen kurallara uyar: en az enerji ilkesi, Pauli ilkesi ve Hund kuralı.
Atomların elektronik konfigürasyonlarının yapısı dikkate alındığında, bilinen tüm elementler, son doldurulmuş alt seviyenin yörünge kuantum sayısının değerine göre dört gruba ayrılabilir: s-elementler, p-elementler, d-elementler, f-elementler.
Bir helyum atomunda He (Z=2) ikinci elektron 1 yer kaplar. s-orbital, elektronik formülü: 1 s 2. Elektronografik diyagram:

Helyum, Elementlerin Periyodik Tablosunun ilk en kısa periyodunu bitirir. Helyumun elektronik konfigürasyonu gösterilir.
İkinci periyot, elektronik formülü olan lityum Li'yi (Z=3) açar:  Elektronografik diyagram:
Elektronografik diyagram:

Aşağıdakiler, aynı enerji seviyesindeki yörüngeleri aynı yükseklikte bulunan elementlerin atomlarının basitleştirilmiş elektron kırınım diyagramlarıdır. Dahili, tamamen doldurulmuş alt düzeyler gösterilmez.
Lityumu, ilave bir elektronun 2'yi doldurduğu berilyum Be (Z=4) takip eder. s-orbital. Elektronik formül Be: 2 s 2

Temel durumda, bir sonraki bor elektronu B (z=5) 2 yer kaplar. R-yörünge, V:1 s 2 2s 2 2p bir ; elektron kırınım modeli:

Aşağıdaki beş öğenin elektronik konfigürasyonları vardır:
C (Z=6): 2 s 2 2p 2N (Z=7): 2 s 2 2p 3

O (Z=8): 2 s 2 2p 4 F (Z=9): 2 s 2 2p 5

Ne (Z=10): 2 s 2 2p 6

Verilen elektronik konfigürasyonlar Hund kuralına göre belirlenir.
Neonun birinci ve ikinci enerji seviyeleri tamamen doldurulur. Elektronik konfigürasyonunu belirleyelim ve element atomlarının elektronik formüllerinin kaydının kısalığı için daha fazla kullanacağız.
Sodyum Na (Z=11) ve Mg (Z=12) üçüncü periyodu açar. Dış elektronlar 3'ü işgal eder s-orbital:
Na (Z=11): 3 s 1

Mg (Z=12): 3 s 2

Daha sonra alüminyumdan (Z=13) başlayarak, 3 R-alt düzey. Üçüncü periyot argon Ar (Z=18) ile biter:
Al (Z=13): 3 s 2 3p 1

Ar (Z=18): 3 s 2 3p 6

Üçüncü periyodun unsurları, ikinci periyodun elemanlarından, serbest 3'e sahip olmaları bakımından farklıdır. d-kimyasal bağ oluşumuna katılabilen orbitaller. Bu, elementlerin sergilediği değerlik durumlarını açıklar.
Dördüncü periyotta, kurala göre ( n+ben), potasyum K (Z=19) ve kalsiyumda Ca (Z=20) elektronları 4 yer kaplar. s- alt seviye, 3 değil d. Skandiyum Sc (Z=21) ile başlayıp çinko Zn (Z=30) ile biten 3 d- alt düzey:
elektronik formüller d- elementler iyonik biçimde temsil edilebilir: alt düzeyler, ana kuantum sayısının artan düzeninde ve sabit bir şekilde listelenir n– artan yörünge kuantum sayısı sırasına göre. Örneğin, Zn için böyle bir giriş şöyle görünür:  Bu girdilerin her ikisi de eşdeğerdir, ancak daha önce verilen çinko formülü, alt seviyelerin doldurulma sırasını doğru şekilde yansıtır.
Bu girdilerin her ikisi de eşdeğerdir, ancak daha önce verilen çinko formülü, alt seviyelerin doldurulma sırasını doğru şekilde yansıtır.
3. sıra d-kromdaki elementler Cr (Z=24) kuralından sapma var ( n+ben). Bu kurala göre Cr konfigürasyonu şöyle görünmelidir:  Gerçek yapılandırması olduğu bulundu
Gerçek yapılandırması olduğu bulundu  Bazen bu etkiye elektronun "başarısızlığı" denir. Benzer etkiler, yarı yarıya artan stabilite ile açıklanmaktadır ( p
3 ,
d
5 ,
f
7) ve tamamen ( p
6 ,
d
10 ,
f
14) tamamlanmış alt seviyeler.
Bazen bu etkiye elektronun "başarısızlığı" denir. Benzer etkiler, yarı yarıya artan stabilite ile açıklanmaktadır ( p
3 ,
d
5 ,
f
7) ve tamamen ( p
6 ,
d
10 ,
f
14) tamamlanmış alt seviyeler.
Kuraldan sapmalar ( n+ben) diğer elementlerde de gözlenmektedir (Tablo 2). Bunun nedeni, temel kuantum sayısı arttıkça alt seviyelerin enerjileri arasındaki farkların azalmasıdır.
Sonraki doldurma 4 geliyor p-alt seviye (Ga - Kr). Dördüncü periyot sadece 18 element içerir. Benzer şekilde, doldurma 5 s-, 4d- ve 5 p- beşinci periyodun 18 elementinin alt seviyeleri. enerji 5 olduğuna dikkat edin s- ve 4 d-alt seviyeler çok yakın ve 5'li bir elektron s- alt seviye 4'e kolayca gidebilir d-alt düzey. 5'te s-alt seviye Nb, Mo, Tc, Ru, Rh, Ag sadece bir elektrona sahiptir. Temel durumda 5 s- alt düzey Pd doldurulmamış. İki elektronun bir "dalması" gözlenir.
Tablo 2
İstisnalar ( n+ben) – ilk 86 element için kurallar
|
Elektronik konfigürasyon |
||
|
kurala göre ( n+ben) |
gerçek |
|
|
4s 2 3d 4 4s 2 3d 9 5s 2 4d 3 5s 2 4d 4 5s 2 4d 5 5s 2 4d 6 5s 2 4d 7 5s 2 4d 8 5s 2 4d 9 6s 2 4f 1 5d 0 6s 2 4f 2 5d 0 6s 2 4f 8 5d 0 6s 2 4f 14 5d 7 6s 2 4f 14 5d 8 6s 2 4f 14 5d 9 |
4s 1 3d 5 4s 1 3d 10 5s 1 4d 4 5s 1 4d 5 5s 1 4d 6 5s 1 4d 7 5s 1 4d 8 5s 0 4d 10 5s 1 4d 10 6s 2 4f 0 5d 1 6s 2 4f 1 5d 1 6s 2 4f 7 5d 1 6s 0 4f 14 5d 9 6s 1 4f 14 5d 9 6s 1 4f 14 5d 10 |
|
6'yı doldurduktan sonraki altıncı dönemde s-alt seviye sezyum Cs (Z=55) ve baryum Ba (Z=56) kuralına göre sonraki elektron ( n+ben), 4 almalı f-alt düzey. Ancak, lantanum La'da (Z=57), bir elektron 5 d-alt düzey. Yarım dolu (4 f 7) 4f-alt seviye kararlılığı arttırmıştır, bu nedenle, europium Eu'dan (Z=63) sonra gadolinyum Gd (Z=64), 4 f-alt seviye önceki elektron sayısını (7) korur ve yeni elektron 5'e ulaşır d-alt seviye, kuralı çiğnemek ( n+ben). Terbiyum Tb'de (Z=65), sonraki elektron 4 yer kaplar. f-alt seviye ve 5'ten elektron geçişi var d- alt düzey (yapılandırma 4 f 9 6s 2). Doldurma 4 f-alt seviye iterbiyum Yb'de biter (Z=70). Lutesyum atomunun bir sonraki elektronu Lu, 5 d-alt düzey. Elektronik konfigürasyonu, lantan atomununkinden yalnızca 4 ile tamamen doldurulmasıyla farklıdır. f-alt düzey.
Şu anda, Periyodik element sisteminde D.I. Mendeleev, skandiyum Sc ve itriyum Y altında, lutesyum (lantan yerine) bazen ilk olarak bulunur. d-element ve lantan da dahil olmak üzere önündeki 14 elementin tümü, onu özel bir gruba koyarak lantanitler Elementlerin Periyodik Tablosunun ötesinde.
Elementlerin kimyasal özellikleri esas olarak dış elektronik seviyelerin yapısı ile belirlenir. Üçüncü dıştaki elektron sayısında değişiklik 4 f- alt seviyenin elementlerin kimyasal özellikleri üzerinde çok az etkisi vardır. Yani tüm 4 f elementler özellikleri bakımından benzerdir. Sonra altıncı periyotta 5'lik bir dolgu var. d-alt seviye (Hf - Hg) ve 6 p-alt seviye (Tl - Rn).
7. periyotta 7 s-alt seviye fransiyum Fr (Z=87) ve radyum Ra (Z=88) için doldurulur. Actinium'un kuraldan bir sapması var ( n+ben) ve sonraki elektron 6'yı doldurur d- alt seviye, 5 değil f. Bunu, 5 dolgulu bir grup eleman (Th - No) takip eder. f-bir aile oluşturan alt düzeyler aktinitler. 6 olduğunu unutmayın d- ve 5 f- alt seviyelerin o kadar yakın enerjileri vardır ki, aktinit atomlarının elektronik konfigürasyonu genellikle kurala uymaz ( n+ben). Ancak bu durumda, tam yapılandırma değeri 5'tir. f t 5d m o kadar önemli değil, çünkü elementin kimyasal özellikleri üzerinde oldukça zayıf bir etkiye sahip.
Lavrensiyum Lr (Z=103), 6'da yeni bir elektrona sahiptir. d-alt düzey. Bu element bazen lutesyum altında Periyodik Tabloya yerleştirilir. Yedinci dönem tamamlanmadı. 104 – 109 elementleri kararsızdır ve özellikleri çok az bilinmektedir. Böylece çekirdeğin yükü arttıkça, dış seviyelerin benzer elektronik yapıları periyodik olarak tekrarlanır. Bu bağlamda, elementlerin çeşitli özelliklerinde periyodik değişiklikler de beklenmelidir.
Kimyasal elementlerin atomlarının özelliklerinde periyodik değişim
Elementlerin atomlarının kimyasal özellikleri, etkileşimleri sırasında kendini gösterir. Atomların dış enerji seviyelerinin konfigürasyon türleri, kimyasal davranışlarının ana özelliklerini belirler.
Her elementin atomunun kimyasal reaksiyonlardaki davranışını belirleyen özellikleri iyonlaşma enerjisi, elektron ilgisi, elektronegatifliktir.
İyonlaşma enerjisi, bir atomdan bir elektron koparmak ve çıkarmak için gereken enerjidir. İyonlaşma enerjisi ne kadar düşük olursa, atomun indirgeme gücü o kadar yüksek olur. Bu nedenle iyonlaşma enerjisi, bir atomun indirgeme yeteneğinin bir ölçüsüdür.
Birinci elektronu koparmak için gereken iyonlaşma enerjisine birinci iyonlaşma enerjisi I 1 denir. İkinci elektronu koparmak için gereken enerjiye ikinci iyonlaşma enerjisi I 2 vb. denir. Bu durumda aşağıdaki eşitsizlik meydana gelir.
ben 1< I 2 < I 3 .
Bir elektronun nötr bir atomdan ayrılması ve çıkarılması, yüklü bir iyondan daha kolay gerçekleşir.
İyonlaşma enerjisinin maksimum değeri soy gazlara karşılık gelir. Alkali metaller minimum iyonlaşma enerjisi değerine sahiptir.
Bir periyot içinde iyonlaşma enerjisi monoton olmayan bir şekilde değişir. Başlangıçta, s elemanlarından ilk p elemanlarına geçerken azalır. Ardından, sonraki p-elementlerinde artar.
Bir grup içinde, elementin sıra sayısındaki artışla, dış seviye ile çekirdek arasındaki mesafenin artması nedeniyle iyonlaşma enerjisi azalır.
Elektron ilgisi, bir elektron bir atoma bağlandığında açığa çıkan enerjidir (E ile gösterilir). Bir atom bir elektronu kabul ettiğinde, negatif yüklü bir iyon haline gelir. Bir periyotta elektron ilgisi artarken, bir grupta kural olarak azalır.
Halojenler en yüksek elektron afinitesine sahiptir. Kabuğu tamamlamak için eksik elektronu bağlayarak, bir soy gaz atomunun tamamlanmış konfigürasyonunu elde ederler.
Elektronegatiflik, iyonlaşma enerjisi ve elektron ilgisi toplamıdır.
Elektronegatiflik bir periyotla artar ve bir alt grupla azalır.
Elektronun dalga yapısından dolayı atomlar ve iyonlar kesin olarak tanımlanmış sınırlara sahip değildir. Bu nedenle, atomların ve iyonların yarıçapları şartlı olarak belirlenir.
Atomların yarıçapındaki en büyük artış, s ve p elementleri için tipik olan, yalnızca dış enerji seviyesinin doldurulduğu küçük periyotların elementlerinde gözlenir. d- ve f-elemanları için, artan nükleer yük ile yarıçapta daha yumuşak bir artış gözlenir.
Bir alt grup içinde, enerji seviyelerinin sayısı arttıkça atom yarıçapı artar.
İlk dört periyodun elementlerinin atomlarının elektron kabuklarının yapısı: $s-$, $p-$ ve $d-$ elementleri. Atomun elektronik konfigürasyonu. Atomların zemin ve uyarılmış halleri
Bir atom kavramı, eski dünyada maddenin parçacıklarını belirtmek için ortaya çıktı. Yunanca'da atom "bölünemez" anlamına gelir.
elektronlar
İrlandalı fizikçi Stoney, deneylere dayanarak, elektriğin tüm kimyasal elementlerin atomlarında bulunan en küçük parçacıklar tarafından taşındığı sonucuna vardı. 1891$'da Stoney bu parçacıkları adlandırmayı önerdi. elektronlar, Yunanca'da "kehribar" anlamına gelir.
Elektronun adını almasından birkaç yıl sonra İngiliz fizikçi Joseph Thomson ve Fransız fizikçi Jean Perrin elektronların negatif bir yük taşıdığını kanıtladılar. Bu, kimyada $(–1)$ birimi olarak alınan en küçük negatif yüktür. Thomson, elektronun hızını (ışık hızına eşittir - 300.000$ km/sn) ve elektronun kütlesini (hidrojen atomunun kütlesinden 1836$ kat daha azdır) belirlemeyi bile başardı.
Thomson ve Perrin, bir akım kaynağının kutuplarını iki metal plaka ile bağladılar - bir katot ve bir anot, havanın tahliye edildiği bir cam tüpe lehimlendi. Elektrot plakalarına yaklaşık 10 bin voltluk bir voltaj uygulandığında, tüpte ışıklı bir deşarj meydana geldi ve parçacıklar katottan (negatif kutup) anoda (pozitif kutup) uçtu ve bilim adamları buna ilk kez adını verdiler. katot ışınları ve sonra bunun bir elektron akışı olduğunu öğrendim. Örneğin bir TV ekranına uygulanan özel maddelere çarpan elektronlar parlamaya neden olur.
Sonuç yapıldı: elektronlar, katodun yapıldığı malzemenin atomlarından kaçar.
Serbest elektronlar veya akıları, örneğin bir metal telin ısıtılması veya periyodik tablonun I. grubunun ana alt grubunun (örneğin sezyum) elementlerinin oluşturduğu metallerin üzerine düşen ışık gibi başka yollarla da elde edilebilir.
Atomdaki elektronların durumu
Bir atomdaki bir elektronun durumu, hakkında bir dizi bilgi olarak anlaşılır. enerji belirli elektron Uzay bulunduğu yer. Bir atomdaki bir elektronun bir hareket yörüngesine sahip olmadığını zaten biliyoruz, yani. sadece hakkında konuşabilir olasılıklar onu çekirdeğin etrafındaki boşlukta bulmak. Çekirdeği çevreleyen bu boşluğun herhangi bir yerinde bulunabilir ve çeşitli konumlarının toplamı, belirli bir negatif yük yoğunluğuna sahip bir elektron bulutu olarak kabul edilir. Figüratif olarak, bu şu şekilde hayal edilebilir: Bir atomdaki bir elektronun konumunu, bir fotoğraf finişinde olduğu gibi, saniyenin yüzde biri veya milyonda biri cinsinden fotoğraflamak mümkün olsaydı, bu tür fotoğraflardaki elektron bir nokta olarak temsil edilirdi. Bu tür sayısız fotoğrafın üst üste bindirilmesi, bu noktaların çoğunun bulunduğu yerde en yüksek yoğunluğa sahip bir elektron bulutu resmiyle sonuçlanacaktır.
Şekil, çekirdekten geçen bir hidrojen atomundaki böyle bir elektron yoğunluğunun bir "kesimini" göstermektedir ve kesikli çizgi, içinde bir elektron bulma olasılığının %90$ olduğu küreyi sınırlandırmaktadır. Çekirdeğe en yakın kontur, bir elektron bulma olasılığının %10$, çekirdekten ikinci kontur içinde bir elektron bulma olasılığının %20$, üçüncünün içinde - $≈30 olduğu uzay bölgesini kapsar. %$ vb. Elektronun durumunda bir miktar belirsizlik vardır. Bu özel durumu karakterize etmek için Alman fizikçi W. Heisenberg, kavramı ortaya attı. belirsizlik ilkesi, yani elektronun enerjisini ve yerini aynı anda ve tam olarak belirlemenin imkansız olduğunu gösterdi. Bir elektronun enerjisi ne kadar doğru belirlenirse konumu o kadar belirsizdir ve bunun tersi de konumu belirledikten sonra elektronun enerjisini belirlemek imkansızdır. Elektron algılama olasılığı bölgesinin net sınırları yoktur. Bununla birlikte, bir elektron bulma olasılığının maksimum olduğu alanı ayırmak mümkündür.
Elektronun bulunma olasılığının en yüksek olduğu atom çekirdeğinin etrafındaki boşluğa orbital denir.

Elektron bulutunun yaklaşık %90$'ını içerir, bu da elektronun uzayın bu bölümünde olduğu zamanın yaklaşık %90$'ı anlamına gelir. Forma göre, $s, p, d$ ve $f$ Latin harfleriyle gösterilen şu anda bilinen yörünge türlerinin 4$'ı ayırt edilir. Şekilde bazı elektronik yörünge biçimlerinin grafik bir gösterimi gösterilmektedir.

Bir elektronun belirli bir yörüngedeki hareketinin en önemli özelliği, çekirdekle olan bağlantısının enerjisidir. Benzer enerji değerlerine sahip elektronlar tek bir elektronik katman, veya enerji seviyesi. Enerji seviyeleri çekirdekten başlayarak numaralandırılır: 1, 2, 3, 4, 5, 6$ ve 7$.
Enerji seviyesinin sayısını gösteren bir $n$ tamsayısına temel kuantum sayısı denir.
Belirli bir enerji seviyesini işgal eden elektronların enerjisini karakterize eder. Çekirdeğe en yakın olan birinci enerji seviyesinin elektronları en düşük enerjiye sahiptir. İlk seviyenin elektronları ile karşılaştırıldığında, sonraki seviyelerin elektronları büyük miktarda enerji ile karakterize edilir. Sonuç olarak, dış seviyenin elektronları, atomun çekirdeğine en az kuvvetle bağlı olanlardır.
Bir atomdaki enerji seviyelerinin (elektronik katmanlar) sayısı, kimyasal elementin ait olduğu D. I. Mendeleev sistemindeki periyodun sayısına eşittir: ilk periyodun elementlerinin atomları bir enerji seviyesine sahiptir; ikinci dönem - iki; yedinci dönem - yedi.
Enerji seviyesindeki en büyük elektron sayısı aşağıdaki formülle belirlenir:
burada $N$ maksimum elektron sayısıdır; $n$, seviye numarası veya ana kuantum numarasıdır. Sonuç olarak: çekirdeğe en yakın birinci enerji seviyesi ikiden fazla elektron içeremez; ikincisinde - en fazla 8$; üçüncüsü - en fazla 18$; dördüncü - en fazla 32$. Ve sırayla, enerji seviyeleri (elektronik katmanlar) nasıl düzenlenir?
İkinci enerji seviyesinden $(n = 2)$ başlayarak, seviyelerin her biri alt seviyelere (alt katmanlar) bölünür, çekirdek ile bağlanma enerjisi birbirinden biraz farklıdır.
Alt seviyelerin sayısı, ana kuantum sayısının değerine eşittir: birinci enerji seviyesinin bir alt seviyesi vardır; ikinci - iki; üçüncü - üç; dördüncüsü dört. Alt seviyeler, sırayla, yörüngeler tarafından oluşturulur.
$n$'ın her değeri, $n^2$'a eşit orbital sayısına karşılık gelir. Tabloda sunulan verilere göre, $n$ ana kuantum sayısı ile alt seviyelerin sayısı, orbitallerin türü ve sayısı ve alt seviye ve seviye başına maksimum elektron sayısı arasındaki ilişkiyi izlemek mümkündür.
Temel kuantum sayısı, orbital türleri ve sayısı, alt düzeylerde ve düzeylerde maksimum elektron sayısı.
| Enerji seviyesi $(n)$ | $n$'a eşit alt düzey sayısı | yörünge tipi | yörünge sayısı | Maksimum elektron sayısı | ||
| alt seviyede | $n^2$ düzeyinde | alt seviyede | $n^2$'a eşit bir seviyede | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| $4d$ | $5$ | $10$ | ||||
| 4f$ | $7$ | $14$ | ||||
Latin harfleriyle alt seviyelerin yanı sıra oluşturdukları yörüngelerin şeklini belirtmek gelenekseldir: $s, p, d, f$. Yani:
- $s$-alt seviye - atom çekirdeğine en yakın her enerji seviyesinin ilk alt seviyesi, bir $s$-orbitalinden oluşur;
- $p$-alt düzey - birinci enerji düzeyi hariç, her birinin ikinci alt düzeyi, üç $p$-yörüngesinden oluşur;
- $d$-alt seviye - her birinin üçüncü alt seviyesi, üçüncü enerji seviyesinden başlayarak, beş $d$-orbitalinden oluşur;
- Dördüncü enerji seviyesinden başlayarak her birinin $f$-alt seviyesi, yedi $f$-orbitalinden oluşur.
atom çekirdeği
Ancak sadece elektronlar atomların bir parçası değildir. Fizikçi Henri Becquerel, uranyum tuzu içeren doğal bir mineralin de bilinmeyen radyasyon yaydığını ve ışıktan kapalı fotoğraf filmlerini aydınlattığını keşfetti. Bu fenomen çağrıldı radyoaktivite.
Üç tür radyoaktif ışın vardır:
- Bir elektronun yükünden 2$ kat daha fazla yüke sahip, ancak pozitif bir işarete ve bir hidrojen atomunun kütlesinden 4$ kat daha büyük bir kütleye sahip $α$-parçacıklarından oluşan $α$-ışınları;
- $β$-ışınları bir elektron akışıdır;
- $γ$-ışınları, elektrik yükü taşımayan, ihmal edilebilir bir kütleye sahip elektromanyetik dalgalardır.
Sonuç olarak, atom karmaşık bir yapıya sahiptir - pozitif yüklü bir çekirdek ve elektronlardan oluşur.
Atom nasıl düzenlenir?
1910'da Londra yakınlarındaki Cambridge'de Ernest Rutherford, öğrencileri ve meslektaşlarıyla birlikte ince altın folyodan geçen ve bir ekranın üzerine düşen $α$ parçacıklarının saçılmasını inceledi. Alfa parçacıkları genellikle orijinal yönden yalnızca bir derece saptı ve görünüşe göre altın atomlarının özelliklerinin tekdüzeliğini ve tekdüzeliğini doğruladı. Ve aniden araştırmacılar, bazı $α$-parçacıklarının, sanki bir tür engelle karşılaşıyormuş gibi aniden yollarının yönünü değiştirdiğini fark ettiler.
Rutherford, ekranı folyonun önüne yerleştirerek, altın atomlarından yansıyan $α$-parçacıklarının ters yönde uçtuğu nadir durumları bile tespit edebildi.
Hesaplamalar, atomun tüm kütlesinin ve tüm pozitif yükünün küçük bir merkezi çekirdekte yoğunlaşması durumunda gözlenen fenomenin meydana gelebileceğini gösterdi. Çekirdeğin yarıçapı, ortaya çıktığı gibi, tüm atomun yarıçapından, yani negatif yüklü elektronların bulunduğu alandan 100.000 kat daha küçüktür. Figüratif bir karşılaştırma yaparsak, atomun tüm hacmi Luzhniki stadyumuna, çekirdeği ise alanın ortasında bulunan bir futbol topuna benzetilebilir.
Herhangi bir kimyasal elementin atomu, küçük bir güneş sistemi ile karşılaştırılabilir. Bu nedenle, Rutherford tarafından önerilen böyle bir atom modeline gezegen denir.
Protonlar ve nötronlar
Atomun tüm kütlesinin yoğunlaştığı küçük atom çekirdeğinin iki tip parçacıktan oluştuğu ortaya çıktı - protonlar ve nötronlar.
protonlar elektronların yüküne eşit, ancak $(+1)$ işaretinin zıttı ve bir hidrojen atomunun kütlesine eşit bir kütleye sahiptir (kimyada bir birim olarak kabul edilir). Protonlar $↙(1)↖(1)p$ (veya $р+$) ile gösterilir. nötronlar yük taşımazlar, nötrdürler ve bir protonun kütlesine eşit bir kütleye sahiptirler, yani. 1$. Nötronlar $↙(0)↖(1)n$ (veya $n^0$) ile gösterilir.
Protonlar ve nötronlar topluca denir nükleonlar(lat. çekirdek- çekirdek).
Atomdaki proton ve nötron sayılarının toplamına ne denir kütle Numarası. Örneğin, bir alüminyum atomunun kütle numarası:

İhmal edilebilir olan elektronun kütlesi ihmal edilebileceğinden, atomun tüm kütlesinin çekirdekte toplandığı açıktır. Elektronlar şu şekilde gösterilir: $e↖(-)$.
Atom elektriksel olarak nötr olduğundan, yani atomdaki proton ve elektron sayıları aynıdır. Kimyasal elementin atom numarasına eşittir Periyodik Tabloda kendisine atanır. Örneğin, bir demir atomunun çekirdeği 26$'lık proton içerir ve 26$'lık elektronlar çekirdeğin etrafında döner. Ve nötron sayısı nasıl belirlenir?
Bildiğiniz gibi, bir atomun kütlesi, proton ve nötronların kütlelerinin toplamıdır. $(Z)$ öğesinin sıra numarasını bilmek, yani. proton sayısı ve kütle numarası $(A)$, proton ve nötron sayılarının toplamına eşitse, nötron sayısını $(N)$ formülünü kullanarak bulabilirsiniz:
Örneğin, bir demir atomundaki nötron sayısı:
$56 – 26 = 30$.
Tablo, temel parçacıkların temel özelliklerini göstermektedir.
Temel parçacıkların temel özellikleri.
izotoplar
Aynı elementin çekirdek yükü aynı, kütle numarası farklı olan atom çeşitlerine izotop denir.
Kelime izotop iki Yunanca kelimeden oluşur: iso'lar- aynı ve topos- yer, Periyodik elementler sisteminde "bir yeri işgal etmek" (hücre) anlamına gelir.
Doğada bulunan kimyasal elementler, izotopların bir karışımıdır. Böylece karbonun kütlesi 12, 13, 14$ olan üç izotopu vardır; oksijen - 16, 17, 18 $, vb. kütleye sahip üç izotop.
Genellikle Periyodik sistemde verilen, bir kimyasal elementin nispi atom kütlesi, belirli bir elementin doğal bir izotop karışımının atomik kütlelerinin ortalama değeridir, doğadaki nispi bollukları dikkate alınarak, bu nedenle, değerleri atomik kütleler oldukça sık kesirlidir. Örneğin, doğal klor atomları iki izotopun bir karışımıdır - 35$ (doğada %75$$ vardır) ve 37$ (%25$$ vardır); bu nedenle, klorun bağıl atom kütlesi 35.5$'dır. Klor izotopları aşağıdaki gibi yazılır:
$↖(35)↙(17)(Cl)$ ve $↖(37)↙(17)(Cl)$
Klor izotoplarının kimyasal özellikleri, potasyum, argon gibi çoğu kimyasal elementin izotoplarıyla tamamen aynıdır:
$↖(39)↙(19)(K)$ ve $↖(40)↙(19)(K)$, $↖(39)↙(18)(Ar)$ ve $↖(40)↙(18 )(Ar)$
Bununla birlikte, hidrojen izotopları, göreli atomik kütlelerindeki çarpıcı kat artışı nedeniyle özelliklerde büyük farklılıklar gösterir; onlara bireysel isimler ve kimyasal işaretler bile verildi: protium - $↖(1)↙(1)(H)$; döteryum - $↖(2)↙(1)(H)$ veya $↖(2)↙(1)(D)$; trityum - $↖(3)↙(1)(H)$ veya $↖(3)↙(1)(T)$.

Artık bir kimyasal elementin modern, daha titiz ve bilimsel bir tanımını vermek mümkün.
Bir kimyasal element, aynı nükleer yüke sahip atomların bir koleksiyonudur.
İlk dört periyodun elementlerinin atomlarının elektron kabuklarının yapısı
D. I. Mendeleev sisteminin periyotlarına göre elementlerin atomlarının elektronik konfigürasyonlarının haritalanmasını düşünün.
İlk dönemin unsurları.
Atomların elektronik yapısının şemaları, elektronların elektronik katmanlar (enerji seviyeleri) üzerindeki dağılımını gösterir.

Atomların elektronik formülleri, elektronların enerji seviyeleri ve alt seviyeleri üzerindeki dağılımını gösterir.
Atomların grafik elektronik formülleri, elektronların sadece seviye ve alt seviyelerde değil, aynı zamanda yörüngelerde de dağılımını gösterir.

Bir helyum atomunda ilk elektron katmanı tamamlanmıştır - 2$ elektrona sahiptir.
Hidrojen ve helyum $s$- elementleridir, bu atomların elektronlarla dolu $s$-orbitalleri vardır.
İkinci dönemin unsurları.
İkinci periyodun tüm elemanları için, birinci elektron katmanı doldurulur ve elektronlar, ikinci elektron katmanının $s-$ ve $p$ orbitallerini en az enerji ilkesine uygun olarak doldurur (önce $s$, sonra $p$) ve Pauli ve Hund kuralları.
Neon atomunda ikinci elektron katmanı tamamlanmıştır - 8$ elektrona sahiptir.
Üçüncü periyodun unsurları.
Üçüncü periyodun element atomları için, birinci ve ikinci elektron katmanları tamamlanır, böylece elektronların 3s-, 3p- ve 3d-alt seviyeleri işgal edebileceği üçüncü elektron tabakası doldurulur.
Üçüncü periyottaki elementlerin atomlarının elektron kabuklarının yapısı.
Magnezyum atomunda 3.5$ elektronlu bir yörünge tamamlanır. $Na$ ve $Mg$, $s$ öğeleridir.
Alüminyum ve sonraki elementler için 3d$ alt seviyesi elektronlarla doldurulur.
| $↙(18)(Ar)$ Argon |  |
$1s^2(2)s^2(2)p^6(3)s^2(3)p^6$ |  |
Bir argon atomunda, dış katman (üçüncü elektron katmanı) 8$ elektrona sahiptir. Dış katman tamamlandığında, ancak toplamda, üçüncü elektron katmanında, bildiğiniz gibi, 18 elektron olabilir, bu da üçüncü periyodun elemanlarının doldurulmamış 3d$-orbitalleri olduğu anlamına gelir.
$Al$ ile $Ar$ - $p$ arasındaki tüm elementler -elementler.
$s-$ ve $r$ -elementler biçim ana alt gruplar Periyodik sistemde.
Dördüncü periyodun unsurları.
Potasyum ve kalsiyum atomları dördüncü bir elektron katmanına sahiptir, 4s$-alt seviye doldurulur, çünkü 3d$-alt seviyesinden daha az enerjiye sahiptir. Dördüncü periyodun elementlerinin atomlarının grafik elektronik formüllerini basitleştirmek için:
- argonun grafik elektronik formülünü koşullu olarak şu şekilde ifade ederiz: $Ar$;
- bu atomlar için doldurulmamış alt seviyeleri göstermeyeceğiz.
$K, Ca$ - $s$ -elementler, ana alt gruplara dahildir. $Sc$'dan $Zn$'a kadar olan atomlar için, 3d alt seviye elektronlarla doldurulur. Bunlar 3d$ öğeleridir. Onlar dahil yan alt gruplar,ön dış elektron katmanları doldurulur, bunlara atıfta bulunulur geçiş elemanları.
Krom ve bakır atomlarının elektron kabuklarının yapısına dikkat edin. Onlarda, bir elektron 4s-$ seviyesinden 3d$ alt seviyesine "düşür", bu da sonuçta ortaya çıkan 3d^5$ ve 3d^(10)$ elektronik konfigürasyonlarının daha yüksek enerji kararlılığı ile açıklanır:
$↙(24)(Cr)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(4) 4s^(2)…$ 
$↙(29)(Cu)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(9)4s^(2)…$ 
| Eleman sembolü, seri numarası, isim | Elektronik yapının şeması | elektronik formül | Grafik elektronik formül |
| $↙(19)(K)$ Potasyum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1$ | |
| $↙(20)(C)$ Kalsiyum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2$ | |
| $↙(21)(Sc)$ Skandiyum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^1$ veya $1s^2(2)s^2(2)p ^6(3)p^6(3)d^1(4)s^1$ |  |
| $↙(22)(Ti)$ Titanyum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^2$ veya $1s^2(2)s^2(2)p ^6(3)p^6(3)d^2(4)s^2$ |  |
| $↙(23)(V)$ Vanadyum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^3$ veya $1s^2(2)s^2(2)p ^6(3)p^6(3)d^3(4)s^2$ |  |
| $↙(24)(Cr)$ Chrome |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^5$ veya $1s^2(2)s^2(2)p ^6(3)p^6(3)d^5(4)s^1$ |  |
| $↙(29)(Сu)$ Krom |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^(10)$ veya $1s^2(2)s^2(2) )p^6(3)p^6(3)d^(10)(4)s^1$ |  |
| $↙(30)(Zn)$ Çinko |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)$ veya $1s^2(2)s^2(2) )p^6(3)p^6(3)d^(10)(4)s^2$ |  |
| $↙(31)(Ga)$ Galyum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^(1)$ veya $1s^2(2) s^2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^(1)$ |  |
| $↙(36)(Kr)$ Kripton |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^6$ veya $1s^2(2)s^ 2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^6$ |  |
Çinko atomunda, üçüncü elektron katmanı tamamlanmıştır - tüm 3s, 3p$ ve 3d$ alt düzeyleri doldurulur, toplamda üzerlerinde 18$ elektron vardır.
Çinkoyu takip eden elementlerde dördüncü elektron katmanı olan $4p$-alt seviye dolmaya devam eder. $Ga$'dan $Kr$'a - $r$'a kadar olan elementler -elementler.
Bir kripton atomunun dış (dördüncü) tabakası tamamlanmıştır, 8$ elektrona sahiptir. Ama sadece dördüncü elektron katmanında, bildiğiniz gibi 32$ elektron olabilir; kripton atomunun hala doldurulmamış 4d-$ ve $4f$-alt seviyeleri var.
Beşinci periyodun unsurları alt seviyeleri şu sırayla dolduruyor: 5sn → 4d → 5р$. $↙(41)Nb$, $↙(42)Mo$, $↙(44)Ru$, $↙(45)Rh$, $↙( için elektronların "başarısızlığı" ile ilgili istisnalar da vardır. 46) Pd$, $↙(47)Ag$. $f$ altıncı ve yedinci periyotlarda görünür -elementler, yani üçüncü dış elektronik katmanın sırasıyla $4f-$ ve $5f$-alt seviyeleri doldurulan elemanlar.
4f$ -elementler aranan lantanitler.
5$$ -elementler aranan aktinitler.
Altıncı periyodun elementlerinin atomlarındaki elektronik alt seviyelerin doldurulma sırası: $↙(55)Cs$ ve $↙(56)Ba$ - $6s$-elemanları; $↙(57)La ... 6s^(2)5d^(1)$ - $5d$-eleman; $↙(58)Ce$ – $↙(71)Lu - 4f$-elemanları; $↙(72)Hf$ – $↙(80)Hg - 5d$-elemanları; $↙(81)Т1$ – $↙(86)Rn - 6d$-elemanları. Ancak burada bile, elektron orbitallerinin doldurulma sırasının ihlal edildiği, örneğin yarı ve tamamen doldurulmuş $f$-alt seviyelerinin daha büyük enerji kararlılığı ile ilişkili unsurlar vardır, yani. $nf^7$ ve $nf^(14)$.
Atomun hangi alt seviyesinin en son elektronlarla dolu olduğuna bağlı olarak, zaten anladığınız gibi tüm elementler dört elektronik aileye veya bloğa ayrılır:
- $s$ -elementler; atomun dış seviyesinin $s$-alt seviyesi elektronlarla doludur; $s$- elementleri hidrojen, helyum ve I ve II gruplarının ana alt gruplarının elementlerini içerir;
- $r$ -elementler; atomun dış seviyesinin $p$-alt seviyesi elektronlarla doldurulur; $p$-öğeleri, III-VIII gruplarının ana alt gruplarının öğelerini içerir;
- $d$ -elementler; atomun dışsal öncesi seviyesinin $d$-alt seviyesi elektronlarla doldurulur; $d$-öğeleri, I-VIII gruplarının ikincil alt gruplarının öğelerini içerir, yani. $s-$ ve $p-$ öğeleri arasında yer alan onlarca yıllık büyük periyotların öğeleri. Onlar da denir geçiş elemanları;
- $f$ -elementler;$f-$alt seviyedeki atomun üçüncü seviyesi elektronlarla doldurulur; bunlara lantanitler ve aktinitler dahildir.

Atomun elektronik konfigürasyonu. Atomların zemin ve uyarılmış halleri
İsviçreli fizikçi W. Pauli, 1925$'da şunu ortaya koydu: Bir atom, bir yörüngede en fazla iki elektrona sahip olabilir. zıt (antiparalel) dönüşlere sahip (İngilizce'den iğ olarak tercüme edilmiştir), yani. koşullu olarak bir elektronun sanal ekseni etrafında saat yönünde veya saat yönünün tersine dönmesi olarak hayal edilebilecek özelliklere sahip. Bu ilke denir Pauli ilkesi.
Bir yörüngede bir elektron varsa buna denir. eşleşmemiş, eğer iki ise, o zaman bu eşleştirilmiş elektronlar, yani zıt spinli elektronlar.
Şekil, enerji seviyelerinin alt seviyelere bölünmesinin bir diyagramını göstermektedir.

$s-$ Orbital, zaten bildiğiniz gibi, küresel bir şekle sahiptir. Hidrojen atomu elektronu $(n = 1)$ bu yörüngede bulunur ve eşleşmemiştir. Buna göre onun elektronik formül, veya elektronik konfigürasyon, şöyle yazılır: $1s^1$. Elektronik formüllerde, enerji seviyesinin numarası $ (1 ...) $ harfinin önündeki sayı ile, Latin harfi alt seviyeyi (yörünge tipi) ve sağına yazılan sayı ile gösterilir. harf (üs olarak) alt seviyedeki elektronların sayısını gösterir.
Aynı $s-$ orbitalinde iki çift elektronu olan bir helyum atomu He için, bu formül: $1s^2$. Helyum atomunun elektron kabuğu tamdır ve çok kararlıdır. Helyum asil bir gazdır. İkinci enerji seviyesi $(n = 2)$, bir $s$ ve üç $p$ olmak üzere dört yörüngeye sahiptir. İkinci seviye $s$-orbital elektronları (2s$-orbitalleri) daha yüksek enerjiye sahiptir, çünkü çekirdekten $1s$-orbital $(n = 2)$ elektronlarından daha uzaktadır. Genel olarak, her $n$ değeri için bir $s-$orbital vardır, ancak üzerinde buna karşılık gelen miktarda elektron enerjisi vardır ve dolayısıyla, buna karşılık gelen bir çap ile $n$.$s- değeri olarak büyür. $Yörünge artışları bildiğiniz gibi küresel bir şekle sahiptir. Hidrojen atomu elektronu $(n = 1)$ bu yörüngede bulunur ve eşleşmemiştir. Bu nedenle, elektronik formülü veya elektronik konfigürasyonu şu şekilde yazılır: $1s^1$. Elektronik formüllerde, enerji seviyesinin numarası $ (1 ...) $ harfinin önündeki sayı ile, Latin harfi alt seviyeyi (yörünge tipi) ve sağına yazılan sayı ile gösterilir. harf (üs olarak) alt seviyedeki elektronların sayısını gösterir.
Aynı $s-$ orbitalinde iki çift elektrona sahip olan bir helyum atomu $He$ için bu formül: $1s^2$. Helyum atomunun elektron kabuğu tamdır ve çok kararlıdır. Helyum asil bir gazdır. İkinci enerji seviyesi $(n = 2)$, bir $s$ ve üç $p$ olmak üzere dört yörüngeye sahiptir. İkinci seviyenin ($2s$-orbitalleri) $s-$ orbitallerinin elektronları daha yüksek enerjiye sahiptir, çünkü çekirdekten $1s$-orbital $(n = 2)$ elektronlarından daha uzaktadır. Genel olarak, her $n$ değeri için bir $s-$ orbitali vardır, ancak üzerinde buna karşılık gelen miktarda elektron enerjisi vardır ve bu nedenle, buna karşılık gelen bir çap ile $n$ değeri arttıkça büyür. 
$r-$ Orbital Bir dambıl şeklinde veya sekiz hacmindedir. Üç $p$-yörüngesinin tümü, atomun çekirdeği boyunca çizilen uzaysal koordinatlar boyunca karşılıklı olarak dik olarak atomda bulunur. $n= 2$'dan başlayan her bir enerji seviyesinin (elektronik katman) üç $p$-yörüngesine sahip olduğu tekrar vurgulanmalıdır. $n$ değeri arttıkça, elektronlar çekirdekten çok uzaklarda bulunan ve $x, y, z$ eksenleri boyunca yönlendirilen $p$-orbitallerini işgal eder.
$(n = 2)$ ikinci periyodunun elemanları için, ilk önce bir $s$-orbital doldurulur ve ardından üç $p$-orbital doldurulur; elektronik formül $Li: 1s^(2)2s^(1)$. 2s^1$ elektron atom çekirdeğine daha az bağlıdır, bu nedenle bir lityum atomu onu kolayca verebilir (muhtemelen hatırladığınız gibi, bu işleme oksidasyon denir), bir lityum iyonu $Li^+$'a dönüşebilir.
Berilyum atomu Be'de dördüncü elektron da $2s$ yörüngesine yerleştirilmiştir: $1s^(2)2s^(2)$. Berilyum atomunun iki dış elektronu kolayca ayrılır - $B^0$, $Be^(2+)$ katyonuna oksitlenir.
Bor atomunun beşinci elektronu $2p$-orbitalini kaplar: $1s^(2)2s^(2)2p^(1)$. Ardından, $C, N, O, F$ atomlarının $2p$-orbitalleri doldurulur ve bu da neon soy gazla biter: $1s^(2)2s^(2)2p^(6)$.
Üçüncü periyodun elemanları için sırasıyla $3s-$ ve $3p$-orbitalleri doldurulur. Üçüncü seviyenin beş $d$-orbitali serbest kalır:
$↙(11)Na 1s^(2)2s^(2)2p^(6)3s^(1)$,
$↙(17)Cl 1s^(2)2s^(2)2p^(6)3s^(2)3p^(5)$,
$↙(18)Ar 1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)$.
Bazen, elektronların atomlardaki dağılımını gösteren diyagramlarda, sadece her bir enerji seviyesindeki elektron sayısı belirtilir, yani. Yukarıdaki tam elektronik formüllerin aksine, kimyasal elementlerin atomlarının kısaltılmış elektronik formüllerini yazın, örneğin:
$↙(11)Na 2, 8, 1;$ $↙(17)Cl 2, 8, 7;$$↙(18)Ar 2, 8, 8$.
Büyük periyotların (dördüncü ve beşinci) elemanları için, ilk iki elektron sırasıyla $4s-$ ve $5s$- orbitallerini işgal eder: $↙(19)K 2, 8, 8, 1;$$↙(38)Sr 2 , 8, 18, 8, 2$. Her büyük periyodun üçüncü elementinden başlayarak, sonraki on elektron sırasıyla önceki $3d-$ ve $4d-$ orbitallerine gidecektir (ikincil alt grupların elemanları için): $↙(23)V 2, 8, 11 , 2;$ $↙( 26)Fr 2, 8, 14, 2;$ $↙(40)Zr 2, 8, 18, 10, 2;$$↙(43)Tc 2, 8, 18, 13, 2$. Kural olarak, önceki $d$-alt düzeyi doldurulduğunda, dış (sırasıyla $4p-$ ve $5p-$) $p-$alt düzeyi doldurulmaya başlar: $↙(33)As 2, 8, 18, 5;$ $ ↙(52)Te 2, 8, 18, 18, 6$.
Büyük periyotların elemanları için - altıncı ve eksik yedinci - elektronik seviyeler ve alt seviyeler, kural olarak aşağıdaki gibi elektronlarla doldurulur: ilk iki elektron dış $s-$alt seviyeye girer: $↙(56)Ba 2, 8 , 18, 18, 8, 2;$ $↙(87)Fr 2, 8, 18, 32, 18, 8, 1$; önceki $d$ alt düzeyine bir sonraki elektron ($La$ ve $Ca$ için): $↙(57)La 2, 8, 18, 18, 9, 2$ ve $↙(89)Ac 2, 8, 18, 32, 18, 9, 2$.
Ardından, sonraki 14$'lık elektronlar dışarıdan üçüncü enerji seviyesine, lantonidlerin ve aktinitlerin sırasıyla $4f$ ve $5f$ orbitallerine girecek: $↙(64)Gd 2, 8, 18, 25, 9, 2 ;$ $↙(92 )U 2, 8, 18, 32, 21, 9, 2$.
Daha sonra dışarıdan ikinci enerji seviyesi ($d$-alt seviye) yan alt grupların elemanları için yeniden oluşmaya başlayacaktır: $↙(73)Ta 2, 8, 18, 32, 11, 2;$ $↙( 104)Rf 2, 8, 18 , 32, 32, 10, 2$. Ve son olarak, ancak $d$-alt düzeyi on elektronla tamamen doldurulduktan sonra, $p$-alt düzeyi yeniden doldurulacaktır: $↙(86)Rn 2, 8, 18, 32, 18, 8$.
Çok sık olarak, atomların elektron kabuklarının yapısı, enerji veya kuantum hücreleri kullanılarak tasvir edilir - sözde yazarlar. grafik elektronik formüller. Bu kayıt için aşağıdaki gösterim kullanılır: her kuantum hücresi, bir yörüngeye karşılık gelen bir hücre ile gösterilir; her elektron, dönüş yönüne karşılık gelen bir okla gösterilir. Grafiksel bir elektronik formül yazarken iki kural hatırlanmalıdır: Pauli prensibi bir hücrenin (yörünge) ikiden fazla elektrona sahip olamayacağı, ancak antiparalel dönüşlere sahip olabileceği ve F. Hund kuralı, elektronların ilk önce serbest hücreleri işgal ettiği ve aynı anda aynı spin değerine sahip olduğu ve ancak o zaman çift olduğu, ancak bu durumda spinler Pauli ilkesine göre zaten zıt yönde olacaktır.
Görev 1. Aşağıdaki elemanların elektronik konfigürasyonlarını yazınız: N, Si, F e, Kr , Te, W .
Çözüm. Atomik orbitallerin enerjisi aşağıdaki sırayla artar:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d .
Her s kabuğunda (bir yörünge) ikiden fazla elektron olamaz, p kabuğunda (üç yörünge) - altıdan fazla, d kabuğunda (beş yörünge) - 10'dan fazla ve f-kabuğu (yedi yörünge) - 14'ten fazla değil.
Bir atomun temel durumunda, elektronlar en düşük enerjili orbitalleri işgal eder. Elektron sayısı, çekirdeğin yüküne (bir bütün olarak atom nötrdür) ve elementin atom numarasına eşittir. Örneğin, bir nitrojen atomunun ikisi 1s orbitalinde, ikisi 2s orbitalinde ve geri kalan üç elektron 2p orbitalinde olmak üzere 7 elektrona sahiptir. Azot atomunun elektronik konfigürasyonu:
7 N : 1s 2 2s 2 2p 3 . Diğer elemanların elektronik konfigürasyonları:
14 Si: 1s 2 2s 2 2p 6 3s 2 3p 2 ,
26 F e : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 ,
36 bin r: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 ,
52 Bunlar : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 4 ,
74 Bunlar : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 .
Görev 2. Kalsiyum atomundan tüm değerlik elektronlarının çıkarılmasından kaynaklanan parçacıkla aynı elektronik konfigürasyona sahip elementlerden hangi soy gaz ve iyonlar?
Çözüm. Kalsiyum atomunun elektron kabuğu 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 yapısına sahiptir. İki değerlik elektronu çıkarıldığında, 1s 2 2s 2 2p 6 3s 2 3p 6 konfigürasyonunda bir Ca 2+ iyonu oluşur. Bir atom aynı elektronik konfigürasyona sahiptir Ar ve iyonlar S 2-, Cl -, K +, Sc 3+, vb.
Görev 3. Al 3+ iyonunun elektronları aşağıdaki orbitallerde olabilir mi: a) 2p; b) 1r; c) 3 boyutlu mu?
Çözüm. Alüminyum atomunun elektronik konfigürasyonu: 1s 2 2s 2 2p 6 3s 2 3p 1 . Al 3+ iyonu, bir alüminyum atomundan üç değerlik elektronunun çıkarılmasıyla oluşur ve 1s 2 2s 2 2p 6 elektronik konfigürasyonuna sahiptir.
a) elektronlar zaten 2p yörüngesindedir;
b) l (l = 0, 1, ... n -1) kuantum sayısına uygulanan kısıtlamalara göre, n = 1'de sadece l = 0 değeri mümkündür, bu nedenle 1p yörüngesi mevcut değildir ;
c) iyon uyarılmış durumdaysa elektronlar 3 boyutlu yörüngede olabilir.
Görev 4.İlk uyarılmış durumda neon atomunun elektronik konfigürasyonunu yazın.
Çözüm. Neon atomunun temel durumdaki elektronik konfigürasyonu 1s 2 2s 2 2p 6'dır. İlk uyarılmış durum, bir elektronun en yüksek dolu yörüngeden (2p) en düşük serbest yörüngeye (3s) geçişi ile elde edilir. Neon atomunun ilk uyarılmış haldeki elektronik konfigürasyonu 1s 2 2s 2 2p 5 3s 1'dir.
Görev 5. 12 C ve 13 C , 14 N ve 15 N izotoplarının çekirdeklerinin bileşimi nedir?
Çözüm. Çekirdekteki proton sayısı, elementin atom numarasına eşittir ve bu elementin tüm izotopları için aynıdır. Nötron sayısı, kütle numarasından (element numarasının sol üst köşesinde gösterilir) eksi proton sayısına eşittir. Aynı elementin farklı izotopları farklı sayıda nötron içerir.
Bu çekirdeklerin bileşimi:
12C: 6p + 6n; 13C: 6p + 7n; 14 N : 7p + 7n ; 15N: 7p + 8n.
Elektronik konfigürasyon- bir kimyasal elementin veya molekülün bir atomunun çeşitli elektron kabuklarındaki elektronların düzenlenmesi için formül.
Elektronik konfigürasyon genellikle atomlar için temel durumlarında yazılır. Bir elemanın elektronik konfigürasyonunu belirlemek için aşağıdaki kurallar mevcuttur:
- Doldurma prensibi. Doldurma ilkesine göre, bir atomun temel durumundaki elektronlar, yörüngeleri artan yörünge enerji seviyeleri dizisinde doldurur. En düşük enerjili yörüngeler her zaman önce doldurulur.
- Pauli dışlama ilkesi. Bu ilkeye göre, herhangi bir yörüngede ikiden fazla elektron olamaz ve bu durumda ancak ters dönüşleri varsa (eşit olmayan dönüş sayıları).
- Hund kuralı. Bu kurala göre, bir alt kabuğun yörüngelerinin doldurulması, paralel (aynı işarette) dönüşlü tek elektronlarla başlar ve yalnızca tek elektronlar tüm yörüngeleri işgal ettikten sonra, yörüngelerin son olarak zıt dönüşlü elektron çiftleriyle doldurulması meydana gelebilir.
Kuantum mekaniği açısından, elektronik konfigürasyon, bir atomun tam dalga fonksiyonunu (yaklaşık olarak) yeterli bir doğruluk derecesi ile oluşturmanın mümkün olduğu tek elektronlu dalga fonksiyonlarının tam bir listesidir. kendi kendine tutarlı bir alan).
Genel olarak konuşursak, bir bileşik sistem olarak atom, yalnızca tam dalga fonksiyonu ile tam olarak tanımlanabilir. Bununla birlikte, böyle bir açıklama, kimyasal elementlerin tüm atomlarının en basiti olan hidrojen atomundan daha karmaşık atomlar için pratik olarak imkansızdır. Uygun bir yaklaşık açıklama, kendi kendine tutarlı alan yöntemidir. Bu yöntem, her elektronun dalga fonksiyonu kavramını tanıtır. Tüm sistemin dalga fonksiyonu, tek elektronlu dalga fonksiyonlarının düzgün simetrik bir ürünü olarak yazılır. Her elektronun dalga fonksiyonu hesaplanırken, diğer tüm elektronların alanı, diğer elektronların dalga fonksiyonlarına bağlı olan bir dış potansiyel olarak dikkate alınır.
Kendinden tutarlı alan yönteminin uygulanmasının bir sonucu olarak, hala çözülmesi zor olan karmaşık bir doğrusal olmayan tam diferansiyel denklem sistemi elde edilir. Bununla birlikte, kendi kendine tutarlı alan denklemleri, orijinal problemin dönme simetrisine sahiptir (yani, küresel olarak simetriktirler). Bu, bir atomun tam dalga fonksiyonunu oluşturan tek elektronlu dalga fonksiyonlarını tamamen sınıflandırmayı mümkün kılar.
Başlangıç olarak, herhangi bir merkezi simetrik potansiyelde olduğu gibi, kendi kendine tutarlı bir alandaki dalga fonksiyonu, toplam açısal momentumun kuantum sayısı ile karakterize edilebilir. l (\görüntüleme stili l) ve açısal momentumun bir eksen üzerindeki izdüşümünün kuantum sayısı m (\görüntüleme stili m). Farklı değerlere sahip dalga fonksiyonları m (\görüntüleme stili m) aynı enerji seviyesine karşılık gelirler, yani dejeneredirler. Ayrıca, bir enerji seviyesi, herhangi bir eksende elektron spininin farklı izdüşümlerine sahip durumlara karşılık gelir. Belirli bir enerji seviyesi için toplam 2 (2 l + 1) (\displaystyle 2(2l+1)) dalga fonksiyonları. Ayrıca, açısal momentumun belirli bir değeri için enerji seviyeleri yeniden numaralandırılabilir. Hidrojen atomuna benzetme yaparak, belirli bir durum için enerji seviyelerini numaralandırmak gelenekseldir. l (\görüntüleme stili l) ile başlayan n = l + 1 (\displaystyle n=l+1). Bir atomun dalga fonksiyonunun oluşturulabileceği tek elektronlu dalga fonksiyonlarının kuantum sayılarının tam listesine elektronik konfigürasyon denir. Kuantum sayısında her şey dejenere olduğundan m (\görüntüleme stili m) ve spinde, durumdaki toplam elektron sayısını verilerle belirtmek yeterlidir. n (\görüntüleme stili n), l (\görüntüleme stili l).
Ansiklopedik YouTube
-
1 / 5
Tarihsel nedenlerden dolayı, elektronik konfigürasyon formülünde kuantum sayısı l (\görüntüleme stili l) Latin harfleriyle yazılmıştır. İle devlet harfle gösterilir s (\görüntüleme stili s), p (\görüntüleme stili p): l = 1 (\displaystyle l=1), d (\görüntüleme stili d): l = 2 (\displaystyle l=2), f (\görüntüleme stili f): l = 3 (\displaystyle l=3), g (\displaystyle g): l = 4 (\displaystyle l=4) ve benzeri alfabetik olarak. Numaranın solunda l (\görüntüleme stili l) bir sayı yaz n (\görüntüleme stili n), ve numaranın üstünde l (\görüntüleme stili l) veri durumundaki elektron sayısıdır n (\görüntüleme stili n) ve l (\görüntüleme stili l). Örneğin 2 sn 2 (\displaystyle 2s^(2)) bir durumda iki elektrona karşılık gelir n = 2 (\displaystyle n=2), l = 0 (\displaystyle l=0). Pratik kolaylık nedeniyle (bkz. Klechkovsky kuralı), elektronik konfigürasyonun tam formülünde, terimler kuantum sayısının artan sırasına göre yazılmıştır. n (\görüntüleme stili n), ve sonra kuantum sayısı l (\görüntüleme stili l), örneğin 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3 (\displaystyle 1s^(2)2s^(2)2p^(6)3s^(2)3p^(3)). Böyle bir gösterim biraz gereksiz olduğundan, bazen formül şuna indirgenir: 1 s 2 2 s 2 p 6 3 s 2 p 3 (\displaystyle 1s^(2)2s^(2)p^(6)3s^(2)p^(3)), yani numarayı atla n (\görüntüleme stili n) burada terim sıralama kuralından tahmin edilebilir.
Periyodik yasa ve atomun yapısı
Atomun yapısında yer alan herkes, çalışmalarının herhangi birinde, kimyager D. I. Mendeleev tarafından keşfedilen periyodik yasa tarafından kendilerine sağlanan araçlardan ilerler; fizikçiler ve matematikçiler, yalnızca bu yasayı anladıklarında, onun gösterdiği bağımlılıkları yorumlamak için “dillerini” kullanırlar (her ne kadar J. W. Gibbs bu konuda oldukça ironik bir aforizma ile tanınırsa da), ancak aynı zamanda, kimyagerlerden izole edilmiştir. Madde, cihazlarının tüm mükemmelliği, avantajları ve evrenselliği ile elbette ne fizikçiler ne de matematikçiler kendi araştırmalarını inşa edemezler.
Bu disiplinlerin temsilcilerinin etkileşimi, konunun daha da geliştirilmesinde de gözlenmektedir. E. V. Biron (1915) tarafından ikincil periyodikliğin keşfi, elektron kabuklarının yapısının düzenlilikleri ile ilgili konuların anlaşılmasında başka bir yön verdi. S. A. Shukarev, E. V. Biron'un öğrencisi ve
Bir atomun elektronik konfigürasyonuē enerji dağılımını gösterir. seviyeler ve alt seviyeler.
1s 1 ←sayı ē verilen bulut şekliyle
↖ elektron bulutu şekli
enerji seviyesi
Grafik elektronik formüller (bir atomun elektronik yapısının görüntüleri) -
ē enerji dağılımını gösterir. seviyeler, alt seviyeler ve yörüngeler.
ben dönem:+1 N
Nerede - ē, ↓ - ē antiparalel dönüşlerle, yörünge.
Grafiksel bir elektronik formül yazarken, Pauli kuralını hatırlamalı ve Hundd kuralı "Bir alt düzeyde birkaç serbest yörünge varsa, o zaman ē her biri ayrı bir yörüngeye yerleştirilir ve yalnızca serbest yörüngelerin yokluğunda çiftler halinde birleştirilir."
(Elektronik ve grafik elektronik formüllerle çalışma).
Örneğin, H+1 1s 1 ; O +2 1s 2 ; Li +3 1s 2 2s 1 ; Na +11 1s 2 2s 2 2p 6 3s 1 ; Ar +18 1s 2 2s 2 2p 6 3s 2 3p 6 ;
ben dönem: hidrojen ve helyum – s-elemanları, s-orbitalleri elektronlarla doludur.
II dönemi: Li ve Be s-elemanlarıdır
B, C, N, O, F, Ne - p elemanları
Atomun hangi alt seviyesinin en son elektronlarla doldurulduğuna bağlı olarak, tüm elementler 4 elektronik aileye veya bloğa ayrılır:
1) s-elemanları – atomun dış tabakasının ē-mi s-alt düzeyine sahiptirler; bunlar hidrojen, helyum ve e-you gl.p/gr içerir. I ve II grupları.
2) p-elemanları - atomun dış seviyesinin elektron dünya-alt seviyesini doldururlar; bunlar gl.p / gr öğelerini içerir. III - VIII grupları.
3) d-elemanları - içlerinde, atomun dışsal öncesi seviyesinin d-alt seviyesi elektronlarla doldurulur; bunlar e-you poboch.p / gr içerir. . I-VIII grupları, yani. el-you eklentisi onlarca yıllık büyük periyotlar, s- ve p-elemanları arasında yer alır, bunlara geçiş elemanları da denir.
4) f-elemanları- dışarıdaki atomun üçüncü seviyesinin f-alt seviyesi elektronlarla doldurulur; bunlara lantanitler (4f elementleri) ve aktinitler (5f elementleri) dahildir.
Bakır ve krom atomları "başarısızlık" 4s-'den 3d-alt seviyeye, ortaya çıkan 3d 5 ve 3d 10 elektronik konfigürasyonlarının daha yüksek enerji kararlılığı ile açıklanmıştır:
29 Cu 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Atomların p-, d-, f-orbitallerinin yarı dolu (p 3 , d 5 , f 7 ), tamamen (p 6 , d 10 , f 14 ) veya serbest olduğu atomların durumlarının deneysel olarak kanıtlanmıştır. , artan stabiliteye sahip. Bu, yakın aralıklı orbitaller arasındaki elektronların geçişlerini - "dipleri" - açıklar. Aynı sapmalar, krom - molibden analogunda ve ayrıca bakır alt grubunun - gümüş ve altın elementlerinde de gözlenir. Bu bakımdan benzersiz olan, atomunda hiç 5s elektronu olmayan ve iz bırakan paladyumdur. Yapılandırma: 46 Pd 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10 .
Otokontrol için sorular
1. Elektron bulutu nedir?
2. 1s-orbital ve 2s-orbital arasındaki fark nedir?
3. Ana kuantum sayısı nedir? Periyot numarasıyla nasıl bir ilişkisi var?
4. Alt düzey nedir ve bu kavram dönem numarasıyla nasıl ilişkilidir?
5. PSCE döneminin 4-6 elementlerinin atomlarının elektronik konfigürasyonlarını oluşturun.
6. Magnezyum ve neon atomlarının elektronik konfigürasyonunu oluşturun.
7. Hangi atomun elektronik konfigürasyona ait olduğunu belirleyin 1S 2 2S 2 2p 6 3S 1, 1S 2 2S 2 2p 6 3S 2, 1S 2 2S 2 2p 4, 1S 2 2S 1
DERS PLANI #7
Disiplin: Kimya.
Başlık:
Dersin amacı:İyonik ve kovalent bağların oluşum mekanizmalarını incelemek, iyonik, atomik ve moleküler kristal kafesleri dikkate almak.
Planlanan sonuçlar
Ders: temel kimyasal kavramlara sahip olma: kimyasal bağ, iyonlar, kristal kafesler, kimyasal terminoloji ve sembollerin güvenli kullanımı; kimyasal formüllere ve denklemlere göre nicel tahminler verme ve hesaplamalar yapabilme yeteneğinin oluşturulması;
Metakonu:çeşitli bilişsel aktivite türlerinin ve temel entelektüel işlemlerin kullanımı: kimyasal elementlerin atomlarının elektronik konfigürasyonlarının derlenmesi.
Kişiye özel: seçilen mesleki faaliyette kişinin kendi entelektüel gelişimini artırmak için modern kimya biliminin ve kimya teknolojilerinin başarılarını kullanma yeteneği;
Zaman normu: 2 saat
Sınıf türü: Ders.
Ders planı:
1. Katyonlar, oksidasyon işleminin bir sonucu olarak atomlardan oluşumları. Anyonlar, indirgeme işleminin bir sonucu olarak atomlardan oluşumları. Elektrostatik çekim nedeniyle katyonlar ve anyonlar arasında bir bağ olarak iyonik bağ.
2. İyonların sınıflandırılması: bileşime, yük işaretine, hidrat kabuğunun varlığına göre.
3. İyonik kristal kafesler. İyonik bir kristal kafes tipine sahip maddelerin özellikleri.
4. Kovalent bir bağın oluşum mekanizması (değişim ve verici-alıcı).
5. Elektronegatiflik. Kovalent polar ve polar olmayan bağlar. Bir kovalent bağın çokluğu.
6. Moleküler ve atomik kristal kafesler. Moleküler ve atomik kristal örgülü maddelerin özellikleri.
Teçhizat: DIMendeleev'in kristal kafes modelleri, ders kitabı, kimyasal elementlerin periyodik sistemi.
Edebiyat:
1. Kimya 11. sınıf: ders kitabı. genel eğitim için kuruluşlar G.E. Rudzitis, F.G. Feldman. - M.: Aydınlanma, 2014. -208 s.: Hasta..
2. Teknik profilin meslekleri ve uzmanlıkları için kimya: öğrenciler için bir ders kitabı. orta kurumlar. Prof. eğitim / O.S.Gabrielyan, I.G. Ostroumov. - 5. baskı, silindi. - M.: Yayın Merkezi "Akademi", 2017. - 272 s., renkli. hasta.
Öğretim Görevlisi: Tubaltseva Yu.N.
Konu 7.İyonik ve kovalent kimyasal bağ.
1) Katyonlar, oksidasyon işlemi sonucunda atomlardan oluşumları. Anyonlar, indirgeme işleminin bir sonucu olarak atomlardan oluşumları. Elektrostatik çekim nedeniyle katyonlar ve anyonlar arasında bir bağ olarak iyonik bağ.
2) İyonların sınıflandırılması: bileşime, yük işaretine, hidratlı bir kabuğun varlığına göre.
3) İyonik kristal kafesler. İyonik bir kristal kafes tipine sahip maddelerin özellikleri.
4) Kovalent bağ oluşum mekanizması (değişim ve verici-alıcı).
5) Elektronegatiflik. Kovalent polar ve polar olmayan bağlar. Bir kovalent bağın çokluğu.
6) Moleküler ve atomik kristal kafesler. Moleküler ve atomik kristal örgülü maddelerin özellikleri.
Katyonlar, oksidasyon işleminin bir sonucu olarak atomlardan oluşumları. Anyonlar, indirgeme işleminin bir sonucu olarak atomlardan oluşumları. Elektrostatik çekim nedeniyle katyonlar ve anyonlar arasında bir bağ olarak iyonik bağ.
Bir kimyasal bağ, bir kimyasal parçacığın veya bir bütün olarak kristalin kararlılığını belirleyen atomların etkileşimidir. Yüklü parçacıklar arasındaki elektrostatik etkileşim nedeniyle kimyasal bir bağ oluşur: katyonlar ve anyonlar, çekirdekler ve elektronlar. Atomlar birbirine yaklaştığında, bir atomun çekirdeği ile diğerinin elektronları arasında çekici kuvvetler ve ayrıca çekirdekler arasında ve elektronlar arasında itici kuvvetler hareket etmeye başlar. Belli bir mesafede bu kuvvetler birbirini dengeler ve kararlı bir kimyasal parçacık oluşur.
Bir kimyasal bağ oluştuğunda, serbest atomlara kıyasla bileşikteki atomların elektron yoğunluğunun önemli bir yeniden dağılımı meydana gelebilir. Sınırlayıcı durumda, bu, yüklü parçacıkların oluşumuna yol açar - iyonlar (Yunanca "iyondan" - gidiyor).
İyonların Etkileşimi:
Bir atom bir veya daha fazla elektron kaybederse, pozitif bir iyona dönüşür - bir katyon (Yunancadan çevrilmiştir - "aşağı iniyor). Hidrojen katyonları H +, lityum Li +, baryum Ba 2+ bu şekilde oluşur. Elektronların alınması , atomlar negatif iyonlara dönüşür - anyonlar (Yunanca "anyon"dan - yukarı çıkıyor) Anyon örnekleri florür iyonu F - , sülfür iyonu S 2 - .
Katyonlar ve anyonlar birbirini çekebilir. Bu durumda kimyasal bir bağ oluşur ve kimyasal bileşikler oluşur. Bu tür kimyasal bağa iyonik bağ denir:
Kural olarak, tipik metallerin atomları ile tipik metal olmayan atomlar arasında bir iyonik bağ oluşur. Metal atomlarının karakteristik bir özelliği, değerlik elektronlarını kolayca vermeleri ve metal olmayan atomların bunları kolayca bağlayabilmeleridir.
Örneğin, sodyum klorür NaCl'de sodyum atomları ve klor atomları arasında bir iyonik bağın meydana geldiğini düşünün.
Bir elektronun bir sodyum atomundan ayrılması, pozitif yüklü bir iyonun oluşumuna yol açar - sodyum katyonu Na +.
Bir klor atomuna bir elektron eklenmesi, negatif yüklü bir iyonun - klor anyonu Cl - oluşumuna yol açar.
Zıt yüke sahip oluşan Na + ve Cl - iyonları arasında, bir bileşiğin oluştuğu elektrostatik bir çekim ortaya çıkar - iyonik tipte bir kimyasal bağa sahip sodyum klorür.
İyonik bağ - Bu, zıt yüklü iyonların elektrostatik etkileşimi nedeniyle gerçekleştirilen kimyasal bir bağdır.
Böylece, bir iyonik bağın oluşum süreci, dış katmanların tam elektronik konfigürasyonları ile zıt yüklü iyonların oluşumu ile elektronların sodyum atomlarından klor atomlarına geçişine indirgenir.
1. Dış elektronlardan vazgeçen metal atomları pozitif iyonlara dönüşür:
burada n, kimyasal elementin grup numarasına karşılık gelen atomun dış katmanındaki elektron sayısıdır.
2. Dış elektron tabakasının tamamlanmasından önce eksik elektronları kabul eden metal olmayan atomlar, negatif iyonlara dönüştürülür:

3. Zıt yüklü iyonlar arasında bir bağ oluşur. iyonik.

2. İyonların sınıflandırılması: bileşime, yük işaretine, hidrat kabuğunun varlığına göre.
İyon sınıflandırması:
1. Yük işaretine göre: katyonlar (pozitif, K+, Ca2+, H+) ve anyonlar (negatif, S2-, Cl-, I-).
2. Kompozisyona göre: karmaşık ( , ) ve basit (Na +, F-)©2015-2019 sitesi
Tüm hakları yazarlarına aittir. Bu site yazarlık iddiasında bulunmaz, ancak ücretsiz kullanım sağlar.
Sayfa oluşturma tarihi: 2017-12-12