Aksiyon potansiyeli, akımın uzunlamasına yayılmasından dolayı akson boyunca hareket eder. “Ya hep ya hiç” ilkesine göre bir dürtü üreten zarın her bölümü, depolarizasyonu ile komşu bölümü heyecanlandırır. Dürtü yayılımının mekanizmasını ve ayrıca sinaptik iletim ve entegrasyonu anlamak için, sinir boyunca dürtülerin pasif yayılımı ilkesini anlamak gerekir.
Akson veya dendrit boyunca hareket ettikçe akım gücünü kaybeder. Akım değerindeki azalma, başta sinir lifi zarının çapı ve özellikleri olmak üzere birçok nedene bağlıdır. Boyuna akım yayılımı ne kadar büyükse, fiber çapı o kadar büyük ve membran direnci o kadar yüksek olur. Membranın kapasitif özellikleri, elektrik sinyallerinin zaman sürecini ve akımın yayılmasını etkiler. Eşik altı potansiyelin yayılabileceği mesafeyi tahmin etmek için nöron zarının geometrisini ve özelliklerini ve ayrıca potansiyel değişimin zaman sürecini bilmek gerekir.
Omurgalılarda birçok sinir hücresi türünün aksonları, yüksek dirençli ve düşük kapasitansa sahip bir miyelin kılıfı ile kaplıdır. Miyelin kılıfı, telin yalıtkan bir sargısı rolünü oynar ve akımı zar boyunca hareket etmeye zorlar. Bu durumda akım, Ranvier'in bir düğümünden (miyelin içermeyen zarın kısa bir bölümü) diğerine hızla atlar ve iletim hızı artar. Miyelinli lifler, sinir ağının iletim hızının önemli bir rol oynadığı alanlarda bulunur.
Elektrik sinyalleri, aralarında boşluk kavşakları adı verilen yakın temas yerlerinde bir nörondan diğerine iletilebilir. Bu tür bağlantılardaki akım, özel kanallardan, bağlantılardan akar.
Sinir ve kas zarlarının pasif elektriksel özellikleriNöronal zarların geçirgenliğinin özellikleri ve aksiyon potansiyellerinin oluşumuna nasıl katkıda bulundukları önceki bölümlerde tartışılmıştır. Bu bölümde esas olarak akımların sinir lifi boyunca nasıl yayıldığına ve yerel potansiyel farkları oluşturduğuna odaklanacağız.
Nöronların pasif elektriksel özellikleri, yani zarın direnci ve kapasitansı ile sitoplazmanın direnci, nöronal sinyalleşmede çok önemli bir rol oynar. Duyu organlarında bu özellikler, duyusal uyaran ile dürtü üretimi arasındaki bağlantıdır; akson seviyesinde, dürtünün yayılmasına izin verirler; sinaptik düzeyde, bunlar, postsinaptik nöronun, hücre gövdesinin yakınında veya en uzak dendritlerde olsun, çoklu sinaptik girdilerde meydana gelen sinaptik potansiyelleri ekleme ve çıkarma yeteneğini belirler. Bu süreçleri anlamak için, elektrik sinyallerinin sinirsel süreçler boyunca yayılmasının ilkelerini bilmeniz gerekir. Bu bölümde, esas olarak, tüm uzunlukları boyunca sabit bir çapa sahip sinir liflerine, yani silindirik iletkenlere odaklanacağız. Ek olarak, bu açıklama için, rejenerasyonun yokluğunda zarın gerçekten pasif olduğunu, yani eşik seviyesine ulaşmayan potansiyel değişikliklerin voltaja bağlı iletkenlikleri etkinleştirmediğini ve dolayısıyla zar direncini değiştirmediğini varsayacağız. . Bu ilkeler aynı zamanda tek tip olmayan elektriksel özelliklere sahip akson milleri veya dendritik miller gibi daha karmaşık yapılar için de geçerlidir. Bu tür yapıların sinir sisteminin işleyişindeki rolü çok önemlidir, ancak elektriksel özelliklerinin nicel bir tanımı daha karmaşık bir analiz gerektirecektir.
Sinir ve kas liflerinin kablo özellikleri
Silindirik bir sinir lifi, bir su altı elektrik kablosuyla aynı bileşenlerden oluşur: bir çekirdek iletken ve iletken bir ortamla çevrili bir yalıtkan kılıf. Ancak, bu iki sistem arasındaki niceliksel fark çok büyüktür. Kablonun çekirdeği genellikle çok yüksek iletkenliğe sahip bakır veya metalden yapılırken, kılıf plastik veya çok yüksek dirençli diğer malzemelerden yapılır. Ek olarak, kabuk genellikle oldukça kalındır ve bu nedenle düşük bir kapasiteye sahiptir. Böyle bir tele uygulanan voltaj, bakırın direnci ve kılıftaki kayıplar küçük olduğu için önemli bir mesafe boyunca iletilebilir. Sinir lifinin içeriği, hücre dışı ortama konsantrasyonda benzer bir tuz çözeltisidir ve bakırdan farklı olarak iletkenliği zayıftır. Hücre zarı da iyi bir yalıtkan değildir ve küçük kalınlığı nedeniyle yüksek kapasitansa sahiptir. Sinir lifine uygulanan voltaj iki nedenden dolayı önemli bir mesafeyi aşmaz:
1) lif içeriğinin iletkenliği küçüktür, bu nedenle akım direnci büyüktür;
2) sitoplazma boyunca akan akım, yeterli izolasyon sağlamayan zardan sızıntı nedeniyle dağılır.
Kablo akımı analizi, transatlantik telefon iletişimi ile ilgili olarak Lord Kelvin tarafından başlatıldı ve Oliver Heaviside tarafından geliştirildi. XX yüzyılın sonunda. Heaviside, hücre zarına eşdeğer bir yalıtım kılıfı yoluyla akım kaçağının önemini ilk dikkate alan ve empedans kavramı da dahil olmak üzere kablo teorisine birçok önemli eklemeler yapan ilk kişi oldu. Kablo teorisi ilk olarak hücre dışı elektrotlar kullanarak ıstakoz aksonunda aksiyon potansiyeli yayılımını deneysel olarak ölçen Hodgkin ve Rushton tarafından sinir lifleri için kullanıldı. Daha sonra, bir dizi sinir ve kas lifinde benzer ölçümler için hücre içi elektrotlar kullanıldı.
Buradaki temel kural Ohm yasasıdır: r direncinden geçen i akımı, bir ν = ir gerilimi yaratır. Aşağıda, membran kapasitansının boyuna akım yayılımının büyüklüğü ve zaman süreci üzerindeki etkisini de ele alacağız.
Kablo akımı
Bir kablodan geçen akımın ilkelerini daha iyi anlamak için, iletken bir ortama (örneğin su) yerleştirilmiş bir ısı yalıtım kılıfındaki metal bir çubuk boyunca ısının nasıl yayıldığını hayal edin. Çubuk bir uçtan ısıtılırsa, ısı çubuk boyunca yayılır ve yayıldıkça kısmen çevreye dağılır ve kabuğun içine nüfuz eder. Isıtılmış uçtan ne kadar uzak olursa, sıcaklık o kadar düşük olur; Sıcaklık azaldıkça, ısı yayılım hızı da azalır. Ortamın ısıl iletkenliğinin yüksek olması koşuluyla, ısının yayılacağı mesafe esas olarak iki parametreye bağlı olacaktır:
1) çubuğun termal iletkenliğinden
2) kabuğun yalıtım özellikleri hakkında.
Kablodaki akım akışı da benzer şekilde çalışır. Kablonun bir ucuna uygulanan voltaj, kılıftan çevreye kısmen kaybolan bir akımın çubuk boyunca uzunlamasına yönde akmasına neden olur. Gerilimin uygulandığı uçtan ne kadar uzak olursa, akım o kadar az olur. Akımın yayılacağı mesafe, çubuğun iletkenliğine ve kılıfın akım kaybını ne kadar etkili bir şekilde önlediğine bağlı olacaktır. Düşük dirençli kılıf, tüm akımın ortama akmasına izin verecektir. Daha yüksek dirençli bir kılıf, akımın daha fazla mesafe kat etmesine izin verecektir.
Aksondaki akım iyonlar tarafından taşınır: bir mikroelektrot aracılığıyla bir sinir lifine (örneğin bir ıstakoz aksonu gibi) akım enjekte edildiğinde, enjekte edilen pozitif yükler diğer katyonları itecek ve anyonları çekecektir. Hücre içindeki küçük iyonların en bol olanı potasyumdur, bu nedenle zardan en fazla akımı taşır. Akson boyunca akım akson boyunca uzunlamasına akar ve hareket ettikçe iyonların zar boyunca hareketi nedeniyle bir kısmı kaybolur. Düşük dirençli ve yüksek iyonik iletkenliğe sahip bir zarda, akımın çoğu, önemli bir mesafe kat etmek için zaman bulamadan kaybolacaktır. Daha yüksek bir membran direnci ile akım, çevreye dağılmadan önce akson boyunca daha uzun bir mesafe boyunca yayılır.
Uyarılabilirlik, bir dokunun tahrişe dokuya özgü bir reaksiyonla yanıt verme yeteneğidir. Uyarma, uyarılabilir dokunun fonksiyonel dinlenme durumundan spesifik aktiviteye geçişidir (sinir uyarılarının üretimi ve sinir uyarılarının iletimi için, kas dokusu için - kasılma, glandüler doku için - bezin salgılanması için). Bu bölümde sinir ve kas dokularının yapısı ve işlevine bakacağız.
Bir sinir hücresi, sinir zincirindeki bir bağlantıdır. Bireysel sinir hücreleri veya nöronlar, karaciğer veya böbreklerdeki hücreler gibi izole birimler olarak işlevlerini yerine getirmezler. İnsan beyninin 50 milyar nöronunun işi, diğer bazı sinir hücrelerinden sinyal alıp üçüncü hücrelere iletmeleridir. Verici ve alıcı hücreler, sinir devreleri veya ağları halinde birleştirilir. Çıkışta (farklı yapı) dallanma süreçlerine sahip tek bir nöron, girişte alınan sinyali bin veya daha fazla başka nörona gönderebilir. Aynı şekilde, diğer bazı nöronlar, eğer yakınsak yollar birleşirse, bir, birkaç veya çok fazla giriş bağlantısı kullanarak diğer nöronlardan girdi bilgisi alabilir.
Nöronların gerçek bağlantılarına - hücrelerin yüzeyinde temasın gerçekleştiği belirli noktalar - denir. sinapslar. Sinapslarda salınan kimyasallar nörotransmiterler- temas eden nöronlar arasındaki devreyi kapatır ve kimyasal sinapslarla sinir hücreleri arasındaki sinir uyarımının iletimi için kimyasal aracılardır. Daha sonra nöronlar arasında bilginin iletilme yollarının farklı olabileceğini öğreneceğiz.
1. Bir nöron bir hücredir.
Nöronlar, vücudun tüm hücrelerinde ortak olan bir takım özelliklere sahiptir (Şekil 1).
Pirinç. 1. Sıradan bir hücre (A) ve bir nöron (B).
Onlar gibi, nöron da tek tek hücrenin sınırlarını tanımlayan bir plazma zarına sahiptir. Nöron, zar ve içerdiği moleküler mekanizmalar yardımıyla diğer hücrelerle etkileşime girer ve yerel ortamındaki değişiklikleri algılar. Membran iyon kanallarının seçici özellikleri ve aktif ve pasif iyon taşıma sistemi sayesinde hücre, hücre içi ozmotik basıncı düzenler ve bu nedenle şeklini korur ve ayrıca mineral elementlerin, besinlerin ve gazların hücreye girmesini sağlar. hücre içi ihtiyaçlar için, nöronların ve diğer hücrelerin işlevinin altında yatan hücre zarında elektriksel potansiyeller üretilir. Her taraftan zar, sitoplazma adı verilen hücrenin iç içeriğini çevreler. Sitoplazma, hücrenin varlığı ve çalışmasının performansı için gerekli olan çekirdeği ve sitoplazmik organelleri içerir: mitokondri, mikrotübüller, nörofibriller, endoplazmik retikulum.
Mitokondri hücreye enerji sağlar. Şeker ve oksijen kullanarak, hücre tarafından ihtiyaç duyulduğunda tüketilen özel yüksek enerjili molekülleri (ATP) sentezlerler. Mikrotübüller, ince destek yapıları, nöronun şeklini korumasına yardımcı olur ve aksonal taşımada yer aldığı düşünülmektedir. Endoplazmik retikulum - bir iç zar tübül ağı - ve üzerinde bulunan yapılar - ribozomlar - hücre, hayati aktivitesi için gerekli maddeleri sentezler, hücre içinde dağıtır ve onun ötesine salgılar. Nörofibriller destek işlevlerini yerine getirir, aksonların terminallerinin (terminal dalları) yönlü hareketini sağlar ve akson taşıma mekanizmasındaki bağlantılardan biridir (aşağıya bakınız).
Bir nöronun çekirdeği, genlerin kimyasal yapısında kodlanmış genetik bilgiyi içerir. Bu bilgiler doğrultusunda, tam olarak oluşmuş bir hücre, sinir hücresi bölünemediğinden, yaşamı boyunca bu hücrenin şeklini, kimyasını ve işlevini belirleyen belirli maddeleri sentezler.
Diğer hücrelerden farklı olarak, nöronların ana hatları düzensizdir: farklı uzunluklarda, genellikle çok sayıda ve dallanmış süreçlere sahiptirler. Bu süreçler, sinir ağlarının oluşturulduğu canlı "tellerdir". Bu tür tellerin işlevleri, sinir hücrelerinin gövdelerinin zarları tarafından da gerçekleştirilir.
Hayvan ve insan organizmasının sinir ağları, teknik elektrik ağlarından (telefon, telgraf ve İnternet dahil) temel bir farklılığa sahiptir: onları besleyen merkezi elektrik akımı jeneratörleri yoktur. Elektrik akımları, hücrelerin moleküler zarları (zarları) üzerinde, bu zarların belirli özelliklerinden dolayı, sürekli olarak elektrik potansiyelleri oluşturmak için ortaya çıkar ve uyarılabilir dokuların (sinir ve kas) hücrelerinde de bunları uzunlukları boyunca iletir.
Bir sinir hücresinin bir ana süreci vardır - bilgiyi başka bir hücreye ilettiği bir akson ve hücrenin gelen bilgileri aldığı çok sayıda dendrit. Hem akson hem de dendritler dallanabilir; özellikle dendritlerde geniş dallanma gözlenir. Dendritlerde ve hücrenin çekirdeği çevreleyen orta kısmının yüzeyinde, nöron gövdesi olarak adlandırılan, diğer nöronların aksonları tarafından oluşturulan giriş sinapsları vardır. Aksonun veya dallarının (terminallerinin) uçları, diğer hücrelerin zarlarının yüzeyinde bu tür sinapsları oluşturur. Bu uçlar, nöron tarafından alıcı hücrenin sinapsına salınan aracı moleküllerinin biriktiği sinaptik veziküller adı verilen organelleri içerir. Aksonlarda protein sentezleyen hücre organelleri bulunmadığından hücre gövdesi ile bağlantısı olmayan bu süreç ölür.
Nöronların uzun süreçlerine sinir lifleri denir.
2. Elektrik akımının iletkeni mi yoksa üreteci mi? Hücre zarının elektrojenik fonksiyonları.
Dinlenme halindeki bir sinir lifine bir mikroelektrot sokulur ve zarın dış tarafına yerleştirilen ikinci bir elektrotla kapatılırsa, kayıt cihazı 60-90 mV'luk bir potansiyel farkı gösterecektir ve zarın iç tarafı negatif olacaktır. yük ve dış taraf pozitif bir yüke sahiptir. Elektrofizyolojideki bu potansiyel farka dinlenme potansiyeli (RP) denir. Membranın her iki tarafındaki yükleri ayıran hangi kuvvetler, zarın elektriksel polaritesini yaratır? Bu soruya ikna edici bir cevap, çalışmaları için Nobel Ödülü alan İngiliz bilim adamları A. Hodgkin, A. Huxley ve B. Katz (1956-1963) tarafından verildi.
Sorunun özünü daha iyi anlamak için, hayvanların ve insanların vücudunda, her hücrenin, esas olarak sodyum, potasyum, magnezyum klorürler ve fosfatlar olmak üzere farklı tuzların bir karışımının bir çözeltisi ile çevrili olduğu gerçeğinden hareket edilmelidir. , vb. ve bunların organik bileşikleri. Aynı bileşikler hücrenin içinde, sitoplazmasında bulunur. Ve eğer hücre bu gerçeğe karşı pasif olsaydı, hayatı ve aktivitesi için hiçbir sonucu olmazdı ve tuzların konsantrasyonu ve dolayısıyla zarının her iki tarafındaki iyonlarının konsantrasyonu olacağı için zarın etrafında hiçbir yük olmazdı. aynısı. Bununla birlikte, böyle bir durumda yaşamın kendisinin imkansız olacağına dikkat edilmelidir.
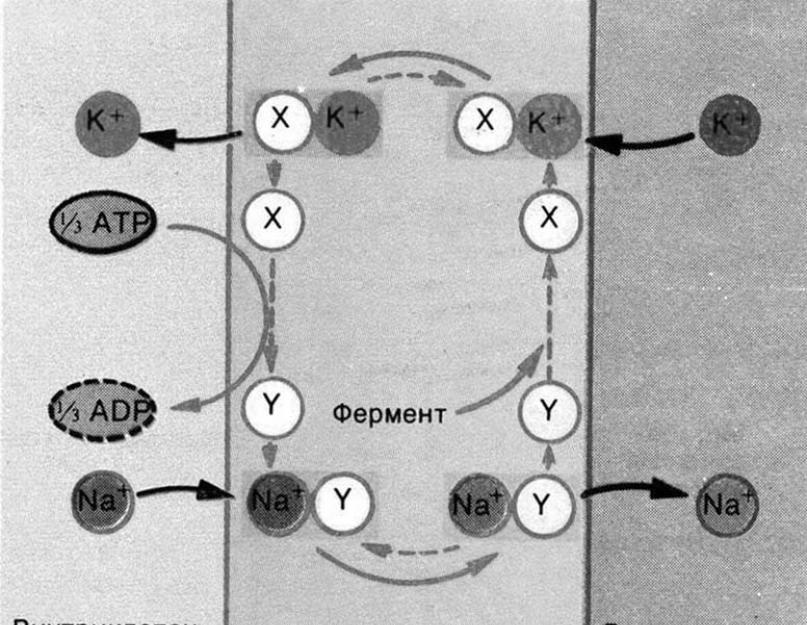
Ancak hücre zarının potasyum iyonlarını hücreye ve sodyum iyonlarını aktif taşıma sistemini kullanarak konsantrasyon gradyanına karşı dışa aktarma yeteneğine sahip olduğu bulundu. Bu yetenek, çalışmaları için ATP enerjisini kullanan zara yerleştirilmiş potasyum-sodyum pompalarının hareketi ile sağlanır (Şekil 2).

Pirinç. 2. İyonik pompanın çalışma şeması.
Bir döngüde pompa hücreden 3 Na+ iyonunu alıp içine 2 K+ iyonunu geri vererek bir ATP molekülünün enerjisini bu iş için harcar. Tabii ki, ATP molekülü bu durumda bir ADP molekülü ve bir fosfat kalıntısı oluşumu ile bölünür. Böylece hücre, zarının etrafında dengede olmayan miktarlarda sodyum ve potasyum oluşturur: zarın iç kısmında, dıştakinden 30-50 kat daha fazla bir potasyum iyonu konsantrasyonu ve hücre dışı sıvıda sodyum iyonları oluşur. hücre sitoplazmasından 10 kat daha fazladır. Ancak bu, kendi başına katyon konsantrasyonlarında bir fark yaratır, ancak yükler oluşturmaz.
Polarizasyon işleminin ikinci kısmı (zamanla birincisiyle aynı anda gerçekleştirilir), zarın çeşitli iyonlar için yarı geçirgenliği veya başka bir deyişle seçici geçirgenliği (seçiciliği) ile sağlanır. Dinlenme halinde, zar K + iyonlarını serbestçe geçer, çok zayıf - Na + iyonları ve büyük organik asit ve protein anyonlarına karşı tamamen geçirimsizdir. İyon pompaları tarafından yaratılan membran etrafındaki potasyum ve sodyum iyonlarının denge dışı düzenlemesi, pasif bir sürece neden olur - bu katyonların konsantrasyon gradyanı boyunca difüzyonu. Hücre içinde potasyum iyonları zara doğru hareket eder ve daha az hareketli olan negatif iyonları geçerek hücrenin dış tarafına ulaşır. Sonuç olarak, zarın iç tarafında negatif bir elektrik yükü, dış tarafında ise sodyum iyonlarının oluşturduğu pozitif yük ve aralarındaki tahmini potansiyel farkı 80-100 mV'dir. Sodyum iyonlarının hücre içine difüzyonu potasyumunkinden çok daha zayıftır (25 kat), ancak yine de vardır ve aynı etkiye neden olur, ancak hücrenin içine yönlendirilir ve sonuç olarak zarın hesaplanan potasyum potansiyelini bir miktar azaltır. Bu nedenle, ortaya çıkan istirahat membran potansiyeli (RP) 50-90 mV'dir. (Şek. 3)

Pirinç. 3. Membranın elektrik yükü.
Sodyum ve potasyum iyonlarının benzer difüzyon akışları, kaçınılmaz olarak zarın her iki tarafındaki iyon konsantrasyonlarının eşitlenmesine yol açacaktır. Ancak bu, canlı bir hücrede meydana gelmez, çünkü iyon pompaları iyonları sürekli olarak mevcut gradyanlara karşı taşır, konsantrasyonlarını ve elektrokimyasal gradyanlarını ve dolayısıyla dinlenme potansiyelini korur. Bu belki de yaşamın ana ve en önemli işlevsel belirtilerinden biridir. Hücre zarındaki iyon pompalarının çalışmasını durdurmak, tüm yaşamsal süreçleri, yani. hücre ölümü.
3. Hücrelerin ömrü elektriklenir. Dinlenme potansiyelinin hücrenin yaşamındaki rolü.
Sıradan bir hücre neden elektriğe ihtiyaç duyar? Hayvanların ve insanların vücudunda sinir ve kasların yanı sıra deri, iç organlar ve çevre dokulara ait hücrelerin de bulunduğu bilinmektedir. Hepsinin sırasıyla 15 ila 50 mV arasında membran potansiyeline sahip olduğu tespit edilmiştir. Bu nedenle, sinir hücreleri, içlerindeki elektrik potansiyellerinin varlığı ve dolayısıyla yaşam aktivitelerinde elektriğin kullanımı ile ilgili olarak tekelci değildir. Hücreler neden elektriğe ihtiyaç duyar? Diyelim ki bir ev hanımına neden elektriğe ihtiyacı var diye sorsak nasıl görüneceğini hayal etmeye çalışalım. Veya bir binanın ikinci katındaki modern bir endüstriyel üretim tesisi neden elektriğe ihtiyaç duysun?
Hücre zarından serbestçe geçen su ve bazı elektrolitlere ek olarak, hücrenin difüzyon yasalarına göre şekerler, amino asitler ve hücreye giremeyen bazı mineral elementler gibi besinlere ihtiyacı vardır. Aslında evrim sürecinde bir hücre, organik maddelerin tüm iyon ve moleküllerinin serbestçe geçişine izin verecek bir zara sahip olabilecek ve hücreye besin sağlama konusundaki tüm sorunlar difüzyon yasalarına göre çözülecektir. Bu gerçekte neden olmadı? Birincisi, difüzyon yasalarına göre, maddelerin iyonları ve molekülleri, ancak hücre dışında daha yoğun olsaydı hücre içinde hareket ederdi ve ikincisi, hücrenin yaşamsal faaliyeti, gerekli maddeyi sağlamada zaman zaman meydana gelebilecek kesintilere tolerans göstermez. Üçüncüsü, hücreye zararlı metabolizma ürünlerinin hücre zarının her iki tarafında hizalanması, hücre üzerinde zararlı bir etkiye sahip olmakla kalmaz, aynı zamanda gerekli maddelerin konsantrasyonunu da azaltır. hücre için dış ortamda, böylece hücreden ters çıkışlarına neden olur. Hücrenin hayati çıkarlarının böyle bir “piyasa” unsuruyla bağdaşmadığı ortaya çıktı ve hücrenin evrimi, zarını bazı iyonlara seçici olarak geçirgen hale getirdi ve hücreye diğer maddeleri “ithal etmek” için aktif araçlarla donattı. hem de hücreden ihtiyacı olmayan metabolik ürünleri “ihraç etmek” için. Hücre, ulaşım araçlarının çalışmasını sağlamak için enerji türünü seçmek zorunda değildi: elektrik, ipekle ovuşturulan kehribarın hafif nesneleri çekme yeteneğine dikkat çeken antik Yunan bilim adamı Thales'ten milyonlarca yıl önce biliniyordu. ,
Taşıyıcı protein molekülleri taşıyıcı olarak hücre zarına yerleştirilmiştir ve besinleri hücreye şu şekilde taşırlar (Şekil 4).

Pirinç. 4. Membran taşıma şeması.
Membranın dışında, taşıyıcı bir protein molekülü kendisine bir besin molekülü ve bir sodyum iyonu bağlayarak pozitif bir yük kazanır. Membranın elektrik alanı, taşıyıcı molekülü varsayımsal ekseni etrafında döndürerek, pozitif yüklü kutbunu zarın içine çeker. Burada, sodyum iyonu yükünü kaybeder ve taşıyıcı hücreyi terk eder, bu da taşınan besinin nötr bir molekülünün ondan elimine edilmesine yol açar. Sodyum dışarı pompalanırken besin hücrenin içinde kalır, bu da zarın dışında pozitif bir yük oluşmasına neden olur.
Çeşitli şekerleri ve amino asitleri hücreye taşımak için farklı taşıyıcı proteinler vardır, ancak hepsi hayvan hücrelerinde sodyum iyonlarını ve dinlenme zar potansiyelini kullanır. Bakteriler sodyum yerine hidrojen iyonları kullanır
Bazı maddelerin hücreden uzaklaştırılması için elektrik taşıma kullanılır.Hücredeki fazla kalsiyum, kalsiyum pompasının çıkarılmasıyla baş edemezse tehlikelidir. Hücrenin acil durum sistemi devreye girdi. Bu durumda özel bir taşıyıcı protein, hücre içi kısmına bir kalsiyum iyonu ve dışarıya üç sodyum iyonu bağlar. Membranın elektrik alanı, taşıyıcı molekülü 180° döndürür ve kalsiyum dışarı atılır. Çalışmaları için ATP'nin enerjisini kullanan ve aynı zamanda zar üzerinde bir elektrik alanı (elektrik potansiyelleri) oluşturan potasyum-sodyum pompalarının aksine, yukarıda bahsedilen taşıyıcı proteinler zarın elektrik enerjisini kullanan elektrik motorları gibi çalışırlar. çalışmaları için potansiyel.
Besinlerin hücreye aktif transfer mekanizmaları, zorunlu olarak yaşamı ile ilgilidir ve şüphesiz hücrenin görünümü ile birlikte ortaya çıkmış olmalıdır. Sinyallerin hücreden hücreye iletilmesi daha sonraki bir evrim ihtiyacıdır, bu nedenle böyle bir ihtiyaç ortaya çıktığında, zarlarını bir şekilde değiştiren sinir hücrelerinin zar potansiyelini yeni bir işlev - sinyal iletimi için kullandığını varsaymak mantıklıdır. Bu modifikasyon neydi?
4. Membran potansiyelindeki değişiklikler. Aksiyon potansiyeli.
1939'da, Plymouth (İngiltere) A. Hodgkin ve H. Huxley'deki deniz istasyonu çalışanları, dev bir (1 mm çapında) kalamar aksonunu ve en gelişmiş deneysel cihazı kullanarak ilk kez bir sinir lifinin PP ve PD'sini ölçtüler. o zaman ekipman. Dinlenme durumunda, zardaki potansiyel farkın yaklaşık 80 mV olduğu ve uyarıldığında, Bernstein'ın varsaydığı gibi zarın boşalmadığı, ancak yeniden şarj olduğu ortaya çıktı: negatif yükleri dışarıda ve pozitif olanlar içeride. Bu durumda zar üzerinde yaklaşık 40 mV'luk bir potansiyel farkı ortaya çıkar. Bu, uyarma üzerine potansiyelin RI değeriyle değişmediği anlamına gelir, yani. sıfıra düşmez, ancak PP ve zıt işaretli yeni ortaya çıkan potansiyelin toplamı ile (Şekil 8). PP üzerindeki bu PD fazlalığı, bir aşma (İngiliz fazla kurum - fazlalığı) olarak adlandırıldı.
Bu "ilave" potansiyeli açıklamak için, Hodgkin ve Huxley, özü, uyarılma üzerine zarın seçici geçirgenliğini tamamen kaybetmekle kalmayıp, aynı zamanda onu değiştirmesi olan bir hipotez öne sürdüler: esas olarak K + iyonları için geçirgen olmaktan. , zar esas olarak Na iyonları için geçirgen hale gelir. Ve zarın dışında bunlardan daha fazlası olduğu için içeriye doğru hücum ederler ve zarı yeniden doldururlar.
Hipotezin ilk testi, 1949 yılında savaş nedeniyle uzun bir aradan sonra A. Hodgkin ve B. Katz tarafından yapılmıştır. Çalışmalar, AP'nin genliğinin, PP'nin değerinin K + iyonlarının konsantrasyonuna bağlı olduğu gibi, Na + iyonlarının konsantrasyonundaki değişikliğe bağlı olduğunu göstermiştir, yani. Nernst formülüne uyar.
Daha sonra, uyarım sırasında zarın potasyum ve sodyum geçirgenliğinin gerçekte nasıl değiştiğini ve bu değişikliklerin hangi koşullara bağlı olduğunu bulmak gerekiyordu. Hodgkin ve Huxley, bir zarın geçirgenliğinin iki koşul tarafından belirlendiğini öne sürdüler: zar potansiyeli ve potansiyel değişikliğinden bu yana geçen süre. Bu varsayımın uzun ve zahmetli bir şekilde doğrulanmasının sonucu, uyarımla ilişkili tüm fenomenlerin mekanizmasının gerçekten de zarın bir özelliğine, yani potasyum ve sodyum iyonları için değişken seçici geçirgenliğine dayandığının deneysel olarak doğrulanmasıydı. AP'nin farklı koşullar ve zarın başlangıç durumları, yani. X-X modeli olarak da adlandırılan "modern membran teorisi". Model, refrakterlik, uyarma eşiği, bir darbeden sonra fiber hiperpolarizasyonu vb. gibi fenomenleri doğru bir şekilde yeniden üretti.
Ancak, sorular hala cevapsız kaldı: Membranın geçirgenliğini değiştirme mekanizması nedir, bu en ince bölme nasıl düzenlenir? Membran yapısının ve işlevsel mekanizmalarının sırlarına nüfuz, daha sonra yeni bir bilim ortaya çıktığında başladı - moleküler biyoloji.
Membranın yapısı. Sitoplazmik zar, iki tabaka lipid molekülünden oluşan pasif bir moleküler filmdir; Zardaki iyon kanalları ve pompaları, taşıyıcı moleküller, reseptörler vb. aktif fonksiyonlarını yerine getiren protein moleküllerini içerir.Bimoleküler lipid tabakası hücreyi ortamdan izole eder ve aynı zamanda bir elektrik yalıtkanıdır. Hücrenin çevre ile iletişimi ve zarının tüm aktif işlevleri, zarın içine gömülü protein molekülleri yardımıyla gerçekleştirilir (Şekil 5).

Pirinç. 5. Hücrenin plazma zarı
Bazı protein molekülleri, zarın uyaranların etkilerine yerel duyarlılığını ve bu etkilere uygun tepkiyi sağlar. Bir sinir hücresi zarının evrimsel modifikasyonu, zar üzerindeki zar potansiyellerinde yerel bir değişiklik için mekanizmaların yaratılmasından ve ardından bu değişikliğin zar boyunca dalga benzeri bir yayılımından oluşuyordu. İkinci yeteneğe diğer dokuların hücre zarları da sahiptir.
iyon kanalları. Hücre zarının aktif elektriksel özellikleri, lipid zarında homojen ve bu parçacıkların belirli koşullar altında içinden geçebileceği moleküller ve iyonlar için geçirimsiz "gözenekler" oluşturan, içine yerleştirilmiş protein molekülleri tarafından belirlenir. Potasyum ve sodyum iyonlarının geçebildiği gözeneklere sırasıyla potasyum ve sodyum iyonu kanalları denir.
İyon kanalları, "kendi" iyonlarını ayırt edebilen ve uygun zar potansiyelinin etkisi altında zar boyunca yollarını açıp kapatabilen özel bir protein molekülü sınıfı tarafından oluşturulur. İngiliz biyofizikçi B. Hill, potasyum kanalının çapının yaklaşık 0,3 nm olduğunu, iyonların geçişi için aralığın ise sodyum kanalı için biraz daha büyük olduğunu keşfetti. Sodyum K+ kanalından farklı olarak, bir inaktivasyon mekanizmasından yoksundur. Birinin veya diğerinin kanala geçişinin, ikincisinin çapı ile değil, fonksiyonel özellikleri ve membran elektrik potansiyelleri ile belirlendiğine dikkat edilmelidir.
İyon kanalı, zarın içine yerleştirilmiş bir açık tüp olarak hayal edilebilir (Şekil 6)

Pirinç. 6. İyon kanalının şeması.
Dış ucun yakınında, tüpün konumu membran potansiyeli tarafından kontrol edilen bir "panjur" veya "kapı" vardır, "panjur" yüklenir ve bu nedenle potansiyel değiştiğinde (depolarizasyon sırasında) açabilir. karşılık gelen iyon için kanala giriş. Kanal kapılarının, bir elektrik alanında hareket edebilen ve böylece potasyum veya sodyum iyonlarının yolunu açan bir protein molekülünün yüklü atom grubu olduğuna inanılmaktadır. Böyle yüklü bir grubun yer değiştirmesine anlık küçük bir elektrik akımı eşlik etmelidir; sodyum kanallarındaki bu akım deneyde kaydedildi ve buna "geçit akımı" adı verildi. Sodyum kanalları incelenirken, kapı mekanizmalarının ve inaktivasyonlarının kanalın farklı uçlarında yer aldığı gösterilmiştir. Kanalın iç ucunun pronaz enzimi ile çıkarılmasından sonra, kanal depolarizasyon etkisi altında sodyum kapısını açmaya devam etti, ancak inaktive olmadı.
Membran içindeki sodyum kanallarının yoğunluğu belirlendi. Membranın mikrometre karesi başına yaklaşık 50 tanesi vardı (zarın böyle bir alanı birkaç milyon lipit molekülünü barındırabilir).
Potasyum ve sodyum kanallarına ek olarak hücre zarlarında kalsiyum, klorür ve diğer iyonlar için kanallar bulunur. Örneğin potasyum iyonları için membran geçirgenliğindeki kademeli değişiklik, karşılık gelen kanalların "açık" ve "kapalı" durumlara ek olarak başka durumlara, yani. kanalların, deneysel olarak doğrulanan işin olasılıksal doğası ile karakterize edildiğini. İlk başta iyon kanalının zara yerleştirilmiş ve uzun süre çalışan kararlı bir biyolojik mekanizma olduğu varsayılırken, daha sonra protein kanallarının sadece yaklaşık bir gün çalıştığı ortaya çıktı ve daha sonra sökülüp parçalandılar. haberci RNA'nın komutlarına göre hücrenin diğer sentezlenmiş ribozomları ile değiştirilir. Kanal proteinlerinin zara rastgele girmediği, farklı iyon kanallarının hücre tarafından tam olarak doğru yere taşındığı bulundu.
Açılıp kapanması elektriksel zar potansiyeli tarafından kontrol edilen kanalların yanı sıra, hücrenin hem dışında hem de içinde zar üzerinde etkili olan kimyasallar (sadece sinapslardaki nörotransmitterler değil) tarafından kontrol edilen iyon kanalları vardır. Örneğin, bazı nöronlarda siklik adenozin monofosfat (cAMP) konsantrasyonundaki bir artış, kanalların açılmasına ve hücrenin depolarizasyonuna yol açar ve bu konsantrasyondaki bir artış adrenalin tarafından uyarılır. Hücre sadece iyon kanallarının işleyişini kontrol etmekle kalmaz, kontrollü biyokimyasal reaksiyonlar yoluyla onları modifiye edebilir, özelliklerini değiştirebilir. Bu tür süreçler, örneğin eğitim sırasında meydana gelir.
Membran potansiyel değişiklikleri . Hücre zarı, yerel depolarizasyonunun hızla büyüyen bir süreci olan dinlenme potansiyelini değiştirerek tahrişe yanıt verme yeteneğine sahiptir. Bu depolarizasyonun derecesi, uyarının yoğunluğuna bağlıdır ve sinir ve kas hücrelerinde, uyarı alanındaki membran potansiyelinin kısa süreli tamamen kaybolması, ardından polarite inversiyonu ve ardından repolarizasyon ile sona erebilir, yani. orijinal halinin restorasyonu. Bu fenomene aksiyon potansiyeli denir. Uyaran gücünde daha fazla artışın ve daha fazla depolarizasyonun bir aksiyon potansiyeline yol açtığı membran potansiyelinin düzeyine eşik, karşılık gelen uyarana ise eşik adı verilir.
Membran depolarizasyon seviyeleri. Membran üzerinde etkili olan uyaranın gücü, eşik uyarma değerinin 0,5'ini geçmezse, zarın depolarizasyonu yalnızca uyaranın etkisi sırasında not edilecektir. Bu fenomene elektrotonik potansiyel denir (Şekil 7)
Pirinç. 7. Elektrotonik potansiyel.
Membranın iyonik geçirgenliği pratikte değişmez. Uyaran gücünün 0,9 eşiğine yükselmesiyle, depolarizasyon süreci S şeklinde bir eğri boyunca ilerler, uyaranın kesilmesinden sonra bir süre artmaya devam eder, ancak daha sonra yavaş yavaş durur. Hücre zarının bu tepkimesine yerel tepki denir. Yerel bir yanıt yayılma yeteneğine sahip değildir. Bununla birlikte, tek bir lokal yanıtın süresinden daha kısa aralıklarla birkaç eşik altı uyaran uygulandığında, ikincisi toplanır ve zarın depolarizasyonu artar, bu da sinir ve kas hücrelerinde bir aksiyon potansiyelinin ortaya çıkmasına neden olabilir. Epitel hücreleri aksiyon potansiyeli oluşturamaz. Herhangi bir kuvvetteki bir uyaranın etkisine tepkileri, yerel bir tepki ile sınırlıdır.
Uyaran zarı bir eşik veya eşik üstü kuvvete maruz kaldığında, zar potansiyeli dinlenme potansiyeline göre 20-40 mV azalır, yani. kritik bir değere kadar. Aynı zamanda uyaranın gücü azalmazsa, zarda sodyum iyonları için gözenekler (kanallar) aniden açılır, bu katyonlar için geçirgenliği onlarca, hatta yüzlerce kez artar. Konsantrasyon ve elektrokimyasal gradyanlar boyunca, sodyum iyonları bir çığ gibi hücreye hücum eder ve onlarla birlikte pozitif yükler taşır. Uyarılmış bir yerde zarın dış tarafında, pozitif yükler yerine, büyük organik asit ve protein anyonları nedeniyle negatif yükler kurulur. Zarın iç tarafı Na katyonlarının bu çığ benzeri akışını pozitif işaretli bir elektrik akımı enjeksiyonu olarak algılar.
Na + iyonlarının zarın iç tarafında birikmesi, önce negatif yükünün nötrleşmesine, yani. depolarizasyonuna ve daha sonra bu yerde pozitif bir yükün kurulmasına: depolarizasyonun yerini yük ters çevirmesi alır (Şekil 8).

Pirinç. 8. Aksiyon potansiyeli.
Uyaran bölgesindeki zar potansiyeli pozitif olur. Membran potansiyelinin bu pozitif fazına aşma veya yükselme denir ve potansiyel eğrisindeki yükseklik 40-50 mV'dir. Grafiksel olarak bu, aksiyon potansiyeli eğrisinin artan dalıdır. Bu anda, sodyum kanallarının inaktivasyonu meydana gelir, zarın sodyum iyonları için geçirgenliği durur ve potasyum iletkenliğinde bir artışa yol açar. Potasyum iyonlarının dışa doğru artan akışı, orijinal polariteyi geri yükleyerek zarın repolarizasyonuna neden olur ve bundan sonra devreye giren sodyum pompaları, sodyum iyonlarını hücreden dışarı pompalayarak repolarizasyon sürecini tamamlar.

Pirinç. 9. Sinir lifi zarının uyarılabilirliğinde değişiklik
aksiyon potansiyeli sırasında
Grafiksel olarak, bu süreçler aksiyon potansiyeli eğrisinin azalan dalını karakterize eder. Na + iyonlarının zarın dış tarafına akışı, zar potansiyelinde ilkine kıyasla bir miktar artışa yol açar. Bu sözde. zarın "iz hiperpolarizasyonu". Refrakter dönem olarak adlandırılan bu dönemde, zar yeniden uyarılmaya karşı duyarsızdır. Bu gerçeğin iki sonucu vardır. Birincisi, zarın bu bölümünün tekrarlanan tahrişe karşı duyarsızlığı, komşu bölümden gelen darbenin geri dönmesine izin vermez ve ikincisi, yüksek frekanslı elektrik akımları sinirde uyarılmaya (aksiyon potansiyellerine) neden olmaz, sadece ısıtır. karşılık gelen doku bölümleri (ve sinirin kendisi de). ).
Aksiyon potansiyeli eğrisinin genliği, istirahat zar potansiyelinin değerlerinin toplamı ve bunun fazlalığı olarak tanımlanır - yük ters çevrilmesinden sonraki aşma. Örneğin, -80mV'lik bir DP ve +50mV'lik bir aşma ile, PD genliği 130mV olacaktır ve bileşenlerinin işaretleri dikkate alınmaz. AP'nin sinir liflerinin zarı üzerindeki süresi 1-3 ms, kaslar - 8 ms'ye kadar, kalp kası - 300 ms'dir.
Na + sisteminin etkisizleştirilmesi . Kalamar aksonunda, sabit depolarizasyon ile, zarın Na + iyonları için geçirgenliği 0,5 ms sonra azalmaya başlar; omurgalı nöronlarında bu süre 5 kat daha azdır. Sodyum iyonlarına membran geçirgenliğindeki bu hızlı azalmaya inaktivasyon denir. Membranın sodyum iyonları için maksimum geçirgenliği, dinlenme potansiyelinden yaklaşık 30-40 mV daha negatif bir depolarizasyon seviyesinde gözlenir. Dinlenme potansiyelinden 20-30 mV daha pozitif olan başlangıç potansiyellerinde Na+ sistemi tamamen inaktive olur ve hiçbir depolarizasyon onu aktive edemez.
Na sisteminin potansiyele bağlı inaktivasyonu, çeşitli koşullar altında hücre uyarılabilirliğini kritik olarak etkiler. Bu nedenle, memeli hücrelerinin PP'si -50 mV'den daha pozitif hale gelirse (örneğin, oksijen eksikliği veya kas gevşeticilerin etkisi altında), sodyum iletimi tamamen etkisiz hale gelir ve hücre uyarılamaz hale gelir. Ca2+ konsantrasyonu arttığında hücre daha az uyarılabilir hale gelir ve azaldığında hücrenin uyarılabilirliği artar. Tetani sendromlarının ve kandaki iyonize kalsiyum eksikliği ile ilişkili diğer durumların altında uyarılabilirlikteki böyle bir artış yatar; bu durumda istemsiz kas kasılmaları ve kasılmalar meydana gelir.
5. Uyarımın sinir lifi boyunca hareketi.
Modern kavramlara göre, uyarımın sinir ve kas lifleri boyunca yayılması, zarlarında aksiyon potansiyellerinin üretilmesi ve ortaya çıkan lokal elektrik akımlarının zarın komşu bölümleri üzerindeki etkisi ile açıklanır. AP eğrisinin tepe noktasına (aşma) yükselen fazı sırasında zarın herhangi bir yerinde bir aksiyon potansiyeli meydana gelirse, zarın bu kısmı elektrik akımının biyolojik bir jeneratörü haline gelir ve içinde pozitif bir akım dışarı akar. zar hücreye girer. Elektrik akımının kaynağı, zardan hızlı bir sodyum iyonu akışıdır.
Membranın iç tarafında, negatif yüklerini nötralize eden pozitif bir elektrik akımı, sitoplazmanın direncini yenerek uyarılmamış alanlara doğru akar, aynı anda hücre dışı sıvıyı kullanarak zaten uyarılmış alana aktığı dış tarafına akar. bir tel (Şekil 9, a).
Bu akımlar, sitoplazmayı ve hücre zarını, elektriği ileten bir ortama yerleştirilmiş, zayıf izolasyonlu pasif bir elektrik teli olarak kullanır ve denir. elektrotonik akımlar. Bu akımların gücü eşiğin altında olduğu sürece aksiyon potansiyeli oluşturmazlar ve aynı zamanda akım olarak da adlandırılırlar. yerel akımlar. Ancak, örneğin, önceki AP'nin meydana geldiği yerden, üretim yerlerinden belirli bir mesafeye kadar güçleri, eşik değerini birkaç kez aşarsa, bu tür akımlar, bitişik bölümün depolarizasyonunu uyarır. membran, ardından burada bir aksiyon potansiyelinin ortaya çıkması. Gelecekte, tüm bunlar bir sonraki komşu bölümde tekrarlanır; uyarma, zar boyunca dalgalar halinde hareket eder. Böylece, bir sinir lifi boyunca bir sinyal iletildiğinde, iki etkileşimli süreç gerçekleşir. İlk işlem, zarın uyarılmasıdır, yani. AP nesli - belirli, yani uyarılabilir hücrelerin zarının aktif elektrojenik özellikleri. İkinci - uyarılmış alandan uyarılmamış olana lif boyunca sinyal iletimi - tamamen elektrikseldir ve sinir lifi elektrik potansiyellerinin pasif bir iletkeni olarak davrandığında pasif elektriksel özelliklerinden kaynaklanır. İlk işlemi kullanarak sinir lifi boyunca uyarma iletimine darbeli, ikinci - darbesiz veya elektrotonik denir. Darbesiz iletim yöntemi, belirli, oldukça kısa mesafeler üzerinden iletilmesi gereken belirli sinir ağlarında gerçekleşir (aşağıya bakın). Darbe iletimi sırasında, sinir lifi, elektrik potansiyellerinin tekrarlayıcıdan tekrarlayıcıya geçtiği bir iletken tarafından bağlanan bir röle cihazları zinciri gibi çalışır. Bununla birlikte, sinir lifi bir sinyali tamamen elektriksel bir şekilde iletebildiğine göre, ilk olarak, neden ara tekrarlayıcılara ihtiyaç duyuyor ve ikinci olarak, hala ihtiyaç duyuluyorsa, sinir lifinin röle noktaları arasındaki mesafeler ne kadar olmalı? olmak?
Sinir lifi uzunluğu sabiti . Gerilimin yalnızca çekirdeğin direncinin üstesinden gelmek için harcandığı, havada bulunan metal çekirdekli bir kablonun aksine, bir sinir lifinde gerilim, kablonun "çekirdeğinin" direncine harcanır - aksoplazma, yalıtımı - zar ve hücre dışı sıvıdaki zarın gözeneklerinden akımın sızması üzerine. Bu nedenle, başlangıçtaki sinyal gücü kademeli olarak azalır ve sinyal zayıflar. Uyarılma bölgesinde ortaya çıkan akımın e faktörü kadar azaldığı sinir lifi bölümünün uzunluğuna sabit uzunluk denir ve Yunanca l-lambda harfi ile gösterilir. E harfi, yaklaşık 2.718 olan doğal logaritmaların tabanını temsil eder. Sinir hücrelerinde, sinir lifinin sabit uzunluğu 0,1 ila 5 mm arasında değişir. Örneğin, 4 lambda uzaklıkta, elektrotonik potansiyelin genliği, ilk potansiyelin sadece %2'sidir. Böylece, 1 m mesafedeki bir sinir lifinde, sadece elektrotonik potansiyel değil, aynı zamanda AP'nin neden olduğu sinyal de tamamen yok olacaktır. Bu nedenle, bir başlangıç gücü sinyalini yaymak için, amplifiye edilmelidir. Ancak sonuçta, sinir lifinin uzunluğu her zaman 1 m'ye ulaşmaz Küçük böceklerde, sinir lifinin sabit uzunluğu 250 mikrondur, bu da Drosophila'da vücudunun% 20'sidir. Ve bu mesafede, orijinal sinyal sadece 2.718 kez kaybolacaktır. Bu zayıflama miktarı, sinyal iletimini engellemez. Ancak böyle bir uzunluk, omurgalıların beynindeki pek çok nöronun özelliğidir. Daha yüksek hayvanlar, uzunlukları boyunca AP oluşturmayan, ancak elektrotonik potansiyellerin (örneğin retina nöronları) pasif iletkenleri olan açık sinir hücrelerine sahiptir.
Zaman sabiti . Bu nedenle, bir sinyalin impulssuz sinir lifleri boyunca iletilebileceği mesafeyi karakterize etmek için, yani. Elektrotonik bir şekilde, her zaman bir uzunluk birimi almanız gerektiğinde - bir uzunluk sabiti veya bir sönüm sabiti ( ben) sinir lifi.
Ancak sönüm sabiti sadece doğru akım için uygundur. Ancak doğru akım ile hiçbir bilgi iletilemez; bu alternatif akım gerektirir. Alternatif akımın katılımıyla sinir lifi boyunca sinyal yayılma hızını belirlerken, zarının alternatif akım genliğinin zirvesine ulaşmadan önce boşaltılması gereken bir elektrik kapasitansına (Şekil 10) sahip olduğu dikkate alınmalıdır. onun maksimum.
Bunun için belirli bir süre harcanmalıdır. Bu süre zarfında, akım sadece zarın bu bölümünün kapasitansını boşaltmakla kalmaz, aynı zamanda dışarı akar (hücreler arası boşluğa). Bu nedenle, hızla değişen bir alternatif akımla, zarı boşaltma verimliliği daha az olacaktır, bu nedenle sinyal daha hızlı bozulur.
Bu durumda sinyalin bozulma oranı, sözde kullanılarak belirlenir. zaman sabiti (t), zarın direncinin (Rm) ve özgül kapasitansının (Cm) ürününe eşittir, yani.
t=RmCm nihai genliğinin %37'si; t=10 ms, belirli bir sinir lifi için, 10 ms süreli bir sinyalin zayıflamasının, uzunluk sabiti (l) ile orantılı olduğu anlamına gelir. Bu fiberdeki böyle bir sinyal, doğru akım gibi pratik olarak iletilecektir, ancak t = 0,5 s (yumuşakça nöron) olan bir sinir lifi için bu sinyal zaten "hızlı" olacaktır, yani. daha kısa bir mesafede bozunacaktır. Omurgalılarda, farklı hücrelerde zaman sabiti (t) 5 ila 50 ms arasında değişir.
Bu nedenle, zaman sabiti (t) ile karşılaştırıldığında yeterince yavaş olan ve zayıflama sabiti (l) ile karşılaştırılabilir bir mesafe üzerinden bir sinyali iletmek için, sinyal iletiminin elektrotonik (darbeli) yöntemi oldukça uygundur. Sinyalin iletilmesi gereken mesafe, zayıflama sabitinden önemli ölçüde büyükse, amplifikasyonu gereklidir, yani. sıralı aksiyon potansiyeli üretimi ile iletim - dürtü sinyali. Evrim bu yöntemlerden sinir lifinin alıcı ucuna yeterli güçte bir sinyalin iletilmesini en iyi sağlayanı seçer veya her iki yöntemi aynı anda kullanarak sinyal güvenilirliğini sağlar.
Bununla birlikte, sinir lifinin etkili işlevini sağlamak için, yalnızca güvenilirlik değil, aynı zamanda yeterince yüksek bir iletim hızı gerektiren sinyal iletiminin zamanında olması da gereklidir.
Elektrotonik iletim hızı. Bu kavram 1946'da A. Hodgkin ve V. Rushton tarafından tanıtıldı]. Her şeyden önce, bir elektrik tonunun hızından ne anlaşılması gerektiğini bulmak gerekiyordu? Sinir lifinde tahriş bölgesinden belirli bir mesafede keyfi olarak küçük bir sinyalin göründüğü süreyi aklımızda tutarsak, bu ışık hızı olacaktır. Bununla birlikte, bu kadar düşük güçte bir sinyal alınamaz, çünkü alım yerinde bir eşik gücüne sahip olması gerekir ve bu nedenle böyle bir gücün sinyali ve elektrik tonunun belirtilen hızı işe yaramaz.
Membranı bir elektrik kapasitans zinciri olan bir kablo olarak sinir lifinin özellikleri (Şekil 9, a ve 10,

Pirinç. 10. Sinir lifi boyunca uyarının yayılması.
sinir lifi boyunca zar potansiyellerinin yayılmasının, lifin her bölümünde yeterli güçte bir akımın gerekli olduğu bu kapasitelerin art arda boşaltılmasıyla gerçekleştirildiğini gösterir; bir sonraki noktaya kadar, böyle bir güçte bir akıma ancak önceki kapasitans boşaldıktan sonra ulaşılabilir ve daha fazla uzak kapasitans sıralı olarak deşarj edildiğinden, potansiyel dağılım belirli bir durağan değere yaklaşır (Şekil 11).

Pirinç. 11. Uyarımın sinir lifi boyunca yayılma hızı.
Grafikte bu değer, sinir lifi boyunca potansiyel dağılım modelinin durağan değere ne kadar hızlı yaklaştığını gösteren üstel bir eğri ile ifade edilir; bu, alınabilen lif sinyalinin belirli bir noktasına ulaşma hızına bağlıdır. Bu hız zaman sabitine bağlıdır. ( t) ve sönüm sabitleri ( ben). Daha fazla t, Membranın birim uzunluğu başına fiberi çevreleyen hücreler arası sıvıya membrandan daha az akım akar ve sonuç olarak, kalan akım bir sonraki kapasitansı daha hızlı boşaltır ve kapasitans (ve dolayısıyla daha büyük) ben), boşalması o kadar yavaş olur ve sonuç olarak bu bölümdeki potansiyel eğrinin durağan bir değere yaklaşması o kadar yavaş olur.
Şekil 2'deki üstel eğri. 2-11, potansiyelin durağan değerine bir noktada ulaşıldığında hızı belirlemenin imkansız olduğunu gösterir, çünkü ona ulaşma zamanı sonsuzluğa meyillidir. Bu nedenle, Hodgkin ve Rushton, bir elektrik tonunun hızının koşullu bir tanımını seçtiler. Bunu yapmak için, zar potansiyelinin durağan değerlerinin iki kez sıkıştırılmış bir üssünü kullandılar (Şekil 2-11'de çarpılarla gösterilmiştir). Görüldüğü gibi başlangıç noktasında a potansiyel, fiberin diğer noktalarından daha erken durağan değerin 0,5'ine eşit hale gelir ve bu süre daha da eşit olarak 0,5 artar t bir mesafede ben Böylece, elektrotonik sinyal iletim hızı, zar potansiyelinin durağan değerinin yarısının sinir lifi boyunca yayılma hızıdır. Şu formülle ifade edilir: V= 2 ben/t, yani zarın uzunluk sabitinin zaman sabitine bölünmesinin iki katına eşittir.
kabul ederse ben= 2,5 mm ve t\u003d 50 ms, o zaman elektrik tonunun hızı saniyede 100 mm olacaktır.
Gerçek bir sinir lifinde elektrotonik sinyal yayılımı için önemli bir ayrıntı akılda tutulmalıdır: ilk membran potansiyelinin genliği eşiğin altında olmalıdır. Membran potansiyelinin eşik üstü değeri, zarı hemen bir uyarma durumuna getirir, yani. onun depolarizasyonuna neden olur, ardından sıradan sinir liflerinde gözlemlediğimiz bir aksiyon potansiyeli oluşumu izler].
Uyarımın darbe iletimi . Sinir lifi boyunca bir sinir impulsunun iletimi, iki alternatif sürecin bir sonucu olarak meydana gelir: aktif - zarın uyarılması ve pasif - elektrotonik potansiyelin lifin hala uyarılmamış bölümü boyunca transferi. Bu nedenle, lif boyunca impulsların iletilme hızı bileşik bir değerdir ve elektrik tonunun hızından ve aksiyon potansiyellerinin oluşumu için harcanan zamandan oluşur. Elektrik tonunun hızı ne kadar yüksek olursa, sinyal, eşik üstü değeri, yani. bir aksiyon potansiyelinin oluşumunu indükleyebilen bir değer. Bu da fiberin aktif özelliklerine bağlıdır: güvenlik faktörü ve darbe üretim hızı.
Güvenlik faktörü, aksiyon potansiyelinin amplitüdünün fiberin uyarma eşiğine oranıdır. AP genliği ne kadar büyükse ve zar uyarma eşiği ne kadar düşükse, AP'nin zarın uyarılmamış kısmını aktive edebildiği mesafe o kadar büyük olur. Ve son olarak, AP oluşturma süreçleri ne kadar hızlı ilerlerse, yeniden iletim için gecikme süresi o kadar kısa olur ve sonuç olarak iletim hızı o kadar yüksek olur.
Evrim, sinir lifi boyunca uyarı iletiminin hızını artırmak için hangi fırsatlara sahipti?
AP genliği iki önemli nedenden dolayı önemli ölçüde artırılamaz. Birincisi, bunun için lifin içindeki ve dışındaki potasyum iyonlarının konsantrasyonundaki farkı yüzlerce kez artırmak ve sonuç olarak, elde edilen sonuçlarla orantısız olan iyon pompaları için enerji maliyetlerini artırmak ve ikincisi , genellikle doğada yaşam olmayan zarın yeteneklerini ihmal etmek. Buradaki nokta şudur. AP'nin genliği yaklaşık 0,1 V'dir. Membranın kalınlığı (10 nm) göz önüne alındığında, üzerindeki alan kuvveti 109 V'tur. AP'nin genliği birkaç kez arttırılırsa, zar delinecektir. Ayrıca uyarma eşiğini önemli ölçüde azaltmak da imkansızdır, çünkü. sözde dinlenme zar potansiyelinin doğal dalgalanmalarının seviyesinin üzerinde olması gerekir. K+ iyonunun düzensiz hareketiyle ilişkili zarın "gürültüsü" zardan geçer.
Bu nedenle, evrim, sinir liflerinde uyarılmanın yayılma hızını artırmak için iki yola sahiptir: ya çaplarını değiştirerek ya da AP oluşum noktaları arasındaki mesafeyi artırarak, yani. sinir lifinin röle istasyonları.
Yukarıda potansiyellerin elektrotonik yayılma hızının çapın karekökü ile orantılı olduğunu gördük, yani. fiber çapı dörde katlandığında, sinyal yayılma hızının iki katına çıkacağını: 200 μm fiber çapı ile hız 20 m/s, fiber çapının 2 mm artmasıyla bu hız 60'a yükselecektir. Hanım. Bununla birlikte, ikincisi, karmaşık bir organizmada, dokuların büyük çaplı sinir lifleri ile dağılmasına yol açacaktır; bu, sadece ekonomik değil, aynı zamanda bu dokuların şekli ve işlevi açısından irrasyonel de olacaktır. Bu nedenle, evrim ikinci yöntemi seçti - birbirinden izole edilmiş sinir lifinin röle istasyonları arasında uyarmanın saltor iletimi yöntemi. 20 µm çapındaki ince miyelinli liflerde dürtü iletim hızı 120 m/s'ye ulaşır. İletim hızında böyle bir artış nasıl sağlanır?
Miyelinli lif, oldukça uzun bölümlerinin iyi bir yalıtım (miyelin) ile kaplanmış olması bakımından sıradan liflerden farklıdır. Bu miyelinli alanlar, kısa (2 μm) izole edilmemiş, sözde ile düzenli olarak değişir. lif zarının yalıtımsız olduğu Ranvier düğümleri. Ara boşluk bölümleri, belirli bir fiberin yaklaşık 100 çapı kadar bir uzunluğa sahiptir; yalıtım, yalıtım bandı gibi sinir lifini birçok kez saran miyelin açısından zengin hücreler tarafından oluşturulur ve bu alanlarda iyonun zardan geçmesini imkansız hale getirir. Kesişmelerde, zar aksiyon potansiyelleri üretmek için özelleşmiştir ve bir akım kaynağıdır; buradaki Na + kanallarının yoğunluğu, etli olmayan elyaftan 100 kat daha fazladır (Şekil 12).

Pirinç. 12. Ranvier'in Durdurulması.
Kesişmede büyük kayıplar olmadan üretilen akım, bir sonraki kesişme noktasına ulaşır ve oradan akan, bir sonraki kesişme bölgesi için akım kaynağı olan zarında AP oluşumunu uyarır. Böylece, membran potansiyeli kaydırıldığında, akım, interstisyel alanların zarından geçmez ve dürtü, bu alanlarda neredeyse sıfır zaman tüketimiyle (0,05-0,07 ms) ve neredeyse zayıflama olmadan (azalma olmadan) elektrotonik olarak yayılır. İletimdeki gecikme, yalnızca elektrotonik potansiyelin eşik kuvvetine ulaşması ve bir aksiyon potansiyelinin oluşmasına neden olması gereken kesişmelerde meydana gelir. Sinir lifinin böyle bir cihazı sadece yüksek bir uyarma hızı sağlamakla kalmaz, aynı zamanda çok ekonomiktir: iyonik pompalar sadece kesişme noktalarında çalışır.
Doğa, bu fiberin 100 çapına eşit aralıklar arası bölümün uzunluğunu seçmiştir. Teorik olarak en uygunu olmamakla birlikte, bir veya daha fazla kesişmenin zar aktivitesi kaybolsa bile bir darbenin iletimini garanti eder. Peki ya yalıtımın kalınlığı?
Rushton (1951), sinir lifindeki aksiyon potansiyelinin yayılma hızının, lifin miyelinli kısmının iç çapının dış çapına oranı 0.6-0.7 olduğunda optimal olacağını belirlemiştir; bu gösterge aşağıdaki formülle tanımlanır:
İle toptan =1/2e, burada K, çapların oranıdır ve e= 2,718 . Histologlar tarafından gerçek sinir liflerinin gerçek ölçümleri bu verileri doğruladı.
6. Sinir liflerinin hıza göre sınıflandırılması.
Erlanger ve Gasser tarafından elde edilen sinirlerin elektrofizyolojik çalışmalarına dayanarak, tüm sinir lifleri A, B ve C olmak üzere üç gruba ayrılır ve A grubunda dört alt grup ayırt edilir (Tablo 1).
Bir sinir, impulsların hızı ve yönü bakımından farklı olan çok sayıda sinir lifi içerebilir. Örneğin insanlarda alt ekstremitenin siniri, işlev, çap ve dürtü iletim hızı bakımından farklılık gösteren sinir lifleri içerir. Böyle bir sinirin aksiyon potansiyeli, bir dizi lif grubu ve bunlar boyunca sinir uyarılarının iletiminin hızları tarafından belirlenir. Tüm grupların sinir liflerini uyarabilecek bir irritasyon uygulandığında, tüm sinirin bileşik aksiyon potansiyeli kaydedilir.
Tablo 1. Erlanger ve Gasser'e göre sinir liflerinin sınıflandırılması].
|
liflerin işlevleri |
Ortalama fiber çapı, µm |
Ortalama iletim hızı, m/s |
|
|
İskelet kaslarının duyusal ve motor lifleri |
|||
|
Dokunma ve basınçtan oluşan afferent lifler |
|||
|
motor kas iğcikleri |
|||
|
Cilde duyarlı ağrılar ve sıcaklıklar |
|||
|
sempatik preganlionik |
|||
|
sempatik postganglionik |
Örneğin arka uzuv siniri, farklı işlev, çap ve hızdaki sinir liflerini içerir. Böyle bir sinirin aksiyon potansiyeli, tüm lif grupları ve sinir impulsu iletim hızları tarafından belirlenir. Tüm grupların sinir liflerini uyarabilecek bir irritasyon uygulandığında, tüm sinirin bileşik aksiyon potansiyeli kaydedilir.
7. Reseptörlerde uyarma üretimi.
Canlı bir organizmada, doğal uyaranların etkisi özel duyu organlarında gerçekleştirilir ve uyaranlar ışık, ses, basınç, sıcaklık, ortamın pH'ındaki değişiklikler vb. Bu uyarıları ayırt eden ve bunlarla ilgili bilgileri sinir sistemine gönderen hücrelere reseptör denir.
Bir reseptör hücresi üzerindeki bir uyaranın etkisi altında, algılama işlemlerinin zarı depolarize edilir ve yeterince büyük bir uyaran gücü ile sözde. reseptör potansiyeli. Diğer uyarılabilir hücrelerin zarlarından farklı olarak, reseptör potansiyelinin süresi, uyarana maruz kalma süresine karşılık gelir ve genliği, uyaranın yoğunluğuna karşılık gelir.
Reseptör potansiyeli, aksonunun kaynaklandığı reseptör hücre gövdesinin tabanına elektrotonik olarak yayılır ve burada eşik seviyesini aşan bir depolarizasyona neden olur; aksiyon potansiyeli oluşur. Bu durumda spesifik olan şudur: aksiyon potansiyelinin sonundaki membran repolarizasyon eğrisi, başlangıç seviyesinin çok altına düşer, membran hiperpolarizasyonu meydana gelir ve daha sonra meydana gelen depolarizasyon eğrisi, eşik seviyesine ulaşır: bir sonraki aksiyon potansiyeli meydana gelir. Bu nedenle, uyaranın neden olduğu alıcı hücrenin giriş zarının kalıcı depolarizasyonu, çıkış zarında daha sonra akson boyunca yayılan bir dizi aksiyon potansiyelinin üretilmesine neden olur. AP serisinin yayınlanma süresi, uyaranın etkisinin süresine karşılık gelir ve serideki darbelerin sıklığı, etkisinin yoğunluğuna karşılık gelir. Böylece bir frekans kodu biçimindeki aksiyon potansiyelleri, uyaranın büyüklüğü ve süresi ile ilgili olarak merkezi sinir sistemine taşınır.
Hassas bir sinir hücresinin aksonu ile tek bir bütün oluşturan reseptörlere birincil; sekonder reseptörler sinir hücresinin aksonuna sinapslarla bağlanır ve reseptör potansiyelinin bir dizi aksiyon potansiyeline dönüştürülmesi, sinir hücresinin alıcı uçlarında (terminaller) tarafından salınan bir aracının etkisi altında gerçekleştirilir. alıcı. Bu durumda dizinin süresi ve sıklığı, yayın süresi ve aracı miktarına göre belirlenir.
8. Uyarımın hücreler arası iletimi.
Bir sinir hücresinin aksonunun ucu ile bir sonraki hücrenin (kas, salgı bezi veya sinir) zarı arasındaki temas noktasında oluşan yapılara sinaps denir. Sinaps adı verilen oluşum, aralarında 10-50 nm genişliğinde (100-500 A) bir boşluk bulunan sinaptik yarık olan presinaptik ve postsinaptik olan temas eden hücrelerin zarlarını içerir. Boşluğun böyle bir genişliği, hücreler arası sıvıdaki büyük akım kaybı nedeniyle uyarının hücreden hücreye elektriksel iletimini imkansız hale getirir. Sinapslarda uyarımın kimyasal iletimi, uyarımı artıran bir mekanizmanın rolünü oynayabilir, ancak güçlendirme. salınan aracı miktarına ve salınma süresine, algılayan zarın duyarlılığına bağlıdır.Bütün bunlar evrimle en uygun şekilde ayarlanabilir ve bu nedenle sinaps, belirli bir uyarıya izin veren bir valf prensibi ile çalışır. geçmek için yoğunluk.
Sinapsların biyolojik önemi . Sinapslar valf olarak olmasaydı, merkezi sinir sisteminin düzenli faaliyeti pek mümkün olmazdı. Sinaptik iletimin etkinliği değiştirilebilir. Örneğin, uyarım iletimi, sinapsın daha sık kullanılmasıyla iyileşir.
Nöronal bağlantıların sinaptik yolu, filogenez ve ontogenez süreçlerinde organizmaların sinir sisteminin gelişiminde ve oluşumunda önemli bir rol oynar. Ontogenez sürecinde, bireyin merkezi sinir sistemi hem yeni nöronlar ekleyerek hem de bunlar arasında yeni nöronlar arası sinaptik bağlantıların ortaya çıkması ve kurulmasıyla gelişir ve belirli bir yaşa kadar iyileşir; bu, sürekli katı hücreler arası durumda imkansız olurdu. morfolojik bağlantılar.
Son olarak, sinapslar, pozitif farmakolojik ve patojenetik önemi olan endojen kökenli maddeler de dahil olmak üzere, eksitasyon iletimini bloke eden birçok farmakolojik madde için uygulama noktalarıdır. Beyin yapılarının işlevi düşünüldüğünde bunlar tartışılacaktır.
Bir nöromüsküler sinaps örneğinde sinaptik iletim mekanizmasını düşünün.
sinir-kas kavşağı İle birlikte. Şematik olarak, nöromüsküler sinapsın yapısı Şek. 13.
Pirinç. 13. Nöromüsküler (kimyasal) sinaps.
Omuriliğin motor nöronlarının aksonları ve medulla oblongata ve orta beynin motor çekirdekleri, iskelet kası lifleri ile sinaps oluşturur. Presinaptik zar, miyelin kılıfını kaybetmiş aksonun birçok terminal dalından oluşur. Sinaps bölgesindeki postsinaptik zar, kas lifine aittir ve uç plaka olarak adlandırılır. Kalınlaşmış akson terminallerindeki sinaptik veziküller kimyasal asetilkolin içerir.
Aksonun aksiyon potansiyelinin etkisi altında, sinaptik veziküllerden asetilkolin, sinaptik yarıktan geçen, uç plakanın depolarizasyonuna ve uç plakanın lokal potansiyelinin ortaya çıkmasına neden olan presinaptik zarından salınır - PCP. İkincisi, bir dizi özellikte aksiyon potansiyelinden farklıdır. Apsisin negatif tarafında yer alan eğrisi, 1-1.5 ms'lik dik bir yükseliş ve 3.5-6 ms'lik yavaş bir düşüş ile karakterize edildiğinden daha uzun sürer. PEP ya hep ya hiç yasasına uymaz; genliği sinapsa salınan aracı miktarına ve sinaps sonrası zarın duyarlılığına bağlıdır. Presinaptik zara ulaşan yeterli bir aksiyon potansiyeli frekansı ile, sinapsa salınan nörotransmiter miktarı ve sonuç olarak EPC toplanır ve kas lifi zarı üzerinde bir aksiyon potansiyelinin görünümünü uyarır.
Aracının sinapsta normal salınımı için kalsiyum iyonlarının varlığı gereklidir. Aracının sinaptik yarığa salınmasının nedeni, presinaptik zarın kendisinin depolarizasyonu değil, depolarizasyonun kalsiyumun presinaptik terminale yolunu açmasıdır. Kalsiyumu dış ortamdan uzaklaştırırsanız, kimyasal sinaps herhangi bir depolarizasyon altında çalışmayacaktır. Ca2+ iyonlarının mediatör salınımı üzerindeki etki mekanizması araştırılmaktadır. Sinapstaki salınımının, aksonun presinaptik terminaline hızla nüfuz eden kalsiyum iyonları için presinaptik zarın geçirgenliğinde keskin bir artıştan önce geldiği tespit edilmiştir. Ca2+ iyonları işlevlerini yerine getirdikten sonra, çalışması sürekli olarak zar çevresinde dengede olmayan bir kalsiyum iyonu konsantrasyonunu koruyan iyonik kalsiyum pompaları tarafından aksondan dışarı pompalanır.
Pompaların çalışması için gerekli olan enerji, akson terminallerinin mitokondrilerinde üretilir ve aynı terminallerde kolin ve asetik asitten asetilkolinin yeniden sentezi için de harcanır.
Nöromüsküler iletimin blokajı . Lokal anestezikler (novokain) presinaptik sinir uçlarında uyarı iletimini bloke eder. Botulinum toksini, presinaptik membranın kalsiyum iyonları için geçirgenliğini bloke ettiği için mediyatör salınımını engeller. Magnezyum iyonları zar üzerinde benzer şekilde hareket eder. Yılan zehiri, örneğin, a-bungarotoksin, kürar zehiri, postsinaptik zarın asetilkolin reseptörlerini geri dönüşümsüz olarak (yılan zehiri) veya geri dönüşümlü olarak (kürare zehiri) bloke eder ve bunlara bağlanır. Toksik dozlardaki organofosfor bileşikleri, normalde asetilkolini işlevini yerine getirdikten sonra parçalayan kolinesteraz enzimini inhibe eder. Aynı zamanda, zaman içinde bölünmeyen enzim, sinapsta o kadar uzun süre etki eder ki, postsinaptik zarın reseptörlerinin aracıya inaktivasyonu meydana gelir.
Esasen kapanmayan kalsiyum kanalları olan karakurt örümceğinin zehirinden bir protein olan latrotoksin izole edildi. Presinaptik zara gömülüdür ve kalsiyumun terminale girmesine izin vermeye başlar. Sonuç olarak, terminaldeki asetilkolin rezervleri tamamen tükenir ve sinir sistemi kas kasılmalarına (solunum olanlar dahil) neden olamaz.
Sinaptik iletimi engelleyen bazı maddeler, anestezi ve diğer tıbbi işlemlerde kasları gevşetmek için kullanılır. Bu maddelere gevşetici denir.
elektrik sinapsları . Hayvanlarda kimyasal sinapslara ek olarak elektriksel sinapslar da bulunmuştur. ES'de iyon akışları, akson terminallerinden hedef hücreye, spesifik membran proteini "yerleştirme" cihazlarının - bağlantıların tübüllerindeki özel kanallar aracılığıyla doğrudan geçer. Connectin protein molekülleri, akson terminal zarlarında ve hedef hücrenin postsinaptik zarında - altı molekülden oluşan ve içinde bir kanal bulunan konneksonda özel bir yapı oluşturur. Bitişik sinaps zarlarının iki bağlantısı birbirine bağlanır ve her birinde bir delik açılır - daha önce kapatılmış bir kanal (bu işlem, yerleştirme sırasında kapakların açılmasına benzer). Bu kanal, iyonların geçişi için düşük bir direnci temsil eder. ES'de birçok bağlantı vardır. Böylece ES, protein moleküllerinin içinden geçerek, yaklaşık 1-1.5 nm çapında birçok ince tüp ile iki hücreyi birbirine bağlar (Şekil 14, d).

Pirinç. 14. Elektrik sinapsları.
ES'nin sinaptik yarığında bulunan bağlantılar arasındaki boşluk bir yalıtkanla doldurulur. Kuşlarda, göz bebeğinin ışığa tepkisini sağlayan nöronlar zincirinde, elektrik sinapslarının boşluğu miyelin ile doldurulur.
ES'nin ayırt edici bir özelliği hızıdır. ES'nin ikinci karakteristik özelliği, sinyali her iki yönde de geçirmeleridir, yani. simetriktirler. Bununla birlikte, bir sinyali bir yönde ileten doğrultucu özelliklere sahip zarların oluşturduğu EC'ler ve ayrıca bir aracılı veziküllerin sinaptik yarık her iki tarafında yer aldığı simetrik kimyasal sinapslar vardır. ES çoğunlukla omurgasızlarda ve alt omurgalılarda (siklostomlar ve balıklar) bulunur.
Sinaps gibi cihazlar. Sinaps gibi cihazlar, çeşitli doku ve organların yaşamında önemli bir rol oynar. Örneğin, çeşitli hayvanlardaki kalp hücreleri, ES'de kanalları oluşturan aynı bağlantı proteininden gelen kanallarla bağlanır. Bu durumda, hücre temas alanına yüksek geçirgenlikli temas denir (sinaps, en az bir katılımcının nöron olduğu bir temastır). İç organların düz kas hücreleri, bir bağlantı sistemi ile birbirine bağlanır. Uyarılmayan hücreler (epitel hücreleri, bezler, karaciğer vb.) ayrıca oldukça geçirgen temaslarla bağlanır. Aslında, neredeyse tüm vücut dokuları tek hücre kümeleri değil, hücrelerin yüksek geçirgenlikteki temas kanalları aracılığıyla çeşitli molekülleri değiş tokuş edebildiği tek bir topluluktur. Bu nedenle dokularda bir tür "hücresel karşılıklı yardımlaşma" mümkündür. Örneğin, bir hücrede membran pompaları iyi çalışmıyorsa, komşuları iyonik rezervlerini yüksek geçirgen kontak kanalları aracılığıyla onunla “paylaşır” ve dinlenme potansiyelini korur.
Connexon'lar stabil tüpler değil, dinamik yapılardır: connexon kanalları çeşitli faktörlerin etkisi altında açılıp kapanabilir. Bu tür kanal kapanmasının moleküler mekanizması aydınlatılmıştır. Connexon, delik kapanabilirken birbirine göre hareket edebilen (bkz. Şekil 2-12, b) 6 alt birimden oluşur; bu cihaz, hareketli yaprakları olan kamera diyafram cihazına çok benzer. Herhangi bir hücrenin zarda ciddi bir hasar alması ve savunma mekanizmalarının, örneğin çevreden gelen kalsiyumun fazlalığı ile baş edememesi ve bunun sonucunda hücrenin ölüme mahkum edilmesi durumunda, yüksek konsantrasyonda Bu hücrenin içindeki kalsiyum komşu hücrelerle olan bağlantıları etkiler, kanalları kapanır ve komşu hücreler hasarlı komşudan ayrılır. Ünlü bir bilim adamı, "Kalbin hücreleri birlikte çalışır ve birer birer ölür" dedi. Şimdi bunun neden mümkün olduğunu biliyoruz.
Connexons dinamizmi sadece beka için önemli değildir. Oldukça geçirgen temasların, çeşitli hayvanların embriyolarının gelişiminin en erken aşamalarında zaten bulunabileceği tespit edilmiştir; yumurtanın ilk ezilmesi sırasında ortaya çıkan hücreleri birbirine bağlarlar ve daha fazla gelişmenin girişinde ya ortaya çıkarlar ya da kaybolurlar. Hücreler ya bazı maddelerle birbirlerini etkilerler, daha sonra embriyonun bölümleri birbirinden izole edilir ve daha sonra bu alanlarda özdeş hücrelerden homojen bir doku gelişir; o zaman bu alanlar yine komşularla temaslarla birbirine bağlanır ve tüm bu karmaşık temaslar oyunu, normal gelişimin düzenlenmesinde belirli işlevleri yerine getirir. Bütün bunlar, ES'deki sinyallemenin, iyon pompaları gibi, organizmaların gelişiminde ve dokularının işleyişinde daha genel ve temel bir rol oynayan yapının ikincil bir "mesleği" olduğunu göstermektedir.
Benzer şekilde, kimyasal sinapsların çalışma prensibi organizmalarda sadece bilgi iletmek için değil, aynı zamanda başka amaçlar için de kullanılır. Bu nedenle, çeşitli salgı hücreleri, salgı salınımını düzenlemek için Ca2+ iyonlarını kullanır, tıpkı kimyasal bir sinapsta bu işlemin bir aracıyı serbest bırakmak için kullanılması gibi. Birçok bezin hücrelerinin elektriksel olarak uyarılabilir olduğunu unutmayın.
Örneğin, insülin üreten pankreas b-hücrelerinin çalışmasını düşünün. Bu hücrelerin yüzeyinde, onları çevreleyen interstisyel sıvıdaki glikoz seviyesine tepki veren reseptörler vardır. Kandaki glikoz seviyesi normalden yüksekse, bu reseptörlerin etkisi altında hücreler depolarize olur (potasyum kanallarının kapanması sonucu) ve bunlarda aksiyon potansiyelleri ortaya çıkar.Bu aksiyon potansiyelleri kalsiyum niteliğindedir. , Ca kanallarının açılması nedeniyle ortaya çıkarlar. Aynı zamanda Ca2+ iyonları hücre içine girerek insülinin kana salınmasına yol açar, sinir uçlarında olduğu gibi bir aracının salınmasına yol açar. Kalsiyumun çeşitli maddelerin, özellikle hormonların salınımındaki rolü, diğer birçok bez için de gösterilmiştir. Pankreas hücrelerinde aksiyon potansiyellerinin ortaya çıkmasının açıklanan mekanizmasının, muhtemelen, belirli hormonların farklı konsantrasyon seviyelerine yanıt veren hipotalamus hücrelerinde de gerçekleştiğini belirtmekte fayda var.
Çeşitli vücut hücreleri, çevrelerine farklı maddeler salmaktadır; Her şeyden önce, bunlar bez hücreleridir. Bu maddeler membran kaplarda - veziküllerde paketlenir ve serbest bırakılmaları, hücreye özel kalsiyum kanallarından giren Ca2 + iyonları tarafından düzenlenir. Evrimin bir sonucu olarak, bu mekanizma sinir hücreleri tarafından kimyasal sinapsların yapımında kullanılmaya başlandı; kaplar bir nörotransmitter içerir ve daha sonra salınımı hormonların ve diğer maddelerin salınımı ile aynı şekilde düzenlenir ve bu açıdan kimyasal sinapslı sinir hücreleri salgı hücreleri için seçeneklerden biridir ve arabulucu sırları, sadece kan dolaşımına salınmaz ve sinaptik yarık yoluyla tamamen belirli tüketicilere girer. Öte yandan, glandüler hücrelerin çalışması sinir hücrelerinin çalışmasına benzer, ancak aksiyon potansiyelleri kalsiyum kanallarının açılmasına ve Ca2+ iyonlarının içeri girmesine hizmet eder. Aynı şeyi, aksiyon potansiyelinin kasılma sürecini tetikleyen Ca2+ iyonları için kapıyı açtığı kas hücrelerinde de gözlemliyoruz.
Böylece, ilk olarak, vücudun farklı hücreleri tarafından farklı amaçlar için kullanılan mekanizmaların yakın benzerliğini bir kez daha görüyoruz ve ikinci olarak, ileriye baktığımızda, duyuların duygusal renklendirilmesinin sırrını ve sinir sisteminin en yüksek tezahürünü önerebiliriz. insan beyninin aktivitesi, bilinç ve düşünme duyumlarıdır - tam olarak bu nöron fonksiyonları birliğinde bulunur. şunlar. özelliğinde hem sinir (elektriksel uyarılar üreten ve ileten) hem de salgılayan bir hücredir.
9. Nöron fonksiyonunun şekline bağımlılığı.
Bir sinir hücresinin fizyolojik işlevleri büyük ölçüde elektriksel özellikleriyle belirlenir. Nöronların, prensipte silindirik bir kablo şekline sahip aksonları ve az ya da çok küre şeklinde vücutları ile çok çeşitli şekillerde olduklarını zaten biliyoruz. Bir kürenin ve aynı zarlardan oluşan bir silindirin elektriksel özelliklerini karşılaştırdığımızda, bu özelliklerin belirlenmesinde uyarılabilir hücrenin şeklinin ne kadar önemli bir rol oynadığını göreceğiz.
Bir sinir hücresini karakterize eden elektriksel parametreler iki gruba ayrılabilir: 1) zarın ve sitoplazmanın maddesini karakterize eden parametreler - zarın spesifik direnci (Rm), 1-10 kOhm / cm2'ye eşittir, spesifik elektrik kapasitansı (1 μF / cm2) ve yaklaşık 100 Ohm.cm'lik spesifik sitoplazmik direnç (Ri); bu parametreler hücrenin şekline bağlı değildir; 2) sistem parametreleri; lifi, hücreyi veya ilgili hücrelerin sistemini bir bütün olarak karakterize ederler ve boyut ve şekle bağlıdırlar; sistem parametrelerinden biri giriş empedansıdır - Rin
Giriş direnci, hücrenin zar potansiyelinin, içine geçen elektrik akımının değerine kaymasının oranıdır: Rin = DV / I. Bu nedenle giriş direnci, bir sinir lifi bölümünün olağan direncinin bir benzeridir.
Aksonun (silindir) giriş empedansı aşağıdaki formülle ifade edilir:
Rin \u003d 1 / p 2 (Rm Ri) / 8a3, nerede a- akson yarıçapı .
Bu formülde Rm ve Ri sırasıyla akson zarının ve sitoplazmanın direncidir, yani. 1. grubun parametreleri; diğer her şey, yarıçaptan çok daha büyük bir uzunluğa sahip bir silindir olarak fiberin geometrisi tarafından belirlenir. Peki ya yarıçapı a olan küresel bir kafes aynı malzemeden yapılmışsa? Çok büyük küresel hücrelerde bile (1 mm çapında) sitoplazmanın direncinin, zarın direncinin sadece %0,1'i olduğu gösterilmiştir; çok daha küçük çaplı küresel hücrelerde (tüm sinir hücreleri aynıdır), sitoplazmanın direnci göz ardı edilebilir ve küresel bir hücrenin gerçek giriş direnci yalnızca zarının direncine ve yarıçapına bağlıdır: Rin = Rm / 4pa3
Bu nedenle, küresel bir hücre için, giriş direnci zarın direnciyle doğru orantılıdır, bu nedenle, hücre uyarıldığında, zarının özgül direnci, örneğin 36 kat azalırsa, o zaman giriş direnci, sistem de 36 kat azalacaktır.
Bir fiber için, giriş direnci sadece 2Rm ile orantılıdır, bu nedenle uyarılma üzerine membran direnci de 36 kat azalırsa, giriş direnci sadece 6 kat değişecektir.
Bütün bunlar nöronun işlevini nasıl etkiler? Küresel bir hücrede, zar potansiyeli, silindirik bir fiberde olduğu gibi anında kaybolmaz, ancak yavaşça - üstel olarak.Sinapslardaki postsinaptik potansiyel, postsinaptik zarın giriş direnci ile doğru orantılıdır, bu nedenle, çapı olan küresel bir hücrede 10 mikrondan, postsinaptik potansiyel, 100 µm çapında bir hücreden 100 kat daha büyük olacaktır. Uyarıcı sinapsların verimliliği ne kadar düşükse, giriş empedansları o kadar düşük olur. Küresel hücredeki inhibitör sinapsın aracısı, postsinaptik zarın giriş direncini azaltır, böylece uyarıcı impulsların etkinliğini azaltır; silindirik bir fiberde bu etki çok daha küçüktür.
Küresel bir hücrenin zarı üzerindeki zar potansiyelindeki yavaş bir azalma, içindeki geçici toplamanın verimliliğini önemli ölçüde artırır. Serebral korteksin nöronlarının vücutlarının farklı şekilleri ve boyutları - bir fenomen tesadüfi değildir!
Çapında bir değişiklik olan bir sinir lifinin iletkenliği. Aynı lifte, genişlemeden önce sinir impulsunun yavaşladığı ve genliğinin azaldığı gösterilmiştir; fiber altı kez genişlediğinde, PD bu genişlemeden geçemez. Aksine, lif daraldığında, daralma noktasına yaklaştıkça darbe hızı artar ve genliği artar. Terminalin sonundaki AP genliğinde bir artış, kimyasal sinapsların çalışması için çok önemlidir, çünkü bu, aracıların salınması için koşulları iyileştirir, Daralan akson, toplam çapı daha küçük olan iki dala ayrılırsa. dallanma noktasındaki çap, o zaman AP dallanmadan önce hızlanır ve dalların toplam çapı daha büyükse - PD hızı yavaşlar ve hatta engellenebilir. Dendritlerin iletkenliği. Uyarma yönünde, dendritler, tekrar tekrar daha kalın dallara birleşen ve nöron gövdesinde kalın gövdelerle biten çok sayıda ince dal olarak başlar. Dendritlerin uzunluğu, sinir hücrelerinin gövdesinin çapından onlarca kat daha fazladır ve terminal dalların kalınlığı, bir mikrometrenin kesirleri olabilir. Bazı dendritlerde, zar uyarılamazdır (AP üretmez) ve sinyalleri yalnızca pasif bir kablo olarak elektrotonik olarak iletebilir; diğerlerinde, bir akson gibi, ancak nöron yönünde aksiyon potansiyelleri üretebilir ve iletebilir. gövde. İlk durumda, bilim adamlarının inandığı gibi, birçok sinaps ince terminal dallarında bulunur ve bu sinapsların birleşik hareketi nöronun gövdesine ulaşır. Kantitatif bir değerlendirme, dendritik sinapsların etkinliğinin, bir nöron gövdesinde bulunan sinapslardan sadece 3-5 kat daha düşük olduğunu gösterdi.Hücre gövdesine etkili bir şekilde ulaşmak için yeterli kuvvet, küçük nedeniyle dendritik sinaps içinde elektrotonik potansiyel alır. dendritik terminalin yarıçapı ve dolayısıyla büyük giriş direnci (yukarıya bakın). Bu kuvvet, dendritlerin genişleme yönünde hareket ederken sinyalin zayıflamasını telafi etmek için yeterlidir.
Dendritik membranları aksiyon potansiyeli üretme ve iletme yeteneğine sahip nöronlarda, dendritik sinapsların benzer yüksek verimliliği, sadece birkaç sinapsın membran potansiyelini eşiğe getirmesine ve bu dalda yayılmaya başlayacak olan AP'ye neden olmasına yol açar. hücre gövdesine. Diğer kaderi, nöron gövdesine giderken geçmek zorunda olduğu dallanma düğümlerinin özelliklerine, diğer dallar boyunca dallanma bölgelerine ulaşan aksiyon potansiyellerinin sayısına ve zamanlamasına vb. bağlı olacaktır. Sonuç olarak, bu tip hücre karmaşık bir mantık devresi gibi çalışır. Karmaşık bir dendrit sistemine sahip hücreler, bir bilgisayarın çok karmaşık öğeleri gibi çalışır.
Dendritik dikenlerin işlevleri . Birçok nöronun dendritlerinde, sözde özel oluşumlar vardır. dikenler. İnce bir sap üzerinde bir kafa şeklindeki bu mantar benzeri oluşumlar, üzerinde başka bir nörondan bir terminal ile kimyasal bir sinapsın oluşturulduğu bir dendritin hücre zarının bir çıkıntısıdır. Bilim adamları, dikenlerin işlevinin aşağıdaki gibi olduğuna inanıyor. Uyarılmayan bir zar durumunda, dikenler, komşu sinapsların dendritin postsinaptik zarı üzerindeki karşılıklı etkisini önemli ölçüde azaltır; bu, dikenlerin yokluğunda dendrit terminalinin giriş direncinde önemli bir azalma olacaktır. ve sonuç olarak, zar potansiyeli seviyesinde bir azalma. Hesaplamalar, dikenli sinapsların doğrudan dendrit üzerinde bulunan sinapslardan bireysel olarak daha az verimli olmasına rağmen, çalışmalarının genel etkisinin gözle görülür şekilde daha yüksek olduğunu göstermiştir.
Omurga zarı uyarılabilir ise, sinaptik iletimin bir yükselticisi olarak çalışabilir. Boynun inceliği nedeniyle, omurganın giriş empedansı çok yüksektir ve tek bir sinaps, dendrite sinapsın akımından çok daha güçlü bir elektrik akımı gönderecek olan kafada bir aksiyon potansiyeli başlatabilir.
10. Nöroglia fonksiyonları.
Merkezi sinir sistemindeki nöronlar arasındaki boşluk, glia adı verilen özel destek hücreleri ile doldurulur. Sayıları nöronlardan 5-10 kat daha fazladır. Glia ayrıca nöronların periferik aksonlarının miyelin kılıflarını oluşturur.
Glial hücreler iki gruba ayrılır - astrositler ve oligodendrositler Astrositler, nöronların hücre dışı alanını fazla iyonlardan ve aracılardan temizler ve bu nedenle hücre dışı kalsiyum iyonları konsantrasyonunda bir artış olması durumunda bir tampon görevi görür ve kimyasal "girişimi" ortadan kaldırır. nöronların çalışması. Nöronlara oksijen ve glikoz erişimini değiştirebilseler de, glia'nın nöronlarla ilgili trofik işlevi kanıtlanmamıştır. karşılık gelen interstisyel sıvı akışlarını bloke eder. Astrositler, sinaptik yarıklardaki zarların tek tek bölümlerini bloke ederek sinapslarda iletilen sinyali değiştirebilirler.Sınırlı beyin hasarı olan yerlerde, astrositler, ölü nöron parçalarının temizlenmesine katılarak sıhhi işlevleri yerine getirir.
Oligodendrositler, nöronların aksonlarının etrafına dolanırlar ve CNS'de miyelin kılıflarını oluştururlar. Çeşitli oligodendrositler - Schwann hücreleri - periferik aksonların süreksiz bir miyelin kılıfını oluşturur.
11. Ontogenezde bir nöronun büyümesi ve gelişimi.
Nöron, işlemlerini serbest bırakmadan önce bölünmeyi durduran küçük bir progenitör hücreden gelişir.
Nöronların kendilerinin bölünmesi sorunu şu anda tartışmalıdır. hem de oluşan organizmada bu sürecin uygunluğu. Hücre gövdesi kısmındaki hasarlı süreçlerin yenilenmesi, tamamen kanıtlanmış bir gerçektir. Kural olarak, önce akson büyümeye başlar ve daha sonra dendritler oluşur. Sinir hücresinin gelişme sürecinin sonunda, düzensiz şekilli bir kalınlaşma ortaya çıkar - görünüşe göre çevre dokudan geçen bir "büyüme konisi". Büyüme konisi, birçok ince dikene sahip bir sinir hücresi sürecinin düzleştirilmiş bir parçasıdır. Mikro sivri uçlar 0,1-0,2 mikron kalınlığa ve 50 mikrona kadar uzunluğa sahiptir. Karşılaştırma için, bir insan kırmızı kan hücresinin çapının 7,3 mikron olduğunu unutmayın. Büyüme konisinin geniş ve düz alanı yaklaşık 5 µm genişliğe ve uzunluğa sahiptir. Mikro omurgalar arasındaki boşluklar katlanmış bir zarla kaplıdır.
Mikro sivri uçlar sürekli hareket halindedir. Bazıları koninin içine geri çekilir, diğerleri uzar, farklı yönlere sapar, alt tabakaya dokunur ve ona yapışabilir. Membranın katlanmış alanlarının hemen altında ve dikenlerde, bir nöronun gövdesine benzer şekilde, birbirine dolanmış aktin filamentleri, mitokondri, mikrotübüller ve nörofilamentlerden oluşan yoğun bir kütle bulunur.
Muhtemelen, mikrotübüller, nörofilamentler ve aktin filamentleri (aşağıya bakınız), esas olarak nöron sürecinin tabanında yeni sentezlenmiş alt birimlerin eklenmesi nedeniyle uzar. Olgun bir nörondaki yavaş akson taşıma hızına karşılık gelen, günde yaklaşık bir milimetre hızla hareket ederler. Görünüşe göre sonunda yeni membran malzemesi eklenir. Küçük zar vezikülleri, nöron süreci boyunca hücre gövdesinden büyüme konisine hızlı bir akson taşıma akışı ile taşınır. Membran materyali, görünüşe göre, nöronun gövdesinde sentezlenir, büyüme konisine veziküller şeklinde aktarılır ve burada ekzositoz yoluyla plazma zarına dahil edilir, böylece sinir hücresinin sürecini uzatır.
Aksonların ve dendritlerin büyümesi, genellikle olgunlaşmamış nöronların yerleştiği ve sinir ağlarında kendileri için kalıcı bir yer bulduğu bir nöronal göç aşaması ile başlar.
Bu notun algılayıcılar, Hopfield ağları veya başka herhangi bir yapay sinir ağı ile ilgili olmadığını hemen size bildireceğim. Sinir uyarılarının üretim ve yayılma süreçlerinin gerçekleştiği “gerçek”, “canlı” biyolojik bir sinir ağının çalışmasını simüle edeceğiz. İngiliz dili literatüründe, bu tür ağlara, yapay sinir ağlarından farkları nedeniyle, sivri sinir ağları denirken, Rus dili literatüründe yerleşik bir isim yoktur. Biri onlara sinir ağları diyor, biri onlara dürtüsel sinir ağları diyor ve birileri onlara ani ağlar diyor.Muhtemelen okuyucuların çoğu Avrupa Birliği tarafından desteklenen Mavi Beyin ve İnsan Beyin projelerini duymuştur, ikinci proje için AB hükümeti yaklaşık bir milyar avro ayırmıştır ki bu da bu alana büyük ilgi olduğunu göstermektedir. Her iki proje de birbiriyle yakından ilişkilidir ve birbiriyle kesişir, hatta birbirlerinden nasıl farklı oldukları konusunda biraz kafa karışıklığı yaratabilecek ortak bir lider olan Henry Markram'a sahiptirler. Kısacası, her iki projenin de nihai amacı, tümü ~ 86 milyar nöron olan tüm beynin bir modelini geliştirmektir. Mavi Beyin Projesi hesaplamalı kısımdır ve İnsan Beyni daha çok beynin prensipleri hakkında bilimsel veri toplamaya ve tek bir model oluşturmaya çalıştıkları temel bir kısımdır. Bu bilime dokunmak ve çok daha küçük ölçekte de olsa kendimiz benzer bir şey yapmaya çalışmak için bu not yazılmıştır.
Habré'de nörobiyoloji üzerine çok sayıda ilginç ve bilgilendirici makale var, bu çok sevindirici.
1. Nörobiyoloji ve yapay zeka: birinci bölüm - eğitim programı.
2. Nörobiyoloji ve yapay zeka: ikinci bölüm - zeka ve beyindeki bilginin temsili.
3. Nörobiyoloji ve yapay zeka: üçüncü bölüm - veri gösterimi ve hafıza
Ama onlar hesaplamalı sinirbilimi ya da başka bir deyişle, nöronların elektriksel aktivitesinin bilgisayar simülasyonunu içeren hesaplamalı sinirbilimi konularını ele almadılar, bu yüzden bu boşluğu doldurmaya karar verdim.
biraz biyoloji
Pirinç. 1 - Bir nöronun yapısının şematik gösterimi.
Modellemeye başlamadan önce, sinirbilimin bazı temellerine aşina olmamız gerekir. Tipik bir nöron 3 bölümden oluşur: vücut (soma), dendritler ve akson. Dendritler, diğer nöronlardan sinyaller alır (bu, nöronun girişidir) ve akson, nöronun gövdesinden sinyalleri diğer nöronlara iletir (çıktı). Bir nöronun aksonu ile diğer bir nöronun dendriti arasındaki temas noktasına sinaps denir. Dendritlerden alınan sinyal vücutta toplanır ve belirli bir eşiği aşarsa, bir sinir impulsu veya başka bir deyişle bir ani oluşur. Hücre gövdesi, iyi bir yalıtkan olan lipid bir zarla çevrilidir. Nöron sitoplazmasının ve hücreler arası sıvının iyonik bileşimleri farklıdır. Sitoplazmada, potasyum iyonlarının konsantrasyonu daha yüksektir ve sodyum ve klor konsantrasyonunun daha düşüktür, hücreler arası sıvıda ise bunun tersi doğrudur. Bunun nedeni, Adenozin TriPhosfat (ATP) moleküllerinde depolanan enerjiyi tüketirken belirli türdeki iyonları bir konsantrasyon gradyanına karşı sürekli olarak pompalayan iyon pompalarının çalışmasıdır. Bu pompaların en bilineni ve çalışılanı sodyum-potasyum pompasıdır. Dışarıya 3 sodyum iyonu getirir ve nöronun içine 2 potasyum iyonu alır. Şekil 2, nöronun iyon bileşimini göstermektedir ve iyon pompaları işaretlenmiştir. Bu pompaların çalışması sayesinde, zarın negatif yüklü iç tarafı ile pozitif yüklü dış tarafı arasında nöronda bir denge potansiyel farkı oluşur. 
Pirinç. 2 - Nöronun ve çevrenin iyonik bileşimi
Pompalara ek olarak, nöron yüzeyinde potansiyel değiştiğinde veya kimyasallara maruz kaldığında açılıp kapanabilen ve böylece belirli tip iyonların akımlarını artıran veya azaltan iyon kanalları da vardır. Membran potansiyeli belirli bir eşiği aşarsa sodyum kanalları açılır ve dışarıda daha fazla sodyum olduğu için nöronun içine yönlendirilmiş bir elektrik akımı belirir, bu da membran potansiyelini daha da artırır ve sodyum kanallarını daha da açarsa, zar potansiyelinde keskin bir artış olur. membran potansiyeli. Fizikçiler buna olumlu geribildirim diyorlar. Ancak, sodyum kanallarının açılması için eşik potansiyelinden daha yüksek bir potansiyel değerden başlayarak, potasyum iyonlarının dışa doğru akmaya başlaması nedeniyle potasyum kanalları da açılır, membran potansiyelini azaltır ve böylece onu denge değerine geri döndürür. İlk uyarılma sodyum kanalı açma eşiğinden daha az ise, nöron denge durumuna geri dönecektir. İlginç bir şekilde, üretilen darbenin genliği, uyarıcı akımın genliğine zayıf bir şekilde bağlıdır: bir darbe vardır veya yoktur, yasa “ya hep ya hiç”tir.
Bu arada, McCulloch ve Pitts'e yapay sinir ağları modelleri yaratma konusunda ilham veren "ya hep ya hiç" ilkesiydi. Ancak yapay sinir ağları alanı kendi yolunda gelişiyor ve asıl amacı, bunun canlı beyindeki bilgi işleme süreçleriyle nasıl ilişkili olduğuna bakılmaksızın, pratik problemlerin en uygun çözümüdür. Spike sinir ağları, gerçek beynin nasıl çalıştığının bir modelidir. Görsel görüntüleri tanımak için bir başak ağı oluşturabilirsiniz, ancak klasik sinir ağları pratik kullanım için daha uygundur, daha basittirler, bir bilgisayarda daha hızlıdırlar ve belirli pratik görevleri öğrenmeleri için birçok algoritma icat edilmiştir.
“Ya hep ya hiç” ilkesi Şekil 3'te açıkça gösterilmiştir. Aşağıda nöron zarının iç tarafına yönlendirilen giriş akımı, üstte ise zarın iç ve dış tarafları arasındaki potansiyel fark görülmektedir. Bu nedenle, yaşayan sinir ağlarında şu anda baskın olan kavrama göre, bilgi, dürtülerin meydana geldiği zamanda veya fizikçilerin söyleyeceği gibi faz modülasyonu ile kodlanır. 
Pirinç. 3 - Bir sinir impulsunun üretilmesi. Aşağıda pkA cinsinden hücreye verilen akım ve üstte mV cinsinden zar potansiyeli yer almaktadır.
Bir nöronu uyarmak, örneğin, içine bir mikro elektrot yerleştirip nöronun içine bir akım uygulayarak mümkündür, ancak canlı bir beyinde, uyarım genellikle sinaptik eylem yoluyla gerçekleşir. Daha önce de belirtildiği gibi, nöronlar, bir nöronun aksonunun diğerinin dendritleriyle temas noktalarında oluşan sinapslar kullanılarak birbirine bağlanır. Sinyalin geldiği nörona presinaptik, sinyalin gittiği nörona ise postsinaptik denir. Presinaptik bir nöronda bir dürtü meydana geldiğinde, sinaptik aralığa nörotransmiterler bırakır, bu da postsinaptik nöronda sodyum kanallarını açar ve daha sonra yukarıda açıklanan olaylar zinciri meydana gelir ve uyarıma yol açar. Uyarılmaya ek olarak, nöronlar birbirlerini de inhibe edebilir. Presinaptik nöron inhibitör ise, o zaman sinaptik aralığa klorür kanallarını açan bir inhibitör nörotransmiter salacaktır ve dışarıda daha fazla klor bulunduğundan, klor nöronun içine akar ve bu da zarın iç tarafında negatif bir yükün oluşmasına neden olur. artışı (sodyum ve potasyumdan farklı olarak klorür iyonlarının negatif yüklü olduğunu unutmayın), nöronu daha da inaktif bir duruma sokar. Bu durumda, nöronu uyarmak daha zordur.
Bir nöronun matematiksel modeli
Yukarıda açıklanan nöron işleminin dinamik mekanizmaları temelinde matematiksel modeli derlenebilir. Şu anda, nöronun bir kapasitör ve direnç olarak temsil edildiği Inregrate ve Fire gibi çeşitli nispeten basit modeller ve ayrıca Hodgkin-Huxley modeli gibi daha karmaşık, biyolojik olarak makul modeller oluşturulmuştur. hesaplama açısından çok daha karmaşık ve dinamiklerini analiz etme açısından, ancak bir nöronun zar potansiyelinin dinamiklerini çok daha doğru bir şekilde tanımlar. Bu yazıda, hesaplama karmaşıklığı ile biyofiziksel akla yatkınlık arasında bir uzlaşma olan Izhikevich modelini kullanacağız. Hesaplama basitliğine rağmen, bu model gerçek nöronlarda meydana gelen çok sayıda fenomeni yeniden üretebilir. Izhikevich modeli bir diferansiyel denklem sistemi olarak verilmiştir (Şekil 4).
Pirinç. 4 - Izhikevich modeli
Neresi a,b,c,d,k,cmçeşitli nöron parametreleri. sanal makine zarın içi ve dışı arasındaki potansiyel farktır ve um yardımcı değişkendir. ben harici doğrudan uygulanan akımdır. Bu modelde, nöronların karakteristik özellikleri şu şekilde gözlemlenir: tek bir harici akım darbesine yanıt olarak sivri uç oluşumu ve nörona sabit bir dış akım uygulandığında belirli bir frekansta bir dizi sivri uç oluşumu. Işın- bu nöronun bağlı olduğu tüm nöronlardan gelen sinaptik akımların toplamı.
Presinaptik nöronda bir sivri uç üretilirse, postsinaptik nöronda sinaptik akımda bir sıçrama meydana gelir ve karakteristik bir zamanla katlanarak bozulur.
Gelelim kodlamaya
Böylece, en ilginç olana geçiyoruz. Bilgisayarda sanal bir sinir dokusu parçasını kodlamanın zamanı geldi. Bunu yapmak için, bir nöronun zar potansiyelinin dinamiklerini tanımlayan bir diferansiyel denklem sistemini sayısal olarak çözeceğiz. Entegrasyon için Euler yöntemini kullanacağız. Biz C++ ile kodlayacağız, Matplolib kütüphanesini kullanarak Python ile yazılmış scriptleri kullanarak çizeceğiz ama Python'u olmayanlar Excel kullanarak çizebilir.İki boyutlu dizilere ihtiyacımız var Vms, Ums boyutlar Tsim*Neur Her bir nöronun zar potansiyellerini ve yardımcı değişkenlerini zamanın her anında depolamak, Tsim sayımlardaki simülasyon süresidir ve sinir ağdaki nöron sayısı.
İlişkiler iki dizi şeklinde saklanacak pre_con ve post_con boyutlar Ncon, burada indeksler bağlantı sayısıdır ve değerler presinaptik ve postsinaptik nöronların indeksleridir. Ncon- bağlantı sayısı.
Ayrıca her sinapsın üstel olarak azalan postsinaptik akımını modüle eden bir değişkeni temsil edecek bir diziye ihtiyacımız var, bunun için bir dizi oluşturuyoruz y boyutlar Ncon*Tsim.
Sabit kayan nokta h = .5f; // ms'de entegrasyon zaman adımı const int Tsim = 1000/.5f; // ayrık örneklerde simülasyon süresi const int Nexc = 100; // Uyarıcı nöron sayısı const int Ninh = 25; // Engelleyici nöronların sayısı const int Nneur = Nexc + Ninh; const int Ncon = Nneur*Nneur*0.1f; // Bağlantı sayısı, 0,1 rastgele 2 nöron arasındaki bağlantı olasılığıdır float Vms; // zar potansiyelleri yüzer Ums; // Izhikevich modelinin yardımcı değişkenleri float Iex; // nöron şamandırasına uygulanan dış doğru akım Isyn; // nöron başına sinaptik akım int pre_conns; // presinaptik nöronların indeksleri int post_conns; // postsinaptik nöronların indeksleri ağırlıkları yüzer; // bağlantı ağırlıkları yüzer y; // sinaps öncesi kayan noktadaki ani yükselmelere bağlı olarak değişken modülasyonlu sinaptik akım psc_excxpire_time = 4.0f; // postsinaptik akımın karakteristik bozulma süresi, ms float minWeight = 50.0f; // ağırlıklar, pkA boyutu float maxWeight = 100.0f; // Nöron parametreleri float Iex_max = 40.0f; // nörona uygulanan maksimum akım 50 pA float a = 0.02f; kayan nokta b = 0.5f; kayan nokta c = -40.0f; // ani şamandıradan sonra sıfırlandığı membran potansiyelinin değeri d = 100.0f; kayan nokta k = 0.5f; yüzer Vr = -60.0f; kayan nokta Vt = -45.0f; kayan nokta Vtepe = 35.0f; // şamandıra V0 = -60.0f ile değere sıfırlamanın yapıldığı membran potansiyelinin maksimum değeri; // membran potansiyeli şamandırası için başlangıç değeri U0 = 0.0f; // yardımcı değişken float için başlangıç değeri Cm = 50.0f; // bir nöronun elektrik kapasitansı, pcF boyutu
Daha önce bahsedildiği gibi, bilgi, uyarıların meydana geldiği zamanda kodlanır, bu yüzden onların meydana gelme zamanlarını ve kaynaklandıkları nöronların indekslerini depolamak için diziler yaratırız. Daha sonra görselleştirme amacıyla bir dosyaya yazılabilirler.
Float spike_times; // ani artışların meydana geldiği zamanlar int spike_neurons; // ani artışların meydana geldiği nöronların indeksleri int spike_num = 0; // başak numarası
Bağlantıları rastgele dağıtır ve ağırlıkları belirleriz.
Void init_connections()( for (int con_idx = 0; con_idx)< Ncon;){
// случайно выбираем постсипантические и пресинаптические нейроны
pre_conns = rand() % Nneur;
post_conns = rand() % Nneur;
weights = (rand() % ((int)(maxWeight - minWeight)*10))/10.0f + minWeight;
if (pre_conns >= Nexc)( // eğer presinaptik nöron inhibitör ise, bağlantı ağırlığı eksi işaret ağırlıkları = -ağırlıklar; ) con_idx++; ))
Nöronlar için başlangıç koşullarının ayarlanması ve uygulanan harici akımın rastgele atanması. Dış akımın ani oluşturma eşiğini aştığı nöronlar, sabit bir frekansta ani yükselmeler üretecektir.
Void init_neurons()( için (int neur_idx = 0; neur_idx)< Nneur; neur_idx++){
// случайно разбрасываем приложенные токи
Iex = (rand() % (int) (Iex_max*10))/10.0f;
Isyn = 0.0f;
Vms = V0;
Ums = U0;
}
}
Programın ana kısmı, Izhikevich modelinin entegrasyonu ile.
Float izhik_Vm(int nöron, int zaman)( dönüş (k*(Vms - Vr)*(Vms - Vt) - Ums + Iex + Isyn)/Cm; ) float izhik_Um(int nöron, int zaman)( return a*( b*(Vms - Vr) - Ums); ) int main()( init_connections(); init_neurons(); float süresi_katsayı = exp(-h/psc_excxpire_time); // için katlanarak azalan akım için (int t = 1; t< Tsim; t++){
// проходим по всем нейронам
for (int neur = 0; neur < Nneur; neur++){
Vms[t] = Vms + h*izhik_Vm(neur, t-1);
Ums[t] = Ums + h*izhik_Um(neur, t-1);
Isyn = 0.0f;
if (Vms >Vpeak)( Vms[t] = c; Ums[t] = Ums + d; spike_times = t*h; spike_neurons = neur; spike_num++; ) ) // (int con = 0; con için tüm bağlantılar boyunca yinelenir)< Ncon; con++){
y[t] = y*expire_coeff;
if (Vms] >Vpeak)( y[t] = 1.0f; ) Isyn] += y[t]*ağırlıklar; ) save2file(); 0 döndür; )
Kodun tam metni indirilebilir
Bu cihazlardan biri (aşağıdaki fotoğrafta gösterilmiştir) beynin alnın arkasında bulunan bölgelerini uyarır. Dikkatten sorumludurlar.
Laboratuvar koşulları altında, bu tür bir stimülasyon bir seferde 20 dakikadan fazla sürmez. Ayrıca, yalnızca daha önce sıkı bir tıbbi muayeneden geçen kişilerin deneye katılmasına izin verilir.
Sonunda, deneklerin beyinleri, bilim adamlarının beklenmedik sonuçlar üretebileceğini söylediği bir cihaza tabi tutulur. Örneğin, beynin diğer bölümlerine bir etki veya elektrotların polaritesindeki bir değişiklik, bir kişiye yalnızca yardımcı olmakla kalmaz, tam tersine zarar verebilir.
Kendinize zarar verebilirsiniz. Oxford Üniversitesi'ndeki bilim adamları, bu yöntemi doğru kullanmayı bilmek, doğru zamanı ve akımın gücünü seçmenin önemli olduğu konusunda uyarıyor.
Swansea Üniversitesi'nden meslektaşları onlarla aynı fikirde. Onlara göre, elektriksel beyin uyarıcıları, kasılmalara ve ruh hali değişimlerine neden olabilir. Yüksek risk grubu, beyin gelişiminin en verimli dönemi olan 20 yaşın altındaki insanları içerir.
Ancak hepsinden önemlisi, bilim adamları, teknik olarak yetenekli birçok çocuğun bu tür aletleri kendi elleriyle bir araya getirmesinden endişe duyuyorlar. Reddit.com forumunda, TDCS tedavisi ile beyin stimülasyonundan sonra "yanmış kafa derisi" ve "öfke patlamaları"ndan şikayet eden gönderiler bulabilirsiniz. 
Bu, öngörülen dozaj aşıldığında meydana gelebilir. Swansea Üniversitesi'nden araştırmacı Nick Davies, hastaların aksine sıradan insanların olası risklerin daha az farkında olduklarını söylüyor.
Pazarlama bilimin önündedir
Oxford bilim adamları, elektriksel beyin uyarıcıları üzerinde daha fazla kontrol için çağrıda bulunuyorlar. Bazı şirketler, uygun kayıt ve kontrole tabi tıbbi ürünler olmalarına rağmen, bu gadget'ları oyun olarak konumlandırıyor.
Bilim adamları, bilişsel geliştirme cihazlarına erişimi yasaklamak veya kısıtlamak istemiyorlar. Kullanıcıların, potansiyel ödülleri elde etmek için hangi riskleri almaları gerektiğini bilmelerini isterler.
Bir başka endişe de, teknolojinin henüz ticari kullanıma hazır olmamasıdır. Yale Üniversitesi'nden sinir bilimci Steven Novell'e göre, şirketler genellikle test edilmemiş teknolojileri laboratuvardan çıkarır ve onları "seksi" olarak adlandırarak pazara sunmaya çalışır.
Tıbbi işlevi olan herhangi bir cihaz buna göre düzenlenmelidir. Novella, “Bizi araştırmaya zaman ve para harcamaya motive eden tek şey düzenlemelerdir” diyor.
Bilim adamlarına göre, teknolojiye olan ilgi yalnızca artacak. Ancak daha fazla araştırma yapılana kadar elektrikli beyin uyarıcılarının dikkatli kullanılmasını tavsiye ediyorlar.
BBC.com'dan alınmıştır
"bio/mol/text" yarışması için makale: Nöronlar arasında bilgi alışverişini sağlayan hücresel süreçler çok fazla enerji gerektirir. Evrim sürecinde, yüksek güç tüketimi, bilgilerin kodlanması ve iletilmesi için en verimli mekanizmaların seçimine katkıda bulunmuştur. Bu makalede, beyin enerjisi çalışmasına teorik yaklaşım, patoloji araştırmalarındaki rolü, hangi nöronların daha gelişmiş olduğu, sinapsların neden bazen “ateşlememesi” için yararlı olduğu ve ayrıca nasıl seçildiklerini öğreneceksiniz. sadece bir nöronun ihtiyaç duyduğu bilgi.
Yarışmanın genel sponsoru şirkettir: biyolojik araştırma ve üretim için en büyük ekipman, reaktifler ve sarf malzemeleri tedarikçisi.

İzleyici Ödülü'nün sponsoru ve "Biomedicine Today and Tomorrow" adaylığının ortağı "Invitro" şirketiydi.

Yarışmanın "Kitap" sponsoru - "Alpina kurgu dışı"
yaklaşımın kökeni
20. yüzyılın ortalarından beri, beynin tüm organizmanın enerji kaynaklarının önemli bir bölümünü tükettiği bilinmektedir: daha yüksek bir primat durumunda tüm glikozun dörtte biri ve tüm oksijenin ⅕. Bu, Massachusetts Teknoloji Enstitüsü'nden (ABD) William Levy ve Robert Baxter'a biyolojik sinir ağlarında bilgi kodlamasının enerji verimliliğinin teorik bir analizini yapma konusunda ilham verdi (Şekil 1). Çalışma aşağıdaki hipoteze dayanmaktadır. Beynin enerji tüketimi yüksek olduğu için, en verimli şekilde çalışan bu tür nöronlara sahip olmak faydalıdır - yalnızca yararlı bilgileri iletir ve en az miktarda enerji harcarlar.
Bu varsayımın doğru olduğu ortaya çıktı: basit bir sinir ağı modelinde, yazarlar bazı parametrelerin deneysel olarak ölçülen değerlerini yeniden üretti. Özellikle, onlar tarafından hesaplanan optimal dürtü oluşturma sıklığı, 6 ila 43 darbe/s arasında değişir - neredeyse hipokampus tabanının nöronlarında olduğu gibi. Darbe frekansına göre iki gruba ayrılabilirler: yavaş (~10 darbe/s) ve hızlı (~40 darbe/s). Aynı zamanda, ilk grup, ikinciden önemli ölçüde daha fazladır. Benzer bir tablo serebral kortekste de gözlenir: Hızlı inhibitör internöronlardan (>100 pals/sn) birkaç kat daha fazla yavaş piramidal nöron (~4-9 puls/s) vardır. Yani, görünüşe göre, beyin tüm kaynakları tüketmemek için daha az hızlı ve enerji tüketen nöronları kullanmayı “tercih ediyor”.

Şekil 1. İki nöron gösterilmiştir. onlardan birinde mor presinaptik protein sinaptofizin boyanmıştır. Başka bir nöron tamamen renklidir. yeşil floresan proteini. Küçük ışık noktaları- nöronlar arasındaki sinaptik temaslar. Ekte, bir "leke" daha yakından sunulmaktadır.
Sinapslarla birbirine bağlanan nöron gruplarına ne ad verilir? nöral ağlar, . Örneğin, serebral kortekste piramidal nöronlar ve internöronlar geniş ağlar oluşturur. Bu hücrelerin iyi koordine edilmiş "konser" çalışması, daha yüksek bilişsel ve diğer yeteneklerimizi belirler. Benzer ağlar, yalnızca diğer nöron türlerinden beyne dağılır, belirli bir şekilde birbirine bağlanır ve tüm organın çalışmasını düzenler.
internöronlar nelerdir?
Merkezi sinir sisteminin nöronları ikiye ayrılır. Etkinleştiriliyor (sinapsları aktive eder) ve engelleyici (inhibitör sinapslar oluşturur). İkincisi büyük ölçüde temsil edilir ara nöronlar veya ara nöronlar. Serebral korteks ve hipokampusta, diğer nöronların koordineli, senkronize çalışmasını sağlayan beyin gama ritimlerinin oluşumundan sorumludurlar. Bu, motor fonksiyonlar, duyusal bilgilerin algılanması, hafıza oluşumu için son derece önemlidir.
Optimum bulmak
Aslında, bir optimizasyon probleminden bahsediyoruz: bir fonksiyonun maksimumunu bulmak ve elde edildiği parametreleri belirlemek. Bizim durumumuzda fonksiyon, faydalı bilgi miktarının enerji maliyetlerine oranıdır. Yararlı bilgi miktarı, bilgi teorisinde yaygın olarak kullanılan Shannon formülü kullanılarak kabaca hesaplanabilir. Enerji maliyetlerini hesaplamak için iki yöntem vardır ve her ikisi de makul sonuçlar verir. Bunlardan biri - "iyon sayma yöntemi" - belirli bir sinyal olayı sırasında nöronun içine giren Na + iyonlarının sayısını saymaya dayanır (PD veya PSP, bkz. kenar çubuğu " aksiyon potansiyeli nedir”) ardından molekül sayısına dönüşüm adenozin trifosfat (ATP), hücrelerin ana enerji "para birimi". İkincisi, elektronik yasalarına göre zardan geçen iyon akımlarının tanımına dayanır ve nöronun eşdeğer elektrik devresinin gücünü hesaplamanıza izin verir, bu daha sonra ATP maliyetlerine dönüştürülür.
Bu "optimal" parametre değerlerinin daha sonra deneysel olarak ölçülenlerle karşılaştırılması ve ne kadar farklı olduklarının belirlenmesi gerekir. Farklılıkların genel resmi, dereceyi gösterecektir. optimizasyon belirli bir nöronun bir bütün olarak: ne kadar gerçek, deneysel olarak ölçülen, parametrelerin değerleri hesaplananlarla çakışıyor. Farklar ne kadar zayıfsa, nöron optimuma o kadar yakındır ve enerjik olarak daha verimli ve optimal çalışır. Öte yandan, belirli parametrelerin bir karşılaştırması, bu nöronun hangi spesifik kapasitede “ideal” e yakın olduğunu gösterecektir.
Ayrıca, nöronların enerji verimliliği bağlamında, beyindeki bilgilerin kodlanması ve iletilmesinin dayandığı iki süreç göz önünde bulundurulur. Bu, bilginin aktarılabileceği bir sinir impulsu veya aksiyon potansiyelidir. gönderilmiş"muhatap" belirli bir mesafede (mikrometreden bir buçuk metreye kadar) ve fiilin altında yatan sinaptik iletim bulaşma bir nörondan diğerine sinyal gönderir.
Aksiyon potansiyeli
Aksiyon potansiyeli (PD) nöronların birbirine gönderdiği bir sinyaldir. PD farklıdır: hızlı ve yavaş, küçük ve büyük. Genellikle uzun dizilerde (kelimelerdeki harfler gibi) veya kısa yüksek frekanslı "paketlerde" düzenlenirler (Şekil 2).

Şekil 2. Farklı nöron türleri farklı sinyaller üretir. Merkezinde- bir memelinin beyninin uzunlamasına bölümü. Ekler, elektrofizyoloji yöntemleriyle kaydedilen farklı sinyal türlerini gösterir. a - Kortikal ( Beyin zarı) piramidal nöronlar düşük frekanslı sinyaller olarak iletebilir ( düzenli ateşleme) ve kısa patlama veya patlama sinyalleri ( seri atış). b - Beyincik Purkinje hücreleri için ( Beyincik) sadece çok yüksek bir frekansta patlama aktivitesi ile karakterize edilir. içinde - Talamusun röle nöronları ( Talamus) iki aktivite modu vardır: patlama ve tonik ( tonik ateşleme). G - Tasmanın orta kısmının nöronları ( MHb, orta habenula) epithalamus, düşük frekanslı tonik sinyaller üretir.
Aksiyon potansiyeli nedir?
- membran ve iyonlar. Nöronun plazma zarı, hücre ile hücre dışı ortam arasında eşit olmayan bir madde dağılımı sağlar (Şekil 3). b) . Bu maddeler arasında, PD'yi tanımlamak için K+ ve Na+'nın önemli olduğu küçük iyonlar da vardır.
Hücrenin içinde çok az Na + iyonu vardır, ancak dışarıda çok fazladır. Bu nedenle sürekli kafese girmeye çalışırlar. Aksine hücrenin içinde çok sayıda K+ iyonu bulunur ve hücre dışına çıkmak için uğraşırlar. İyonlar bunu kendi başlarına yapamazlar çünkü zar onlar için geçirimsizdir. İyonların zardan geçişi için özel proteinlerin açılması gerekir - iyon kanalları membranlar. - iyon kanalları. Kanal çeşitliliği çok fazla. Bazıları zar potansiyelindeki bir değişikliğe yanıt olarak açılır, diğerleri - bir ligand (örneğin bir sinapstaki bir nörotransmitter) bağlandığında, diğerleri - zardaki mekanik değişikliklerin bir sonucu olarak vb. Kanalın açılması, yapısının değişmesinden oluşur, bunun sonucunda iyonlar içinden geçebilir. Bazı kanallar yalnızca belirli bir iyon tipini geçirirken, diğerleri karışık iletkenlik ile karakterize edilir.
Membran potansiyelini "hisseden" kanallar, AP üretiminde önemli bir rol oynar - potansiyel bağımlı iyon kanalları. Membran potansiyelindeki değişikliklere yanıt olarak açılırlar. Bunların arasında sadece Na+ iyonlarının geçmesine izin veren voltaj bağımlı sodyum kanalları (Na kanalları) ve sadece K+ iyonlarının geçmesine izin veren voltaja bağlı potasyum kanalları (K kanalları) ile ilgileniyoruz. - İyonik akım ve PD. PD'nin temeli iyon akımıdır - iyonların zarın iyon kanalları boyunca hareketi. İyonlar yüklü olduğundan, akımları nöronun içindeki ve dışındaki toplam yükte bir değişikliğe yol açar ve bu da hemen zar potansiyelinde bir değişikliğe neden olur.
AP üretimi, kural olarak, aksonun ilk bölümünde meydana gelir - bunun nöron gövdesine bitişik olan kısmında, . Burada yoğunlaşan birçok Na-kanalı vardır. Açılırlarsa, güçlü bir Na + iyonu akımı aksona akar ve depolarizasyon membranlar - mutlak değerde membran potansiyelinde bir azalma (Şekil 3 içinde). Ardından, orijinal değerine geri dönmeniz gerekir - repolarizasyon. K+ iyonları bundan sorumludur. K kanalları açıldığında (AP maksimumdan kısa bir süre önce), K+ iyonları hücreyi terk etmeye ve zarı repolarize etmeye başlar.
Depolarizasyon ve repolarizasyon, PD'nin iki ana aşamasıdır. Bunlara ek olarak, gereklilik olmadığı için burada dikkate alınmayan birkaç tane daha var. PD neslinin ayrıntılı bir açıklaması, içinde bulunabilir. PD'nin kısa bir açıklaması da "Biomolecule" ile ilgili makalelerde yer almaktadır. - İlk akson segmenti ve AP başlatma. Aksonun ilk segmentinde Na kanallarının açılmasına ne yol açar? Yine, nöronun dendritleri boyunca "gelen" zar potansiyelindeki değişiklik (Şekil 3 a). BT - postsinaptik potansiyeller (PSP) sinaptik iletimden kaynaklanır. Bu süreç ana metinde daha ayrıntılı olarak açıklanmaktadır.
- PD yürütmek. Yakındaki Na kanalları, aksonun ilk bölümünde AP'ye kayıtsız olmayacaktır. Onlar da AP'yi tetikleyecek olan membran potansiyelindeki bu değişikliğe yanıt olarak açılacaktır. İkincisi, aksonun bir sonraki bölümünde, nöron gövdesinden daha uzakta, vb. benzer bir "reaksiyona" neden olacaktır. Bu şekilde olur iletken akson boyunca PD, . Sonunda presinaptik sonlarına ulaşacaktır ( kıpkırmızı oklar incirde. 3 a) burada sinaptik iletimi tetikleyebilir.
- AP üretimi için enerji tüketimi, sinapsların çalışmasından daha azdır. Ana enerji "para birimi" olan adenosin trifosfatın (ATP) kaç molekülü PD'nin maliyetidir? Bir tahmine göre, sıçan serebral korteksindeki piramidal nöronlar için saniyede 4 AP üretmek için enerji tüketimi, nöronun toplam enerji tüketiminin yaklaşık ⅕'sidir. Diğer sinyalleşme süreçlerini, özellikle sinaptik iletimi hesaba katarsak, oran ⅘ olacaktır. Motor işlevlerden sorumlu olan serebellar korteks için durum benzerdir: bir çıkış sinyali oluşturmak için enerji tüketimi, hepsinin %15'idir ve yaklaşık yarısı giriş bilgilerinin işlenmesi içindir. Dolayısıyla, PD en çok enerji tüketen süreç olmaktan uzaktır. Sinapsın çalışması için bazen daha fazla enerji gerekir. Ancak bu, PD üretim sürecinin enerji verimliliği özellikleri göstermediği anlamına gelmez.

Şekil 3. Nöron, iyon kanalları ve aksiyon potansiyeli. a - Sıçan beyin korteksindeki şamdan hücresinin yeniden yapılandırılması. mavi nöronun dendritler ve gövdesi boyanır (ortada mavi nokta), kırmızı- akson (birçok nöron türünde akson, dendritlerden çok daha fazla dallıdır). Yeşillik ve kıpkırmızı oklar bilgi akışının yönünü gösterir: nöronun dendritler ve gövdesi onu alır, akson onu diğer nöronlara gönderir. b - Bir nöronun zarı, diğer herhangi bir hücre gibi, iyon kanalları içerir. Yeşil kupalar- Na + iyonları, mavi- K + iyonları. içinde - Purkinje nöronu tarafından bir aksiyon potansiyelinin (AP) üretilmesi sırasında zar potansiyelindeki değişiklikler. yeşil alan: Na kanalları açılır, Na+ iyonları nörona girer, depolarizasyon meydana gelir. Mavi alan: K kanalları açılır, K+ çıkar, repolarizasyon oluşur. Yeşil ve mavi bölgelerin örtüşmesi, Na +'nın girdiği ve K +'nın aynı anda çıktığı döneme karşılık gelir.
PD, membran potansiyelindeki genlik sıçraması benzeri değişiklikte nispeten güçlüdür.
Farklı nöron türlerinin analizi (Şekil 4), omurgasız nöronların çok enerji verimli olmadığını ve bazı omurgalı nöronlarının neredeyse mükemmel olduğunu gösterdi. Bu çalışmanın sonuçlarına göre, hafıza ve duyguların oluşumunda yer alan hipokampal internöronların yanı sıra talamustan serebral kortekse duyusal bilginin ana akışını taşıyan talamokortikal röle nöronlarının en fazla enerji olduğu ortaya çıktı. verimli.

Şekil 4. Farklı nöronlar farklı şekillerde verimlidir.Şekil, farklı nöron türlerinin enerji tüketiminin bir karşılaştırmasını göstermektedir. Modellerde enerji tüketimi, parametrelerin başlangıç (gerçek) değerleri ile hesaplanmaktadır ( siyah sütunlar) ve bir yandan nöronun atanan işlevini yerine getirdiği, diğer yandan minimum enerji harcadığı optimal olanlarla ( gri çubuklar). Sunulanlardan en etkilisinin iki tür omurgalı nöron olduğu ortaya çıktı: hipokampal internöronlar ( sıçan hipokampal internöron, RHI) ve talamokortikal nöronlar ( fare talamokortikal röle hücresi, MTCR), çünkü onlar için orijinal modeldeki enerji tüketimi, optimize edilmiş olanın enerji tüketimine en yakın olanıdır. Buna karşılık, omurgasız nöronlar daha az verimlidir. Efsane: SA (kalamar akson) - dev kalamar akson; CA (yengeç akson) - yengeç aksonu; MFS (fare hızlı başak kortikal interneuron) - hızlı kortikal fare internöronu; BK (bal arısı mantarı gövdesi Kenyon hücresi) arının mantar şeklindeki Kenyon hücresidir.
Neden daha verimliler? Çünkü Na- ve K-akımlarının çok az örtüşmesi vardır. PD üretimi sırasında her zaman bu akımların aynı anda mevcut olduğu bir zaman periyodu vardır (Şekil 3 içinde). Bu durumda, pratikte yük transferi yoktur ve membran potansiyelindeki değişim minimumdur. Ancak her halükarda, bu dönemdeki “işe yaramazlıklarına” rağmen, bu akımların “ödemesi” gerekir. Bu nedenle süresi, ne kadar enerji kaynağının boşa harcandığını belirler. Ne kadar kısa olursa, enerji kullanımı o kadar verimli olur. Ne kadar uzun, o kadar az etkili. Sadece yukarıda bahsedilen iki nöron tipinde hızlı iyon kanalları sayesinde bu süre çok kısadır ve PD'ler en etkili olanıdır.
Bu arada, internöronlar beyindeki diğer nöronların çoğundan çok daha aktiftir. Aynı zamanda, küçük yerel ağlar oluşturdukları nöronların koordineli, senkronize çalışması için son derece önemlidir. Muhtemelen, internöronların AP'sinin yüksek enerji verimliliği, diğer nöronların çalışmalarını koordine etmedeki yüksek aktivitelerine ve rollerine bir tür adaptasyondur.
sinaps
Bir nörondan diğerine sinyal iletimi, nöronlar arasında özel bir temasta gerçekleşir. sinaps . sadece dikkate alacağız kimyasal sinapslar (biraz daha var mı elektriksel), sinir sisteminde çok yaygın oldukları ve hücresel metabolizmanın düzenlenmesi, besin dağıtımı için önemli oldukları için.
Aksonun presinaptik ucunda, AP, bir nörotransmiterin hücre dışı ortama - alıcı nörona - salınmasına neden olur. İkincisi sadece bunu dört gözle bekliyor: dendritik zarda, reseptörler - belirli bir tipteki iyon kanalları - nörotransmitteri bağlar, açar ve çeşitli iyonların geçmesine izin verir. Bu, küçük bir neslin oluşmasına neden olur. postsinaptik potansiyel(PSP) dendrit zarı üzerinde. AP'ye benzer, ancak genlik olarak çok daha küçüktür ve diğer kanalların açılması nedeniyle oluşur. Her biri kendi sinapslarından gelen bu küçük PSP'lerin çoğu, dendritik zar boyunca nöronun gövdesine "aşılır" ( yeşil oklar incirde. 3 a) ve Na kanallarının açılmasına neden oldukları ve onu AP üretmeye “provokasyon” yaptıkları aksonun ilk segmentine ulaşırlar.
Bu tür sinapslara denir heyecan verici : nöronun aktivasyonuna ve AP oluşumuna katkıda bulunurlar. Ayrıca orada engelleyici sinapslar. Aksine, inhibisyona katkıda bulunurlar ve AP oluşumunu engellerler. Genellikle aynı nöronda her iki sinaps da bulunur. İnhibisyon ve uyarma arasında belirli bir ilişki, beynin normal işleyişi, daha yüksek bilişsel işlevlere eşlik eden beyin ritimlerinin oluşumu için önemlidir.
İşin garibi, bir nörotransmitterin sinapsta salınması hiç gerçekleşmeyebilir - bu olasılıksal bir süreçtir. Nöronlar bu şekilde enerji tasarrufu sağlar: sinaptik iletim, nöronların tüm enerji tüketiminin yaklaşık yarısını zaten belirler. Sinapslar her zaman ateşlenirse, tüm enerji onları çalıştırmak için harcanır ve diğer süreçler için kaynak kalmaz. Ayrıca, sinapsların en yüksek enerji verimliliğine tekabül eden nörotransmitter salınımının düşük olasılığıdır (%20-40). Bu durumda faydalı bilgi miktarının harcanan enerjiye oranı maksimumdur, . Böylece, “başarısızlıkların” sinapsların ve buna bağlı olarak tüm beynin çalışmasında önemli bir rol oynadığı ortaya çıkıyor. Ve bazen "çalışmayan" sinapslarla sinyal iletimi konusunda endişelenmenize gerek yok, çünkü genellikle nöronlar arasında çok sayıda sinaps bulunur ve bunlardan en az biri işe yarar.
Sinaptik iletimin bir başka özelliği de, gelen sinyalin modülasyon frekansına (kabaca söylemek gerekirse, gelen AP'lerin frekansına) göre genel bilgi akışının ayrı bileşenlere bölünmesidir. Bunun nedeni, postsinaptik zar üzerindeki farklı reseptörlerin kombinasyonudur. Bazı reseptörler çok hızlı etkinleştirilir: örneğin, AMPA reseptörleri (AMPA, α-'den gelir a mino-3-hidroksi-5- m etil-4-izoksazol p ropionik a cid). Postsinaptik nöronda sadece bu tür reseptörler varsa, yüksek frekanslı bir sinyali açıkça algılayabilir (örneğin, Şekil 2'deki gibi). içinde). En açık örnek, ses kaynağının yerini belirlemede ve konuşmada yaygın olarak temsil edilen tıklamalar gibi kısa sesleri doğru bir şekilde tanımada yer alan işitsel sistem nöronlarıdır. NMDA reseptörleri (NMDA - N -m etil- D -a spartat) daha yavaştır. Nöronların daha düşük frekanslı sinyalleri seçmesine izin verirler (Şekil 2 G), yüksek frekanslı AP serisini birleşik bir şey olarak algılamanın yanı sıra - sözde sinaptik sinyallerin entegrasyonu. Hatta daha yavaş metabotropik reseptörler vardır, bunlar bir nörotransmitere bağlanırken çok çeşitli hücresel süreçleri ayarlamak için hücre içi "ikinci haberciler" zincirine bir sinyal iletir. Örneğin, G-proteini ile ilişkili reseptörler yaygındır. Türüne bağlı olarak, örneğin, zardaki kanal sayısını düzenlerler veya çalışmalarını doğrudan modüle ederler.
Hızlı AMPA-, daha yavaş NMDA- ve metabotropik reseptörlerin çeşitli kombinasyonları, nöronların, işlevleri için önemli olan kendileri için en yararlı bilgiyi seçmesine ve kullanmasına izin verir. Ve "işe yaramaz" bilgi elenir, nöron tarafından "algılanmaz". Bu durumda, gereksiz bilgileri işlemek için enerji harcamanız gerekmez. Bu, nöronlar arasındaki sinaptik iletimi optimize etmenin başka bir yönüdür.
Başka?
Beyin hücrelerinin enerji verimliliği de morfolojileriyle bağlantılı olarak incelenir. Araştırmalar, dendritik ve akson dallanmasının kaotik olmadığını ve ayrıca enerji tasarrufu sağladığını gösteriyor. Örneğin akson, AP'nin geçtiği yolun toplam uzunluğu en küçük olacak şekilde dallanır. Bu durumda, akson boyunca AP iletmek için enerji tüketimi minimumdur.
Bir nöronun enerji tüketiminde bir azalma, belirli bir inhibitör ve uyarıcı sinaps oranıyla da elde edilir. Bu doğrudan ilişkilidir, örneğin, iskemi(damarlardaki bozulmuş kan akışının neden olduğu patolojik bir durum). Bu patolojide, büyük olasılıkla, metabolik olarak en aktif nöronlar ilk başarısız olanlardır. Kortekste, diğer birçok piramidal nöron üzerinde inhibitör sinapslar oluşturan inhibitör internöronlar tarafından temsil edilirler. Ara nöronların ölümü sonucunda piramidal inhibisyon azalır. Sonuç olarak, ikincisinin genel aktivite seviyesi artar (sinapsları aktive etmek daha sık ateşlenir, AP'ler daha sık üretilir). Bunu hemen, iskemi koşulları altında nöronların ölümüne yol açabilecek enerji tüketimlerinde bir artış izler.
Patolojileri incelerken, en çok enerji tüketen süreç olarak sinaptik iletime de dikkat edilir. Örneğin Parkinson, Huntington, Alzheimer hastalıklarında ATP sentezinde büyük rol oynayan mitokondri sinapslarında bir arıza veya taşınma söz konusudur. Parkinson hastalığı durumunda, bu, motor fonksiyonların ve kas tonusunun düzenlenmesi için önemli olan substantia nigra'nın yüksek düzeyde enerji tüketen nöronlarının bozulması ve ölümüne bağlı olabilir. Huntington hastalığında, mutant protein Huntingtin, yeni mitokondrilerin sinapslara teslim mekanizmalarını bozar, bu da ikincisinin "enerji açlığına", nöronların artan savunmasızlığına ve aşırı aktivasyona yol açar. Bütün bunlar, nöronların çalışmasının daha da bozulmasına, ardından striatum ve serebral korteksin atrofisine neden olabilir. Alzheimer hastalığında, amiloid plaklarının birikmesi nedeniyle mitokondrinin bozulması (sinaps sayısındaki azalmaya paralel olarak) meydana gelir. İkincisinin mitokondri üzerindeki etkisi, oksidatif stresin yanı sıra apoptoz - nöronların hücre ölümüne yol açar.
Her şey hakkında bir kez daha
20. yüzyılın sonunda, iki önemli özelliğin aynı anda dikkate alındığı beyin çalışmasına bir yaklaşım doğdu: bir nöron (veya sinir ağı veya sinaps) ne kadar yararlı bilgiyi kodlar ve iletir ve ne kadar enerji verir? harcar, . Oranları, nöronların, sinir ağlarının ve sinapsların enerji verimliliği için bir tür kriterdir.
Bu kriterin hesaplamalı sinirbilimde kullanılması, belirli fenomenlerin, süreçlerin rolüne ilişkin bilgide önemli bir artış sağlamıştır. Özellikle, sinapsta nörotransmiter salınımı olasılığının düşük olması, nöron inhibisyonu ve uyarma arasında belirli bir denge, belirli bir alıcı kombinasyonu nedeniyle yalnızca belirli bir tür gelen bilginin salınması - tüm bunlar değerli enerji kaynaklarının korunmasına katkıda bulunur.
Ayrıca, sinyal süreçlerinin (örneğin, AP'nin üretimi, iletimi, sinaptik iletim) enerji tüketiminin yalnızca belirlenmesi, besin dağıtımının patolojik bir ihlali durumunda öncelikle hangisinin zarar göreceğini bulmayı mümkün kılar. Sinapslar çalışmak için en fazla enerjiyi gerektirdiğinden iskemi, Alzheimer ve Huntington hastalıkları gibi patolojilerde ilk başarısız olanlardır. Benzer şekilde, farklı tipteki nöronların enerji tüketimini belirlemek, bir patoloji durumunda hangisinin diğerlerinden daha erken öleceğini bulmaya yardımcı olur. Örneğin, aynı iskemi ile, korteksin internöronları her şeyden önce başarısız olacaktır. Aynı nöronlar, yoğun metabolizma nedeniyle yaşlanma, Alzheimer hastalığı ve şizofreni sırasında en savunmasız hücrelerdir.
teşekkürler
Ebeveynlerim Olga Natalevich ve Alexander Zhukov'a, kız kardeşler Lyuba ve Alena'ya, süpervizörüm Alexei Brazhe'ye ve laboratuvardaki harika arkadaşlarım Evelina Nickelsparg ve Olga Slatinskaya'ya destekleri ve ilhamları, makaleyi okurken yapılan değerli yorumları için içtenlikle minnettarım. Ayrıca makalenin editörü Anna Petrenko'ya ve Biomolecule'ün genel yayın yönetmeni Anton Chugunov'a notlar, öneriler ve yorumlar için çok minnettarım.
Edebiyat
- Obur beyin;
- SEYMOUR S. KETY. (1957). BEYNİN VIVO GENEL METABOLİZMASI. Sinir Sistemi Metabolizması. 221-237;
- L. Sokoloff, M. Reivich, C. Kennedy, M.H. Des Rosiers, C.S. Patlak, et. diğerleri (1977). YEREL SEREBRAL GLİKOZ KULLANIMININ ÖLÇÜMÜ İÇİN DEOKSİGLUKOZ YÖNTEMİ: BİLİNÇLİ VE ANESTEZİ YAPILMIŞ ALBINO SıNCAKLARINDA TEORİ, PROSEDÜR VE NORMAL DEĞERLER . J Nörokimya. 28 , 897-916;
- Magistretti P.J. (2008). Beyin enerji metabolizması. Temel sinirbilimde // Ed. Squire L.R., Berg D., Bloom F.E., du Lac S., Ghosh A., Spitzer N. San Diego: Academic Press, 2008. P. 271–297;
- Pierre J. Magistretti, Igor Allaman. (2015). Beyin Enerjisi Metabolizması ve Fonksiyonel Görüntüleme Üzerine Hücresel Bir Bakış. Nöron. 86 , 883-901;
- William B Levy, Robert A. Baxter. (1996). Enerji Verimli Sinir Kodları. Sinirsel Hesaplama. 8 , 531-543;
- Keskin P.E. ve Green C. (1994). Serbestçe hareket eden sıçanın alt kısmındaki tek hücrelerin ateşleme modellerinin mekansal bağıntıları. J. Neurosci. 14 , 2339–2356;
- H. Hu, J. Gan, P. Jonas. (2014). Hızlı yükselen, parvalbumin+ GABAerjik internöronlar: Hücresel tasarımdan mikro devre işlevine. Bilim. 345 , 1255263-1255263;
- Oliver Kann, Ismini E Papageorgiou, Andreas Draguhn. (2014). Yüksek Enerjili İnhibitör Aranöronlar, Kortikal Ağlarda Bilgi İşleme için Merkezi Bir Unsurdur. J-Cereb Kan Akışı Metabı. 34 , 1270-1282;
- David Attwell, Simon B. Laughlin. (2001). Beynin Gri Maddesinde Sinyal Vermek İçin Bir Enerji Bütçesi. J-Cereb Kan Akışı Metabı. 21 , 1133-1145;
- Henry Markram, Maria Toledo-Rodriguez, Yun Wang, Anirudh Gupta, Gilad Silberberg, Caizhi Wu. (2004).