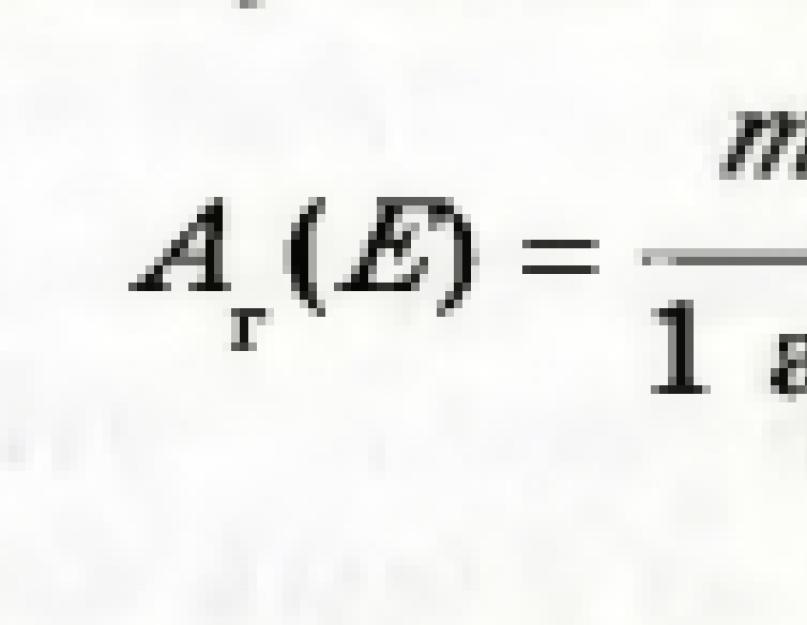>> Bir atomun kütlesi. Bağıl atom kütlesi
Atom kütlesi. Bağıl atom kütlesi
Bu paragraftaki materyal şunları anlamanıza yardımcı olacaktır:
> atom kütlesi ile bağıl kütle arasındaki fark nedir atom kütlesi ;
> bağıl atom kütlelerini kullanmak neden uygundur;
> Bir elementin bağıl atom kütlesinin nerede bulunacağı.
Bu ilginç
Bir elektronun kütlesi yaklaşık 9 10 -28 g'dır.
Atom kütlesi.
Bir atomun önemli bir özelliği kütlesidir. Bir atomun kütlesinin neredeyse tamamı çekirdekte yoğunlaşmıştır. Elektronların kütlesi o kadar küçüktür ki genellikle ihmal edilirler.
1/12 ile karşılaştırıldığında - bir Karbon atomunun kütlesi (bir Hidrojen atomundan neredeyse 12 kat daha ağırdır). Bu küçük kütleye atomik kütle birimi adı verildi (a.m.u. olarak kısaltılır):
1a. e.m. = 1/12m a (C) = 1/12 1,994 10 -23 g = 1,662 10 -24 g.
Hidrojen atomunun kütlesi neredeyse atomik kütle birimiyle çakışmaktadır: m a (H) ~ 1a. e.m. Uranyum atomunun kütlesi ondan daha büyüktür.
yani
m a (U) ~ 238 a. sabah
Bir elementin atomunun kütlesinin atomik kütle birimine bölünmesiyle elde edilen sayıya elementin bağıl atom kütlesi denir. Bu değer A r (E) ile gösterilir:

A harfinin yanındaki indeks, A harfinin ilk harfidir. Latince kelime göreceli - göreceli.
Bir elementin bağıl atom kütlesi, bir atomun kütlesinin kaç katı olduğunu gösterir. eleman Bir karbon atomunun kütlesinin 1/12'sinden fazlası.
m a (N) = 1,673 10 -2 4 g
m a (H)= 1 a. sabah
Ar(H) = 1
Bir elementin bağıl atom kütlesinin boyutu yoktur.
Göreli atom kütlelerinin ilk tablosu neredeyse 200 yıl önce İngiliz bilim adamı J. Dalton tarafından derlendi.
Sunulan materyale dayanarak aşağıdaki sonuçlar çıkarılabilir:
Bağıl atom kütleleri atomların kütleleriyle orantılıdır;
atom kütlelerinin oranları bağıl atom kütleleriyle aynıdır.
Kimyasal elementlerin bağıl atom kütleleri şöyle yazılır: periyodik tablo .
John Dalton (1766-1844)

Üstün İngilizce fizikçi ve kimyager. Londra Kraliyet Cemiyeti (İngiliz Bilimler Akademisi) üyesi. Atomların farklı kütleleri ve boyutları hakkında bir hipotez ortaya atan, birçok elementin bağıl atom kütlelerini belirleyen ve değerlerinin ilk tablosunu derleyen ilk kişi oydu (1803). Elementler için semboller ve kimyasal bileşikler için gösterimler önerdi.
200.000'den fazla para kazandım meteorolojik gözlemler havanın bileşimini ve özelliklerini inceledikten sonra kısmi (kısmi) basınç yasalarını keşfetti gazlar(1801), gazların termal genleşmesi (1802), gazların sıvılardaki çözünürlüğü (1803).

Pirinç. 35. Uranüs elementinin hücresi
Çok ile tanımlanırlar yüksek doğruluk; karşılık gelen sayılar çoğunlukla beş ve altı hanelidir (Şekil 35).
Sıradan kimyasal hesaplamalarda bağıl atom kütleleri genellikle tam sayılara yuvarlanır. Hidrojen ve Uranüs için
Ar(H) = 1,0079 ~ 1;
Ar (U) = 238.029 ~ 238.
Yalnızca Klorun bağıl atom kütlesi en yakın onda birine yuvarlanır:
Ar(Cl) = 35,453 ~ 35,5.
Periyodik tablodaki Lityum, Karbon, Oksijen ve Neon'un bağıl atom kütlelerini bulun ve bunları tam sayılara yuvarlayın.
Karbon, Oksijen, Neon ve Magnezyum atomlarının kütleleri Helyum atomunun kütlesinden kaç kat daha büyüktür? Hesaplamalar için bağıl atom kütlelerinin yuvarlatılmış değerlerini kullanın.
lütfen aklınızda bulundurun: Elementler periyodik tabloda artan atom kütlelerine göre sıralanmıştır.
Sonuçlar
Atomlar son derece düşük kütleye sahiptir.
Hesaplamaların kolaylığı için atomların bağıl kütleleri kullanılır.
Bir elementin bağıl atom kütlesi, elementin bir atomunun kütlesinin bir karbon atomunun kütlesine oranıdır.
Bağıl atom kütlelerinin değerleri, kimyasal elementlerin periyodik tablosunda belirtilmiştir.
?
48. “Atom kütlesi” ile bağıl atom kütlesi kavramları arasındaki fark nedir?”
49. Atomik kütle birimi nedir?
50. A r ve A r girdileri ne anlama geliyor?
51. Hangi atom daha hafiftir: Karbon mu Titan mı? Kaç kez?
52. Hangisinin kütlesi daha fazladır: bir Flor atomu veya iki Lityum atomu; iki Magnezyum atomu mu yoksa üç atom Kükürt mü?
53. Periyodik tabloda atom kütle oranı şu şekilde olan üç veya dört çift element bulun: a) 1: 2; b) 1:3.
54. Helyumun bir atomunun kütlesi 6,647 - 10 -24 g ise, Helyumun bağıl atom kütlesini hesaplayın.
55. Berilyum atomunun kütlesini hesaplayın.
Popel P.P., Kryklya L.S., Kimya: Pidruch. 7. sınıf için. zagalnosvit. navch. kapanış - K.: VC "Akademi", 2008. - 136 s.: hasta.
Ders içeriği ders taslağı ve destekleyici çerçeve ders sunumu etkileşimli teknolojiler hızlandırıcı öğretim yöntemleri Pratik testler, çevrimiçi görevlerin test edilmesi ve alıştırmalar ev ödevleri atölye çalışmaları ve eğitimler sınıf tartışmaları için sorular İllüstrasyonlar video ve işitsel materyaller fotoğraflar, resimler, grafikler, tablolar, diyagramlar, çizgi romanlar, benzetmeler, sözler, bulmacalar, anekdotlar, şakalar, alıntılar Eklentiler özetler merak edilen makaleler için ipuçları (MAN) literatür temel ve ek terimler sözlüğü Ders kitaplarının ve derslerin iyileştirilmesi ders kitabındaki hataları düzeltmek, eski bilgileri yenileriyle değiştirmek Sadece öğretmenler için takvim planları eğitim programları metodolojik önerilerAnsiklopedik YouTube
1 / 3
✪ Kimya| Bağıl atom kütlesi
✪ Bağıl atom kütlesi. Molekül ağırlığı.
✪ 15. Atom kütlesi
Altyazılar
Genel bilgi
Bir atomun temel özelliklerinden biri kütlesidir. Bir atomun mutlak kütlesi son derece küçük bir değerdir. Dolayısıyla bir hidrojen atomunun kütlesi yaklaşık 1,67⋅10 −24 g'dır. Bu nedenle kimyada (pratik amaçlar için) göreceli [geleneksel] bir değerin kullanılması tercih edilir ve çok daha uygundur. bağıl atom kütlesi ya da sadece atom kütlesi ve bu, belirli bir elementin atomunun kütlesinin, kütle ölçüm birimi olarak alınan başka bir elementin atomunun kütlesinden kaç kat daha büyük olduğunu gösterir.
Atomik ve moleküler kütlelerin ölçü birimi 1 ⁄ 12 Karbon 12 C'nin en yaygın izotopunun nötr atomunun kütlesinin bir kısmı. Sistemik olmayan bu kütle ölçüm birimine denir. atomik kütle birimi (A. e. m.) veya Dalton (Evet).
Bir izotopun atom kütlesi ile kütle numarası arasındaki farka fazla kütle adı verilir (genellikle MeV cinsinden ifade edilir). Olumlu ya da olumsuz olabilir; ortaya çıkmasının nedeni, çekirdeklerin bağlanma enerjisinin proton ve nötron sayısına doğrusal olmayan bağımlılığının yanı sıra proton ve nötron kütlelerindeki farktır.
Bir izotopun atom kütlesinin kütle numarasına bağımlılığı şu şekildedir: Kütle fazlası hidrojen-1 için pozitiftir, kütle numarasının artmasıyla azalır ve demir-56 için minimuma ulaşılıncaya kadar negatif olur, sonra azalmaya başlar. ağır nüklidler için büyür ve pozitif değerlere yükselir. Bu, demirden daha ağır çekirdeklerin bölünmesinin enerji açığa çıkarması, hafif çekirdeklerin bölünmesinin ise enerji gerektirmesi gerçeğine karşılık gelir. Aksine, demirden daha hafif çekirdeklerin füzyonu enerji açığa çıkarırken, demirden daha ağır elementlerin füzyonu ek enerji gerektirir.
Hikaye
Başlangıçta atom kütlelerini hesaplarken (ile XIX'in başı yüzyılda J. Dalton'un önerisiyle; bkz. Dalton'un atom teorisi) en hafif element olan hidrojen atomunun kütlesi, kütle birimi [göreceli] olarak alınmış ve diğer elementlerin atomlarının kütleleri buna göre hesaplanmıştır. Ancak çoğu elementin atomik kütleleri, oksijen bileşiklerinin bileşimine göre belirlendiğinden, aslında (fiilen) hesaplamalar, 16'ya eşit alınan oksijenin atomik kütlesine göre yapılmıştır; oksijen ve hidrojenin atom kütleleri arasındaki oranın 16: 1'e eşit olduğu kabul edildi. Daha sonra, daha doğru ölçümler, hangi atomun - oksijen veya hidrojen olduğuna bağlı olarak bu oranın 15.874: 1 veya aynı olan 16: 1.0079 olduğunu gösterdi. - bir tamsayı değerine bakın. Oksijenin atom kütlesindeki bir değişiklik, çoğu elementin atom kütlesinde bir değişikliğe yol açacaktır. Bu nedenle hidrojenin atom kütlesi 1,0079'a eşit alınarak oksijenin atom kütlesinin 16'da bırakılmasına karar verildi.
Böylece atom kütlesinin birimi alınmış oldu 1 ⁄ 16 oksijen atomunun kütlesinin bir kısmı denir oksijen ünitesi. Daha sonra, doğal oksijenin bir izotop karışımı olduğu, böylece oksijen kütle biriminin, kararsız olduğu ortaya çıkan doğal oksijen izotoplarının (oksijen-16, oksijen-17 ve oksijen-18) atomlarının ortalama kütlesini karakterize ettiği bulundu. oksijenin izotop bileşimindeki doğal değişiklikler nedeniyle. İçin atom fiziği böyle bir birimin kabul edilemez olduğu ortaya çıktı ve bu bilim dalında atom kütlesi birimi benimsendi 1 ⁄ 16 oksijen atomunun kütlesinin bir kısmı 16 O. Sonuç olarak, kimyasal ve fiziksel olmak üzere iki atom kütlesi ölçeği şekillendi. İki atomik kütle ölçeğinin varlığı büyük rahatsızlık yarattı. Fiziksel ve kimyasal ölçekte hesaplanan birçok sabitin değerlerinin farklı olduğu ortaya çıktı. Bu kabul edilemez konum, oksijen ölçeği yerine atom kütlelerinin karbon ölçeğinin kullanılmasına yol açtı.
Göreli atom kütlelerinin birleşik ölçeği ve yeni bir atom kütlesi birimi, Uluslararası Fizikçiler Kongresi (1960) tarafından kabul edildi ve Uluslararası Kimyacılar Kongresi (1961; 1. Uluslararası Kimyacılar Kongresi'nden 100 yıl sonra) tarafından birleştirildi. atom kütlesinin önceki iki oksijen birimi - fiziksel ve kimyasal. Oksijen kimyasal birimi 0,999957 yeni karbon atomik kütle birimine eşittir. Modern ölçekte, oksijen ve hidrojenin bağıl atom kütleleri sırasıyla 15,9994:1,0079'dur... Yeni atomik kütle birimi, bir kimyasal elementin ortalama atom kütlesine değil, belirli bir izotopa bağlı olduğundan, doğal izotop varyasyonları meydana gelir. o birimin tekrarlanabilirliğini etkilemez.
Ders materyallerinden bazı kimyasal elementlerin atomlarının diğer kimyasal elementlerin atomlarından kütle bakımından farklı olduğunu öğreneceksiniz. Öğretmeniniz size kimyacıların elektron mikroskobuyla bile göremeyeceğiniz kadar küçük atomların kütlesini nasıl ölçtüklerini anlatacak.
Konu: İlk kimyasal fikirler
Ders: Kimyasal Elementlerin Bağıl Atom Kütlesi
19. yüzyılın başında. (Robert Boyle'un çalışmasından 150 yıl sonra), İngiliz bilim adamı John Dalton, kimyasal elementlerin atomlarının kütlesini belirlemek için bir yöntem önerdi. Bu yöntemin özünü ele alalım.
Dalton, karmaşık bir maddenin molekülünün farklı kimyasal elementlerden yalnızca bir atom içerdiğine göre bir model önerdi. Örneğin bir su molekülünün 1 hidrojen atomu ve 1 oksijen atomundan oluştuğuna inanıyordu. Dahil basit maddeler Dalton'a göre bir kimyasal elementin yalnızca bir atomu bulunur. Onlar. Bir oksijen molekülü bir oksijen atomundan oluşmalıdır.
Ve sonra, bir maddedeki elementlerin kütle kesirlerini bilerek, bir elementin atomunun kütlesinin başka bir elementin atomunun kütlesinden kaç kat farklı olduğunu belirlemek kolaydır. Bu nedenle Dalton, bir maddedeki bir elementin kütle oranının atomunun kütlesi tarafından belirlendiğine inanıyordu.
Magnezyum oksit içindeki magnezyumun kütle oranının %60, oksijenin kütle oranının ise %40 olduğu bilinmektedir. Dalton'un mantığına göre magnezyum atomunun kütlesinin oksijen atomunun kütlesinden 1,5 kat daha büyük olduğunu söyleyebiliriz (60/40 = 1,5):
Bilim adamı hidrojen atomunun kütlesinin en küçük olduğunu fark etti çünkü Hidrojenin kütle fraksiyonunun başka bir elementin kütle fraksiyonundan daha büyük olacağı karmaşık bir madde yoktur. Bu nedenle elementlerin atomlarının kütlelerini bir hidrojen atomunun kütlesiyle karşılaştırmayı önerdi. Ve bu şekilde kimyasal elementlerin göreceli (hidrojen atomuna göre) atom kütlelerinin ilk değerlerini hesapladı.
Hidrojenin atom kütlesi birlik olarak alındı. Ve anlamı bağıl kütle kükürtün 17'ye eşit olduğu ortaya çıktı. Ancak elde edilen tüm değerler ya yaklaşık ya da yanlıştı çünkü o zamanın deneysel tekniği mükemmel olmaktan uzaktı ve Dalton'un maddenin bileşimi hakkındaki varsayımı yanlıştı.
1807 - 1817'de İsveçli kimyager Jons Jakob Berzelius, elementlerin bağıl atom kütlelerini açıklığa kavuşturmak için kapsamlı araştırmalar yaptı. Günümüze yakın sonuçlar elde etmeyi başardı.
Berzelius'un çalışmasından çok daha sonra, kimyasal elementlerin atomlarının kütleleri, bir karbon atomunun kütlesinin 1/12'si ile karşılaştırılmaya başlandı (Şekil 2).

Pirinç. 1. Bir kimyasal elementin bağıl atom kütlesini hesaplamak için model
Bir kimyasal elementin bağıl atom kütlesi, bir kimyasal elementin atomunun kütlesinin, bir karbon atomunun kütlesinin 1/12'sinden kaç kat daha büyük olduğunu gösterir.
Bağıl atom kütlesi Ar ile gösterilir; atom kütlelerinin oranını gösterdiğinden herhangi bir ölçü birimi yoktur.
Örneğin: A r(S) = 32, yani. Bir kükürt atomu, bir karbon atomunun kütlesinin 1/12'sinden 32 kat daha ağırdır.
Bir karbon atomunun 1/12'sinin mutlak kütlesi, değeri yüksek doğrulukla hesaplanan ve 1,66 * 10 -24 g veya 1,66 * 10 -27 kg olan bir referans birimidir. Bu referans kütlesine denir atomik kütle birimi (a.e.m.).
Kimyasal elementlerin göreceli atom kütlelerinin değerlerini ezberlemeye gerek yoktur; bunlar kimya üzerine herhangi bir ders kitabında veya referans kitabında ve ayrıca D.I.'nin periyodik tablosunda verilmiştir. Mendeleev.
Hesaplarken, bağıl atom kütlelerinin değerleri genellikle tam sayılara yuvarlanır.
Bunun istisnası, klorun bağıl atom kütlesidir; klor için 35,5 değeri kullanılır.
1. Kimyada problemlerin ve alıştırmaların toplanması: 8. sınıf: P.A.'nın ders kitabına. Orzhekovsky ve diğerleri “Kimya, 8. sınıf” / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. – M.: AST: Astrel, 2006.
2. Ushakova O.V. Kimya çalışma kitabı: 8. sınıf: P.A.'nın ders kitabına. Orzhekovsky ve diğerleri. “Kimya. 8. sınıf” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovski; altında. ed. prof. P.A. Orzhekovsky - M.: AST: Astrel: Profizdat, 2006. (s. 24-25)
3. Kimya: 8. sınıf: ders kitabı. genel eğitim için kurumlar / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. M.: AST: Astrel, 2005.(§10)
4. Kimya: inorg. kimya: ders kitabı. 8. sınıf için. genel eğitim kurumlar / G.E. Rudzitis, Fyu Feldman. – M.: Eğitim, OJSC “Moskova Ders Kitapları”, 2009. (§§8,9)
5. Çocuklar için ansiklopedi. Cilt 17. Kimya / Bölüm. ed.V.A. Volodin, Ved. ilmi ed. I. Leenson. – M.: Avanta+, 2003.
Ek web kaynakları
1. Dijital eğitim kaynaklarının birleşik koleksiyonu ().
2. “Kimya ve Yaşam” () dergisinin elektronik versiyonu.
Ev ödevi
s.24-25 Sayı 1-7 Kimya Çalışma Kitabından: 8. sınıf: P.A.'nın ders kitabına. Orzhekovsky ve diğerleri. “Kimya. 8. sınıf” / O.V. Ushakova, P.I. Bespalov, P.A. Orzhekovski; altında. ed. prof. P.A. Orzhekovsky - M .: AST: Astrel: Profizdat, 2006.
Atom kütlesi, bağıl atom kütlesi(eski ad - atom ağırlığı) - atom kütlesi birimlerinde ifade edilen bir atomun kütlesinin değeri. Şu anda atomik kütle birimi, karbon 12C'nin en yaygın izotopunun nötr atomunun kütlesinin 1/12'sine eşit olarak alınmaktadır, dolayısıyla bu izotopun atom kütlesi tanım gereği tam olarak 12'dir. Diğer herhangi bir izotop için, atom kütlesi bir tam sayı değildir, ancak bu izotopun kütle numarasına (yani çekirdeğindeki toplam nükleon sayısı - proton ve nötron -) yakın olmasına rağmen. Bir izotopun atom kütlesi ile kütle numarası arasındaki farka fazla kütle adı verilir (genellikle MeVah cinsinden ifade edilir). Olumlu ya da olumsuz olabilir; ortaya çıkmasının nedeni, çekirdeklerin bağlanma enerjisinin proton ve nötron sayısına doğrusal olmayan bağımlılığının yanı sıra proton ve nötron kütlelerindeki farktır.
Atom kütlesinin kütle numarasına bağımlılığı şu şekildedir: Kütle fazlası hidrojen-1 için pozitiftir, kütle numarası arttıkça azalır ve demir-56 için minimuma ulaşılıncaya kadar negatif olur, sonra büyüyüp artar. ağır nüklidler için pozitif değerlere. Bu, demirden daha ağır çekirdeklerin bölünmesinin enerji açığa çıkarması, hafif çekirdeklerin bölünmesinin ise enerji gerektirmesi gerçeğine karşılık gelir. Aksine, demirden daha hafif çekirdeklerin füzyonu enerji açığa çıkarırken, demirden daha ağır elementlerin füzyonu ek enerji gerektirir.
Bir kimyasal elementin atom kütlesi (aynı zamanda "ortalama atom kütlesi", "standart atom kütlesi"), belirli bir kimyasal elementin tüm kararlı izotoplarının, doğal bollukları dikkate alınarak ağırlıklı ortalama atom kütlesidir. yer kabuğu ve atmosfer. Periyodik tabloda sunulan ve stokiyometrik hesaplamalarda kullanılan bu atom kütlesidir. Bozulmuş izotop oranına sahip (örneğin, bazı izotoplarda zenginleştirilmiş) bir elementin atom kütlesi standart olandan farklıdır.
Molekül ağırlığı mo kimyasal bileşik kendisini oluşturan elementlerin atom kütlelerinin toplamının, bileşiğin kimyasal formülüne göre elementlerin stokiyometrik katsayıları ile çarpılmasıdır. Kesin olarak söylemek gerekirse, bir molekülün kütlesi, kendisini oluşturan atomların kütlesinden, molekülün bağlanma enerjisine eşit bir miktarda daha azdır. Ancak bu kütle kusuru molekülün kütlesinden 9-10 kat daha küçüktür ve ihmal edilebilir.
Bir molün (ve Avogadro sayısının) tanımı, bir maddenin bir molünün kütlesi ( molar kütle Gram cinsinden ifade edilen ), sayısal olarak bu maddenin atomik (veya moleküler) kütlesine eşitti. Örneğin demirin atom kütlesi 55.847'dir. Bu nedenle, bir mol demir atomu (yani sayıları, sayıya eşit Avogadro, 6.022 1023) 55.847 gram içerir.
Atom ve moleküllerin kütlelerinin doğrudan karşılaştırılması ve ölçümü, kütle spektrometrik yöntemler kullanılarak gerçekleştirilir.
Hikaye
1960'lara kadar atom kütlesi, izotop oksijen-16'nın atom kütlesi 16 (oksijen ölçeği) olacak şekilde tanımlanıyordu. Ancak atom kütlesi hesaplamalarında da kullanılan doğal oksijendeki oksijen-17 ve oksijen-18 oranı, iki farklı atom kütlesi tablosunun ortaya çıkmasına neden oldu. Kimyacılar, oksijen izotoplarının doğal karışımının atom kütlesinin 16 olacağı gerçeğine dayanan bir ölçek kullanırken, fizikçiler en yaygın oksijen izotopunun (sekiz proton ve sekiz nötron içeren) atom kütlesine aynı sayıyı 16 olarak atadılar. ).
Vikipedi
TANIM
Ütü- Periyodik Tablonun yirmi altıncı elementi. Tanım - Latince "ferrum" kelimesinden gelen Fe. Dördüncü periyotta VIIIB grubu yer alır. Metalleri ifade eder. Nükleer yük 26'dır.
Demir, alüminyumdan sonra dünya üzerinde en yaygın metaldir: yer kabuğunun (ağırlıkça) %4'ünü oluşturur. Demir çeşitli bileşikler formunda bulunur: oksitler, sülfitler, silikatlar. Demir serbest halde yalnızca meteorlarda bulunur.
İLE en önemli cevherler demir, manyetik demir cevheri Fe304, kırmızı demir cevheri Fe203, kahverengi demir cevheri 2Fe203 × 3H2O ve spar demir cevheri FeCO3'ü içerir.
Demir gümüş renkli (Şekil 1) sünek bir metaldir. Dövme, haddeleme ve diğer mekanik işleme türlerine uygundur. Mekanik özellikler Demir, saflığına, hatta çok küçük miktarlardaki diğer elementlerin içeriğine bile büyük ölçüde bağlıdır.
Pirinç. 1. Demir. Dış görünüş.
Demirin atomik ve moleküler kütlesi
Maddenin bağıl moleküler ağırlığı(Mr), belirli bir molekülün kütlesinin, bir karbon atomunun kütlesinin 1/12'sinden kaç kat daha büyük olduğunu gösteren bir sayıdır ve bir elementin bağıl atom kütlesi(A r) - bir kimyasal elementin ortalama atom kütlesinin, bir karbon atomunun kütlesinin 1/12'sinden kaç katı olduğu.
Serbest halde demir, tek atomlu Fe molekülleri formunda mevcut olduğundan, atomik ve moleküler kütlelerinin değerleri çakışmaktadır. 55.847'ye eşittirler.
Demirin allotropisi ve allotropik modifikasyonları
Demir iki kristal modifikasyon oluşturur: α-demir ve γ-demir. Bunlardan ilki cisim merkezli kübik kafese, ikincisi ise yüz merkezli kübik kafese sahiptir. α-Demir iki sıcaklık aralığında termodinamik olarak stabildir: 912 o C'nin altında ve 1394 o C'den erime noktasına kadar. Demirin erime noktası 1539 ± 5 o C'dir. 912 o C ile 1394 o C arasında γ-demir stabildir.
α- ve γ-demirin stabilitesinin sıcaklık aralıkları, sıcaklık değişimleriyle her iki modifikasyonun Gibbs enerjisindeki değişimin doğasına göre belirlenir. 912 o C'nin altındaki ve 1394 o C'nin üzerindeki sıcaklıklarda, α-demirin Gibbs enerjisi γ-demirin Gibbs enerjisinden daha azdır ve 912 - 1394 o C aralığında daha yüksektir.
Demir izotopları
Doğada demirin 54 Fe, 56 Fe, 57 Fe ve 57 Fe olmak üzere dört kararlı izotop halinde bulunabileceği bilinmektedir. Kütle sayıları sırasıyla 54, 56, 57 ve 58'dir. Demir izotopu 54 Fe'nin bir atomunun çekirdeği yirmi altı proton ve yirmi sekiz nötron içerir ve geri kalan izotoplar ondan yalnızca nötron sayısında farklılık gösterir.
Kütle sayıları 45'ten 72'ye kadar olan yapay demir izotoplarının yanı sıra çekirdeğin 6 izomerik durumu vardır. Yukarıdaki izotoplar arasında en uzun ömürlü olanı, 2,6 milyon yıllık yarı ömrüyle 60 Fe'dir.
Demir iyonları
Demir elektronlarının yörünge dağılımını gösteren elektronik formül aşağıdaki gibidir:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 .
Kimyasal etkileşimin bir sonucu olarak demir, değerlik elektronlarından vazgeçer; onların donörüdür ve pozitif yüklü bir iyona dönüşür:
Fe 0 -2e → Fe 2+;
Fe 0 -3e → Fe 3+.
Demir molekülü ve atom
Serbest durumda demir, monoatomik Fe molekülleri formunda bulunur. Demir atomunu ve molekülünü karakterize eden bazı özellikler şunlardır:
Demir alaşımları
19. yüzyıla kadar demir alaşımları çoğunlukla çelik ve dökme demir adı verilen karbonlu alaşımlarıyla biliniyordu. Ancak daha sonra krom, nikel ve diğer elementleri içeren yeni demir bazlı alaşımlar oluşturuldu. Şu anda demir alaşımları karbon çelikleri, dökme demirler, alaşımlı çelikler ve özel özelliklere sahip çelikler olarak ayrılmaktadır.
Teknolojide demir alaşımlarına genellikle demir metalleri denir ve bunların üretimine demir metalurjisi denir.
Problem çözme örnekleri
| Egzersiz yapmak | Maddenin elementel bileşimi şu şekildedir: demir elementinin kütle oranı 0,7241 (veya %72,41), oksijenin kütle oranı 0,2759 (veya %27,59). Kimyasal formülü türetin. |
| Çözüm | NX bileşimindeki bir moleküldeki X elementinin kütle oranı aşağıdaki formül kullanılarak hesaplanır: ω (X) = n × Ar (X) / M (HX) × %100. Moleküldeki demir atomu sayısını “x”, oksijen atomu sayısını ise “y” ile gösterelim. Demir ve oksijen elementlerinin karşılık gelen bağıl atom kütlelerini bulalım (D.I. Mendeleev'in Periyodik Tablosundan alınan bağıl atom kütlelerinin değerlerini tam sayılara yuvarlayacağız). Ar(Fe) = 56; Ar(O) = 16. Elementlerin yüzde içeriğini karşılık gelen bağıl atom kütlelerine bölüyoruz. Böylece bileşiğin molekülündeki atom sayısı arasındaki ilişkiyi bulacağız: x:y= ω(Fe)/Ar(Fe) : ω(O)/Ar(O); x:y = 72,41/56: 27,59/16; x:y = 1,29: 1,84. En küçük sayıyı bir olarak alalım (yani tüm sayıları en küçük sayı olan 1,29'a bölelim): 1,29/1,29: 1,84/1,29; Sonuç olarak, demir ve oksijen kombinasyonunun en basit formülü Fe203'tür. |
| Cevap | Fe2O3 |
Demirin fiziksel özellikleri saflığına bağlıdır. Saf demir, gümüşi beyaz renkte, oldukça sünek bir metaldir. Demirin yoğunluğu 7,87 g/cm3'tür. Erime noktası 1539 °C'dir. Demir, diğer birçok metalden farklı olarak manyetik özellikler gösterir.
Saf demir havada oldukça kararlıdır. İÇİNDE pratik aktiviteler Safsızlıklar içeren demir kullanılır. Demir ısıtıldığında birçok metal olmayan maddeye karşı oldukça aktiftir. Tipik metal olmayanlarla etkileşim örneğini kullanarak demirin kimyasal özelliklerini ele alalım: oksijen ve kükürt.
Demir oksijen içinde yandığında, demir pulu adı verilen bir demir ve oksijen bileşiği oluşur. Reaksiyona ısı ve ışık salınımı eşlik eder. Kimyasal reaksiyon için bir denklem oluşturalım:
3Fe + 2O 2 = Fe 3 O 4
Demir ısıtıldığında kükürt ile şiddetli reaksiyona girerek ferrum(II) sülfit oluşturur. Reaksiyona aynı zamanda ısı ve ışık salınımı da eşlik eder. Kimyasal reaksiyon için bir denklem oluşturalım:
Demir endüstride ve günlük yaşamda yaygın olarak kullanılmaktadır. Demir Çağı, M.Ö. 1. binyılın başında demir eritme işleminin yayılması ve demir aletlerin ve askeri silahların imalatıyla bağlantılı olarak başlayan, insanlığın gelişiminde bir dönemdir. Demir çağı bronz çağının yerini aldı. Çelik ilk kez Hindistan'da MÖ 10. yüzyılda, dökme demir ise yalnızca Orta Çağ'da ortaya çıktı. Saf demir, transformatör çekirdekleri ve elektromıknatısların yanı sıra özel alaşımların üretiminde de kullanılır. Pratikte en yaygın kullanılan demir alaşımları dökme demir ve çeliktir. Döküm ve çelik üretiminde dökme demir, korozyona dayanıklı yapı ve takım malzemesi olarak çelik kullanılmaktadır.
Atmosferdeki oksijen ve nemin etkisi altında demir alaşımları paslanır. Pas ürünü tanımlanabilir kimyasal formül Fe 2 O 3 · xH 2 O. Eritilmiş dökme demirin altıda biri paslanma nedeniyle ölür, bu nedenle korozyonla mücadele konusu çok önemlidir. Korozyona karşı koruma yöntemleri çok çeşitlidir. Bunlardan en önemlileri: metal yüzeyinin bir kaplama ile korunması, korozyon önleyici özelliklere sahip alaşımlar oluşturulması, elektrokimyasal maddeler, ortamın bileşiminin değiştirilmesi. Koruyucu kaplamalar iki gruba ayrılır: metal (çinko, krom, nikel, kobalt, bakır ile demir kaplama) ve metal olmayan (vernikler, boyalar, plastikler, kauçuk, çimento). Alaşımların bileşimine özel katkı maddeleri eklenerek paslanmaz çelik elde edilir.
Ütü. Demirin doğada bulunması
Ütü. Doğada demirin yaygınlığı. Biyolojik rol bez
Oksijenden sonra özellikleri incelenecek olan ikinci önemli kimyasal element Ferum'dur. Demir, basit demir maddesini oluşturan metalik bir elementtir. Demir, periyodik tablonun ikincil alt grubunun sekizinci grubunun bir parçasıdır. Grup numarasına göre, demirin maksimum değerliği sekiz olmalıdır, ancak Ferum bileşiklerinde demir değeri altı olan bilinen bileşiklerin yanı sıra daha çok iki ve üç değerliği sergiler. Demirin bağıl atom kütlesi elli altıdır.
Ferum, yer kabuğundaki bolluğu açısından metalik elementler arasında alüminyumdan sonra ikinci sırada yer almaktadır. Yer kabuğundaki demirin kütle oranı neredeyse yüzde beştir. Demir doğal haliyle çok nadir bulunur, genellikle yalnızca meteorit şeklinde bulunur. Atalarımız demirle ilk kez bu şekilde tanışıp onu çok değerli buldular. iyi malzeme aletlerin üretimi için. Demirin çekirdeğin ana bileşeni olduğuna inanılıyor küre. Ferum çoğunlukla doğada cevherlerde bulunur. Bunlardan en önemlileri şunlardır: manyetik demir cevheri (manyetit) Fe 3 O 4, kırmızı demir cevheri (hematit) Fe 2 O 3, kahverengi demir cevheri (limonit) Fe 2 O 3 nH 2 O, demir pirit (pirit) FeS 2 , spar demir cevheri ( siderit) FeСO3, götit FeO (OH). Birçok suda maden kaynakları Fe (HCO3) 2 ve diğer bazı demir tuzlarını içerir.
Demir hayati bir elementtir. İnsan vücudunda, hayvanlar gibi, ferrum da tüm dokularda bulunur, ancak en büyük kısmı (yaklaşık üç gram) kan hücrelerinde yoğunlaşmıştır. Demir atomları hemoglobin moleküllerinde merkezi bir konuma sahiptir; hemoglobin, rengini ve oksijeni bağlama ve çıkarma yeteneğini onlara borçludur. Demir, oksijenin akciğerlerden vücut dokularına taşınması sürecinde rol oynar. Vücudun günlük Ferum ihtiyacı 15-20 mg'dır. Toplam miktarı insan vücuduna girer. bitki besinleri ve et. Kan kaybıyla birlikte Ferum ihtiyacı, kişinin yiyeceklerden aldığı miktarı aşıyor. Vücutta demir eksikliği, kandaki kırmızı kan hücrelerinin ve hemoglobin sayısının azalmasıyla karakterize bir duruma yol açabilir. Demir takviyeleri yalnızca doktorun önerdiği şekilde alınmalıdır.
Oksijenin kimyasal özellikleri. Bileşik reaksiyonlar
Oksijenin kimyasal özellikleri. Bileşik reaksiyonlar. Oksitler, oksidasyon ve yanma kavramı. Yanmanın başlatılması ve durdurulması için koşullar
Isıtıldığında oksijen birçok maddeyle kuvvetli reaksiyona girer. Oksijenli bir kaba sıcak kömür C eklerseniz, akkor hale gelir ve yanar. Kimyasal reaksiyon için bir denklem oluşturalım:
C + ONaHCO2 = CONaHCO2
Kükürt S, gaz halindeki bir madde olan kükürt dioksiti oluşturmak için oksijende parlak mavi bir alevle yanar. Kimyasal reaksiyon için bir denklem oluşturalım:
S + ONaHCO2 = SONaHCO2
Fosfor P, oksijende parlak bir alevle yanar ve katı fosfor (V) oksit parçacıklarından oluşan kalın beyaz bir duman üretir. Kimyasal reaksiyon için bir denklem oluşturalım:
4P + 5ONaHCO2 = 2PNaHCO2ONaHCO5
Oksijenin kömür, kükürt ve fosfor ile etkileşimine ilişkin reaksiyon denklemleri, her durumda iki başlangıç maddesinden bir maddenin oluşması gerçeğiyle birleştirilir. Birkaç başlangıç maddesinden (reaktif) yalnızca bir maddenin (ürün) oluştuğu bu tür reaksiyonlara iletişim reaksiyonları denir.
Oksijenin dikkate alınan maddelerle (kömür, kükürt, fosfor) etkileşiminin ürünleri oksitlerdir. Oksitler denir karmaşık maddeler biri oksijen olmak üzere iki element içerir. Helyum, neon, argon, kripton ve ksenon gibi bazı inert elementler dışında hemen hemen tüm kimyasal elementler oksitler oluşturur. Bazıları var kimyasal elementler Aurum gibi oksijenle doğrudan birleşmeyenler.
Oksijenle etkileşime giren maddelerin kimyasal reaksiyonlarına oksidasyon reaksiyonları denir. "Oksidasyon" kavramı "yanma" kavramından daha geneldir. Yanma, ısı ve ışığın açığa çıkmasıyla birlikte maddelerin oksitlendiği kimyasal bir reaksiyondur. Yanmanın gerçekleşmesi için gerekli aşağıdaki koşullar: Havanın yanıcı bir maddeyle yakın teması ve tutuşma sıcaklığına kadar ısınması. Çeşitli maddeler için tutuşma sıcaklığı farklı anlamlar. Örneğin ağaç tozunun tutuşma sıcaklığı 610°C, kükürt – 450°C, beyaz fosfor 45 - 60°C. Yanma oluşumunu önlemek için belirtilen koşullardan en az birinin uyarılması gerekir. Yani yanıcı maddenin uzaklaştırılması, tutuşma sıcaklığının altına soğutulması ve oksijenin erişiminin engellenmesi gerekir. Yanma süreçleri günlük yaşamda bize eşlik eder, bu nedenle her insan yanmanın meydana gelmesi ve durması için koşulları bilmeli ve ayrıca gözlemlemelidir. gerekli kurallar yanıcı maddelerin işlenmesi.
Doğada oksijen döngüsü
Doğada oksijen döngüsü. Oksijen kullanımı, biyolojik rolü
Tüm canlı maddelerin atomlarının yaklaşık dörtte biri oksijendir. Doğadaki toplam oksijen atomu sayısı sabit olduğundan, solunum ve diğer işlemler nedeniyle oksijen havadan uzaklaştırıldığı için yeniden doldurulması gerekir. Oksijenin en önemli kaynakları cansız doğa karbondioksit ve sudur. Oksijen atmosfere esas olarak bu-o-ikiyi içeren fotosentez süreci yoluyla girer. Önemli bir oksijen kaynağı Dünya'nın atmosferidir. Oksijenin bir kısmı oluşur üst parçalar Etki altındaki suyun ayrışması nedeniyle atmosfer güneş radyasyonu. Oksijenin bir kısmı, al-iki-o ve bu-ikide-ile fotosentez işlemi sırasında yeşil bitkiler tarafından salınır. Buna karşılık atmosferik bu-o-iki, hayvanların yanma ve solunum reaksiyonları sonucunda oluşur. Atmosferik o-iki, atmosferin üst kısımlarında ozon oluşumunda, kayaların ayrışmasının oksidatif süreçlerinde, hayvanların solunum sürecinde ve yanma reaksiyonlarında harcanır. Bu-o-iki'nin tse-o-iki'ye dönüşümü enerji açığa çıkmasına neden olur; dolayısıyla bu-o-iki'yi o-iki'ye dönüştürmek için enerji harcanması gerekir. Bu enerjinin Güneş olduğu ortaya çıkıyor. Dolayısıyla Dünya'daki yaşam döngüselliğe bağlıdır. kimyasal süreçler güneş enerjisi sayesinde mümkündür.
Oksijenin kullanımı kimyasal özelliklerinden kaynaklanmaktadır. Oksijen yaygın olarak oksitleyici bir madde olarak kullanılır. Metallerin kaynaklanması ve kesilmesinde kullanılır. kimya endüstrisi- çeşitli bileşikler elde etmek ve bazılarını yoğunlaştırmak üretim süreçleri. Uzay teknolojisinde oksijen, hidrojeni ve diğer yakıt türlerini yakmak için, havacılıkta ise uçarken kullanılır. yüksek rakımlar, ameliyatta - nefes almada zorluk çeken hastaları desteklemek için.
Oksijenin biyolojik rolü, solunumu destekleme yeteneği ile belirlenir. Bir kişi, bir dakika içinde nefes alırken ortalama 0,5 dm3 oksijen, gün boyunca - 720 dm3 ve yıl boyunca - 262,8 m3 oksijen tüketir.
1. Potasyum permanganatın termal ayrışmasının reaksiyonu. Kimyasal reaksiyon için bir denklem oluşturalım:
Potasyum-manganez-o-dört maddesi günlük yaşamda "potasyum permanganat" adı altında yaygın olarak dağıtılmaktadır. Oluşan oksijen, reaksiyonun gerçekleştirildiği cihazın gaz çıkış borusunun açıklığında veya oksijenli bir kaba verildiğinde parlak bir şekilde yanıp sönen, için için yanan bir kıymık ile kendini gösterir.
2. Manganez (IV) oksit varlığında hidrojen peroksitin ayrışma reaksiyonu. Kimyasal reaksiyon için bir denklem oluşturalım:
Hidrojen peroksit günlük yaşamdan da iyi bilinmektedir. Sıyrıkları ve küçük yaraları tedavi etmek için kullanılabilir (her acil durum çantasında en az iki-o-iki ağırlıkça yüzde üç solüsyon bulunmalıdır). Birçok kimyasal reaksiyonlar belirli maddelerin varlığında hızlanır. İÇİNDE bu durumda Hidrojen peroksitin ayrışma reaksiyonu manganez-o-iki ile hızlandırılır, ancak manganez-o-iki'nin kendisi tüketilmez ve reaksiyon ürünlerine dahil edilmez. Manganez-o-iki bir katalizördür.
Katalizörler, tüketilmeden kimyasal reaksiyonları hızlandıran maddelerdir. Katalizörler yalnızca kimya endüstrisinde yaygın olarak kullanılmaz, aynı zamanda önemli rol bir insanın hayatında. Biyokimyasal süreçlerin düzenlenmesinde rol oynayan, enzim adı verilen doğal katalizörler.
Daha önce de belirtildiği gibi oksijen havadan biraz daha ağırdır. Bu nedenle ağzı açık olarak yerleştirilen bir kaba havanın verilmesiyle toplanabilir.
Bir çukura inşa edilmiş bir demirhanede (bkz.) Kömürle restore ettiler; demirhaneye körük pompaladılar, ürün olan kritsa darbelerle cüruftan ayrıldı ve ondan çeşitli ürünler dövüldü. Üfleme yöntemleri geliştikçe ve ocak yüksekliği arttıkça işlem arttı ve bir kısmı karbürlendi, yani dökme demir elde edildi; nispeten kırılgan olan bu ürün, üretim atığı olarak değerlendirildi. Dolayısıyla dökme demirin adı “domuz”, “domuz” - İngilizce pik demir. Daha sonra, demirhaneye demir yerine dökme demir yüklerken, düşük karbonlu demir hamurunun da elde edildiği ve böyle iki aşamalı bir işlemin (Krichny yeniden dağıtımına bakın) peynir üfleme işleminden daha karlı olduğu ortaya çıktığı fark edildi. 12.-13. yüzyıllarda. çığlık atma yöntemi zaten yaygındı. 14. yüzyılda Dökme demir, yalnızca ileri işlemler için yarı ürün olarak değil, aynı zamanda çeşitli ürünlerin dökümü için bir malzeme olarak da eritilmeye başlandı. Fırının bir madene ("ev") ve ardından yüksek fırına dönüştürülmesi de aynı zamana kadar uzanıyor. 18. yüzyılın ortalarında. Avrupa'da çelik üretimine yönelik olarak Suriye'de bilinen pota prosesi kullanılmaya başlandı. erken dönem Orta Çağ'da, ancak daha sonra unutuldu. Bu yöntemle çelik, yüksek derecede refrakter bir kütleden metal yüklerinin küçük (potalar) içinde eritilmesiyle üretildi. İÇİNDE son çeyrek 18. yüzyıl Dökme demiri ateşli bir yansıtıcı ocağa dönüştürmeye yönelik su birikintisi süreci gelişmeye başladı (bkz. Pudling). 18. yüzyıl - 19. yüzyıl başları sanayi devrimi, buhar makinesinin icadı, inşaat demiryolları, büyük köprüler ve buhar filosu buna büyük bir ihtiyaç yarattı. Ancak mevcut üretim yöntemlerinin tümü pazarın ihtiyaçlarını karşılayamıyordu. Çeliğin seri üretimi ancak 19. yüzyılın ortalarında Bessemer, Thomas ve açık ocak süreçlerinin geliştirilmesiyle başladı. 20. yüzyılda Elektrikli fırın eritme işlemi ortaya çıktı ve yaygınlaştı ve yüksek kaliteli çelik üretildi.
Doğada yaygınlık. Litosferdeki içerik açısından (kütlece %4,65) ikinci (birinci) sırada yer almaktadır. Yer kabuğunda kuvvetli bir şekilde göç ederek yaklaşık 300 (vb.) oluşturur. formasyonun ilişkili olduğu magmatik, hidrotermal ve süperjen süreçlerde aktif rol alır çeşitli türler mevduatları (bkz. Demir). - dünyevi derinliklerde birikir erken aşamalar magma, ultrabazik (%9,85) ve bazik (%8,56) (granitlerde sadece %2,7). B, birçok deniz ve kıta çökeltisinde birikerek tortul birikintiler oluşturur.
Aşağıdakiler öncelikle toplam safsızlık içeriği kütlece %0,01'den az olanlarla ilgili fiziksel özelliklerdir:
İle tuhaf bir etkileşim. Konsantre HNO 3 (yoğunluk 1,45 g/cm3), yüzeyinde koruyucu bir oksit filmin ortaya çıkması nedeniyle pasifleşir; daha seyreltik HNO3, Fe 2+ veya Fe 3+ oluşturmak üzere çözünür ve MH3 veya N20 ve N2'ye indirgenir.
Kabul ve başvuru. Saf, nispeten küçük miktarlarda sulu it veya it olarak elde edilir. Doğrudan elde edilebilecek bir yöntem geliştiriliyor. Oldukça saf metallerin üretimi, ya doğrudan cevher konsantrelerinden ya da nispeten düşük seviyelerde kömürden giderek artmaktadır.
En önemli modern teknoloji. İÇİNDE saf biçim Düşük değeri nedeniyle pratikte kullanılmaz, ancak günlük yaşamda çelik veya dökme demir ürünlerine genellikle "demir" adı verilir. Yığın, çok farklı bileşimler ve özellikler şeklinde kullanılır. Tüm metal ürünlerin yaklaşık %95'ini oluşturur. Zengin (ağırlıkça %2'nin üzerinde) dökme demirler yüksek fırınlarda zenginleştirilmiş demirden eritilir (bkz. Yüksek fırın üretimi). Çeşitli kalitelerdeki çelikler (içeriği ağırlıkça %2'den az olan), açık ocakta ve elektrikli dönüştürücülerde dökme demirden fazlalığı (yakarak), zararlı yabancı maddeleri (esas olarak S, P, O) uzaklaştırarak ve alaşım elementleri ekleyerek eritilir (bkz. Açık -ocak, Dönüştürücü). Yüksek alaşımlı çelikler (diğer elementlerin yüksek içeriğine sahip) elektrik arkı ve indüksiyonla eritilir. Çelik üretimi için yeni prosesler ve özellikle de kritik olanlar kullanılmaktadır - vakum, elektroslag yeniden eritme, plazma ve elektron ışınıyla eritme, vb. Sürekli çalışan ünitelerde çelik eritme için prosesin yüksek kalitesini ve otomasyonunu sağlayan yöntemler geliştirilmektedir.
Buna dayanarak, yüksek ve alçak, yüksek, agresif ortamlar, yüksek alternatif voltajlar, nükleer radyasyon vb. etkilerine dayanabilecek malzemeler yaratılmaktadır. Üretimi sürekli artmaktadır. 1971 yılında SSCB 89,3 milyon ton demir ve 121 milyon ton çelik üretti.
L. A. Shvartsman, L. V. Vanyukova.
Sanatsal bir malzeme olarak Mısır'da (Thebes yakınlarındaki Tutankhamun'un mezarındaki kafa için, MÖ 14. yüzyılın ortaları, Ashmolean Müzesi, Oxford), Mezopotamya'da (Karkamış yakınında bulunan hançerler, MÖ 500, British Museum, Londra) antik çağlardan beri kullanılmaktadır. ),