Metan, CH4 formülüne sahip bir alkan serisinin ilk temsilcisidir. Renksiz, kokusuz bir doğal gazdır. sayesinde fiziksel ve kimyasal özellikler Yakıt olarak metan kullanılıyor.
Yapı
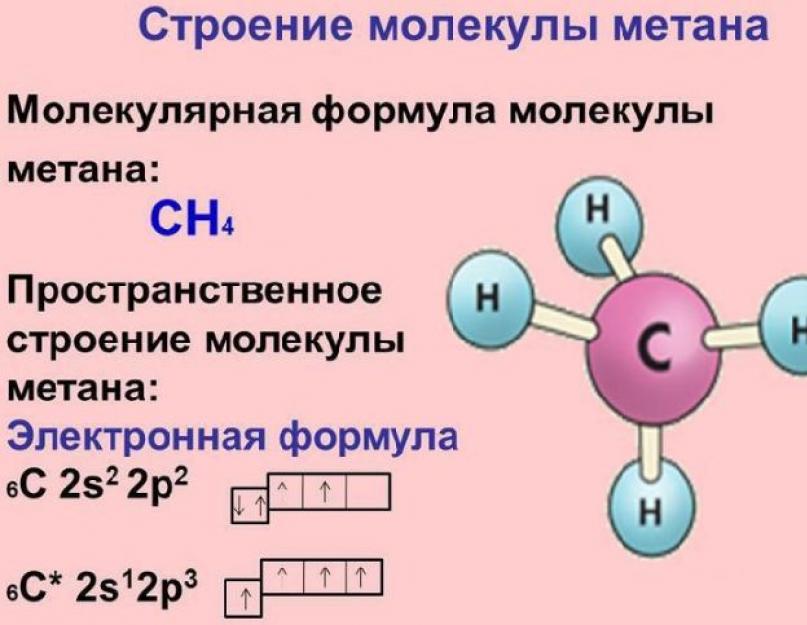
Metan molekülü, ortasında hidrojen atomlarıyla basit (tek) σ bağlarıyla bağlanan karbonun bulunduğu bir tetrahedrondur. Metan molekülünün yapısı ve özellikleri bütünün anlaşılması açısından önemlidir. organik Kimyaçoğunluk olduğundan organik bileşikler metil grupları -CH2 içerir.

Pirinç. 1. Metan molekülünün yapısı.
Metan homolog bir alkan serisi oluşturur. Sonraki her homolog, bir öncekinden birer -CH2 grubu farklıdır.
Uzun alkan molekülleri tetrahedral konfigürasyonları nedeniyle bükülmüş zincirler halinde görünür.
Fiş
Metan Evrende yaygın bir gazdır. Doğal ve ilişkili gazlarda bulunur, denizlerin dibinde oluşur ve bağırsak bakterilerinin hayati aktivitesinin son ürünü olarak açığa çıkar. Metan dev gezegenlerin atmosferinin bir parçasıdır. Satürn'ün uydusu Titan'ın yüzeyinde etan-metan gölleri ve nehirleri bulunmaktadır.

Pirinç. 2. Uydu Titanı.
Endüstride metan izole edilir doğal gaz ve koklaştırma (kalsinasyon) yoluyla elde edilir kömür.
Laboratuvarda metan, kuru sodyum hidroksitin asetik asitle ısıtılmasının yanı sıra asetatın sodyum hidroksit ile eritilmesiyle oluşturulur:
- 2NaOH + CH3COOH → Na2C03 + H20 + CH4;
- CH3COONa + NaOH → CH4 + Na2C03.
Metan ilk kez 1776'da fizikçi Alessandro Volta tarafından bataklıklarda keşfedildi. İki yıl sonra bataklık gazından saf metanı izole etti.
Özellikler
Temel fiziksel özellikler:
- havadan daha hafif;
- kokusuz ve tatsız;
- suda az çözünür;
- moleküler ağırlık - 16;
- erime noktası - -182,49°C;
- kaynama noktası - -161,56°C;
- parlama noktası - 87,8°C;
- kendiliğinden tutuşma sıcaklığı - 537,8°C.
Metan, homolog alkan serilerinin fizikokimyasal özelliklerini belirler. Şu tarihte: normal koşullar metan ve homologları aktif değildir ve yüksek sıcaklığın ve bir katalizörün etkisi altında reaksiyona girer. Ek koşullar C-H bağının bölünmesi için gereklidir.
Metanın ana reaksiyonları:
- nitrasyon:
CH4 + HONO2 → CH3-NO2 + H20;
- halojenasyon:
CH4 + Cl2 → CH3Cl + HC1;
- sülfoklorlama:
CH4 + S02 + Cl2 → CH3-S02Cl + HC1;
- Bakır ve manganez tuzlarının etkisi altında katalitik oksidasyon:
2CH4 + O2 → 2CH3OH;
- tam oksidasyon (yanma):
CH4 + 2O2 → C02 + 2H20 + Q;
- buhar oksidasyonu:
CH4 + H20 → CO + 3H2;
- çatlama (yağ rafinasyon yöntemi):
2CH4 → HC≡CH + 3H2 .

Pirinç. 3. Metanın yanması.
Havadaki metan konsantrasyonunun %4'ten fazla olması patlayıcıdır. Bu nedenle gazın kükürt içeren tiyollerle karıştırılmasıyla metana özel bir koku verilir. Bu, evdeki gaz kaçağının kontrol edilmesine yardımcı olur.
Ne öğrendik?
Metan, alkan sınıfının en basit temsilcisi olup homolog bir seri oluşturur. Doğal gazdan açığa çıkan ve kömürün koklaşması sırasında ortaya çıkan renksiz yanıcı bir gazdır. Yakıt olarak metan kullanılıyor. Yüksek sıcaklıklarda kendiliğinden tutuşur. Gaz, nitrasyona, halojenasyona, sülfoklorinasyona, bir katalizörün etkisi altında oksidasyona, su buharına, yanmaya ve ayrıca petrol rafinasyonunda kullanılan çatlamaya maruz kalır.
Metan (bataklık gazı; CH4) en basit doymuş hidrokarbondur. Renksiz, kokusuz gaz, erime noktası -182,48°. Metan kolayca tutuşur; metan ve hava karışımı patlayıcıdır.
Metan, doğal gazın (%60-99), maden gazının (%35-40) ve çeşitli anaerobik ayrışma ürünlerinin ana bileşenidir. organik maddeörneğin bataklık gazı, sulama alanlarından gelen gazlar. Metan, kömürün koklaşması, kömürün hidrojenlenmesi ve diğer endüstriyel işlemler sırasında büyük miktarlarda oluşur.
Metan, gazlaştırma için yakıt olarak ve ayrıca büyük mol hidrokarbonların endüstriyel sentezi için kullanılır. ağırlık. Şu tarihte: eksik yanma veya metanın katalitik oksidasyonu metanol (bkz. Metil alkol), (bkz.), asetilen (bkz.) oluşturur. Metan ayrıca is, metil klorür, klorbromobenzen, nitrometan ve diğer ürünlerin üretiminde de kullanılır.
Metan bağırsak gazlarında (metan fermantasyonu sonucu), hayvanların ve insanların kanında bulunur.
Metan, parafin hidrokarbonlar grubundan en inert bileşiktir. Fizyolojik metan kayıtsızdır ve yalnızca çok yüksek konsantrasyonlarda zehirlenmeye neden olabilir (metanın su ve kandaki çözünürlüğünün düşük olması nedeniyle). Ancak metanın toksik etkisi havadaki metan konsantrasyonunun düşük olması durumunda da ortaya çıkar. Böylece hava %25-30 metan içerdiğinde ilk belirtiler ortaya çıkar (kalp atış hızının artması, nefes alma hacminin artması, ince kas hareketlerinin koordinasyonunun bozulması vb.). Havadaki yüksek metan konsantrasyonları insanlarda baş ağrısına neden olur. Metanın tam toksik etkisi ancak yüksek tansiyon(2-3 atmosfer).
Akut zehirlenmelerde ilk yardım: Mağdurun zararlı atmosferden uzaklaştırılması. Sıcak su şişeleri. Solunum yoksa, derhal (doktor gelmeden önce) suni teneffüs yapılır ve bu, ancak ölüm sertliği belirtileri ortaya çıktıktan sonra durur.
Metanın kronik etkileri. Havada metan ve metan serisindeki diğer hidrokarbonların bulunduğu endüstrilerde çalışanlarda, yan tarafta gözle görülür değişiklikler tanımlanmıştır (pozitif okülo-kardiyak refleks, belirgin atropin testi). Bununla birlikte, metana kronik maruz kalma ciddi organik değişikliklere neden olmuyor, ancak bazı araştırmacılar madencilerde göz titremesinin ortaya çıkmasını metana uzun süre maruz kalmayla ilişkilendiriyor.
Metan zehirlenmesinin önlenmesi. Yeraltı madenlerinde hacimce %0,75'in üzerindeki metan içeriğine izin verilmez. Metan içeriği artarsa işçiler uzaklaştırılmalı ve tesis havalandırılmalıdır. Madenlerde metan birikimini önlemenin temel önlemi iyi havalandırmanın varlığıdır. Kişisel korunma için basınçlı hava beslemeli kaskların veya hava beslemeli solunum cihazının kullanılması gereklidir.
Metan molekülündeki karbon atomu dördünün örtüşmesi sonucu sp3 hibridizasyonu durumundadır. hibrit yörüngeler Hidrojen atomlarının s-orbitallerine sahip karbon atomu, çok güçlü bir metan molekülü oluşur.
Metan gazı renksiz ve kokusuzdur, havadan hafiftir, suda az çözünür, karbon monoksit (IV) oluşturabilir ve metan soluk mavimsi bir alevle yanar: CH4 + 2O2 = 2H2O.
Metan, havayla (veya oksijenle, özellikle reaksiyon denkleminden de anlaşılacağı gibi hacim oranı 1:2 oranında) karıştığında patlayıcı karışımlar oluşturur. Bu nedenle hem günlük yaşamda (musluklardan gaz sızıntısı) hem de tehlikelidir. Madenlerde eksik yanma durumunda metan, endüstriyel olarak bu şekilde üretilir. Katalizörlerin varlığında metanın oksidasyonu metil alkol ve formaldehit üretir.
Güçlü bir şekilde ısıtıldığında metan şu denkleme göre parçalanır: CH4=C+2H2
Özel olarak tasarlanmış fırınlarda metanın ayrıştırılması, ara ürün olan asitilene gerçekleştirilebilir:
2CH4=C2H 2+3H2
Metan ikame reaksiyonları ile karakterize edilir. Işıkta veya normal sıcaklıkta, halojenler (klor ve brom) yavaş yavaş (aşamalar halinde) metan molekülünden hidrojeni uzaklaştırır ve halojen türevleri olarak adlandırılan bileşikleri oluşturur. çeşitli bileşiklerin karışımı:
CH3Cl-klorometan (metil klorür),CH2Cl2-diklorometan,CHCl3-triklorometan,CCl4-tetraklorometan
Her bileşik bu karışımdan izole edilebilir. Kloroform ve karbon tetraklorür, reçineler, yağlar, kauçuk ve diğer organik maddeler için çözücüler olarak önemlidir.
Metanın halojen türevlerinin oluşumu zincirsiz radikal mekanizması yoluyla gerçekleşir. Işığın etkisi altında klor molekülleri inorganik radikallere ayrışır: Cl2 = 2Cl.
İnorganik radikal Cl, metan molekülünden bir elektronlu bir hidrojen atomunu uzaklaştırarak HCl ve serbest radikal CH3HH'yi oluşturur.
H:C_| H+Cl=H:C +HCl
H| H
Serbest radikal, klor molekülü Cl2 ile etkileşime girerek bir halojen türevi ve bir klor radikali oluşturur:
CH3+Cl_| Cl=CH3-Cl+Cl
Metan normal sıcaklıklarda asitlere, alkalilere ve birçok oksitleyici maddeye karşı daha dirençlidir ancak nitrik asitle reaksiyona girer:
CH4+HNO3=CH3NO2 +H2O
nitrometan
Metan, molekülündeki tüm değerlikler doymuş olduğundan ekleme reaksiyonları yapamaz.
Yukarıdaki ikame reaksiyonlarına C-H bağlarının bölünmesi eşlik eder. Bununla birlikte, yalnızca C-H bağlarının bölünmesinin değil aynı zamanda karbon atomu zincirinin kopmasının da meydana geldiği süreçler bilinmektedir (metan homologlarında bu reaksiyonlar). yüksek sıcaklıklar ve örneğin katalizörlerin varlığında:
C4H10+H2 - dehidrojenasyon işlemi
C4H10-|
C2H6 + C2H4 çatlaması
Metan üretiyor.
Metan doğada yaygındır, hem doğal (% 90-98) hem de yapay olarak odun, turba, kömürün kuru damıtılması sırasında ve ayrıca petrolün parçalanması sırasında açığa çıkan birçok yanıcı gazın ana bileşenidir.
Metan, bataklıkların dibinden ve madenlerdeki kömür damarlarından salınır ve burada bitki artıklarının havaya erişimi olmadan yavaş yavaş ayrışması sırasında oluşur. Bu nedenle metana genellikle bataklık gazı veya maden gazı denir.
Laboratuvar koşullarında metan, bir sodyum asetat ve sodyum hidroksit karışımının ısıtılmasıyla elde edilir:
200 *C
CH3|COONa +NaO|H=Na2CO3 + CH4|
veya alüminyum karbür su ile etkileşime girdiğinde:
Al4C3 +12H2O=4Al(OH)3 +3CH4|
İÇİNDE ikinci durum Metanın çok saf olduğu ortaya çıktı.
Metan şuradan elde edilebilir: basit maddeler bir katalizör varlığında ısıtıldığında: Ni
C+2H2=CH4
Ve ayrıca su gazına dayalı sentez yoluyla
Ni
CO+3H2 =CH4 +H2O
Metan gibi metan homologları laboratuvar koşulları karşılık gelen organik asitlerin tuzlarının alkalilerle kalsinasyonuyla elde edilir. Başka bir yöntem Wurtz reaksiyonudur, yani. monohalojen türevlerinin sodyum metali ile ısıtılması, ör.
C2H5 |Br+2Na+Br|C2H5= C2H5-C2H5+2NaBr
Teknolojide, sentetik benzin (6-10 karbon atomu içeren bir hidrokarbon karışımı) üretmek için, bir katalizör (kobalt bileşiği) varlığında ve yüksek basınçta karbon monoksit (II) ve hidrojenden sentez kullanılır. denklemle ifade edilir:
200*С
nCO+(2n+1)H2=CnH2n+2+nH2O
Alkanların uygulamaları
Yüksek kalorifik değeri nedeniyle metan büyük miktarlarda yakıt olarak tüketilir (evsel gazda ve sanayide. Ondan elde edilen maddeler yaygın olarak kullanılır: hidrojen, asitelen, kurum. Formaldehit üretimi için başlangıç \u200b\u200bhammaddesi görevi görür, metil alkolün yanı sıra çeşitli sentetik ürünler
Yüksek doymuş hidrokarbonların (20-25 karbon atomlu parafinler) oksidasyonu büyük endüstriyel öneme sahiptir. Bu şekilde sentetiktir. yağ asidi Sabun, çeşitli deterjan, yağlayıcı, vernik ve emaye üretiminde kullanılan farklı zincir uzunluklarına sahip.
Yakıt olarak sıvı hidrokarbonlar kullanılır (benzin ve gazyağının bir parçasıdır). Alkanlar organik sentezde yaygın olarak kullanılır.
Metan havada yanma mavimsi bir alevle yanar ve açığa çıkan enerji 1 m3 başına yaklaşık 39 MJ'dir. Havalı formlar patlayıcı karışımlar. Maden işletmelerinde, kömür işleme ve briket fabrikalarında ve ayırma tesislerinde maden yataklarının yer altı madenciliği sırasında açığa çıkan metan özellikle tehlikelidir. Böylece havadaki içerik %5-6'ya kadar olduğunda metan bir ısı kaynağının yakınında yanar (tutuşma sıcaklığı 650-750°C), %5-6'dan %14-16'ya kadar patlar, %16'dan fazlası yanabilir. dışarıdan oksijen akışı. Metan konsantrasyonundaki azalma patlamaya yol açabilir. Ek olarak, havadaki metan konsantrasyonunun önemli ölçüde artması boğulmaya neden olabilir (örneğin, %43 metan konsantrasyonu %12 O2'ye karşılık gelir).
Patlayıcı yanma 500-700 hızında yayılır m/sn; Kapalı bir hacimde patlama sırasındaki gaz basıncı 1'dir Min/m 2 . Bir ısı kaynağıyla temas ettikten sonra metan tutuşması bir miktar gecikmeyle meydana gelir. Güvenli patlayıcıların ve patlamaya dayanıklı elektrikli ekipmanların oluşturulması bu özelliğe dayanmaktadır. Metan varlığı nedeniyle tehlikeli olan sahalarda (çoğunlukla kömür madenleri), sözde. gaz modu.
150-200 °C'de ve 30-90 atm basınçta metan oksitlenir. formik asit.
Metan, doğada yaygın olarak bulunan gaz hidratlar olan inklüzyon bileşiklerini oluşturur.
Metan uygulaması
Metan termal olarak en kararlı doymuş hidrokarbondur. Evsel ve endüstriyel yakıt olarak ve sanayi için hammadde olarak yaygın olarak kullanılmaktadır. . Böylece metanın klorlanması metil klorür, metilen klorür, kloroform ve karbon tetraklorür üretir.
Metanın eksik yanması kuruma neden olur , katalitik oksidasyon sırasında - formaldehit , kükürt - karbon disülfür ile etkileşime girdiğinde .
Metanın termal-oksidatif parçalanması ve elektro parçalanması, asetilen üretimi için önemli endüstriyel yöntemlerdir. .
Bir metan ve amonyak karışımının katalitik oksidasyonu, hidrosiyanik asitin endüstriyel üretiminin temelini oluşturur. . Metan, amonyak üretiminde hidrojen kaynağı olarak ve ayrıca su gazı (sözde sentez gazı) üretiminde kullanılır: CH4 + H2O → CO + 3H2, hidrokarbonların endüstriyel sentezi için kullanılır. , alkoller, aldehitler vb. Önemli metan türevi - nitrometan .
Metan ve sera etkisi
Metan Sera gazı. Karbondioksitin iklim üzerindeki etkisinin derecesi geleneksel olarak bir olarak alınırsa, metanın sera etkisi 23 birim olacaktır. Atmosferdeki metan seviyeleri son iki yüzyılda çok hızlı bir şekilde arttı.
Şimdi modern atmosferdeki ortalama metan CH4 içeriğinin 1,8 ppm olduğu tahmin edilmektedir ( milyonda parça, milyonda parça). Ve her ne kadar gaz molekülü başına karbondioksit (CO2) içeriğinden 200 kat daha az olsa da metanın sera etkisi, yani güneşle ısınan Dünya tarafından yayılan ısının yayılmasına ve tutulmasına katkısı - CO2'den önemli ölçüde daha yüksektir. Ek olarak metan, diğer sera gazlarına karşı şeffaf olan spektrumun "pencerelerinde" Dünya'nın radyasyonunu emer. Sera gazları olmadan - CO 2, su buharı, metan ve diğer bazı yabancı maddeler ortalama sıcaklık Dünya yüzeyinde sıcaklık yalnızca –23°C olurdu, ama şimdi yaklaşık +15°C.
Metan yer kabuğundaki çatlaklardan okyanusun dibine sızıyor ve madencilik sırasında ve ormanların yakılması sırasında önemli miktarlarda açığa çıkıyor. Yakın zamanda yeni, tamamen beklenmedik bir metan kaynağı keşfedildi - yüksek bitkiler ancak oluşum mekanizmaları ve bu sürecin bitkiler için önemi henüz açıklığa kavuşturulmamıştır.
Metan organik bir gazdır, kokusuz ve renksizdir. CH4 kimyasal formülüdür ve maddenin kütlesi havanın kütlesinden azdır. Suda çözünme yavaş ilerler. Metanın organik doğasından bahsetmişken, bu, oluşum vakalarının neredeyse %95'inin doğal nitelikte olduğu anlamına gelir. Örneğin bitki artıklarının ayrışması sırasında açığa çıkar. Bu nedenle, birçok özelliğinin daha önce çalışılmış olması şaşırtıcı değildir. Yeni Çağİnsanlar durgun su kütlelerinin yüzeyinde hava kabarcıkları gözlemlediğinde. Bu kabarcıklar tam olarak bataklığın dibindeki bitkilerin çürümesi sırasında açığa çıkan metandı.
Diğer doğal gaz kaynakları şunlardır:
- Hayvancılık. Midelerinde yaşayan bakteriler yaşamları boyunca metan gazı yayarlar ve metan gazının payı tüm atmosferik gazların %20'sini oluşturur.
- Bitkiler. Metan fotosentez sırasında açığa çıkan ayrılmaz bir maddedir.
- Haşarat. Termitler en aktif şekilde metan üretirler.
- Mayınlar. Altında yeryüzü Metanın oluştuğu kömürün sürekli yavaş bir ayrışması vardır.
- Petrol kuyuları. Bu gazın petroldeki içeriği çok büyüktür.
- Volkanlar. Metan da muhtemelen tarih öncesi organik maddenin aktif ayrışması nedeniyle burada oluşuyor.
- Okyanus. Sualtının derinliklerinde metanın sızabileceği çatlaklar var.
- Orman yanıyor.
- Sanayi. Bu işletmelerin görünürdeki faaliyetlerine rağmen, toplam kütle içindeki emisyon payları ihmal edilebilir düzeydedir.
Yukarıdaki örneklerin tümü, metanın sürekli olarak atmosferde bulunduğunu, görünümünün aktif insan faaliyetinin başlangıcıyla ilişkili olmadığını açıkça doğrulamaktadır. Bu nedenle bir gezegende metan gazının bulunması, o gezegende yaşam olabileceğinin ya da bir zamanlar orada olduğunun bir işaretidir.
Ancak bu gazın “doğal olması” bize zarar vermeyeceği anlamına gelmiyor. Buharları, özellikle yüksek konsantrasyonlarda, insan ölümüne yol açabilecek kapasitededir. Madencilik endüstrisinin gelişiminin ilk aşamalarında, madencilerin metan ile patlamaları veya ciddi zehirlenmeleri sıklıkla kaydedildi. Medyadaki bilgileri takip ederseniz bu olaylar Türkiye'de de gerçekleşiyor. modern dünya. Metan zehirlenmesi olasılığını en aza indirmek için, ilk işarette, konsantrasyonun doğru bir şekilde belirlenmesinin mümkün olacağı odadaki havanın profesyonel bir analizi için sipariş vermek gerekir.
Modern dünyada metan
Gaz modern dünyada yaygın olarak kullanılmaktadır:
- İçten yanmalı motorlar çoğunlukla metanla çalışır.
- Gaz, antiseptikler ve uyku hapları da dahil olmak üzere birçok ilacın üretilmesini mümkün kılar.
- Metan, gübrelerin ve diğer birçok maddenin yapıldığı formaldehit ve metanolün temelidir.
- Metan olmadan yangın söndürücüler ve çözücüler yapmak mümkün değildir.
- Hidrosiyanik asit sadece bir zehir değildir, aynı zamanda geniş bir yelpazeye sahiptir. pratik kullanım ve üretim süreci metan ve amonyak karışımının oksidasyonuna dayanmaktadır.
Metan ve insan vücudu için tehlikesi
Metan tehlikesi aşağıdaki faktörlerde yatmaktadır:
- Patlama tehlikesi. Ona “patlayıcı gaz” adını veren de bu özelliğiydi. En küçük kıvılcım olan metan birikimi - tüm bunlar yıkıcı bir patlamaya yol açabilir. Bu nedenle bu gazın birikiminin veya emisyonunun kaydedildiği yerlerde sigara içmemeli veya açık alev kaynaklarını kullanmamalısınız. Ancak bazen bu güvenlik önlemleri bile yeterli olmuyor; gaz, can almaya devam ediyor.
- Metanın madenlerde birikebileceği özellikten daha önce bahsetmiştik. Esas olarak büyük kaya katmanları arasındaki boşluklarda ve madencilerin madencilik işlemi sırasında yarattığı boşluklarda bulunur. Madencilik ne kadar aktifse, metan emisyonları da o kadar yoğun oluyor ve bu nedenle bu gazdan en çok ölenler maden işçileri oluyor.
- Patlamalar tek tehlike değildir; metan da ciddi zehirlenmelere neden olabilir. Büyük miktarlarda solunması kanda oksijen eksikliğine, kulaklarda "çınlamaya" ve "dökme demir" kafa hissine yol açar. Konsantrasyon artışı kalbin daha hızlı atmasına neden olur, kişi genel halsizlik hisseder, mide bulantısı çeker ve cilt kızarır. En ciddi sonuçları bayılma, solgunluk, kasılmalar ve hatta ölümdür.
- Ne yazık ki, saf formu Metanın kokusu yoktur ve bu nedenle tespit edilmesi zordur. Koklayabildiğimiz “metan” aroması, kullanımını daha güvenli ve kontrollü hale getiren özel kokuların sonucudur.
- Madenlerde elbette metana hiçbir koku eklenmez. Antik çağlardan beri insanlar kullanıyor özel yollarla havadaki varlığının tespit edilmesini mümkün kılıyor. Örneğin ilk madenciler yanlarına bir kanarya aldılar. Kuş şarkı söylemeyi bırakırsa veya hatta ölürse, o zaman kendisini acilen kesimden uzaklaştırmak gerekir.
- 50'li yıllarda geçen yüzyıl hava karışımındaki metan yüzdesini doğru bir şekilde belirlemeyi mümkün kılan özel aletler kullanmaya başladı. Ancak deneyimli işçiler kanaryanın yeni çıkmış cihazlardan çok daha iyi bir yöntem olduğunu söyledi. Kesinlikle, modern cihazlar daha hassas ve kompakt olduğundan bazen lambalar gibi doğrudan madenci kasklarına monte edilirler. Madenlere sabit sensörler de kurularak sürekli olarak uzmanlara bilgi aktarılıyor. Tehlikeli artışlar, acil elektrik kesintilerine ve personelin tahliyesine neden olur. Günümüzde kömür tozunun patlamasını en fazla lokalize edebilecek özel tesisler de kullanılmaktadır. erken aşamalar. Başlamadan önce vardiya sayesinde madendeki metan miktarı son derece güvenli seviyelere indiriliyor.
İnsanlar için metan tehlikesinin aynı anda iki taraftan geldiği ortaya çıktı. Patlama eğilimi, zehirli etki, koku ve rengin olmaması - tüm bunlar "patlayıcı gazı" inanılmaz derecede tehlikeli hale getirir. En kötü yanlarıyla karşılaşmamak için önceden havadaki metan konsantrasyonunun seviyesini belirleyebilecek bir çevresel değerlendirme yaptırmakta fayda var.