Ozonun fiziksel özellikleri çok karakteristiktir: Kolayca patlayan mavi bir gazdır. Bir litre ozon yaklaşık 2 gram, hava ise 1.3 gramdır. Bu nedenle ozon havadan ağırdır. Ozonun erime noktası eksi 192,7ºС'dir. Bu "erimiş" ozon koyu mavi bir sıvıdır. Ozon "buz", menekşe renk tonu ile koyu mavi bir renge sahiptir ve 1 mm'den fazla kalınlıkta opak hale gelir. Ozonun kaynama noktası eksi 112ºС'dir. Gaz halinde ozon diyamanyetiktir, yani. sahip değil manyetik özellikler ve sıvı halde zayıf bir şekilde paramanyetiktir. Ozonun erimiş suda çözünürlüğü oksijenden 15 kat daha fazladır ve yaklaşık 1,1 g/l'dir. Bir litre asetik asit, oda sıcaklığında 2.5 gram ozonu çözer. Ayrıca uçucu yağlar, terebentin, karbon tetraklorür. Ozon kokusu, 15 µg/m3 havanın üzerindeki konsantrasyonlarda hissedilir. Minimum konsantrasyonlarda "tazelik kokusu" olarak algılanır, daha yüksek konsantrasyonlarda keskin tahriş edici bir renk tonu kazanır.
Ozon oksijenden aşağıdaki formüle göre oluşturulur: 3O2 + 68 kcal → 2O3. Ozon oluşumunun klasik örnekleri: fırtına sırasında yıldırım etkisi altında; üst atmosferde güneş ışığına maruz kalır. Ozon ayrıca, örneğin hidrojen peroksitin ayrışması sırasında atomik oksijen salınımının eşlik ettiği herhangi bir işlem sırasında da oluşturulabilir. Ozonun endüstriyel sentezi, düşük sıcaklıklarda elektrik deşarjlarının kullanılmasıyla ilişkilidir. Ozon üretme teknolojileri birbirinden farklı olabilir. Bu nedenle, tıbbi amaçlar için kullanılan ozon elde etmek için sadece saf (katışıksız) tıbbi oksijen kullanılır. Oluşan ozonun oksijen safsızlığından ayrılması, fiziksel özelliklerdeki farklılıklar nedeniyle genellikle zor değildir (ozon daha kolay sıvılaşır). Reaksiyonun belirli kalitatif ve kantitatif parametreleri gerekli değilse, ozonun elde edilmesi herhangi bir özel zorluk oluşturmaz.
O3 molekülü kararsızdır ve ısı salınımı ile oldukça hızlı bir şekilde O2'ye dönüşür. Düşük konsantrasyonlarda ve yabancı safsızlıklar olmadan ozon, yüksek konsantrasyonlarda bir patlama ile yavaş yavaş ayrışır. Alkol temas ettiğinde anında tutuşur. Ozonun ihmal edilebilir miktarlarda oksidasyon substratı (organik maddeler, bazı metaller veya bunların oksitleri) ile ısıtılması ve teması, ayrışmasını keskin bir şekilde hızlandırır. Ozon, bir stabilizatör (az miktarda HNO3) varlığında -78ºº'de ve ayrıca camdan, bazı plastiklerden veya değerli metallerden yapılmış kaplarda uzun süre saklanabilir.
Ozon en güçlü oksitleyici ajandır. Bu fenomenin nedeni, bozunma sürecinde atomik oksijenin oluşması gerçeğinde yatmaktadır. Bu tür oksijen, moleküler oksijenden çok daha agresiftir, çünkü oksijen molekülünde, moleküler orbitalin toplu kullanımlarından dolayı dış seviyede elektron eksikliği o kadar belirgin değildir.
18. yüzyılda, ozon varlığında cıvanın parlaklığını kaybettiği ve cama yapıştığı fark edildi; oksitlenmiş. Ozon, sulu bir potasyum iyodür çözeltisinden geçirildiğinde, gaz halinde iyot salınmaya başlar. Saf oksijenle aynı "hileler" işe yaramadı. Daha sonra, ozonun insanlık tarafından hemen benimsenen özellikleri keşfedildi: ozon mükemmel bir antiseptik olduğu ortaya çıktı, ozon herhangi bir menşeli organik maddeleri sudan (parfümler ve kozmetikler, biyolojik sıvılar) hızla uzaklaştırdı, endüstride yaygın olarak kullanıldı ve günlük yaşamda ve diş matkabına alternatif olarak kendini kanıtlamıştır.
21. yüzyılda ozonun insan yaşamının ve faaliyetinin tüm alanlarında kullanımı büyüyor ve gelişiyor ve bu nedenle egzotikten günlük işler için tanıdık bir araca dönüşmesine tanık oluyoruz. OZONE O3, oksijenin allotropik bir formudur.
makbuz ve fiziksel özellikler ozon.
Bilim adamları, elektrostatik makinelerle deney yapmaya başladıklarında ilk olarak bilinmeyen bir gazın varlığından haberdar oldular. 17. yüzyılda oldu. Ancak yeni gazı ancak gelecek yüzyılın sonunda incelemeye başladılar. 1785 yılında Hollandalı fizikçi Martin van Marum, elektrik kıvılcımlarını oksijenden geçirerek ozonu yarattı. Ozon adı sadece 1840'ta ortaya çıktı; İsviçreli kimyager Christian Schönbein tarafından Yunan ozon kokusundan türetilerek icat edildi. Bu gazın kimyasal bileşimi oksijenden farklı değildi, ancak çok daha agresifti. Böylece, kahverengi iyot salınımı ile renksiz potasyum iyodürü anında oksitledi; Shenbein, potasyum iyodür ve nişasta çözeltisi ile emprenye edilmiş kağıdın mavilik derecesine göre ozonu belirlemek için bu reaksiyonu kullandı. Oda sıcaklığında inaktif olan cıva ve gümüş bile ozon varlığında oksitlenir.
Oksijen gibi ozon moleküllerinin sadece oksijen atomlarından oluştuğu, sadece ikiden değil üçten oluştuğu ortaya çıktı. Oksijen O2 ve ozon O3 - bir kimyasal element tarafından iki gaz (normal koşullar altında) oluşumunun tek örneği basit maddeler. O3 molekülünde atomlar bir açıyla yerleştirilmiştir, dolayısıyla bu moleküller polardır. Ozon, elektriksel deşarjlar, ultraviyole ışınları, gama ışınları, hızlı elektronlar ve diğer yüksek enerjili parçacıkların etkisi altında oksijen moleküllerinden oluşan serbest oksijen atomlarının O2 moleküllerine “yapışması” sonucu üretilir. Ozon her zaman, ultraviyole radyasyon yayan bakterisidal cıva-kuvars lambaların yanında, fırçaların “ışıldadığı” çalışan elektrikli makinelerin yakınında kokar. Oksijen atomları da bazı durumlarda serbest bırakılır. kimyasal reaksiyonlar. Asitlenmiş suyun elektrolizi sırasında, havada ıslak beyaz fosforun yavaş oksidasyonu sırasında, yüksek oksijen içeriğine sahip bileşiklerin (KMnO4, K2Cr2O7, vb.) veya konsantre sülfürik asidin baryum peroksiti üzerinde. Oksijen atomları her zaman bir alev içinde bulunur, bu nedenle jeti yönlendirirseniz sıkıştırılmış hava bir oksijen brülörünün alevi boyunca havada karakteristik ozonun kokusu bulunacaktır.
3O2 → 2O3 reaksiyonu oldukça endotermiktir: 1 mol ozon üretmek için 142 kJ harcanmalıdır. Ters reaksiyon, enerjinin serbest bırakılmasıyla ilerler ve çok kolay bir şekilde gerçekleştirilir. Buna göre, ozon kararsızdır. Safsızlıkların yokluğunda, gaz halindeki ozon 70°C'lik bir sıcaklıkta yavaş yavaş ve 100°C'nin üzerinde hızla ayrışır.Ozon bozunma hızı, katalizörlerin varlığında önemli ölçüde artar. Gazlar (örneğin nitrik oksit, klor) ve birçok katı madde (hatta kap duvarları) olabilirler. Bu nedenle saf ozonun elde edilmesi zordur ve onunla çalışmak patlama olasılığı nedeniyle tehlikelidir.
Ozonun keşfinden sonraki on yıllar boyunca, temel fiziksel sabitlerinin bile bilinmemesi şaşırtıcı değildir: uzun bir süre boyunca hiç kimse saf ozon elde etmeyi başaramadı. D.I. Mendeleev'in Kimyanın Temelleri adlı ders kitabında yazdığı gibi, "gaz halindeki ozonu hazırlamanın tüm yöntemleri için, oksijen içeriği her zaman önemsizdir, genellikle yalnızca yüzde onda birkaçı, nadiren yüzde 2 ve yalnızca çok düşük sıcaklık%20'ye ulaşır. Sadece 1880'de Fransız bilim adamları J. Gotfeil ve P. Chappui, eksi 23 ° C sıcaklıkta saf oksijenden ozonu elde ettiler. Ozonun kalın bir tabakada güzel bir mavi renge sahip olduğu ortaya çıktı. Soğutulmuş ozonlanmış oksijen yavaşça sıkıştırıldığında gaz koyu maviye döndü ve basıncın hızlı bir şekilde serbest bırakılmasından sonra sıcaklık daha da düştü ve koyu mor sıvı ozon damlacıkları oluştu. Gaz hızlı bir şekilde soğutulmadıysa veya sıkıştırılmadıysa, ozon sarı bir flaşla anında oksijene dönüştü.
Daha sonra ozon sentezi için uygun bir yöntem geliştirildi. Konsantre bir perklorik, fosforik veya sülfürik asit çözeltisi, platin veya kurşun(IV) oksitten yapılmış soğutulmuş bir anot ile elektrolize tabi tutulursa, anotta salınan gaz %50'ye kadar ozon içerecektir. Ozonun fiziksel sabitleri de rafine edildi. Oksijenden çok daha hafif sıvılaşır - -112 ° C sıcaklıkta (oksijen - -183 ° C'de). -192.7 °C'de ozon katılaşır. Katı ozon mavi-siyah renktedir.
Ozonla yapılan deneyler tehlikelidir. Gaz halindeki ozon, havadaki konsantrasyonu %9'u aşarsa patlayabilir. Sıvı ve katı ozon, özellikle oksitleyici maddelerle temas ettiğinde daha kolay patlar. Ozon, florlu hidrokarbonlarda (freonlar) çözeltiler şeklinde düşük sıcaklıklarda depolanabilir. Bu çözümler mavi renktedir.
Ozonun kimyasal özellikleri.
Ozon, son derece yüksek bir reaktivite ile karakterizedir. Ozon en güçlü oksitleyici ajanlardan biridir ve bu bakımdan sadece flor ve oksijen florür OF2'den daha düşüktür. Oksitleyici bir ajan olarak ozonun aktif prensibi, ozon molekülünün bozunması sırasında oluşan atomik oksijendir. Bu nedenle, oksitleyici bir ajan olarak hareket eden ozon molekülü, kural olarak, yalnızca bir oksijen atomunu “kullanır”, diğer ikisi ise serbest oksijen şeklinde salınır, örneğin 2KI + O3 + H2O → I2 + 2KOH + O2. Diğer birçok bileşik aynı şekilde oksitlenir. Ancak, ozon molekülünün oksidasyon için sahip olduğu üç oksijen atomunun tamamını kullandığı durumlarda istisnalar vardır, örneğin 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3.
Ozon ve oksijen arasındaki çok önemli bir fark, ozonun oksitleyici özellikler zaten oda sıcaklığında. Örneğin, PbS ve Pb(OH)2 normal koşullar altında oksijen ile reaksiyona girmezken, ozon varlığında sülfür PbSO4'e ve hidroksit PbO2'ye dönüştürülür. Ozonlu bir kaba konsantre bir amonyak çözeltisi dökülürse, beyaz duman görünecektir - bu ozon, amonyum nitrit NH4NO2 oluşturmak üzere amonyağı oksitlemiştir. Ozonun özellikle karakteristik özelliği, AgO ve Ag2O3 oluşumuyla gümüş parçaları “karartma” yeteneğidir.
Bir elektron bağlayıp negatif iyon O3-'e dönüşerek ozon molekülü daha kararlı hale gelir. Bu tür anyonları içeren "ozonat tuzları" veya ozonitler uzun zamandır bilinmektedir - bunlar lityum dışındaki tüm alkali metallerden oluşur ve ozonitlerin stabilitesi sodyumdan sezyuma yükselir. Alkali toprak metallerinin bazı ozonitleri de bilinmektedir, örneğin Ca(O3)2. Gaz halinde ozon akımı katı bir kuru alkalinin yüzeyine yönlendirilirse, ozonidler içeren turuncu-kırmızı bir kabuk oluşur, örneğin 4KOH + 4O3 → 4KO3 + O2 + 2H2O. Aynı zamanda, katı alkali suyu etkili bir şekilde bağlar, bu da ozonutin ani hidrolizini önler. Bununla birlikte, fazla su ile ozonitler hızla ayrışır: 4KO3 + 2H2O → 4KOH + 5O2. Ayrışma ayrıca depolama sırasında meydana gelir: 2KO3 → 2KO2 + O2. Ozonidler, sıvı amonyakta yüksek oranda çözünürler, bu da onları saf formlarında izole etmeyi ve özelliklerini incelemeyi mümkün kıldı.
Ozonun temas ettiği organik maddeleri genellikle yok eder. Böylece ozon, klordan farklı olarak benzen halkasını parçalayabilir. Ozonla çalışırken kauçuk tüpler ve hortumlar kullanamazsınız - anında “sızarlar”. Ozon, büyük miktarda enerji açığa çıkararak organik bileşiklerle reaksiyona girer. Örneğin terebentin, metan ve diğer birçok maddeye batırılmış eter, alkol, pamuk yünü ozonlu hava ile temas ettiğinde kendiliğinden tutuşur ve ozonun etilen ile karıştırılması güçlü bir patlamaya yol açar.
Ozon kullanımı.
Ozon her zaman organik maddeyi "yakmaz"; bazı durumlarda yüksek oranda seyreltik ozon ile spesifik reaksiyonlar gerçekleştirmek mümkündür. Örneğin, oleik asidi ozonlarken (büyük miktarlarda bulunur. sebze yağları) yüksek kaliteli yağlama yağları, sentetik elyaflar ve plastikler için plastikleştiriciler üretmek için kullanılan azelaik asit HOOC(CH2)7COOH oluşturulur. Benzer şekilde, naylon sentezinde kullanılan adipik asit elde edilir. 1855'te Schönbein, C=C çift bağları içeren doymamış bileşiklerin ozon ile reaksiyonunu keşfetti, ancak Alman kimyager H. Staudinger'in bu reaksiyonun mekanizmasını kurması 1925 yılına kadar değildi. Ozon molekülü, çift bağı ozonid oluşumu ile birleştirir - bu sefer organik ve bir oksijen atomu C \u003d C bağlarından birinin yerini alır ve -O-O- grubu diğerinin yerini alır. Bazı organik ozonitler saf halde izole edilmiş olsa da (örneğin, etilen ozonid), ozonitler serbest halde çok kararsız olduklarından, bu reaksiyon genellikle seyreltik çözelti içinde gerçekleştirilir. patlayıcılar. Doymamış bileşiklerin ozonlama reaksiyonu, organik kimyacılar arasında büyük saygı görmektedir; bu tepkiye sahip görevler genellikle okul olimpiyatları. Gerçek şu ki, ozonid su tarafından ayrıştırıldığında, tanımlanması kolay olan ve orijinal doymamış bileşiğin yapısını daha da oluşturan iki aldehit veya keton molekülü oluşur. Böylece, 20. yüzyılın başlarında kimyagerler, doğal olanlar da dahil olmak üzere, C=C bağları içeren birçok önemli organik bileşiğin yapısını oluşturdular.
Ozonun önemli bir uygulama alanı içme suyunun dezenfeksiyonudur. Genellikle su klorludur. Bununla birlikte, klor etkisi altında sudaki bazı safsızlıklar, çok hoş olmayan bir kokuya sahip bileşiklere dönüştürülür. Bu nedenle, uzun zamandır klorun ozon ile değiştirilmesi önerilmiştir. Ozonlanmış su yabancı koku veya tat almaz; birçok organik bileşik ozonla tamamen oksitlendiğinde sadece karbondioksit ve su oluşur. Ozon ile arındırın ve atık su. Fenoller, siyanürler, yüzey aktif maddeler, sülfitler, kloraminler gibi kirleticilerin bile ozon oksidasyonu ürünleri, renk ve kokusu olmayan zararsız bileşiklerdir. Fazla ozon, oksijen oluşumu ile hızla ayrışır. Ancak su ozonlaması klorlamadan daha pahalıdır; ayrıca ozon taşınamaz ve yerinde üretilmesi gerekir.
Atmosferdeki ozon.
Dünya atmosferinde çok fazla ozon yok - 4 milyar ton, yani. ortalama olarak sadece 1 mg/m3. Ozon konsantrasyonu, Dünya yüzeyinden uzaklaştıkça artar ve 20-25 km yükseklikte stratosferde maksimuma ulaşır - bu "ozon tabakası" dır. Atmosferden gelen tüm ozon, normal basınçta Dünya yüzeyinin yakınında toplanırsa, sadece 2-3 mm kalınlığında bir tabaka elde edilecektir. Ve havadaki bu kadar az miktarda ozon aslında Dünya'da yaşam sağlıyor. Ozon, tüm canlılar için zararlı olan güneşin sert ultraviyole ışınlarının Dünya yüzeyine ulaşmasına izin vermeyen bir "koruyucu perde" oluşturur.
Son yıllarda, önemli ölçüde azaltılmış stratosferik ozon içeriğine sahip alanlar olan "ozon delikleri" olarak adlandırılan alanların ortaya çıkmasına çok dikkat edildi. Böyle bir "sızdıran" kalkan sayesinde, Güneş'in daha sert ultraviyole radyasyonu Dünya'nın yüzeyine ulaşır. Bu nedenle bilim adamları uzun süredir atmosferdeki ozonu izliyorlar. 1930'da İngiliz jeofizikçi S. Chapman, stratosferdeki sabit ozon konsantrasyonunu açıklamak için dört reaksiyonlu bir şema önerdi (bu reaksiyonlara M'nin fazla enerjiyi taşıyan herhangi bir atom veya molekül anlamına geldiği Chapman döngüsü denir):
O + O + M → O2 + M
O + O3 → 2O2
O3 → O2 + O.
Bu döngünün birinci ve dördüncü reaksiyonları fotokimyasaldır, güneş ışınımının etkisi altındadır. Bir oksijen molekülünün atomlara ayrışması için, 242 nm'den daha az dalga boyuna sahip radyasyon gereklidir, oysa ozon ışık 240-320 nm bölgesinde emildiğinde bozunur (ikinci reaksiyon bizi sadece sert ultraviyoleden korur, çünkü oksijen bu spektral bölgede absorbe etmez). Kalan iki reaksiyon termaldir, yani. ışığın etkisi olmadan gidin. Ozonun yok olmasına yol açan üçüncü reaksiyonun bir aktivasyon enerjisine sahip olması çok önemlidir; bu, böyle bir reaksiyonun hızının, katalizörlerin etkisiyle artırılabileceği anlamına gelir. Anlaşıldığı üzere, ozon bozunması için ana katalizör nitrik oksit NO'dur. En şiddetli güneş radyasyonunun etkisi altında azot ve oksijenden üst atmosferde oluşur. Ozonosferde bir kez, O3 + NO → NO2 + O2, NO2 + O → NO + O2 olmak üzere iki reaksiyon döngüsüne girer, bunun sonucunda atmosferdeki içeriği değişmez ve sabit ozon konsantrasyonu azalır. Stratosferdeki ozon içeriğinde azalmaya yol açan başka döngüler de vardır, örneğin klorun katılımıyla:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
Ozon ayrıca toz ve gazlar tarafından da yok edilir. çok sayıda volkanik patlamalar sırasında atmosfere salınır. AT son zamanlar ozonun aynı zamanda gazlardan salınan hidrojeni yok etmede de etkili olduğu öne sürülmüştür. yer kabuğu. Ozon oluşumu ve bozunmasıyla ilgili tüm reaksiyonların toplamı, bir ozon molekülünün stratosferdeki ortalama ömrünün yaklaşık üç saat olduğu gerçeğine yol açar.
Ozon tabakasını etkileyen doğal faktörlerin yanı sıra yapay faktörlerin de olduğu varsayılmaktadır. İyi bilinen bir örnek, klor atomlarının kaynakları olan freonlardır. Freonlar, hidrojen atomlarının flor ve klor atomları ile değiştirildiği hidrokarbonlardır. Soğutmada ve aerosol kutularını doldurmak için kullanılırlar. Sonunda, freonlar havaya girer ve hava akımlarıyla yavaş yavaş yükselir ve sonunda ozon tabakasına ulaşır. Güneş radyasyonunun etkisi altında ayrışan freonlar, ozonu katalitik olarak ayrıştırmaya başlar. "Ozon delikleri" için freonların ne ölçüde suçlanacağı henüz tam olarak bilinmiyor ve yine de kullanımlarını sınırlamak için uzun süredir önlemler alındı.
Hesaplamalar, 60-70 yıl içinde stratosferdeki ozon konsantrasyonunun %25 oranında azalabileceğini göstermektedir. Ve aynı zamanda, yüzey tabakasındaki ozon konsantrasyonu - troposfer, artacaktır, bu da kötüdür, çünkü ozon ve havadaki dönüşümlerinin ürünleri zehirlidir. Troposferdeki ozonun ana kaynağı, hava kütleleri ile stratosferik ozonun alt katmanlara aktarılmasıdır. Yılda yaklaşık 1,6 milyar ton ozon tabakasına girer. Atmosferin alt kısmındaki bir ozon molekülünün ömrü çok daha uzundur - 100 günden fazla, çünkü yüzey tabakasında ozonu yok eden daha az ultraviyole güneş radyasyonu yoğunluğu vardır. Genellikle, troposferde çok az ozon bulunur: temiz temiz havada, konsantrasyonu ortalama sadece 0.016 μg / l'dir. Havadaki ozonun konsantrasyonu sadece rakıma değil aynı zamanda araziye de bağlıdır. Bu nedenle, ozon orada daha yavaş bozunduğundan, okyanusların üzerinde her zaman karadan daha fazla ozon vardır. Soçi'deki ölçümler, havanın deniz kıyısı kıyıdan 2 km uzaklıktaki bir ormandakinden %20 daha fazla ozon içerir.
Modern insanlar atalarından çok daha fazla ozon soluyor. Bunun temel nedeni havadaki metan ve nitrojen oksit miktarının artmasıdır. Böylece atmosferdeki metan içeriği, doğal gazın kullanılmaya başlandığı 19. yüzyılın ortalarından bu yana sürekli olarak artmaktadır. Azot oksitlerle kirlenmiş bir atmosferde metan, oksijen ve su buharını içeren karmaşık bir dönüşüm zincirine girer ve bunun sonucu CH4 + 4O2 → HCHO + H2O + 2O3 denklemi ile ifade edilebilir. Diğer hidrokarbonlar da metan görevi görebilir, örneğin arabaların egzoz gazlarında bulunanlar. eksik yanma benzin. Sonuç olarak, son on yılda büyük şehirlerin havasında ozon konsantrasyonu on kat arttı.
Şimşek oksijenin ozona dönüşmesine katkıda bulunduğundan, bir fırtına sırasında havadaki ozon konsantrasyonunun önemli ölçüde arttığına her zaman inanılmıştır. Aslında, artış önemsizdir ve bir fırtına sırasında değil, ondan birkaç saat önce meydana gelir. Bir fırtına sırasında ve ondan birkaç saat sonra ozon konsantrasyonu azalır. Bu, fırtınadan önce güçlü dikey karışımın meydana gelmesiyle açıklanır. hava kütleleri, böylece ek ozon üst katmanlardan gelir. Ek olarak, bir fırtınadan önce, elektrik alan gücü artar ve örneğin dalların uçları gibi çeşitli nesnelerin noktalarında bir korona deşarjı oluşumu için koşullar yaratılır. Aynı zamanda ozon oluşumuna da katkıda bulunur. Ve sonra geliştirme ile gök gürültüsü bulutu altında, doğrudan bulutun altındaki ozon içeriğini azaltan güçlü yükselen hava akımları ortaya çıkar.
Havadaki ozon içeriği hakkında ilginç bir soru iğne yapraklı ormanlar. Örneğin, Derste inorganik kimya G. Remy'nin "İğne yapraklı ormanların ozonlu havası"nın bir kurgu olduğu okunabilir. Öyle mi? Elbette hiçbir bitki ozon yaymaz. Ancak bitkiler, özellikle kozalaklı ağaçlar, terpen sınıfının doymamış hidrokarbonları da dahil olmak üzere havaya birçok uçucu organik bileşik yayar (terebentin içinde birçoğu vardır). Böylece, sıcak bir günde, bir çam ağacı, iğnelerin her gram kuru ağırlığı için saatte 16 mikrogram terpen salmaktadır. Terpenler sadece kozalaklı ağaçlarla değil, aynı zamanda kavak ve okaliptüs gibi bazı yaprak döken ağaçlarla da ayırt edilir. Ve bazı tropik ağaçlar saatte 1 g kuru yaprak kütlesi başına 45 mikrogram terpen salabilir. Sonuç olarak, bir hektar iğne yapraklı orman günde 4 kg'a kadar organik madde ve yaklaşık 2 kg yaprak döken orman salabilir. Dünyanın ormanlık alanı milyonlarca hektardır ve hepsi terpenler de dahil olmak üzere yılda yüz binlerce ton çeşitli hidrokarbon yayar. Ve metan örneğinde gösterildiği gibi, güneş radyasyonunun etkisi altında ve diğer safsızlıkların varlığında hidrokarbonlar ozon oluşumuna katkıda bulunur. Deneylerin gösterdiği gibi, uygun koşullar altında, terpenler gerçekten de ozon oluşumu ile atmosferik fotokimyasal reaksiyonların döngüsünde çok aktif olarak yer alır. Yani iğne yapraklı bir ormandaki ozon bir icat değil, deneysel bir gerçektir.
Ozon ve sağlık.
Fırtınadan sonra yürüyüşe çıkmak ne güzel! Hava temiz ve taze, canlandırıcı jetleri herhangi bir çaba harcamadan akciğerlere akıyor gibi görünüyor. “Ozon gibi kokuyor” diyorlar bu gibi durumlarda sık sık. “Sağlık için çok iyi.” Öyle mi?
Bir zamanlar ozon kesinlikle sağlığa faydalı olarak kabul edildi. Ancak konsantrasyonu belirli bir eşiği aşarsa, pek çok hoş olmayan sonuca neden olabilir. Konsantrasyona ve soluma süresine bağlı olarak ozon, akciğerlerde değişikliklere, göz ve burun mukozalarında tahrişe, baş ağrısına, baş dönmesine, kan basıncını düşürmeye neden olur; ozon, vücudun solunum yollarının bakteriyel enfeksiyonlarına karşı direncini azaltır. Havadaki izin verilen maksimum konsantrasyonu sadece 0,1 µg/l'dir, bu da ozonun klordan çok daha tehlikeli olduğu anlamına gelir! Sadece 0,4 μg / l ozon konsantrasyonu ile içeride birkaç saat geçirirseniz, göğüs ağrıları, öksürük, uykusuzluk görünebilir, görme keskinliği azalır. Ozonda 2 μg / l'den fazla konsantrasyonda uzun süre nefes alırsanız, sonuçlar daha şiddetli olabilir - stupora ve kardiyak aktivitede düşüşe kadar. 8-9 µg/l ozon içeriği ile birkaç saat sonra pulmoner ödem oluşur. ölümcül. Ancak bir maddenin bu kadar önemsiz miktarlarının geleneksel kimyasal yöntemlerle analiz edilmesi genellikle zordur. Neyse ki, bir kişi ozonun varlığını zaten çok düşük konsantrasyonlarda hissediyor - nişasta iyot kağıdının maviye dönmeyeceği yaklaşık 1 μg / l. Bazı insanlar için, küçük konsantrasyonlarda ozon kokusu, klor kokusuna, diğerlerine - kükürt dioksite, diğerlerine - sarımsak kokusuna benzer.
Zehirli olan sadece ozonun kendisi değildir. Havaya katılımıyla, örneğin, peroksiasetil nitrat (PAN) CH3-CO-OONO2 oluşur - yırtılma dahil güçlü bir tahriş edici, nefes almayı zorlaştıran ve daha yüksek konsantrasyonlarda kalp felcine neden olan bir madde. PAN, yaz aylarında kirli havada oluşan sözde fotokimyasal dumanın bileşenlerinden biridir (bu kelime İngilizce duman - duman ve sis - sisten türetilmiştir). Dumandaki ozon konsantrasyonu, izin verilen maksimum değerden 20 kat daha yüksek olan 2 μg/l'ye ulaşabilir. Ozon ve nitrojen oksitlerin havadaki birleşik etkisinin, her bir maddenin ayrı ayrı on kat daha güçlü olduğu da dikkate alınmalıdır. Şaşırtıcı olmayan bir şekilde, bu tür sisin sonuçları büyük şehirlerözellikle şehrin üzerindeki hava "taslaklar" tarafından üflenmezse ve durgun bir bölge oluşursa felaket olabilir. Böylece, 1952'de Londra'da birkaç gün içinde 4.000'den fazla insan dumandan öldü. 1963'te New York'ta bir duman 350 kişiyi öldürdü. Benzer hikayeler Tokyo'daydı, diğerleri büyük şehirler. Sadece insanlar atmosferik ozondan muzdarip değildir. Amerikalı araştırmacılar, örneğin, havada yüksek ozon içeriğine sahip bölgelerde, araba lastiklerinin ve diğer kauçuk ürünlerin hizmet ömrünün önemli ölçüde azaldığını göstermiştir.
Zemin tabakasındaki ozon içeriği nasıl azaltılır? Atmosfere metan emisyonlarını azaltmak pek gerçekçi değil. Başka bir yol daha var - nitrojen oksit emisyonlarını azaltmak, onsuz ozona yol açan reaksiyon döngüsünün devam edemeyeceği. Bu yol da kolay değildir, çünkü nitrojen oksitler sadece arabalar tarafından değil, aynı zamanda (esas olarak) termik santraller tarafından da yayılır.
Ozon kaynakları sadece sokakta değil. Röntgen odalarında, fizyoterapi odalarında (kaynağı cıva-kuvars lambalarıdır), fotokopi makinelerinin (fotokopi makineleri), lazer yazıcıların çalışması sırasında oluşur (burada oluşumunun nedeni yüksek voltajlı deşarjdır). Ozon, perhidrol, argon ark kaynağı üretimi için kaçınılmaz bir arkadaştır. Ozonun zararlı etkilerini azaltmak için, davlumbazı ultraviyole lambalarla donatmak, odanın iyi havalandırılması gerekir.
Yine de ozonun sağlığa zararlı olduğunu düşünmek pek doğru olmaz. Her şey konsantrasyonuna bağlıdır. Araştırmalar, temiz havanın karanlıkta çok zayıf bir şekilde parladığını göstermiştir; parlamanın nedeni ozon içeren oksidasyon reaksiyonlarıdır. Parlama ayrıca, içine önceden ozonlanmış oksijenin doldurulduğu bir şişede su çalkalandığında da gözlendi. Bu parıltı her zaman hava veya sudaki küçük miktarlarda organik safsızlıkların varlığı ile ilişkilidir. Temiz havayı solunan bir kişiyle karıştırırken, parıltının yoğunluğu on kat arttı! Ve bu şaşırtıcı değil: solunan havada etilen, benzen, asetaldehit, formaldehit, aseton ve formik asit mikro safsızlıkları bulundu. Ozon tarafından "vurgulanırlar". Aynı zamanda, "eski", yani. Ozondan tamamen yoksun, çok temiz olmasına rağmen hava parlamaya neden olmaz ve kişi bunu "bayat" olarak hisseder. Bu hava damıtılmış su ile karşılaştırılabilir: çok saftır, neredeyse hiç kirlilik içermez ve içilmesi zararlıdır. Bu nedenle, havada ozonun tamamen yokluğu, görünüşe göre, içindeki mikroorganizmaların içeriğini arttırdığı için insanlar için de elverişsizdir, ozonun yok ettiği zararlı maddelerin ve hoş olmayan kokuların birikmesine yol açar. Böylece, içinde insan olmasa bile, binaların düzenli ve uzun süreli havalandırılması ihtiyacı ortaya çıkıyor: sonuçta, odaya giren ozon uzun süre oyalanmaz - kısmen ayrışır. ve büyük ölçüde duvarlara ve diğer yüzeylere yerleşir (yüzer). Odada ne kadar ozon olması gerektiğini söylemek zor. Bununla birlikte, minimum konsantrasyonlarda ozon muhtemelen gerekli ve faydalıdır.
Dolayısıyla ozon bir saatli bombadır. Doğru kullanılırsa insanlığa hizmet eder, başka amaçlar için kullanılır kullanılmaz ise anında kötülüklere yol açar. küresel felaket ve Dünya, Mars gibi bir gezegene dönüşecek.
Elektrik kıvılcımları oksijen veya havadan geçtiğinde, nedeni yeni bir madde olan ozon oluşumu olan karakteristik bir koku ortaya çıkar. Ozon, mükemmel saflıkta kuru oksijenden elde edilebilir; bundan sadece oksijenden oluştuğu ve onun allotropik modifikasyonunu temsil ettiği sonucu çıkar.
Ozonun moleküler kütlesi 48'dir. Oksijenin atom kütlesi 16'dır; bu nedenle ozon molekülü üç oksijen atomundan oluşur.
Ozon elde etmek için sessiz elektrik deşarjlarının oksijen üzerindeki etkisi kullanılır. Bu amaca hizmet eden cihazlara ozonizer denir.
Pirinç. 110. Ozon molekülünün yapısının şeması.

Pirinç. 111. Ozon molekülündeki merkezi oksijen atomunun yörüngelerinin şeması.
Normal şartlar altında ozon bir gazdır. Güçlü soğutma ile oksijenden ayrılabilir; ozon yoğunlaşarak mavi bir sıvıya dönüşür.
Ozonun sudaki çözünürlüğü oksijenden çok daha fazladır: 100 hacim su 49 hacim ozonu çözer.
Oksijenden ozonun oluşumu denklem ile ifade edilebilir.
buradan ozon oluşumunun standart entalpisinin pozitif ve eşit olduğu sonucu çıkar. Ayrıca denklemin katsayılarının gösterdiği gibi, bu reaksiyon sırasında üç gaz molekülünden iki molekül elde edilir, yani sistemin entropisi azalır. Sonuç olarak, söz konusu reaksiyondaki Gibbs enerjisindeki standart değişim de pozitiftir (163). Böylece oksijenin ozona dönüşümünün reaksiyonu kendiliğinden ilerleyemez: gerçekleşmesi için enerji gereklidir. Ters reaksiyon - ozonun bozunması - kendiliğinden ilerler, çünkü bu işlem sırasında sistemin Gibbs enerjisi azalır. Başka bir deyişle, ozon kararsız bir maddedir.
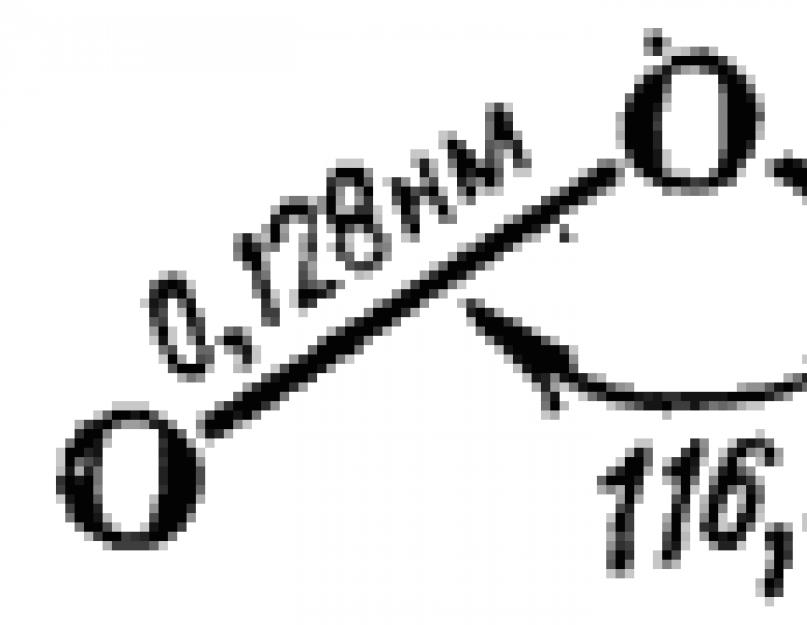
Ozon molekülü bir ikizkenar üçgen şeklinde inşa edilmiştir. Yapısı şematik olarak Şek. 110. Üçgenin tepesindeki açının 120°'ye yakınlığı, merkezi oksijen atomunun burada bir hibridizasyon durumunda olduğunu gösterir. Buna uygun olarak, HS yöntemi açısından bir molekülün oluşumu aşağıdaki gibi tarif edilebilir.
Merkezi atomun bir elektron içeren hibrit -yörüngesi (Şekil 111, sol), aşırı oksijen atomlarından birinin -yörüngesi ile örtüşür ve bir -bağ oluşumuna neden olur. Hibridizasyona katılmayan merkezi atomun yörüngesi, molekül düzlemine dik olarak yönlendirilir ve ayrıca eşleşmemiş bir elektron içerir, aynı aşırı oksijen atomunun benzer şekilde yerleştirilmiş - yörüngesi ile örtüşür ve bu da oluşumuna yol açar. bir -bağ. Son olarak, birini işgal eden bir elektron çiftinin donörü olarak hareket etmek hibrit yörüngeler(Şekil 111, sağda), merkezi oksijen atomu, verici-alıcı yöntemine göre, diğer uç oksijen atomuyla bir bağ oluşturur.
Ortaya çıkan yapı, noktaların yalnız elektron çiftlerini gösterdiği ve - ve - bağların harflerle işaretlendiği değerlik şeması A'ya karşılık gelir.

Şema A'ya göre, merkezi oksijen atomunun iki uç atomla olan bağları eşdeğer değildir - bunlardan biri çift, diğeri basittir. Ancak bu bağların aynı uzunlukta olması (Şekil 110) denkliklerini gösterir. Bu nedenle, Şema A ile birlikte, ozon molekülünün yapısı Şema B ile aynı gerekçeyle tarif edilebilir. Değerlik şemalarının üst üste bindirilmesi yöntemi açısından (bakınız § 44), bu, gerçekte ozon molekülü, A ve B şemaları arasında bir ara maddedir ve şu şekilde temsil edilebilir:
Burada noktalı çizgiler -elektron çiftinin yer değiştirmesini, yani onun üç oksijen atomunun tümüne ait olduğunu gösterir. Bu nedenle ozon molekülündeki -bağı üç merkezlidir.
Ozon molekülünün yapısının MO yöntemi açısından ele alınması da burada üç merkezli bir bağlayıcı moleküler orbitalin oluştuğu sonucunu doğurur.
Ozon en güçlü oksitleyici ajanlardan biridir. Altın ve platin metallerinin yanı sıra çoğu metal olmayan metaller hariç tüm metalleri oksitler. Düşük oksitleri yüksek oksitlere ve metal sülfitleri sülfatlarına dönüştürür. Bu reaksiyonların çoğu sırasında ozon molekülü bir oksijen atomunu kaybederek bir moleküle dönüşür.
Bir potasyum iyodür çözeltisinden ozon, iyot açığa çıkarır:
KI ve nişasta çözeltileri ile nemlendirilmiş bir kağıt parçası ozon içeren havaya konursa hemen maviye döner. Bu reaksiyon ozonu keşfetmek için kullanılır.
Güçlü bir oksitleyici ajan olarak ozon bakterileri öldürür ve bu nedenle su dezenfeksiyonu ve hava dezenfeksiyonu için kullanılır.
Ozon zehirlidir. İzin verilen maksimum, havadaki içeriğine eşittir. Bu konsantrasyonda, kokusu iyi hissedilir. Atmosferin yüzey tabakasında ozon içeriği genellikle elektriksel boşalmalar sırasında oluştuğu sınırlar içindedir.
1. OZON hakkında ne biliyoruz?
Ozon (Yunanca ozondan - kokulu) keskin kokulu, güçlü bir oksitleyici ajan olan mavi bir gazdır. Ozon bir oksijen allotropudur. O3'ün moleküler formülü. Oksijenden 2,5 kat daha ağırdır. Su, yiyecek ve havanın dezenfeksiyonunda kullanılır.
teknoloji
Korona ozon teknolojisine dayalı olarak, dezenfeksiyon ve sterilizasyon için ozonu kullanan Green World çok fonksiyonlu anyon ozonatörü geliştirildi.
Ozon kimyasal elementinin özellikleri
Ozon, bilimsel adÜç oksijen atomunun birleştirilmesi işleminde elde edilen O3, dezenfeksiyon ve stearilizasyonda etkili olan yüksek oksitleyici fonksiyonlara sahiptir. Sudaki ve havadaki çoğu bakteriyi yok edebilir. Etkili bir dezenfektan ve antiseptik olarak kabul edilir. Ozon, atmosferin önemli bir bileşenidir. Atmosferimiz, doğadaki bakteri seviyelerini dengeleyen 0.01ppm-0.04ppm ozon içerir. Ozon ayrıca fırtınalar sırasında yıldırım deşarjları ile doğal olarak üretilir. Yıldırımın elektrik boşalması sırasında temiz hava dediğimiz hoş bir tatlı koku yayılır.
Ozon molekülleri kararsızdır ve çok hızlı bir şekilde oksijen moleküllerine parçalanır. Bu kalite, ozonu değerli bir gaz ve su arıtıcısı yapar. Ozon molekülleri diğer maddelerin molekülleri ile birleşerek parçalanır ve bunun sonucunda organik bileşikleri oksitleyerek zararsız karbondioksit ve suya dönüştürür. Ozon, oksijen moleküllerine kolayca parçalandığından, klor gibi diğer dezenfektanlardan önemli ölçüde daha az toksiktir. Aynı zamanda "en saf oksitleyici ve dezenfektan" olarak da adlandırılır.
Ozonun özellikleri - mikroorganizmaları öldürür
1. bakterileri öldürür
a) havadaki koli bakterilerinin ve stafilokokların çoğunu öldürür
b) nesnelerin yüzeyindeki koli bakterilerinin %99,7'sini ve stafilokokların %99,9'unu öldürür
c) Fosfat bileşiklerindeki koli bakterilerini, stafilokokları ve salmonella grubu mikropları %100 öldürür
d) Sudaki koli bakterilerinin %100'ünü öldürür
2. Bakteri sporlarını yok eder
a) brevibakteium sporlarını yok eder
b) havadaki bakterileri yok etme yeteneği
c) Sudaki brevibakteiumsporların %99,999'unu öldürür
3. virüsleri yok eder
a) %99,99 HBsAg ve %100 HAAg'yi yok eder
b) Havadaki influenza virüsünü yok eder
c) PVI ve hepatit A virüsünü suda saniyeler veya dakikalar içinde yok eder
d) SA-11 virüsünü suda yok eder
e) Kan serumundaki ozon konsantrasyonu 4 mg/l'ye ulaştığında, 106cd50/ml'de HIV'i yok edebilmektedir.
a) %100 aspergillus versicolor ve penicillium'u öldürür
b) aspergillusniger, fusariumoxysporumf.sp.melonogea ve fusariumoxysporumf.sp'nin %100'ünü öldürür. lycopersici
c) aspergillus niger ve candida bakterilerini öldürür
2. Ozon doğada nasıl oluşur?
Elektriksel deşarj sırasında veya ultraviyole radyasyonun etkisi altında moleküler oksijenden (O2) oluşur. Bu, özellikle oksijen açısından zengin yerlerde fark edilir: ormanda, deniz kenarında veya bir şelalenin yakınında. Güneş ışığına maruz kaldığında, bir damla sudaki oksijen ozona dönüştürülür. Ayrıca, bir elektrik boşalmasıyla oluştuğunda, bir fırtınadan sonra ozonun kokusunu alırsınız.
3. Fırtınadan sonra hava neden daha temiz görünür?
Ozon, organik maddelerin safsızlıklarını oksitler ve havayı dezenfekte ederek hoş bir tazelik (fırtına kokusu) verir. Ozonun karakteristik kokusu %10-7 konsantrasyonlarında ortaya çıkar.
4. Ozonosfer nedir? Gezegendeki yaşam üzerindeki etkisi nedir?
Atmosferdeki ozonun ana kütlesi, 20-25 km yükseklikte maksimum konsantrasyonla 10 ila 50 km yükseklikte bulunur ve ozonosfer adı verilen bir tabaka oluşturur.
Ozonosfer, sert ultraviyole radyasyonu yansıtır, canlı organizmaları radyasyonun zararlı etkilerinden korur. Karada yaşam, havanın oksijeninden "ozon" oluşumu sayesinde mümkün oldu.
5. Ozon ne zaman keşfedildi ve kullanım tarihi nedir?
Ozon ilk olarak 1785 yılında tanımlanmıştır. Hollandalı fizikçi Mac Van Marum.
1832'de Prof. Basel Üniversitesi'nden Schonbein "Ozonun Kimyasal Üretimi" kitabını yayınladı. Ona Yunanca "kokulu" kelimesinden "ozon" adını verdi.
1857'de Werner von Siemens, içme suyunun arıtılması için ilk teknik kurulumu tasarladı. O zamandan beri ozonlama, hijyenik olarak saf su elde etmeyi mümkün kılmıştır.
1977'ye kadar Dünyada 1000'den fazla içme suyu ozonlama tesisi bulunmaktadır. Şu anda Avrupa'da içme suyunun %95'i ozonla arıtılıyor. Ozonlama Kanada ve ABD'de yaygınlaştı. Rusya'da, içme suyunun arıtılması, yüzme havuzları için su arıtımı, oto yıkamaların geri dönüşüm suyu temininde derin atık su arıtımı için kullanılan birkaç büyük istasyon vardır.
Ozon ilk olarak Birinci Dünya Savaşı sırasında antiseptik olarak kullanıldı.
1935'ten beri çeşitli bağırsak hastalıklarının (proktit, hemoroid, ülseratif kolit, fistüller, baskılama) tedavisi için bir ozon-oksijen karışımının rektal uygulamasını kullanmaya başladı patojenik mikroorganizmalar, bağırsak florasının restorasyonu).
Ozon etkisinin incelenmesi, enfeksiyöz lezyonlar, tüberküloz, zatürree, hepatit, herpes enfeksiyonu, anemi vb. Tedavisinde cerrahi uygulamada kullanılmasını mümkün kılmıştır.
1992'de Moskova'da. Rusya Federasyonu Onurlu Bilim Adamı MD'nin rehberliğinde. Zmyzgovoy A.V. ozonun çok çeşitli hastalıkları tedavi etmek için kullanıldığı "Ozon Tedavisi için Bilimsel ve Pratik Merkez" oluşturuldu. Ozon kullanarak zarar vermeyen etkili maruz kalma yöntemlerinin geliştirilmesi devam etmektedir. Bugün ozon popüler kabul ediliyor ve etkili araç su, hava ve gıdaların dezenfeksiyonu. Ayrıca oksijen-ozon karışımları çeşitli hastalıkların tedavisinde, kozmetolojide ve birçok yönetim alanında kullanılmaktadır.
6. Ozon soluyabilir misiniz? Ozon zararlı bir gaz mıdır?
Gerçekten de, yüksek konsantrasyonlarda ozon solumak tehlikelidir, solunum organlarının mukoza zarını yakabilir.
Ozon güçlü bir oksitleyici ajandır. Olumlu ve zararlı özellikleri burada yatmaktadır. Her şey konsantrasyona bağlıdır, yani. havadaki ozon yüzdesinden Eylemi ateş gibidir... Küçük miktarlarda destekler ve iyileştirir, büyük miktarlarda yok edebilir.
7. Düşük ve yüksek konsantrasyonlarda ozon ne zaman kullanılır?
Dezenfeksiyon için nispeten yüksek konsantrasyonlar kullanılırken, daha düşük ozon konsantrasyonları protein yapılarına zarar vermez ve iyileşmeyi destekler.
8. Ozonun virüslere etkisi nedir?
Ozon, virüsü hücrenin hem dışında hem de içinde bastırır (inaktive eder), kabuğunu kısmen tahrip eder. Üreme süreci durur ve virüslerin vücut hücreleriyle bağlantı kurma yeteneği bozulur.
9. Mikroorganizmalara maruz kaldığında ozonun bakterisit özelliği kendini nasıl gösterir?
Mayalar da dahil olmak üzere mikroorganizmalar üzerinde ozona maruz kaldıklarında, hücre zarları yerel olarak hasar görür ve bu da ölümlerine veya çoğalmalarına neden olmaz. Mikroorganizmaların antibiyotiklere duyarlılığında bir artış kaydedildi.
Deneyler, gaz halindeki ozonun hemen hemen tüm bakteri, virüs, küf ve maya benzeri mantar ve protozoa türlerini öldürdüğünü göstermiştir. 1 ila 5 mg/l arasındaki konsantrasyonlarda ozon, 4-20 dakika içinde Escherichia coli, streptococci, mucobacteria, phylococci, Escherichia ve Pseudomonas aeruginosa, Proteus, Klebsiella, vb.'nin %99,9'unun ölümüne yol açar.
10. Ozon cansız doğada nasıl çalışır?
Ozon çoğu organik ve inorganik maddelerle reaksiyona girer. Reaksiyon sürecinde oksijen, su, karbon oksitler ve diğer elementlerin daha yüksek oksitleri oluşur. Tüm bu ürünler kirletmez çevre klor ve flor bileşiklerinin aksine kanserojen maddelerin oluşumuna yol açmaz.
11. Hava ozonlaması sırasında yaşam alanlarında oluşan bileşikler tehlikeli olabilir mi?
Bir ev ozonatörü tarafından oluşturulan ozon konsantrasyonları, yerleşim alanlarında zararsız bileşiklerin oluşmasına yol açar. Odanın ozonlanması sonucunda havadaki oksijen içeriğinde artış ve virüslerden ve bakterilerden arındırma gerçekleşir.
12. İç ortam havasının ozonlanması sonucu hangi bileşikler oluşur?
Bizi çevreleyen bileşiklerin çoğu, zararsız bileşikler oluşturmak için ozonla reaksiyona girer.
Çoğu karbondioksit, su ve serbest oksijene ayrışır. Bazı durumlarda inaktif (zararsız) bileşikler (oksitler) oluşur. Ayrıca reaktif olmayan maddeler de vardır - titanyum oksitler, silikon, kalsiyum vb. Ozonla reaksiyona girmezler.
13. Klimalı odalarda havayı ozonlamak gerekli midir?
Hava, klima ve ısıtma cihazlarından geçtikten sonra havadaki oksijen içeriği azalır ve havanın toksik bileşenlerinin seviyesi azalmaz. Ek olarak, eski klimaların kendileri de bir kirlilik ve enfeksiyon kaynağıdır. "Kapalı Oda Sendromu" - baş ağrısı, yorgunluk, sık solunum problemleri. Bu tür tesislerin ozonlanması basitçe gereklidir.
14. Klima dezenfekte edilebilir mi?
Evet yapabilirsin.
15. Havalı ozonlamanın kullanılması, onarım sonrası dumanlı binaların ve binaların kokularının (boya, vernik kokuları) giderilmesinde etkili midir?
Evet, etkilidir. İşlem, ıslak temizleme ile birlikte birkaç kez yapılmalıdır.
16. Ev havasındaki bakteri ve mantarlar için hangi konsantrasyonlarda ozon zararlıdır?
1.000.000.000 hava parçacığı başına 50 ozon parçacığı konsantrasyonu, hava kirliliğini önemli ölçüde azaltır. Özellikle güçlü etki Escherichia coli, salmonella, staphylococcus aureus, candida, aspergillus olduğu ortaya çıktı.
17. Ozonlanmış havanın insanlar üzerindeki etkilerine dair herhangi bir araştırma yapıldı mı?
Özellikle, 5 ay boyunca iki grup insanla - kontrol ve test - gerçekleştirilen bir deney açıklanmaktadır.
Test grubunun odasındaki hava, 1.000.000.000 hava parçacığı başına 15 parçacık ozon konsantrasyonunda ozonla dolduruldu. Tüm denekler sağlık durumunun iyi olduğunu, sinirliliğin ortadan kalktığını belirtti. Doktorlar, kandaki oksijen içeriğinin arttığını, bağışıklık sisteminin güçlendiğini, basıncın normalleştiğini ve birçok stres belirtisinin ortadan kalktığını kaydetti.
18. Ozon vücut hücrelerine zararlı mıdır?
Ev tipi ozonlaştırıcıların oluşturduğu ozon konsantrasyonları, virüsleri ve mikroorganizmaları baskılar, ancak vücudun hücrelerine zarar vermez, çünkü. ozon cilde zarar vermez. İnsan vücudunun sağlıklı hücreleri, oksidasyonun (antioksidan) zararlı etkilerine karşı doğal bir savunmaya sahiptir. Başka bir deyişle ozonun etkisi canlı organizmalara göre seçicidir.
Bu, ihtiyati tedbirlerin uygulanmasını engellemez. Ozonlama işlemi sırasında odada bulunmak istenmeyen bir durumdur ve ozonlama işleminden sonra oda havalandırılmalıdır. Ozonizer, çocukların erişemeyeceği veya açılmasının imkansız olduğu bir yere yerleştirilmelidir.
19. Ozonizerin performansı nedir?
Normal modda - 200 mg / saat, geliştirilmiş - 400 mg / saat. Ozonizerin çalışması sonucunda odadaki ozon konsantrasyonu nedir? Konsantrasyon, odanın hacmine, ozonatörün konumuna, hava nemine ve sıcaklığa bağlıdır. Ozon kararlı bir gaz değildir ve hızla ayrışır, bu nedenle ozon konsantrasyonu büyük ölçüde zamana bağlıdır. Gösterge verileri 0,01 - 0,04 PPm.
20. Havadaki hangi ozon konsantrasyonları sınırlayıcı olarak kabul edilir?
0,5 - 2,5 PPm (0,0001 mg/l) aralığındaki ozon konsantrasyonları güvenli kabul edilir.
21. Su ozonlaması neden kullanılır?
Ozon, suyun dezenfeksiyonunda, safsızlıkların, kokunun ve renginin giderilmesinde kullanılır.
1. Suyun klorlanması ve florlanmasından farklı olarak, ozonlama sırasında suya yabancı hiçbir şey girmez (ozon hızla ayrışır). Aynı zamanda, mineral bileşimi ve pH değişmeden kalır.
2. Ozon, patojenlere karşı en büyük dezenfektan özelliğine sahiptir.
3. Sudaki organik maddeleri yok ederek Daha fazla gelişme mikroorganizmalar.
4. Zararlı bileşikler oluşmadan çoğu kimyasal yok edilir. Bunlara kanserojen olan pestisitler, herbisitler, petrol ürünleri, deterjanlar, kükürt ve klor bileşikleri dahildir.
5. Metaller, demir, manganez, alüminyum vb. dahil olmak üzere aktif olmayan bileşiklere oksitlenir. Oksitler çöker ve kolayca filtrelenir.
6. Hızla çürüyen ozon oksijene dönüşerek tadı iyileştirir ve Tıbbi özellikler su.
23. Ozonlama işlemine tabi tutulmuş suyun asitlik indeksi nedir?
Su hafif alkali pH'a sahiptir = 7.5 - 9.0. Bu su içmek için tavsiye edilir.
24. Ozonlamadan sonra sudaki oksijen içeriği ne kadar artar?
Sudaki oksijen içeriği 12 kat artar.
25. Ozon havada, suda ne kadar çabuk bozunur?
10 dakika sonra havada. ozon konsantrasyonu yarıya düşerek oksijen ve su oluşturur.
20-30 dakika sonra suda. Ozon ikiye bölünerek bir hidroksil grubu ve su oluşturur.
26. Su ısıtma, içindeki oksijen içeriğini nasıl etkiler?
Sudaki oksijen içeriği ısıtıldıktan sonra azalır.
27. Sudaki ozon konsantrasyonunu ne belirler?
Ozon konsantrasyonu safsızlıklara, sıcaklığa, suyun asitliğine, malzemeye ve kap geometrisine bağlıdır.
28. Neden O değil de O3 molekülü kullanılıyor? 2 ?
Ozon suda oksijenden yaklaşık 10 kat daha fazla çözünür ve yüksek oranda korunur. Su sıcaklığı ne kadar düşük olursa, saklama süresi o kadar uzun olur.
29. Oksijenli su içmek neden iyidir?
Ozon kullanımı dokular ve organlar tarafından glikoz tüketimini arttırır, kan plazmasının oksijen ile doygunluğunu arttırır, oksijen açlığının derecesini azaltır ve mikro dolaşımı iyileştirir.
Ozon, karaciğer ve böbreklerin metabolizması üzerinde olumlu bir etkiye sahiptir. Kalp kasının çalışmasını destekler. Solunum hızını azaltır ve gelgit hacmini artırır.
30. Ev tipi ozonatör ne işe yarar?
Ev ozonatörü aşağıdakiler için kullanılabilir:
yaşam alanlarında, banyo ve tuvalet odalarında, değişim evlerinde, dolaplarda, buzdolaplarında vb. havanın dezenfeksiyonu ve kokudan arındırılması;
gıda işleme (et, balık, yumurta, sebze ve meyveler);
su kalitesinin iyileştirilmesi (dezenfeksiyon, oksijen zenginleştirme, klor ve diğer zararlı kirliliklerin giderilmesi);
ev kozmetolojisi (kepek, akne, gargara, diş fırçalama, mantar hastalıklarının ortadan kaldırılması, ozonlanmış yağın hazırlanması);
evcil hayvan ve balık bakımı;
Sır iç mekan bitkileri ve tohum tedavisi;
çamaşırların ağartılması ve renklendirilmesi;
ayakkabı işleme.
31. Tıbbi uygulamada ozonun kullanılmasının etkisi nedir?
Ozon antibakteriyel, antiviral etkiye sahiptir (virüslerin inaktivasyonu ve sporların yok edilmesi).
Ozon, bir dizi biyokimyasal süreci aktive eder ve normalleştirir.
Ozon tedavisi ile elde edilen etki şu şekilde karakterize edilir:
detoksifikasyon süreçlerinin aktivasyonu, bir baskılama var
dış ve iç toksinlerin aktivitesi;
metabolik süreçlerin aktivasyonu (metabolik süreçler);
artan mikro sirkülasyon (kan temini
kanın reolojik özelliklerinin iyileştirilmesi (kan hareketli hale gelir);
belirgin bir analjezik etkiye sahiptir.
32. Ozon insan bağışıklığını nasıl etkiler?
Hücresel ve hümoral bağışıklığı artırır. Fagositoz aktive edilir, interferonların ve diğer spesifik olmayan vücut sistemlerinin sentezi artar.
33. Ozonlama metabolik süreçleri nasıl etkiler?
Ozon kullanımı dokular ve organlar tarafından glikoz tüketimini arttırır, kan plazmasının oksijen ile doygunluğunu arttırır, oksijen açlığının derecesini azaltır ve mikro dolaşımı iyileştirir. Ozon, karaciğer ve böbreklerin metabolizması üzerinde olumlu bir etkiye sahiptir. Kalp kasının çalışmasını destekler. Solunum hızını azaltır ve gelgit hacmini artırır.
34. Kaynak sırasında ve fotokopi makinesinin çalışması sırasında ozon oluşur. Bu ozon zararlı mı?
Evet, bu durumda tehlikeli kirlilikler oluştuğundan zararlıdır. Ozonizer tarafından üretilen ozon saftır ve bu nedenle zararsızdır.
35. Endüstriyel, tıbbi ve ev tipi ozonizerler arasında fark var mıdır?
Endüstriyel ozonlaştırıcılar, ev kullanımı için tehlikeli olan yüksek konsantrasyonda ozon verir.
Tıbbi ve ev tipi ozonatörler performans açısından birbirine yakındır, ancak tıbbi olanlar daha uzun süreli sürekli çalışma için tasarlanmıştır.
36. Ultraviyole üniteleri ve ozonlaştırıcılar kullanıldığında dezenfeksiyonun karşılaştırmalı özellikleri nelerdir?
Ozon bakteri ve virüsleri yok etme özelliği bakımından ultraviyole ışınlarından 2,5 - 6 kat, klordan 300 - 600 kat daha etkilidir. Aynı zamanda, klordan farklı olarak ozon, solucan kistlerini, uçuk virüsünü ve tüberkülozu bile yok eder.
Ozon, organik ve kimyasal maddeleri sudan uzaklaştırır, bunları suya, karbondioksite ayrıştırır ve aktif olmayan elementlerin bir çökeltisini oluşturur.
Ozon, demir ve manganez tuzlarını kolayca oksitleyerek, çökeltme veya süzme yoluyla uzaklaştırılan çözünmeyen maddeler oluşturur. Sonuç olarak, ozonlanmış su güvenli, berrak ve tadı hoştur.
37. Bulaşıkları ozonla dezenfekte edebilir misiniz?
Evet! Çocuk bulaşıklarını, konserve tabaklarını vb. dezenfekte etmek iyidir. Bunu yapmak için bulaşıkları suyla dolu bir kaba koyun, hava kanalını bir ayırıcı ile indirin. 10-15 dakika boyunca işlem yapın.
38. Ozonlama aletleri hangi malzemelerden yapılmalıdır?
Cam, seramik, ahşap, plastik, emaye (talaş veya çatlak yok). Alüminyum ve bakır kaplar dahil metal kullanmayın. Kauçuk, ozonla temasa dayanmaz.
Amerikan şirketi Green World'den gelen anyonik ozonatör, yalnızca sağlığınızı korumanıza değil, aynı zamanda sağlığınızı da önemli ölçüde iyileştirmenize yardımcı olacaktır. Evinizde vazgeçilmez bir cihaz kullanma fırsatına sahipsiniz - hem bir hava iyonlaştırıcısının hem de bir ozonlaştırıcının (çok fonksiyonlu...
Araba için ozonatör, aydınlatma ve aromatizer ile birlikte verilir. Aynı anda ozonlama ve iyonizasyon modu açılabilir. Bu modlar ayrı ayrı da etkinleştirilebilir. Bu ozonizer, sürücü yorgunluğunun arttığı, görme ve hafızanın bozulduğu uzun yolculuklar için vazgeçilmezdir. Ozonizer, akınına bağlı olarak canlılık vererek, uyuşukluğu giderir...
OZON O3 (Yunanca ozon kokulu), oksijenin allotropik bir modifikasyonudur ve her üç kümelenme durumunda da var olabilir. Ozon kararsız bir bileşiktir ve oda sıcaklığında bile yavaş yavaş moleküler oksijene ayrışır, ancak ozon bir radikal değildir.
Fiziksel özellikler
Molekül ağırlığı = 47.9982 g/mol. Gaz halindeki ozon, 1 atm ve 29°C basınçta 2.144 10-3 g/cm3 yoğunluğa sahiptir.
Ozon özel bir maddedir. Son derece kararsızdır ve artan konsantrasyonla, genel şemaya göre kolayca orantısızlaşır: 2O3 -> 3O2 Gaz halinde, ozon mavimsi bir renk tonuna sahiptir, havadaki ozon içeriği% 15-20 olduğunda fark edilir.
ozon normal koşullar- keskin kokulu bir gaz. Çok düşük konsantrasyonlarda, ozon kokusu hoş bir tazelik olarak algılanır, ancak artan konsantrasyonla rahatsız edici hale gelir. Donmuş çamaşırların kokusu ozon kokusudur. Buna alışmak kolaydır.
Ana miktarı, 15-30 km yükseklikte "ozon kuşağı" olarak adlandırılan bölgede yoğunlaşmıştır. Dünyanın yüzeyinde, ozon konsantrasyonu canlılar için çok daha az ve kesinlikle güvenlidir; Tamamen yokluğunun da bir kişinin performansını olumsuz yönde etkilediğine dair bir görüş bile var.
Yaklaşık 10 MPC'lik konsantrasyonlarda ozon çok iyi hissedilir, ancak birkaç dakika sonra bu his neredeyse tamamen kaybolur. Onunla çalışırken bu akılda tutulmalıdır.
Ancak ozon, Dünya'daki yaşamın korunmasını da sağlar, çünkü. Ozon tabakası, 300 nm'den daha az bir dalga boyuna sahip Güneş'in UV radyasyonunun canlı organizmalar ve bitkiler için en zararlı kısmını tutar, CO2 ile birlikte, Dünya'nın kızılötesi radyasyonunu emerek soğumasını önler.
Ozon suda oksijenden daha fazla çözünür. Suda, ozon gaz fazından çok daha hızlı ayrışır ve safsızlıkların, özellikle metal iyonlarının varlığının, bozunma hızı üzerinde son derece büyük bir etkisi vardır.
Şekil1. Ozonun parçalanması çeşitli tipler 20 ° C sıcaklıkta su (1 - bidistilat; 2 - distilat; 3 - musluk suyu; 4 - filtrelenmiş göl suyu)
Ozon, silika jel ve alümina jel tarafından iyi emilir. Kısmi ozon basıncında, örneğin 20 mm Hg. Art. ve 0 ° C'de silika jel, ağırlıkça yaklaşık % 0.19 ozonu emer. Düşük sıcaklıklarda, adsorpsiyon belirgin şekilde zayıflar. Adsorplanmış durumda, ozon çok kararlıdır. Ozonun iyonlaşma potansiyeli 12.8 eV'dir.
ozonun kimyasal özellikleri
İki ana özellikte farklılık gösterirler - kararsızlık ve oksitleme yeteneği. Hava ile küçük konsantrasyonlarda karıştırıldığında, nispeten yavaş ayrışır, ancak sıcaklık yükseldikçe ayrışması hızlanır ve 100 ° C'nin üzerindeki sıcaklıklarda çok hızlı hale gelir.
Havada NO2, Cl bulunması ve ayrıca metal oksitlerin - gümüş, bakır, demir, manganez - katalitik etkisi ozonun ayrışmasını hızlandırır. Oksijen atomlarından biri molekülünden çok kolay ayrılabildiği için ozon çok güçlü oksitleyici özelliklere sahiptir. Kolayca oksijene geçer.
Ozon, çoğu metali normal sıcaklıklarda oksitler. Ozonun asidik sulu çözeltileri oldukça kararlıdır; alkali çözeltilerde ozon hızla yok edilir. Değişken değerlikli metaller (Mn, Co, Fe vb.), birçok oksit, peroksit ve hidroksit ozonu etkili bir şekilde yok eder. Çoğu metal yüzey, metalin en yüksek değerlik durumunda (örneğin, PbO2, AgO veya Ag2O3, HgO) bir oksit film ile kaplanmıştır.
Ozon, altın ve platin grubu metaller hariç tüm metalleri oksitler, diğer elementlerin çoğuyla reaksiyona girer, hidrojen halojenürleri (HF hariç) ayrıştırır, düşük oksitleri yüksek oksitlere dönüştürür, vb.
Altın, platin, iridyum, %75 Fe + %25 Cr alaşımını oksitlemez. Siyah kurşun sülfür PbS'yi beyaz sülfat PbSO4, arsenik anhidrit As2O3'ü arsenik As2O5'e vb. dönüştürür.
Ozonun değişken değerlikli metal iyonları (Mn, Cr ve Co) ile reaksiyonu son yıllar boyalar, vitamin PP (izonikotinik asit) vb. için ara maddelerin sentezi için pratik uygulama bulur. Oksitlenebilir bir bileşik (örneğin metilpiridinler) içeren asidik bir çözelti içindeki manganez ve krom tuzlarının karışımları ozon tarafından oksitlenir. Bu durumda Cr3+ iyonları Cr6+'ya geçer ve sadece metil gruplarında metilpiridinleri oksitler. Metal tuzlarının yokluğunda, ağırlıklı olarak aromatik çekirdek yok edilir.
Ozon ayrıca atmosferde bulunan birçok gazla da reaksiyona girer. Hidrojen sülfür H2S, ozon ile birleştiğinde serbest kükürt açığa çıkarır, kükürtlü anhidrit SO2, sülfürik SO3'e dönüşür; nitröz oksit N2O - NO'ya, nitrik oksit NO hızla NO2'ye oksitlenir, sırayla NO2 de ozon ile reaksiyona girer ve nihayetinde N2O5 oluşur; amonyak NH3 - nitrojen amonyum tuzu NH4NO3'e.
Ozonun inorganik maddelerle en önemli reaksiyonlarından biri potasyum iyodür bozunmasıdır. Bu reaksiyon, ozonun kantitatif tayini için yaygın olarak kullanılmaktadır.
Bazı durumlarda ozon, katı maddelerle de reaksiyona girerek ozonitleri oluşturur. Alkali metallerin ozonidleri, alkali toprak metalleri: stronsiyum, baryum izole edilmiştir ve belirtilen serilerde stabilizasyon sıcaklıkları artar; Ca(O3) 2, 238 K'da, Ba(O3) 2 273 K'da stabildir. Ozonitler, örneğin NaO3 -> NaO2 + 1/2O2 gibi süperperoksit oluşturmak üzere ayrışır. Ozonun organik bileşiklerle reaksiyonlarında çeşitli ozonitler de oluşur.
Ozon, çok sayıda organik maddeyi, doymuş, doymamış ve siklik hidrokarbonları oksitler. Ozonun çeşitli aromatik hidrokarbonlarla reaksiyon ürünlerinin bileşimi üzerine birçok çalışma yayınlanmıştır: benzen, ksilenler, naftalin, fenantren, antrasen, benzantrasen, difenilamin, kinolin, akrilik asit, vb. İndigo ve diğer birçok organik maddeleri ağartır. kumaş ağartma için bile kullanıldığı boyalar.
Ozonun çift C=C bağı ile reaksiyon hızı, tek bir ozon ile reaksiyon hızından 100.000 kat daha hızlıdır. C-C bağlantısı. Bu nedenle kauçuklar ve kauçuklar öncelikle ozondan etkilenir. Ozon, bir ara kompleks oluşturmak için çift bağ ile reaksiyona girer:

Bu reaksiyon, 0°C'nin altındaki sıcaklıklarda zaten oldukça hızlı ilerler. Doymuş bileşikler söz konusu olduğunda, ozon olağan oksidasyon reaksiyonunun başlatıcısıdır:

İlginç olan, ozonun havada ozon varlığında güçlü bir şekilde flüoresan olan bazı organik boyalarla etkileşimidir. Bunlar örneğin eikrosin, riboflavin ve luminol (triaminoftalhidrazid) ve özellikle rodamin-B ve buna benzer rodamin-C'dir.
Ozonun yüksek oksitleyici özellikleri, organik maddeleri yok etme ve metalleri (özellikle demir) çözünmez bir forma oksitleme, suda çözünür gaz halindeki bileşikleri parçalama, sulu çözeltileri oksijenle doyurma, ozonun suda düşük kalıcılığı ve kendi kendini yok etme yeteneği özellikleri insanlar için tehlikelidir - tüm bunlar birlikte ozonu, evsel suyun hazırlanması ve çeşitli atık suların arıtılması için en çekici madde haline getirir.
ozon sentezi
Oksijenin atomlara ayrıştığı koşullar ortaya çıkarsa, oksijen içeren gazlı bir ortamda ozon oluşur. Bu, her türlü elektrik boşalmasında mümkündür: ışıma, ark, kıvılcım, korona, yüzey, bariyer, elektrotsuz vb. Ayrışmanın ana nedeni, moleküler oksijenin bir elektrik alanında hızlandırılmış elektronlarla çarpışmasıdır.
Boşalmaya ek olarak, oksijen ayrışmasına, dalga boyu 240 nm'den az olan UV radyasyonu ve çeşitli yüksek enerjili parçacıklar neden olur: alfa, beta, gama parçacıkları, x-ışınları, vb. Ozon ayrıca suyun elektrolizi ile üretilir.
Ozon oluşumunun hemen hemen tüm kaynaklarında, ozonun ayrışmasının bir sonucu olarak bir grup reaksiyon vardır. Ozon oluşumuna müdahale ederler, ancak gerçekten varlar ve dikkate alınmaları gerekiyor. Bu, reaktörün hacminde ve duvarlarında termal ayrışmayı, radikaller ve uyarılmış parçacıklarla reaksiyonlarını, oksijen ve ozon ile temas edebilecek katkı maddeleri ve safsızlıklarla reaksiyonları içerir.
Tam mekanizma, önemli sayıda reaksiyondan oluşur. Gerçek tesisler, hangi prensipte çalışırlarsa çalışsınlar, ozon üretimi için yüksek enerji maliyetleri gösterirler. Ozon jeneratörünün verimliliği, üretilen ozonun birim kütlesi başına hesaplanan - tam veya aktif - güce bağlıdır.
bariyer deşarjı
Bir bariyer boşalması, iki dielektrik veya bir dielektrik ve bir metal arasında meydana gelen bir boşalma olarak anlaşılır. Elektrik devresinin bir dielektrik tarafından kesilmesi nedeniyle, güç yalnızca alternatif akımla sağlanır. İlk kez 1897'de Siemens tarafından modernlere yakın bir ozonatör önerildi.
Düşük güçte, salınan ısı oksijen ve ozon akışı ile taşındığından ozonlaştırıcı soğutulamaz. AT endüstriyel üretimler ozon ayrıca ark ozonlaştırıcılarda (plazmatronlar), kızdırma ozon jeneratörlerinde (lazerler) ve yüzey deşarjlarında da sentezlenir.
fotokimyasal yöntem
Yeryüzünde üretilen ozonun çoğu, doğada fotokimyasal süreçlerle üretilir. AT pratik faaliyetlerİnsanlarda, fotokimyasal sentez yöntemleri, bir bariyer boşalmasında sentezlerden daha az rol oynar. Kullanımlarının ana alanı, orta ve düşük konsantrasyonlarda ozon elde etmektir. Bu tür ozon konsantrasyonları, örneğin kauçuk ürünleri atmosferik ozonun etkisi altında çatlamaya karşı direnç açısından test ederken gereklidir. Uygulamada bu yöntemle ozon üretimi için cıva ve ksenon excimer lambaları kullanılmaktadır.
elektrolitik sentez yöntemi
Elektrolitik süreçlerde ozonun oluşumunun ilk sözü 1907'ye kadar uzanır. Bununla birlikte, oluşum mekanizması şu ana kadar belirsizliğini koruyor.
Genellikle elektrolit olarak sulu perklorik veya sülfürik asit çözeltileri kullanılır, elektrotlar platinden yapılır. O18 ile işaretlenmiş asitlerin kullanılması, ozon oluşumu sırasında oksijenlerinden vazgeçmediklerini göstermiştir. Bu nedenle, brüt şema yalnızca suyun ayrışmasını dikkate almalıdır:
H2O + O2 -> O3 + 2H+ + e-
iyonların veya radikallerin olası ara oluşumu ile.
İyonlaştırıcı radyasyon etkisi altında ozon oluşumu
Ozon, bir oksijen molekülünün ya ışık ya da bir elektrik alanı ile uyarılmasının eşlik ettiği bir dizi işlemde oluşur. Oksijen ile ışınlandığında iyonlaştırıcı radyasyon uyarılmış moleküller de oluşabilir ve ozon oluşumu gözlenir. İyonlaştırıcı radyasyon etkisi altında ozon oluşumu henüz ozon sentezi için kullanılmamıştır.
Mikrodalga alanında ozon oluşumu
Mikrodalga alanından bir oksijen jeti geçirildiğinde, ozon oluşumu gözlendi. Bu fenomene dayalı jeneratörler genellikle laboratuvar uygulamalarında kullanılmasına rağmen, bu süreç çok az çalışılmıştır.
Ozonun günlük yaşamda kullanımı ve insanlar üzerindeki etkisi
Su, hava ve diğer maddelerin ozonlanması
Ozonlu su, toksik halometanlar içermez - klor ile su sterilizasyonunun tipik safsızlıkları. Ozonlama işlemi, süspansiyonlardan arıtılan suyun ozonlanmış hava veya oksijen ile karıştırıldığı köpüren banyolarda veya karıştırıcılarda gerçekleştirilir. İşlemin dezavantajı, O3'ün suda hızlı yok edilmesidir (yarılanma ömrü 15-30 dakika).
Ozonlama da kullanılır Gıda endüstrisi buzdolaplarının, depoların sterilizasyonu, hoş olmayan kokuların giderilmesi için; tıbbi uygulamada - açık yaraların dezenfeksiyonu ve bazı kronik hastalıkların (trofik ülserler, mantar hastalıkları), venöz kanın ozonlanması, fizyolojik çözeltilerin tedavisi için.
Ozonun havada veya oksijende elektrik boşalması yoluyla elde edildiği modern ozonlaştırıcılar, ozon jeneratörleri ve güç kaynaklarından oluşur ve ozonlaştırıcılara ek olarak yardımcı cihazları da içeren ozonatör tesislerinin ayrılmaz bir parçasıdır.
Şu anda ozon, ozon teknolojilerinde kullanılan bir gazdır: içme suyunun arıtılması ve hazırlanması, atık su arıtımı (evsel ve endüstriyel atık su), gaz atığı vb.
Ozon kullanma teknolojisine bağlı olarak, ozon jeneratörünün verimliliği, saatte bir gramın kesirlerinden onlarca kilogram ozona kadar olabilir. Tıbbi aletlerin ve küçük ekipmanların gaz sterilizasyonu için özel ozonizerler kullanılmaktadır. Sterilizasyon, sterilizasyon odasını dolduran yapay olarak nemlendirilmiş ozon-oksijen ortamında gerçekleştirilir. Sterilizasyon döngüsü, sterilizasyon odasındaki havanın nemlendirilmiş ozon-oksijen karışımı ile değiştirilmesi aşamasından, sterilizasyona maruz bırakma aşamasından ve odadaki ozon-oksijen karışımının mikrobiyolojik olarak saflaştırılmış hava ile değiştirilmesi aşamasından oluşur.
Tıpta ozon tedavisi için kullanılan ozonlaştırıcılar, ozon-oksijen karışımının konsantrasyonunun geniş bir regülasyonu aralığına sahiptir. Ozon-oksijen karışımının üretilen konsantrasyonunun garantili doğruluğu, ozonizer otomasyon sistemi tarafından kontrol edilir ve otomatik olarak korunur.
ozonun biyolojik etkisi
Ozonun biyolojik etkisi, uygulama yöntemine, dozuna ve konsantrasyonuna bağlıdır. Etkilerinin çoğu, farklı konsantrasyon aralıklarında ortaya çıkar. değişen dereceler. Ozon tedavisinin terapötik etkisinin temeli, ozon-oksijen karışımlarının kullanılmasıdır. Ozonun yüksek redoks potansiyeli, sistemik (oksijen homeostazının restorasyonu) ve lokal (belirgin dezenfektan) terapötik etkisine neden olur.
Ozon ilk kez 1915 yılında A. Wolff tarafından enfekte yaraların tedavisinde antiseptik bir ajan olarak kullanılmıştır. Son yıllarda, ozon tedavisi tıbbın hemen hemen tüm alanlarında başarıyla kullanılmaktadır: acil ve pürülan cerrahi, genel ve bulaşıcı tedavi, jinekoloji, üroloji, gastroenteroloji, dermatoloji, kozmetoloji, vb. Ozon kullanımı, vücut üzerindeki benzersiz etki yelpazesinden kaynaklanmaktadır. immünomodülatör, antienflamatuar, bakterisit, antiviral, mantar öldürücü vb.
Bununla birlikte, birçok biyolojik göstergedeki bariz avantajlara rağmen, ozonun tıpta kullanım yöntemlerinin hala devam ettiği inkar edilemez. geniş uygulama almamış. Literatür verilerine göre, yüksek ozon konsantrasyonları hemen hemen tüm mikroorganizma türleri için kesinlikle bakterisittir. Bu nedenle, ozon, klinik uygulamada, çeşitli etiyoloji ve lokalizasyonların enfeksiyöz ve enflamatuar odaklarının rehabilitasyonunda evrensel bir antiseptik olarak kullanılır.
Literatürde akut pürülan cerrahi hastalıkların tedavisinde ozonlamadan sonra antiseptik preparatların etkinliğinin arttığına dair veriler vardır.
Ozonun ev içi kullanımına ilişkin sonuçlar
Her şeyden önce ozonun tıbbın birçok alanında şifalı ve dezenfekte edici bir ajan olarak şifa pratiğinde kullanılması gerçeğini koşulsuz olarak doğrulamak gerekir, ancak henüz yaygın kullanımından bahsetmek mümkün değildir.
Ozon, en az olumsuz alerjik belirtilere sahip bir kişi tarafından algılanır. Ve literatürde O3'e karşı bireysel hoşgörüsüzlükten söz edilebilse bile, bu vakalar örneğin klor içeren ve diğer halojenli antibakteriyel ilaçlarla karşılaştırılamaz.
Ozon, triatomik oksijendir ve en çevre dostudur. Fırtınadan sonraki sıcak yaz günlerinde “tazelik” kokusunu kim bilmez?! Dünya atmosferindeki sürekli varlığı, herhangi bir canlı organizma tarafından deneyimlenir.
İnceleme, İnternet'teki materyallere dayanmaktadır.
Bilim adamları, elektrostatik makinelerle deney yapmaya başladıklarında ilk olarak bilinmeyen bir gazın varlığından haberdar oldular. 17. yüzyılda oldu. Ancak yeni gazı ancak gelecek yüzyılın sonunda incelemeye başladılar. 1785 yılında Hollandalı fizikçi Martin van Marum, elektrik kıvılcımlarını oksijenden geçirerek ozonu yarattı. Ozon adı sadece 1840'ta ortaya çıktı; İsviçreli kimyager Christian Schönbein tarafından Yunan ozon kokusundan türetilerek icat edildi. Bu gazın kimyasal bileşimi oksijenden farklı değildi, ancak çok daha agresifti. Böylece, kahverengi iyot salınımı ile renksiz potasyum iyodürü anında oksitledi; Shenbein, potasyum iyodür ve nişasta çözeltisi ile emprenye edilmiş kağıdın mavilik derecesine göre ozonu belirlemek için bu reaksiyonu kullandı. Oda sıcaklığında inaktif olan cıva ve gümüş bile ozon varlığında oksitlenir.
Oksijen gibi ozon moleküllerinin sadece oksijen atomlarından oluştuğu, sadece ikiden değil üçten oluştuğu ortaya çıktı. Oksijen O2 ve ozon O3, bir kimyasal element tarafından iki gaz halindeki (normal şartlar altında) basit maddenin oluşumunun tek örneğidir. O3 molekülünde atomlar bir açıyla yerleştirilmiştir, dolayısıyla bu moleküller polardır. Ozon, elektriksel deşarjlar, ultraviyole ışınları, gama ışınları, hızlı elektronlar ve diğer yüksek enerjili parçacıkların etkisi altında oksijen moleküllerinden oluşan serbest oksijen atomlarının O2 moleküllerine “yapışması” sonucu üretilir. Ozon her zaman, ultraviyole radyasyon yayan bakterisidal cıva-kuvars lambaların yanında, fırçaların “ışıldadığı” çalışan elektrikli makinelerin yakınında kokar. Bazı kimyasal reaksiyonlar sırasında oksijen atomları da açığa çıkar. Asitlenmiş suyun elektrolizi sırasında, havada ıslak beyaz fosforun yavaş oksidasyonu sırasında, yüksek oksijen içeriğine sahip bileşiklerin (KMnO4, K2Cr2O7, vb.) veya konsantre sülfürik asidin baryum peroksiti üzerinde. Oksijen atomları her zaman bir alevde bulunur, bu nedenle bir oksijen brülörünün alevine bir basınçlı hava akımı yönlendirirseniz, havada karakteristik ozon kokusu bulunur.
3O2 → 2O3 reaksiyonu oldukça endotermiktir: 1 mol ozon üretmek için 142 kJ harcanmalıdır. Ters reaksiyon, enerjinin serbest bırakılmasıyla ilerler ve çok kolay bir şekilde gerçekleştirilir. Buna göre, ozon kararsızdır. Safsızlıkların yokluğunda, gaz halindeki ozon 70°C'lik bir sıcaklıkta yavaş yavaş ve 100°C'nin üzerinde hızla ayrışır. Katalizörlerin varlığında ozon bozunma hızı önemli ölçüde artar. Gazlar (örneğin nitrik oksit, klor) ve birçok katı madde (hatta kap duvarları) olabilirler. Bu nedenle saf ozonun elde edilmesi zordur ve onunla çalışmak patlama olasılığı nedeniyle tehlikelidir.
Ozonun keşfinden sonraki on yıllar boyunca, temel fiziksel sabitlerinin bile bilinmemesi şaşırtıcı değildir: uzun bir süre boyunca hiç kimse saf ozon elde etmeyi başaramadı. D.I. Mendeleev'in Kimyanın Temelleri adlı ders kitabında yazdığı gibi, "gaz halindeki ozonu hazırlamanın tüm yöntemleriyle, oksijen içeriği her zaman önemsizdir, genellikle yüzde onda birkaçı, nadiren yüzde 2'dir ve yalnızca çok düşük sıcaklıklarda ulaşır. %20.” Sadece 1880'de Fransız bilim adamları J. Gotfeil ve P. Chappui, eksi 23 ° C sıcaklıkta saf oksijenden ozonu elde ettiler. Ozonun kalın bir tabakada güzel bir mavi renge sahip olduğu ortaya çıktı. Soğutulmuş ozonlanmış oksijen yavaşça sıkıştırıldığında gaz koyu maviye döndü ve basıncın hızlı bir şekilde serbest bırakılmasından sonra sıcaklık daha da düştü ve koyu mor sıvı ozon damlacıkları oluştu. Gaz hızlı bir şekilde soğutulmadıysa veya sıkıştırılmadıysa, ozon sarı bir flaşla anında oksijene dönüştü.
Daha sonra ozon sentezi için uygun bir yöntem geliştirildi. Konsantre bir perklorik, fosforik veya sülfürik asit çözeltisi, platin veya kurşun(IV) oksitten yapılmış soğutulmuş bir anot ile elektrolize tabi tutulursa, anotta salınan gaz %50'ye kadar ozon içerecektir. Ozonun fiziksel sabitleri de rafine edildi. -112°C'de oksijenden çok daha hafif sıvılaşır (-183°C'de oksijen). –192.7°C'de ozon katılaşır. Katı ozon mavi-siyah renktedir.
Ozonla yapılan deneyler tehlikelidir. Gaz halindeki ozon, havadaki konsantrasyonu %9'u aşarsa patlayabilir. Sıvı ve katı ozon, özellikle oksitleyici maddelerle temas ettiğinde daha kolay patlar. Ozon, florlu hidrokarbonlarda (freonlar) çözeltiler şeklinde düşük sıcaklıklarda depolanabilir. Bu çözümler mavi renktedir.
Ozonun kimyasal özellikleri.
Ozon, son derece yüksek bir reaktivite ile karakterizedir. Ozon en güçlü oksitleyici ajanlardan biridir ve bu bakımdan sadece flor ve oksijen florür OF2'den daha düşüktür. Oksitleyici bir ajan olarak ozonun aktif prensibi, ozon molekülünün bozunması sırasında oluşan atomik oksijendir. Bu nedenle, oksitleyici bir ajan olarak hareket eden ozon molekülü, kural olarak, yalnızca bir oksijen atomunu “kullanır”, diğer ikisi ise serbest oksijen şeklinde salınır, örneğin 2KI + O3 + H2O → I2 + 2KOH + O2. Diğer birçok bileşik aynı şekilde oksitlenir. Ancak, ozon molekülünün oksidasyon için sahip olduğu üç oksijen atomunun tamamını kullandığı durumlarda istisnalar vardır, örneğin 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3.
Ozon ve oksijen arasındaki çok önemli bir fark, ozonun oda sıcaklığında zaten oksitleyici özellikler sergilemesidir. Örneğin, PbS ve Pb(OH)2 normal koşullar altında oksijen ile reaksiyona girmezken, ozon varlığında sülfür PbSO4'e ve hidroksit PbO2'ye dönüştürülür. Ozonlu bir kaba konsantre bir amonyak çözeltisi dökülürse, beyaz duman görünecektir - bu ozon, amonyum nitrit NH4NO2 oluşturmak üzere amonyağı oksitlemiştir. Ozonun özellikle karakteristik özelliği, AgO ve Ag2O3 oluşumuyla gümüş parçaları “karartma” yeteneğidir.
Bir elektron bağlayıp negatif iyon O3–'ye dönüşerek ozon molekülü daha kararlı hale gelir. Bu tür anyonları içeren "ozonat tuzları" veya ozonitler uzun zamandır bilinmektedir - bunlar lityum dışındaki tüm alkali metallerden oluşur ve ozonitlerin stabilitesi sodyumdan sezyuma yükselir. Alkali toprak metallerinin bazı ozonitleri de bilinmektedir, örneğin Ca(O3)2. Gaz halinde ozon akımı katı bir kuru alkalinin yüzeyine yönlendirilirse, ozonidler içeren turuncu-kırmızı bir kabuk oluşur, örneğin 4KOH + 4O3 → 4KO3 + O2 + 2H2O. Aynı zamanda, katı alkali suyu etkili bir şekilde bağlar, bu da ozonutin ani hidrolizini önler. Bununla birlikte, fazla su ile ozonitler hızla ayrışır: 4KO3 + 2H2O → 4KOH + 5O2. Ayrışma ayrıca depolama sırasında meydana gelir: 2KO3 → 2KO2 + O2. Ozonidler, sıvı amonyakta yüksek oranda çözünürler, bu da onları saf formlarında izole etmeyi ve özelliklerini incelemeyi mümkün kıldı.
Ozonun temas ettiği organik maddeleri genellikle yok eder. Böylece ozon, klordan farklı olarak benzen halkasını parçalayabilir. Ozonla çalışırken kauçuk tüpler ve hortumlar kullanamazsınız - anında “sızarlar”. Ozon, büyük miktarda enerji açığa çıkararak organik bileşiklerle reaksiyona girer. Örneğin terebentin, metan ve diğer birçok maddeye batırılmış eter, alkol, pamuk yünü ozonlu hava ile temas ettiğinde kendiliğinden tutuşur ve ozonun etilen ile karıştırılması güçlü bir patlamaya yol açar.
Ozon kullanımı.
Ozon her zaman organik maddeyi "yakmaz"; bazı durumlarda yüksek oranda seyreltik ozon ile spesifik reaksiyonlar gerçekleştirmek mümkündür. Örneğin, oleik asidin (bitkisel yağlarda büyük miktarlarda bulunur) ozonlanması, yüksek kaliteli yağlama yağları, sentetik lifler ve plastikler için plastikleştiriciler üretmek için kullanılan azelaik asit HOOC(CH2)7COOH üretir. Benzer şekilde, naylon sentezinde kullanılan adipik asit elde edilir. 1855'te Schönbein, C=C çift bağları içeren doymamış bileşiklerin ozon ile reaksiyonunu keşfetti, ancak Alman kimyager H. Staudinger'in bu reaksiyonun mekanizmasını kurması 1925 yılına kadar değildi. Ozon molekülü çift bağı bir ozonid oluşumuyla birleştirir - bu sefer organik ve bir oksijen atomu C=C bağlarından birinin yerini alır ve –О–О– grubu diğerinin yerini alır. Bazı organik ozonidler saf biçimde izole edilmiş olsa da (örneğin, etilen ozonid), serbest ozonitler çok kararsız patlayıcılar olduğundan, bu reaksiyon genellikle seyreltik bir çözelti içinde gerçekleştirilir. Doymamış bileşiklerin ozonlama reaksiyonu, organik kimyacılar arasında büyük saygı görmektedir; Bu tepkiyle ilgili sorunlar genellikle okul olimpiyatlarında bile sunulur. Gerçek şu ki, ozonid su tarafından ayrıştırıldığında, tanımlanması kolay olan ve orijinal doymamış bileşiğin yapısını daha da oluşturan iki aldehit veya keton molekülü oluşur. Böylece, 20. yüzyılın başlarında kimyagerler, doğal olanlar da dahil olmak üzere, C=C bağları içeren birçok önemli organik bileşiğin yapısını oluşturdular.
Ozonun önemli bir uygulama alanı içme suyunun dezenfeksiyonudur. Genellikle su klorludur. Bununla birlikte, klor etkisi altında sudaki bazı safsızlıklar, çok hoş olmayan bir kokuya sahip bileşiklere dönüştürülür. Bu nedenle, uzun zamandır klorun ozon ile değiştirilmesi önerilmiştir. Ozonlanmış su yabancı koku veya tat almaz; birçok organik bileşik ozonla tamamen oksitlendiğinde sadece karbondioksit ve su oluşur. Ozon ve atık su ile arındırın. Fenoller, siyanürler, yüzey aktif maddeler, sülfitler, kloraminler gibi kirleticilerin bile ozon oksidasyonu ürünleri, renk ve kokusu olmayan zararsız bileşiklerdir. Fazla ozon, oksijen oluşumu ile hızla ayrışır. Ancak su ozonlaması klorlamadan daha pahalıdır; ayrıca ozon taşınamaz ve yerinde üretilmesi gerekir.
Atmosferdeki ozon.
Dünya atmosferinde çok fazla ozon yok - 4 milyar ton, yani. ortalama olarak sadece 1 mg/m3. Ozon konsantrasyonu, Dünya yüzeyinden uzaklaştıkça artar ve 20-25 km yükseklikte stratosferde maksimuma ulaşır - bu "ozon tabakası" dır. Atmosferden gelen tüm ozon, normal basınçta Dünya yüzeyinin yakınında toplanırsa, sadece yaklaşık 2-3 mm kalınlığında bir tabaka elde edilecektir. Ve havadaki bu kadar az miktarda ozon aslında Dünya'da yaşam sağlıyor. Ozon, tüm canlılar için zararlı olan güneşin sert ultraviyole ışınlarının Dünya yüzeyine ulaşmasına izin vermeyen bir "koruyucu perde" oluşturur.
Son yıllarda, önemli ölçüde azaltılmış stratosferik ozon içeriğine sahip alanlar olan "ozon delikleri" olarak adlandırılan alanların ortaya çıkmasına çok dikkat edildi. Böyle bir "sızdıran" kalkan sayesinde, Güneş'in daha sert ultraviyole radyasyonu Dünya'nın yüzeyine ulaşır. Bu nedenle bilim adamları uzun süredir atmosferdeki ozonu izliyorlar. 1930'da İngiliz jeofizikçi S. Chapman, stratosferdeki sabit ozon konsantrasyonunu açıklamak için dört reaksiyonlu bir şema önerdi (bu reaksiyonlara M'nin fazla enerjiyi taşıyan herhangi bir atom veya molekül anlamına geldiği Chapman döngüsü denir):
O2 → 2O
O + O + M → O2 + M
O + O3 → 2O2
O3 → O2 + O.
Bu döngünün birinci ve dördüncü reaksiyonları fotokimyasaldır, güneş ışınımının etkisi altındadır. Bir oksijen molekülünün atomlara ayrışması için, dalga boyu 242 nm'den daha az olan radyasyon gereklidir, oysa ozon ışık 240-320 nm bölgesinde emildiğinde bozunur (ikinci reaksiyon bizi sadece sert ultraviyoleden korur, çünkü oksijen bu spektral bölgede absorbe etmez). Kalan iki reaksiyon termaldir, yani. ışığın etkisi olmadan gidin. Ozonun yok olmasına yol açan üçüncü reaksiyonun bir aktivasyon enerjisine sahip olması çok önemlidir; bu, böyle bir reaksiyonun hızının, katalizörlerin etkisiyle artırılabileceği anlamına gelir. Anlaşıldığı üzere, ozon bozunması için ana katalizör nitrik oksit NO'dur. En şiddetli güneş radyasyonunun etkisi altında azot ve oksijenden üst atmosferde oluşur. Ozonosferde bir kez, O3 + NO → NO2 + O2, NO2 + O → NO + O2 olmak üzere iki reaksiyon döngüsüne girer, bunun sonucunda atmosferdeki içeriği değişmez ve sabit ozon konsantrasyonu azalır. Stratosferdeki ozon içeriğinde azalmaya yol açan başka döngüler de vardır, örneğin klorun katılımıyla:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
Ozon ayrıca volkanik patlamalar sırasında atmosfere büyük miktarlarda giren toz ve gazlar tarafından da yok edilir. Son zamanlarda ozonun yerkabuğundan salınan hidrojeni yok etmede de etkili olduğu öne sürülmüştür. Ozon oluşumu ve bozunmasıyla ilgili tüm reaksiyonların toplamı, bir ozon molekülünün stratosferdeki ortalama ömrünün yaklaşık üç saat olduğu gerçeğine yol açar.
Ozon tabakasını etkileyen doğal faktörlerin yanı sıra yapay faktörlerin de olduğu varsayılmaktadır. İyi bilinen bir örnek, klor atomlarının kaynakları olan freonlardır. Freonlar, hidrojen atomlarının flor ve klor atomları ile değiştirildiği hidrokarbonlardır. Soğutmada ve aerosol kutularını doldurmak için kullanılırlar. Sonunda, freonlar havaya girer ve hava akımlarıyla yavaş yavaş yükselir ve sonunda ozon tabakasına ulaşır. Güneş radyasyonunun etkisi altında ayrışan freonlar, ozonu katalitik olarak ayrıştırmaya başlar. "Ozon delikleri" için freonların ne ölçüde suçlanacağı henüz tam olarak bilinmiyor ve yine de kullanımlarını sınırlamak için uzun süredir önlemler alındı.
Hesaplamalar, 60-70 yıl içinde stratosferdeki ozon konsantrasyonunun %25 oranında azalabileceğini göstermektedir. Ve aynı zamanda, yüzey tabakasındaki ozon konsantrasyonu - troposfer, artacaktır, bu da kötüdür, çünkü ozon ve havadaki dönüşümlerinin ürünleri zehirlidir. Troposferdeki ozonun ana kaynağı, hava kütleleri ile stratosferik ozonun alt katmanlara aktarılmasıdır. Yılda yaklaşık 1,6 milyar ton ozon tabakasına girer. Atmosferin alt kısmındaki bir ozon molekülünün ömrü çok daha uzundur - 100 günden fazla, çünkü yüzey tabakasında ozonu yok eden daha az ultraviyole güneş radyasyonu yoğunluğu vardır. Genellikle, troposferde çok az ozon bulunur: temiz temiz havada, konsantrasyonu ortalama sadece 0.016 μg / l'dir. Havadaki ozonun konsantrasyonu sadece rakıma değil aynı zamanda araziye de bağlıdır. Bu nedenle, ozon orada daha yavaş bozunduğundan, okyanusların üzerinde her zaman karadan daha fazla ozon vardır. Sochi'deki ölçümler, deniz kıyısına yakın havanın, kıyıdan 2 km uzaklıktaki ormandakinden %20 daha fazla ozon içerdiğini gösterdi.
Modern insanlar atalarından çok daha fazla ozon soluyor. Bunun temel nedeni havadaki metan ve nitrojen oksit miktarının artmasıdır. Böylece atmosferdeki metan içeriği, doğal gazın kullanılmaya başlandığı 19. yüzyılın ortalarından bu yana sürekli olarak artmaktadır. Azot oksitlerle kirlenmiş bir atmosferde metan, oksijen ve su buharını içeren karmaşık bir dönüşüm zincirine girer ve bunun sonucu CH4 + 4O2 → HCHO + H2O + 2O3 denklemi ile ifade edilebilir. Diğer hidrokarbonlar, örneğin benzinin eksik yanması sırasında arabaların egzoz gazlarında bulunanlar gibi metan görevi de görebilir. Sonuç olarak, son on yılda büyük şehirlerin havasında ozon konsantrasyonu on kat arttı.
Şimşek oksijenin ozona dönüşmesine katkıda bulunduğundan, bir fırtına sırasında havadaki ozon konsantrasyonunun önemli ölçüde arttığına her zaman inanılmıştır. Aslında, artış önemsizdir ve bir fırtına sırasında değil, ondan birkaç saat önce meydana gelir. Bir fırtına sırasında ve ondan birkaç saat sonra ozon konsantrasyonu azalır. Bu, bir gök gürültülü fırtınadan önce, hava kütlelerinin güçlü bir dikey karışımının olması ve böylece üst katmanlardan ek miktarda ozon gelmesi gerçeğiyle açıklanır. Ek olarak, bir fırtınadan önce, elektrik alan gücü artar ve örneğin dalların uçları gibi çeşitli nesnelerin noktalarında bir korona deşarjı oluşumu için koşullar yaratılır. Aynı zamanda ozon oluşumuna da katkıda bulunur. Ve sonra, bir gök gürültüsü bulutunun gelişmesiyle, altında ozon içeriğini doğrudan bulutun altında azaltan güçlü yükselen hava akımları ortaya çıkar.
İlginç bir soru, iğne yapraklı ormanların havasındaki ozon içeriği hakkındadır. Örneğin, G. Remy'nin İnorganik Kimya Kursu'nda “iğne yapraklı ormanların ozonlanmış havası”nın bir kurgu olduğu okunabilir. Öyle mi? Elbette hiçbir bitki ozon yaymaz. Ancak bitkiler, özellikle kozalaklı ağaçlar, terpen sınıfının doymamış hidrokarbonları da dahil olmak üzere havaya birçok uçucu organik bileşik yayar (terebentin içinde birçoğu vardır). Böylece, sıcak bir günde, bir çam ağacı, iğnelerin her gram kuru ağırlığı için saatte 16 mikrogram terpen salmaktadır. Terpenler sadece kozalaklı ağaçlarla değil, aynı zamanda kavak ve okaliptüs gibi bazı yaprak döken ağaçlarla da ayırt edilir. Ve bazı tropik ağaçlar saatte 1 g kuru yaprak kütlesi başına 45 mikrogram terpen salabilir. Sonuç olarak, bir hektar iğne yapraklı orman günde 4 kg'a kadar organik madde ve yaklaşık 2 kg yaprak döken orman salabilir. Dünyanın ormanlık alanı milyonlarca hektardır ve hepsi terpenler de dahil olmak üzere yılda yüz binlerce ton çeşitli hidrokarbon yayar. Ve metan örneğinde gösterildiği gibi, güneş radyasyonunun etkisi altında ve diğer safsızlıkların varlığında hidrokarbonlar ozon oluşumuna katkıda bulunur. Deneylerin gösterdiği gibi, uygun koşullar altında, terpenler gerçekten de ozon oluşumu ile atmosferik fotokimyasal reaksiyonların döngüsünde çok aktif olarak yer alır. Yani iğne yapraklı bir ormandaki ozon bir icat değil, deneysel bir gerçektir.
Ozon ve sağlık.
Fırtınadan sonra yürüyüşe çıkmak ne güzel! Hava temiz ve taze, canlandırıcı jetleri herhangi bir çaba harcamadan akciğerlere akıyor gibi görünüyor. “Ozon gibi kokuyor” diyorlar bu gibi durumlarda sık sık. “Sağlık için çok iyi.” Öyle mi?
Bir zamanlar ozon kesinlikle sağlığa faydalı olarak kabul edildi. Ancak konsantrasyonu belirli bir eşiği aşarsa, pek çok hoş olmayan sonuca neden olabilir. Konsantrasyona ve soluma süresine bağlı olarak ozon, akciğerlerde değişikliklere, göz ve burun mukozalarında tahrişe, baş ağrısına, baş dönmesine, kan basıncını düşürmeye neden olur; ozon, vücudun solunum yollarının bakteriyel enfeksiyonlarına karşı direncini azaltır. Havadaki izin verilen maksimum konsantrasyonu sadece 0,1 µg/l'dir, bu da ozonun klordan çok daha tehlikeli olduğu anlamına gelir! Sadece 0,4 μg / l ozon konsantrasyonu ile içeride birkaç saat geçirirseniz, göğüs ağrıları, öksürük, uykusuzluk görünebilir, görme keskinliği azalır. Ozonda 2 μg / l'den fazla konsantrasyonda uzun süre nefes alırsanız, sonuçlar daha şiddetli olabilir - stupora ve kardiyak aktivitede düşüşe kadar. 8-9 µg/l ozon içeriği ile birkaç saat sonra ölümle dolu pulmoner ödem oluşur. Ancak bir maddenin bu kadar önemsiz miktarlarının geleneksel kimyasal yöntemlerle analiz edilmesi genellikle zordur. Neyse ki, bir kişi ozonun varlığını zaten çok düşük konsantrasyonlarda hissediyor - nişasta iyot kağıdının maviye dönmeyeceği yaklaşık 1 μg / l. Bazı insanlar için, küçük konsantrasyonlarda ozon kokusu, diğerlerine - kükürt dioksit, diğerlerine - sarımsak - klor kokusuna benzer.
Zehirli olan sadece ozonun kendisi değildir. Havaya katılımıyla, örneğin, peroksiasetil nitrat (PAN) CH3-CO-OONO2 oluşur - yırtılma dahil güçlü bir tahriş edici, nefes almayı zorlaştıran ve daha yüksek konsantrasyonlarda kalp felcine neden olan bir madde. PAN, yaz aylarında kirli havada oluşan sözde fotokimyasal dumanın bileşenlerinden biridir (bu kelime İngilizce duman - duman ve sis - sisten türetilmiştir). Dumandaki ozon konsantrasyonu, izin verilen maksimum değerden 20 kat daha yüksek olan 2 μg/l'ye ulaşabilir. Ozon ve nitrojen oksitlerin havadaki birleşik etkisinin, her bir maddenin ayrı ayrı on kat daha güçlü olduğu da dikkate alınmalıdır. Şaşırtıcı olmayan bir şekilde, büyük şehirlerdeki bu tür dumanların sonuçları felaket olabilir, özellikle de şehrin üzerindeki hava "taslaklar" tarafından üflenmezse ve durgun bir bölge oluşursa. Böylece, 1952'de Londra'da birkaç gün içinde 4.000'den fazla insan dumandan öldü. 1963'te New York'ta bir duman 350 kişiyi öldürdü. Benzer hikayeler Tokyo ve diğer büyük şehirlerde de vardı. Sadece insanlar atmosferik ozondan muzdarip değildir. Amerikalı araştırmacılar, örneğin, havada yüksek ozon içeriğine sahip bölgelerde, araba lastiklerinin ve diğer kauçuk ürünlerin hizmet ömrünün önemli ölçüde azaldığını göstermiştir.
Zemin tabakasındaki ozon içeriği nasıl azaltılır? Atmosfere metan emisyonlarını azaltmak pek gerçekçi değil. Başka bir yol daha var - nitrojen oksit emisyonlarını azaltmak, onsuz ozona yol açan reaksiyon döngüsünün devam edemeyeceği. Bu yol da kolay değildir, çünkü nitrojen oksitler sadece arabalar tarafından değil, aynı zamanda (esas olarak) termik santraller tarafından da yayılır.
Ozon kaynakları sadece sokakta değil. Röntgen odalarında, fizyoterapi odalarında (kaynağı cıva-kuvars lambalarıdır), fotokopi makinelerinin (fotokopi makineleri), lazer yazıcıların çalışması sırasında oluşur (burada oluşumunun nedeni yüksek voltajlı deşarjdır). Ozon, perhidrol, argon-ark kaynağı üretimi için kaçınılmaz bir arkadaştır. Ozonun zararlı etkilerini azaltmak için, davlumbazı ultraviyole lambalarla donatmak, odanın iyi havalandırılması gerekir.
Yine de ozonun sağlığa koşulsuz olarak zararlı olduğunu düşünmek pek doğru değildir. Her şey konsantrasyonuna bağlıdır. Araştırmalar, temiz havanın karanlıkta çok zayıf bir şekilde parladığını göstermiştir; parlamanın nedeni ozonun katılımıyla gerçekleşen oksidasyon reaksiyonlarıdır. Parlama ayrıca, içine önceden ozonlanmış oksijenin doldurulduğu bir şişede su çalkalandığında da gözlendi. Bu parıltı her zaman hava veya sudaki küçük miktarlarda organik safsızlıkların varlığı ile ilişkilidir. Temiz havayı solunan bir kişiyle karıştırırken, parıltının yoğunluğu on kat arttı! Ve bu şaşırtıcı değil: solunan havada etilen, benzen, asetaldehit, formaldehit, aseton ve formik asit mikro safsızlıkları bulundu. Ozon tarafından "vurgulanırlar". Aynı zamanda, "eski", yani. Ozondan tamamen yoksun, çok temiz olmasına rağmen hava parlamaya neden olmaz ve kişi bunu "bayat" olarak hisseder. Bu hava damıtılmış su ile karşılaştırılabilir: çok saftır, neredeyse hiç kirlilik içermez ve içilmesi zararlıdır. Bu nedenle, havada ozonun tamamen yokluğu, görünüşe göre, içindeki mikroorganizmaların içeriğini arttırdığı için insanlar için de elverişsizdir, ozonun yok ettiği zararlı maddelerin ve hoş olmayan kokuların birikmesine yol açar. Böylece, içinde insan olmasa bile, binaların düzenli ve uzun süreli havalandırılması ihtiyacı ortaya çıkıyor: sonuçta, odaya giren ozon uzun süre oyalanmaz - kısmen ayrışır. ve büyük ölçüde duvarlara ve diğer yüzeylere yerleşir (yüzer). Odada ne kadar ozon olması gerektiğini söylemek zor. Bununla birlikte, minimum konsantrasyonlarda ozon muhtemelen gerekli ve faydalıdır.
Ilya Leenson