Onarıcı özellikler- bunlar tüm metallerin temel kimyasal özellikleridir. Çevreden gelen oksitleyici maddeler de dahil olmak üzere çok çeşitli oksitleyici maddelerle etkileşim halinde kendilerini gösterirler. Genel olarak bir metalin oksitleyici maddelerle etkileşimi aşağıdaki şema ile ifade edilebilir:
Ben + Oksitleyici madde" Ben(+X),
(+X) Me'nin pozitif oksidasyon durumudur.
Metal oksidasyon örnekleri.
Fe + O 2 → Fe(+3) 4Fe + 3O 2 = 2 Fe 2 O 3
Ti + I 2 → Ti(+4) Ti + 2I 2 = TiI 4
Zn + H + → Zn(+2) Zn + 2H + = Zn 2+ + H 2
Metal aktivite serisi
Metallerin indirgeyici özellikleri birbirinden farklıdır. Elektrot potansiyelleri E, metallerin indirgeme özelliklerinin niceliksel bir özelliği olarak kullanılır.
Metal ne kadar aktif olursa, standart elektrot potansiyeli Eo o kadar negatif olur.
Oksidatif aktiviteleri azaldıkça sıralanan metaller bir aktivite serisi oluşturur.
Metal aktivite serisi
| Ben | Li | k | CA | Hayır | Mg | Al | Mn | Zn | CR | Fe | Hayır | sn | kurşun | H2 | Cu | Ag | Au |
| ben z+ | Li+ | K+ | Ca2+ | Na+ | Mg 2+ | Al 3+ | Min 2+ | Zn2+ | Kr3+ | Fe 2+ | Hayır 2+ | sn 2+ | Pb2+ | H+ | Cu 2+ | Ag+ | Au 3+ |
| E o,B | -3,0 | -2,9 | -2,87 | -2,71 | -2,36 | -1,66 | -1,18 | -0,76 | -0,74 | -0,44 | -0,25 | -0,14 | -0,13 | 0 | +0,34 | +0,80 | +1,50 |
Bir metalin tuz çözeltisinden daha yüksek indirgeme aktivitesine sahip başka bir metalle indirgenmesine sementasyon denir.. Sementasyon metalurji teknolojilerinde kullanılır.
Özellikle Cd, tuzunun çinko ile çözeltisinden indirgenmesiyle elde edilir.
Zn + Cd 2+ = Cd + Zn 2+
3.3. 1. Metallerin oksijenle etkileşimi
Oksijen güçlü bir oksitleyici ajandır. dışındaki metallerin büyük çoğunluğunu oksitleyebilir.AuVepuan . Havaya maruz kalan metaller oksijenle temas eder, bu nedenle metallerin kimyası incelenirken her zaman metalin oksijenle etkileşiminin özelliklerine dikkat edilir.
Herkes nemli havadaki demirin pasla nemlendirilmiş demir oksitle kaplandığını bilir. Ancak çok yüksek olmayan sıcaklıklarda kompakt durumdaki birçok metal, yüzeylerinde ince koruyucu filmler oluşturduklarından oksidasyona karşı direnç gösterir. Bu oksidasyon ürünleri filmleri oksitleyici maddenin metalle temas etmesini önler. Metalin yüzeyinde metalin oksidasyonunu önleyen koruyucu tabakaların oluşması olayına metalin pasifleşmesi denir.
Sıcaklıktaki artış metallerin oksijenle oksidasyonunu teşvik eder. Metallerin aktivitesi ince ezilmiş halde artar. Toz halindeki metallerin çoğu oksijende yanar.
s-metaller
En büyük indirgeyici aktiviteyi gösterS-metaller. Na, K, Rb Cs metalleri havada tutuşabilir ve kapalı kaplarda veya bir gazyağı tabakası altında depolanırlar. Be ve Mg havada düşük sıcaklıklarda pasifleştirilir. Ancak ateşlendiğinde Mg bandı kör edici bir alevle yanar.
MetallerIIA-alt grupları ve Li, oksijenle etkileşime girdiğinde oksitler oluşturur.
2Ca + O2 = 2CaO
4 Li + Ö 2 = 2 Li 2 Ö
Alkali metaller hariçLioksijenle etkileşime girdiğinde oksitler değil peroksitler oluştururlarBen 2 Ö 2 ve süperoksitlerMeO 2 .
2Na + O2 = Na202
K + Ö2 = KO2
p-metaller
Ait olduğu metallerP- blok havada pasifleştirilir.
Oksijenle yanarken
- IIIA alt grubunun metalleri bu tür oksitler oluşturur Ben 2 Ç 3,
- Sn oksitlenir SnO 2 ve Pb - kadar PbO
- Bi gidiyor Bi2O3.
d-metaller
TümD-periyod 4 metalleri oksijenle oksitlenir. Sc, Mn, Fe en kolay oksitlenenlerdir. Korozyona karşı özellikle dayanıklı olanlar Ti, V, Cr'dir.
Oksijenle yandığında hepsindenD
Oksijenle yandığında hepsindenD-periyod 4 elementlerinden yalnızca skandiyum, titanyum ve vanadyum, Me'nin grup numarasına eşit en yüksek oksidasyon durumunda olduğu oksitleri oluşturur. Geriye kalan 4 d-metal periyodu oksijende yakıldığında Me'nin orta fakat kararlı oksidasyon durumlarında olduğu oksitler oluşturur.
Oksijende yandığında 4. periyot d-metallerinin oluşturduğu oksit türleri:
- MeO Zn, Cu, Ni, Co'yu oluşturur. (T>1000°C'de Cu, Cu2O'yu oluşturur),
- Ben 2 Ç 3, Cr, Fe ve Sc'yi oluşturur,
- MeO 2 - Mn ve Ti,
- V daha yüksek bir oksit oluşturur - V 2 Ö 5 .
Oksijenle yandığındaD-5. ve 6. periyotların metalleri kural olarak daha yüksek oksitler oluşturur, istisnalar Ag, Pd, Rh, Ru metalleridir.
Oksijende yanma sırasında 5. ve 6. periyotlardaki d-metallerin oluşturduğu oksit türleri:
- Ben 2 Ç 3- Y, La'yı oluşturur; Rh;
- MeO 2- Zr, Hf; IR:
- Ben 2 Ç 5- Nb, Ta;
- MeO 3- Mo, W
- Ben 2 Ç 7- Tc, Re
- MeO 4 - İşletim sistemi
- MeO- Cd, Hg, Pd;
- Ben 2 O- Ag;
Metallerin asitlerle etkileşimi
Asit çözeltilerinde hidrojen katyonu oksitleyici bir maddedir. H+ katyonu aktivite serisindeki metalleri hidrojene kadar oksitleyebilir yani Negatif elektrot potansiyeline sahip olan
Oksitlendiğinde birçok metal asidik sulu çözeltilerde katyonlara dönüşür.ben + .
Bir dizi asidin anyonları, H + 'dan daha güçlü oksitleyici özellikler gösterme yeteneğine sahiptir. Bu tür oksitleyici maddeler arasında anyonlar ve en yaygın asitler bulunur. H 2 BU YÜZDEN 4 VeHNO 3 .
NO 3 - anyonlar çözeltideki herhangi bir konsantrasyonda oksitleyici özellikler sergiler, ancak indirgeme ürünleri asit konsantrasyonuna ve oksitlenen metalin doğasına bağlıdır.
SO 4 2-anyonları yalnızca konsantre H 2 SO 4'te oksitleyici özellikler sergiler.
Oksitleyici maddelerin indirgeme ürünleri: H+, NO 3 - , BU YÜZDEN 4 2 -
2Н + + 2е - =H2
BU YÜZDEN 4
2-
konsantre H 2 SO 4'ten BU YÜZDEN 4
2-
+ 2e -
+ 4
H +
=
BU YÜZDEN 2
+ 2
H 2
Ö
(S, H 2 S oluşumu da mümkündür)
NO 3 - konsantre HNO 3'ten NO 3 - + e -
+ 2H + =
NO 2 + H 2 O
NO 3 - seyreltik HNO 3'ten NO 3 - + 3e -
+4H+=HAYIR+2H2O
(N 2 O, N 2, NH 4 + oluşumu da mümkündür)
Metaller ve asitler arasındaki reaksiyon örnekleri
Zn + H 2 SO 4 (seyreltilmiş) " ZnSO 4 + H 2
8Al + 15H 2 SO 4 (k.) " 4Al 2 (SO 4) 3 + 3H 2 S + 12H 2 O
3Ni + 8HNO 3 (dil.) " 3Ni(NO 3) 2 + 2NO + 4H 2 O
Cu + 4HNO 3 (k.) " Cu(NO 3) 2 + 2NO 2 + 2H 2 O
Asidik çözeltilerde metal oksidasyon ürünleri
Alkali metaller Me + tipi bir katyon oluşturur, ikinci grubun s-metalleri katyonları oluşturur Ben 2+.
Asitlerde çözündüğünde p-blok metalleri tabloda belirtilen katyonları oluşturur.
Pb ve Bi metalleri yalnızca nitrik asitte çözünür.
| Ben | Al | GA | İçinde | TL | sn | kurşun | Bi |
| Mez+ | Al 3+ | Ga 3+ | 3+'de | TL+ | sn 2+ | Pb2+ | Bi 3+ |
| Eo,B | -1,68 | -0,55 | -0,34 | -0,34 | -0,14 | -0,13 | +0,317 |
4 periyodun tüm d-metalleri hariç Cu iyonlar tarafından oksitlenebilirH+ asidik çözeltilerde.
4. periyot d-metallerinin oluşturduğu katyon türleri:
- ben 2+(Mn'den Cu'ya kadar değişen d-metalleri oluşturur)
- ben 3+ ( nitrik asitte Sc, Ti, V, Cr ve Fe oluşturur).
- Ti ve V ayrıca katyonlar oluşturur MeO 2+
Asidik çözeltilerde H + oksitlenebilir: Y, La, Cd.
Aşağıdakiler HNO 3'te çözülebilir: Cd, Hg, Ag. Pd, Tc, Re sıcak HNO 3'te çözünür.
Aşağıdakiler sıcak H 2 SO 4'te çözünür: Ti, Zr, V, Nb, Tc, Re, Rh, Ag, Hg.
Metaller: Ti, Zr, Hf, Nb, Ta, Mo, W genellikle HNO3 + HF karışımı içinde çözülür.
Kral suyunda (HNO3 + HCl karışımı) Zr, Hf, Mo, Tc, Rh, Ir, Pt, Au ve Os zorlukla çözülebilir. Metallerin kral sularında veya HNO3 + HF karışımında çözünmesinin nedeni karmaşık bileşiklerin oluşmasıdır.
Örnek. Altının Kral Suyu'nda çözünmesi, bir kompleksin oluşması nedeniyle mümkün olur -
Au + HNO3 + 4HCl = H + NO + 2H2O
Metallerin su ile etkileşimi
Suyun oksitleyici özelliği şunlardan kaynaklanmaktadır: H(+1).
2H 2 Ö + 2e -" N 2 + 2OH -
Sudaki H+ konsantrasyonu düşük olduğundan oksitleyici özellikleri düşüktür. Metaller suda çözünebilir e< - 0,413 B. Число металлов, удовлетворяющих этому условию, значительно больше, чем число металлов, реально растворяющихся в воде. Причиной этого является образование на поверхности большинства металлов плотного слоя оксида, нерастворимого в воде. Если оксиды и гидроксиды металла растворимы в воде, то этого препятствия нет, поэтому щелочные и щелочноземельные металлы энергично растворяются в воде. TümS-metaller hariç Be ve Mg suda kolaylıkla çözünür.
2 Hayır + 2 HOH = H 2 + 2 AH -
Na suyla kuvvetli bir şekilde reaksiyona girerek ısı açığa çıkarır. Açığa çıkan H2 tutuşabilir.
2H2 +O2 =2H2O
Mg yalnızca kaynar suda çözünür, Be inert çözünmeyen bir oksitle oksidasyondan korunur
P-blok metalleri, P-blok metallerine göre daha az güçlü indirgeyici ajanlardır.S.
P-metaller arasında indirgeme aktivitesi IIIA alt grubunun metallerinde daha yüksektir, Sn ve Pb zayıf indirgeyici maddelerdir, Bi'nin Eo > 0'ı vardır.
p-metaller normal koşullar altında suda çözünmez. Koruyucu oksit su ile alkali çözeltilerde yüzeyden çözündüğünde Al, Ga ve Sn oksitlenir.
D-metaller arasında su ile oksitlenirler Sc ve Mn, La, Y ısıtıldığında Demir su buharı ile reaksiyona girer.
Metallerin alkali çözeltilerle etkileşimi
Alkali çözeltilerde su, oksitleyici bir madde görevi görür..
2H 2 Ö + 2e - =H2 + 2OH - Eo = - 0,826 B (pH = 14)
H + konsantrasyonunun azalmasına bağlı olarak suyun oksitleyici özellikleri artan pH ile azalır. Yine de, Suda çözünmeyen bazı metaller alkali çözeltilerde çözünür.örneğin Al, Zn ve diğerleri. Bu tür metallerin alkali çözeltilerde çözünmesinin ana nedeni, bu metallerin oksit ve hidroksitlerinin amfoterisite sergilemesi ve alkali içinde çözünerek oksitleyici madde ile indirgeyici madde arasındaki bariyeri ortadan kaldırmasıdır.
Örnek. Al'ın NaOH çözeltisinde çözünmesi.
2Al + 3H20 + 2NaOH + 3H20 = 2Na + 3H2
Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H 2 , Cu, Ag, Hg, Au
Bir metal standart elektrot potansiyelleri serisinde ne kadar soldaysa indirgeyici madde o kadar güçlüdür; en güçlü indirgeyici madde lityum metaldir, altın en zayıftır ve bunun tersine altın (III) iyonu en güçlü oksitleyicidir ajan, lityum (I) en zayıfıdır.
Her metal, kendisinden sonraki gerilim dizisindeki metalleri çözeltideki tuzlardan indirgeme yeteneğine sahiptir; örneğin demir, bakırı kendi tuzlarının çözeltilerinden çıkarabilir. Ancak alkali ve toprak alkali metallerin suyla doğrudan reaksiyona gireceğini unutmayın.
Hidrojenin solundaki voltaj serisinde bulunan metaller, onu seyreltik asit çözeltilerinden çözerken, bunların içinde çözebilir.
Bir metalin indirgeme aktivitesi her zaman periyodik tablodaki konumuna karşılık gelmez, çünkü bir metalin bir serideki yerini belirlerken sadece elektron verme yeteneği değil, aynı zamanda onu yok etmek için harcanan enerji de dikkate alınır. metalin kristal kafesinin yanı sıra iyonların hidrasyonu için harcanan enerji.
Basit maddelerle etkileşim
İLE oksijen Çoğu metal oksitler oluşturur - amfoterik ve bazik:
4Li + Ö2 = 2Li2O,
4Al + 3O2 = 2Al203.
Lityum dışındaki alkali metaller peroksitler oluşturur:
2Na + O2 = Na202.
İLE halojenler metaller hidrohalik asitlerin tuzlarını oluşturur, örneğin,
Cu + Cl2 = CuCl2.
İLE hidrojen en aktif metaller, hidrojenin -1 oksidasyon durumuna sahip olduğu tuz benzeri maddeler olan iyonik hidritleri oluşturur.
2Na + H2 = 2NaH.
İLE gri metaller sülfitler oluşturur - hidrojen sülfür asit tuzları:
İLE azot Bazı metaller nitrür oluşturur; reaksiyon neredeyse her zaman ısıtıldığında meydana gelir:
3Mg + N2 = Mg3N2.
İLE karbon karbürler oluşur:
4Al + 3C = Al3C4.
İLE fosfor – fosfitler:
3Ca + 2P = Ca3P2 .
Metaller birbirleriyle etkileşime girerek oluşturabilirler. intermetalik bileşikler :
2Na + Sb = Na2Sb,
3Cu + Au = Cu 3 Au.
Metaller yüksek sıcaklıklarda reaksiyona girmeden birbirlerine karışabilirler. alaşımlar.
Alaşımlar
Alaşımlar yalnızca metalik durumda karakteristik özelliklere sahip olan, iki veya daha fazla metalin yanı sıra metaller ve metal olmayanlardan oluşan sistemler olarak adlandırılır.
Alaşımların özellikleri çok çeşitlidir ve bileşenlerinin özelliklerinden farklıdır, örneğin altının daha sert hale gelmesi ve mücevher yapımına daha uygun hale gelmesi için içine gümüş eklenir ve% 40 kadmiyum ve% 60 bizmut içeren bir alaşım kullanılır. 144 °C'lik bir erime noktasına sahiptir, yani bileşenlerinin erime noktasından (Cd 321 °C, Bi 271 °C) çok daha düşüktür.
Aşağıdaki alaşım türleri mümkündür:
Erimiş metaller herhangi bir oranda birbirleriyle karıştırılır, örneğin Ag-Au, Ag-Cu, Cu-Ni ve diğerleri gibi birbirleri içinde süresiz olarak çözülür. Bu alaşımlar bileşim olarak homojendir, kimyasal direnci yüksektir ve elektrik akımını iletir;
Düzleştirilmiş metaller birbirleriyle herhangi bir oranda karıştırılır, ancak soğutulduğunda ayrılırlar ve örneğin Pb-Sn, Bi-Cd, Ag-Pb ve diğerleri gibi bileşenlerin ayrı ayrı kristallerinden oluşan bir kütle elde edilir.
Redoks aktivitelerine bağlı olarak tüm metaller, elektrokimyasal metal voltaj serisi (içindeki metaller artan standart elektrokimyasal potansiyellere göre düzenlendiğinden) veya metal aktivite serisi adı verilen bir seri halinde birleştirilir:
Li, K, Ba, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Pt, Au
Kimyasal olarak en aktif metaller hidrojene kadar olan aktivite serisinde yer alır ve metal ne kadar solda yer alırsa o kadar aktif olur. Faaliyet serisinde hidrojenden sonra yer alan metaller inaktif olarak değerlendirilmektedir.
Alüminyum
Alüminyum gümüşi beyaz renktedir. Alüminyumun temel fiziksel özellikleri hafiflik, yüksek termal ve elektrik iletkenliğidir. Serbest durumda, alüminyum havaya maruz kaldığında dayanıklı bir Al203 oksit filmi ile kaplanır ve bu da onu konsantre asitlerin etkisine karşı dirençli kılar.
Alüminyum p-ailesi metallerine aittir. Dış enerji seviyesinin elektronik konfigürasyonu 3s 2 3p 1'dir. Bileşiklerinde alüminyum “+3” oksidasyon durumu sergiler.
Alüminyum, bu elementin erimiş oksidinin elektrolizi ile üretilir:
2Al 2 Ö 3 = 4Al + 3O 2
Bununla birlikte, ürünün düşük verimi nedeniyle, Na3 ve Al203 karışımının elektrolizi yoluyla alüminyum üretme yöntemi daha sık kullanılır. Reaksiyon, 960 ° C'ye ısıtıldığında ve katalizörlerin - florürlerin (AlF3, CaF2, vb.) varlığında meydana gelirken, katotta alüminyum salınımı meydana gelir ve anotta oksijen salınır.
Alüminyum, yüzeyindeki oksit filmi (1) çıkarıldıktan sonra suyla etkileşime girebilir, basit maddelerle (oksijen, halojenler, nitrojen, kükürt, karbon) (2-6), asitlerle (7) ve bazlarla (8) etkileşime girebilir:
2Al + 6H 2 Ö = 2Al(OH) 3 + 3H 2 (1)
2Al +3/2O 2 = Al 2 Ö 3 (2)
2Al + 3Cl2 = 2AlCl3 (3)
2Al + N 2 = 2AlN (4)
2Al +3S = Al 2 S 3 (5)
4Al + 3C = Al4C3 (6)
2Al + 3H 2 SO 4 = Al 2 (S04) 3 + 3H 2 (7)
2Al +2NaOH +3H20 = 2Na + 3H2 (8)
Kalsiyum
Serbest formunda Ca gümüşi beyaz bir metaldir. Havaya maruz kaldığında anında hava bileşenleriyle etkileşiminin ürünü olan sarımsı bir filmle kaplanır. Kalsiyum oldukça sert bir metaldir ve yüzey merkezli kübik kristal kafesine sahiptir.
Dış enerji seviyesinin elektronik konfigürasyonu 4s2'dir. Bileşiklerinde kalsiyum “+2” oksidasyon durumu sergiler.
Kalsiyum, erimiş tuzların, çoğunlukla klorürlerin elektrolizi ile elde edilir:
CaCl2 = Ca + Cl2
Kalsiyum suda çözünerek hidroksitler oluşturabilir, güçlü temel özellikler sergileyebilir (1), oksijenle reaksiyona girebilir (2), oksitler oluşturabilir, metal olmayanlarla etkileşime girebilir (3-8), asitlerde çözünebilir (9):
Ca + H20 = Ca(OH)2 + H2 (1)
2Ca + Ö2 = 2CaO (2)
Ca + Br2 = CaBr2 (3)
3Ca + N2 = Ca3N2 (4)
2Ca + 2C = Ca 2 C 2 (5)
2Ca + 2P = Ca3P2 (7)
Ca + H2 = CaH2 (8)
Ca + 2HCl = CaCl2 + H2 (9)
Demir ve bileşikleri
Demir gri bir metaldir. Saf haliyle oldukça yumuşak, dövülebilir ve viskozdur. Dış enerji seviyesinin elektronik konfigürasyonu 3d 6 4s 2'dir. Bileşiklerinde demir “+2” ve “+3” oksidasyon durumlarını sergiler.
Metalik demir su buharı ile reaksiyona girerek karışık oksit (II, III) Fe3O4 oluşturur:
3Fe + 4H 2 Ö (v) ↔ Fe 3 Ö 4 + 4H 2
Havada demir, özellikle nem (pas) varlığında kolayca oksitlenir:
3Fe + 3O2 + 6H2O = 4Fe(OH)3
Diğer metaller gibi demir de halojenler (1) gibi basit maddelerle reaksiyona girer ve asitlerde (2) çözünür:
Fe + 2HCl = FeCl2 + H2 (2)
Demir, çeşitli oksidasyon durumları sergilediği için geniş bir bileşik yelpazesi oluşturur: demir (II) hidroksit, demir (III) hidroksit, tuzlar, oksitler, vb. Böylece demir (II) hidroksit, alkali çözeltilerin havaya erişimi olmayan demir (II) tuzları üzerindeki etkisiyle elde edilebilir:
FeS04 + 2NaOH = Fe(OH)2 ↓ + Na2S04
Demir(II) hidroksit asitlerde çözünür ve oksijen varlığında demir(III) hidroksite oksitlenir.
Demir (II) tuzları indirgeyici madde özellikleri sergiler ve demir (III) bileşiklerine dönüştürülür.
Demir (III) oksit, demirin oksijende yakılmasıyla elde edilemez; bunu elde etmek için demir sülfitlerin yakılması veya diğer demir tuzlarının kalsine edilmesi gerekir:
4FeS2 + 11O2 = 2Fe203 +8SO2
2FeS04 = Fe203 + SO2 + 3H20
Demir (III) bileşikleri zayıf oksitleyici özellikler sergiler ve güçlü indirgeyici maddelerle redoks reaksiyonlarına girme yeteneğine sahiptir:
2FeCl3 + H2S = Fe(OH)3 ↓ + 3NaCl
Demir ve çelik üretimi
Çelikler ve dökme demirler, çelikte %2'ye kadar ve dökme demirde %2-4'e kadar karbon içeriğine sahip demir ve karbon alaşımlarıdır. Çelikler ve dökme demirler alaşım katkı maddeleri içerir: çelikler – Cr, V, Ni ve dökme demir – Si.
Çeliklerin farklı türleri vardır; örneğin yapı çelikleri, paslanmaz çelikler, takım çelikleri, ısıya dayanıklı çelikler ve kriyojenik çelikler kullanım amaçlarına göre ayrılır. Kimyasal bileşimlerine göre karbonlu (düşük, orta ve yüksek karbonlu) ve alaşımlı (düşük, orta ve yüksek alaşımlı) olarak ayrılırlar. Yapısına bağlı olarak östenitik, ferritik, martensitik, perlitik ve beynitik çelikler ayırt edilir.
Çelikler inşaat, kimya, petrokimya, çevre koruma, ulaşım enerjisi ve diğer endüstriler gibi ulusal ekonominin birçok sektöründe uygulama alanı bulmuştur.
Dökme demir - sementit veya grafit içindeki karbon içeriğinin biçimine ve bunların miktarına bağlı olarak, çeşitli dökme demir türleri ayırt edilir: beyaz (sementit formunda karbonun varlığı nedeniyle kırığın açık rengi), gri (grafit formundaki karbonun varlığı nedeniyle kırığın gri rengi), dövülebilir ve ısıya dayanıklıdır. Dökme demirler çok kırılgan alaşımlardır.
Dökme demirin uygulama alanları geniştir - sanatsal dekorasyonlar (çitler, kapılar), dolap parçaları, sıhhi tesisat ekipmanları, ev eşyaları (kızartma tavaları) dökme demirden yapılır ve otomotiv endüstrisinde kullanılır.
Problem çözme örnekleri
ÖRNEK 1
| Egzersiz yapmak | 26,31 g ağırlığındaki bir magnezyum ve alüminyum alaşımı hidroklorik asit içerisinde çözüldü. Bu durumda 31.024 litre renksiz gaz açığa çıktı. Alaşımdaki metallerin kütle fraksiyonlarını belirleyin. |
| Çözüm | Her iki metal de hidroklorik asitle reaksiyona girerek hidrojen açığa çıkarabilir: Mg +2HCl = MgCl2 + H2 2Al +6HCl = 2AlCl3 + 3H2 Açığa çıkan hidrojenin toplam mol sayısını bulalım: v(H2) =V(H2)/Vm v(H2) = 31,024/22,4 = 1,385 mol Mg maddesinin miktarı x mol ve Al y mol olsun. Daha sonra reaksiyon denklemlerine dayanarak hidrojenin toplam mol sayısı için ifadeyi yazabiliriz: x + 1,5y = 1,385 Karışımdaki metallerin kütlesini ifade edelim: Daha sonra karışımın kütlesi aşağıdaki denklemle ifade edilecektir: 24x + 27y = 26,31 Bir denklem sistemi aldık: x + 1,5y = 1,385 24x + 27y = 26,31 Hadi çözelim: 33,24 -36y+27y = 26,31 v(Al) = 0,77 mol v(Mg) = 0,23 mol Bu durumda karışımdaki metallerin kütlesi: m(Mg) = 24×0,23 = 5,52 gr m(Al) = 27×0,77 = 20,79 g Karışımdaki metallerin kütle kesirlerini bulalım: ώ =m(Me)/m toplamı ×100% ώ(Mg) = 5,52/26,31 ×%100= %20,98 ώ(Al) = 100 – 20,98 = %79,02 |
| Cevap | Alaşımdaki metallerin kütle oranları: %20,98, %79,02 |
Kolayca reaksiyona giren metallere aktif metaller denir. Bunlara alkali, alkalin toprak metalleri ve alüminyum dahildir.
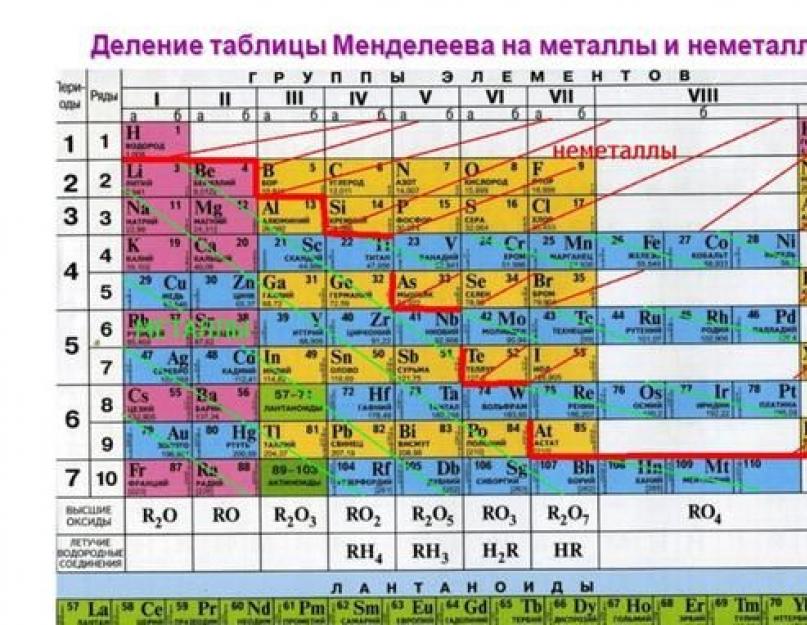
Periyodik tablodaki konumu
Periyodik tabloda elementlerin metalik özellikleri soldan sağa doğru azalır. Bu nedenle, I ve II gruplarının unsurları en aktif olarak kabul edilir.

Pirinç. 1. Periyodik tablodaki aktif metaller.
Tüm metaller indirgeyici maddelerdir ve dış enerji seviyesinde elektronlarla kolayca ayrılırlar. Aktif metallerin yalnızca bir veya iki değerlik elektronu vardır. Bu durumda enerji seviyelerinin artmasıyla birlikte metalik özellikler yukarıdan aşağıya doğru artar, çünkü Elektron atomun çekirdeğinden ne kadar uzaktaysa ayrılması o kadar kolay olur.
Alkali metaller en aktif olarak kabul edilir:
- lityum;
- sodyum;
- potasyum;
- rubidyum;
- sezyum;
- Fransızca
Alkali toprak metalleri şunları içerir:
- berilyum;
- magnezyum;
- kalsiyum;
- stronsiyum;
- baryum;
- radyum.
Bir metalin aktivite derecesi, metal voltajlarının elektrokimyasal serisiyle belirlenebilir. Bir element hidrojenin soluna ne kadar uzaksa o kadar aktiftir. Hidrojenin sağındaki metaller aktif değildir ve yalnızca konsantre asitlerle reaksiyona girebilir.

Pirinç. 2. Metallerin elektrokimyasal serileri.
Kimyadaki aktif metallerin listesi aynı zamanda grup III'te ve hidrojenin solunda bulunan alüminyumu da içerir. Ancak alüminyum aktif ve orta derecede aktif metallerin sınırında yer alır ve normal şartlarda bazı maddelerle reaksiyona girmez.
Özellikler
Aktif metaller yumuşaktır (bıçakla kesilebilir), hafiftir ve erime noktası düşüktür.
Metallerin ana kimyasal özellikleri tabloda sunulmaktadır.
|
Reaksiyon |
Denklem |
İstisna |
|
Alkali metaller oksijenle etkileşime girdiğinde havada kendiliğinden tutuşur |
K + Ö2 → KO2 |
Lityum oksijenle yalnızca yüksek sıcaklıklarda reaksiyona girer |
|
Alkali toprak metaller ve alüminyum havada oksit filmler oluşturur ve ısıtıldığında kendiliğinden tutuşur. |
2Ca + Ö2 → 2CaO |
|
|
Basit maddelerle reaksiyona girerek tuzlar oluşturur |
Ca + Br2 → CaBr2; |
Alüminyum hidrojenle reaksiyona girmez |
|
Suyla şiddetli reaksiyona girerek alkaliler ve hidrojen oluşturur |
|
Lityum ile reaksiyon yavaştır. Alüminyum ancak oksit filmi çıkarıldıktan sonra suyla reaksiyona girer |
|
Asitlerle reaksiyona girerek tuzlar oluşturur |
Ca + 2HCl → CaCl2 + H2; 2K + 2HMnO4 → 2KMnO4 + H2 |
|
|
Tuz çözeltileriyle etkileşime girerek önce suyla, sonra tuzla reaksiyona girer. |
2Na + CuCl2 + 2H20: 2Na + 2H20 → 2NaOH + H2; |
Aktif metaller kolayca reaksiyona girer, bu nedenle doğada yalnızca karışımlarda (mineraller, kayalar) bulunurlar.

Pirinç. 3. Mineraller ve saf metaller.
Ne öğrendik?
Aktif metaller, I ve II gruplarının elemanlarını içerir - alkali ve toprak alkali metallerin yanı sıra alüminyum. Aktiviteleri atomun yapısına göre belirlenir; birkaç elektron dış enerji seviyesinden kolayca ayrılır. Bunlar basit ve karmaşık maddelerle hızla reaksiyona girerek oksitler, hidroksitler ve tuzlar oluşturan yumuşak hafif metallerdir. Alüminyum hidrojene daha yakındır ve maddelerle reaksiyonu ek koşullar gerektirir - yüksek sıcaklıklar, oksit filminin tahrip edilmesi.
Konuyla ilgili deneme
Raporun değerlendirilmesi
Ortalama puanı: 4.4. Alınan toplam puan: 388.
Bir dizi voltajdan hangi bilgiler elde edilebilir?
İnorganik kimyada bir dizi metal voltajı yaygın olarak kullanılmaktadır. Özellikle birçok reaksiyonun sonuçları ve hatta bunların uygulanma olasılığı, belirli bir metalin NER'deki konumuna bağlıdır. Bu konuyu daha detaylı tartışalım.
Metallerin asitlerle etkileşimi
Hidrojenin solundaki voltaj serisinde bulunan metaller, oksitleyici olmayan maddeler olan asitlerle reaksiyona girer. NER'de H'nin sağında bulunan metaller yalnızca oksitleyici asitlerle (özellikle HNO 3 ve konsantre H 2 SO 4 ile) etkileşime girer.
örnek 1. Çinko, NER'de hidrojenin solunda bulunur, bu nedenle hemen hemen tüm asitlerle reaksiyona girebilir:
Zn + 2HCl = ZnCl2 + H2
Zn + H2S04 = ZnS04 + H2
Örnek 2. Bakır, ERN'de H'nin sağında bulunur; bu metal “sıradan” asitlerle (HCl, H3PO4, HBr, organik asitler) reaksiyona girmez, ancak oksitleyici asitlerle (nitrik, konsantre sülfürik) etkileşime girer:
Cu + 4HNO3 (kons.) = Cu(NO3)2 + 2NO2 + 2H2O
Cu + 2H 2 SO 4 (kons.) = CuSO 4 + SO 2 + 2H 2 O
Önemli bir noktaya dikkatinizi çekmek isterim: Metaller oksitleyici asitlerle etkileşime girdiğinde açığa çıkan hidrojen değil, diğer bazı bileşiklerdir. Bu konuda daha fazlasını okuyabilirsiniz!
Metallerin su ile etkileşimi
Mg'nin solundaki voltaj serisinde bulunan metaller, halihazırda oda sıcaklığındaki suyla kolayca reaksiyona girerek hidrojen açığa çıkarır ve bir alkali çözelti oluşturur.
Örnek 3. Sodyum, potasyum, kalsiyum, alkali bir çözelti oluşturmak için suda kolayca çözünür:
2Na + 2H20 = 2NaOH + H2
2K + 2H20 = 2KOH + H2
Ca + 2H20 = Ca(OH)2 + H2
Hidrojenden magnezyuma (dahil) kadar voltaj aralığında bulunan metaller bazı durumlarda suyla etkileşime girer, ancak reaksiyonlar belirli koşullar gerektirir. Örneğin alüminyum ve magnezyum, H2O ile ancak oksit filmi metal yüzeyden çıkarıldıktan sonra etkileşime girmeye başlar. Demir oda sıcaklığında suyla reaksiyona girmez ancak su buharıyla reaksiyona girer. Kobalt, nikel, kalay ve kurşun pratikte H2O ile yalnızca oda sıcaklığında değil, aynı zamanda ısıtıldığında da etkileşime girmez.
ERN'nin sağ tarafında yer alan metaller (gümüş, altın, platin) hiçbir koşulda suyla reaksiyona girmez.
Metallerin sulu tuz çözeltileriyle etkileşimi
Aşağıdaki türdeki reaksiyonlardan bahsedeceğiz:
metal (*) + metal tuzu (**) = metal (**) + metal tuzu (*)
Bu durumda yıldız işaretlerinin metalin oksidasyon durumunu veya değerliliğini göstermediğini, sadece 1 numaralı metal ile 2 numaralı metal arasında ayrım yapılmasına izin verdiğini vurgulamak isterim.
Böyle bir reaksiyonu gerçekleştirmek için üç koşulun aynı anda karşılanması gerekir:
- sürece dahil olan tuzlar suda çözülmelidir (bu, çözünürlük tablosu kullanılarak kolayca kontrol edilebilir);
- metal (*), metalin (**) solundaki gerilim serisinde olmalıdır;
- metalin (*) suyla reaksiyona girmemesi gerekir (bu da ESI tarafından kolayca doğrulanır).
Örnek 4. Birkaç tepkiye bakalım:
Zn + CuS04 = ZnS04 + Cu
K + Ni(NO 3) 2 ≠
İlk reaksiyon kolayca uygulanabilir, yukarıdaki koşulların tümü karşılanır: bakır sülfat suda çözünür, çinko bakırın solundaki NER'de bulunur, Zn suyla reaksiyona girmez.
İkinci reaksiyon imkansızdır çünkü birinci koşul karşılanmamıştır (bakır (II) sülfit suda pratik olarak çözünmez). Üçüncü reaksiyon mümkün değildir, çünkü kurşun demirden daha az aktif bir metaldir (ESR'de sağda bulunur). Son olarak dördüncü işlem, potasyumun suyla reaksiyona girmesi nedeniyle nikel çökelmesine neden OLMAYACAKTIR; ortaya çıkan potasyum hidroksit tuz çözeltisiyle reaksiyona girebilir, ancak bu tamamen farklı bir işlemdir.
Nitratların termal ayrışma süreci
Nitratların nitrik asit tuzları olduğunu hatırlatmama izin verin. Tüm nitratlar ısıtıldığında ayrışır, ancak ayrışma ürünlerinin bileşimi değişebilir. Bileşim, metalin gerilim serisindeki konumuna göre belirlenir.
NER'de magnezyumun solunda bulunan metal nitratlar ısıtıldığında karşılık gelen nitrit ve oksijeni oluşturur:
2KNO3 = 2KNO2 + Ö2
Mg ila Cu dahil voltaj aralığında bulunan metal nitratların termal ayrışması sırasında metal oksit, NO2 ve oksijen oluşur:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Son olarak, en az aktif metallerin (ERN'de bakırın sağında bulunur) nitratlarının ayrışması sırasında metal, nitrojen dioksit ve oksijen oluşur.