Basit ve karmaşık maddeler. Kimyasal element
Atomlar ve kimyasal elementler hakkında
Kimyada “atom” ve “molekül” terimlerinin yanı sıra “element” kavramı da sıklıkla kullanılır. Bu kavramların ortak noktaları nelerdir ve aralarındaki farklar nelerdir?
Kimyasal element aynı türden atomlardır. Yani örneğin tüm hidrojen atomları hidrojen elementidir; tüm oksijen ve cıva atomları sırasıyla oksijen ve cıva elementleridir.
Şu anda 107'den fazla atom türü, yani 107'den fazla kimyasal element bilinmektedir. “Kimyasal element”, “atom” ve “basit madde” kavramlarını birbirinden ayırmak gerekir.
Basit ve karmaşık maddeler
Elementel bileşimlerine göre, bir elementin atomlarından (H2, O2,Cl2, P4, Na, Cu, Au) oluşan basit maddeler ile farklı elementlerin atomlarından (H2O, NH3, OF2, H2SO4) oluşan karmaşık maddeler arasında ayrım yaparlar. , MgCl2, K2SO4) .
Şu anda yaklaşık 500'ü oluşturan 115 kimyasal element bilinmektedir. basit maddeler.
Yerli altın basit bir maddedir.
Bir elementin özellikleri farklı olan çeşitli basit maddeler formunda var olma yeteneğine allotropi denir. Örneğin oksijen O elementinin iki allotropik formu vardır: dioksijen O2 ve ozon O3c farklı numara Moleküllerdeki atomlar.
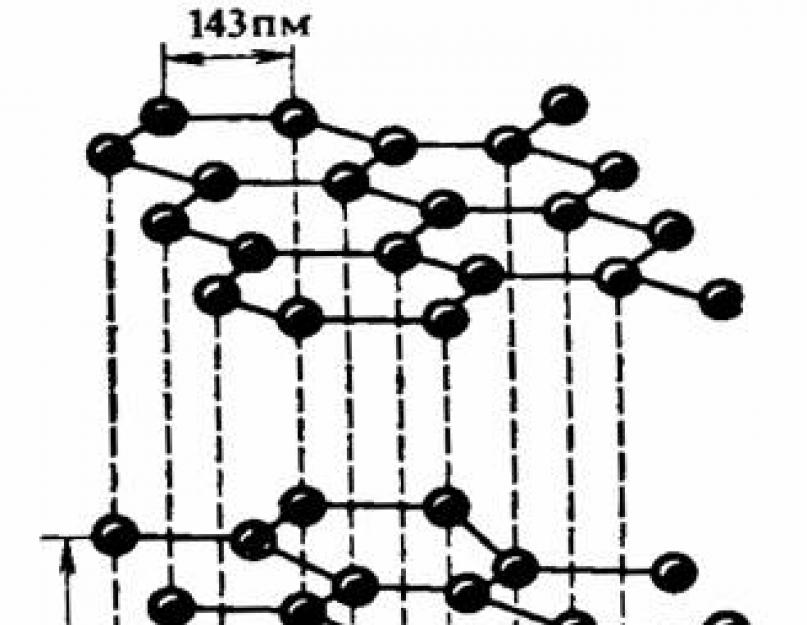
Karbon C elementinin allotropik formları - elmas ve grafit - kristallerinin yapısında farklılık gösterir. Allotropinin başka nedenleri de vardır.
Allotropik karbon formları:
grafit:


elmas:


Karmaşık maddelere genellikle kimyasal bileşikler denir, örneğin cıva(II) oksit HgO (basit maddelerin atomlarının birleştirilmesiyle elde edilir - cıva Hg ve oksijen O2), sodyum bromür (basit maddelerin atomlarının birleştirilmesiyle elde edilir - sodyum Na ve brom Br2) .
O halde yukarıdakileri özetleyelim. İki tür madde molekülü vardır:
1. Basit– Bu tür maddelerin molekülleri aynı türden atomlardan oluşur. İÇİNDE kimyasal reaksiyonlar daha basit birkaç madde oluşturacak şekilde ayrışamaz.
2.Karmaşık- bu tür maddelerin molekülleri atomlardan oluşur farklı türler. Kimyasal reaksiyonlarda daha basit maddeler oluşturmak üzere ayrışabilirler.
“Kimyasal element” ve “basit madde” kavramları arasındaki fark
“Kimyasal element” ve “basit madde” kavramları, basit ve basit maddelerin özellikleri karşılaştırılarak ayırt edilebilir. karmaşık maddeler. Örneğin basit bir madde olan oksijen, nefes almak ve yanmayı desteklemek için gerekli olan renksiz bir gazdır. Basit oksijen maddesinin en küçük parçacığı iki atomdan oluşan bir moleküldür. Oksijen ayrıca karbon monoksit (karbon monoksit) ve suya da dahildir. Ancak su ve karbon monoksit kimyasal olarak bağlı oksijen içerir ve bu oksijen özellikle basit bir maddenin özelliklerine sahip değildir, solunum için kullanılamaz; Örneğin balıklar, su molekülünün bir parçası olan kimyasal olarak bağlı oksijeni solumaz, ancak içinde çözünmüş serbest oksijeni solur. Peki ne zaman hakkında konuşuyoruz Herhangi bir kimyasal bileşiğin bileşimi hakkında, bu bileşiklerin basit maddeler değil, belirli bir türdeki atomları, yani karşılık gelen elementleri içerdiği anlaşılmalıdır.
Karmaşık maddeler ayrıştığında, atomlar serbest halde salınabilir ve birleşerek basit maddeler oluşturabilir. Basit maddeler bir elementin atomlarından oluşur. “Kimyasal element” ve “basit madde” kavramları arasındaki fark, aynı elementin birden fazla basit madde oluşturabilmesiyle de doğrulanmaktadır. Örneğin oksijen elementinin atomları diatomik oksijen molekülleri ve triatomik ozon molekülleri oluşturabilir. Oksijen ve ozon tamamen farklı basit maddelerdir. Bu, kimyasal elementlerden çok daha basit maddelerin bilindiği gerçeğini açıklıyor.
“Kimyasal element” kavramını kullanarak basit ve karmaşık maddelere şu tanımı verebiliriz:
Basit bir kimyasal elementin atomlarından oluşan maddelere denir.
Karmaşık farklı kimyasal elementlerin atomlarından oluşan maddelere denir.
“Karışım” ve “Kavramları arasındaki fark” kimyasal bileşik»
Karmaşık maddelere genellikle kimyasal bileşikler denir.
Bağlantıyı takip edin ve basit maddeler demir ve kükürtün etkileşimi deneyimini izleyin.
Soruları cevaplamaya çalışın:
1. Karışımlar bileşim açısından kimyasal bileşiklerden nasıl farklıdır?
2. Karışımların ve kimyasal bileşiklerin özelliklerini karşılaştırır mısınız?
3. Bir karışımın ve bir kimyasal bileşiğin bileşenlerini hangi yollarla ayırabilirsiniz?
4. Şuna göre yargılamak mümkün mü? dış işaretler bir karışımın ve kimyasal bir bileşiğin oluşumu hakkında?
Karışımların ve kimyasalların karşılaştırmalı özellikleri
bağlantılar
|
Karışımları kimyasal bileşiklerle eşleştirmeye yönelik sorular | Karşılaştırmak |
|
Karışımlar | Kimyasal bileşikler |
|
Karışımlar bileşim açısından kimyasal bileşiklerden nasıl farklıdır? | Maddeler herhangi bir oranda karıştırılabilir; karışımların değişken bileşimi | Kimyasal bileşiklerin bileşimi sabittir. |
Karışımların ve kimyasal bileşiklerin özelliklerini karşılaştırır mısınız? | Karışımdaki maddeler özelliklerini korur | Bileşik oluşturan maddeler, başka özelliklere sahip kimyasal bileşikler oluştuğundan özelliklerini korumazlar. |
Bir karışım ve bir kimyasal bileşik kendisini oluşturan bileşenlere hangi yollarla ayrılabilir? | Maddeler fiziksel yollarla ayrılabilir | Kimyasal bileşikler ancak kimyasal reaksiyonlarla parçalanabilir |
Bir karışımın ve kimyasal bir bileşiğin oluşumunu dış işaretlerle yargılamak mümkün müdür? | Mekanik karıştırmaya ısı açığa çıkması veya diğer kimyasal reaksiyon belirtileri eşlik etmez | Kimyasal bir bileşiğin oluşumu, kimyasal reaksiyonların belirtileriyle değerlendirilebilir. |
Konsolidasyon görevleri
I. Simülatörlerle çalışma
Simülatör No.1
Simülatör No.2
Simülatör No.3
II. Görevi çöz
Önerilen madde listesinden basit ve karmaşık maddeleri ayrı ayrı yazın:
NaCl, H2SO4, K, S8, CO2, O3, H3PO4, N2, Fe.
Her durumda seçiminizi açıklayın.
III. Soruları cevapla
№1
Bir dizi formülde kaç tane basit madde yazılmıştır:
H2O, N2, O3, HNO3, P2O5, S, Fe, CO2, KOH.
№2
Her iki madde de karmaşıktır:
A) C (kömür) ve S (kükürt);
B) CO2 (karbon dioksit) ve H2O (su);
B) Fe (demir) ve CH4 (metan);
D) H2SO4 (sülfürik asit) ve H2 (hidrojen).
№3
Doğru ifadeyi seçin:
Basit maddeler aynı cins atomlardan oluşur.
Doğru
B) Yanlış
№4
Karışımlar için tipik olan şey şudur:
A) Sabit bir bileşime sahiptirler;
B) “Karışım”daki maddeler bireysel özelliklerini korumaz;
C) “Karışımlardaki” maddeler fiziksel özelliklerine göre ayrılabilir;
D) “Karışımlardaki” maddeler kimyasal reaksiyon kullanılarak ayrılabilir.
№5
Aşağıdakiler “kimyasal bileşikler” için tipiktir:
A) Değişken bileşim;
B) “Kimyasal bileşik”in içerdiği maddeler fiziksel yollarla ayrılabilir;
C) Kimyasal bir bileşiğin oluşumu, kimyasal reaksiyonların belirtileriyle değerlendirilebilir;
D) Kalıcı kompozisyon.
№6
Hangi durumda kimyasal element olarak demirden bahsediyoruz?
A) Demir, mıknatıs tarafından çekilen bir metaldir;
B) Demir pasın bir parçasıdır;
C) Demir, metalik bir parlaklıkla karakterize edilir;
D) Demir sülfür bir demir atomu içerir.
№7
Hangi durumda basit bir madde olarak oksijenden bahsediyoruz?
A) Oksijen, solunumu ve yanmayı destekleyen bir gazdır;
B) Balıklar suda çözünmüş oksijeni solur;
C) Oksijen atomu su molekülünün bir parçasıdır;
D) Oksijen havanın bir parçasıdır.
Çevremizdeki dünya maddidir. Maddenin iki türü vardır: madde ve alan. Kimyanın amacı bir maddedir (çeşitli alanların madde üzerindeki etkisi dahil - ses, manyetik, elektromanyetik vb.)
Madde, hareketsiz kütlesi olan her şeydir (yani, hareket etmediğinde kütlenin varlığıyla karakterize edilir). Yani, bir elektronun geri kalan kütlesi (hareket etmeyen bir elektronun kütlesi) çok küçük olmasına rağmen - yaklaşık 10-27 g, ancak bir elektron bile maddedir.
Madde üç şekilde gelir toplanma durumları– gaz, sıvı ve katı. Maddenin başka bir durumu daha var - plazma (örneğin, gök gürültüsü ve şimşek çakması plazma içerir), ancak okul derslerinde plazmanın kimyası neredeyse hiç dikkate alınmaz. 
Maddeler saf, çok saf (örneğin fiber optik oluşturmak için gerekli) olabilir, gözle görülür miktarda yabancı madde içerebilir veya karışımlar olabilir.
Tüm maddeler atom adı verilen çok küçük parçacıklardan oluşur. Aynı cins atomlardan oluşan maddeler(bir elementin atomlarından), basit denir(örneğin kömür, oksijen, nitrojen, gümüş vb.). Farklı elementlerin birbirine bağlı atomlarını içeren maddelere karmaşık denir.
Bir madde (örneğin hava) iki veya daha büyük sayı basit maddeler ve atomları birbirine bağlı değilse, buna karmaşık madde değil, basit maddelerin karışımı denir. Basit maddelerin sayısı nispeten azdır (yaklaşık beş yüz), ancak karmaşık maddelerin sayısı çok fazladır. Bugüne kadar on milyonlarca farklı karmaşık madde bilinmektedir. 
Kimyasal dönüşümler
Maddeler birbirleriyle etkileşime girebilir ve yeni maddeler ortaya çıkar. Bu tür dönüşümlere denir kimyasal. Örneğin, basit bir madde olan kömür, başka bir basit madde olan oksijenle etkileşime girer (kimyacılar tepkimeye girdiğini söyler), bunun sonucunda karbon ve oksijen atomlarının birbirine bağlı olduğu karmaşık bir madde olan karbondioksit oluşur. Bir maddenin diğerine bu tür dönüşümlerine kimyasal denir. Kimyasal dönüşümler kimyasal reaksiyonlardır. Böylece, şeker havada ısıtıldığında, karmaşık bir tatlı madde olan sakkaroz (şekerin yapıldığı) basit bir maddeye - kömüre ve karmaşık bir madde - suya dönüşür.
Kimya bir maddenin diğerine dönüşümünü inceler. Kimyanın görevi, belirli bir maddenin belirli koşullar altında hangi maddelerle etkileşime girebileceğini (reaksiyona girebileceğini) ve neyin oluştuğunu bulmaktır. Ayrıca belirli bir dönüşümün hangi koşullar altında meydana gelebileceğini ve istenilen maddenin elde edilebileceğini bulmak da önemlidir.
Maddelerin fiziksel özellikleri
Her madde bir dizi fiziksel ve kimyasal özellikler. Fiziksel özellikler, fiziksel araçlar kullanılarak karakterize edilebilecek özelliklerdir.. Örneğin termometre kullanarak suyun erime ve kaynama noktalarını belirleyebilirsiniz. Bir maddenin iletkenlik yeteneğini karakterize etmek için fiziksel yöntemler kullanılabilir. elektrik akımı, bir maddenin yoğunluğunu, sertliğini vb. belirler. Fiziksel işlemler sırasında maddelerin bileşimi değişmeden kalır.
Maddelerin fiziksel özellikleri sayılabilir (belirli fiziksel araçlar kullanılarak sayıyla karakterize edilebilenler, örneğin yoğunluk, erime ve kaynama noktaları, sudaki çözünürlük vb. belirtilerek) ve sayısız (şu şekilde karakterize edilemeyenler) olarak ikiye ayrılır: sayı veya çok zor - renk, koku, tat vb. gibi).
Maddelerin kimyasal özellikleri
Bir maddenin kimyasal özellikleri, başka hangi maddelerin ve belirli bir maddenin hangi koşullar altında kimyasal etkileşimlere girdiği hakkında bir dizi bilgidir.. En önemli görev kimya - maddelerin kimyasal özelliklerinin belirlenmesi.
Kimyasal dönüşümler, maddelerin en küçük parçacıklarını (atomları) içerir. Kimyasal dönüşümler sırasında bazı maddelerden başka maddeler oluşur ve orijinal maddeler kaybolur, yerlerine yeni maddeler (reaksiyon ürünleri) oluşur. A atomlar herkes kimyasal dönüşümler korunur. Kimyasal dönüşümler sırasında yeniden düzenlenmeleri meydana gelir, atomlar arasındaki eski bağlar yok edilir ve yeni bağlar ortaya çıkar.
Kimyasal element
Farklı maddelerin sayısı çok fazladır (ve her birinin kendine özgü fiziksel ve kimyasal özellikleri vardır). Çevremizdeki maddi dünyada, en önemli özellikleri bakımından birbirinden farklı olan nispeten az sayıda atom vardır - yaklaşık yüz. Her atom tipinin kendine ait kimyasal elementi vardır. Kimyasal element aynı veya benzer özelliklere sahip atomların topluluğudur. Doğada yaklaşık 90 farklı kimyasal element bulunur. Bugüne kadar fizikçiler Dünya'da bulunmayan yeni atom türleri yaratmayı öğrendiler. Bu tür atomlara (ve buna göre bu tür kimyasal elementlere) yapay (İngilizce - insan yapımı elementler) denir. Bugüne kadar iki düzineden fazla yapay olarak elde edilen element sentezlendi.
Her elemanın Latince adı ve bir veya iki harfli bir karakter. Rusça kimya literatüründe, kimyasal elementlerin sembollerinin telaffuzuna ilişkin açık kurallar yoktur. Bazıları bunu şu şekilde telaffuz ediyor: elementi Rusça olarak adlandırıyorlar (sodyum, magnezyum vb. Sembolleri), diğerleri - göre Latin harfleri(karbon, fosfor, kükürt sembolleri), üçüncüsü - elementin adının Latince'deki sesi (demir, gümüş, altın, cıva). Genellikle hidrojen H elementinin sembolünü Fransızcada bu harfin okunduğu şekilde telaffuz ediyoruz.
Kimyasal elementlerin ve basit maddelerin en önemli özelliklerinin karşılaştırması aşağıdaki tabloda verilmiştir. Bir element birkaç basit maddeye (alotropi fenomeni: karbon, oksijen vb.) veya belki de sadece bir tanesine (argon ve diğer inert gazlar) karşılık gelebilir.

Kimya doğa bilimlerine aittir. Maddelerin bileşimini, yapısını, özelliklerini ve dönüşümlerini ve bu dönüşümlere eşlik eden olayları inceliyor.
Madde maddenin temel varoluş biçimlerinden biridir. Maddenin bir biçimi olarak madde, değişen karmaşıklık derecelerine sahip bireysel parçacıklardan oluşur ve sözde kendi kütlesine sahiptir.
dinlenme kütlesi.
Basit ve karmaşık maddeler. Allotropi.
Tüm maddeler ikiye ayrılabilir basit Ve karmaşık .
Basit maddeler bir kimyasal elementin atomlarından oluşur, karmaşık - çeşitli kimyasal elementlerin atomlarından.
Kimyasal element - bu aynı nükleer yüke sahip belirli bir atom türüdür. Buradan, atom bir kimyasal elementin en küçük parçacığıdır.
Konsept basit madde kavramıyla özdeşleştirilemez.
kimyasal element . Bir kimyasal element, atom çekirdeğinin belirli bir pozitif yükü, izotopik bileşimi ve kimyasal özellikleri ile karakterize edilir. Bir elementin özellikleri onun bireysel atomlarıyla ilgilidir. Basit bir madde belirli bir yoğunluk, çözünürlük, erime ve kaynama noktaları vb. ile karakterize edilir. Bu özellikler bir atom topluluğuyla ilgilidir ve farklı basit maddeler için farklıdır.
Basit madde - bu, kimyasal bir elementin serbest halde bulunma şeklidir. Birçok kimyasal element, yapı ve özellik bakımından farklılık gösteren birkaç basit madde oluşturur. Bu fenomene denir allotropi ve oluşturucu maddeler allotropik modifikasyonlar . Böylece, oksijen elementi iki allotropik modifikasyon oluşturur - oksijen ve ozon, karbon elementi - elmas, grafit, karbin, fulleren.
Allotropi fenomeni iki nedenden kaynaklanır: moleküldeki farklı sayıda atom (örneğin oksijen). HAKKINDA 2 ve azon HAKKINDA 3 ) veya çeşitli kristal formların oluşumu (örneğin, karbon aşağıdaki allotropik modifikasyonları oluşturur: elmas, grafit, karabina, fulleren), karabina 1968'de keşfedildi (A. Sladkov, Rusya) ve fulleren teorik olarak 1973'te keşfedildi (D) . Bochvar, Rusya) ve 1985'te - deneysel olarak (G. Kroto ve R. Smalley, ABD).
Karmaşık maddeler Basit maddelerden değil kimyasal elementlerden oluşurlar. Böylece suyun bir parçası olan hidrojen ve oksijen, karakteristik özellikleriyle gaz halindeki hidrojen ve oksijen formunda değil, formda bulunur. elemanlar - hidrojen ve oksijen.
Moleküler yapıya sahip maddelerin en küçük parçacığı, belirli bir maddenin kimyasal özelliklerini koruyan bir moleküldür. Modern kavramlara göre moleküller esas olarak sıvı ve gaz halindeki maddelerden oluşur. Çoğu katı (çoğunlukla inorganik) moleküllerden değil, diğer parçacıklardan (iyonlar, atomlar) oluşur. Tuzlar, metal oksitler, elmas, metaller vb. moleküler bir yapıya sahip değildir.
Bağıl atom kütlesi
Modern araştırma yöntemleri, son derece küçük atom kütlelerinin daha yüksek doğrulukla belirlenmesini mümkün kılar. Örneğin bir hidrojen atomunun kütlesi 1,674 10 -27 kg, karbon – 1,993 10 -26 kilogram.
Kimyada geleneksel olarak atom kütlelerinin mutlak değerleri değil, göreceli değerleri kullanılır. 1961'de birim başına atom kütlesi kabul edildi atomik kütle birimi (am olarak kısaltılır), yani 1/12 bir karbon izotop atomunun kütlesinin bir kısmı 12 İLE.
Çoğu kimyasal elementin farklı kütlelere (izotoplara) sahip atomları vardır. Bu yüzden bağıl atom kütlesi (veya sadece atom kütlesi) A R Bir kimyasal elementin değeri, elementin bir atomunun ortalama kütlesinin oranına eşit bir değerdir. 1/12 karbon atomu kütlesi 12 İLE.
Elementlerin atom kütleleri şu şekilde gösterilir: A R, nerede dizin R– ilk harf İngilizce kelime akraba - akraba. Gönderiler A R (H), bir R (O) A R (C) ortalama: hidrojenin bağıl atom kütlesi, oksijenin bağıl atom kütlesi, karbonun bağıl atom kütlesi.
Bağıl atom kütlesi, bir kimyasal elementin temel özelliklerinden biridir.
Basit bir madde, bir kimyasal elementin serbest formdaki varoluş şeklidir. İçerdiği elementlerin büyük çoğunluğu doğal nesneler, basit maddeler şeklinde izole edilmiştir. Nükleer reaksiyonlar kullanılarak sentezlenen birçok element (teknetyum, prometyum, neptunyum, plütonyum, amerikyum, küriyum, berkelyum, kaliforniyum) bile metalik formda elde edildi.
Bilim adamları uzun zamandır elementlerle basit maddeler arasında net bir ayrım yapamadı. Bu fark ilk kez, "basit cisimlerin yalnızca bir element içeren maddeler olduğunu" ve periyodik sistemin basit maddelere değil, özellikle elementlere atıfta bulunduğunu belirten D.I. Mendeleev tarafından tam bir kesinlikle belirlendi.
Basit maddelerin sayısı, bilinen kimyasal elementlerin sayısını önemli ölçüde aşmaktadır (şu anda 400'den fazla basit madde bilinmektedir). Birçok element, allotropik modifikasyonlar adı verilen birkaç basit maddeyi oluşturur (bkz. Allotropi). Örneğin, serbest karbonun üç modifikasyonu vardır: elmas, grafit, karabina.
Şu tarihte: normal koşullar en basit maddeler - katılar. Hidrojen, helyum, nitrojen, oksijen (ve allotropik modifikasyonu - ozon), flor, neon, klor, argon, kripton, ksenon ve radon gazlardır. Ve normal koşullar altında yalnızca iki element - brom ve cıva - sıvı basit maddeler formunda bulunur.
Basit maddelerin metallere ve ametallere (veya metaloidlere) bölünmesi, fiziksel ve kimyasal özelliklerinin özelliklerine dayanmaktadır. Çok daha fazla metal var. Bakış açısından elektronik konfigürasyonlar Metalik elementler, atomlardaki s-, d- veya f-alt kabukları elektronlarla doldurulmuş olanların tümünü içerir. (Tek istisna hidrojen ve helyumdur). Metaller ayrıca bazı p-elementlerini (alüminyum, galyum, indiyum, talyum, kalay, kurşun, bizmut, polonyum) içerir; diğer tüm p-elementleri metal değildir veya zayıf derecede metalik özellikler gösterir (antimon, iyot, astatin).
Kimyasal açıdan bakıldığında, metaller ve ametaller arasında net bir sınır çizmek imkansızdır, çünkü bileşikleri belirgin amfoterik özelliklere, yani hem metallerin hem de ametallerin özelliklerine sahip olan birkaç metal vardır (bkz. Amfoterlik). Fizikçiler metalleri, iyi termal ve elektriksel iletkenlik ve karakteristik metalik parlaklık ile karakterize edilen maddeler olarak kabul ederler (her ne kadar bu özellikler bazı metal olmayanlarda da mevcut olsa da). çok yüksek tansiyon Görünüşe göre tüm metal olmayanlar metalik duruma dönüştürülebilir.
Elementlerin fiziksel özellikleri olarak adlandırılan özellikler, büyük ölçüde karşılık gelen basit maddelerin özellikleridir ve bu özellikler, özellikle metaller için çok çeşitlidir. Yoğunluktan bahsedecek olursak en hafif metal lityum (0,53 g/cm3), en ağır metal ise osmiyumdur (22,6 g/cm3). Civa en kolay eriyendir (-38,9° C), tungsten ise en zor eriyendir (3410° C).
En düşük kaynama noktası cıvanın karakteristiğidir (357,25°C), en yüksek kaynama noktası ise tungsten içindir (5700°C).
Basit maddelerin özellikleri şunlara bağlıdır: seri numaraları içindeki elementler periyodik tablo. Ancak bu bağımlılık oldukça karmaşıktır ve her zaman doğrusal değildir. Örneğin, basit maddelerin erime sıcaklıklarının atom numarasına (nükleer yük Z) bağlı olduğunu düşünün. Elementler sisteminin her periyodunu başlatan element, erime noktası düşük olan basit bir maddedir (alkali metaller). Z arttıkça erime sıcaklığı artar, bir veya daha fazla maksimumdan geçer ve dönem sonlarında minimuma ulaşır (inert gazlar). Küçük dönemlerde (ikinci ve üçüncü) en yüksek puanlar erime karbon ve silikonda (alt grup IVa'nın elemanları), büyüklerde (dördüncü - altıncı) - krom, molibden ve tungstende (alt grup VIb'nin elemanları) meydana gelir. Böylece basit maddelerin erime sıcaklığı eğrisi de periyodik bir karakter sergiler.
Basit maddelerin özelliklerinin atom numarasına periyodik bağımlılığının iyi bir örneği, şekilde gösterilen atom hacimlerinin eğrisidir (atom hacmi, atom kütlesinin yoğunluğa bölümüdür). Maksimum değerler atom hacimleri - y alkali metaller minimumlar ise periyotların ortasında yer alan elementlerde meydana gelir. Atomik hacim eğrisi ilk olarak 1870 yılında Alman bilim adamı L. Meyer tarafından önerildi.
§ 9. Basit ve karmaşık maddeler
Bu konuya hakim olduğunuzda şunları yapabileceksiniz:
“Basit madde” ve “karmaşık madde” kavramlarını, basit ve karmaşık maddelerin formüllerini ayırt eder;
“Kimyasal bileşik” kavramını anlayın;
Basit ve karmaşık maddelere örnekler verin;
Günlük kullanımdan bildiğiniz basit ve karmaşık maddeleri tanımlayın;
Çeşitli maddeler hakkında yargılarda bulunun.
Kimyasal elementlerin çoğu atomu birbirleriyle veya diğer kimyasal elementlerin atomlarıyla birleşme yeteneğine sahiptir. Bunun sonucunda kimyasal bileşikler oluşur. Yapısal parçacıklarının bileşimi ne olursa olsun, hem basit hem de karmaşık maddeler aralarında kimyasal bağlar oluştuğu için kimyasal bileşiklerdir.
Kimyasal elementlerin atomlarının yapısına zaten aşina oldunuz. Bileşenleri atom olan maddelere atom denir.
Bununla birlikte, tüm kimyasal bileşiklerin çeşitliliği arasında moleküler maddeler de vardır. Onları oluşturan parçalar moleküllerdir.
Moleküller, bir maddenin kimyasal özelliklerini koruyan en küçük parçacıklarıdır.
Bir molekül, bir maddenin bölünebilme sınırı olarak kabul edilir. Eğer yok edilirse, o zaman madde yok olur. Karakteristik özellik Moleküller sürekli hareket halindedir.
Doğa tarihi dersinizden, yayılma olarak adlandırılan olguyu hatırlayın.
Her molekül, bir veya farklı kimyasal elementlerin belirli sayıda atomundan oluşur.
Doğa tarihi dersinizden maddelerin bileşimlerine ve kökenlerine göre nasıl bölündüğünü hatırlayın.
Hangi maddelere denir: a) basit; b) zor mu? Günlük yaşamda en sık kullandığınız basit ve karmaşık maddelere bazı örnekler verin.
Basit maddeler, bir kimyasal elementin oluşturduğu maddelerdir.
Örneğin basit maddeler hidrojen, oksijen, nitrojen, Hidrojen, Oksijen, Azot kimyasal elementlerine göre oluşur. Molekülleri bu elementlerin birbirine bağlı iki atomunu içerir (Şekil 41 a, 6, c).
Oksijen elementi, belirli koşullar altında, molekülü üç atom içeren başka bir basit madde olan ozon oluşturur (Şekil 41 d).
Pirinç. 41. Basit maddelerin moleküllerinin modelleri: a - hidrojen; b - oksijen; c - ozon; g - nitrojen
Kompleks maddeler iki veya daha fazla kimyasal elementin oluşturduğu maddelerdir.
Kompleks maddeler arasında; su, şeker, sabun, sofra tuzu, tebeşir, metan (bileşen) doğal gaz), karbondioksit. Canlı organizmaların hücrelerini oluşturan maddeler (proteinler, yağlar ve karbonhidratlar) karmaşıktır ve esas olarak Karbon, Oksijen, Hidrojen, Azot, Kükürt, Fosfor atomlarını içerir ve moleküler bir yapıya sahiptir.
Suyun karmaşık bir madde olduğunu nasıl kanıtlayacağınızı unutmayın. Bilim adamları suyun bileşimini belirlemek için hangi araştırma yöntemlerini kullandılar?
Şekil 42 metan, karbondioksit ve su moleküllerinin modellerini göstermektedir. Bir metan molekülü, bir Karbon atomu ve dört Hidrojen atomundan, bir Karbon atomu ve iki Oksijen atomundan oluşan bir karbondioksit molekülünden, bir Oksijen atomundan ve iki Hidrojen atomundan oluşan bir su molekülünden oluşur.

Pirinç. 42. Karmaşık maddelerin moleküllerinin modelleri: a - metan; b - karbondioksit; c - su
Yani maddeler bileşimlerine göre basit ve karmaşık olarak sınıflandırılır. Maddelerin sınıflandırma şeması Şekil 43'te gösterilmektedir.

Pirinç. 43. Maddelerin sınıflandırılması
Basit maddeler: metaller ve metal olmayanlar. Basit maddeler iki gruba ayrılır. Metalik elementler metalleri, metalik olmayan elementler ametalleri oluşturur. Fiziksel özellikleriyle ayırt edilirler.
Zaten aşina olduğunuz maddelerin hangi fiziksel özelliklerine sahip olduğunuzu hatırlayın. Onlara isim verin.
Gösterilere dönelim ve basit metal ve metal olmayan madde örneklerine bakalım. Teknolojide, çeşitli endüstrilerde ve günlük yaşamda en yaygın olan metaller arasında demir, çinko, alüminyum, bakır, gümüş, altın; Laboratuvardaki metal olmayanlar arasında kükürt, karbon, kırmızı fosfor, brom ve iyot bulunur.
Metallerin ve metal olmayanların toplanma durumuna dikkat edin. Bromun neden kapalı ampullerde saklandığını düşünüyorsunuz?
Basit maddelerin metallere ve metal olmayanlara bölünmesi, bunların temeline dayanır. fiziksel özellikler(Tablo 2).
Tablo 2
Basit maddelerin fiziksel özellikleri
Ametaller çoğunlukla moleküllerden oluşan maddelerdir. Birçoğunun molekülleri diyatomiktir. Bununla birlikte, çok atomlu moleküller de vardır: daha önce bahsedilen ozon, kristal kükürt - sekiz Kükürt atomu içerir, beyaz fosfor- bu elementin dört atomu. Karbon elementinin oluşturduğu basit maddelerde atomlar molekül oluşturmadan belli bir düzende birleşirler.
Metaller karşılık gelen elementlerin atomlarından oluşur. Metallerin isimleri genellikle onları oluşturan metalik elementlerin isimleriyle örtüşmektedir. Örneğin maddeler alüminyum, çinko, nikel, krom, magnezyuma karşılık gelen kimyasal elementlerden oluşur. Bununla birlikte, bakır maddesi Cuprum, gümüş - Argentum, altın - Aurum, cıva - Cıva, demir - Demir elementinin atomlarından oluşur. Az sayıda madde için ametallerin, elementlerin ve basit maddelerin adları örtüşmektedir (Tablo 3).
Tablo C
Kimyasal elementlerin ve basit maddelerin adları
|
maden |
metalik olmayan |
||
|
Kimyasal element |
Basit madde |
Kimyasal element |
Basit madde |
|
Alüminyum |
alüminyum |
||
|
Arjantin |
|||
|
Merkür |
oksijen |
||
Laboratuvar deneyimi 2
Basit ve karmaşık madde örneklerine aşinalık
Görev 1. Bankalarda size verilen maddelere dikkatlice bakın. Etiketleri okuyun: H 2 O (su), S (sülfür), P (fosfor), Mg (magnezyum), NaOH (sodyum hidroksit), C (karbon), Fe 3 O 4 (ferum (II, III) oksit) , Fe (demir), ZnO (çinko oksit), CaCO3 (kalsiyum karbonat), Al (alüminyum), Zn (çinko), CaO (kalsiyum oksit), Na2C03 (sodyum karbonat).
Bu maddeleri iki gruba ayırın: basit ve karmaşık. Maddeleri metaller ve metal olmayanlar olarak basit bir şekilde sınıflandırın.
Görev 2. Aşağıdakileri açıklayın: a) basit ve karmaşık maddelerin bileşim açısından ne kadar farklı olduğu; 6) Sınıflandırmayı yaparken hangi kriterleri kullandınız?
Görev 3. Gözlemlerinize dayanarak maddelerin fiziksel özelliklerini tanımlayın.
Görevi tamamladıktan sonra çalışma kitabınızdaki verileri tablo şeklinde yazın. Çalışmanın sonunda sonuçları formüle edin.
|
maddeler |
maddeler |
Gözlemlere dayalı özelliklerin açıklaması |
|
|
Ametaller |
|||
Çeşitli maddeler. Maddelerin çeşitliliği, elementlerin atomlarının birbirleriyle birleşme yeteneği ile açıklanmaktadır. Hangi atomların, hangi miktarda ve nasıl birleştiklerine bağlı olarak birçok basit ve karmaşık madde oluşur (Şekil 44).

Pirinç. 44. Basit madde kükürt (a) ve karmaşık madde ametist (b)
Kimyasal elementlerden biraz daha basit maddeler vardır - 400, çünkü zaten bildiğiniz gibi aynı element (Oksijen, Karbon, Fosfor, Kükürt) iki veya daha fazla madde oluşturabilir.
Çok daha karmaşık maddeler bilinmektedir (neredeyse 20 milyon). Bu, molekülü Hidrojen ve Oksijen, karbondioksit - Karbon ve Oksijen, sofra tuzu - Sodyum ve Klor içeren sudur. Bu maddelerin bileşimi yalnızca iki element içerir - bunlar ikili bileşiklerdir. Ancak maddelerin önemli bir kısmı üç veya daha fazla elementten oluşur. Böylece glikoz üç element içerir: Karbon, Hidrojen ve Oksijen ve karbonat dört element içerir: Sodyum, Hidrojen, Karbon ve Oksijen.
Hepsi karmaşık kabul edilir organik madde. Ek olarak, büyük endüstriyel ve evsel amaçlara sahip olan sentetik ve yapay bileşiklerin çıkarılmasına yönelik bir endüstri de bulunmaktadır.
Doğa tarihi dersinizden hangi maddelerin inorganik ve organik olarak adlandırıldığını hatırlayın. İnorganik ve organik bileşiklere örnekler veriniz.
Şu tarihte: normal koşullar(sıcaklık 0 °C, basınç 101,3 kPa) maddeler üç toplanma halindedir: sıvı (su, yağ, alkol), katı (çinko, demir, kükürt, fosfor, karbon, bakır) ve gaz halinde (hidrojen, oksijen, ozon, nitrojen, karbondioksit, inert gazlar).
ÖĞRENDİKLERİMİZİ ÖZETLEYELİM
Maddeler basit ve karmaşık olarak ikiye ayrılır.
Karmaşık maddeler iki veya daha fazla kimyasal elementten oluşur. Basit olanlardan çok daha fazlası var.
Her basit ve karmaşık madde belirli özelliklerle, yani benzerliklerinin ve farklılıklarının tanımlanabileceği işaretlerle karakterize edilir.
Karmaşık maddeler organik ve inorganik kökenlidir.
Maddelerin çeşitliliği, elementlerin atomlarının birbirleriyle birleşme yeteneği ile açıklanmaktadır.
BİLGİYİ KONTROL ETME GÖREVLERİ
1. “Molekül”, “basit madde”, “karmaşık madde”, “kimyasal bileşik” kavramlarının ne anlama geldiğini açıklayınız.
2. Örnekler verin: a) basit ve karmaşık maddeler; b) organik ve inorganik maddeler.
3. “Kimyasal bileşik” ve “maddelerin karışımı” kavramlarının aynı olup olmadığını gerekçelendirin.
4. Aşağıdakilerin fiziksel özelliklerini tanımlayın: a) şeker; b) su; c) yağlar.
5. Neden basit maddelerden daha karmaşık maddelerin bulunduğunu gerekçelendirin.
6. Maddelerin insan yaşamı ve sağlığı açısından önemi konusunda kendi düşüncenizi ifade edin.
BİLMEK İLGİNÇ
İngiliz kimyager G. Davy, elektroliz yoluyla sodyum, potasyum, kalsiyum, stronsiyum, baryum ve magnezyum metallerini serbest halde izole eden ilk kişiydi. Bu çalışmalar, projektörler, deniz fenerleri vb. için güçlü lambaların üretiminin başlangıcını işaret ediyordu. Daha sonra bilim adamı, pille çalışan bir lambayla değiştirilene kadar tüm dünyada kullanılan güvenli bir madenci lambası yarattı.
Maria Sklodowska-Curie (1867-1934) - Fransız fizikçi ve kimyager, öğretmen, halk figürü. Bilim ona iki radyoaktif elementin (Polonyum ve Radyum) keşfini ve çalışmasını borçludur. Radyum elementinin keşfi cilt kanserini tedavi etmek için bir yöntem başlattı. Çalışmalarından dolayı kendisine iki ödül verildi Nobel Ödülleri Zakopane'de bir sanatoryum ve Varşova'daki (Polonya) Radyoloji Enstitüsü'nün inşası için bağışladığı.