> Evrende kaç atom var?
Anlamak evrende kaç atom var: nasıl hesaplandığı, görünen Evrenin büyüklüğü, fotoğraflarla doğum ve gelişim tarihi, yıldız sayısı, kütle, araştırma.
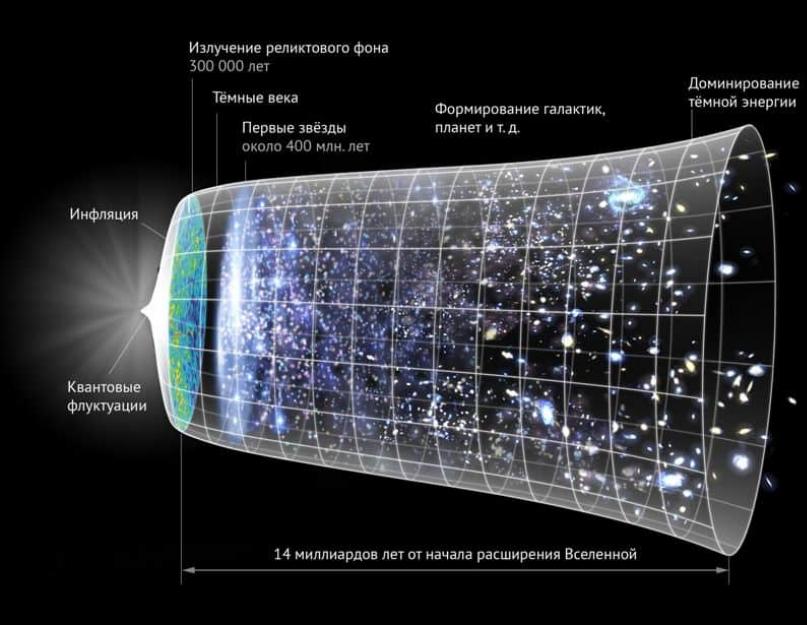
Elbette herkes Evrenin büyük ölçekli bir yer olduğunu biliyor. İle genel değerlendirmeler, önümüzde sadece 93 milyar ışıkyılı açık (“Görünür Evren”). Bu çok büyük bir rakam, özellikle bunun sadece cihazlarımızın erişebildiği kısım olduğunu unutmazsak. Ve bu kadar hacim göz önüne alındığında, madde miktarının da önemli olması gerektiğini varsaymak garip olmaz.
Konuyu küçük ölçekte incelemeye başlamak ilginç. Sonuçta, Evrenimiz 120-300 sekstilyon yıldız (1,2 veya 3 x 10 23) içeriyor. Her şeyi atom seviyesine çıkarırsak, bu sayılar düşünülemez görünüyor. Evrende kaç atom var?
Hesaplamalara göre Evrenin 10 78 -10 82 atomla dolu olduğu ortaya çıktı. Ancak bu göstergeler bile ne kadar madde içerdiğini tam olarak yansıtmıyor. Yukarıda 46 milyar ışık yılını herhangi bir yönde kavrayabildiğimizden, yani resmin tamamını göremediğimizden bahsetmiştik. Ayrıca Evren sürekli genişliyor ve bu da nesneleri bizden uzaklaştırıyor.
Kısa bir süre önce bir Alman süper bilgisayarı, görünürde 500 milyar galaksinin bulunduğunu gösteren bir sonuç üretti. Muhafazakâr kaynaklara yönelirsek 300 milyar elde ederiz. Bir galakside 400 milyar yıldız barındırabilir, dolayısıyla Evrendeki toplam sayı 1,2 x 10 23 - 100 sekstilyona ulaşabilir.
Bir yıldızın ortalama ağırlığı 10 35 gramdır. Toplam ağırlık – 10 58 gram. Hesaplamalar, her gramın 10 24 proton veya aynı sayıda hidrojen atomu (bir hidrojen bir proton içerir) içerdiğini göstermektedir. Toplamda 10 82 hidrojen elde ediyoruz.
Bu miktarın eşit olarak dağıtılması gereken (300 milyon ışıkyılı üzerinde) görünür Evreni temel alıyoruz. Ancak daha küçük ölçekte madde, hepimizin bildiği parlak madde yığınları yaratacaktır.
Özetlemek gerekirse, Evrendeki atomların çoğu, galaksileri oluşturan yıldızlarda yoğunlaşmıştır, bunlar kümeler halinde birleşerek üstkümeleri oluşturur ve tüm bunları oluşumla tamamlar. Çin Seddi. Bu büyütme ile. Eğer gidersen ters taraf ve daha küçük ölçekte kümeler toz, gaz ve diğer maddeleri içeren bulutlarla doludur.

Madde izotropik olarak yayılma eğilimindedir. Yani bütün gök alanları aynıdır ve her biri aynı miktarı içerir. Uzay, 2,725 K'ye (mutlak sıfırın biraz üzerinde) eşit olan güçlü bir izotropik radyasyon dalgasına doymuştur.
Homojen bir Evrenden bahsediyor kozmolojik prensip. Buradan hareketle fizik yasalarının Evrenin her yerinde eşit derecede geçerli olacağı ve büyük ölçekte ihlal edilmemesi gerektiği ileri sürülebilir. Bu fikir aynı zamanda evrensel yapının evrimini gösteren gözlemlerle de desteklenmektedir. Büyük patlama.
Araştırmacılar maddenin çoğunun Büyük Patlama sırasında yaratıldığı ve genişlemenin yeni madde eklemediği konusunda hemfikir. Son 13,7 milyar yılın mekanizmaları ana kütlelerin genişlemesi ve dağılmasıdır.
Ancak teori, Einstein'ın kütlesinin ve enerjisinin eşitliği nedeniyle karmaşıklaşıyor. genel teori görelilik (kütle eklenmesi enerji miktarını kademeli olarak artırır).

Ancak Evrenin yoğunluğu sabit kalır. Modern, cm3 başına 9,9 x 10 30 grama ulaşır. Karanlık enerjinin %68,3'ü, karanlık maddenin %26,8'i ve ışıklı maddenin %4,9'u burada yoğunlaşmıştır. Yoğunluğun 4 m3 başına bir hidrojen atomu olduğu ortaya çıktı.
Bilim adamları hala özellikleri çözemedikleri için bunların eşit şekilde mi dağıldığını yoksa yoğun kümeler mi oluşturduğunu kesin olarak söylemek mümkün değil. Ancak karanlık maddenin genişlemeyi yavaşlattığına, ancak karanlık enerjinin onu hızlandırdığına inanılıyor.
Evrendeki atom sayısına ilişkin verilen sayıların tamamı şunlardır: kaba tahmin. unutma ana fikir: Görünen evrenin hesaplamalarından bahsediyoruz.
En düşük enerjiye sahip bir durumu arzulamak maddenin genel bir özelliğidir. Muhtemelen dağı biliyorsundur kar çığları ve kaya düşmeleri. Enerjileri o kadar büyüktür ki köprüleri, evleri ve diğer büyük ve dayanıklı yapıları silip süpürebilir. Bu korkunç doğal olgunun nedeni, kar veya taş kütlesinin en düşük enerjiye sahip durumu işgal etme eğiliminde olması ve dağın eteğindeki fiziksel bedenin potansiyel enerjisinin, yokuş veya zirveye göre daha az olmasıdır.
Atomlar aynı sebepten dolayı birbirleriyle bağ kurarlar: Bağlı atomların toplam enerjisi, aynı atomların serbest durumdaki enerjisinden daha azdır. Bu sizin ve benim için çok mutlu bir durum - sonuçta, atomları moleküller halinde birleştirirken enerjide bir kazanç olmasaydı, o zaman Evren yalnızca elementlerin atomlarıyla doldurulacaktı ve basit ve karmaşık moleküllerin ortaya çıkması için gerekliydi. yaşamın varlığı imkansız olurdu.
Ancak atomlar rastgele bir şekilde birbirlerine bağlanamazlar. Her atom belirli sayıda başka atomla bağlanma yeteneğine sahiptir ve bağlı atomlar uzayda kesin olarak tanımlanmış bir şekilde konumlandırılmıştır. Bu sınırlamaların nedeni atomların elektron kabuklarının özelliklerinde veya daha doğrusu özelliklerinde aranmalıdır. harici Atomların birbirleriyle etkileşime girdiği elektron kabukları.
Tamamlanmış dış elektron kabuğu, tamamlanmamış olandan daha az (yani atom için daha uygun) enerjiye sahiptir. Oktet kuralına göre tamamlanmış bir kabuk 8 elektron içerir:

Bunlar helyum hariç soy gaz atomlarının dış elektron kabuklarıdır (n = 1) kabuğunun tamamı iki s elektronundan (1s) oluşan 2 ) basitçe çünkü P - 1. seviyede alt seviye yoktur.
Soy gazlar hariç tüm elementlerin dış kabukları TAMAMLANMAMIŞTIR ve kimyasal etkileşim sürecinde mümkün olduğunca TAMAMLANMIŞTIR.
Böyle bir "tamamlanma"nın gerçekleşebilmesi için atomların ya elektronları birbirlerine aktarmaları ya da ortak kullanıma sunmaları gerekir. Bu, atomları birbirine yakın olmaya zorlar, yani. kimyasal bir bağla bağlanır.
Kimyasal bağ türlerini ifade eden birkaç terim vardır: kovalent, polar kovalent, iyonik, metalik, donör-alıcı, hidrojen ve diğerleri. Ancak göreceğimiz gibi madde parçacıklarını birbirine bağlamanın tüm yöntemleri genel doğa kişinin kendi elektronlarını bağışlamasıdır ortak kullanım(daha doğrusu - sosyalleşme genellikle elektron geçişleri sırasında ortaya çıkan farklı yükler arasındaki elektrostatik etkileşimle desteklenir. Bazen bireysel parçacıklar arasındaki çekim kuvvetleri tamamen elektrostatik olabilir. Bu sadece iyonlar arasındaki çekim değil aynı zamanda çeşitli moleküller arası etkileşimlerdir.
Kimya, maddelerin ve onların birbirlerine dönüşümlerinin bilimidir.
Maddeler kimyasal olarak saf maddelerdir
Kimyasal olarak saf bir madde, aynı niteliksel ve niceliksel bileşime ve aynı yapıya sahip moleküllerin topluluğudur.
CH3 -O-CH3 -
CH3-CH2-OH
Molekül - bir maddenin tüm kimyasal özelliklerine sahip en küçük parçacıkları; bir molekül atomlardan oluşur.
Atom, moleküllerin oluşturulduğu, kimyasal olarak bölünemeyen bir parçacıktır. (soylu gazlar için molekül ve atom aynıdır, He, Ar)
Bir atom, etrafında negatif yüklü elektronların kesin olarak tanımlanmış yasalara göre dağıtıldığı pozitif yüklü bir çekirdekten oluşan elektriksel olarak nötr bir parçacıktır. Ayrıca elektronların toplam yükü çekirdeğin yüküne eşittir.
Bir atomun çekirdeği, herhangi bir yük taşımayan pozitif yüklü protonlardan (p) ve nötronlardan (n) oluşur. Nötron ve protonların ortak adı nükleonlardır. Proton ve nötronların kütleleri hemen hemen aynıdır.
Elektronlar (e -), bir protonun yüküne eşit bir negatif yük taşırlar. E'nin kütlesi proton ve nötronun kütlesinin yaklaşık %0,05'idir. Böylece bir atomun tüm kütlesi çekirdeğinde yoğunlaşmıştır.
Bir atomdaki çekirdeğin yüküne eşit olan p sayısına seri numarası (Z) denir, çünkü atom elektriksel olarak nötrdür; e sayısı p sayısına eşittir.
Bir atomun kütle numarası (A), çekirdekteki proton ve nötronların toplamıdır. Buna göre bir atomdaki nötron sayısı A ile Z arasındaki farka (atomun kütle numarası ve atom numarası (N=A-Z)) eşittir.
17 35 Cl р=17, N=18, Z=17. 17р + , 18n 0 , 17е - .
Nükleonlar
Atomların kimyasal özellikleri, elektronik yapılarıyla (elektron sayısı) belirlenir. seri numarası atomlar (nükleer yük). Bu nedenle aynı nükleer yüke sahip tüm atomlar kimyasal olarak aynı davranır ve aynı yüke sahip atomlar olarak hesaplanır. kimyasal element.
Kimyasal element, aynı nükleer yüke sahip atomların topluluğudur. (110 kimyasal element).
Aynı nükleer yüke sahip olan atomlar, çekirdeklerindeki farklı sayıda nötronla ilişkili kütle numarası bakımından farklılık gösterebilir.
Z'leri aynı fakat kütle numaraları farklı olan atomlara izotop denir.
17 35 Cl 17 37 Cl
Hidrojen H izotopları:
Tanım: 1 1 N 1 2 D 1 3 T
Adı: protium döteryum trityum
Çekirdek bileşimi: 1р 1р+1n 1р+2n
Protium ve döteryum kararlıdır
Trityum bozunmaları (radyoaktif) Hidrojen bombalarında kullanılır.
Atomik kütle birimi. Avogadro'nun numarası. Mol.
Atomların ve moleküllerin kütleleri çok küçüktür (yaklaşık 10 -28 ila 10 -24 g); bu kütleleri pratik olarak görüntülemek için, uygun ve tanıdık bir ölçeğe yol açacak şekilde kendi ölçüm biriminizi girmeniz önerilir.
Bir atomun kütlesi, neredeyse eşit kütleye sahip proton ve nötronlardan oluşan çekirdeğinde yoğunlaştığından, bir nükleonun kütlesini atom kütlesinin bir birimi olarak almak mantıklıdır.
Atom ve moleküllerin kütle birimi olarak simetrik nükleer yapıya sahip (6p+6n) karbon izotopunun on ikide birini almayı kabul ettik. Bu birime atom kütle birimi (amu) denir ve sayısal olarak bir nükleonun kütlesine eşittir. Bu ölçekte atomların kütleleri tam sayı değerlerine yakındır: He-4; Al-27; Ra-226 sabah……
1 amu'nun kütlesini gram cinsinden hesaplayalım.
1/12 (12°C) ![]() = =1,66*10 -24 g/a.u.m
= =1,66*10 -24 g/a.u.m
1g'de kaç amu bulunduğunu hesaplayalım.
N A = 6,02 *-Avogadro sayısı
Ortaya çıkan orana Avogadro sayısı denir ve 1g'de kaç amu bulunduğunu gösterir.
Periyodik Tabloda verilen atom kütleleri amu cinsinden ifade edilir.
Moleküler kütle, bir molekülün amu cinsinden ifade edilen kütlesidir ve belirli bir molekülü oluşturan tüm atomların kütlelerinin toplamı olarak bulunur.
m(1 molekül H2S04)= 1*2+32*1+16*4= 98 a.u.
Kimyada pratik olarak kullanılan amu'dan 1 g'a geçmek için, her bir bölüm yapısal birimlerin (atomlar, moleküller, iyonlar, elektronlar) N A sayısını içeren bir madde miktarının bölüm hesaplaması tanıtıldı. Bu durumda 1 mol olarak adlandırılan böyle bir kısmın gram cinsinden kütlesi sayısal olarak amu cinsinden ifade edilen atomik veya moleküler kütleye eşittir.
1 mol H 2 SO 4'ün kütlesini bulalım:
M(1 mol H2S04)=
98a.u.m*1.66**6.02*=
Görüldüğü gibi moleküler ve molar kütle sayısal olarak eşittir.
1 mol– Avogadro sayısı kadar yapısal birim (atomlar, moleküller, iyonlar) içeren bir maddenin miktarı.
Molekül ağırlığı(M)- 1 mol maddenin kütlesi, gram cinsinden ifade edilir.
Madde miktarı - V (mol); maddenin kütlesi m(g); molar kütle M(g/mol) - şu ilişkiyle ilişkilidir: V=;
2H 2 O+ Ç 2 2H 2 Ö
2 mol 1 mol
2.Kimyanın temel kanunları
Bir maddenin bileşiminin sabitlik yasası - kimyasal olarak saf bir madde, hazırlama yöntemine bakılmaksızın her zaman sabit bir niteliksel ve niceliksel bileşime sahiptir.
CH3+2O2=CO2+2H2O
NaOH+HCl=NaCl+H2O
Sabit bileşime sahip maddelere daltonitler denir. Bir istisna olarak, bileşimi değişmeyen maddeler bilinmektedir - bertolitler (oksitler, karbürler, nitrürler)
Kütlenin korunumu yasası (Lomonosov) - reaksiyona giren maddelerin kütlesi her zaman reaksiyon ürünlerinin kütlesine eşittir. Bundan, reaksiyon sırasında atomların kaybolmadığı ve oluşmadığı, bir maddeden diğerine geçmediği sonucu çıkar. Bir kimyasal reaksiyonun denklemindeki katsayıların seçiminin temeli budur; denklemin sol ve sağ taraflarındaki her bir elementin atom sayısı eşit olmalıdır.
Eşdeğerler kanunu - kimyasal reaksiyonlarda maddeler eşdeğerlerine eşit miktarlarda reaksiyona girer ve oluşur (Bir maddenin kaç eşdeğeri tüketilir, tam olarak aynı sayıda eşdeğer başka bir maddeden tüketilir veya oluşturulur).
Eşdeğer, bir reaksiyon sırasında bir mol H atomu (iyon) ekleyen, değiştiren veya serbest bırakan madde miktarıdır. Gram cinsinden ifade edilen eşdeğer kütleye eşdeğer kütle (E) denir.
Gaz kanunları
Dalton kanunu: Bir gaz karışımının toplam basıncı, gaz karışımının tüm bileşenlerinin kısmi basınçlarının toplamına eşittir.
![]()
Avogadro Yasası: Aynı koşullar altında farklı gazların eşit hacimleri eşit sayıda molekül içerir.
Sonuç: Normal koşullar altında herhangi bir gazın bir molü (t=0 derece veya 273K ve P=1 atmosfer veya 101255 Pascal veya 760 mm Hg. Col.) V=22,4 litre kaplar.
Bir mol gazda yer alan V'ye molar hacim Vm denir.
Verilen koşullar altında gazın (gaz karışımı) hacmini ve Vm'yi bildiğimizde, gaz miktarını (gaz karışımı) =V/Vm hesaplamak kolaydır.
Mendeleev-Clapeyron denklemi, gaz miktarını gazın bulunduğu koşullarla ilişkilendirir. pV=(m/M)*RT= *RT
Bu denklemi kullanırken tüm fiziksel büyüklükler SI cinsinden ifade edilmelidir: p-gaz basıncı (pascal), V-gaz hacmi (litre), m-gaz kütlesi (kg), M-molar kütle (kg/mol), T- mutlak ölçekte sıcaklık (K), Nu-gaz miktarı (mol), R-gaz sabiti = 8,31 J/(mol*K).
D - bir gazın diğerine göre göreceli yoğunluğu - standart olarak seçilen M gazının M gazına oranı, bir gazın diğerinden kaç kat daha ağır olduğunu gösterir D = M1 / M2.
Bir madde karışımının bileşimini ifade etme yöntemleri.
Kütle fraksiyonu W - maddenin kütlesinin tüm karışımın kütlesine oranı W=((m karışım)/(m çözelti))*%100
Mol fraksiyonu æ, madde sayısının tüm maddelerin toplam sayısına oranıdır. Karışımın içinde.
Doğadaki çoğu kimyasal element farklı izotopların karışımı halinde bulunur; Bir kimyasal elementin mol kesirleri cinsinden ifade edilen izotopik bileşimi bilinerek, bu elementin atom kütlesinin ISHE'ye dönüştürülen ağırlıklı ortalama değeri hesaplanır. А= Σ (æi*Аi)= æ1*А1+ æ2*А2+…+ æn*Аn, burada æi, i-inci izotopun mol kesridir, Аi- atom kütlesi i-inci izotop.
Hacim fraksiyonu (φ), Vi'nin tüm karışımın hacmine oranıdır. φi=Vi/VΣ
Gaz karışımının hacimsel bileşimi bilinerek gaz karışımının Mav'ı hesaplanır. Мср= Σ (φi*Mi)= φ1*М1+ φ2*М2+…+ φn*Мn
Atom, kimyasal bir maddenin özelliklerini koruyabilen en küçük parçacığıdır. "Atom" kelimesi, eski Yunanca'da "bölünemez" anlamına gelen "atomos" kelimesinden gelmektedir. Bir atomda kaç tane ve hangi parçacıkların bulunduğuna bağlı olarak bir kimyasal element belirlenebilir..
Kısaca atomun yapısı hakkında
Pozitif yüklü tek çekirdeğe sahip bir parçacık hakkında temel bilgileri kısaca nasıl sıralayabilirsiniz? Bu çekirdeğin etrafında negatif yüklü bir elektron bulutu vardır. Normal durumdaki her atom nötrdür. Bu parçacığın boyutu tamamen çekirdeği çevreleyen elektron bulutunun boyutuna göre belirlenebilir.
Çekirdeğin kendisi de daha küçük parçacıklardan (protonlar ve nötronlar) oluşur. Protonlar pozitif yüklüdür. Nötronlar herhangi bir yük taşımazlar. Ancak protonlar ve nötronlar tek bir kategoride birleştirilir ve nükleonlar olarak adlandırılır. Kısaca atomun yapısına ilişkin temel bilgilere ihtiyaç duyulursa bu bilgiler listelenen verilerle sınırlandırılabilir..

Atom hakkında ilk bilgiler
Eski Yunanlılar maddenin küçük parçacıklardan oluşabileceğinden şüpheleniyorlardı. Var olan her şeyin atomlardan oluştuğuna inanıyorlardı. Ancak böyle bir görüş doğası gereği tamamen felsefidir ve bilimsel olarak yorumlanamaz.
Atomun yapısı hakkında temel bilgileri ilk elde eden İngiliz bilim adamıydı. İki kimyasal elementin farklı oranlara girebileceğini ve bu tür kombinasyonların her birinin yeni bir maddeyi temsil edeceğini keşfeden bu araştırmacıydı. Örneğin oksijen elementinin sekiz kısmı karbondioksite yol açar. Dört kısım oksijen karbon monoksittir.
1803 yılında Dalton kimyada çoklu oranlar yasasını keşfetti. Dolaylı ölçümler kullanarak (o zamanın mikroskopları altında tek bir atom bile incelenemediğinden) Dalton, atomların bağıl ağırlığı hakkında bir sonuca vardı..

Rutherford'un araştırması
Neredeyse bir yüzyıl sonra, atomların yapısı hakkındaki temel bilgiler başka bir İngiliz kimyager tarafından doğrulandı - Bilim Adamı, en küçük parçacıkların elektron kabuğunun bir modelini önerdi.
O dönemde Rutherford'un "Gezegensel Atom Modeli" kimyanın atabileceği en önemli adımlardan biriydi. Atomun yapısına ilişkin temel bilgiler, onun güneş sistemine benzediğini gösteriyordu: Elektron parçacıkları, tıpkı gezegenlerin yaptığı gibi, çekirdeğin etrafında kesin olarak tanımlanmış yörüngelerde dönüyordu.
Atomların elektronik kabuğu ve kimyasal elementlerin atom formülleri
Her atomun elektron kabuğu, çekirdeğindeki protonların sayısı kadar elektron içerir. Bu nedenle atom nötrdür. 1913 yılında başka bir bilim adamı atomun yapısı hakkında temel bilgileri elde etti. Niels Bohr'un formülü Rutherford'un elde ettiği formüle benziyordu. Onun anlayışına göre elektronlar da merkezde bulunan çekirdeğin etrafında dönmektedir. Bohr, Rutherford'un teorisini geliştirdi ve gerçeklerine uyum getirdi.
O zaman bile, bazıları için formüller kimyasallar. Örneğin, şematik olarak nitrojen atomunun yapısı 1s 2 2s 2 2p 3 olarak gösterilir, sodyum atomunun yapısı ise 1s 2 2s 2 2p 6 3s 1 formülüyle ifade edilir. Bu formüller sayesinde belirli bir kimyasal maddenin her bir yörüngesinde kaç elektronun hareket ettiğini görebilirsiniz.

Schrödinger modeli
Ancak daha sonra bu atom modeli de geçerliliğini yitirdi. Atomun yapısı hakkında temel bilgiler, bilim tarafından bilinen Avusturyalı bir fizikçinin araştırmaları sayesinde bugün büyük ölçüde kullanılabilir hale geldi
O önerdi yeni model yapısı dalgadır. Bu zamana kadar bilim adamları, elektronun yalnızca bir parçacığın doğasına sahip olmadığını, aynı zamanda bir dalganın özelliklerine de sahip olduğunu zaten kanıtlamışlardı.
Ancak Schrödinger ve Rutherford modelinin de genel hükümler. Teorileri, elektronların belirli seviyelerde mevcut olması bakımından benzerdir.
Bu seviyelere aynı zamanda denir. elektronik katmanlar. Seviye numarasını kullanarak elektron enerjisi karakterize edilebilir. Katman ne kadar yüksek olursa, o kadar fazla enerjiye sahip olur. Tüm seviyeler aşağıdan yukarıya doğru sayılır, böylece seviye numarası enerjiye karşılık gelir. Bir atomun elektron kabuğundaki katmanların her birinin kendi alt seviyeleri vardır. Bu durumda, ilk seviye bir alt seviyeye sahip olabilir, ikinci seviye iki, üçüncü seviye üç vb. olabilir (yukarıya bakın) elektronik formüller nitrojen ve sodyum).

Daha da küçük parçacıklar
Açık şu anda Elbette elektron, proton ve nötrondan daha küçük parçacıklar da keşfedildi. Protonun kuarklardan oluştuğu biliniyor. Evrenin daha da küçük parçacıkları var; örneğin, kuarktan yüz kat, protondan milyar kat daha küçük olan nötrino.
Bir nötrino o kadar küçük bir parçacıktır ki, örneğin bir Tyrannosaurus rex'ten 10 septilyon kat daha küçüktür. Tyrannosaurus'un kendisi aynı miktardadır daha küçük boyutlar gözlemlenebilir Evrenin tamamından daha fazla.
Atomun yapısı hakkında temel bilgiler: radyoaktivite
Tek bir kişinin bile olmadığı her zaman biliniyordu. kimyasal reaksiyon bir elementi diğerine dönüştüremez. Ancak radyoaktif radyasyon sürecinde bu kendiliğinden gerçekleşir.
Radyoaktivite, atom çekirdeklerinin diğer çekirdeklere (daha kararlı olanlara) dönüşme yeteneğidir. İnsanlar atomların yapısı hakkında temel bilgiler aldığında, izotoplar bir dereceye kadar ortaçağ simyacılarının hayallerinin somutlaşmış hali olarak hizmet edebilirdi.
İzotoplar bozundukça radyoaktif radyasyon yayılır. Bu fenomen ilk olarak Becquerel tarafından keşfedildi. Ana görünüm Radyoaktif radyasyon alfa bozunumudur. Bu meydana geldiğinde, bir alfa parçacığı serbest bırakılır. Ayrıca bir beta parçacığının bir atomun çekirdeğinden fırlatıldığı beta bozunması da vardır.
Doğal ve yapay izotoplar
Şu anda yaklaşık 40 doğal izotop bilinmektedir. Çoğu üç kategoride yer alıyor: uranyum-radyum, toryum ve aktinyum. Bütün bu izotoplar doğada, kayalarda, toprakta, havada bulunabilir. Ancak bunların yanı sıra, yapay olarak elde edilen yaklaşık bin kadar yapay olarak türetilmiş izotop da bilinmektedir. nükleer reaktörler. Bu izotopların çoğu tıpta, özellikle teşhiste kullanılmaktadır..

Atom içindeki oranlar
Boyutları uluslararası bir stadyumun boyutlarıyla karşılaştırılabilecek bir atom hayal edersek görsel olarak aşağıdaki oranları elde edebiliriz. Böyle bir "stadyumdaki" atomun elektronları tribünlerin en üstünde yer alacaktır. Her biri bir toplu iğnenin başından daha küçük olacaktır. Daha sonra çekirdek bu alanın ortasına yerleştirilecek ve boyutu bezelye büyüklüğünde olmayacaktır.
Bazen insanlar bir atomun gerçekte neye benzediğini soruyorlar. Aslında kelimenin tam anlamıyla hiçbir şeye benzemiyor; bunun nedeni bilimde kullanılan mikroskopların yeterince iyi olmaması değil. Bir atomun boyutları “görünürlük” kavramının bulunmadığı alanlardadır.
Atomların boyutları çok küçüktür. Peki bu boyutlar gerçekte ne kadar küçük? Gerçek şu ki, insan gözüyle zar zor görülebilen en küçük tuz tanesinde yaklaşık bir kentilyon atom bulunur.
Eğer içine sığabilecek büyüklükte bir atom hayal edersek insan eli o zaman yanında 300 metre uzunluğunda virüsler olurdu. Bakterilerin uzunluğu 3 km, insan saçının kalınlığı ise 150 km olacaktır. Sırt üstü pozisyondayken dünya atmosferinin sınırlarının ötesine geçebilecekti. Ve eğer bu oranlar geçerli olsaydı, o zaman bir insan saçı uzunluğu Ay'a ulaşabilirdi. Bu, bilim adamlarının bugüne kadar incelemeye devam ettiği çok karmaşık ve ilginç bir atom.
TANIM
Atom– en küçük kimyasal parçacık.
Kimyasal bileşiklerin çeşitliliği, kimyasal elementlerin atomlarının moleküller ve moleküler olmayan maddeler halinde farklı kombinasyonlarından kaynaklanmaktadır. Bir atomun içeri girme yeteneği kimyasal bileşikler, kimyasal ve fiziksel özellikler atomun yapısına göre belirlenir. Bu bakımdan kimya açısından büyük önem taşımaktadır. iç yapı atomun yapısı ve her şeyden önce elektron kabuğunun yapısı.
Atomik yapı modelleri
19. yüzyılın başında D. Dalton, o zamana kadar bilinen kimyanın temel yasalarına (bileşimin sabitliği, çoklu oranlar ve eşdeğerler) dayanarak atom teorisini yeniden canlandırdı. İlk deneyler maddenin yapısını incelemek için yapıldı. Ancak yapılan keşiflere rağmen (aynı elementin atomları aynı özelliklere sahiptir ve diğer elementlerin atomları farklı özelliklere sahiptir, atom kütlesi kavramı ortaya atılmıştır), atomun bölünemez olduğu kabul edilmiştir.
Deneysel kanıtlar elde edildikten sonra ( XIX sonu 20. yüzyılın başlarında) atomun yapısının karmaşıklığı (fotoelektrik etki, katot ve x-ışınları, radyoaktivite), atomun birbiriyle etkileşime giren negatif ve pozitif yüklü parçacıklardan oluştuğu tespit edilmiştir.
Bu keşifler atom yapısının ilk modellerinin oluşturulmasına ivme kazandırdı. İlk modellerden biri önerildi J. Thomson(1904) (Şekil 1): Atom, içinde salınan elektronların bulunduğu bir "pozitif elektrik denizi" olarak hayal edildi.
1911'de α parçacıklarıyla yapılan deneylerden sonra. Rutherford sözde önerdi gezegen modeli atomik yapı (Şekil 1), yapıya benzer güneş sistemi. Gezegen modeline göre atomun merkezinde Z e yüküne sahip, büyüklüğü yaklaşık 1.000.000 katı olan çok küçük bir çekirdek vardır. daha küçük boyutlar atomun kendisi. Çekirdek atomun neredeyse tüm kütlesini içerir ve pozitif yüke sahiptir. Elektronlar çekirdeğin etrafında, sayısı çekirdeğin yüküne göre belirlenen yörüngelerde hareket eder. Dış yörünge elektronların hareketini belirler dış boyutlar atom. Bir atomun çapı 10 -8 cm iken çekirdeğin çapı -10 -12 cm'dir.
Pirinç. 1 Thomson ve Rutherford'a göre atomik yapı modelleri
Atomik spektrumların incelenmesi üzerine yapılan deneyler, atomun yapısının gezegensel modelinin kusurlu olduğunu gösterdi, çünkü bu model atom spektrumunun çizgi yapısıyla çelişiyor. Rutherford'un modeline, Einstein'ın ışık kuantumu doktrini ve Planck'ın kuantum radyasyon teorisine dayanmaktadır. Niels Bohr'un (1913) formüle edilmiş varsayımlar, oluşur atom yapısı teorisi(Şekil 2): bir elektron çekirdeğin etrafında herhangi bir yerde değil, yalnızca bazı belirli yörüngelerde (sabit) dönebilir, böyle bir yörünge boyunca hareket ederek elektromanyetik enerji, radyasyon (bir kuantum elektromanyetik enerjinin emilmesi veya yayılması) yaymaz ) elektronun bir yörüngeden diğerine geçişi (atlama benzeri) sırasında meydana gelir.

Pirinç. 2. N. Bohr'a göre atomun yapısının modeli
Atomun yapısını karakterize eden birikmiş deneysel materyal, diğer mikro nesneler gibi elektronların özelliklerinin de klasik mekanik kavramları temelinde tanımlanamayacağını göstermiştir. Mikropartiküller, yaratılışın temeli haline gelen kuantum mekaniği yasalarına uyar atom yapısının modern modeli.
Kuantum mekaniğinin ana tezleri:
- enerji cisimler tarafından ayrı kısımlarda yayılır ve emilir - kuantum, dolayısıyla parçacıkların enerjisi aniden değişir;
- elektronlar ve diğer mikropartiküller ikili bir yapıya sahiptirler - hem partiküllerin hem de dalgaların özelliklerini sergilerler (dalga-partikül ikiliği);
— kuantum mekaniği, mikropartiküller için belirli yörüngelerin varlığını reddeder (hareket eden elektronlar için kesin konumu belirlemek imkansızdır, çünkü onlar çekirdeğin yakınında uzayda hareket ederler, yalnızca bir elektron bulma olasılığını belirleyebilirsiniz) çeşitli parçalar uzay).
Elektron bulma olasılığının oldukça yüksek (%90) olduğu çekirdeğe yakın uzaya denir. orbital.
Kuantum sayıları. Pauli'nin ilkesi. Klechkovsky'nin kuralları
Bir atomdaki elektronun durumu dört kullanılarak tanımlanabilir. kuantum sayıları.
N– ana kuantum sayısı. Bir atomdaki elektronun toplam enerji rezervini ve enerji seviyesi sayısını karakterize eder. n, 1'den ∞'a kadar tam sayı değerleri alır. Elektron n=1 olduğunda en düşük enerjiye sahiptir; artan n – enerji ile. Bir atomun elektronlarının toplam enerjisi minimum olacak enerji seviyelerinde olduğu duruma toprak denir. Daha fazlasına sahip eyaletler yüksek değerler heyecanlı denir. Enerji seviyeleri gösterilir Arap rakamları n değerine göre. Elektronlar yedi düzeyde düzenlenebilir, bu nedenle n gerçekte 1'den 7'ye kadar bulunur. Ana kuantum sayısı elektron bulutunun boyutunu belirler ve bir atomdaki elektronun ortalama yarıçapını belirler.
ben– yörünge kuantum sayısı. Alt seviyedeki elektronların enerji rezervini ve yörüngenin şeklini karakterize eder (Tablo 1). 0'dan n-1'e kadar tam sayı değerlerini kabul eder.

n'ye bağlıyım. Eğer n=1 ise l=0 yani 1. seviyede 1. alt seviye vardır. Ben

– manyetik kuantum sayısı. Yörüngenin uzaydaki yönelimini karakterize eder. –l ile 0 ila +l arasındaki tamsayı değerlerini kabul eder. Böylece l=1 (p-orbital) olduğunda m e -1, 0, 1 değerlerini alır ve yörüngenin yönelimi farklı olabilir (Şekil 3).
Pirinç. 3. P-orbitalinin uzayındaki olası yönelimlerden biri S
– spin kuantum sayısı. Elektronun kendi ekseni etrafındaki dönüşünü karakterize eder. -1/2(↓) ve +1/2() değerlerini kabul eder. Aynı yörüngedeki iki elektron antiparalel spinlere sahiptir. Atomlardaki elektronların durumu belirlenir Pauli ilkesi : Bir atomun tüm kuantum sayıları aynı kümeye sahip iki elektronu olamaz. Yörüngelerin elektronlarla doldurulma sırası belirlenir Klechkovsky kuralları
: Bu yörüngelerin toplamı (n+l) artan sırada yörüngeler elektronlarla doldurulur, eğer toplam (n+l) aynı ise, önce n değeri daha küçük olan yörünge doldurulur. Bununla birlikte, bir atom genellikle bir değil birkaç elektron içerir ve bunların birbirleriyle etkileşimlerini hesaba katmak için, elektron başına etkili nükleer yük kavramı kullanılır. harici seviye
çekirdeğin yükünden daha az bir yük etki eder, bunun sonucunda iç elektronlar dış elektronları perdeler.
Bir atomun temel özellikleri: atom yarıçapı (kovalent, metalik, van der Waals, iyonik), elektron ilgisi, iyonlaşma potansiyeli, manyetik moment.
Atomların elektronik formülleri Bir atomun tüm elektronları onun elektron kabuğunu oluşturur. Elektron kabuğunun yapısı tasvir edilmiştir elektronik formül
İkinci periyodun elemanları için elektronlar, 8'den fazla elektron içeremeyen 2. enerji seviyesini doldurur. İlk önce elektronlar s-alt seviyesini, ardından p-alt seviyesini doldurur. Örneğin:
5 B 1s 2 2s 2 2p 1
Bir atomun elektronik yapısı ile elementin Periyodik Tablodaki konumu arasındaki ilişki
Bir elementin elektronik formülü onun içindeki konumuna göre belirlenir. Periyodik tablo DI. Mendeleev. Böylece periyot numarası şuna karşılık gelir: İkinci periyodun elemanlarında elektronlar, en fazla 8 elektron içerebilen 2. enerji seviyesini doldurur. Birincisi elektronlar doluyor İkinci periyodun elemanlarında elektronlar 8'den fazla elektron içeremeyen 2. enerji seviyesini dolduruyor. İlk önce elektronlar s-alt seviyesini, ardından p-alt seviyesini doldurur. Örneğin:
5 B 1s 2 2s 2 2p 1
Bazı elementlerin atomlarında, elektronun dış enerji seviyesinden sondan bir önceki seviyeye “sıçraması” olgusu gözlenir. Bakır, krom, paladyum ve diğer bazı elementlerin atomlarında elektron kaçağı meydana gelir. Örneğin:
24 Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
8'den fazla elektron içeremeyen bir enerji seviyesi. İlk önce elektronlar s-alt seviyesini, ardından p-alt seviyesini doldurur. Örneğin:
5 B 1s 2 2s 2 2p 1
Ana alt grupların elemanları için grup numarası sayıya eşit dış enerji seviyesindeki elektronlara değerlik elektronları denir (kimyasal bağ oluşumuna katılırlar). Yan alt grupların elemanları için değerlik elektronları, dış enerji seviyesinin elektronları ve sondan bir önceki seviyenin d-alt seviyesi olabilir. III-VII gruplarının yanı sıra Fe, Ru, Os'un ikincil alt gruplarının element grup sayısı karşılık gelir toplam sayı dış enerji seviyesinin s-alt seviyesindeki ve sondan bir önceki seviyenin d-alt seviyesindeki elektronlar
Görevler:
Fosfor, rubidyum ve zirkonyum atomlarının elektronik formüllerini çizin. Değerlik elektronlarını belirtin.
Cevap:
15 P 1s 2 2s 2 2p 6 3s 2 3p 3 Değerlik elektronları 3s 2 3p 3
37 Rb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1 Değerlik elektronları 5s 1
40 Zr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 2 5s 2 Değerlik elektronları 4d 2 5s 2