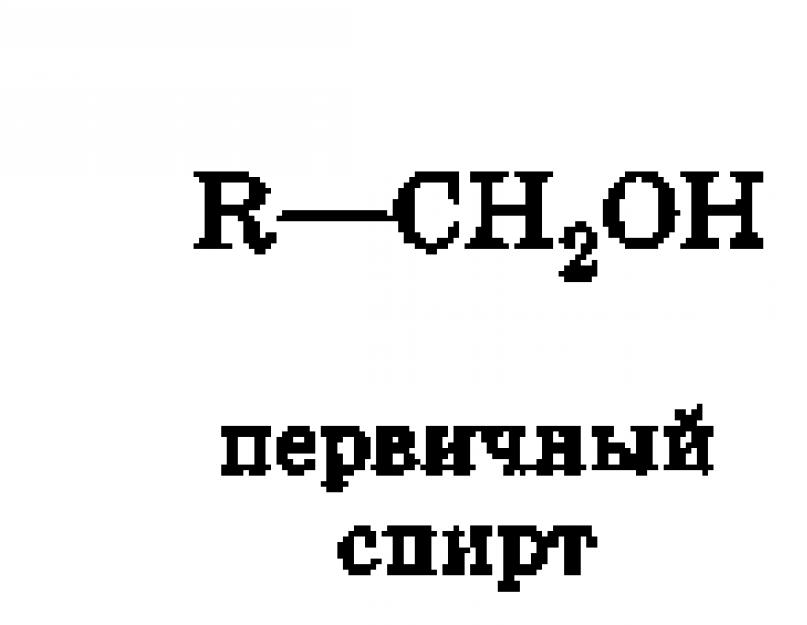TANIM
Monohidrik alkolleri sınırlayın bir hidrojen atomunun bir hidroksil grubu ile değiştirildiği moleküllerdeki metan serisinin hidrokarbonlarının türevleri olarak düşünülebilir.
Bu nedenle, doymuş monohidrik alkoller, bir hidrokarbon radikali ve bir fonksiyonel grup -OH'den oluşur. Alkollerin isimlerinde hidroksil grubu -ol eki ile gösterilir.
Doymuş monohidrik alkollerin genel formülü C n H 2 n +1 OH veya R-OH veya C n H 2 n +2 O'dur. Bir alkolün moleküler formülü, molekülün yapısını yansıtmaz, çünkü iki kesinlikle farklı maddeler, Örneğin Moleküler formül C2H5OH, hem etil alkol hem de aseton (dimetil keton) için ortaktır:
CH3-CH2-OH (etanol);
CH3-O-CH3 (aseton).
Metan serisinin hidrokarbonları gibi, doymuş monohidrik alkoller de homolog metanol serisini oluşturur.
Bu homolog dizisini oluşturalım ve hidrokarbon radikalindeki artışa bağlı olarak bu dizideki bileşiklerin fiziksel özelliklerindeki değişim modellerini ele alalım (Tablo 1).
Doymuş monohidrik alkollerin homolog serisi (eksik)
Tablo 1. Doymuş monohidrik alkollerin homolog serileri (eksik).
Limit monohidrik alkoller, yoğunlukları nedeniyle sudan daha hafiftir. birden az. Düşük alkoller su ile her bakımdan karışabilir, hidrokarbon radikalinin artmasıyla bu yetenek azalır. Alkollerin çoğu organik çözücülerde yüksek oranda çözünür. Alkoller, moleküller arası bağ oluşturma olasılıkları nedeniyle, karşılık gelen hidrokarbonlardan veya halojen türevlerinden daha yüksek kaynama ve erime noktalarına sahiptir.
Doymuş monohidrik alkollerin en önemli temsilcileri metanol (CH3OH) ve etanoldür (C2H5OH).
Problem çözme örnekleri
ÖRNEK 1
| Egzersiz yapmak | Doğal incilerde kalsiyum, karbon ve oksijenin kütle oranları 10:3:12'dir. En basit inci formülü nedir? |
| Çözüm | Nasıl bir ilişki olduğunu öğrenmek için kimyasal elementler molekülün bileşiminde madde miktarlarını bulmak gerekir. Bir maddenin miktarını bulmak için aşağıdaki formülün kullanılması gerektiği bilinmektedir: Kalsiyum, karbon ve oksijenin molar kütlelerini bulalım (D.I. Mendeleev'in Periyodik Tablosundan alınan bağıl atomik kütlelerin değerleri tam sayılara yuvarlanacaktır). M = Mr olduğu bilinmektedir, bu da M(Ca)=40 g/mol, Ar(C)=12 g/mol ve M(O)=32 g/mol anlamına gelir. Daha sonra, bu elementlerin madde miktarı şuna eşittir: n (Ca) = m (Ca) / M (Ca); n (Ca) \u003d 10 / 40 \u003d 0,25 mol. n(C) = m(C) / M(C); n(C) = 3/12 = 0.25 mol. n(O) = m(O) / M(O); n (O) \u003d 12 / 16 \u003d 0,75 mol. Molar oranı bulun: n(Ca) :n(C):n(O) = 0,25: 0,25: 0,75= 1: 1: 3, onlar. inci bileşik formülü CaCO3'tür. |
| Cevap | CaCO3 |
ÖRNEK 2
| Egzersiz yapmak | Nitrik oksit %63.2 oksijen içerir. oksit formülü nedir |
| Çözüm | HX bileşiminin molekülündeki X elementinin kütle oranı aşağıdaki formülle hesaplanır: ω (X) = n × Ar (X) / M (HX) × %100. Oksitteki nitrojenin kütle oranını hesaplayalım: ω (N) \u003d %100 - ω (O) \u003d %100 - %63,2 \u003d %36,8. Bileşiği oluşturan elementlerin mol sayısını "x" (azot) ve "y" (oksijen) olarak gösterelim. Ardından, molar oran şöyle görünecektir (D.I. Mendeleev'in Periyodik Tablosundan alınan bağıl atom kütlelerinin değerleri tam sayılara yuvarlanacaktır): x:y = ω(N)/Ar(N) : ω(O)/Ar(O); x:y= 36,8/14: 63,2/16; x:y= 2,6: 3,95 = 1: 2. Yani nitrojen ve oksijen bileşiğinin formülü NO 2 olacaktır. Bu nitrik oksittir (IV). |
| Cevap | 2 NO |
makalenin içeriği
ALKOL(alkoller) – sınıf organik bileşikler bir veya daha fazla C-OH grubu içeren, OH hidroksil grubu ise alifatik bir karbon atomuna bağlıdır (C-OH grubundaki karbon atomunun aromatik çekirdeğin bir parçası olduğu bileşiklere fenoller denir)
Alkollerin sınıflandırılması çeşitlidir ve yapının hangi özelliğinin esas alındığına bağlıdır.
1. Moleküldeki hidroksil gruplarının sayısına bağlı olarak alkoller ikiye ayrılır:
a) monoatomik (bir hidroksil OH grubu içerir), örneğin metanol CH3OH, etanol C2H5OH, propanol C3H7OH
b) çok atomlu (iki veya daha fazla hidroksil grubu), örneğin etilen glikol
HO-CH2-CH2-OH, gliserol HO-CH2-CH(OH) -CH2-OH, pentaeritritol C (CH2OH) 4.
Bir karbon atomunun iki hidroksil grubuna sahip olduğu bileşikler çoğu durumda kararsızdır ve suyu ayırırken kolayca aldehitlere dönüşür: RCH (OH) 2 ® RCH \u003d O + H20
2. OH grubunun bağlı olduğu karbon atomunun türüne göre alkoller ikiye ayrılır:
a) OH grubunun birincil karbon atomuna bağlı olduğu birincil. Birincil karbon atomu, yalnızca bir karbon atomu ile ilişkili olarak adlandırılır (kırmızı ile vurgulanır). Birincil alkol örnekleri - etanol CH3 - C H 2 -OH, propanol CH3 -CH2 - C H2-OH.
b) OH grubunun ikincil bir karbon atomuna bağlandığı ikincil. İkincil karbon atomu (mavi renkle vurgulanmıştır), örneğin ikincil propanol, ikincil bütanol gibi iki karbon atomuna aynı anda bağlıdır (Şekil 1).
Pirinç. 1. SEKONDER ALKOLLERİN YAPISI
c) OH grubunun üçüncül karbon atomuna bağlı olduğu üçüncül. Üçüncül karbon atomu (izole yeşil) aynı anda üç komşu karbon atomuna, örneğin üçüncül bütanol ve pentanol'e bağlanır (Şekil 2).
Pirinç. 2. ÜÇÜNCÜ ALKOLLERİN YAPISI
Buna bağlı alkol grubu, karbon atomunun türüne göre birincil, ikincil veya üçüncül olarak da adlandırılır.
İki veya daha fazla OH grubu içeren polihidrik alkollerde, örneğin gliserol veya ksilitolde hem birincil hem de ikincil H O grupları aynı anda bulunabilir (Şekil 3).
Pirinç. 3. POLYATOMİK ALKOLLERİN YAPISINDA BİRİNCİL VE İKİNCİL OH GRUPLARININ KOMBİNASYONU.
3. Bir OH grubu ile bağlanan organik grupların yapısına göre, alkoller doymuş (metanol, etanol, propanol), doymamış, örneğin alil alkol CH2 \u003d CH - CH2-OH, aromatik (örneğin , R grubunda bir aromatik grup içeren benzil alkol C6H5CH2OH).
OH grubunun çift bağa "bitişik" olduğu doymamış alkoller, yani. aynı anda bir çift bağın oluşumuna katılan bir karbon atomuna bağlı (örneğin, vinil alkol CH 2 \u003d CH–OH), son derece kararsızdır ve hemen izomerleşir ( santimetre.İZOMERİZASYON) aldehitlere veya ketonlara:
CH 2 \u003d CH–OH ® CH3 -CH \u003d O
Alkollerin isimlendirilmesi.
Basit bir yapıya sahip yaygın alkoller için, basitleştirilmiş bir terminoloji kullanılır: organik grubun adı bir sıfata dönüştürülür (son ek ve son ek kullanılarak " yeni”) ve “alkol” kelimesini ekleyin:
Organik grubun yapısının daha karmaşık olması durumunda, bütün için ortaktır. organik Kimya tüzük. Bu tür kurallara göre derlenen isimlere sistematik denir. Bu kurallara göre hidrokarbon zinciri OH grubunun en yakın olduğu uçtan numaralandırılır. Daha sonra, bu numaralandırma, ana zincir boyunca çeşitli ikame edicilerin konumunu belirtmek için kullanılır, ismin sonuna "ol" soneki ve OH grubunun konumunu gösteren bir sayı eklenir (Şekil 4):
Pirinç. 4. ALKOLLERİN SİSTEMATİK İSİMLERİ. Fonksiyonel (OH) ve ikame (CH 3) grupları ve bunlara karşılık gelen dijital indeksler farklı renklerle vurgulanmıştır.
En basit alkollerin sistematik isimleri aynı kurallara göre yapılır: metanol, etanol, butanol. Bazı alkoller için, tarihsel olarak geliştirilmiş önemsiz (basitleştirilmiş) isimler korunmuştur: propargil alkol HCє C–CH2 –OH, gliserol HO–CH2 –CH (OH)–CH2 –OH, pentaeritritol C (CH2OH) 4, fenetil alkol C6H5-CH2-CH2-OH.
Alkollerin fiziksel özellikleri.
Alkoller çoğu organik çözücüde çözünür, en basit üç temsilci - metanol, etanol ve propanol ve ayrıca üçüncül butanol (H 3 C) 3 COH - suyla her oranda karışabilir. Organik gruptaki C atomlarının sayısının artmasıyla hidrofobik (su itici) etki etkilenmeye başlar, sudaki çözünürlük sınırlanır ve 9'dan fazla karbon atomu içeren R'de pratik olarak kaybolur.
OH gruplarının varlığı nedeniyle, alkol molekülleri arasında hidrojen bağları oluşur.
Pirinç. 5. ALKOLLERDEKİ HİDROJEN BAĞLARI(noktalı çizgi ile gösterilmiştir)
Sonuç olarak, tüm alkoller, karşılık gelen hidrokarbonlardan, örneğin T. kip'ten daha yüksek bir kaynama noktasına sahiptir. etanol + 78 °C ve T. kip. etan –88.63°C; T. kip. bütanol ve bütan sırasıyla +117.4°C ve –0.5°C.
Alkollerin kimyasal özellikleri.
Alkoller çeşitli dönüşümlerle ayırt edilir. Alkollerin reaksiyonları bazı genel kalıplar: birincil monohidrik alkollerin reaktivitesi ikincil olanlardan daha yüksektir, buna karşılık ikincil alkoller kimyasal olarak üçüncül olanlardan daha aktiftir. Dihidrik alkoller için, OH gruplarının komşu karbon atomlarında bulunması durumunda, bu grupların karşılıklı etkisinden dolayı (monohidrik alkollere kıyasla) artan bir reaktivite gözlenir. Alkoller için, hem C–O hem de O–H bağlarının bölünmesiyle meydana gelen reaksiyonlar mümkündür.
1. О–Н bağından geçen reaksiyonlar.
ile etkileşim kurarken aktif metaller(Na, K, Mg, Al) alkoller, zayıf asitlerin özelliklerini sergiler ve alkolatlar veya alkoksitler adı verilen tuzlar oluşturur:
2CH 3 OH + 2Na® 2CH 3 OK + H 2
Alkolatlar kimyasal olarak kararsızdır ve suyun etkisi altında alkol ve metal hidroksit oluşturmak üzere hidrolize olurlar:
C 2 H 5 OK + H 2 O ® C 2 H 5 OH + KOH
Bu reaksiyon, alkollerin suya kıyasla daha zayıf asitler olduğunu gösterir (güçlü asit zayıf olanın yerini alır), ayrıca alkoller alkali çözeltilerle etkileşime girdiğinde alkolatlar oluşturmaz. Bununla birlikte, polihidrik alkollerde (OH gruplarının komşu C atomlarına bağlanması durumunda), alkol gruplarının asitliği çok daha yüksektir ve yalnızca metallerle değil, alkalilerle de etkileşime girdiklerinde alkolatlar oluşturabilirler:
HO–CH 2 –CH 2 –OH + 2NaOH ® NaO–CH 2 –CH 2 –ONa + 2H 2 O
Polihidrik alkollerdeki HO grupları bitişik olmayan C atomlarına bağlandığında, HO gruplarının karşılıklı etkisi görünmediğinden alkollerin özellikleri monohidrik yakındır.
Mineral veya organik asitlerle etkileşime girdiğinde, alkoller esterler oluşturur - R-O-A fragmanını içeren bileşikler (A, asit kalıntısıdır). Eğitim esterler ayrıca alkollerin anhidritler ve karboksilik asitlerin asit klorürleri ile etkileşimi sırasında da oluşur (Şekil 6).
Oksitleyici ajanların (K2Cr207, KMnO4) etkisi altında, birincil alkoller aldehitleri ve ikincil alkoller ketonları oluşturur (Şekil 7)
Pirinç. 7. ALKOLLERİN OKSİTLENMESİ SIRASINDA ALDEHİT VE KETON OLUŞUMU
Alkollerin indirgenmesi, ilk alkol molekülü ile aynı sayıda C atomu içeren hidrokarbonların oluşumuna yol açar (Şekil 8).
Pirinç. 8. BUTANOLÜN GERİ KAZANILMASI
2. C–O bağında meydana gelen reaksiyonlar.
Katalizörlerin veya güçlü mineral asitlerin varlığında, alkoller dehidre edilir (su ayrılır), reaksiyon iki yönde ilerleyebilir:
a) iki alkol molekülünün katılımıyla moleküller arası dehidrasyon, moleküllerden birindeki C-O bağları kırılır, bu da eterlerin oluşmasına neden olur - R-O-R fragmanını içeren bileşikler (Şekil 9A).
b) molekül içi dehidrasyon sırasında alkenler oluşur - çift bağlı hidrokarbonlar. Çoğunlukla, her iki süreç de -bir eter ve bir alken oluşumu- paralel olarak gerçekleşir (Şekil 9B).
İkincil alkoller söz konusu olduğunda, bir alken oluşumu sırasında, reaksiyonun iki yönü mümkündür (Şekil 9C), baskın yön, yoğunlaşma sırasında hidrojenin en az hidrojenlenmiş karbon atomundan ayrıldığı yöndür ( ile işaretlenmiştir) 3 numara), yani daha az hidrojen atomu ile çevrilidir (atom 1'e kıyasla). Şek. Alkenler ve eterler üretmek için 10 reaksiyon kullanılır.
Alkollerde C-O bağının kırılması, OH grubunun bir halojen veya bir amino grubu ile yer değiştirmesi ile de meydana gelir (Şekil 10).
Pirinç. 10. ALKOLLERDEKİ OH-GRUBU'NUN HALOJEN VEYA AMİN GRUBU İLE DEĞİŞTİRİLMESİ
Şek. 10 halokarbonlar ve aminler üretmek için kullanılır.
Alkol almak.
Yukarıda gösterilen reaksiyonların bazıları (Şekil 6,9,10) tersine çevrilebilir ve değişen koşullar altında, örneğin esterlerin ve halokarbonların hidrolizi sırasında alkol üretimine yol açarak ters yönde ilerleyebilir (Şekil 1). sırasıyla 11A ve B), ayrıca hidrasyon alkenleri - su ekleyerek (Şekil 11B).
Pirinç. on bir. ORGANİK BİLEŞİKLERİN HİDROLİZ VE HİDRASYONU YOLUYLA ALKOL ÜRETİMİ
Alkenlerin hidroliz reaksiyonu (Şekil 11, şema B) altta yatan endüstriyel üretim 4'e kadar karbon atomu içeren düşük alkoller.
Etanol ayrıca şekerlerin sözde alkollü fermantasyonu sırasında da oluşur, örneğin glikoz C6H1206. İşlem, maya mantarlarının varlığında ilerler ve etanol ve CO2 oluşumuna yol açar:
C 6 H 12 O 6 ® 2C 2 H 5 OH + 2CO 2
Mayalar daha yüksek alkol konsantrasyonunda öldüğünden, fermantasyon %15'ten fazla sulu alkol çözeltisi üretemez. Damıtma ile daha yüksek konsantrasyondaki alkol çözeltileri elde edilir.
Metanol endüstriyel olarak karbon monoksitin 400°C'de 20–30 MPa basınç altında bakır, krom ve alüminyum oksitlerden oluşan bir katalizör varlığında indirgenmesiyle üretilir:
CO + 2 H 2 ® H 3 SON
Alkenlerin hidrolizi yerine (Şek. 11) oksidasyon yapılırsa, dihidrik alkoller oluşur (Şek. 12)
Pirinç. 12. DİATOMİK ALKOL ELDE ETMEK
Alkollerin kullanımı.
Alkollerin çeşitli kimyasal reaksiyonlara katılma yeteneği, polimerlerin, boyaların ve ilaçların üretiminde organik çözücüler olarak kullanılan aldehitler, ketonlar, karboksilik asitler, eterler ve esterler gibi her türlü organik bileşiği elde etmek için kullanılmalarına izin verir.
Metanol CH 3 OH solvent olarak kullanıldığı gibi fenol-formaldehit reçineleri elde etmek için kullanılan formaldehit üretiminde de, Son zamanlarda metanol umut verici olarak kabul edilir motor yakıtı. Üretim ve nakliyede büyük hacimlerde metanol kullanılmaktadır. doğal gaz. Metanol, tüm alkoller arasında en zehirli bileşiktir, öldürücü doz ağızdan alındığında - 100 ml.
Etanol C2H5OH - orijinal bağlantı asetaldehit, asetik asit üretimi ve ayrıca çözücü olarak kullanılan karboksilik asitlerin esterlerinin üretimi için. Ayrıca tüm alkollü içeceklerin ana bileşeni olan etanol, tıpta dezenfektan olarak da yaygın olarak kullanılmaktadır.
Butanol, yağlar ve reçineler için bir çözücü olarak kullanılır, ayrıca aromatik maddelerin (bütil asetat, bütil salisilat vb.) Üretimi için bir hammadde görevi görür. Şampuanlarda solüsyonların şeffaflığını artıran bir bileşen olarak kullanılır.
Benzil alkol C6H5-CH2-OH serbest halde (ve esterler halinde) bulunur. uçucu yağlar yasemin ve sümbül. Antiseptik (dezenfekte edici) özelliği vardır, kozmetikte krem, losyon, diş iksiri için koruyucu, parfümeride güzel kokulu madde olarak kullanılır.
Fenetil alkol C6H5-CH2-CH2-OH gül kokusuna sahiptir, gül yağında bulunur ve parfümeride kullanılır.
Etilen glikol HOCH 2 -CH 2 OH, plastik üretiminde ve antifriz (sulu çözeltilerin donma noktasını düşüren bir katkı maddesi) olarak, ayrıca tekstil ve baskı mürekkeplerinin imalatında kullanılır.
Dietilen glikol HOCH 2 -CH 2 OCH 2 -CH 2 OH, hidrolik fren cihazlarını doldurmak için ve ayrıca tekstil endüstrisinde kumaşları terbiye ederken ve boyarken kullanılır.
Gliserin HOCH 2 -CH(OH) -CH2OH, polyester gliptal reçineleri üretmek için kullanılır, ayrıca birçok kozmetik preparatın bir bileşenidir. Nitrogliserin (Şekil 6), madencilik ve demiryolu yapımında kullanılan dinamitin ana bileşenidir. patlayıcı.
Pentaeritritol (HOCH 2) 4 C, polyester (pentaftalik reçineler) üretiminde, sentetik reçineler için sertleştirici olarak, polivinil klorür için plastikleştirici olarak ve ayrıca tetranitropentaeritritol patlayıcı üretiminde kullanılır.
Polihidrik alkoller ksilitol HOCH2–(CHOH)3–CH2OH ve sorbitol HOCH2– (CHOH)4–CH2OH tatlı bir tada sahiptir ve şeker hastaları ve obez insanlar için şekerleme üretiminde şeker yerine kullanılır. Sorbitol, üvez ve kiraz meyvelerinde bulunur.
Mihail Levitski
Alkoller, hidroksil grubu veya hidroksil adı verilen bir veya daha fazla -OH grubu içeren hidrokarbon türevleridir.
Alkoller sınıflandırılır:
1. Molekülde bulunan hidroksil gruplarının sayısına göre, alkoller monoatomik (bir hidroksil ile), iki atomlu (iki hidroksil ile), triatomik (üç hidroksil ile) ve polihidrik olarak ayrılır.
Doymuş hidrokarbonlar gibi, monohidrik alkoller de düzenli olarak oluşturulmuş bir dizi homolog oluşturur:
Diğer homolog serilerde olduğu gibi, alkol serisinin her bir üyesi, önceki ve sonraki üyelerden homolog farkla (-CH2-) bileşim bakımından farklılık gösterir.
2. Hidroksilin bulunduğu karbon atomuna bağlı olarak birincil, ikincil ve üçüncül alkoller ayırt edilir. Birincil alkollerin molekülleri, metanolde (birincil karbon atomunda hidroksil) bir radikal veya bir hidrojen atomu ile bağlantılı bir -CH2OH grubu içerir. İkincil alkoller, iki radikalle (ikincil karbon atomundaki hidroksil) ilişkili bir >CHOH grubu ile karakterize edilir. Üçüncül alkollerin molekülleri, üç radikalle (üçüncül karbon atomunda hidroksil) ilişkili bir >C-OH grubuna sahiptir. Radikali R ile göstererek, bu alkollerin formüllerini genel biçimde yazabiliriz: 
IUPAC terminolojisine uygun olarak, bir monohidrik alkolün adı oluşturulurken, ana hidrokarbon adına -ol soneki eklenir. Bileşikte daha yüksek işlevler varsa, hidroksil grubu hidroksi- ön eki ile gösterilir (Rusça'da genellikle oksi- öneki kullanılır). Ana zincir olarak, bir hidroksil grubu ile ilişkili bir karbon atomu içeren en uzun dallanmamış karbon atomu zinciri seçilir; bileşik doymamışsa çoklu bağ da bu zincire dahildir. Numaralandırmanın başlangıcını belirlerken, hidroksil fonksiyonunun genellikle halojen, çift bağ ve alkile göre öncelikli olduğuna dikkat edilmelidir, bu nedenle numaralandırma, hidroksil grubunun bulunduğu zincirin sonundan başlar:

En basit alkoller, hidroksil grubunun bağlı olduğu radikallere göre adlandırılır: (CH3)2CHOH - izopropil alkol, (CH3)3COH - tert-bütil alkol.
Alkollerin rasyonel terminolojisi sıklıkla kullanılır. Bu terminolojiye göre, alkoller metil alkol - karbinol türevleri olarak kabul edilir:

Bu sistem, kök adının basit ve oluşturulması kolay olduğu durumlarda uygundur.
2. Alkollerin fiziksel özellikleri
Alkoller daha yüksek kaynama noktalarına sahiptir ve önemli ölçüde daha az uçucudur, daha yüksek erime noktalarına sahiptir ve karşılık gelen hidrokarbonlara göre suda daha fazla çözünür; ancak moleküler ağırlık arttıkça fark azalır.
Fiziksel özelliklerdeki fark, alkol moleküllerinin hidrojen bağı yoluyla birleşmesine yol açan hidroksil grubunun yüksek polaritesinden kaynaklanmaktadır:

Bu nedenle, alkollerin kaynama noktalarının karşılık gelen hidrokarbonların kaynama noktalarına göre daha yüksek olması, moleküllerin ek enerji gerektiren gaz fazına geçişi sırasında hidrojen bağlarını kırma ihtiyacından kaynaklanmaktadır. Öte yandan, bu tür bir ilişki, doğal olarak uçuculuğun azalmasına yol açan moleküler ağırlıkta bir artışa yol açar.
Düşük moleküler ağırlığa sahip alkoller suda oldukça çözünür, bu da su molekülleri ile hidrojen bağları oluşturma olasılığı göz önüne alındığında anlaşılabilir (suyun kendisi çok büyük ölçüde ilişkilidir). Metil alkolde hidroksil grubu, molekülün kütlesinin neredeyse yarısını oluşturur; bu nedenle, metanolün her bakımdan su ile karışabilir olmasına şaşmamak gerekir. Alkoldeki hidrokarbon zincirinin boyutu arttıkça, hidroksil grubunun alkollerin özellikleri üzerindeki etkisi sırasıyla azalır, maddelerin sudaki çözünürlüğü azalır ve hidrokarbonlardaki çözünürlüğü artar. Yüksek moleküler ağırlıklı monohidrik alkollerin fiziksel özellikleri, karşılık gelen hidrokarbonlarınkine zaten çok benzer.

Biri çeşitli alkoller olan organik oksijen içeren bileşikler, hidrokarbonların önemli fonksiyonel türevleridir. Tek atomlu, iki ve çok atomludurlar. Monohidrik alkoller, aslında, moleküler bileşeninde doymuş karbon atomları ile ilişkili bir hidroksil grubu ("-OH" ile gösterilir) bulunan hidrokarbonların türevleridir.
Yayma
Monohidrik alkoller doğada yaygın olarak bulunur. Bu nedenle, bazı bitkilerin (örneğin yaban otu) öz suyunda az miktarda metil alkol bulunur. Organik bileşiklerin alkollü fermantasyonunun bir ürünü olan etil alkol, asitlendirilmiş meyve ve meyvelerde bulunur. Setil alkol balina yağında bulunur. Balmumu, seril, mirisil alkolleri içerir. Gül yaprakları 2-feniletanol içerir. Kokulu maddeler formundaki terpen alkolleri birçok baharat-aromatik kültürde bulunur.
sınıflandırma
Alkoller, hidroksil gruplarının moleküler sayısına göre sınıflandırılır. Her şeyden önce:
- monohidrik alkoller (örn. etanol);
- iki atomlu (etandiol);
- çok atomlu (gliserin).
Hidrokarbon radikalinin doğasına göre alkoller aromatik, alifatik, siklik olarak ayrılır. Hidroksil grubu ile bağ yapan karbon atomunun türüne bağlı olarak, alkoller birincil, ikincil ve üçüncül olarak kabul edilir. Sınırlayıcı monohidrik alkollere uygulanan monohidrik alkolün genel formülü şu değerle ifade edilir: CnH2n+2O.

terminoloji
Radikal fonksiyonel terminolojiye göre alkollerin adı, radikalin hidroksil grubu ile ilişkili addan ve "alkol" kelimesinden oluşur. IUPAC sistematik terminolojisine göre, alkolün adı, "-ol" sonunun eklenmesiyle karşılık gelen alkanlardan oluşur. Örneğin:
- metanol - metil alkol;
- metilpropanol-1-2-izobütil (tert-bütil);
- etanol - etil;
- bütanol-1-2 - bütil (sek-bütil);
- propanol-1-2 - propil (izopropil).
IUPAC kurallarına göre numaralandırma, hidroksil grubunun konumuna göre sınıflandırılır, daha düşük bir sayı alır. Örneğin: pentandiol-2-4, 4-metilpentanol-2, vb.
izomerizm
Limit monohidrik alkoller aşağıdaki türler yapısal ve uzaysal izomerizm. Örneğin:
- Karbon iskelet.
- İzomerik eterler.
- Fonksiyonel grubun pozisyonları.
Alkollerin uzamsal izomerizmi, optik izomerizm ile temsil edilir. Molekülde asimetrik bir karbon atomunun (dört farklı ikame edici içeren) varlığında optik izomerizm mümkündür.

Monohidrik alkol elde etme yöntemleri
Ultimate'ı Alın monohidrik alkol birkaç şekilde yapılabilir:
- Haloalkanların hidrolizi.
- Alkenlerin hidrasyonu.
- Aldehit ve ketonların indirgenmesi.
- organomagnezyum sentezi.
Haloalkanların hidrolizi, alkollerin hazırlanması için en yaygın laboratuvar yöntemlerinden biridir. Su ile muamele edilerek (alternatif olarak - sulu bir alkali çözeltisi ile), birincil ve ikincil alkoller elde edilir:
CH3 - CH2 -Br + NaOH → CH3 - CH2 - OH + NaBr.
Tersiyer haloalkanlar daha kolay hidrolize edilirler, ancak daha kolay bir eliminasyon yan reaksiyonuna sahiptirler. Bu nedenle, üçüncül alkoller başka yöntemlerle elde edilir.
Alkenler, asit içeren katalizörlerin (H3P04) varlığında alkenlere su eklenerek hidratlanır. Yöntem, etil, izopropil, tert-bütil gibi alkollerin endüstriyel üretiminin temelini oluşturur.
Karbonil grubunun indirgenmesi, bir hidrojenasyon katalizörü (Ni veya Pt) varlığında hidrojen ile gerçekleştirilir. Bu durumda, ketonlardan ikincil alkoller ve aldehitlerden birincil doymuş monohidrik alkoller oluşur. İşlem formülü:
CH3 - C \u003d O (-H) + H2 (etanal) → CH3 - CH2 - OH (etanol).
Magnezyum organik bileşikleri, aldehit ve ketonlara alkilmagnezyum halojenürlerin eklenmesiyle elde edilir. Reaksiyon, kuru dietil eter içinde gerçekleştirilir. Organomagnezyum bileşiklerinin müteakip hidrolizi monohidrik alkolleri oluşturur.
Birincil alkoller, yalnızca formaldehit ve herhangi bir alkilmagnezyum halojenürden Grignard reaksiyonu ile oluşturulur. Diğer aldehitler bu reaksiyonla ikincil alkoller, ketonlar - üçüncül alkoller verir.

Metanolün endüstriyel sentezi
Endüstriyel yöntemler, kural olarak, gaz fazında gerçekleştirilen, büyük reaktan kütlelerinin çoklu yeniden sirkülasyonu ile sürekli işlemlerdir. Endüstriyel olarak önemli alkoller metanol ve etanoldür.
Metanol (üretim hacimleri alkoller arasında en büyüğüdür) 1923 yılına kadar ahşabın kuru damıtılmasıyla (hava erişimi olmadan ısıtma) elde edildi. Bugün sentez gazından (CO ve H 2 karışımı) üretilir. İşlem 250-400˚C sıcaklık aralığında oksit katalizörler (ZnO + Cr 2 O 3 , CuO + ZnO + Al 2 O 3 ve diğerleri) kullanılarak 5-10 MPa basınçta gerçekleştirilir, sonuç olarak, doymuş monohidrik alkoller elde edildi. Reaksiyon formülü: CO + 2H2 → CH3OH.
1980'lerde, bu sürecin mekanizmasını incelerken, metanolün karbon monoksitten değil, karbon monoksitin eser miktarda su ile etkileşiminden kaynaklanan karbondioksitten oluştuğu bulundu.

Etanolün endüstriyel sentezi
Teknik etanolün sentezi için yaygın bir üretim yöntemi, etilenin hidrasyonudur. Monohidrik alkol etanol formülü aşağıdaki formu alacaktır:
CH2 \u003d CH2 + H20 → CH3 - CH2OH.
İşlem 6-7 MPa basınç altında gaz fazında katalizör üzerinden etilen ve su buharı geçirilerek gerçekleştirilir. Katalizör, silis jel üzerinde biriken fosforik veya sülfürik asittir.
Gıda ve Medikal etanolüzümlerde, meyvelerde, tahıllarda, patateslerde bulunan şekerlerin enzimatik hidrolizi ve ardından elde edilen glikozun fermantasyonu ile elde edilir. Şekerli maddelerin fermantasyonu, enzim grubuna ait maya mantarları tarafından gerçekleştirilir. İşlem için en uygun sıcaklık 25-30˚С'dir. Endüstriyel işletmelerde, ahşabın hidrolizi sırasında oluşan karbonhidratların ve kağıt hamuru ve kağıt üretiminden kaynaklanan atıkların fermantasyonu ile elde edilen etanol kullanılır.

Monohidrik alkollerin fiziksel özellikleri
Alkol moleküllerinde, elektronegatif bir elementle ilişkili hidrojen atomları vardır - oksijen, pratik olarak elektronlardan yoksundur. Bu hidrojen atomları ile yalnız elektron çiftlerine sahip oksijen atomları arasında moleküller arası hidrojen bağları oluşur.
Hidrojen bağı nedeniyle spesifik özellikler hidrojen atomu:
- Bağlayıcı elektronlar daha elektronegatif bir atoma çekildiğinde, hidrojen atomunun çekirdeği "çıplaktır" ve diğer elektronlar tarafından korunmayan bir proton oluşur. Başka herhangi bir atom iyonize olduğunda, elektron kabuğu çekirdeği taramaya devam eder.
- Hidrojen atomu, diğer atomlara kıyasla küçük bir boyuta sahiptir, bunun bir sonucu olarak, bir kovalent bağ ile bağlanmadan, komşu negatif polarize bir atomun elektron kabuğuna oldukça derinden nüfuz edebilmektedir.
Hidrojen bağı, normal kovalent bağdan yaklaşık 10 kat daha zayıftır. Hidrojen bağı enerjisi 4-60 kJ/mol aralığında, alkol molekülleri için 25 kJ/mol'dür. Uzunluğuna kıyasla daha uzun olması (0.166 nm) ile sıradan s-bağlarından farklıdır. OH bağları(0.107 nm).
Kimyasal özellikler
Monohidrik alkollerin kimyasal reaksiyonları, moleküllerinde fonksiyonel olan bir hidroksil grubunun varlığı ile belirlenir. Oksijen atomu sp3 hibrit durumundadır. Bağ açısı dörtyüzlüye yakındır. İki sp3-hibrit orbital, diğer atomlarla bağ oluşturmaya gider ve diğer iki orbital, yalnız elektron çiftleri içerir. Buna göre, kısmi bir negatif yük oksijen atomu üzerinde yoğunlaşır ve kısmi pozitif yükler hidrojen ve karbon atomları üzerinde yoğunlaşır.
C-O ve C-H bağları kovalent polardır (ikincisi daha polardır). OH bağının H + oluşumu ile heterolitik bölünmesi, monohidrik alkollerin asidik özelliklerini belirler. Kısmi pozitif yüklü bir karbon atomu, bir nükleofilik reaktif tarafından saldırıya uğrayabilir.

Asit özellikleri
Alkoller çok zayıf asitler, sudan daha zayıf ama asetilenden daha güçlü. Göstergenin rengini değiştirmezler. Monohidrik alkollerin oksidasyonu, aktif metaller (alkali ve toprak alkali) ile hidrojen salınımı ve alkolat oluşumu ile etkileşime girdiğinde kendini gösterir:
2ROH + 2Na → 2RONa + H2.
Alkali metal alkolatlar, oksijen ve sodyum arasında iyonik bağa sahip maddelerdir; monohidrik alkol çözeltisinde alkoksit iyonları oluşturmak üzere ayrışırlar:
CH3ONa → CH3O - + Na + (metoksit iyonu).
Alkolatların oluşumu, alkolün sodyum amid ile reaksiyonuyla da gerçekleştirilebilir:
C2H5OH + NaNH2 → C2H5ONa + NH3.
Etanol alkali ile reaksiyona girer mi? Neredeyse hiç. Su, etil alkolden daha güçlü bir asit olduğu için burada bir denge kurulur. Alkol molekülündeki hidrokarbon radikalinin uzunluğunun artmasıyla asidik özellikler azalır. Ayrıca, doymuş monohidrik alkoller, serideki asitlikte bir azalma ile karakterize edilir: birincil → ikincil → üçüncül.
Nükleofilik ikame reaksiyonu
Alkollerde, C-O bağı polarize edilir ve kısmi bir pozitif yük, karbon atomu üzerinde yoğunlaşır. Sonuç olarak, karbon atomu nükleofilik parçacıklar tarafından saldırıya uğrar. kırılma sürecinde C-O bağları hidroksil grubu, başka bir nükleofil ile değiştirilir.
Bu reaksiyonlardan biri, alkollerin hidrojen halojenürler veya konsantre çözeltileri ile etkileşimidir. Reaksiyon denklemi:
C2H5OH + HBr → C2H5Br + H20.
Hidroksil grubunun ortadan kaldırılmasını kolaylaştırmak için katalizör olarak konsantre sülfürik asit kullanılır. Oksijen atomunu protonlayarak monohidrik alkol molekülünü aktive eder.
Birincil alkoller, birincil haloalkanlar gibi, SN 2 mekanizmasına göre değişim reaksiyonlarına girerler. İkincil haloalkanlar gibi ikincil monohidrik alkoller hidrohalik asitlerle reaksiyona girer. Alkollerin etkileşim koşulları, reaksiyona giren bileşenlerin doğasına tabidir. Alkollerin reaktivitesi aşağıdaki kalıba uyar:
R3COH → R2CHOH → RCH2OH.
Oksidasyon
Hafif koşullarda (nötr veya alkali çözeltiler Potasyum permanganat, krom karışımı 40-50 °C sıcaklıkta) birincil alkoller daha fazla ısıtıldığında aldehitlere oksitlenir. Yüksek sıcaklık- asitlere. İkincil alkoller, ketonlara oksidasyon sürecinden geçer. Üçüncül olanlar, çok sert koşullar altında (örneğin, 180 ° C sıcaklıkta bir krom karışımı ile) asit varlığında oksitlenir. Üçüncül alkollerin oksidasyon reaksiyonu, bir alken oluşumu ile alkolün dehidrasyonu ve çift bağın kırılması ile ikincisinin oksidasyonu yoluyla ilerler.
Bileşimlerinde bir veya daha fazla hidroksil grubu içerenler. OH gruplarının sayısına bağlı olarak, bunlar monohidrik alkoller, trihidrik vb. olarak ayrılır. Çoğu zaman, bu karmaşık maddeler, molekülleri değişikliğe uğramış olan hidrokarbonların türevleri olarak kabul edilir, çünkü. bir veya daha fazla hidrojen atomu, bir hidroksil grubu ile değiştirilmiştir.
Bu sınıfın en basit temsilcileri, genel formülü şöyle görünen monohidrik alkollerdir: R-OH veya

Cn + H2n + 1OH.
- 15'e kadar karbon atomu içeren alkoller sıvı, 15 ve daha fazlası katıdır.
- Suda çözünürlük moleküler ağırlığa bağlıdır, ne kadar yüksekse, alkol suda o kadar kötü çözülür. Bu nedenle, düşük alkoller (propanole kadar) su ile herhangi bir oranda karışabilirken, daha yüksek olanlar pratikte suda çözünmez.
- Arttıkça kaynama noktası da artar atomik kütle, örneğin, t kip. CH3OH \u003d 65 ° С ve t bp. С2Н5ОН = 78 ° С.
- Kaynama noktası ne kadar yüksek olursa, uçuculuk o kadar düşük olur, yani madde iyi buharlaşmaz.
Veri fiziki ozellikleri bir hidroksil grubuna sahip doymuş alkoller, bileşiğin kendi molekülleri veya alkol ve su arasında moleküller arası bir hidrojen bağının oluşmasıyla açıklanabilir.
Monohidrik alkoller bu gibi durumlara girebilir. kimyasal reaksiyonlar:

düşündükten sonra Kimyasal özellikler alkoller, monohidrik alkollerin amfoterik bileşikler olduğu sonucuna varabiliriz, tk. ile reaksiyona girebilirler alkali metaller, zayıf gösteren ve hidrojen halojenürlü, temel özellikler gösteren. Tüm kimyasal reaksiyonlar bir boşlukla gider O-N bağlantıları veya S-O.
Böylece, doymuş monohidrik alkoller karmaşık bağlantılar bir OH grubu ile, oluşumdan sonra serbest değerleri yoktur C-C bağlantıları ve hem asitlerin hem de bazların zayıf özelliklerini sergilemek. Fiziksel ve kimyasal özelliklerinden dolayı buldukları geniş uygulama organik sentezde, çözücülerin, yakıt katkı maddelerinin üretiminde ve ayrıca Gıda endüstrisi, tıp, kozmetoloji (etanol).