giriiş
Geçen yüzyılın altmışlı yıllarına gelindiğinde, organik kimya, açıklama gerektiren büyük miktarda gerçek materyal biriktirmişti. Deneysel gerçeklerin sürekli birikiminin arka planına karşı, organik kimyanın teorik kavramlarının yetersizliği özellikle keskindi. Teori, uygulama ve deneyin gerisinde kaldı. Bu gecikme, laboratuvarlardaki deneysel araştırmaların seyrine acı bir şekilde yansıdı; kimyagerler, araştırmalarını büyük ölçüde rastgele, körü körüne, çoğu zaman sentezledikleri maddelerin doğasını ve oluşumlarına yol açan reaksiyonların özünü anlamadan yürüttüler. Örneğin, 1856'da saf olmayan anilinin oksidasyonu ile leylak rengi boyayı sentezleyen İngiliz V. Perkin Sr., keşfettiği reaksiyonun mekanizması hakkında kesinlikle hiçbir fikri yoktu; ayrıca boyayı sentezleme görevini hiç üstlenmedi, kinin elde etmeye çalıştı. Organik kimya, Wöhler'in yerinde ifadesiyle, harika şeylerle dolu yoğun bir ormana, çıkışı ve sonu olmayan devasa bir çalılığa benziyordu.
Organik kimyanın acil sorunları, temel sorunun çözümünü gerektiriyordu: moleküller, çekici kuvvetler tarafından bir arada tutulan rastgele bir atom yığını mı, yoksa bir maddenin özelliklerinin incelenmesiyle belirlenebilen belirli bir yapıya sahip molekül parçacıkları mı? Gerard'ın, o zamanın çoğu kimyacı tarafından belirli çekincelerle tanınan tipler teorisi, kimyasal özelliklerin incelenmesine dayanan moleküllerin yapısı sorununu çözmeyi reddetti. Bu arada, organik kimyada, o zamana kadar bu sorunu çözmenin temeli olarak hizmet edebilecek gerçekler ve genellemeler birikmişti. Böylece, örneğin, radikaller teorisi, organik kimyaya, kimyasal reaksiyonlar sırasında belirli atom gruplarının, başlangıç maddelerinin moleküllerinden bu reaksiyonlarda oluşan moleküllere değişmeden geçmesi gerçeğinden oluşan son derece önemli bir genelleme verdi. Türler teorisi, kendi payına, moleküllerin en değişken kısımlarının ve bu değişkenliğin nedenlerinin araştırılmasına büyük ölçüde katkıda bulunmuştur.
Bölüm 1
1.1. Elementlerin değerliklerinin keşfi
Organometalik bileşiklerin bileşimini araştıran Frankland (1853), her metalin kesin olarak tanımlanmış sayıda radikale sahip bileşikler verdiğini; bu sayı metalin değeridir. Aşağıda bir, iki, üç ve dört değerlikli metallerin en basit organometalik bileşikleri verilmiştir:
Frankland'ın keşfinden sonra, atomların ancak atomların değerlikleriyle belirlenen ilişkilerde birleşerek moleküller oluşturabileceği anlaşıldı. Özellikle karbonun dört değerlikli olduğu tespit edilmiştir (Kukule, Kolbe).
Değerlik keşfi, doğrudan moleküllerin belirli bir yapıya sahip olduğu fikrine yol açtı. Bununla birlikte, moleküllerin yapısını oluşturmanın yolları ve bir maddenin özelliklerinin moleküllerinin yapısına bağımlılığı ile ilgili sorular açık kaldı.
Kimyasal yapı teorisinin ortaya çıkmasıyla organik kimyada yeni bir dönem başladı. Yapı teorisinin yaratılması, doğrulanması ve onaylanmasındaki ana rol, ünlü Rus bilim adamı Alexander Mihayloviç Butlerov'a aittir., onun yanında olsa da, bu teorinin unsurları İngiltere'de A. Cooper (1831-1892) ve Almanya'da A. Kekule (1829-1896) tarafından geliştirilmeye başlandı.
1.2. A. Cooper'ın gelişmeleri
1858'de Cooper, üç dilde (İngilizce, Fransızca ve Almanca) "Yeni bir kimyasal teori üzerine" bir makale yayınladı, burada tür teorisini reddetti ve organik maddelerin tüm özelliklerinin mümkün olduğu bakış açısını ifade etti. atomların sadece iki özelliği dikkate alınırsa açıklanabilir: "seçici afinite" (atomların bağlantısı) ve "afinite derecesi" (atomların değerliliği).
Cooper şunları yazdı: “Benim bakış açıma göre, bu iki özellik organik kimyanın tüm karakteristik özelliklerini açıklamak için yeterlidir: Aşağıda kanıtlayacağım şey bu… Üç, dört, beş vb. karbon atomundan oluşan bir molekülde ve eşdeğer miktarda hidrojen, oksijen vb., ikincisi diğer elementler ile değiştirilebilirken, karbon birbirine bağlı bir düğüm oluşturur. Demek oluyor bir karbon başka bir karbona bağlanır. Bu özellik, tabiri caizse, karbona özel bir fizyonomi verir ve organik bileşiklerde karbon atomlarının katmanlaşmasının önceden anlaşılmaz gerçeğini anlamayı mümkün kılar.
Böylece karbon atomlarının zinciri hakkında önemli bir fikre ulaşan Cooper, görüşlerini, planına göre bileşiklerin yapısının bir resmini vermesi gereken formüllerde daha da ifade eder. İlk anayasal formüller olan formüllerine örnek olarak aşağıdakiler verilebilir:

Bu örneklerden, Cooper'ın bu bileşiklerin yanı sıra daha karmaşık ve o zamanlar çok az çalışılan (tartarik ve tartarik asitler) bazılarının yapısını şaşırtıcı bir şekilde doğru bir şekilde aktarabildiği görülebilir.
Ancak, tüm bu formüller deneysel kanıtlardan yoksun bırakıldı. Cooper, deneysel doğrulama olasılığı sorusunu hiç gündeme getirmedi. Onun formülleri, kolayca görülebileceği gibi, değerlik ve atomların bağlanması kavramlarının biçimsel bir yorumuna ve hatta kısmen sezgiye dayanıyordu. Doğal olarak, bu yaklaşımla hatalardan kaçınmak imkansızdır. Örneğin, Cooper tarafından verilen gliserol, gliserik asit ve oksalik asit formülleri zaten yanlıştır:

Dolayısıyla Cooper'ın yetenekli, ilginç çalışmasında geliştirdiği görüşleri titiz bir teori niteliği taşımamaktadır.
1.3. Loschmidt'in anayasal formülleri
Başka 1861'de Loschmidt, organik bileşikleri yapısal formüllerle tasvir etme girişiminde bulundu. . Loschmidt, formüllerini oluştururken atomları, çekim ve itme kuvvetlerinin etkisine maruz kalan en küçük maddi parçacıklar olarak gördü. Bu kuvvetler, atomlar birbirine yaklaştığında dengelenir ve çeşitli atomlar belirli bir denge konumunda birbirine yakın tutulur. Loschmidt, atom kuvvetlerinin etki alanlarını dairelerle keyfi olarak gösterdi (örneğin, karbon ve hidrojen atomları - basit daireler, oksijen - çift, azot - üçlü).
Loschmidt'in formülleri aşağıdaki forma sahipti:

Loschmidt, benzen molekülündeki altı karbon atomunun bağlanma şekli hakkında herhangi bir fikir oluşturmaya çalışmadan, benzeni simgesiyle ifade etmiştir.

Cooper'ın aksine, formülleri seçerken Loschmidt, değerliliğe ek olarak (ifadesinde "polentity") bazen kimyasal özellikler tarafından yönlendirildi. Bununla birlikte, genel olarak, Loschmidt'in formüllerini türetme yöntemi soyuttu ve çoğu zaman basitçe mantıksızdı. Böylece, Loschmidt kimyasal verilere dayanmadan indigo, ürik asit vb. gibi karmaşık maddeler için formüller türetmeye çalıştı.
Doğal olarak, bu formüllerin hatalı olduğu ortaya çıktı. Loschmidt tarafından önerilen organik bileşiklerin formüllerinin çoğunun başarılı olmasına rağmen, çalışmaları o zamanın kimyagerleri tarafından neredeyse fark edilmedi ve organik kimya teorisinin gelişimi üzerinde önemli bir etkisi olmadı.
1.4. Yapısal teorinin oluşturulmasına katkı Kekule
Ünlü Alman kimyager tarafından yapısal teorinin yaratılmasına büyük katkı yapıldı. Kekule. Karbonun tetravalansını belirledi, metan türünü tanıttı, iyi bilinen benzen formülünü önerdi ve en önemlisi, o zamanın organik kimyasının ana problemlerinden birini doğru bir şekilde formüle etti.
1858'de "Kimyasal bileşiklerin oluşumu ve dönüşümleri ve karbonun kimyasal doğası üzerine" makalesinde Kekule şunları yazdı:: “Şu anda kimyanın ana görevinin, bazı özelliklerinden dolayı radikal olarak kabul edilebilecek atomik grupların keşfi ve bileşiklerin başka bir anlamı olmayan belirli türlere atanması olmadığına inanıyorum. örnek formüller olarak değil. Tam tersine, düşünceyi radikallerin kendi yapılarına kadar genişletmek gerektiğine inanıyorum; elementlerin doğasından hem radikallerin doğası hem de bileşikleri çıkarılmalıdır. Bunun için çıkış noktası Kekule, "elementin bazlığı" (valans) ve organik bileşiklerle ilgili olarak her şeyden önce karbonun doğasını ele aldı. Kekule ayrıca atomların bağlantısı hakkında bir dizi başka doğru düşünceyi de grafik formüllerde ifade ederek dile getirdi. Ancak Kekule, formüllerine yapının formüllerine önem vermemiş, onlarla sadece tepkisellik ifade etmeye çalışmıştır. Bu yüzden şöyle yazdı: “Rasyonel formüller, bileşiğin kimyasal doğası, dolayısıyla metamorfozları ve diğer cisimlerle olan ilişkisi hakkında kesin bir fikir vermeyi amaçlar ... Aynı zamanda, doğal olarak, akılcı formüllerin - bunlar yalnızca dönüşüm formülleridir ve anayasal formüller değildir, bunların yalnızca cisimlerin başkalaşımları için bir ifade aracı ve çeşitli maddeleri birbirleriyle karşılaştırmanın sonuçları olduğu akılda tutulmalıdır; hiçbir durumda yapıyı, yani karşılık gelen bileşikteki atomların düzenini ifade etmemelidirler.
Moleküllerin gerçek yapısını oluşturma Kekule de kimyanın görevini düşündü, ancak onun görüşüne göre bu, kimyasal dönüşümleri inceleyerek değil, yalnızca bileşiklerin fiziksel özelliklerinin karşılaştırmalı bir çalışmasıyla başarılabilir. Böylece bu konuda da Kekule, Gérard'ın pozisyonunda durdu.
Diğer tip teorisyenleri gibi, Kekule de maddeyi birkaç tipik formülle tasvir etmiştir. Örneğin, asetik asidin o zamanlar bilinen kimyasal özelliklerini aktarmak için Kekule, onu sekiz formülle temsil etmeyi önerdi. Böylece Kekule'nin görüşleri yeni yapısal görüşlere yakın olmasına rağmen, Kekule kimyasal yapı teorisinin gelişimine önemli bir katkı sağlasa da, kendisini tip teorisi fikirlerinden tamamen kurtaramadı.
Bölüm 2. A.M.'nin kimyasal yapısı teorisi Butlerov
2.1. Butlerov'un fikirleri
A. M. Butlerov, tip teorisinin, moleküllerin yapısını kimyasal yollarla oluşturmanın imkansızlığı konusundaki pozisyonuna karşı çıktı; bunu gösterdi bir molekülde atomların belirli bir kimyasal bağı dizisi vardır (kimyasal yapı). Butlerov ayrıca kanıtladı bir molekülün yapısı, bir maddenin kimyasal özellikleri incelenerek oluşturulabilir ve tersine, yapı bilinerek bir bileşiğin birçok özelliği öngörülebilir. Butlerov, bu pozisyonu yalnızca halihazırda mevcut olan olgusal materyallerle doğrulamakla kalmadı, aynı zamanda daha sonra kendisi ve diğer kimyagerler tarafından keşfedilen yeni maddelerin varlığının olasılığını da tahmin etti.
A. M. Butlerov'un teorisinin ana fikri, 1861'de “Maddelerin kimyasal yapısı hakkında” makalesinde formüle edildi.Şöyle yazdı: “Vücudun parçası olan her kimyasal atomun bu ikincisinin oluşumunda yer aldığı ve burada kendisine ait belirli bir miktarda kimyasal kuvvet (afinite) ile hareket ettiği fikrinden yola çıkarak, kimyasal yapıya dağılım diyorum. Bu kuvvetin etkisinin, hangi kimyasal atomların birbirlerini dolaylı veya doğrudan etkilediğinden dolayı, kimyasal bir parçacık halinde birleşmesi.
Butlerov'un teorisinin temeli, bir moleküldeki atomların kimyasal etkileşim sırası fikridir. . Bu kimyasal etkileşim sırası, kimyasal bağların mekanizması ve atomların fiziksel düzenlenişi hakkındaki fikirleri içermez. Kimyasal yapı teorisinin bu önemli özelliği, bir molekülün fiziksel bir modelini oluştururken her zaman ona güvenmeyi mümkün kılar.
Kimyasal yapı kavramını kuran A. M. Butlerov yeni bir tanım veriyor. maddenin doğası : « karmaşık bir parçacığın kimyasal yapısı, temel bileşenlerin doğası, bunların miktarı ve kimyasal yapısı ile belirlenir. ».
Böylece, A. M. Butlerov, bunu ilk tespit eden kişi oldu. her molekülün belirli bir kimyasal yapısı vardır, bu yapı maddenin özelliklerini belirler ve bir maddenin kimyasal dönüşümlerini inceleyerek onun yapısını belirleyebilir. .
2.2. Kimyasal yapı formülleri
A. M. Butlerov'un kimyasal yapı formüllerinin önemi hakkındaki görüşleri, teorisinin ana hükümlerinden kaynaklanmaktadır. Butlerov, bu formüllerin "tipik", "gerici" değil, anayasal olması gerektiğine inanıyordu. Bu anlamda, her madde için, kimyasal özelliklerin yargılanabileceği yalnızca bir rasyonel formül mümkündür.
Yapısal formüller yazma yöntemine gelince, Butlerov haklı olarak bu konuyu ikincil öneme sahip olarak değerlendirdi: “Meselenin biçimde değil, özünde, kavramda, fikirde olduğunu ve izomerizmi ifade eden formüllerin dikkate alındığını hatırlamak. Mevcut parçacığı, yani içinde var olan belirli kimyasal ilişkileri ifade etmek mantıksal olarak gereklidir, ancak bu ilişkileri uygun bir şekilde ifade ederse, herhangi bir yazma yönteminin iyi olabileceği sonucuna varmak zor değildir. Belirli bir durum için daha anlamlı olanı tercih ederek farklı yollar kullanmak bile oldukça doğaldır. Örneğin, etan C2H6 neredeyse kayıtsız bir şekilde tasvir edilebilir:
Ancak, yetersiz tanımlanmış bir anlayışla, farklı bir yazma şekli şaşkınlığa yol açabilir.
2.3. Kimyasal yapı teorisinin değeri, rolü
Kimyasal yapı teorisinin ortaya çıkışıyla birlikte, organik kimya tipik formüllerin labirentinden ortaya çıktı; moleküllerin iç yapısı bilgisine giden yollar gösterildi; kimyasal süreçleri anlamak, organik bileşikleri sentezlemenin yeni yollarını tahmin etmek için teorik bir temel ortaya çıktı. Kimyasal yapı teorisi, başlangıcından bu yana, kimyagerlerin deneysel araştırmaları amaçlı ve amaçlı bir şekilde yürütmesini mümkün kılmıştır.
Kimyasal yapı teorisinde dikkate değer bir başarı, geçen yüzyılın ilk çeyreğinde keşfedilen izomerizm olgusunun açıklamasıydı.
Bildiğiniz gibi, 18. yüzyılın sonunda, verilen her maddenin belirli, sabit bir bileşime sahip olduğu, bileşimin değişmezliği yasası kuruldu. Birkaç on yıl boyunca, bu yasaya zıt anlam da verildi, yani yalnızca belirli bir maddenin belirli bir kesin bileşime sahip olduğuna inanılıyordu. İkinci pozisyonun yanlışlığı, bir dizi organik maddenin çalışmasının bir sonucu olarak gösterildi. 1823'te fulminik asidin gümüş tuzunu inceleyen Liebig, bileşiminin (AgCNO), ondan keskin bir şekilde farklı olan 1822'de Wöhler tarafından elde edilen gümüş izosiyanatın bileşimi ile aynı olduğunu buldu.
Bu dikkate değer gerçek uzun süre izole kalmadı; aynı bileşime sahip ancak farklı özelliklere sahip birçok başka madde kısa sürede keşfedildi. 1830'dan beri keşfedilen fenomene izomerizm (Yunancadan - aynı parçalardan oluşur) ve aynı bileşime sahip maddeler - izomerler olarak adlandırılmaya başlandı. İzomerizmi radikaller teorisi ve tip teorisi ile açıklama girişimleri (bu teorilerin kendileri gibi) tek taraflıydı ve bu nedenle tatmin edici sonuçlar vermedi. Aslında, neredeyse kırk yıldır, izomerizm olgusu teorik bir açıklama bulamadı.
Böyle bir açıklama, ancak bir maddenin doğasının sadece molekülü oluşturan atomların doğası ve sayısı ile değil, aynı zamanda yapısı, kimyasal yapısı ile de belirlendiği kimyasal yapı teorisinin yaratılmasından sonra mümkün oldu. Bundan, şüphesiz, aynı bileşime ve moleküler ağırlığa sahip olan ve yine de eşit olmayan kimyasal yapı nedeniyle tamamen farklı olan maddelerin var olma olasılığını takip eder. Böylece kimyasal yapıdaki fark, izomerizm olgusunun doğal ve basit bir açıklamasıydı.
2.4. Butlerov'un dinamik izomerizm fenomenini keşfetmesi
bu not alınmalı A. M. Butlerov ilk kez dinamik izomerizm fenomenini keşfetti ve açıkladı , belirli koşullar altında iki veya daha fazla izomerin kolayca birbirine geçmesi gerçeğinden oluşur (bu fenomen şu anda totomerizm olarak adlandırılır). Bir bütün olarak izomerizm sorunu, Butler'ın teorisi için ciddi bir testti ve onun tarafından zekice çözüldü.
A. M. Butlerov'un öğretilerinin önemli bir özelliği, molekülü hiçbir şekilde tek tek atomların ölü, cansız bir yapıya bağlandığı bir tür hareketsiz oluşum olarak görmemesidir. . Bu konuyla ilgili şunları yazdı:
“... şu anda kimyasal bir bileşiğe ölü, hareketsiz bir şey olarak bakmıyoruz; tersine, en küçük parçacıklarında yer alan, belirli karşılıklı ilişkileri sürekli değişikliklere tabi olan, bu durumda belirli bir sabit ortalama sonuçla özetlenen sabit bir hareketle donatıldığını kabul ediyoruz. Burada maddelerin kütlesini oluşturan kimyasal parçacıklarda da sürekli değişiklikler olabilir, ancak tüm bunlar kütlenin kendisinin belirli bir ortalama durumuna indirgenir. Tek kelimeyle, genel olarak, her zaman önümüzde belirli bir hareketli denge durumu vardır. Kimyasal bileşiğin doğası ve kimyasal reaksiyonlar hakkındaki bu dinamik bakış açısından, önceki bakış açısından tamamen anlaşılmaz olan bu tür fenomenleri açıkça açıklıyoruz. Örneğin, ayrışmaya, şimdi geri tepkileri ne kadar kolay açıkladığımıza vb. işaret etmeye değer. ”
2.5. Butlerov'un önceliklerini savunması. D.I. Mendeleev'in rolü
A. M. Butlerov tarafından kısa sürede formüle edilen kimyasal yapı teorisinin açık, reddedilemez hükümleri, evrensel olarak tanınmasını sağlamıştır. Bununla birlikte, aynı zamanda, A. M. Butlerov'un esasını örtbas etme ve yapı teorisinin yaratıcıları olarak sadece Kekule ve Cooper'ı sunma eğilimi vardı.
Yapı teorisinin yaratılmasından birkaç yıl sonra, A. M. Butlerov önceliğini savunmak zorunda kaldı, çünkü ilk başta teorisini tanımayan ve hatta anlamayan bazı yabancı kimyagerler daha sonra ana hükümleri yaratma onurunu atfetmeye çalıştılar. bu teorinin kendilerine
A. M. Butlerov'un kimyasal yapı teorisinin yaratılmasındaki belirleyici rolü, 1868'de büyük Rus bilim adamı D. I. Mendeleev tarafından açıkça vurgulandı. , A. M. Butlerov'u St. Petersburg Üniversitesi'ne tavsiye etmek. Mendeleev, Butlerov'un “... yine kimyasal dönüşümleri inceleyerek, heterojen elementleri bir arada tutan bağların derinliklerine nüfuz etmeye çalıştığını, her birine bilinen sayıda bileşiğe girme konusunda doğuştan gelen bir yetenek verdiğini ve özelliklerindeki farklılık, elemanları farklı bir şekilde bağlama. Daha önce incelenmiş olmalarına rağmen, hiç kimse bu düşünceleri onun kadar tutarlı bir şekilde takip etmedi ... Tüm organik bileşik sınıflarına aynı şekilde bakmak için Butlerov 1864'te bir kitap yayınladı: "Organik Kimyanın Komple Çalışmasına Giriş ", geçen yıl Butlerov tarafından Almanca'ya çevrildi, okumaları ve fikirlerin büyüsü ile Kazan'da kendi yönünde çalışan bir kimyagerler okulu kurdu. Markovnikov, Myasnikov, Popov, iki Zaitsev, Morgunov ve diğerlerinin isimleri, esas olarak Butleroz hareketinin bağımsızlığı nedeniyle yapılan birçok keşifle ün kazanmayı başardı. Wurtz ve Kolbe gibi Fransız ve Alman bilim adamlarının Butlerov'u zamanımızda kimyadaki teorik eğilimin en etkili hareket ettiricilerinden biri olarak gördüklerine şahsen tanıklık edebilirim.
A. M. Butlerov, haklı olarak, kimyasal yapı teorisinin yeni olgusal materyaller biriktikçe gelişeceğine inanıyordu.. Şöyle yazdı: “...Kimyasal yapı ilkesinin vardığı sonuçların binlerce durumda gerçeklerle tutarlı olduğunu görmeden edemiyorum. Herhangi bir teoride olduğu gibi ve burada elbette eksiklikler, kusurlar var - kimyasal yapı kavramına tam olarak uymayan gerçekler var. Elbette bu tür gerçeklerin yeniden üretilmesini özellikle istemek gerekir; Mevcut teoriler tarafından açıklanmayan gerçekler bilim için en pahalı olanlardır ve gelişmelerinden yakın gelecekte gelişmesini beklemek gerekir.
Çözüm
Kimyasal yapı teorisi, 19. yüzyılın ortalarında, Rusya'da yeni burjuva sosyo-ekonomik ilişkilerin büyüdüğü ve üretici güçlerin büyümesinin doğa biliminin güçlü gelişimine yol açtığı bir zamanda A. M. Butlerov tarafından yaratıldı. Bu dönemde, I. M. Sechenov ve ardından I. P. Pavlov, insan ve hayvanların daha yüksek sinirsel aktivitesine dair materyalist bir doktrin yarattı, K. A. Timiryazev ve bir süre sonra I. V. Michurin, biyolojinin gelişiminde yeni bir aşamanın temelini attı, D. I. Mendeleev keşfetti en önemli doğa yasası - o sırada mevcut olan kimyasal elementler hakkındaki tüm bilgileri genelleştiren periyodik yasa. N. I. Lobachevsky yeni bir matematik alanı açar.
Kimyasal yapı teorisi, organik kimyanın olgusal materyalinin bilimsel bir sistemleştirilmesi olasılığını yarattı, en önemli düzenliliklerini açıkladı ve yeni gerçekleri tahmin etmenin anahtarını sağladı. Modern organik kimyanın yaratılmasının bilimsel temeliydi. Organik kimyanın modern teorik kavramlarının temelini oluşturdu. Bugün bu teorinin özü şu şekilde ifade edilebilir: organik bileşiklerin fiziksel ve kimyasal özellikleri, moleküllerinin bileşiminin yanı sıra kimyasal, uzamsal ve elektronik yapı tarafından belirlenir.
bibliyografya
1. Yapay Zeka Artemenko "Organik Kimya": Bina için bir ders kitabı. uzman. üniversiteler. – 4. baskı, gözden geçirilmiş. ve ek - M.: Yüksek okul; 2000. - 559 s.: hasta.
2. A.E. Chichibabin "Organik Kimya": Üniversiteler için ders kitabı. - T. 1-2. Ed. 3, isp. ve ek 1963. - 910 s.
Hidrojen tipi:
Bu tür formüller modern olanlara biraz benzer. Ancak tip teorisinin savunucuları, bunların maddelerin gerçek yapısını yansıttığını düşünmediler ve bu formülleri kullanarak yazmaya çalıştıkları kimyasal reaksiyonlara bağlı olarak bir bileşik için birçok farklı formül yazdılar. Moleküllerin yapısının temelde bilinemez olduğunu düşündüler ve bu da bilimin gelişmesine zarar verdi.
3. J. Berzelius tarafından 1830'da aynı bileşimde ve farklı özelliklere sahip maddelerin varlığı olgusu için "izomerizm" teriminin kullanılması.
4. Organik bileşiklerin sentezindeki başarılar, bunun sonucunda canlıların vücudunda organik maddelerin oluştuğu iddia edilen "yaşam gücü" olan vitalizm doktrini ortadan kaldırıldı:
1828'de F. Wehler, inorganik bir maddeden (amonyum siyanat) üre sentezledi;
1842'de Rus kimyager N. N. Zinin anilin aldı;
1845'te Alman kimyager A. Kolbe asetik asidi sentezledi;
1854'te Fransız kimyager M. Berthelot yağları sentezledi ve sonunda,
1861'de A. M. Butlerov'un kendisi şeker benzeri bir madde sentezledi.
5. XVIII yüzyılın ortalarında. kimya daha titiz bir bilim haline gelir. E. Frankland ve A. Kekule'nin çalışmalarının bir sonucu olarak, kimyasal elementlerin atomlarının değerliliği kavramı kuruldu. Kekule, karbonun tetravalansı kavramını geliştirdi. Cannizzaro'nun çalışmaları sayesinde atomik ve moleküler kütle kavramları netleşti, anlamları ve belirleme yöntemleri rafine edildi.
1860 yılında, farklı Avrupa ülkelerinden 140'tan fazla önde gelen kimyager, Karlsruhe'de uluslararası bir kongre için bir araya geldi. Kongre kimya tarihinde çok önemli bir olay haline geldi: bilimin başarıları özetlendi ve organik kimyanın gelişiminde yeni bir aşama için koşullar hazırlandı - organik maddelerin kimyasal yapısı teorisinin ortaya çıkması A. M. Butlerov ( 1861), ayrıca D. I. Mendeleev'in temel keşfi için - Periyodik Kanun ve Kimyasal Elementler Sistemi (1869).
1861'de A. M. Butlerov, Speyer kentindeki doktorlar ve doğa bilimcilerin kongresinde "Vücutların kimyasal yapısı hakkında" bir raporla konuştu. İçinde organik bileşiklerin kimyasal yapısı teorisinin temellerini özetledi. Kimyasal yapı altında, bilim adamı atomların moleküllerdeki bağlantı sırasını anladı.
A. M. Butlerov'un kişisel nitelikleri
A. M. Butlerov, kimyasal bilginin ansiklopedik doğası, gerçekleri analiz etme ve genelleştirme ve tahmin etme yeteneği ile ayırt edildi. Bir bütan izomerinin varlığını öngördü ve sonra onu ve ayrıca bütilen - izobütilen izomerini aldı.
Butlerov Alexander Mihayloviç (1828-1886)
Rus kimyager, St. Petersburg Bilimler Akademisi akademisyeni (1874'ten beri). Kazan Üniversitesi'nden mezun oldu (1849). Orada çalıştı (1857'den beri - profesör, 1860 ve 1863'te - rektör). Modern kimyanın temelini oluşturan organik bileşiklerin kimyasal yapısı teorisinin yaratıcısı. Bir moleküldeki atomların karşılıklı etkisi fikrini doğruladı. Birçok organik bileşiğin izomerizmini öngördü ve açıkladı. "Organik kimyanın tam çalışmasına giriş" (1864) yazdı - bilim tarihinde kimyasal yapı teorisine dayanan ilk el kitabı. Rus Fizik ve Kimya Derneği (1878-1882) Kimya Bölümü Başkanı.
A. M. Butlerov, Rusya'da parlak bilim adamlarının ortaya çıktığı ilk organik kimyagerler okulunu yarattı: V. V. Markovnikov, D. P. Konovalov, A. E. Favorsky ve diğerleri.
D. I. Mendeleev'in şunları yazdığına şaşmamalı: “A. M. Butlerov, Rusya'nın en büyük bilim adamlarından biridir, hem ilmî eğitimi hem de eserlerinin özgünlüğü açısından Rus'dur.”
Kimyasal bileşiklerin yapısı teorisinin ana hükümleri
A. M. Butlerov tarafından geçen yüzyılın ikinci yarısında (1861) öne sürülen organik bileşiklerin kimyasal yapısı teorisi, Butlerov'un öğrencileri ve kendisi de dahil olmak üzere birçok bilim insanının çalışmasıyla doğrulandı. O zamana kadar hiçbir yorumu olmayan birçok fenomeni açıklamanın temelinde mümkün olduğu ortaya çıktı: izomerizm, homoloji, organik maddelerde karbon atomları tarafından tetravalansın tezahürü. Teori aynı zamanda prognostik işlevini de yerine getirdi: temelinde, bilim adamları hala bilinmeyen bileşiklerin varlığını tahmin ettiler, özellikleri tanımladılar ve onları keşfettiler.
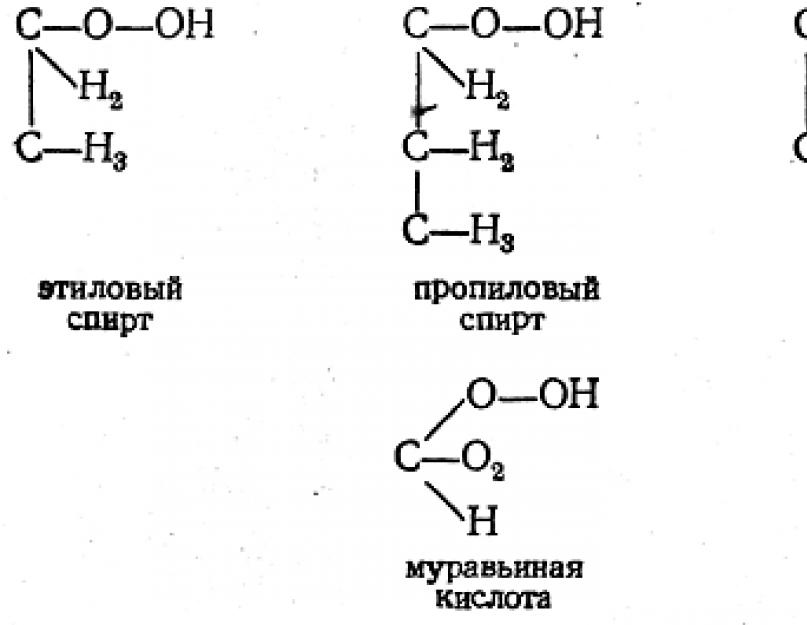
Yani, 1862-1864'te. A. M. Butlerov, propil, butil ve amil alkollerin izomerizmini düşündü, olası izomerlerin sayısını belirledi ve bu maddelerin formüllerini türetti. Varlıkları daha sonra deneysel olarak kanıtlandı ve bazı izomerler Butlerov'un kendisi tarafından sentezlendi.
XX yüzyıl boyunca. kimyasal bileşiklerin kimyasal yapısı teorisinin hükümleri, bilimde yayılan yeni görüşler temelinde geliştirildi: atomun yapısı teorisi, kimyasal bağ teorisi, kimyasal reaksiyonların mekanizmaları hakkında fikirler. Şu anda, bu teori evrensel bir karaktere sahiptir, yani sadece organik maddeler için değil, aynı zamanda inorganik olanlar için de geçerlidir.
İlk pozisyon. Moleküllerdeki atomlar, değerliklerine göre belirli bir sırayla bağlanır. Tüm organik ve çoğu inorganik bileşiklerdeki karbon dört değerlidir.
Teorinin ilk hükmünün son bölümünün, bileşiklerdeki karbon atomlarının uyarılmış durumda olmasıyla kolaylıkla açıklanabileceği açıktır: 
a) dört değerlikli karbon atomları birbirleriyle birleşerek çeşitli zincirler oluşturabilir:
açık dallı
- dalsız açık
- kapalı
b) moleküllerdeki karbon atomlarının bağlantı sırası farklı olabilir ve karbon atomları arasındaki kovalent kimyasal bağın türüne bağlıdır - tek veya çoklu (çift ve üçlü).
İkinci pozisyon. Maddelerin özellikleri yalnızca niteliksel ve niceliksel bileşimlerine değil, aynı zamanda moleküllerinin yapısına da bağlıdır.
Bu pozisyon izomerizm fenomenini açıklar. Aynı bileşime, ancak farklı kimyasal veya uzamsal yapıya ve dolayısıyla farklı özelliklere sahip maddelere izomerler denir. Ana izomerizm türleri:
Maddelerin moleküllerdeki atomların bağlanma sırasına göre farklılık gösterdiği yapısal izomerizm:
1) karbon iskeletinin izomerizmi 
3) homolog serilerin izomerizmi (sınıflar arası) 
Madde moleküllerinin atomların bağlanma sırasına göre değil, uzaydaki konumlarına göre farklılık gösterdiği mekansal izomerizm: cis-trans-izomerizm (geometrik).
Bu izomerizm, molekülleri düzlemsel bir yapıya sahip olan maddeler için tipiktir: alkenler, sikloalkanlar, vb.
Optik (ayna) izomerizm de uzamsal izomerizme aittir.
Bildiğiniz gibi karbon atomunun etrafındaki dört tekli bağ, tetrahedral olarak düzenlenmiştir. Bir karbon atomu dört farklı atoma veya gruba bağlıysa, bu grupların uzayda farklı bir düzenlemesi, yani iki uzaysal izomerik form mümkündür.
Amino asit alaninin (2-aminopropanoik asit) iki ayna formu Şekil 17'de gösterilmektedir.
Bir aynanın önüne bir alanin molekülünün yerleştirildiğini hayal edin. -NH2 grubu aynaya daha yakındır, bu nedenle yansımada önde olacak ve -COOH grubu arka planda olacaktır, vb. (sağdaki resme bakın). Alanya, üst üste bindirildiğinde birbiriyle birleşmeyen iki mekansal biçimde var olur.
Kimyasal bileşiklerin yapısı teorisinin ikinci pozisyonunun evrenselliği, inorganik izomerlerin varlığını doğrular.
Böylece, organik maddelerin sentezlerinden ilki - Wehler (1828) tarafından gerçekleştirilen üre sentezi, inorganik bir maddenin - amonyum siyanat ve bir organik maddenin - ürenin izomer olduğunu gösterdi: 
Üredeki oksijen atomunu bir kükürt atomu ile değiştirirseniz, Fe3+ iyonları için iyi bilinen bir reaktif olan amonyum tiyosiyanata izomerik olan tiyoüre elde edersiniz. Açıkçası, tiyoüre bu kalitatif reaksiyonu vermez.
Üçüncü konum. Maddelerin özellikleri, moleküllerdeki atomların karşılıklı etkisine bağlıdır.
Örneğin, asetik asitte, dört hidrojen atomundan sadece biri alkali ile reaksiyona girer. Buna dayanarak, sadece bir hidrojen atomunun oksijene bağlı olduğu varsayılabilir:
Öte yandan, asetik asidin yapısal formülünden, bir hareketli hidrojen atomu içerdiği, yani monobazik olduğu sonucuna varılabilir.
Yapı teorisinin konumunun, maddelerin özelliklerinin, sadece organiklerde değil, aynı zamanda inorganik bileşiklerde de bulunan moleküllerdeki atomların karşılıklı etkisi üzerindeki bağımlılığına bağlı olduğunu doğrulamak için, hidrojen atomlarının özelliklerini karşılaştırırız. metal olmayan hidrojen bileşikleri. Moleküler bir yapıya sahiptirler ve normal şartlar altında gazlar veya uçucu sıvılardır. Metal olmayanın D. I. Mendeleev'in Periyodik sistemindeki konumuna bağlı olarak, bu tür bileşiklerin özelliklerindeki değişiklikte bir model tanımlanabilir: 
Metan su ile etkileşmez. Metanın temel özelliklerinin eksikliği, karbon atomunun değerlik yeteneklerinin doygunluğu ile açıklanmaktadır.
Amonyak temel özellikler sergiler. Molekül, azot atomunun yalnız elektron çiftine (verici-alıcı bağ oluşum mekanizması) olan çekiciliği nedeniyle kendisine bir hidrojen iyonu bağlayabilir.
Fosfin PH3'te, fosfor atomunun yarıçapı ile ilişkili olan temel özellikler zayıf bir şekilde ifade edilir. Azot atomunun yarıçapından çok daha büyüktür, bu nedenle fosfor atomu hidrojen atomunu kendine daha zayıf çeker.
Soldan sağa periyotlarda, atom çekirdeğinin yükleri artar, atomların yarıçapları azalır, hidrojen atomunun kısmi pozitif yüklü G + itici gücü artar ve bu nedenle metal olmayan hidrojen bileşiklerinin asidik özellikleri geliştirilmiştir. 
Ana alt gruplarda elementlerin atom yarıçapları yukarıdan aşağıya doğru artar, 5'li metal olmayan atomlar 5+ daha zayıf hidrojen atomlarını çeker, hidrojen bileşiklerinin gücü azalır, kolayca ayrışırlar ve dolayısıyla asidik özellikleri artar.
Metal olmayan hidrojen bileşiklerinin çözeltilerdeki hidrojen katyonlarını çıkarma veya ekleme konusundaki farklı yetenekleri, metal olmayan bir atomun hidrojen atomları üzerindeki eşit olmayan etkisi ile açıklanır.
Aynı periyottaki elementlerin oluşturduğu hidroksitlerin moleküllerindeki atomların farklı etkileri, asit-baz özelliklerindeki değişimi de açıklar.
Merkez atomun oksidasyon derecesi arttıkça hidroksitlerin temel özellikleri azalır, asit olanlar artar, bu nedenle oksijen atomu (8-) ile bağının enerjisi ve hidrojen atomunun (8+) tarafından itilmesi. artar.
Sodyum hidroksit NaOH. Hidrojen atomunun yarıçapı çok küçük olduğu için oksijen atomunu kendisine daha güçlü bir şekilde çeker ve hidrojen ile oksijen atomları arasındaki bağ, sodyum ve oksijen atomları arasındaki bağdan daha güçlü olacaktır. Alüminyum hidroksit Al(OH)3 amfoterik özellikler sergiler.
Perklorik asit HclO 4'te, nispeten büyük bir pozitif yüke sahip klor atomu, oksijen atomuna daha güçlü bir şekilde bağlanır ve hidrojen atomunu 6+ ile daha güçlü bir şekilde iter. Ayrışma asit tipine göre ilerler.
Kimyasal bileşiklerin yapısı teorisinin gelişimindeki ana yönler ve önemi
A. M. Butlerov zamanında, organik kimyada ampirik (moleküler) ve yapısal formüller yaygın olarak kullanılıyordu. Sonuncusu, bir moleküldeki atomların, tire ile gösterilen değerlerine göre bağlantı sırasını yansıtır.
Kayıt kolaylığı için, genellikle yalnızca karbon veya karbon ve oksijen atomları arasındaki bağların tire ile gösterildiği kısaltılmış yapısal formüller kullanılır.
Kısaltılmış yapısal formüller
Daha sonra, kimyasal bağın doğası ve organik maddelerin moleküllerinin elektronik yapısının özellikleri üzerindeki etkisi hakkındaki bilgilerin gelişmesiyle birlikte, kovalent bağın geleneksel olarak iki nokta ile gösterildiği elektronik formülleri kullanmaya başladılar. Bu tür formüllerde, bir moleküldeki elektron çiftlerinin yer değiştirme yönü sıklıkla gösterilir.
Mezomerik ve indüksiyon etkilerini açıklayan maddelerin elektronik yapısıdır.
Endüktif etki, farklı elektronegatiflikleri nedeniyle gama bağlarının elektron çiftlerinin bir atomdan diğerine yer değiştirmesidir. (->) ile gösterilir.
Bir atomun (veya bir atom grubunun) indüksiyon etkisi negatiftir (-/), eğer bu atom yüksek bir elektronegatifliğe (halojenler, oksijen, azot) sahipse, gama bağı elektronlarını çeker ve kısmi bir negatif yük alır. Bir atom (veya atom grubu), gama bağlarının elektronlarını itiyorsa, pozitif endüktif etkiye (+/) sahiptir. Bu özelliğe bazı sınırlayıcı radikaller C2H5) sahiptir. Alkenlere (propen) nasıl hidrojen ve bir hidrojen halojenür eklendiğine ilişkin Markovnikov'un kuralını hatırlayın ve bu kuralın belirli bir yapıya sahip olduğunu anlayacaksınız. Bu iki reaksiyon denklemi örneğini karşılaştırın:
[[Theory_of_the_chemical_compounds_A._M._Butlerov|  ]]
]]
Bireysel maddelerin moleküllerinde hem indüksiyon hem de mezomerik etkiler aynı anda ortaya çıkar. Bu durumda ya birbirlerini güçlendirirler (aldehitlerde, karboksilik asitlerde) ya da karşılıklı olarak zayıflarlar (vinil klorürde).
Atomların moleküllerdeki karşılıklı etkisinin sonucu, elektron yoğunluğunun yeniden dağıtılmasıdır.
Kimyasal bağların uzamsal yönü fikri ilk olarak Fransız kimyager J. A. Le Bel ve Hollandalı kimyager J. X. Van't Hoff tarafından 1874'te ifade edildi. Bilim adamlarının varsayımları kuantum kimyası tarafından tamamen doğrulandı. Maddelerin özellikleri, moleküllerinin uzaysal yapısından önemli ölçüde etkilenir. Örneğin, özelliklerinde farklılık gösteren buten-2'nin cis- ve trans-izomerleri için formülleri zaten verdik (bkz. Şekil 16).
Bir formdan diğerine geçiş sırasında kırılması gereken ortalama bağ enerjisi yaklaşık olarak 270 kJ/mol'dür; oda sıcaklığında çok fazla enerji yoktur. Büten-2 formlarının birinden diğerine karşılıklı geçişi için bir kovalent bağın kırılması ve bunun yerine bir diğerinin oluşturulması gerekir. Başka bir deyişle, bu işlem bir kimyasal reaksiyon örneğidir ve düşünülen her iki büten-2 formu da farklı kimyasal bileşiklerdir.
Kauçuğun sentezindeki en önemli sorunun stereo-düzenli kauçuğun elde edilmesi olduğunu hatırlarsınız. Yapısal birimlerin katı bir sırayla düzenleneceği bir polimer oluşturmak gerekliydi (örneğin doğal kauçuk, yalnızca cis-birimlerinden oluşur), çünkü kauçuğun esnekliği gibi önemli bir özelliği buna bağlıdır.
Modern organik kimya iki ana izomerizm türünü ayırt eder: yapısal (zincir izomerizmi, çoklu bağların konumunun izomerizmi, homolog serilerin izomerizmi, fonksiyonel grupların konumunun izomerizmi) ve stereoizomerizm (geometrik veya cis-trans-izomerizm, optik, veya ayna, izomerizm).
Böylece, A. M. Butlerov tarafından açıkça formüle edilen kimyasal yapı teorisinin ikinci pozisyonunun eksik olduğundan emin oldunuz. Modern bir bakış açısından, bu hüküm ilaveler gerektirir:
maddelerin özellikleri yalnızca niteliksel ve niceliksel bileşimlerine değil, aynı zamanda aşağıdakilere de bağlıdır:
Kimyasal,
elektronik,
Mekânsal yapı.
Maddelerin yapısı teorisinin oluşturulması, organik kimyanın gelişmesinde önemli bir rol oynamıştır. Ağırlıklı olarak tanımlayıcı bir bilimden yaratıcı, sentezleyici bir bilime dönüşüyor; çeşitli maddelerin moleküllerindeki atomların karşılıklı etkisini yargılamak mümkün hale geldi (bkz. Tablo 10). Yapı teorisi, organik moleküllerin çeşitli izomerizm türlerinin yanı sıra kimyasal reaksiyonların yönleri ve mekanizmalarını açıklamak ve tahmin etmek için ön koşulları yarattı.
Bu teoriye dayanarak, organik kimyagerler, yalnızca doğal olanların yerini alan değil, aynı zamanda özelliklerinde önemli ölçüde aşan maddeler yaratırlar. Bu nedenle, sentetik boyalar, örneğin antik çağda bilinen alizarin ve çivit gibi birçok doğal olandan çok daha iyi ve daha ucuzdur. Sentetik kauçuklar, çok çeşitli özelliklere sahip büyük miktarlarda üretilir. Plastik ve lifler yaygın olarak kullanılmaktadır ve ürünleri mühendislikte, günlük yaşamda, tıpta ve tarımda kullanılmaktadır.
A. M. Butlerov'un kimyasal yapı teorisinin organik kimya için değeri, Periyodik yasanın değeri ve inorganik kimya için D. I. Mendeleev'in periyodik kimyasal element sistemi ile karşılaştırılabilir. Her iki teorinin de oluşum biçimleri, gelişim yönleri ve genel bilimsel önemi açısından bu kadar çok ortak noktaya sahip olması boşuna değildir. Ancak, önde gelen herhangi bir bilimsel teorinin tarihinde (Ch. Darwin'in teorisi, genetik, kuantum teorisi vb.) böyle ortak aşamalar bulunabilir.
1. İki önde gelen kimya teorisi - D. I. Mendeleev'in Periyodik Yasası ve Kimyasal Elementlerin Periyodik Tablosu ile A. M. Butlerov'un organik bileşiklerin kimyasal yapısı teorisi arasında aşağıdaki gerekçelerle paralellikler kurun: önkoşullarda ortak, prognostik rollerde ortak olan gelişimlerinin yönleri.
2. Kimyasal bileşiklerin yapısı teorisi, Periyodik Yasanın oluşumunda nasıl bir rol oynadı?
3. İnorganik kimyadan hangi örnekler, kimyasal bileşiklerin yapısı teorisinin hükümlerinin her birinin evrenselliğini doğrular?
4. Fosforlu asit H3PO3, dibazik asitleri ifade eder. Yapısal formülünü önerin ve bu asidin molekülündeki atomların karşılıklı etkisini düşünün.
5. С3Н8O bileşimine sahip izomerleri yazın. Bunları sistematik terminolojiye göre adlandırın. İzomerizm türlerini belirleyin.
6. Krom(III) klorürün kristalli hidratlarının aşağıdaki formülleri bilinmektedir: [Cr(H20)6]Cl3; [Cr(H20)5Cl]Cl2H20; [Cr(H20)4 * Cl2]Cl 2H2O. Bu fenomene ne ad verirsiniz?
Organik bileşiklerin kimyasal yapısı teorisinin ana hükümleri, 1861'de Kazan Üniversitesi profesörü A. M. Butlerov tarafından formüle edildi.
- Moleküllerdeki atomlar, elementlerin değerlerine göre kesin olarak tanımlanmış bir sırayla bağlanır.
- Maddelerin özellikleri yalnızca nicel ve nitel bileşimlerine değil, aynı zamanda moleküllerdeki atomların bağlanma sırasına da bağlıdır, yani. kimyasal yapısından.
- Moleküllerdeki atomlar karşılıklı olarak birbirini etkiler.
- Maddelerin özellikleri yapıları tarafından belirlenir ve tersine, yapıyı bilmek, özellikleri tahmin edebilir.
- Maddelerin kimyasal yapısı kimyasal yöntemlerle belirlenebilir.
A.M.'nin kimyasal yapısı teorisi. Butlerov, en önemli yönleri olan bir evrim geçirdi:
- Organik kimyada, organik maddelerin kimyasal davranışlarının elektronik yapıya bağımlılığını formüle etmeyi mümkün kılan elektronik teorilerin ortaya çıkışı.
- Maddelerin kimyasal özellikleri ile mekansal yapı arasındaki ilişkiyi belirleyen stereokimyasal temsiller.
Organik bileşiklerin özellikleri, çeşitliliği öncelikle organik bileşiklerde dörde eşit bir değer sergileyen ve sp3 -, sp 2 - ve sp-hibrit durumunda olabilen karbon atomunun elektronik yapısı ile belirlenir. Bu nedenle, atomlar arasındaki bağ bir, iki ve üç elektron çifti ile gerçekleştirilebilir, yani. tekli (σ - bağ), ikili (1σ - bağ ve 1π - bağ), üçlü (1σ - bağ ve 2 π - bağ). Karbonun istisnai bir özelliği, çeşitli uzunluklarda ve siklik yapılarda atom zincirleri oluşturma yeteneğidir.
Yapı teorisinin ikinci konumundan itibaren, organik maddelerde homoloji ve izomerizmin varlığını takip eder. homolog seri benzer bir yapıya ve özelliklere sahip olan ve bileşimde bir veya daha fazla grup -CH2 - ile birbirinden farklı olan bir dizi organik bileşik olarak adlandırılır. Aynı homolog serinin temsilcilerine denir. homologlar.
izomerler- aynı nicel ve nitel bileşime sahip, ancak moleküllerin yapısında ve dolayısıyla özelliklerinde farklılık gösteren maddeler. Yapısal ve uzaysal (stereo-) izomerizm vardır. İlk tip
- karbon iskeletinin izomerizmi (örneğin, n-bütan ve izobütan);
- moleküldeki çoklu bağın pozisyonunun izomerizmi (örneğin, 2-metil-1-buten ve 2-metil-2-buten);
- fonksiyonel grup pozisyonu izomerizmi (örn. 1-kloropropan ve 2-kloropropan);
- sınıflar arası izomerizm veya metamerizm (örneğin, bütin-1 ve bütadien-1,3), vb.
Uzaysal izomerlerde, moleküllerdeki atomların bağ sırası aynıdır, ancak uzaydaki konumları farklıdır, bu da özelliklerde farklılığa neden olur. Mekansal geometrik izomerizmdir. Örneğin, alkenlerde mümkündür.
Organik bileşiklerin kimyasal yapısı teorisinin yaratılmasının temeli A.M. Butlerov, atomik ve moleküler teoriydi (A. Avagadro ve S. Cannizzaro'nun çalışmaları). Yaratılmadan önce dünyanın organik maddeler hakkında hiçbir şey bilmediğini ve organik bileşiklerin yapısını doğrulamak için hiçbir girişimde bulunulmadığını varsaymak yanlış olur. 1861'de (A.M. Butlerov'un organik bileşiklerin kimyasal yapısı teorisini yarattığı yıl), bilinen organik bileşiklerin sayısı yüzbinlere ulaştı ve organik kimyanın bağımsız bir bilim olarak ayrılması 1807 gibi erken bir tarihte gerçekleşti (J. Berzelius) .
Organik bileşiklerin yapısı teorisinin arka planı
Organik bileşiklerle ilgili geniş bir çalışma, 18. yüzyılda, canlı organizmalardan elde edilen maddelerin karbon, hidrojen, oksijen, azot, kükürt ve fosfor gibi çeşitli elementlerden oluştuğunu gösteren A. Lavoisier'in çalışmasıyla başladı. "Radikal" ve "izomerizm" terimlerinin tanıtımı ve radikal teorisinin oluşumu büyük önem taşıyordu (L. Giton de Morvo, A. Lavoisier, J. Liebig, J. Dumas, J. Berzelius) , organik bileşiklerin (üre, anilin, asetik asit, yağlar, şeker benzeri maddeler vb.) sentezinde başarı.
"Kimyasal yapı" terimi ve klasik kimyasal yapı teorisinin temelleri ilk olarak A.M. Butlerov, 19 Eylül 1861'de Speyer'deki Alman Doğa Bilimcileri ve Hekimleri Kongresi'ndeki raporunda.
Organik bileşiklerin yapısı teorisinin ana hükümleri A.M. Butlerov
1. Organik bir maddenin molekülünü oluşturan atomlar belirli bir sırayla birbirine bağlanır ve her atomdan bir veya daha fazla değerlik birbirine bağlanmak için harcanır. Serbest değerlik yoktur.
Butlerov, atomların bağlantı sırasını "kimyasal yapı" olarak adlandırdı. Grafik olarak, atomlar arasındaki bağlar bir çizgi veya nokta ile gösterilir (Şekil 1).
Pirinç. 1. Metan molekülünün kimyasal yapısı: A - yapısal formül, B - elektronik formül
2. Organik bileşiklerin özellikleri, moleküllerin kimyasal yapısına bağlıdır, yani. Organik bileşiklerin özellikleri, atomların molekülde bağlanma sırasına bağlıdır. Özellikleri inceleyerek maddeyi tasvir edebilirsiniz.
Bir örnek düşünün: bir maddenin brüt formülü C 2 H 6 O'dur. Bu maddenin sodyum ile etkileşime girdiğinde hidrojen açığa çıktığı ve üzerine bir asit etki ettiğinde su oluştuğu bilinmektedir.
C 2 H 6 O + Na = C 2 H 5 ONa + H 2
C2H6O + HCl \u003d C2H5Cl + H20
Bu madde iki yapısal formüle karşılık gelebilir:
CH3-0-CH3 - aseton (dimetil keton) ve CH3-CH2-OH - etil alkol (etanol),
bu maddenin kimyasal özelliklerine dayanarak, bunun etanol olduğu sonucuna varıyoruz.
İzomerler, aynı kalitatif ve kantitatif bileşime sahip ancak farklı kimyasal yapıya sahip maddelerdir. Birkaç izomerizm türü vardır: yapısal (doğrusal, dallanmış, karbon iskeleti), geometrik (cis- ve trans-izomerizm, çoklu çift bağa sahip bileşiklerin özelliği (Şekil 2)), optik (ayna), stereo (uzaysal, maddelerin özelliği , uzayda farklı şekillerde yer alabilen (Şekil 3)).

Pirinç. 2. Geometrik izomerizm örneği
3. Organik bileşiklerin kimyasal özellikleri, molekülde bulunan diğer atomlardan da etkilenir. Bu tür atom gruplarına, bir maddenin molekülündeki varlıklarının ona özel kimyasal özellikler kazandırması nedeniyle fonksiyonel gruplar denir. Örneğin: -OH (hidrokso grubu), -SH (tio grubu), -CO (karbonil grubu), -COOH (karboksil grubu). Ayrıca, organik maddenin kimyasal özellikleri, fonksiyonel gruptan ziyade hidrokarbon iskeletine daha az bağlıdır. Sınıflandırılmalarına bağlı olarak (alkoller, aldehitler, karboksilik asitler vb.) Organik bileşiklerin çeşitliliğini sağlayan fonksiyonel gruplardır. Fonksiyonel gruplar bazen karbon-karbon bağları içerir (çoklu ikili ve üçlü). fonksiyonel gruplar, daha sonra denir homopolifonksiyonel (CH2 (OH) -CH (OH) -CH2 (OH) - gliserol), eğer birkaç, ancak farklıysa - heteropolifonksiyonel (NH2 -CH (R) -COOH - amino asitler) .

Şek. 3. Bir stereoizomerizm örneği: a - sikloheksan, "sandalye" formu, b - sikloheksan, "banyo" formu
4. Organik bileşiklerde karbonun değeri her zaman dörttür.
İlki 19. yüzyılın başında ortaya çıktı. radikaller teorisi (J. Gay-Lussac, F. Wehler, J. Liebig). Radikaller, kimyasal reaksiyonlar sırasında bir bileşikten diğerine değişmeden geçen atom grupları olarak adlandırıldı. Bu radikal kavramı korunmuştur, ancak radikaller teorisinin diğer hükümlerinin çoğunun yanlış olduğu ortaya çıkmıştır.
Tip teorisine göre (C. Gerard), tüm organik maddeler belirli inorganik maddelere karşılık gelen tiplere ayrılabilir. Örneğin, R-OH alkolleri ve R-O-R eterleri, hidrojen atomlarının radikallerle değiştirildiği H-OH tipi suyun temsilcileri olarak kabul edildi. Tip teorisi, bazı prensipleri şu anda uygulanan organik maddelerin bir sınıflandırmasını yarattı.
Organik bileşiklerin yapısının modern teorisi, seçkin Rus bilim adamı A.M. Butlerov.
1. Bir moleküldeki atomlar, değerliklerine göre belirli bir sıraya göre dizilirler. Organik bileşiklerde karbon atomunun değeri dörttür.
2. Maddelerin özellikleri, yalnızca molekülün hangi atomların ve hangi miktarlarda bulunduğuna değil, aynı zamanda bunların birbirine bağlanma sırasına da bağlıdır.
3. Molekülleri oluşturan atomlar veya atom grupları, moleküllerin kimyasal aktivitesi ve reaktivitesinin bağlı olduğu karşılıklı olarak birbirini etkiler.
4. Maddelerin özelliklerinin incelenmesi, kimyasal yapılarını belirlemenizi sağlar.
Moleküllerde komşu atomların karşılıklı etkisi, organik bileşiklerin en önemli özelliğidir. Bu etki, ya bir tekli bağlar zinciri yoluyla ya da bir konjuge (alternatif) tekli ve çiftli bağlar zinciri yoluyla iletilir.
Organik bileşiklerin sınıflandırılması molekül yapısının iki yönünün analizine dayanır - karbon iskeletinin yapısı ve fonksiyonel grupların varlığı.