Raspodjela elektrona preko različitih AO naziva se elektronska konfiguracija atoma. Elektronska konfiguracija sa najnižom energijom odgovara osnovno stanje atom, na koje se odnose preostale konfiguracije uzbuđena stanja.
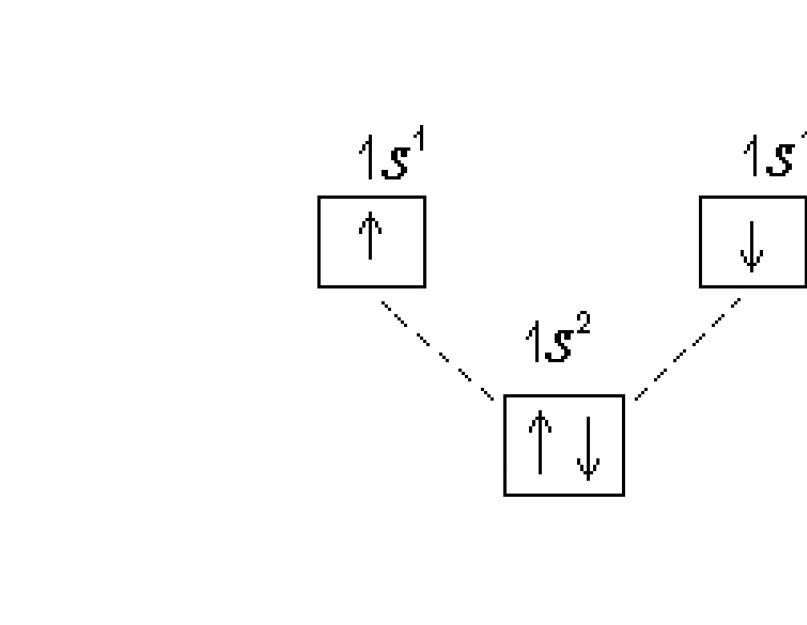
Elektronska konfiguracija atoma prikazana je na dva načina - u obliku elektronskih formula i dijagrama difrakcije elektrona. Prilikom pisanja elektronskih formula koriste se glavni i orbitalni kvantni brojevi. Podnivo je označen glavnim kvantnim brojem (brojem) i orbitalnim kvantnim brojem (odgovarajuće slovo). Broj elektrona u podnivou karakteriše superskript. Na primjer, za osnovno stanje atoma vodika, elektronska formula je: 1 s 1 .
Struktura elektronskih nivoa može se potpunije opisati korišćenjem dijagrama difrakcije elektrona, gde je raspodela po podnivoima predstavljena u obliku kvantnih ćelija. U ovom slučaju, orbitala je konvencionalno prikazana kao kvadrat, blizu kojeg je pričvršćena oznaka podnivoa. Podnivoi na svakom nivou trebaju biti malo pomaknuti po visini, jer je njihova energija nešto drugačija. Elektroni su predstavljeni strelicama ili ↓ u zavisnosti od predznaka spin kvantnog broja. Dijagram difrakcije elektrona atoma vodika:
Princip konstruisanja elektronskih konfiguracija višeelektronskih atoma je dodavanje protona i elektrona atomu vodika. Distribucija elektrona po energetskim nivoima i podnivoima je u skladu sa prethodno razmatranim pravilima: principom najmanje energije, Paulijevim principom i Hundovim pravilom.
Uzimajući u obzir strukturu elektronskih konfiguracija atoma, svi poznati elementi, u skladu sa vrijednošću orbitalnog kvantnog broja posljednjeg ispunjenog podnivoa, mogu se podijeliti u četiri grupe: s-elementi, str-elementi, d-elementi, f-elementi.
U atomu helijuma He (Z=2) drugi elektron zauzima 1 s-orbitala, njena elektronska formula: 1 s 2. Elektronografski dijagram:

Helijum završava prvi najkraći period periodnog sistema elemenata. Elektronska konfiguracija helijuma je označena .
Drugi period otvara litijum Li (Z=3), njegova elektronska formula:  Elektronografski dijagram:
Elektronografski dijagram:

Slijede pojednostavljeni dijagrami difrakcije elektrona atoma elemenata čije se orbitale istog energetskog nivoa nalaze na istoj visini. Unutrašnji, potpuno popunjeni podnivoi nisu prikazani.
Nakon litijuma slijedi berilijum Be (Z=4), u kojem se dodatni elektron naseli 2 s-orbitalni. Elektronska formula Be: 2 s 2

U osnovnom stanju, sledeći elektron bora B (z=5) zauzima 2 R-orbitalna, V:1 s 2 2s 2 2str jedan ; njegov uzorak elektronske difrakcije:

Sljedećih pet elemenata imaju elektronske konfiguracije:
C (Z=6): 2 s 2 2str 2N (Z=7): 2 s 2 2str 3

O (Z=8): 2 s 2 2str 4 F (Z=9): 2 s 2 2str 5

Ne (Z=10): 2 s 2 2str 6

Zadate elektronske konfiguracije određene su Hundovim pravilom.
Prvi i drugi energetski nivo neona su potpuno ispunjeni. Označimo njegovu elektronsku konfiguraciju i dalje ćemo koristiti za sažetost zapisa elektronskih formula atoma elemenata.
Natrijum Na (Z=11) i Mg (Z=12) otvaraju treći period. Vanjski elektroni zauzimaju 3 s-orbitalna:
Na (Z=11): 3 s 1

Mg (Z=12): 3 s 2

Zatim, počevši od aluminijuma (Z=13), 3 R-podnivo. Treći period završava argonom Ar (Z=18):
Al (Z=13): 3 s 2 3str 1

Ar (Z=18): 3 s 2 3str 6

Elementi trećeg perioda razlikuju se od elemenata drugog po tome što imaju slobodna 3 d-orbitale koje mogu učestvovati u formiranju hemijske veze. Ovo objašnjava valentna stanja koja pokazuju elementi.
U četvrtom periodu, u skladu sa pravilom ( n+l), u kalijum K (Z=19) i kalcijum Ca (Z=20) elektroni zauzimaju 4 s- podnivo, ne 3 d. Počevši sa skandijem Sc (Z=21) i završavajući sa cinkom Zn (Z=30), 3 d- podnivo:
Elektronske formule d-elementi se mogu predstaviti u ionskom obliku: podnivoi su navedeni uzlaznim redoslijedom glavnog kvantnog broja i konstantno n– po rastućem orbitalnom kvantnom broju. Na primjer, za Zn bi takav unos izgledao ovako:  Oba ova unosa su ekvivalentna, ali formula za cink koja je ranije data ispravno odražava redoslijed kojim se podnivoi popunjavaju.
Oba ova unosa su ekvivalentna, ali formula za cink koja je ranije data ispravno odražava redoslijed kojim se podnivoi popunjavaju.
Red 3 d-elementi u hromu Cr (Z=24) postoji odstupanje od pravila ( n+l). Prema ovom pravilu, Cr konfiguracija bi trebala izgledati ovako:  Ustanovljeno je da je njegova prava konfiguracija
Ustanovljeno je da je njegova prava konfiguracija  Ponekad se ovaj efekat naziva "neuspjehom" elektrona. Slični efekti se objašnjavaju povećanom stabilnošću za polovinu ( str
3 ,
d
5 ,
f
7) i potpuno ( str
6 ,
d
10 ,
f
14) završeni podnivoi.
Ponekad se ovaj efekat naziva "neuspjehom" elektrona. Slični efekti se objašnjavaju povećanom stabilnošću za polovinu ( str
3 ,
d
5 ,
f
7) i potpuno ( str
6 ,
d
10 ,
f
14) završeni podnivoi.
Odstupanja od pravila ( n+l) se također primjećuju u drugim elementima (tabela 2). To je zbog činjenice da kako se glavni kvantni broj povećava, razlike između energija podnivoa se smanjuju.
Slijedi punjenje 4 str-podnivo (Ga - Kr). Četvrti period sadrži samo 18 elemenata. Slično, popunjavanje 5 s-, 4d- i 5 str- podnivoi od 18 elemenata petog perioda. Imajte na umu da energija 5 s- i 4 d-podnivoi su veoma blizu, a elektron sa 5 s- podnivo može lako preći na 4 d-podnivo. Dana 5 s-podnivo Nb, Mo, Tc, Ru, Rh, Ag ima samo jedan elektron. U osnovnom stanju 5 s- podnivo Pd nije popunjen. Uočen je „propust“ od dva elektrona.
tabela 2
Izuzeci od ( n+l) – pravila za prvih 86 elemenata
|
Elektronska konfiguracija |
||
|
po pravilu ( n+l) |
stvarni |
|
|
4s 2 3d 4 4s 2 3d 9 5s 2 4d 3 5s 2 4d 4 5s 2 4d 5 5s 2 4d 6 5s 2 4d 7 5s 2 4d 8 5s 2 4d 9 6s 2 4f 1 5d 0 6s 2 4f 2 5d 0 6s 2 4f 8 5d 0 6s 2 4f 14 5d 7 6s 2 4f 14 5d 8 6s 2 4f 14 5d 9 |
4s 1 3d 5 4s 1 3d 10 5s 1 4d 4 5s 1 4d 5 5s 1 4d 6 5s 1 4d 7 5s 1 4d 8 5s 0 4d 10 5s 1 4d 10 6s 2 4f 0 5d 1 6s 2 4f 1 5d 1 6s 2 4f 7 5d 1 6s 0 4f 14 5d 9 6s 1 4f 14 5d 9 6s 1 4f 14 5d 10 |
|
U šestom periodu nakon popunjavanja 6 s-podnivo cezijuma Cs (Z=55) i barijuma Ba (Z=56) sledeći elektron, po pravilu ( n+l), treba uzeti 4 f-podnivo. Međutim, u lantanu La (Z=57), elektron ulazi u 5 d-podnivo. Do pola popunjena (4 f 7) 4f-podnivo ima povećanu stabilnost, dakle, gadolinijum Gd (Z=64), nakon europijuma Eu (Z=63), za 4 f-podnivo zadržava prethodni broj elektrona (7), a novi elektron stiže na 5 d-podnivo, kršenje pravila ( n+l). U terbijumu Tb (Z=65), sljedeći elektron zauzima 4 f-podnivo i postoji prelaz elektrona sa 5 d- podnivo (konfiguracija 4 f 9 6s 2). Punjenje 4 f-podnivo završava na iterbijumu Yb (Z=70). Sljedeći elektron atoma lutecijuma Lu zauzima 5 d-podnivo. Njegova elektronska konfiguracija razlikuje se od one atoma lantana samo po tome što je potpuno ispunjen sa 4 f-podnivo.
Trenutno, u Periodnom sistemu elemenata D.I. Mendeljejev, ispod skandija Sc i itrijuma Y, lutecij (a ne lantan) se ponekad nalazi kao prvi d-element, i svih 14 elemenata ispred njega, uključujući lantan, stavljajući ga u posebnu grupu lantanidi izvan periodnog sistema elemenata.
Hemijska svojstva elemenata su uglavnom određena strukturom vanjskih elektronskih nivoa. Promjena broja elektrona na trećoj vanjskoj strani 4 f- podnivo ima mali uticaj na hemijska svojstva elemenata. Dakle sve 4 f elementi su slični po svojim svojstvima. Zatim u šestom periodu dolazi do popunjavanja 5 d-podnivo (Hf - Hg) i 6 str-podnivo (Tl - Rn).
U sedmom periodu 7 s-podnivo je popunjen za francij Fr (Z=87) i radij Ra (Z=88). Aktinijum ima odstupanje od pravila ( n+l), a sljedeći elektron popuni 6 d- podnivo, ne 5 f. Nakon toga slijedi grupa elemenata (Th - No) sa ispunom 5 f-podnivoi koji čine porodicu aktinidi. Imajte na umu da 6 d- i 5 f- podnivoi imaju tako bliske energije da elektronska konfiguracija atoma aktinida često ne poštuje pravilo ( n+l). Ali u ovom slučaju, tačna vrijednost konfiguracije je 5 f t 5d m nije toliko važno, jer ima prilično slab učinak na hemijska svojstva elementa.
Lorencijum Lr (Z=103) ima novi elektron na 6 d-podnivo. Ovaj element se ponekad stavlja u periodni sistem pod lutecijumom. Sedmi period nije završen. Elementi 104 – 109 su nestabilni i njihova svojstva su malo poznata. Dakle, kako se naboj jezgra povećava, slične elektronske strukture vanjskih nivoa se periodično ponavljaju. S tim u vezi treba očekivati i periodične promjene različitih svojstava elemenata.
Periodične promjene u svojstvima atoma hemijskih elemenata
Hemijska svojstva atoma elemenata se manifestuju tokom njihove interakcije. Tipovi konfiguracija spoljašnjih energetskih nivoa atoma određuju glavne karakteristike njihovog hemijskog ponašanja.
Karakteristike atoma svakog elementa koje određuju njegovo ponašanje u hemijskim reakcijama su energija jonizacije, afinitet prema elektronu, elektronegativnost.
Energija ionizacije je energija potrebna za odvajanje i uklanjanje elektrona iz atoma. Što je energija ionizacije manja, to je veća redukujuća snaga atoma. Stoga je energija jonizacije mjera redukcijske sposobnosti atoma.
Energija ionizacije potrebna za odvajanje prvog elektrona naziva se prva energija ionizacije I 1 . Energija potrebna za odvajanje drugog elektrona naziva se druga energija ionizacije I 2, itd. U ovom slučaju se javlja sljedeća nejednakost
I 1< I 2 < I 3 .
Odvajanje i uklanjanje elektrona od neutralnog atoma događa se lakše nego od nabijenog jona.
Maksimalna vrijednost energije jonizacije odgovara plemenitim plinovima. Alkalni metali imaju minimalnu vrijednost energije jonizacije.
Unutar jednog perioda, energija jonizacije varira nemonotono. U početku se smanjuje pri prelasku sa s-elemenata na prve p-elemente. Zatim se u narednim p-elementima povećava.
Unutar jedne grupe, sa povećanjem rednog broja elementa, energija ionizacije opada, što je posljedica povećanja udaljenosti između vanjskog nivoa i jezgra.
Elektronski afinitet je energija (označena sa E) koja se oslobađa kada je elektron vezan za atom. Kada atom prihvati elektron, on postaje negativno nabijeni ion. Afinitet elektrona u periodu raste, dok se u grupi po pravilu smanjuje.
Halogeni imaju najveći afinitet prema elektronima. Pričvršćivanjem elektrona koji nedostaje za kompletiranje ljuske, oni dobijaju potpunu konfiguraciju atoma plemenitog plina.
Elektronegativnost je zbir energije jonizacije i afiniteta elektrona
Elektronegativnost raste s periodom i opada sa podgrupom.
Atomi i joni nemaju striktno definisane granice zbog talasne prirode elektrona. Stoga se polumjeri atoma i iona određuju uslovno.
Najveći porast radijusa atoma uočen je kod elemenata malih perioda, u kojima je ispunjen samo vanjski energetski nivo, što je tipično za s- i p-elemente. Za d- i f-elemente, uočava se glatkiji porast radijusa s povećanjem nuklearnog naboja.
Unutar podgrupe, radijus atoma se povećava kako se povećava broj energetskih nivoa.
Struktura elektronskih omotača atoma elemenata prva četiri perioda: $s-$, $p-$ i $d-$elementi. Elektronska konfiguracija atoma. Osnovna i pobuđena stanja atoma
Koncept atoma nastao je u antičkom svijetu za označavanje čestica materije. Na grčkom, atom znači "nedjeljiv".
Elektroni
Irski fizičar Stoney je na osnovu eksperimenata došao do zaključka da elektricitet nose najmanje čestice koje postoje u atomima svih kemijskih elemenata. U 1891$, Stoney je predložio da se te čestice nazovu elektrona, što na grčkom znači "ćilibar".
Nekoliko godina nakon što je elektron dobio ime, engleski fizičar Joseph Thomson i francuski fizičar Jean Perrin dokazali su da elektroni nose negativan naboj. Ovo je najmanji negativni naboj, koji se u hemiji uzima kao jedinica $(–1)$. Thomson je čak uspio odrediti brzinu elektrona (jednaka je brzini svjetlosti - 300 000$ km/s) i masu elektrona (1836$ je puta manja od mase atoma vodonika).
Thomson i Perrin su spojili polove izvora struje s dvije metalne ploče - katodom i anodom, zalemljene u staklenu cijev, iz koje je evakuiran zrak. Kada je napon od oko 10 hiljada volti primijenjen na ploče elektroda, u cijevi je zabljesnulo svjetlosno pražnjenje, a čestice su poletjele sa katode (negativni pol) na anodu (pozitivni pol), koju su naučnici prvi nazvali katodne zrake, a zatim otkrio da je to bio tok elektrona. Elektroni, udarajući u posebne tvari nanesene, na primjer, na TV ekran, uzrokuju sjaj.
Zaključak je napravljen: elektroni izlaze iz atoma materijala od kojeg je napravljena katoda.
Slobodni elektroni ili njihov tok mogu se dobiti i na druge načine, na primjer, zagrijavanjem metalne žice ili padanjem svjetlosti na metale formirane od elemenata glavne podgrupe grupe I periodnog sistema (na primjer, cezijum).
Stanje elektrona u atomu
Stanje elektrona u atomu shvata se kao skup informacija o energije specifični elektron u prostor u kojoj se nalazi. Već znamo da elektron u atomu nema putanju kretanja, tj. mogu samo pričati vjerovatnoće pronalazeći ga u prostoru oko jezgra. Može se nalaziti u bilo kojem dijelu ovog prostora koji okružuje jezgro, a ukupnost njegovih različitih položaja smatra se elektronskim oblakom s određenom negativnom gustinom naboja. Slikovito, to se može zamisliti na sljedeći način: kada bi bilo moguće snimiti položaj elektrona u atomu u stotim ili milionitim dijelovima sekunde, kao u fotofinišu, tada bi elektron na takvim fotografijama bio predstavljen kao tačka. Preklapanje bezbrojnih takvih fotografija rezultiralo bi slikom elektronskog oblaka sa najvećom gustinom tamo gdje ima najviše ovih tačaka.
Na slici je prikazan "rez" takve elektronske gustine u atomu vodonika koji prolazi kroz jezgro, a sfera je ograničena isprekidanom linijom, unutar koje je vjerovatnoća pronalaska elektrona $90%$. Kontura najbliža jezgru pokriva područje prostora u kojem je vjerovatnoća pronalaska elektrona $10%$, vjerovatnoća pronalaženja elektrona unutar druge konture iz jezgra je $20%$, unutar treće - $≈30 %$ itd. Postoji određena nesigurnost u stanju elektrona. Kako bi okarakterizirao ovo posebno stanje, njemački fizičar W. Heisenberg uveo je koncept princip nesigurnosti, tj. pokazao da je nemoguće istovremeno i tačno odrediti energiju i lokaciju elektrona. Što je tačnije određena energija elektrona, to je njegov položaj nesigurniji, i obrnuto, nakon što se odredi položaj, nemoguće je odrediti energiju elektrona. Područje vjerovatnoće detekcije elektrona nema jasne granice. Međutim, moguće je izdvojiti prostor u kojem je vjerovatnoća pronalaska elektrona maksimalna.
Prostor oko atomskog jezgra, u kojem se najvjerovatnije nalazi elektron, naziva se orbitala.

Sadrži otprilike 90%$ elektronskog oblaka, što znači da je oko 90%$ vremena elektrona u ovom dijelu svemira. Prema obliku razlikuju se $4$ trenutno poznatih tipova orbitala koje se označavaju latiničnim slovima $s, p, d$ i $f$. Na slici je prikazan grafički prikaz nekih oblika elektronskih orbitala.

Najvažnija karakteristika kretanja elektrona u određenoj orbiti je energija njegove veze sa jezgrom. Elektroni sa sličnim energetskim vrijednostima čine jedan elektronski sloj, ili nivo energije. Energetski nivoi su numerisani počevši od jezgra: $1, 2, 3, 4, 5, 6$ i $7$.
Cijeli broj $n$ koji označava broj energetskog nivoa naziva se glavni kvantni broj.
Karakterizira energiju elektrona koji zauzimaju dati energetski nivo. Najmanju energiju imaju elektroni prvog energetskog nivoa, najbližeg jezgru. U poređenju sa elektronima prvog nivoa, elektroni narednih nivoa karakteriše velika količina energije. Posljedično, elektroni vanjskog nivoa su najmanje vezani za jezgro atoma.
Broj energetskih nivoa (elektronskih slojeva) u atomu jednak je broju perioda u sistemu D. I. Mendeljejeva, kome pripada hemijski element: atomi elemenata prvog perioda imaju jedan energetski nivo; drugi period - dva; sedmi period - sedam.
Najveći broj elektrona na energetskom nivou određen je formulom:
gdje je $N$ maksimalni broj elektrona; $n$ je broj nivoa, ili glavni kvantni broj. Posljedično: prvi energetski nivo najbliži jezgru ne može sadržavati više od dva elektrona; na drugom - ne više od 8$; na trećem - ne više od 18$; na četvrtom - ne više od 32$. A kako su, zauzvrat, raspoređeni energetski nivoi (elektronski slojevi)?
Počevši od drugog energetskog nivoa $(n = 2)$, svaki od nivoa je podeljen na podnivoe (podslojeve), koji se malo razlikuju jedan od drugog po energiji vezivanja sa jezgrom.
Broj podnivoa jednak je vrijednosti glavnog kvantnog broja: prvi energetski nivo ima jedan podnivo; drugi - dva; treći - tri; četvrti je četiri. Podnivoi su, pak, formirani orbitalama.
Svaka vrijednost od $n$ odgovara broju orbitala jednakih $n^2$. Prema podacima prikazanim u tabeli, moguće je pratiti odnos između glavnog kvantnog broja $n$ i broja podnivoa, vrste i broja orbitala, te maksimalnog broja elektrona po podnivou i nivou.
Glavni kvantni broj, vrste i broj orbitala, maksimalni broj elektrona na podnivoima i nivoima.
| Energetski nivo $(n)$ | Broj podnivoa jednak $n$ | Orbitalni tip | Broj orbitala | Maksimalni broj elektrona | ||
| u podnivou | na nivou jednakom $n^2$ | u podnivou | na nivou jednakom $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| $4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ | ||||
Uobičajeno je da se podnivoi označavaju latiničnim slovima, kao i oblik orbitala od kojih se sastoje: $s, p, d, f$. dakle:
- $s$-podnivo - prvi podnivo svakog energetskog nivoa najbližeg atomskom jezgru, sastoji se od jedne $s$-orbitale;
- $p$-podnivo - drugi podnivo svakog, osim prvog, energetskog nivoa, sastoji se od tri $p$-orbitale;
- $d$-podnivo - treći podnivo svakog, počevši od trećeg energetskog nivoa, sastoji se od pet $d$-orbitala;
- $f$-podnivo svake, počevši od četvrtog energetskog nivoa, sastoji se od sedam $f$-orbitala.
atomsko jezgro
Ali nisu samo elektroni dio atoma. Fizičar Henri Becquerel otkrio je da prirodni mineral koji sadrži uranijumovu so također emituje nepoznato zračenje, osvjetljavajući fotografske filmove koji su zatvoreni od svjetlosti. Ovaj fenomen je nazvan radioaktivnost.
Postoje tri vrste radioaktivnih zraka:
- $α$-zrake, koje se sastoje od $α$-čestica koje imaju naboj $2$ puta veći od naboja elektrona, ali sa pozitivnim predznakom, i masu $4$ puta veću od mase atoma vodika;
- $β$-zrake su tok elektrona;
- $γ$-zrake su elektromagnetski talasi sa zanemarljivom masom koji ne nose električni naboj.
Posljedično, atom ima složenu strukturu - sastoji se od pozitivno nabijenog jezgra i elektrona.
Kako je atom raspoređen?
Godine 1910. u Kembridžu, u blizini Londona, Ernest Rutherford sa svojim studentima i kolegama proučavao je raspršivanje $α$ čestica koje prolaze kroz tanku zlatnu foliju i padaju na ekran. Alfa čestice su obično odstupale od prvobitnog pravca samo za jedan stepen, potvrđujući, čini se, uniformnost i uniformnost svojstava atoma zlata. I odjednom su istraživači primijetili da su neke $α$-čestice naglo promijenile smjer svog puta, kao da nailaze na neku prepreku.
Postavljanjem ekrana ispred folije, Rutherford je uspio otkriti čak i one rijetke slučajeve kada su $α$-čestice, reflektirane od atoma zlata, letjele u suprotnom smjeru.
Proračuni su pokazali da bi se uočeni fenomeni mogli dogoditi ako se cijela masa atoma i sav njegov pozitivan naboj koncentrišu u malom centralnom jezgru. Radijus jezgra je, kako se ispostavilo, 100.000 puta manji od radijusa cijelog atoma, tog područja u kojem se nalaze elektroni koji imaju negativan naboj. Ako primenimo figurativno poređenje, onda se čitav volumen atoma može uporediti sa stadionom Lužnjiki, a jezgro se može uporediti sa fudbalskom loptom koja se nalazi u centru terena.
Atom bilo kog hemijskog elementa je uporediv sa sićušnim solarnim sistemom. Stoga se takav model atoma, koji je predložio Rutherford, naziva planetarnim.
Protoni i neutroni
Ispostavilo se da se sićušna atomska jezgra, u kojoj je koncentrirana cijela masa atoma, sastoji od čestica dvije vrste - protona i neutrona.
Protoni imaju naboj jednak naboju elektrona, ali suprotan predznakom $(+1)$, i masu jednaku masi atoma vodika (u hemiji je prihvaćena kao jedinica). Protoni su označeni sa $↙(1)↖(1)p$ (ili $r+$). Neutroni ne nose naelektrisanje, neutralni su i imaju masu jednaku masi protona, tj. $1$. Neutroni su označeni sa $↙(0)↖(1)n$ (ili $n^0$).
Protoni i neutroni se zajednički nazivaju nukleoni(od lat. jezgro- jezgro).
Zove se zbir broja protona i neutrona u atomu maseni broj. Na primjer, maseni broj atoma aluminija:

Pošto se masa elektrona, koja je zanemarljiva, može zanemariti, očigledno je da je čitava masa atoma koncentrisana u jezgru. Elektroni se označavaju na sljedeći način: $e↖(-)$.
Budući da je atom električno neutralan, to je također očigledno da je broj protona i elektrona u atomu isti. On je jednak atomskom broju hemijskog elementa dodijeljena mu u periodnom sistemu. Na primjer, jezgro atoma željeza sadrži $26$ protona, a $26$ elektrona kruže oko jezgra. I kako odrediti broj neutrona?
Kao što znate, masa atoma je zbir mase protona i neutrona. Poznavajući redni broj elementa $(Z)$, tj. broj protona i maseni broj $(A)$, jednak zbroju brojeva protona i neutrona, možete pronaći broj neutrona $(N)$ koristeći formulu:
Na primjer, broj neutrona u atomu željeza je:
$56 – 26 = 30$.
Tabela prikazuje glavne karakteristike elementarnih čestica.
Osnovne karakteristike elementarnih čestica.
izotopi
Raznolikosti atoma istog elementa koji imaju isti nuklearni naboj, ali različite masene brojeve nazivaju se izotopi.
Riječ izotop sastoji se od dvije grčke riječi: isos- isto i topos- mjesto, znači "zauzeti jedno mjesto" (ćelija) u Periodnom sistemu elemenata.
Hemijski elementi koji se nalaze u prirodi su mješavina izotopa. Dakle, ugljenik ima tri izotopa sa masom od $12, 13, 14$; kiseonik - tri izotopa mase 16, 17, 18 dolara itd.
Obično se daje u periodičnom sistemu, relativna atomska masa hemijskog elementa je prosečna vrednost atomskih masa prirodne mešavine izotopa datog elementa, uzimajući u obzir njihovu relativnu zastupljenost u prirodi, dakle, vrednosti atomske mase su često frakcione. Na primjer, prirodni atomi hlora su mješavina dva izotopa - $35$ (u prirodi ima $75%$) i $37$ (ima $25%$); stoga je relativna atomska masa hlora 35,5$. Izotopi hlora zapisuju se na sljedeći način:
$↖(35)↙(17)(Cl)$ i $↖(37)↙(17)(Cl)$
Hemijska svojstva izotopa hlora su potpuno ista kao i izotopi većine hemijskih elemenata, kao što su kalij, argon:
$↖(39)↙(19)(K)$ i $↖(40)↙(19)(K)$, $↖(39)↙(18)(Ar)$ i $↖(40)↙(18 )(Ar)$
Međutim, izotopi vodika se jako razlikuju po svojstvima zbog dramatičnog povećanja njihove relativne atomske mase; čak su dobili pojedinačna imena i hemijske znakove: protij - $↖(1)↙(1)(H)$; deuterijum - $↖(2)↙(1)(H)$, ili $↖(2)↙(1)(D)$; tricijum - $↖(3)↙(1)(H)$, ili $↖(3)↙(1)(T)$.

Sada je moguće dati modernu, rigorozniju i naučniju definiciju hemijskog elementa.
Hemijski element je skup atoma s istim nuklearnim nabojem.
Struktura elektronskih ljuski atoma elemenata prva četiri perioda
Razmotrite mapiranje elektronskih konfiguracija atoma elemenata po periodima sistema D. I. Mendeljejeva.
Elementi prvog perioda.
Šeme elektronske strukture atoma pokazuju distribuciju elektrona po elektronskim slojevima (energetski nivoi).

Elektronske formule atoma pokazuju distribuciju elektrona po energetskim nivoima i podnivoima.
Grafičke elektronske formule atoma pokazuju distribuciju elektrona ne samo po nivoima i podnivoima, već i po orbitalama.

U atomu helijuma, prvi elektronski sloj je kompletan - ima 2$ elektrona.
Vodik i helijum su $s$-elementi, ovi atomi imaju $s$-orbitale ispunjene elektronima.
Elementi drugog perioda.
Za sve elemente drugog perioda, prvi elektronski sloj je popunjen, a elektroni popunjavaju $s-$ i $p$ orbitale drugog elektronskog sloja u skladu sa principom najmanje energije (prvo $s$, zatim $ p$) i pravila Paulija i Hunda.
U atomu neona, drugi elektronski sloj je kompletan - ima elektrona od 8$.
Elementi trećeg perioda.
Za atome elemenata trećeg perioda, prvi i drugi elektronski sloj su kompletirani, pa je ispunjen treći elektronski sloj u kojem elektroni mogu zauzimati 3s-, 3p- i 3d-podnivo.
Struktura elektronskih ljuski atoma elemenata trećeg perioda.
Orbitala elektrona od 3,5$ je završena na atomu magnezija. $Na$ i $Mg$ su $s$-elementi.
Za aluminijum i naknadne elemente, $3d$ podnivo je ispunjen elektronima.
| $↙(18)(Ar)$ Argon |  |
$1s^2(2)s^2(2)p^6(3)s^2(3)p^6$ |  |
U atomu argona, vanjski sloj (treći elektronski sloj) ima $8$ elektrona. Kako je vanjski sloj završen, ali ukupno, u trećem elektronskom sloju, kao što već znate, može biti 18 elektrona, što znači da elementi trećeg perioda imaju $3d$-orbitale koje su ostale nepopunjene.
Svi elementi od $Al$ do $Ar$ - $p$ -elementi.
$s-$ i $r$ -elementi formu glavne podgrupe u periodičnom sistemu.
Elementi četvrtog perioda.
Atomi kalijuma i kalcijuma imaju četvrti elektronski sloj, $4s$-podnivo je ispunjen, jer ima manje energije od $3d$-podnivoa. Da pojednostavimo grafičke elektronske formule atoma elemenata četvrtog perioda:
- grafičku elektronsku formulu argona uslovno označavamo na sljedeći način: $Ar$;
- nećemo prikazivati podnivoe koji nisu ispunjeni za ove atome.
$K, Ca$ - $s$ -elementi, uključeni u glavne podgrupe. Za atome od $Sc$ do $Zn$, 3d podnivo je ispunjen elektronima. Ovo su $3d$-elementi. Oni su uključeni u bočne podgrupe, njihov pred-eksterni elektronski sloj je ispunjen, na njih se poziva prelaznih elemenata.
Obratite pažnju na strukturu elektronskih ljuski atoma hroma i bakra. U njima jedan elektron "pada" sa $4s-$ na $3d$ podnivo, što se objašnjava većom energetskom stabilnošću rezultirajućih $3d^5$ i $3d^(10)$ elektronskih konfiguracija:
$↙(24)(Cr)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(4) 4s^(2)…$ 
$↙(29)(Cu)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(9)4s^(2)…$ 
| Simbol elementa, serijski broj, naziv | Dijagram elektronske strukture | Elektronska formula | Grafička elektronska formula |
| $↙(19)(K)$ Kalijum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1$ | |
| $↙(20)(C)$ Kalcijum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2$ | |
| $↙(21)(Sc)$ Scandium |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^1$ ili $1s^2(2)s^2(2)p ^6(3)p^6(3)d^1(4)s^1$ |  |
| $↙(22)(Ti)$ Titanijum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^2$ ili $1s^2(2)s^2(2)p ^6(3)p^6(3)d^2(4)s^2$ |  |
| $↙(23)(V)$ Vanadijum |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^3$ ili $1s^2(2)s^2(2)p ^6(3)p^6(3)d^3(4)s^2$ |  |
| $↙(24)(Cr)$ Chrome |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^5$ ili $1s^2(2)s^2(2)p ^6(3)p^6(3)d^5(4)s^1$ |  |
| $↙(29)(Su)$ Chromium |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^(10)$ ili $1s^2(2)s^2(2 )p^6(3)p^6(3)d^(10)(4)s^1$ |  |
| $↙(30)(Zn)$ Cink |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)$ ili $1s^2(2)s^2(2 )p^6(3)p^6(3)d^(10)(4)s^2$ |  |
| $↙(31)(Ga)$ Galij |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^(1)$ ili $1s^2(2) s^2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^(1)$ |  |
| $↙(36)(Kr)$ Krypton |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^6$ ili $1s^2(2)s^ 2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^6$ |  |
U atomu cinka, treći elektronski sloj je gotov - svi $3s, 3p$ i $3d$ podnivoi su popunjeni, na njima je ukupno $18$ elektrona.
U elementima nakon cinka, četvrti elektronski sloj, $4p$-podnivo, nastavlja da bude ispunjen. Elementi od $Ga$ do $Kr$ - $r$ -elementi.
Vanjski (četvrti) sloj atoma kriptona je završen, ima 8$ elektrona. Ali samo u četvrtom elektronskom sloju, kao što znate, može biti 32$ elektrona; atom kriptona još uvijek ima nepopunjene $4d-$ i $4f$-podnivoe.
Elementi petog perioda popunjavaju podnivoe sledećim redosledom: $5s → 4d → 5r$. A postoje i izuzeci vezani za "neuspjeh" elektrona, za $↙(41)Nb$, $↙(42)Mo$, $↙(44)Ru$, $↙(45)Rh$, $↙( 46) Pd$, $↙(47)Ag$. $f$ se pojavljuju u šestom i sedmom periodu -elementi, tj. elementi čiji se $4f-$ i $5f$-podnivo trećeg vanjskog elektronskog sloja popunjavaju, respektivno.
$4f$ -elementi pozvao lantanidi.
$5f$ -elementi pozvao aktinidi.
Redoslijed popunjavanja elektronskih podnivoa u atomima elemenata šestog perioda: $↙(55)Cs$ i $↙(56)Ba$ - $6s$-elementi; $↙(57)La ... 6s^(2)5d^(1)$ - $5d$-element; $↙(58)Ce$ – $↙(71)Lu - 4f$-elementi; $↙(72)Hf$ – $↙(80)Hg - 5d$-elementi; $↙(81)T1$ – $↙(86)Rn - 6d$-elementi. Ali i ovdje postoje elementi u kojima je narušen redoslijed popunjavanja elektronskih orbitala, što je, na primjer, povezano sa većom energetskom stabilnošću polu i potpuno ispunjenih $f$-podnivoa, tj. $nf^7$ i $nf^(14)$.
Ovisno o tome koji je podnivo atoma posljednji ispunjen elektronima, svi elementi, kao što ste već shvatili, podijeljeni su u četiri elektronske porodice, ili blokove:
- $s$ -elementi;$s$-podnivo vanjskog nivoa atoma je ispunjen elektronima; $s$-elementi uključuju vodonik, helijum i elemente glavnih podgrupa grupa I i II;
- $r$ -elementi;$p$-podnivo vanjskog nivoa atoma je ispunjen elektronima; $p$-elementi uključuju elemente glavnih podgrupa grupa III–VIII;
- $d$ -elementi;$d$-podnivo predspoljnog nivoa atoma je ispunjen elektronima; $d$-elementi uključuju elemente sekundarnih podgrupa grupa I–VIII, tj. elementi interkaliranih decenija velikih perioda koji se nalaze između $s-$ i $p-$elemenata. Oni se takođe zovu prijelazni elementi;
- $f$ -elementi;$f-$podnivo trećeg nivoa atoma izvana je ispunjen elektronima; tu spadaju lantanidi i aktinidi.

Elektronska konfiguracija atoma. Osnovna i pobuđena stanja atoma
Švicarski fizičar W. Pauli u 1925$ je to ustanovio Atom može imati najviše dva elektrona u jednoj orbitali. ima suprotne (antiparalelne) vrtnje (prevedeno sa engleskog kao vreteno), tj. posjeduju takva svojstva koja se uslovno mogu zamisliti kao rotacija elektrona oko njegove imaginarne ose u smjeru kazaljke na satu ili suprotno od kazaljke na satu. Ovaj princip se zove Paulijev princip.
Ako postoji jedan elektron u orbitali, onda se to zove unpaired, ako dva, onda ovo upareni elektroni, tj. elektrona sa suprotnim spinovima.
Na slici je prikazan dijagram podjele energetskih nivoa na podnivoe.

$s-$ Orbital, kao što već znate, ima sferni oblik. Elektron atoma vodika $(n = 1)$ nalazi se na ovoj orbitali i nije uparen. Prema ovom njegovom elektronska formula, ili elektronska konfiguracija, piše se ovako: $1s^1$. U elektronskim formulama, broj energetskog nivoa je označen brojem ispred slova $ (1 ...) $, podnivo (orbitalni tip) je označen latiničnim slovom, a broj koji je upisan u desno od slova (kao eksponent) prikazuje broj elektrona u podnivou.
Za atom helijuma He, koji ima dva uparena elektrona na istoj $s-$orbitali, ova formula je: $1s^2$. Elektronska ljuska atoma helija je kompletna i vrlo stabilna. Helijum je plemeniti gas. Drugi energetski nivo $(n = 2)$ ima četiri orbitale, jednu $s$ i tri $p$. $s$-orbitalni elektroni drugog nivoa ($2s$-orbitale) imaju veću energiju, jer su na većoj udaljenosti od jezgra od elektrona $1s$-orbitale $(n = 2)$. Općenito, za svaku vrijednost $n$ postoji jedna $s-$orbitala, ali sa odgovarajućom količinom energije elektrona na njoj i, prema tome, sa odgovarajućim prečnikom, koji raste kao vrijednost $n$.$s- $Orbitalni porast, kao što već znate, ima sferni oblik. Elektron atoma vodika $(n = 1)$ nalazi se na ovoj orbitali i nije uparen. Stoga se njegova elektronska formula, ili elektronska konfiguracija, piše na sljedeći način: $1s^1$. U elektronskim formulama, broj energetskog nivoa je označen brojem ispred slova $ (1 ...) $, podnivo (orbitalni tip) je označen latiničnim slovom, a broj koji je upisan u desno od slova (kao eksponent) prikazuje broj elektrona u podnivou.
Za atom helijuma $He$, koji ima dva uparena elektrona u istoj $s-$orbitali, ova formula je: $1s^2$. Elektronska ljuska atoma helija je kompletna i vrlo stabilna. Helijum je plemeniti gas. Drugi energetski nivo $(n = 2)$ ima četiri orbitale, jednu $s$ i tri $p$. Elektroni $s-$orbitala drugog nivoa ($2s$-orbitale) imaju veću energiju, jer su na većoj udaljenosti od jezgra od elektrona $1s$-orbitale $(n = 2)$. Općenito, za svaku vrijednost od $n$ postoji jedna $s-$orbitala, ali sa odgovarajućom količinom energije elektrona na njoj i, prema tome, sa odgovarajućim prečnikom, koji raste kako se vrijednost $n$ povećava. 
$r-$ Orbital Ima oblik bučice, odnosno zapremine osam. Sve tri $p$-orbitale nalaze se u atomu međusobno okomito duž prostornih koordinata povučenih kroz jezgro atoma. Treba još jednom naglasiti da svaki energetski nivo (elektronski sloj), počevši od $n= 2$, ima tri $p$-orbitale. Kako vrijednost $n$ raste, elektroni zauzimaju $p$-orbitale smještene na velikim udaljenostima od jezgra i usmjerene duž osa $x, y, z$.
Za elemente drugog perioda $(n = 2)$ prvo se popunjava jedna $s$-orbitala, a zatim tri $p$-orbitale; elektronska formula $Li: 1s^(2)2s^(1)$. Elektron $2s^1$ je manje vezan za atomsko jezgro, tako da ga atom litijuma lako može odati (kao što se vjerovatno sjećate, ovaj proces se naziva oksidacija), pretvarajući se u litijum jon $Li^+$.
U atomu berilijuma Be, četvrti elektron je takođe smešten u $2s$ orbitalu: $1s^(2)2s^(2)$. Dva vanjska elektrona atoma berilijuma se lako odvajaju - $B^0$ se oksidira u $Be^(2+)$ kation.
Peti elektron atoma bora zauzima $2p$-orbitalu: $1s^(2)2s^(2)2p^(1)$. Zatim se popunjavaju $2p$-orbitale atoma $C, N, O, F$, što se završava neonskim plemenitim gasom: $1s^(2)2s^(2)2p^(6)$.
Za elemente trećeg perioda, $3s-$ i $3p$-orbitale su popunjene, respektivno. Pet $d$-orbitala trećeg nivoa ostaje slobodno:
$↙(11)Na 1s^(2)2s^(2)2p^(6)3s^(1)$,
$↙(17)Cl 1s^(2)2s^(2)2p^(6)3s^(2)3p^(5)$,
$↙(18)Ar 1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)$.
Ponekad je u dijagramima koji prikazuju distribuciju elektrona u atomima naznačen samo broj elektrona na svakom energetskom nivou, tj. napisati skraćene elektronske formule atoma hemijskih elemenata, za razliku od gornjih potpunih elektronskih formula, na primjer:
$↙(11)Na 2, 8, 1;$ $↙(17)Cl 2, 8, 7;$ $↙(18)Ar 2, 8, 8$.
Za elemente velikih perioda (četvrti i peti), prva dva elektrona zauzimaju $4s-$ i $5s$-orbitale: $↙(19)K 2, 8, 8, 1;$ $↙(38)Sr 2 , 8, 18, 8, 2$. Počevši od trećeg elementa svakog velikog perioda, sljedećih deset elektrona će ići na prethodne $3d-$ i $4d-$orbitale, respektivno (za elemente sekundarnih podgrupa): $↙(23)V 2, 8, 11 , 2;$ $↙( 26)Fr 2, 8, 14, 2;$ $↙(40)Zr 2, 8, 18, 10, 2;$ $↙(43)Tc 2, 8, 18, 13, 2$. Po pravilu, kada se prethodni $d$-podnivo popuni, vanjski (odnosno $4p-$ i $5p-$) $p-$podnivo će početi da se popunjava: $↙(33)Kao 2, 8, 18, 5;$ $ ↙(52)Te 2, 8, 18, 18, 6$.
Za elemente velikih perioda - šesti i nepotpuni sedmi - elektronski nivoi i podnivoi su ispunjeni elektronima, po pravilu, na sledeći način: prva dva elektrona ulaze u spoljašnji $s-$podnivo: $↙(56)Ba 2, 8 , 18, 18, 8, 2;$ $↙(87)Fr 2, 8, 18, 32, 18, 8, 1$; sljedeći jedan elektron (za $La$ i $Ca$) na prethodni $d$-podnivo: $↙(57)La 2, 8, 18, 18, 9, 2$ i $↙(89)Ac 2, 8, 18, 32, 18, 9, 2$.
Tada će sljedećih $14$ elektrona ući u treći energetski nivo izvana, na $4f$ i $5f$ orbitale lantonida i aktinida, redom: $↙(64)Gd 2, 8, 18, 25, 9, 2 ;$ $↙(92 )U 2, 8, 18, 32, 21, 9, 2$.
Tada će drugi energetski nivo izvana ($d$-podnivo) ponovo početi da se stvara za elemente bočnih podgrupa: $↙(73)Ta 2, 8, 18, 32, 11, 2;$ $↙( 104)Rf 2, 8, 18 , 32, 32, 10, 2$. I, konačno, tek nakon što je $d$-podnivo potpuno ispunjen sa deset elektrona, $p$-podnivo će biti ponovo popunjen: $↙(86)Rn 2, 8, 18, 32, 18, 8$.
Vrlo često se struktura elektronskih omotača atoma prikazuje pomoću energije ili kvantnih ćelija - one zapisuju tzv. grafičke elektronske formule. Za ovaj zapis koristi se sljedeća notacija: svaka kvantna ćelija je označena ćelijom koja odgovara jednoj orbitali; svaki elektron je označen strelicom koja odgovara smjeru spina. Prilikom pisanja grafičke elektronske formule, treba imati na umu dva pravila: Paulijev princip, prema kojem ćelija (orbitala) ne može imati više od dva elektrona, ali sa antiparalelnim spinovima, i F. Hundovo pravilo, prema kojem elektroni zauzimaju slobodne ćelije prvo jednu po jednu i istovremeno imaju istu vrijednost spina, pa tek onda uparuju, ali će spinovi, prema Paulijevom principu, već biti suprotno usmjereni.
Zadatak 1. Napišite elektronske konfiguracije sljedećih elemenata: N, Si, F e, Kr , Te, W .
Rješenje. Energija atomskih orbitala raste sljedećim redoslijedom:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d .
Na svakoj s-ljusci (jedna orbitala) ne može biti više od dva elektrona, na p-ljusci (tri orbitale) - ne više od šest, na d-ljusci (pet orbitala) - ne više od 10 i na f-ljuska (sedam orbitala) - ne više od 14.
U osnovnom stanju atoma, elektroni zauzimaju orbitale s najnižom energijom. Broj elektrona jednak je naboju jezgra (atom je u cjelini neutralan) i atomskom broju elementa. Na primjer, atom dušika ima 7 elektrona, od kojih su dva u 1s orbitalama, dva u 2s orbitalama, a preostala tri elektrona su u 2p orbitalama. Elektronska konfiguracija atoma dušika:
7 N : 1s 2 2s 2 2p 3 . Elektronske konfiguracije ostalih elemenata:
14 Si: 1s 2 2s 2 2p 6 3s 2 3p 2 ,
26 F e : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 ,
36 K r: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 ,
52 Oni : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 4 ,
74 Oni : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 .
Zadatak 2. Koji inertni plin i ioni kojih elemenata imaju istu elektronsku konfiguraciju kao i čestica koja nastaje uklanjanjem svih valentnih elektrona iz atoma kalcija?
Rješenje. Elektronska ljuska atoma kalcija ima strukturu 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . Kada se uklone dva valentna elektrona, formira se ion Ca 2+ sa konfiguracijom 1s 2 2s 2 2p 6 3s 2 3p 6 . Atom ima istu elektronsku konfiguraciju Ar i joni S 2-, Cl -, K +, Sc 3+, itd.
Zadatak 3. Mogu li elektroni jona Al 3+ biti na sljedećim orbitalama: a) 2p; b) 1r; c) 3d?
Rješenje. Elektronska konfiguracija atoma aluminija: 1s 2 2s 2 2p 6 3s 2 3p 1 . Al 3+ jon nastaje uklanjanjem tri valentna elektrona iz atoma aluminijuma i ima elektronsku konfiguraciju 1s 2 2s 2 2p 6 .
a) elektroni su već u 2p orbitali;
b) u skladu sa ograničenjima nametnutim kvantnom broju l (l = 0, 1, ... n -1), pri n = 1 moguća je samo vrijednost l = 0, dakle, 1p orbitala ne postoji ;
c) elektroni mogu biti u 3d orbitali ako je jon u pobuđenom stanju.
Zadatak 4. Napišite elektronsku konfiguraciju atoma neona u prvom pobuđenom stanju.
Rješenje. Elektronska konfiguracija atoma neona u osnovnom stanju je 1s 2 2s 2 2p 6 . Prvo pobuđeno stanje se dobija prelaskom jednog elektrona sa najviše zauzete orbitale (2p) na najnižu slobodnu orbitu (3s). Elektronska konfiguracija atoma neona u prvom pobuđenom stanju je 1s 2 2s 2 2p 5 3s 1 .
Zadatak 5. Kakav je sastav jezgara izotopa 12 C i 13 C , 14 N i 15 N ?
Rješenje. Broj protona u jezgru jednak je atomskom broju elementa i isti je za sve izotope ovog elementa. Broj neutrona jednak je masenom broju (označenom gore lijevo od broja elementa) umanjenom za broj protona. Različiti izotopi istog elementa imaju različit broj neutrona.
Sastav ovih jezgara:
12 C: 6p + 6n; 13 C: 6p + 7n; 14 N : 7p + 7n ; 15N: 7p + 8n.
Elektronska konfiguracija- formula za raspored elektrona u raznim elektronskim ljuskama atoma hemijskog elementa ili molekula.
Elektronska konfiguracija se obično piše za atome u njihovom osnovnom stanju. Za određivanje elektronske konfiguracije elementa postoje sljedeća pravila:
- Princip punjenja. Prema principu punjenja, elektroni u osnovnom stanju atoma ispunjavaju orbite u nizu rastućih nivoa orbitalne energije. Orbitale najniže energije se uvijek prve popunjavaju.
- Paulijev princip isključenja. Prema ovom principu, na bilo kojoj orbitali ne mogu biti više od dva elektrona, i to samo ako imaju suprotne spinove (nejednaki spin brojevi).
- Hundovo pravilo. Prema ovom pravilu, punjenje orbitala jedne podljuske počinje pojedinačnim elektronima sa paralelnim (istih predznaka) spinovima, a tek nakon što pojedinačni elektroni zauzmu sve orbitale, konačno punjenje orbitala parovima elektrona sa suprotnim spinovima može doći.
Sa stanovišta kvantne mehanike, elektronska konfiguracija je potpuna lista jednoelektronskih talasnih funkcija, iz kojih je, sa dovoljnim stepenom tačnosti, moguće sastaviti kompletnu talasnu funkciju atoma (u aproksimaciji samokonzistentno polje).
Uopšteno govoreći, atom, kao kompozitni sistem, može se u potpunosti opisati samo punom talasnom funkcijom. Međutim, takav opis je praktički nemoguć za atome složenije od atoma vodika, najjednostavnijeg od svih atoma kemijskih elemenata. Pogodan približan opis je metoda samodoslednog polja. Ova metoda uvodi koncept valne funkcije svakog elektrona. Talasna funkcija cijelog sistema je zapisana kao pravilno simetrizovani proizvod jednoelektronskih valnih funkcija. Prilikom izračunavanja valne funkcije svakog elektrona, polje svih ostalih elektrona se uzima u obzir kao vanjski potencijal, koji zauzvrat ovisi o valnim funkcijama ovih drugih elektrona.
Kao rezultat primjene metode samokonzistentnog polja, dobija se složen sistem nelinearnih integro-diferencijalnih jednačina, koji je još uvijek teško riješiti. Međutim, jednadžbe samokonzistentnog polja imaju rotacijsku simetriju originalnog problema (to jest, sferno su simetrične). Ovo omogućava da se u potpunosti klasifikuju talasne funkcije jednog elektrona koje čine kompletnu talasnu funkciju atoma.
Za početak, kao u svakom centralno simetričnom potencijalu, valna funkcija u samokonzistentnom polju može se okarakterizirati kvantnim brojem ukupnog kutnog momenta l (\displaystyle l) i kvantni broj projekcije ugaonog momenta na neku osu m (\displaystyle m). Valne funkcije s različitim vrijednostima m (\displaystyle m) odgovaraju istom energetskom nivou, tj. degenerisani su. Takođe, jedan energetski nivo odgovara stanjima sa različitim projekcijama spina elektrona na bilo koju osu. Ukupno za dati nivo energije 2 (2 l + 1) (\displaystyle 2(2l+1)) valne funkcije. Nadalje, za datu vrijednost ugaonog momenta, energetski nivoi se mogu prenumerisati. Po analogiji sa atomom vodonika, uobičajeno je numerisati nivoe energije za dati l (\displaystyle l) počevši od n = l + 1 (\displaystyle n=l+1). Potpuna lista kvantnih brojeva jednoelektronskih valnih funkcija, od kojih se može sastaviti valna funkcija atoma, naziva se elektronska konfiguracija. Pošto je sve degenerisano u kvantnom broju m (\displaystyle m) a na spinu je dovoljno naznačiti ukupan broj elektrona u stanju sa podacima n (\displaystyle n), l (\displaystyle l).
Enciklopedijski YouTube
-
1 / 5
Iz istorijskih razloga, u formuli elektronske konfiguracije, kvantni broj l (\displaystyle l) napisan latiničnim slovima. Stanje sa je označeno slovom s (\displaystyle s), p (\displaystyle p): l = 1 (\displaystyle l=1), d (\displaystyle d): l = 2 (\displaystyle l=2), f (\displaystyle f): l = 3 (\displaystyle l=3), g (\displaystyle g): l = 4 (\displaystyle l=4) i tako dalje po abecednom redu. Lijevo od broja l (\displaystyle l) napiši broj n (\displaystyle n), i na vrhu broja l (\displaystyle l) je broj elektrona u stanju podataka n (\displaystyle n) i l (\displaystyle l). Na primjer 2 s 2 (\displaystyle 2s^(2)) odgovara dva elektrona u stanju sa n = 2 (\displaystyle n=2), l = 0 (\displaystyle l=0). Zbog praktične pogodnosti (vidi pravilo Klečkovskog), u punoj formuli za elektronsku konfiguraciju, termini su zapisani uzlaznim redoslijedom kvantnog broja n (\displaystyle n), a zatim kvantni broj l (\displaystyle l), na primjer 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3 (\displaystyle 1s^(2)2s^(2)2p^(6)3s^(2)3p^(3)). Budući da je takva notacija pomalo suvišna, ponekad se formula svodi na 1 s 2 2 s 2 p 6 3 s 2 p 3 (\displaystyle 1s^(2)2s^(2)p^(6)3s^(2)p^(3)), tj. izostaviti broj n (\displaystyle n) gdje se može naslutiti iz pojma pravilo reda.
Periodični zakon i struktura atoma
Svi oni koji su uključeni u strukturu atoma u bilo kojoj svojoj studiji polaze od alata koje im daje periodični zakon, koji je otkrio hemičar D. I. Mendeljejev; samo u svom razumijevanju ovog zakona, fizičari i matematičari koriste svoj "jezik" da tumače ovisnosti koje je on pokazao (iako je poznat prilično ironičan aforizam J. W. Gibbsa o ovoj temi), ali, u isto vrijeme, izolovani od hemičara koji proučavaju materije, uz sav savršenstvo, prednosti i univerzalnost svog aparata, ni fizičari ni matematičari, naravno, ne mogu izgraditi svoja istraživanja.
U daljem razvoju teme uočava se i interakcija predstavnika ovih disciplina. Otkriće sekundarne periodičnosti E. V. Birona (1915) dalo je još jedan aspekt u razumijevanju pitanja vezanih za pravilnosti strukture elektronskih ljuski. S. A. Shukarev, učenik E. V. Birona i
Elektronska konfiguracija atoma je prikazuje distribuciju energije ē. nivoa i podnivoa.
1s 1 ←broj ē sa datim oblikom oblaka
↖ oblik elektronskog oblaka
nivo energije
Grafičke elektronske formule (slike elektronske strukture atoma) -
prikazuje distribuciju energije ē. nivoa, podnivoa i orbitala.
I period:+1 N
Gdje je - ē, ↓ - ē sa antiparalelnim spinovima, orbitalno.
Prilikom pisanja grafičke elektronske formule treba se sjetiti Paulijevog pravila i Hundovo pravilo “Ako postoji nekoliko slobodnih orbitala unutar jednog podnivoa, onda se ē postavljaju svaka na zasebnu orbitalu i samo u nedostatku slobodnih orbitala se kombinuju u parove.”
(Rad sa elektronskim i grafičkim elektronskim formulama).
Na primjer, H +1 1s 1 ; On +2 1s 2 ; Li +3 1s 2 2s 1 ; Na +11 1s 2 2s 2 2p 6 3s 1 ; Ar +18 1s 2 2s 2 2p 6 3s 2 3p 6 ;
I period: vodonik i helijum – s-elementi, njihova s-orbitala je ispunjena elektronima.
II period: Li i Be su s-elementi
B, C, N, O, F, Ne - p-elementi
Ovisno o tome koji je podnivo atoma posljednji ispunjen elektronima, svi elementi se dijele u 4 elektronske porodice ili blokove:
1) s-elementi – imaju ē-mi s-podnivo vanjskog sloja atoma; to uključuje vodonik, helijum i e-you gl.p / gr. I i II grupe.
2) p-elementi - oni ispunjavaju elektronski svet-podnivo spoljašnjeg nivoa atoma; to uključuje elemente gl.p / gr. III - VIII grupe.
3) d-elementi - u njima je d-podnivo predspoljnog nivoa atoma ispunjen elektronima; to uključuje e-you poboch.p / gr. . I-VIII grupe, tj. el-you plug-in decenijama velikih perioda, koji se nalaze između s- i p-elemenata, nazivaju se i prijelaznim elementima.
4) f-elementi- f-podnivo trećeg nivoa atoma spolja ispunjen je elektronima; ovo uključuje lantanoide (4f-elementi) i aktinide (5f-elemente).
Atomi bakra i hroma imaju "neuspjeh" ē sa 4s- na 3d-podnivo, što se objašnjava većom energetskom stabilnošću rezultirajućih elektronskih konfiguracija 3d 5 i 3d 10:
29 Cu 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Eksperimentalno je dokazano da su stanja atoma u kojima su p-, d-, f-orbitale napola popunjene (p 3 , d 5 , f 7 ), potpuno (p 6 , d 10 , f 14 ) ili slobodne , imaju povećanu stabilnost. Ovo objašnjava prelaze - "padove" - elektrona između blisko raspoređenih orbitala. Ista odstupanja uočena su i kod analoga hroma - molibdena, kao iu elementima podgrupe bakra - srebra i zlata. Jedinstven u ovom pogledu je paladijum, čiji atom uopšte nema 5s elektrona i koji ima trag. Konfiguracija: 46 Pd 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10 .
Pitanja za samokontrolu
1. Šta je oblak elektrona?
2. Koja je razlika između 1s-orbitale i 2s-orbitale?
3. Koji je glavni kvantni broj? Kako se to odnosi na broj perioda?
4. Šta je podnivo i kako se ovaj koncept odnosi na broj perioda?
5. Sastaviti elektronske konfiguracije atoma elemenata 4-6 iz PSCE perioda.
6. Sastavite elektronsku konfiguraciju atoma magnezija i neona.
7. Odredi koji atom pripada elektronskoj konfiguraciji 1S 2 2S 2 2p 6 3S 1, 1S 2 2S 2 2p 6 3S 2, 1S 2 2S 2 2p 4, 1S 2 2S 1
PLAN ČASA #7
disciplina: hemija.
Tema:
Svrha lekcije: Proučiti mehanizme formiranja ionskih i kovalentnih veza, razmotriti ionske, atomske i molekularne kristalne rešetke.
Planirani rezultati
Predmet: posedovanje osnovnih hemijskih pojmova: hemijska veza, joni, kristalne rešetke, pouzdano korišćenje hemijske terminologije i simbola; formiranje sposobnosti davanja kvantitativnih procjena i proračuna prema hemijskim formulama i jednačinama;
metasubjekt: upotreba raznih vrsta kognitivnih aktivnosti i osnovnih intelektualnih operacija: kompilacija elektronskih konfiguracija atoma hemijskih elemenata.
Lični: sposobnost korišćenja dostignuća savremene hemijske nauke i hemijskih tehnologija za povećanje sopstvenog intelektualnog razvoja u izabranoj profesionalnoj delatnosti;
Vremenska norma: 2 sata
Vrsta razreda: Predavanje.
Plan lekcije:
1. Kationi, njihovo nastajanje iz atoma kao rezultat procesa oksidacije. Anioni, njihovo stvaranje iz atoma kao rezultat procesa redukcije. Jonska veza, kao veza između kationa i aniona zbog elektrostatičke privlačnosti.
2. Klasifikacija jona: po sastavu, znaku naelektrisanja, prisustvu hidratne ljuske.
3. Jonske kristalne rešetke. Svojstva supstanci sa jonskim tipom kristalne rešetke.
4. Mehanizam stvaranja kovalentne veze (razmjenska i donor-akceptor).
5. Elektronegativnost. Kovalentne polarne i nepolarne veze. Višestrukost kovalentne veze.
6. Molekularne i atomske kristalne rešetke. Svojstva tvari s molekularnom i atomskom kristalnom rešetkom.
Oprema: Modeli kristalnih rešetki, udžbenik, periodni sistem hemijskih elemenata D.I.Mendeljejeva.
književnost:
1. Hemija 11. razred: udžbenik. za opšte obrazovanje organizacije G.E. Rudžitis, F.G. Feldman. - M.: Prosvjeta, 2014. -208 str.: Il..
2. Hemija za struke i specijalnosti tehničkog profila: udžbenik za studente. srednje institucije. prof. obrazovanje / O.S.Gabrielyan, I.G. Ostroumov. - 5. izdanje, izbrisano. - M .: Izdavački centar "Akademija", 2017. - 272 str., s bojom. ill.
Predavač: Tubaltseva Yu.N.
Tema 7. Jonska i kovalentna hemijska veza.
1) Kationi, njihovo stvaranje iz atoma kao rezultat procesa oksidacije. Anioni, njihovo stvaranje iz atoma kao rezultat procesa redukcije. Jonska veza, kao veza između kationa i aniona zbog elektrostatičke privlačnosti.
2) Klasifikacija jona: po sastavu, znaku naelektrisanja, prisustvu hidratizovane ljuske.
3) Jonske kristalne rešetke. Svojstva supstanci sa jonskim tipom kristalne rešetke.
4) Mehanizam stvaranja kovalentne veze (razmjenska i donor-akceptor).
5) Elektronegativnost. Kovalentne polarne i nepolarne veze. Višestrukost kovalentne veze.
6) Molekularne i atomske kristalne rešetke. Svojstva tvari s molekularnom i atomskom kristalnom rešetkom.
Kationi, njihovo stvaranje iz atoma kao rezultat procesa oksidacije. Anioni, njihovo stvaranje iz atoma kao rezultat procesa redukcije. Jonska veza, kao veza između kationa i aniona zbog elektrostatičke privlačnosti.
Hemijska veza je interakcija atoma koja određuje stabilnost kemijske čestice ili kristala u cjelini. Hemijska veza nastaje zbog elektrostatičke interakcije između nabijenih čestica: kationa i aniona, jezgara i elektrona. Kada se atomi približavaju jedan drugom, između jezgra jednog atoma i elektrona drugog atoma počinju djelovati privlačne sile, kao i sile odbijanja između jezgara i između elektrona. Na određenoj udaljenosti, ove sile uravnotežuju jedna drugu i formira se stabilna hemijska čestica.
Kada se formira hemijska veza, može doći do značajne preraspodjele elektronske gustine atoma u spoju u odnosu na slobodne atome. U graničnom slučaju, to dovodi do stvaranja nabijenih čestica - jona (od grčkog "ion" - ide).
Interakcija jona:
Ako atom izgubi jedan ili više elektrona, onda se pretvara u pozitivan ion - katjon (u prijevodu s grčkog - "spuštanje). Tako nastaju katjoni vodonika H +, litij Li +, barij Ba 2+. Sticanje elektrona , atomi se pretvaraju u negativne jone - anione (od grčkog "anion" - ide gore) Primjeri anjona su fluoridni jon F - , sulfidni ion S 2 - .
Kationi i anioni su u stanju da privlače jedni druge. U tom slučaju dolazi do hemijske veze i formiraju se hemijska jedinjenja. Ova vrsta hemijske veze naziva se jonska veza:
Jonska veza, u pravilu, nastaje između atoma tipičnih metala i tipičnih nemetala. Karakteristično svojstvo atoma metala je da lako doniraju svoje valentne elektrone, dok ih atomi nemetala mogu lako spojiti.
Razmotrite pojavu ionske veze, na primjer, između atoma natrija i atoma klora u natrijevom kloridu NaCl.
Odvajanje elektrona od atoma natrija dovodi do stvaranja pozitivno nabijenog jona - natrijevog kationa Na +.
Dodavanje elektrona atomu hlora dovodi do stvaranja negativno nabijenog jona - anjona hlora Cl-.
Između formiranih Na + i Cl - iona, koji imaju suprotan naboj, nastaje elektrostatička privlačnost, zbog čega nastaje spoj - natrijev klorid s ionskom vrstom kemijske veze.
Jonska veza - Ovo je hemijska veza, koja se ostvaruje usled elektrostatičke interakcije suprotno naelektrisanih jona.
Dakle, proces formiranja jonske veze svodi se na prijelaz elektrona s atoma natrija na atome klora uz formiranje suprotno nabijenih iona s potpunim elektronskim konfiguracijama vanjskih slojeva.
1. Atomi metala, odustajući od vanjskih elektrona, pretvaraju se u pozitivne jone:
gdje je n broj elektrona u vanjskom sloju atoma, koji odgovara broju grupe kemijskog elementa.
2. Atomi nemetala, prihvataju elektrone koji nedostaju prije završetka vanjskog elektronskog sloja, pretvaraju se u negativne jone:

3. Između suprotno nabijenih jona nastaje veza, koja se naziva jonski.

2. Klasifikacija jona: po sastavu, znaku naelektrisanja, prisustvu hidratne ljuske.
Klasifikacija jona:
1. Prema predznaku naelektrisanja: kationi (pozitivni, K+, Ca2+, H+) i anjoni (negativni, S2-, Cl-, I-).
2. Po sastavu: složeni ( , ) i prosti (Na +, F-)©2015-2019 stranica
Sva prava pripadaju njihovim autorima. Ova stranica ne tvrdi autorstvo, ali omogućava besplatno korištenje.
Datum kreiranja stranice: 2017-12-12