Akcioni potencijal se kreće duž aksona zbog uzdužnog širenja struje. Svaki dio membrane, generirajući impuls po principu "sve ili ništa", svojom depolarizacijom pobuđuje susjedni dio. Za razumijevanje mehanizma propagacije impulsa, kao i sinaptičkog prijenosa i integracije, potrebno je razumjeti princip pasivnog širenja impulsa duž nerva.
Kako se kreće duž aksona ili dendrita, struja gubi snagu. Smanjenje vrijednosti struje ovisi o nizu razloga, prvenstveno o promjeru i svojstvima membrane nervnih vlakana. Uzdužno širenje struje je veće, što je veći prečnik vlakna i što je veći otpor membrane. Kapacitivna svojstva membrane utiču na vremenski tok električnih signala, kao i na širenje struje. Da bi se procijenila udaljenost do koje se potencijal ispod praga može širiti, potrebno je poznavati geometriju i svojstva neuronske membrane i, pored toga, vremenski tok promjene potencijala.
Aksoni mnogih tipova nervnih ćelija u kralježnjaka prekriveni su omotačem mijelina, koji ima visok otpor i nisku kapacitivnost. Mijelinski omotač igra ulogu izolacijskog namotaja žice i tjera struju da se kreće duž membrane. U ovom slučaju struja brzo skače s jednog Ranvierovog čvora (kratak dio membrane bez mijelina) u drugi, a brzina provođenja se povećava. Mijelinska vlakna se nalaze u područjima neuronske mreže gdje brzina provodljivosti igra važnu ulogu.
Električni signali se također mogu prenijeti s jednog neurona na drugi na mjestima bliskog kontakta između njih, koji se nazivaju praznine. Struja u takvim vezama teče kroz posebne kanale, koneksone.
Pasivna električna svojstva nervnih i mišićnih membranaKarakteristike propusnosti neuronskih membrana i kako one doprinose stvaranju akcionih potencijala razmatrane su u prethodnim poglavljima. U ovom poglavlju ćemo se uglavnom fokusirati na to kako se struje šire duž nervnog vlakna i formiraju lokalne potencijalne razlike.
Pasivna električna svojstva neurona, odnosno otpor i kapacitet membrane, kao i otpor citoplazme, igraju ključnu ulogu u neuronskoj signalizaciji. U čulnim organima, ova svojstva su veza između senzornog stimulusa i generisanja impulsa; na nivou aksona omogućavaju širenje impulsa; na sinaptičkom nivou, oni određuju sposobnost postsinaptičkog neurona da dodaje i oduzima sinaptičke potencijale koji se javljaju na više sinaptičkih ulaza, bilo u blizini tijela ćelije ili na najudaljenijim dendritima. Da biste razumjeli ove procese, morate znati principe propagacije električnih signala duž neuronskih procesa. U ovom poglavlju ćemo se fokusirati uglavnom na nervna vlakna sa konstantnim prečnikom po celoj dužini, odnosno na cilindrične provodnike. Osim toga, za ovaj opis ćemo pretpostaviti da je, u nedostatku regeneracije, membrana zaista pasivna, tj. promjene potencijala koje ne dosegnu granični nivo ne aktiviraju provodljivosti zavisne od napona i time ne mijenjaju otpor membrane. . Ovi principi se također primjenjuju na složenije strukture kao što su aksonske arbore ili dendritske lukove s neujednačenim električnim svojstvima. Uloga ovakvih struktura u funkcionisanju nervnog sistema je veoma važna, ali kvantitativni opis njihovih električnih svojstava zahteva složeniju analizu.
Svojstva kabla nervnih i mišićnih vlakana
Cilindrično nervno vlakno sastoji se od istih komponenti kao i podvodni električni kabel: jezgrenog vodiča i izolacijskog omotača okruženog provodljivim medijem. Međutim, kvantitativna razlika između ova dva sistema je veoma velika. Jezgra kabla je obično od bakra ili metala sa veoma visokom provodljivošću, dok je omotač od plastike ili drugih materijala sa veoma visokim otporom. Osim toga, školjka je obično prilično debela i stoga ima mali kapacitet. Napon koji se primjenjuje na takvu žicu može se prenijeti na znatnu udaljenost zbog činjenice da je otpor bakra mali, kao i gubici kroz omotač. Sadržaj nervnog vlakna je rastvor soli, po koncentraciji slična ekstracelularnoj sredini i, za razliku od bakra, ima slabu provodljivost. Ćelijska membrana, pak, nije dobar izolator i ima visok kapacitet zbog svoje male debljine. Napon primijenjen na nervno vlakno ne proteže se na značajnu udaljenost iz dva razloga:
1) provodljivost sadržaja vlakana je mala, stoga je strujni otpor velik;
2) struja koja teče duž citoplazme se raspršuje zbog curenja kroz membranu, što ne daje dovoljnu izolaciju.
Analizu struje kablova pokrenuo je Lord Kelvin u vezi sa transatlantskim telefonskim komunikacijama, a poboljšao ju je Oliver Hevisajd. Krajem XX veka. Hevisajd je bio prvi koji je uzeo u obzir važnost curenja struje kroz izolacioni omotač koji je ekvivalentan ćelijskoj membrani, a takođe je napravio mnoge važne dodatke u teoriji kablova, uključujući koncept impedanse. Teoriju kabla su za nervna vlakna prvi koristili Hodgkin i Rushton, koji su eksperimentalno izmjerili propagaciju akcijskog potencijala u aksonu jastoga koristeći ekstracelularne elektrode. Kasnije su intracelularne elektrode korištene za slična mjerenja brojnih nervnih i mišićnih vlakana.
Osnovno pravilo ovdje je Ohmov zakon: struja i, prolazeći kroz otpor r, stvara napon ν = ir. U nastavku ćemo također razmotriti utjecaj kapacitivnosti membrane na veličinu i vremenski tok širenja uzdužne struje.
Struja kabla
Za bolje razumijevanje principa protoka struje kroz kabel, zamislite kako se toplina širi duž metalne šipke u toplotnoizolacijskom omotaču, koji je postavljen u provodljivi medij (na primjer, vodu). Ako se štap zagrijava s jednog kraja, toplina se širi duž štapa i, kako se širi, djelomično se raspršuje u okolinu, prodirući kroz školjku. Što je dalje od zagrijanog kraja, to je niža temperatura; Kako se temperatura smanjuje, tako se smanjuje i brzina odvođenja topline. Pod uslovom da okolina ima visoku toplotnu provodljivost, udaljenost na kojoj će se toplota širiti zavisiće uglavnom od dva parametra:
1) od toplotne provodljivosti štapa
2) na izolaciona svojstva ljuske.
Protok struje u kablu radi na sličan način. Napon primijenjen na jedan kraj kabela uzrokuje da struja teče duž šipke u uzdužnom smjeru, koja se djelomično gubi kroz omotač u okolinu. Što je dalje od kraja na koji se napon primjenjuje, to je manja struja. Udaljenost preko koje će se struja širiti ovisit će o provodljivosti štapa i o tome koliko učinkovito plašt sprječava gubitak struje. Plašt niskog otpora će omogućiti da sva struja teče u okolinu. Plašt s većim otporom omogućit će struji da putuje veću udaljenost.
Struja u aksonu se prenosi jonima: kada se struja ubrizgava u nervno vlakno (kao što je akson jastoga) kroz mikroelektrodu, ubrizgani pozitivni naboji će odbiti druge katione i privući anione. Najzastupljeniji od malih jona unutar ćelije je kalij, koji stoga nosi najveću struju kroz membranu. Struja teče uzdužno duž aksona, a dok putuje, dio se gubi zbog kretanja jona kroz membranu. U membrani sa niskim otporom i visokom jonskom provodljivošću, većina struje će se izgubiti prije nego što stigne prijeći bilo koju značajnu udaljenost. Uz veću otpornost membrane, struja će se širiti duž aksona na veću udaljenost prije nego što se rasprši u okolinu.
Ekscitabilnost je sposobnost tkiva da odgovori na iritaciju tkivno specifičnom reakcijom. Ekscitacija je prijelaz ekscitabilnog tkiva iz stanja funkcionalnog mirovanja u specifičnu aktivnost (za generiranje nervnih impulsa i provođenje nervnih impulsa, za mišićno tkivo - kontrakciju, za žljezdano tkivo - izlučivanje žlijezde). U ovom dijelu ćemo pogledati strukturu i funkciju nervnog i mišićnog tkiva.
Nervna ćelija je karika u nervnom lancu. Pojedinačne nervne stanice, ili neuroni, ne obavljaju svoje funkcije kao izolirane jedinice, poput stanica u jetri ili bubrezima. Rad 50 milijardi neurona ljudskog mozga je da primaju signale od nekih drugih nervnih ćelija i prenose ih trećim. Ćelije koje prenose i primaju se kombinuju u nervna kola ili mreže. Jedan neuron sa granastim sistemom procesa na izlazu (divergentna struktura) može poslati signal primljen na ulazu hiljadu ili čak više drugih neurona. Na isti način, neki drugi neuron može primiti ulazne informacije od drugih neurona koristeći jednu, nekoliko ili vrlo mnogo ulaznih veza ako se na njemu konvergentne staze konvergiraju.
Zovu se stvarni spojevi neurona - specifične tačke na površini ćelija na kojima dolazi do kontakta sinapse. Hemikalije koje se oslobađaju u sinapsama neurotransmiteri- zatvaraju krug između neurona u kontaktu i hemijski su posrednici za prenos nervnog pobuđenja između nervnih ćelija sa hemijskim sinapsama. Kasnije ćemo naučiti da načini na koje se informacije prenose između neurona mogu biti različiti.
1. Neuron je ćelija.
Neuroni imaju niz karakteristika zajedničkih za sve ćelije u telu (slika 1).
Rice. 1. Obična ćelija (A) i neuron (B).
Kao i oni, neuron ima plazma membranu koja definira granice pojedinačne stanice. Uz pomoć membrane i molekularnih mehanizama sadržanih u njoj, neuron stupa u interakciju s drugim stanicama i percipira promjene u svom lokalnom okruženju. Uz pomoć selektivnih svojstava membranskih jonskih kanala i sistema aktivnog i pasivnog transporta jona, ćelija reguliše intracelularni osmotski pritisak i samim tim održava svoj oblik, a takođe obezbeđuje ulazak mineralnih elemenata, hranljivih materija i gasova u ćeliju. za intracelularne potrebe, električni potencijali se stvaraju na ćelijskoj membrani koja leži u osnovi funkcije neurona i drugih ćelija. Membrana sa svih strana okružuje unutrašnji sadržaj ćelije, nazvan citoplazma. Citoplazma sadrži jezgro i citoplazmatske organele neophodne za postojanje ćelije i obavljanje njenog rada: mitohondrije, mikrotubule, neurofibrile, endoplazmatski retikulum.
Mitohondrije obezbeđuju ćeliju energijom. Koristeći šećer i kisik, oni sintetiziraju posebne visokoenergetske molekule (ATP) koje ćelija troši po potrebi. Mikrotubule, tanke potporne strukture, pomažu neuronu da održi svoj oblik i smatra se da su uključene u aksonalni transport. Uz pomoć endoplazmatskog retikuluma - mreže unutarnjih membranskih tubula - i struktura koje se nalaze na njoj - ribozoma - stanica sintetizira tvari potrebne za njenu vitalnu aktivnost, distribuira ih u ćeliji i izlučuje izvan nje. Neurofibrili obavljaju potporne funkcije, obezbjeđuju usmjereno kretanje terminala (terminalnih grana) aksona i jedna su od karika u mehanizmu transporta aksona (vidi dolje).
Jezgro neurona sadrži genetske informacije kodirane u hemijskoj strukturi gena. U skladu sa ovim informacijama, potpuno formirana ćelija sintetiše specifične supstance koje određuju oblik, hemiju i funkciju ove ćelije tokom njenog života, budući da nervna ćelija nije u stanju da se deli.
Za razliku od drugih ćelija, neuroni imaju nepravilne obrise: imaju procese različite dužine, često brojne i razgranate. Ovi procesi su žive "žice" uz pomoć kojih se formiraju neuronske mreže. Funkcije takvih žica također obavljaju membrane tijela nervnih ćelija.
Nervne mreže organizma životinja i ljudi imaju fundamentalnu razliku od tehničkih električnih mreža (uključujući telefonske, telegrafske i internetske): nemaju centralne generatore električne struje koji ih hrane. Električne struje nastaju na molekularnim membranama (membranama) ćelija, zbog specifičnog svojstva ovih membrana, da dosljedno stvaraju električne potencijale, a u ćelijama ekscitabilnih tkiva (nerva i mišića) ih također provode duž svoje dužine.
Nervna ćelija ima jedan glavni proces - akson, preko kojeg prenosi informaciju drugoj ćeliji, i brojne dendrite, preko kojih ćelija prima dolazne informacije. I akson i dendriti se mogu granati; posebno ekstenzivno grananje uočeno je u dendritima. Na dendritima i na površini centralnog dijela ćelije koja okružuje jezgro, zvanog tijelo neurona, nalaze se ulazne sinapse koje formiraju aksoni drugih neurona. Završeci aksona ili njegovih grana (terminala) formiraju takve sinapse na površini membrana drugih stanica. Ovi završeci sadrže organele zvane sinaptičke vezikule, u kojima se akumuliraju molekuli medijatora koje neuron oslobađa u sinapsu ćelije koja prima. U aksonima ne postoje ćelijske organele koje sintetiziraju proteine, pa ovaj proces, lišen veze sa ćelijskim tijelom, umire.
Dugi procesi neurona nazivaju se nervna vlakna.
2. Provodnik ili generator električne struje? Elektrogene funkcije stanične membrane.
Ako se mikroelektroda umetne u nervno vlakno u mirovanju i zatvori na drugu elektrodu umetnutu na vanjsku stranu membrane, tada će uređaj za snimanje pokazati potencijalnu razliku od 60-90 mV, a unutrašnja strana membrane ima negativan naboj, a vanjska strana ima pozitivan naboj. Ova razlika potencijala u elektrofiziologiji se naziva potencijal mirovanja (RP). Koje sile, razdvajajući naboje s obje strane membrane, stvaraju njen električni polaritet? Uvjerljiv odgovor na ovo pitanje dali su engleski naučnici A. Hodgkin, A. Huxley i B. Katz (1956-1963), koji su za svoj rad dobili Nobelovu nagradu.
Da bi se bolje razumjela suština problema, treba poći od činjenice da je u tijelu životinja i ljudi svaka ćelija okružena otopinom mješavine različitih soli, uglavnom klorida i fosfata natrijuma, kalija, magnezija. itd., kao i njihova organska jedinjenja. Ista jedinjenja nalaze se unutar ćelije, u njenoj citoplazmi. A da je ćelija pasivna na ovu činjenicu, to ne bi imalo nikakvih posljedica po njen život i aktivnost, a ne bi bilo naelektrisanja oko membrane, jer bi koncentracija soli i, posljedično, njihovih jona na obje strane njene membrane bila isto. Treba napomenuti, međutim, da bi sam život tada bio nemoguć.
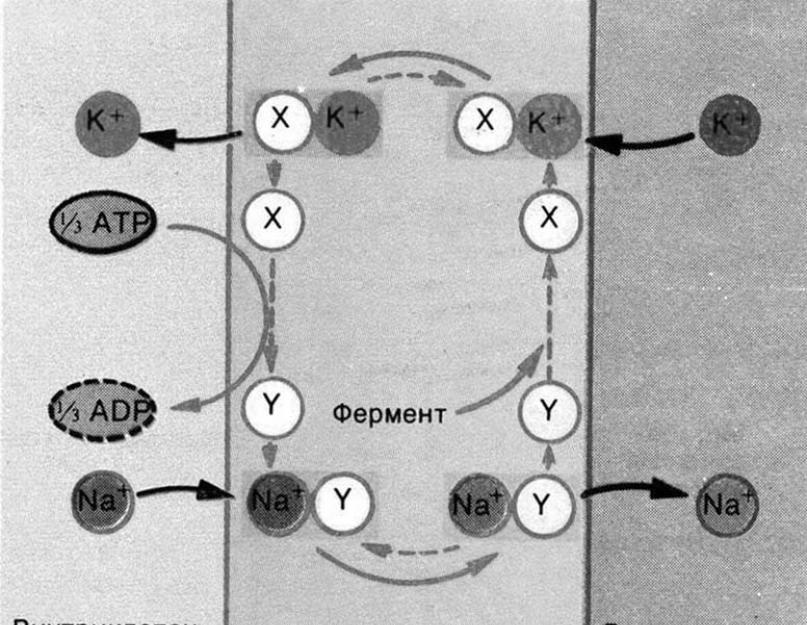
Ali otkriveno je da ćelijska membrana ima sposobnost da prenese ione kalija u ćeliju, a ione natrijuma - prema van protiv gradijenta koncentracije koristeći aktivni transportni sistem. Ovu sposobnost obezbeđuje delovanje kalijum-natrijum pumpi ugrađenih u membranu, koje za svoj rad koriste energiju ATP-a (slika 2).

Rice. 2. Šema rada jonske pumpe.
U jednom ciklusu, pumpa iz ćelije izvlači 3 Na+ jona i vraća 2 K+ jona u nju, trošeći energiju jednog ATP molekula za ovaj rad. Naravno, molekula ATP-a se u ovom slučaju cijepa formiranjem ADP molekula i ostatka fosfata. Dakle, stanica stvara neravnotežne količine natrijuma i kalija oko svoje membrane: na unutarnjoj strani membrane stvara se koncentracija kalijevih jona koja je 30-50 puta veća nego na vanjskoj, a iona natrijuma u ekstracelularnoj tekućini su 10 puta više nego u citoplazmi ćelije. To, međutim, samo po sebi stvara razliku u koncentraciji kationa, ali ne i naboja.
Drugi dio procesa polarizacije (vremenski se odvija istovremeno s prvim) obezbjeđuje polupropusnost, odnosno, drugim riječima, selektivna permeabilnost (selektivnost) membrane za različite ione. U mirovanju, membrana slobodno propušta ione K+, vrlo slabo - ione Na+ i potpuno je nepropusna za velike anjone organskih kiselina i proteina. Neravnotežni raspored jona kalija i natrijuma oko membrane, stvoren ionskim pumpama, uzrokuje pasivni proces - difuziju ovih kationa duž gradijenta koncentracije. Unutar ćelije, ioni kalija kreću se prema membrani i, prestižući manje pokretne negativne ione, dopiru do njene vanjske strane. Kao rezultat, na unutarnjoj strani membrane stvara se negativan električni naboj, a na vanjskoj strani membrane pozitivan naboj koji stvaraju natrijevi ioni i procijenjena razlika potencijala između njih je 80-100 mV. Difuzija natrijevih jona u ćeliju je mnogo slabija (25 puta) od kalijevih, ali i dalje postoji i izaziva isti učinak, ali usmjerena unutar ćelije, te kao rezultat donekle smanjuje izračunati kalijev potencijal membrane. Stoga je rezultujući membranski potencijal mirovanja (RP) 50–90 mV. (sl.3)

Rice. 3. Električni naboj membrane.
Slični difuzijski tokovi jona natrijuma i kalija neminovno bi doveli do izjednačavanja koncentracije jona na obje strane membrane. To se, međutim, ne događa u živoj ćeliji, budući da jonske pumpe konstantno transportuju ione protiv postojećih gradijenta, održavajući njihovu koncentraciju i elektrohemijske gradijente i, posljedično, potencijal mirovanja. Ovo je možda jedan od glavnih i najvažnijih funkcionalnih znakova života. Zaustavljanje rada jonskih pumpi u ćelijskoj membrani znači zaustavljanje svih vitalnih procesa, tj. ćelijska smrt.
3. Život ćelija je naelektrisan. Uloga potencijala mirovanja u životu ćelije.
Zašto je običnoj ćeliji potrebna struja? Poznato je da u tijelu životinja i čovjeka, osim živaca i mišića, postoje ćelije kože, unutrašnjih organa i okolnih tkiva. Utvrđeno je da svi imaju membranski potencijal od 15 do 50 mV. Dakle, nervne ćelije nisu monopolisti u pogledu prisutnosti električnih potencijala u njima i, posljedično, korištenja električne energije u njihovoj životnoj aktivnosti. Zašto je ćelijama potrebna struja? Pokušajmo zamisliti kako bi to izgledalo da pitamo, recimo, domaćicu, zašto joj treba struja? Ili zašto bi modernom industrijskom proizvodnom pogonu, recimo, na drugom spratu zgrade, bila potrebna struja?
Osim vode i nekih elektrolita koji slobodno prolaze kroz ćelijsku membranu, ćeliji su potrebni nutrijenti, kao što su šećeri, aminokiseline i neki mineralni elementi koji ne mogu prodrijeti u ćeliju po zakonima difuzije. Zapravo, u procesu evolucije, stanica bi mogla steći membranu koja bi omogućila da svi joni i molekuli organskih tvari nesmetano prolaze, a sva pitanja snabdijevanja ćelije nutrijentima rješavala bi se po zakonima difuzije. Zašto se to zapravo nije dogodilo? Prvo, prema zakonima difuzije, joni i molekuli supstanci kretali bi se unutar ćelije samo kada bi bili koncentrisaniji spolja; treće, poravnanje na obe strane ćelijske membrane proizvoda njenog metabolizma štetnih za ćeliju ne bi samo štetno djeluju na ćeliju, ali bi i smanjile koncentraciju supstanci neophodnih za ćeliju u vanjskom okruženju, uzrokujući na taj način njihov obrnuti odljev iz ćelije. Pokazalo se da su vitalni interesi ćelije nekompatibilni sa takvim "tržišnim" elementom, a evolucija ćelije je učinila da njena membrana bude selektivno propusna za neke jone i dala je aktivnim nosačima za "uvoz" drugih supstanci u ćeliju, kao npr. kao i za „izvoz“ metaboličkih proizvoda koji mu nisu potrebni iz ćelije. Ćelija nije morala da bira vrstu energije kako bi osigurala rad transportnog sredstva: električna energija joj je bila poznata milionima godina ranije od starogrčkog naučnika Thalesa, koji je ukazao na sposobnost ćilibara protrljanog svilom da privlači lake predmete. ,
Molekuli proteina-nosača ugrađeni su u ćelijsku membranu kao nosači i transportuju hranljive materije u ćeliju na sledeći način (slika 4).

Rice. 4. Šema membranskog transporta.
Na vanjskoj strani membrane, molekula bjelančevina nosača vezuje molekul hranjive tvari i natrijev ion za sebe, čime stiče pozitivan naboj. Električno polje membrane, okrećući molekulu nosača oko svoje hipotetičke ose, povlači njen pozitivno nabijeni pol u unutrašnjost membrane. Ovdje ion natrijuma gubi naboj i napušta ćeliju nosač, što dovodi do eliminacije neutralne molekule transportiranog nutrijenta iz nje. Hranjivi sastojak ostaje unutar ćelije, dok se natrijum ispumpava, što rezultira pozitivnim nabojem na vanjskoj strani membrane.
Postoje različiti proteini nosači za transport različitih šećera i aminokiselina u ćeliju, ali svi oni koriste ione natrija i potencijal membrane mirovanja u životinjskim stanicama. Bakterije koriste jone vodonika umjesto natrijuma
Električni transport se koristi za uklanjanje određenih supstanci iz ćelije.Višak kalcijuma u ćeliji, ako se kalcijumska pumpa ne može nositi sa njegovim uklanjanjem, opasan je. Sistem za hitne slučajeve ćelije je aktiviran. U ovom slučaju, poseban protein nosač vezuje ion kalcija na njegov intracelularni dio, a tri natrijeva jona na vanjski dio. Električno polje membrane rotira molekulu nosača za 180° i kalcijum se izbacuje. Za razliku od kalij-natrijum pumpi, koje za svoj rad koriste energiju ATP-a i istovremeno stvaraju električno polje (električne potencijale) na membrani, gore navedeni proteini nosači rade kao elektromotori koji koriste električnu energiju membrane. potencijal za njihov rad.
Mehanizmi aktivnog prenosa nutrijenata u ćeliju nužno su povezani sa njenim životom i, nesumnjivo, trebali su nastati zajedno sa pojavom ćelije. Prijenos signala od stanice do stanice je kasnija potreba evolucije, stoga je razumno pretpostaviti da su živčane stanice, kada se pojavila takva potreba, malo modificirajući svoju membranu, iskoristile membranski potencijal za novu funkciju - prijenos signala. Kakva je bila ova modifikacija?
4. Promjene u membranskom potencijalu. akcioni potencijal.
Godine 1939., zaposlenici pomorske stanice u Plymouthu (Engleska) A. Hodgkin i H. Huxley prvi put su izmjerili PP i PD nervnog vlakna, koristeći džinovski akson lignje (1 mm u prečniku) i najnapredniji eksperimentalni opreme u to vreme. Pokazalo se da je u mirovanju razlika potencijala na membrani otprilike 80 mV, a kada je pobuđena, membrana se ne prazni, kako je Bernstein sugerirao, već se puni: njeni negativni naboji su vani, a pozitivni unutra. U tom slučaju na membrani se pojavljuje razlika potencijala od približno 40 mV. To znači da se pri pobuđivanju potencijal ne mijenja za vrijednost RI, tj. ne pada na nulu, već zbirom PP i novonastalog potencijala suprotnog predznaka (slika 8). Ovaj višak PD u odnosu na PP nazvan je prekoračenjem (engleski oversoot - višak).
Da bi objasnili ovaj "dodatni" potencijal, Hodgkin i Huxley iznijeli su hipotezu, čija je suština bila da nakon ekscitacije membrana ne samo da potpuno gubi svoju selektivnu propusnost, već je i mijenja: od propusne uglavnom za K+ ione. , membrana postaje propusna uglavnom za Na ione. A pošto ih ima više izvan membrane, oni jure unutra i pune membranu.
Prvi test hipoteze izvršili su A. Hodgkin i B. Katz nakon duže pauze zbog rata 1949. godine. Istraživanja su pokazala da amplituda AP zavisi od promene koncentracije Na+ jona na isti način kao što vrednost PP zavisi od koncentracije K+ jona, tj. pridržava se Nernstove formule.
Zatim je bilo potrebno otkriti kako se propusnost membrane za kalij i natrij zapravo mijenja tokom ekscitacije i od kojih uslova te promjene zavise. Hodgkin i Huxley su sugerirali da je propusnost membrane određena s dva uvjeta: potencijalom membrane i vremenom koje je proteklo od promjene potencijala. Rezultat duge i mukotrpne provjere ove pretpostavke bila je eksperimentalna potvrda da je mehanizam svih pojava povezanih s ekscitacijom zaista zasnovan na svojstvu membrane: njenoj varijabilnoj selektivnoj permeabilnosti za jone kalija i natrija. Stvorena je teorija za nastanak AP u različitim uslovima i početnim stanjima membrane, tj. "moderna teorija membrane", koja se naziva i modelom X-X. Model je ispravno reprodukovao takve fenomene kao što su refraktornost, prag pobude, hiperpolarizacija vlakana nakon impulsa, itd.
Međutim, pitanja su i dalje ostala bez odgovora: koji je mehanizam promjene propusnosti membrane, kako je uređena ova najtanja pregrada? Prodiranje u tajne strukture membrane i njenih funkcionalnih mehanizama počelo je kasnije, kada se pojavila nova nauka - molekularna biologija.
Struktura membrane. Citoplazmatska membrana je pasivni molekularni film koji se sastoji od dva sloja molekula lipida; sadrži proteinske molekule koji u membrani obavljaju aktivne funkcije jonskih kanala i pumpi, molekule nosače, receptore itd. Bimolekularni sloj lipida izoluje ćeliju od okoline, a ujedno je i električni izolator. Komunikacija ćelije sa okolinom i sve aktivne funkcije njene membrane odvijaju se uz pomoć proteinskih molekula ugrađenih u membranu (slika 5.)

Rice. 5. Plazma membrana ćelije
Određeni proteinski molekuli obezbjeđuju sposobnost lokalne osjetljivosti membrane na djelovanje podražaja i odgovarajući odgovor na te efekte. Evolucijska modifikacija membrane živčane stanice sastojala se u stvaranju mehanizama za lokalnu promjenu membranskih potencijala na membrani, nakon čega je uslijedilo valovito širenje ove promjene duž membrane. Posljednju sposobnost posjeduju i ćelijske membrane drugih tkiva.
jonski kanali. Aktivna električna svojstva ćelijske membrane određuju molekuli proteina ugrađeni u nju, koji formiraju "pore" u lipidnoj membrani koja je homogena i nepropusna za molekule i jone, kroz koje te čestice mogu proći pod određenim uvjetima. One pore kroz koje mogu proći ioni kalijuma i natrijuma nazivaju se kalijevi i natrijum jonski kanali, respektivno.
Jonske kanale formira posebna klasa proteinskih molekula koji su u stanju da razlikuju "svoje" ione i otvore ili zatvore njihov put kroz membranu pod dejstvom odgovarajućeg membranskog potencijala. Engleski biofizičar B. Hill je otkrio da je prečnik kalijumovog kanala približno 0,3 nm, dok je jaz za prolaz jona nešto veći za natrijumski kanal. Za razliku od natrijum K+ kanala, nema mehanizam za inaktivaciju. Treba napomenuti da je prolaz jednog ili drugog do kanala određen ne promjerom potonjeg, već njegovim funkcionalnim svojstvima i električnim potencijalima membrane.
Jonski kanal se može zamisliti kao prolazna cijev ugrađena u membranu (slika 6)

Rice. 6. Šema jonskog kanala.
Blizu vanjskog kraja, cijev ima "zatvarač" ili "kapija", čiji položaj kontrolira membranski potencijal, "zatvarač" je nabijen i stoga, kada se potencijal promijeni (tokom depolarizacije), može otvoriti ulaz u kanal za odgovarajući ion. Vjeruje se da su kapije kanala nabijena grupa atoma proteinske molekule koja se može kretati u električnom polju, otvarajući tako put jonima kalija ili natrijuma. Pomeranje takve naelektrisane grupe mora biti praćeno trenutnom malom električnom strujom; ova struja u natrijumskim kanalima je eksperimentalno registrovana i nazvana je „struja kapije“). Prilikom proučavanja natrijumovih kanala pokazalo se da se mehanizmi kapije i njihova inaktivacija nalaze na različitim krajevima kanala. Nakon uklanjanja unutrašnjeg kraja kanala enzimom pronazom, kanal je nastavio da otvara natrijumsku kapiju pod dejstvom depolarizacije, ali nije inaktiviran.
Određena je gustina natrijumskih kanala u membrani. Bilo ih je oko 50 po kvadratnom mikrometru membrane (takva površina membrane može primiti nekoliko miliona lipidnih molekula).
Pored kalijumovih i natrijumovih kanala, ćelijske membrane imaju kanale za kalcijum, hlorid i druge jone. Postepena promjena propusnosti membrane, na primjer, za jone kalija, objašnjava se činjenicom da odgovarajući kanali, pored "otvorenog" i "zatvorenog" stanja, imaju još neka stanja, tj. da kanale karakteriše probabilistička priroda rada, što je eksperimentalno potvrđeno. U početku se pretpostavljalo da je ionski kanal stabilan biološki mehanizam koji je ugrađen u membranu i radi dugo vremena, ali se kasnije pokazalo da proteinski kanali funkcionišu samo oko jedan dan, a zatim se rastavljaju i zamijenjen drugim sintetiziranim ribozomima stanice prema naredbama glasničke RNK. Utvrđeno je da se proteini kanala ne ubacuju nasumično u membranu, da se različiti jonski kanali prenose putem ćelije tačno na pravo mjesto.
Pored kanala čije otvaranje i zatvaranje kontroliše električni membranski potencijal, postoje i jonski kanali kontrolirani hemikalijama (ne samo neurotransmiterima u sinapsama) koji djeluju na membranu izvan i unutar ćelije. Na primjer, povećanje koncentracije cikličkog adenozin monofosfata (cAMP) u nekim neuronima dovodi do otvaranja kanala i depolarizacije ćelije, a povećanje te koncentracije stimulira adrenalin. Ćelija ne samo da može kontrolirati rad jonskih kanala, već ih može modificirati, mijenjati njihova svojstva putem kontroliranih biokemijskih reakcija. Takvi procesi se dešavaju, na primjer, tokom treninga.
Promjene potencijala membrane . Stanična membrana ima sposobnost da odgovori na iritaciju promjenom potencijala mirovanja – brzo rastući proces njene lokalne depolarizacije. Stepen ove depolarizacije zavisi od intenziteta podražaja, a u nervnim i mišićnim ćelijama može završiti potpunim kratkotrajnim nestankom membranskog potencijala u području stimulacije, nakon čega sledi inverzija polariteta, a zatim repolarizacija, tj. vraćanje prvobitnog stanja. Ova pojava se zove akcioni potencijal. Nivo membranskog potencijala na kojem daljnje povećanje jačine stimulusa i daljnja depolarizacija dovode do akcionog potencijala naziva se prag, a odgovarajući stimulus prag.
Nivoi depolarizacije membrane. Ako jačina stimulusa koji djeluje na membranu ne prelazi 0,5 vrijednosti praga stimulacije, tada će se depolarizacija membrane primijetiti samo za vrijeme djelovanja stimulusa. Ova pojava se naziva elektrotonički potencijal (slika 7)
Rice. 7. Elektrotonski potencijal.
Jonska permeabilnost membrane se praktički ne mijenja. Sa povećanjem jačine stimulansa na 0,9 granične vrijednosti, proces depolarizacije se odvija duž krivulje u obliku slova S, nastavlja se povećavati neko vrijeme nakon prestanka stimulacije, ali zatim polako prestaje. Ova reakcija stanične membrane naziva se lokalni odgovor. Lokalni odgovor nije u stanju da se propagira. Međutim, pri primjeni nekoliko podpražnih podražaja s intervalom kraćim od trajanja jednog lokalnog odgovora, potonji se zbrajaju i depolarizacija membrane se povećava, što u živčanim i mišićnim stanicama može dovesti do pojave akcionog potencijala. Epitelne ćelije ne mogu stvoriti akcioni potencijal. Njihova reakcija na djelovanje stimulusa bilo koje snage ograničena je na lokalni odgovor.
Kada je podražajna membrana izložena graničnoj ili supragraničnoj sili, potencijal membrane se smanjuje za 20-40 mV u odnosu na potencijal mirovanja, tj. do neke kritične vrijednosti. Ako se u isto vrijeme snaga stimulusa ne smanji, tada se pore (kanali) za natrijeve ione naglo otvaraju u membrani, njena propusnost za te katione se povećava za desetine, čak i stotine puta. Duž koncentracijskog i elektrohemijskog gradijenta, ioni natrija jure u ćeliju poput lavine, noseći sa sobom pozitivne naboje. Na vanjskoj strani membrane na pobuđenom mjestu umjesto pozitivnih naboja uspostavljaju se negativni naboji zbog velikih anjona organskih kiselina i proteina. Unutrašnja strana membrane ovaj lavinski tok Na kationa doživljava kao ubrizgavanje električne struje sa pozitivnim predznakom.
Nakupljanje Na + jona na unutrašnjoj strani membrane prvo dovodi do neutralizacije njenog negativnog naboja, tj. do njegove depolarizacije, a zatim i do uspostavljanja pozitivnog naboja na ovom mestu: depolarizacija se zamenjuje inverzijom naelektrisanja (slika 8).

Rice. 8. Akcioni potencijal.
Potencijal membrane na mjestu stimulusa postaje pozitivan. Ova pozitivna faza membranskog potencijala naziva se prekoračenje ili šiljak, a visina na krivulji potencijala je 40-50 mV. Grafički, ovo je uzlazna grana krive akcionog potencijala. U ovom trenutku dolazi do inaktivacije natrijevih kanala, prestaje propusnost membrane za natrijeve ione, ustupajući mjesto povećanju provodljivosti kalija. Povećani protok kalijevih jona prema van vraća prvobitni polaritet, izazivajući repolarizaciju membrane, a natrijumove pumpe koje se nakon toga uključuju, ispumpujući jone natrijuma iz ćelije, dovršavaju proces repolarizacije.

Rice. 9. Promjena ekscitabilnosti membrane nervnih vlakana
tokom akcionog potencijala.
Grafički, ovi procesi karakterišu silaznu granu krive akcionog potencijala. Protok Na + jona na vanjsku stranu membrane dovodi do određenog povećanja membranskog potencijala u odnosu na početni. Ovo je tzv. "tragove hiperpolarizacije" membrane. Tokom ovog perioda, koji se naziva refraktorni period, membrana je neosjetljiva na ponovnu stimulaciju. Ova činjenica ima dvije posljedice. Prvo, neosjetljivost ovog dijela membrane na ponavljanu iritaciju ne dopušta povratku impulsa iz susjednog dijela, a drugo, visokofrekventne električne struje ne izazivaju ekscitaciju (akcijske potencijale) u živcu, već samo zagrijavaju odgovarajuće dijelove tkiva (i sam nerv također). ).
Amplituda krivulje akcijskog potencijala definira se kao zbir vrijednosti membranskog potencijala mirovanja i njegovog viška - prekoračenja nakon inverzije naboja. Na primjer, sa DP od -80 mV i prekoračenjem od +50 mV, amplituda PD će biti 130 mV, a znaci njegovih komponenti se ne uzimaju u obzir. Trajanje AP na membrani nervnih vlakana je 1-3 ms, mišića - do 8 ms, srčanog mišića - 300 ms.
Inaktivacija Na + -sistema . U aksonu lignje, uz konstantnu depolarizaciju, propusnost membrane za ione Na + počinje opadati nakon 0,5 ms; u neuronima kralježnjaka ovaj period je 5 puta manji. Ovo brzo smanjenje permeabilnosti membrane za jone natrija naziva se inaktivacija. Maksimalna permeabilnost membrane za jone natrija uočena je na nivou depolarizacije približno 30-40 mV negativnijem od potencijala mirovanja. Na početnim potencijalima, 20-30 mV pozitivnijim od potencijala mirovanja, Na + sistem je potpuno inaktiviran i nikakva depolarizacija ga ne može aktivirati.
Potencijalno zavisna inaktivacija Na-sistema kritično utiče na ekscitabilnost ćelija u različitim uslovima. Dakle, ako PP stanica sisara postane pozitivniji od -50 mV (na primjer, uz nedostatak kisika ili pod djelovanjem mišićnih relaksansa), tada se natrijeva provodljivost potpuno inaktivira i stanica postaje neuzbudljiva. Kada se koncentracija Ca 2+ poveća, stanica postaje manje ekscitabilnost, a kada se smanji povećava ekscitabilnost stanice. Takav porast ekscitabilnosti leži u osnovi sindroma tetanije i drugih stanja povezanih sa nedostatkom jonizovanog kalcijuma u krvi; u ovom slučaju dolazi do nevoljnih mišićnih kontrakcija i konvulzija.
5. Kretanje ekscitacije duž nervnog vlakna.
Prema modernim konceptima, širenje ekscitacije duž nervnih i mišićnih vlakana objašnjava se stvaranjem akcionih potencijala na njihovim membranama i utjecajem nastalih lokalnih električnih struja na susjedne dijelove membrane. Ako se akcioni potencijal pojavi na bilo kojem dijelu membrane u vrijeme uzlazne faze AP krive do svog vrha (prekoračivanja), ovaj dio membrane postaje biološki generator električne struje, a unutar njega teče pozitivna struja izvana. membranu u ćeliju. Izvor električne struje je brz protok jona natrijuma kroz membranu.
Na unutrašnjoj strani membrane pozitivna električna struja, neutralizirajući svoje negativne naboje, teče prema neuzbuđenim područjima, savladavajući otpor citoplazme, istovremeno teče na njenu vanjsku stranu, gdje već teče prema pobuđenom području, koristeći ekstracelularnu tekućinu kao žicu (slika 9, a).
Ove struje koriste citoplazmu i staničnu membranu kao pasivnu električnu žicu sa lošom izolacijom, smještenu u električno provodljivo okruženje, a nazivaju se elektrotonski struje. Sve dok je jačina ovih struja ispod praga, one ne izazivaju akcioni potencijal i nazivaju se i lokalne struje. Ali ako njihova snaga, do određene udaljenosti od mjesta njihove generacije, na primjer, od mjesta nastanka prethodnog AP, nekoliko puta premašuje graničnu vrijednost, tada takve struje stimuliraju depolarizaciju susjednog dijela membrane, nakon čega dolazi do pojave akcionog potencijala. U budućnosti, sve se ovo ponavlja u sljedećem susjednom dijelu; ekscitacija se kreće u talasima duž membrane. Dakle, kada se signal prenosi duž nervnog vlakna, odvijaju se dva procesa u interakciji. Prvi proces je ekscitacija membrane, tj. generacija AP - zbog specifičnih, tj. aktivna elektrogena svojstva membrane ekscitabilnih stanica. Drugi - prijenos signala duž vlakna od pobuđenog područja do nepobuđenog - je čisto električni i nastaje zbog njegovih pasivnih električnih svojstava, kada se nervno vlakno ponaša kao pasivni provodnik električnih potencijala. Provođenje ekscitacije duž nervnog vlakna pomoću prvog procesa naziva se pulsno, a drugo - bez impulsa ili elektrotonično. Metoda prijenosa bez impulsa odvija se u određenim neuronskim mrežama, gdje je potrebno da se prenosi na određene, prilično kratke udaljenosti (vidi dolje). Tokom provođenja impulsa, nervno vlakno radi kao lanac relejnih uređaja povezanih vodičem, duž kojih električni potencijali idu od repetitora do repetitora. Međutim, budući da nervno vlakno može prenositi signal na čisto električni način, onda, prvo, zašto su mu potrebni posredni repetitori i, drugo, ako su još uvijek potrebni, koliko bi onda trebala biti razmaka između relejnih točaka nervnog vlakna biti?
Konstantna dužina nervnog vlakna . Za razliku od kabla sa metalnom jezgrom koja se nalazi u vazduhu, u kojoj se napon troši samo da bi se savladao otpor samog jezgra, u nervnom vlaknu napon se troši na otpor "jezgre" kabla - tj. aksoplazme, njenoj izolaciji - membrani i o curenju struje kroz pore membrane u ekstracelularnoj tečnosti. Zbog toga se početna jačina signala postepeno smanjuje i signal se slabi. Dužina dijela nervnog vlakna na kojem se jačina struje koja je nastala na mjestu ekscitacije smanjuje za faktor e naziva se njegova konstantna dužina i označava se grčkim slovom l-lambda. Slovo e označava bazu prirodnih logaritama, što je otprilike 2.718. U nervnim ćelijama, konstantna dužina nervnog vlakna kreće se od 0,1 do 5 mm. Na primjer, na udaljenosti od 4 lambda, amplituda elektrotoničkog potencijala je samo 2% početnog potencijala. Tako će u nervnom vlaknu na udaljenosti od 1 m potpuno izumrijeti ne samo elektrotonički potencijal, već i signal izazvan AP. Stoga, da bi se širio signal početne jačine, mora se pojačati. Ali na kraju krajeva, dužina nervnog vlakna ne doseže uvijek 1 m. Kod malih insekata, stalna dužina nervnog vlakna je 250 mikrona, što je kod Drosophile 20% njenog tijela. A na ovoj udaljenosti, originalni signal će izblijediti samo 2.718 puta. Ova količina slabljenja ne ometa prijenos signala. Ali takva dužina je karakteristična za mnoge neurone u mozgu kralježnjaka. Više životinje imaju otvorene nervne ćelije koje ne stvaraju AP duž svoje dužine, već su pasivni provodnici elektrotoničnih potencijala (retinalni neuroni, na primer).
Vremenska konstanta . Dakle, da bi se okarakterisala udaljenost na kojoj se signal može prenijeti duž nervnih vlakana bez impulsa, tj. elektrotonskom metodom, svaki put kada trebate uzeti jedinicu dužine - konstantu dužine ili konstantu prigušenja ( l) nervno vlakno.
Međutim, konstanta prigušenja je prikladna samo za jednosmjernu struju. Ali sa jednosmjernom strujom, nikakve informacije se ne mogu prenijeti; ovo zahtijeva naizmjeničnu struju. Prilikom određivanja brzine širenja signala duž nervnog vlakna uz učešće naizmenične struje, mora se uzeti u obzir da njena membrana ima električni kapacitet (slika 10), koji se mora isprazniti pre nego što dostigne vrhunac amplitude naizmenične struje. svoj maksimum.
Za to se mora potrošiti određeno vrijeme. Za to vrijeme struja ne samo da prazni kapacitet ovog dijela membrane, već i teče (u međućelijski prostor). Stoga, s brzom promjenom naizmjenične struje, efikasnost pražnjenja membrane će biti manja, pa signal brže propada.
Brzina opadanja signala u ovom slučaju se određuje pomoću tzv. vremenska konstanta (t) jednaka proizvodu otpora (Rm) membrane i njenog specifičnog kapaciteta (Cm), tj.
t=RmCm Vremenska konstanta elektrotoničkog potencijala određena je vremenom za koje potencijal dostiže nivo 1/e, 37% njegove konačne amplitude; t=10 ms znači da je za dato nervno vlakno slabljenje signala u trajanju od 10 ms proporcionalno njegovoj konstanti dužine (l). Takav signal u ovom vlaknu će se prenositi praktično, kao jednosmjerna struja, ali za nervno vlakno sa t = 0,5 s (neurona mekušaca) ovaj signal će već biti "brz", tj. će se raspasti na kraćoj udaljenosti. Kod kičmenjaka, u različitim ćelijama, vremenska konstanta (t) se kreće od 5 do 50 ms.
Dakle, za prijenos signala koji je dovoljno spor u usporedbi s vremenskom konstantom (t) i na udaljenosti koja je usporediva s konstantom slabljenja (l), elektrotonični (bez impulsni) način prijenosa signala je sasvim prikladan. Ako je udaljenost preko koje se signal mora prenijeti znatno veća od konstante slabljenja, tada je potrebno njegovo pojačanje, tj. prijenos sa sekvencijalnim stvaranjem akcionih potencijala - impulsna signalizacija. Evolucija od ovih metoda bira onu koja na najbolji način osigurava prijenos signala dovoljne jačine do prijemnog kraja nervnog vlakna, ili koristi obje metode istovremeno, čime se osigurava pouzdanost signalizacije.
Međutim, da bi se osigurala efikasna funkcija nervnog vlakna, potrebna je ne samo pouzdanost, već i pravovremenost prijenosa signala, što zahtijeva dovoljno veliku brzinu njihovog prijenosa.
Elektrotonska brzina prenosa. Ovaj koncept su 1946. uveli A. Hodgkin i V. Rushton]. Prije svega, trebalo je saznati što treba razumjeti pod brzinom električnog tona? Ako imamo u vidu vrijeme tokom kojeg se proizvoljno mali signal pojavljuje u nervnom vlaknu na određenoj udaljenosti od mjesta iritacije, onda će to biti brzina svjetlosti. Međutim, signal tako male jačine se ne može primiti, jer na mjestu prijema mora imati graničnu jačinu, pa su signal takve jačine i naznačena brzina električnog tona beskorisni.
Karakteristike nervnog vlakna kao kabla čija je membrana lanac električnih kapacitivnosti (sl. 9, a i 10,

Rice. 10. Širenje ekscitacije duž nervnog vlakna.
pokazuje da se širenje membranskih potencijala duž nervnog vlakna vrši uzastopnim pražnjenjem ovih kapaciteta, za šta je potrebna struja dovoljne snage u svakom dijelu vlakna; do sljedeće tačke, struja takve jačine može se postići tek nakon što se prethodni kapacitet isprazni, a kako se sve više i više udaljenih kapacitivnosti uzastopno prazni, raspodjela potencijala se približava određenoj stacionarnoj vrijednosti (slika 11).

Rice. 11. Brzina širenja ekscitacije duž nervnog vlakna.
Na grafikonu je ova vrijednost izražena eksponencijalnom krivuljom, koja pokazuje da koliko brzo se obrazac raspodjele potencijala duž nervnog vlakna približava stacionarnoj vrijednosti ovisi o brzini dostizanja određene točke signala vlakna koji se može primiti. Ova brzina zavisi od vremenske konstante ( t) i konstante prigušenja ( l). Više t, manja struja teče kroz membranu u međućelijsku tekućinu koja okružuje vlakno po jedinici dužine membrane i, posljedično, što će preostala struja brže isprazniti sljedeći kapacitet, što je veći kapacitet (a samim tim i l), sporije će biti njegovo pražnjenje i, posljedično, aproksimacija potencijalne krive u ovom dijelu stacionarnoj vrijednosti.
Eksponencijalna kriva na sl. 2-11 pokazuje da je nemoguće odrediti brzinu do trenutka kada je u nekom trenutku dostignuta stacionarna vrijednost potencijala, jer vrijeme da se to postigne teži beskonačnosti. Stoga su Hodgkin i Rushton odabrali uvjetnu definiciju brzine električnog tona. Da bi to učinili, koristili su dvostruko komprimirani eksponent stacionarnih vrijednosti membranskog potencijala (na slici 2-11 označen je križićima). To se vidi na početnoj tački a potencijal postaje jednak 0,5 stacionarne vrijednosti ranije nego u drugim tačkama vlakna, a dalje se ovo vrijeme povećava ravnomjerno za 0,5 t na udaljenosti u l Dakle, brzina prijenosa elektrotoničkog signala je brzina kojom se polovina stacionarne vrijednosti membranskog potencijala širi duž nervnog vlakna. Izražava se formulom: V= 2 l/t, tj. jednak je dvostrukoj konstanti dužine membrane podijeljenoj s njenom vremenskom konstantom.
Ako prihvatite l= 2,5 mm, i t\u003d 50 ms, tada će brzina električnog tona biti 100 mm u sekundi.
Za širenje elektrotoničkog signala u stvarnom nervnom vlaknu, treba imati na umu jedan važan detalj: amplituda početnog membranskog potencijala mora biti ispod praga. Iznad granična vrijednost membranskog potencijala odmah dovodi membranu u stanje ekscitacije, tj. uzrokuje njegovu depolarizaciju, praćenu stvaranjem akcionog potencijala, što opažamo u običnim nervnim vlaknima].
Impulsno provođenje ekscitacije . Provođenje nervnog impulsa duž nervnog vlakna nastaje kao rezultat dva naizmjenična procesa: aktivnog - ekscitacija membrane i pasivnog - prijenos elektrotoničkog potencijala duž još nepobuđenog dijela vlakna. Stoga je brzina provođenja impulsa duž vlakna složena vrijednost i sastoji se od brzine električnog tona i vremena utrošenog na stvaranje akcionih potencijala. Što je veća brzina električnog tona, to će se signal brže i dalje širiti duž još nepobuđenog vlakna, održavajući vrijednost iznad praga, tj. vrijednost koja može izazvati stvaranje akcionog potencijala. Ovo zauzvrat zavisi od aktivnih karakteristika vlakna: faktor sigurnosti i brzina generisanja impulsa.
Faktor sigurnosti je omjer amplitude akcionog potencijala i praga pobude vlakna. Jasno je da što je veća amplituda AP i što je niži prag ekscitacije membrane, to je veća udaljenost AP je u stanju da aktivira nepobuđeni dio membrane. I, konačno, što brže napreduju procesi generisanja AP, to je kraće vremensko kašnjenje za retransmisiju i, posljedično, veća je brzina provođenja.
Koje je mogućnosti evolucija imala da poveća brzinu provođenja ekscitacije duž nervnog vlakna?
Amplituda AP se ne može značajno povećati iz dva važna razloga. Prvo, za to bi bilo potrebno stotine puta povećati razliku u koncentraciji kalijevih jona unutar i izvan vlakana i, posljedično, povećati troškove energije za jonske pumpe, što bi bilo nesrazmjerno postignutim rezultatima, a drugo, zanemariti mogućnosti membrane, što je općenito ne postoji život u prirodi. Poenta je u ovome. Amplituda AP je približno 0,1 V. S obzirom na debljinu membrane (10 nm), jačina polja na njoj je 109 V. Ako se amplituda AP poveća nekoliko puta, membrana će biti probušena. Takođe je nemoguće značajno smanjiti prag uzbuđenja, jer. mora biti iznad nivoa prirodnih fluktuacija potencijala membrane mirovanja, tzv. "šum" membrane povezan s neravnomjernim kretanjem K+ jona teče kroz membranu.
Dakle, evolucija ima na raspolaganju dva načina povećanja brzine širenja ekscitacije u nervnim vlaknima: ili promenu njihovog prečnika ili povećanje udaljenosti između tačaka generisanja AP, tj. relejne stanice nervnog vlakna.
Gore smo vidjeli da je brzina elektrotoničkog širenja potencijala proporcionalna kvadratnom korijenu prečnika, tj. da kada se prečnik vlakna udvostruči, brzina širenja signala duž njega će se udvostručiti: sa prečnikom vlakna od 200 μm, brzina je 20 m/s, sa povećanjem prečnika vlakna na 2 mm, ova brzina će se povećati na 60 gospođa. Ovo poslednje bi, međutim, u složenom organizmu dovelo do zatrpanosti tkiva nervnim vlaknima velikog prečnika, što bi bilo ne samo neekonomično, već i neracionalno sa stanovišta oblika i funkcije ovih tkiva. Stoga je evolucija odabrala drugu metodu - metodu slanog provođenja pobude između relejnih stanica nervnih vlakana izoliranih jedna od druge. U tankim mijeliniziranim vlaknima promjera 20 µm, brzina provođenja impulsa doseže 120 m/s. Kako se osigurava takvo povećanje brzine provođenja?
Mijelinsko vlakno razlikuje se od običnih vlakana po tome što su njegovi prilično dugi dijelovi prekriveni dobrom izolacijom (mijelin). Ova mijelinizirana područja se redovno izmjenjuju sa kratkim (2 μm) neizolovanim, tzv. Ranvierovi čvorovi, u kojima je vlaknasta membrana bez izolacije. Međuprostorni dijelovi imaju dužinu od oko 100 prečnika datog vlakna; izolaciju čine ćelije bogate mijelinom, koje, poput izolacijske trake, mnogo puta obavijaju nervno vlakno, onemogućujući protok jona kroz membranu u tim područjima. U presretcima, membrana je specijalizovana za generisanje akcionih potencijala i izvor je struje; gustina Na + kanala je ovde 100 puta veća nego kod nemesnatog vlakna (slika 12).

Rice. 12. Presretanja Ranviera.
Struja generirana u presjeku dolazi do sljedećeg presjeka bez velikih gubitaka i, tečeći tamo, pobuđuje generiranje AP na njegovoj membrani, koja je izvor struje za sljedeće područje presretanja. Dakle, kada se membranski potencijal pomjeri, struja ne prolazi kroz membranu intersticijskih područja i impuls se u tim područjima širi elektrotonski, uz gotovo nultu potrošnju vremena (0,05-0,07 ms) i gotovo bez slabljenja (bez dekrementa). Do kašnjenja u provodljivosti dolazi samo na prekidima, gdje elektrotonički potencijal mora dostići graničnu snagu i uzrokovati stvaranje akcionog potencijala. Takav uređaj nervnog vlakna ne samo da pruža veliku brzinu uzbuđenja, već je i vrlo ekonomičan: ionske pumpe rade samo u prekidima
Priroda je odabrala dužinu međuprostora jednaku 100 prečnika ovog vlakna. Nije najoptimalniji teoretski, jamči provođenje impulsa čak i ako se izgubi aktivnost membrane jednog ili više presretanja. Pa, šta je sa debljinom izolacije?
Rushton (1951) je utvrdio da će brzina propagacije akcionog potencijala u nervnom vlaknu biti optimalna kada je odnos unutrašnjeg prečnika mijelinizovanog dela vlakna i njegovog spoljašnjeg prečnika 0,6-0,7; ovaj indikator je definisan formulom:
To veleprodaja =1/2e, gdje je K odnos prečnika, i e= 2,718 . Stvarna mjerenja stvarnih nervnih vlakana od strane histologa potvrdila su ove podatke.
6. Klasifikacija nervnih vlakana prema brzini.
Na osnovu elektrofizioloških studija nerava dobijenih po Erlangeru i Gasseru, sva nervna vlakna su podeljena u tri grupe - A, B i C, a u grupi A izdvajaju se četiri podgrupe (tabela 1).
Nerv može sadržavati veliki broj nervnih vlakana, različitih po brzini i smjeru impulsa. Nerv donjeg ekstremiteta kod ljudi, na primjer, sadrži nervna vlakna koja se razlikuju po funkciji, promjeru i brzini provođenja impulsa. Akcioni potencijal takvog živca određen je cijelim spektrom grupa vlakana i brzinama provođenja nervnih impulsa duž njih. Kada se primeni iritacija koja može da uzbudi nervna vlakna svih grupa, snima se kompozitni akcioni potencijal celog nerva.
Tabela 1. Klasifikacija nervnih vlakana prema Erlangeru i Gasseru].
|
Funkcije vlakana |
Prosječni prečnik vlakna, µm |
Prosječna brzina provođenja, m/s |
|
|
Senzorna i motorna vlakna skeletnih mišića |
|||
|
Aferentna vlakna dodira i pritiska |
|||
|
vretena motornih mišića |
|||
|
Bolovi i temperature osetljive na kožu |
|||
|
Simpatički preganlionski |
|||
|
Simpatički postganglijski |
Nerv zadnjeg ekstremiteta, na primjer, sadrži nervna vlakna različite funkcije, promjera i brzine. Akcioni potencijal takvog nerva određen je cijelim spektrom grupa vlakana i brzinama provođenja nervnog impulsa. Kada se primeni iritacija koja može da uzbudi nervna vlakna svih grupa, snima se kompozitni akcioni potencijal celog nerva.
7. Stvaranje ekscitacije u receptorima.
U živom organizmu uticaj prirodnih nadražaja vrši se u posebnim čulnim organima, a podražaji su svetlost, zvuk, pritisak, temperatura, promene pH okoline itd. Ćelije koje razlikuju ove podražaje i šalju informacije o njima nervnom sistemu nazivaju se receptori.
Pod dejstvom stimulusa na receptorsku ćeliju dolazi do depolarizacije membrane njenih opažajnih procesa, a sa dovoljno velikom snagom stimulusa nastaje tzv. receptorski potencijal. Za razliku od membrana drugih ekscitabilnih ćelija, trajanje receptorskog potencijala odgovara trajanju izlaganja stimulusu, a njegova amplituda odgovara intenzitetu stimulusa.
Potencijal receptora se elektrotonički širi do baze tijela receptorske ćelije, odakle nastaje njen akson, i ovdje uzrokuje depolarizaciju koja prelazi nivo praga; javlja akcioni potencijal. Specifično je u ovom slučaju sljedeće: kriva repolarizacije membrane na kraju akcionog potencijala pada mnogo ispod početne razine, dolazi do hiperpolarizacije membrane, a krivulja depolarizacije koja se zatim ponovo javlja dostiže granični nivo: javlja se sljedeći akcioni potencijal. Dakle, trajna depolarizacija ulazne membrane receptorske ćelije uzrokovana stimulusom uzrokuje stvaranje niza akcionih potencijala na njenoj izlaznoj membrani, koji se zatim propagiraju duž aksona. Trajanje izdavanja AP serije odgovara trajanju djelovanja stimulusa, a frekvencija impulsa u seriji odgovara intenzitetu njegovog djelovanja. Tako se akcioni potencijali u obliku frekvencijskog koda prenose u centralni nervni sistem o veličini i trajanju stimulusa.
Receptori koji čine jednu celinu sa aksonom osetljive nervne ćelije nazivaju se primarni; Sekundarni receptori su sinapsama povezani sa aksonom nervne ćelije, a transformacija receptorskog potencijala u niz akcionih potencijala vrši se u receptivnim završecima (terminalima) nervne ćelije pod uticajem medijatora koji oslobađa receptor. Trajanje i učestalost serije u ovom slučaju određuju se trajanjem oslobađanja i količinom medijatora.
8. Međućelijski prijenos ekscitacije.
Strukture koje nastaju na mjestu kontakta između kraja aksona živčane stanice i membrane sljedeće ćelije (mišićne, žljezdane ili živčane) nazivaju se sinapse. Formacija, nazvana sinapsa, uključuje membrane kontaktnih stanica - presinaptičke i postsinaptičke, između kojih postoji prostor širine 10-50 nm (100-500 A) - sinaptički rascjep. Takva širina jaza onemogućava električni prijenos pobude od ćelije do ćelije zbog velikog gubitka struje u intersticijskoj tekućini. Hemijski prijenos ekscitacije u sinapsama može igrati ulogu mehanizma koji pojačava ekscitaciju, međutim jačanje. zavisi od količine oslobođenog medijatora, a od trajanja njegovog oslobađanja, osetljivosti percepcijske membrane.Sve se to može optimalno prilagoditi evolucijom i tako sinapsa radi na principu ventila koji omogućava ekscitaciju određenog intenzitet prolaska.
Biološki značaj sinapsi . Bez sinapsi kao ventila, uredna aktivnost centralnog nervnog sistema teško bi bila moguća. Efikasnost sinaptičkog prenosa može se modifikovati. Na primjer, prijenos ekscitacije se poboljšava češćom upotrebom sinapse.
Sinaptički način interneuronskih veza igra važnu ulogu u razvoju i formiranju nervnog sistema organizama u procesima filogeneze i ontogeneze. U procesu ontogeneze, centralni nervni sistem pojedinca se razvija i usavršava do određenog uzrasta kako dodavanjem novih neurona tako i nastankom i uspostavljanjem novih interneuronskih sinaptičkih veza među njima, što bi bilo nemoguće u slučaju konstantne krute međućelijske morfološke veze.
Konačno, sinapse su mjesta primjene mnogih farmakoloških supstanci koje blokiraju prijenos ekscitacije, uključujući tvari endogenog porijekla koje imaju pozitivnu farmakološku i patogenetsku vrijednost. O njima će se raspravljati kada se razmatra funkcija moždanih struktura.
Razmotrimo mehanizam sinaptičkog prijenosa na primjeru neuromuskularne sinapse.
neuromuskularni spoj With. Šematski je struktura neuromuskularne sinapse prikazana na Sl. 13.
Rice. 13. Neuromuskularna (hemijska) sinapsa.
Aksoni motornih neurona kičmene moždine i motorna jezgra produžene moždine i srednjeg mozga formiraju sinapse sa vlaknima skeletnih mišića. Presinaptičku membranu formiraju mnoge terminalne grane aksona koje su izgubile mijelinsku ovojnicu. Postsinaptička membrana u sinapsi pripada mišićnom vlaknu i naziva se krajnja ploča. Sinaptičke vezikule u zadebljanim terminalima aksona sadrže kemikaliju acetilholin.
Pod uticajem akcionog potencijala aksona, acetilholin se oslobađa iz sinaptičkih vezikula kroz njegovu presinaptičku membranu, koja, prošavši kroz sinaptičku pukotinu, izaziva depolarizaciju završne ploče i pojavu lokalnog potencijala završne ploče - ECP na njemu. Potonji se razlikuje od akcionog potencijala po brojnim svojstvima. Duže traje, njena krivulja, koja je na negativnoj strani x-ose, karakteriše strm porast od 1-1,5 ms i spori pad u trajanju od 3,5-6 ms. PKP ne poštuje zakon sve ili ništa; njegova amplituda ovisi o količini medijatora koji se oslobađa u sinapsu i osjetljivosti postsinaptičke membrane na njega. Sa dovoljnom frekvencijom akcionih potencijala koji pristižu na presinaptičku membranu, količina neurotransmitera koji se oslobađa u sinapsu i, posljedično, EPC se sumiraju, stimulirajući pojavu akcionog potencijala na membrani mišićnog vlakna.
Za normalno oslobađanje medijatora u sinapsi neophodno je prisustvo jona kalcijuma. Razlog oslobađanja medijatora u sinaptički rascjep nije depolarizacija same presinaptičke membrane, već to što depolarizacija otvara put kalciju u presinaptički terminal. Ako uklonite kalcij iz vanjskog okruženja, tada kemijska sinapsa neće raditi ni pod kakvom depolarizacijom. Proučava se mehanizam djelovanja Ca 2+ jona na oslobađanje medijatora. Utvrđeno je da njegovom oslobađanju u sinapsi prethodi naglo povećanje permeabilnosti presinaptičke membrane za ione kalcija, koji brzo prodiru u presinaptički terminal aksona. Nakon što ioni Ca 2+ izvrše svoju funkciju, oni se ispumpavaju iz aksona pomoću ionskih kalcijevih pumpi, čiji rad konstantno održava neravnotežnu koncentraciju jona kalcija oko membrane.
Energija potrebna za rad pumpi stvara se u mitohondrijima terminala aksona, koja se također troši na resintezu acetilholina iz holina i octene kiseline u istim terminalima.
Blokada neuromuskularne transmisije . Lokalni anestetici (novokain) blokiraju provođenje ekscitacije u presinaptičkim nervnim završecima. Botulinum toksin sprječava oslobađanje medijatora, jer blokira propusnost presinaptičke membrane za jone kalcija. Ioni magnezija djeluju slično na membranu. Zmijski otrov, na primjer, a-bungarotoksin, otrov kurare blokiraju acetilkolinske receptore postsinaptičke membrane, ireverzibilno (zmijski otrov) ili reverzibilno (otrov kurare), vezujući se za njih. Organofosforni spojevi u toksičnim dozama inhibiraju enzim kolinesterazu, koji normalno razgrađuje acetilkolin nakon što izvrši svoju funkciju. Istovremeno, enzim koji nije razdvojen u vremenu djeluje u sinapsi toliko dugo da dolazi do inaktivacije postsinaptičkih membranskih receptora za medijator.
Protein, latrotoksin, izolovan je iz otrova pauka karakurta, koji u suštini ne zatvara kalcijumske kanale. Ugrađuje se u presinaptičku membranu i počinje puštati kalcij u terminal. Kao rezultat toga, rezerve acetilholina u terminalu su potpuno iscrpljene i nervni sistem ne može izazvati kontrakcije mišića (uključujući respiratorne).
Neke tvari koje blokiraju sinaptički prijenos koriste se u anesteziji i drugim medicinskim procedurama za opuštanje mišića. Ove supstance se nazivaju relaksanti.
električne sinapse . Pored hemijskih sinapsi, kod životinja su pronađene i električne sinapse. Kod ES, tokovi jona prolaze od terminala aksona do ciljne ćelije direktno kroz posebne kanale u tubulima specifičnih membranskih proteinskih uređaja za "pristajanje" - koneksona. Molekuli proteina konektora formiraju posebnu strukturu u terminalnim membranama aksona i postsinaptičkoj membrani ciljne ćelije - konekson, koji se sastoji od šest molekula i ima kanal unutar. Dva koneksona susjednih sinapsnih membrana su međusobno povezana i u svakoj od njih se otvara rupa - kanal koji je prethodno bio zatvoren (ovaj proces je sličan otvaranju otvora prilikom spajanja). Ovaj kanal predstavlja nizak otpor za prolaz jona. Postoji mnogo koneksona u ES-u. Dakle, ES povezuje dvije ćelije s mnogo tankih cijevi prečnika oko 1-1,5 nm, prolazeći unutar proteinskih molekula (slika 14, d).

Rice. 14. Električne sinapse.
Prostor između koneksona u sinaptičkom pukotinu ES ispunjen je izolatorom. Kod ptica, u lancu neurona koji obezbjeđuje reakciju zenice na svjetlost, praznina električnih sinapsi je ispunjena mijelinom.
Karakteristična karakteristika ES-a je njegova brzina. Druga karakteristična karakteristika ES-a je da prenose signal u oba smjera, tj. oni su simetrični. Postoje, međutim, EC formirane od membrana s ispravljajućim svojstvima koje prenose signal u jednom smjeru, kao i simetrične kemijske sinapse, u kojima su vezikule s medijatorom prisutne s obje strane sinaptičke pukotine. ES se najčešće nalaze kod beskičmenjaka i nižih kralježnjaka (ciklostomi i ribe).
Uređaji kao što su sinapse. Uređaji poput sinapsi igraju važnu ulogu u životu različitih tkiva i organa. Na primjer, ćelije srca kod raznih životinja povezane su kanalima iz istog proteina proteina koji formira kanale u ES. U ovom slučaju, kontaktno područje ćelije naziva se kontaktom visoke propusnosti (sinapsa je kontakt u kojem je najmanje jedan sudionik neuron). Glatke mišićne ćelije unutrašnjih organa međusobno su povezane sistemom koneksona. Neekscitabilne ćelije (ćelije epitela, žlijezda, jetra itd.) također su povezane visokopropusnim kontaktima. Zapravo, gotovo sva tjelesna tkiva nisu skupovi pojedinačnih ćelija, već jedan kolektiv u kojem ćelije mogu razmjenjivati različite molekule kroz kanale visokopropusnih kontakata. Zbog toga je moguća svojevrsna "ćelijska uzajamna pomoć" u tkivima. Na primjer, ako membranske pumpe ne rade dobro u ćeliji, njeni susjedi "dijele" svoju ionsku rezervu s njom kroz kanale visokopropusnih kontakata i održavaju njen potencijal mirovanja.
Koneksoni nisu stabilne cijevi, već dinamičke strukture: koneksonski kanali se mogu otvarati i zatvarati pod utjecajem različitih faktora. Molekularni mehanizam takvog zatvaranja kanala je razjašnjen. Konekson se sastoji od 6 podjedinica koje se mogu kretati jedna u odnosu na drugu (vidi sliku 2-12, b), dok se rupa može zatvoriti; ovaj uređaj je veoma sličan uređaju sa dijafragmom kamere sa pokretnim laticama. U slučaju da je bilo koja ćelija ozbiljno oštećena membrane i njeni odbrambeni mehanizmi ne mogu da se izbore sa viškom, na primer, kalcijuma koji dolazi iz okoline, usled čega je ćelija osuđena na smrt, visoka koncentracija Kalcijum unutar ove ćelije utiče na veze sa susednim ćelijama, njihovi kanali se zatvaraju i susedne ćelije se odvajaju od oštećenog suseda. "Ćelije srca rade zajedno i umiru jedna po jedna", rekao je jedan poznati naučnik. Sada znamo zašto je to moguće.
Dinamizam koneksona važan je ne samo za preživljavanje. Utvrđeno je da se visokopropusni kontakti mogu naći već u najranijim fazama razvoja embriona različitih životinja; međusobno povezuju ćelije koje nastaju već prilikom prvog drobljenja jajeta, a na ulazu u dalji razvoj ili se pojavljuju ili nestaju. Ćelije ili utiču jedna na drugu nekim supstancama, zatim se delovi embriona izoluju jedan od drugog i tada se u tim područjima razvija homogeno tkivo iz identičnih ćelija; onda su ta područja opet povezana kontaktima sa susjedima, a sva ta složena igra kontakata obavlja određene funkcije u regulaciji normalnog razvoja. Sve ovo sugerira da je signalizacija u ES-u sekundarna "profesija" strukture, koja, kao i jonske pumpe, igra općenitiju i fundamentalniju ulogu u razvoju organizama i funkcioniranju njihovih tkiva.
Slično tome, princip rada hemijskih sinapsi se koristi u organizmima ne samo za prenošenje informacija, već i za druge svrhe. Dakle, razne sekretorne ćelije koriste ione Ca2+ da regulišu oslobađanje sekreta, baš kao što se u hemijskoj sinapsi ovaj proces koristi za oslobađanje medijatora. Imajte na umu da su ćelije mnogih žlijezda električno pobuđene.
Razmotrimo, na primjer, rad b-ćelija gušterače koje proizvode inzulin. Na površini ovih ćelija nalaze se receptori koji reaguju na nivo glukoze u intersticijskoj tečnosti koja ih okružuje. Ako je nivo koncentracije glukoze u krvi veći od normalnog, tada pod uticajem ovih receptora dolazi do depolarizacije ćelija (kao rezultat zatvaranja kalijumovih kanala) i u njima nastaju akcioni potencijali.Ti akcioni potencijali su kalcijuma prirode, nastaju zbog otvaranja Ca kanala. Istovremeno, ioni Ca2+ ulaze u ćeliju, što dovodi do oslobađanja inzulina u krv, kao i kod nervnih završetaka, dovodi do oslobađanja medijatora. Uloga kalcija u oslobađanju različitih supstanci, posebno hormona, dokazana je i za mnoge druge žlijezde. Vrijedi napomenuti da se opisani mehanizam za nastanak akcionih potencijala u stanicama gušterače vjerovatno odvija i u stanicama hipotalamusa, koje reagiraju na različite razine koncentracije određenih hormona,
Različite tjelesne ćelije oslobađaju različite tvari u svoju okolinu; Prije svega, to su ćelije žlijezde. Ove tvari su pakirane u membranske posude - vezikule, a njihovo oslobađanje reguliraju joni Ca2+, koji kroz posebne kalcijumove kanale ulaze u ćeliju. Kao rezultat evolucije, ovaj mehanizam su počele da koriste nervne ćelije u izgradnji hemijskih sinapsi; kontejneri sadrže neurotransmiter, a zatim je njegovo oslobađanje organizirano na isti način kao i oslobađanje hormona i drugih supstanci, te su s ove tačke gledišta nervne ćelije sa hemijskim sinapsama jedna od opcija za sekretorne ćelije, a posrednik je njihova tajna, koja se ne samo ispušta u krvotok, već kroz sinaptički rascjep ulazi u potpuno specifične potrošače. S druge strane, rad žljezdanih ćelija je sličan radu nervnih ćelija, ali njihov akcioni potencijal služi za otvaranje kalcijumskih kanala i puštanje Ca2+ jona unutra. Istu stvar opažamo i u mišićnim ćelijama, gdje akcioni potencijal otvara kapiju za jone Ca 2+, koji pokreću proces kontrakcije.
Tako, prvo, još jednom vidimo blisku sličnost mehanizama koje različite ćelije tijela koriste u različite svrhe, a drugo, gledajući unaprijed, možemo sugerirati da je tajna emocionalne obojenosti osjeta i najviše manifestacije nervnog stanja. aktivnost ljudskog mozga je senzacija svijesti i razmišljanja - nalazi se upravo u ovom jedinstvu neuronskih funkcija. one. po svom svojstvu da bude i nervna (generira i provodi električne impulse) i ćelija koja izlučuje.
9. Ovisnost funkcije neurona o njegovom obliku.
Fiziološke funkcije nervne ćelije u velikoj su meri određene njenim električnim svojstvima. Već znamo da neuroni dolaze u raznim oblicima, pri čemu njihovi aksoni u principu imaju oblik cilindričnog kabla, a njihova tijela manje-više sfernog oblika. Upoređujući električna svojstva kugle i cilindra formiranog od identičnih membrana, vidjet ćemo koliko važnu ulogu u određivanju ovih svojstava ima oblik ekscitabilne ćelije.
Električni parametri koji karakterišu nervnu ćeliju mogu se podeliti u dve grupe: 1) parametri koji karakterišu supstancu membrane i citoplazme - specifični otpor membrane (Rm), jednak 1-10 kOhm / cm2, njen specifični električni kapacitet (1 μF / cm2) i specifični citoplazmatski otpor (Ri) od oko 100 Ohm.cm; ovi parametri ne ovise o obliku ćelije; 2) sistemske parametre; karakterišu vlakno, ćeliju ili sistem srodnih ćelija u celini i zavise od veličine i oblika; jedan od parametara sistema je njegova ulazna impedansa - Rin
Ulazni otpor je omjer pomaka membranskog potencijala ćelije i vrijednosti električne struje koja prolazi u nju: Rin = DV / I. Dakle, ulazni otpor je analog uobičajenog otpora dijela nervnog vlakna.
Ulazna impedancija aksona (cilindra) izražava se formulom:
Rin \u003d 1 / p 2 (Rm Ri) / 8a3, gdje a- radijus aksona .
U ovoj formuli, Rm i Ri su otpor aksonske membrane i citoplazme, tj. parametri 1. grupe; sve ostalo je određeno geometrijom vlakna kao cilindra dužine mnogo veće od radijusa. A što ako je sferni kavez polumjera a napravljen od istog materijala? Pokazalo se da čak iu vrlo velikim sfernim ćelijama (1 mm u prečniku) otpor citoplazme iznosi samo 0,1% otpora membrane; u sfernim ćelijama mnogo manjeg prečnika (sve nervne ćelije su iste), otpor citoplazme se može zanemariti, a stvarni ulazni otpor sferične ćelije zavisi samo od specifičnog otpora njene membrane i radijusa: Rin = Rm /4pa3
Dakle, za sferičnu ćeliju, ulazni otpor je direktno proporcionalan otporu membrane, pa ako se, kada je ćelija pobuđena, specifični otpor njene membrane smanji, recimo, za faktor 36, tada ulazni otpor sistem će se takođe smanjiti za faktor 36.
Za vlakno, ulazni otpor je proporcionalan samo 2Rm, tako da ako se, nakon ekscitacije, otpor membrane također smanji za faktor 36, tada će se ulazni otpor promijeniti samo za faktor 6.
Kako sve to utiče na funkciju neurona? U sfernoj ćeliji membranski potencijal ne nestaje trenutno, kao u cilindričnom vlaknu, već polako – eksponencijalno.Postsinaptički potencijal u sinapsama je direktno proporcionalan ulaznom otporu postsinaptičke membrane, dakle, u sfernoj ćeliji promjera od 10 mikrona, postsinaptički potencijal će biti 100 puta veći nego u ćeliji prečnika 100 µm. Efikasnost ekscitatornih sinapsi je manja, što je niža njihova ulazna impedansa. Posrednik inhibitorne sinapse u globularnoj ćeliji smanjuje ulazni otpor postsinaptičke membrane, čime se smanjuje efikasnost ekscitatornih impulsa; kod cilindričnog vlakna ovaj efekat je mnogo manji.
Sporo smanjenje membranskog potencijala na membrani sferne ćelije značajno povećava efikasnost privremene sumacije u njoj. Različiti oblici i veličine tijela neurona moždane kore - pojava nije slučajna!
Provodljivost nervnog vlakna sa promjenom njegovog promjera. Pokazano je da se u istom vlaknu, prije njegovog širenja, nervni impuls usporava, a njegova amplituda smanjuje; kada se vlakno proširi šest puta, PD ne može proći kroz ovo proširenje. Naprotiv, kada se vlakno sužava, kako se približava tački suženja, brzina pulsa se povećava, a njegova amplituda se povećava. Povećanje AP amplitude na kraju terminala veoma je važno za rad hemijskih sinapsi, jer poboljšava uslove za oslobađanje medijatora.Ako se akson suženja račva na dve grane čiji je ukupan prečnik manji od prečnika na mestu grananja, tada se AP ubrzava pre grananja, a ako je ukupan prečnik grana veći - brzina PD se usporava i može čak biti blokirana. Provodljivost dendrita. U smjeru provođenja ekscitacije, dendriti počinju kao tanke brojne grane, koje se više puta spajaju u deblje grane, a završavaju na tijelu neurona debelim stablima. Dužina dendrita je desetine puta veća od promjera tijela nervnih ćelija, a debljina terminalnih grana može biti djeliće mikrometra. U nekim dendritima, membrana je neekscitabilna (ne stvara AP) i može samo elektrotonski prenositi signale kao pasivni kabel; u drugima je u stanju generirati i provoditi akcione potencijale poput aksona, ali u smjeru neurona. tijelo. U prvom slučaju, kako vjeruju naučnici, mnoge sinapse se nalaze na tankim terminalnim granama i kombinovano djelovanje tih sinapsi dopire do tijela neurona. Kvantitativna procjena je pokazala da je efikasnost dendritskih sinapsi samo 3-5 puta manja od sinapsi smještenih na tijelu neurona. Dovoljnu snagu da efikasno dopre do tijela ćelije, elektrotonični potencijal prima u dendritskoj sinapsi zbog male radijus dendritskog terminala i stoga njegov veliki ulazni otpor (vidi gore). Ova sila je dovoljna da kompenzira slabljenje signala dok se kreće u smjeru širenja dendrita.
Kod neurona čija je dendritična membrana sposobna generirati i provoditi akcione potencijale, slična visoka efikasnost dendritskih sinapsi dovodi do činjenice da će samo nekoliko sinapsi dovesti membranski potencijal do praga i izazvati AP u ovoj grani, koja će početi da se širi. na telo ćelije. Njegova dalja sudbina ovisit će o svojstvima čvorova grananja koje mora proći na putu do tijela neurona, o broju i vremenu akcionih potencijala koji pristižu na mjesta grananja duž drugih grana, itd. Kao rezultat toga, ova vrsta ćelije radi kao složeno logičko kolo. Ćelije sa složenim sistemom dendrita rade kao veoma složeni elementi kompjutera.
Funkcije dendritskih bodlji . Na dendritima mnogih neurona postoje posebne formacije, tzv. kičme. Ove gljivaste formacije u obliku glave na tankoj stabljici su izbočina stanične membrane dendrita, na kojoj se formira hemijska sinapsa sa terminalom drugog neurona. Naučnici vjeruju da je funkcija kičme sljedeća. U slučaju neekscitabilne membrane, bodlje značajno smanjuju međusobni utjecaj susjednih sinapsi na postsinaptičku membranu dendrita, u kojoj bi, u odsustvu bodlji, došlo do značajnog smanjenja ulaznog otpora terminala dendrita. i, posljedično, smanjenje nivoa membranskog potencijala. Proračuni su pokazali da iako su bodljikave sinapse pojedinačno manje efikasne od sinapsa smještenih direktno na dendritu, ukupni učinak njihovog rada je primjetno veći.
Ako je membrana kralježnice podražljiva, onda može raditi kao pojačalo sinaptičkog prijenosa. Zbog tankog vrata, ulazna impedansa kralježnice je vrlo visoka, a jedna sinapsa može pokrenuti akcioni potencijal u glavi, koji će poslati mnogo jaču električnu struju do dendrita od struje sinapse.
10. Funkcije neuroglije.
Prostor između neurona u centralnom nervnom sistemu ispunjen je specijalizovanim potpornim ćelijama zvanim glija. Njihov broj je 5-10 puta veći od neurona. Glija takođe formira mijelinske ovojnice perifernih aksona neurona.
Glijalne ćelije se dele u dve grupe - astrocite i oligodendrocite.Astrociti čiste ekstracelularni prostor neurona od viška jona i medijatora i stoga deluju kao pufer u slučaju povećanja ekstracelularne koncentracije jona kalcijuma i eliminišu hemijske "smetnje" u rad neurona. Trofička funkcija glije u odnosu na neurone nije dokazana, iako mogu promijeniti pristup kisiku i glukozi neuronima. blokiranje odgovarajućih tokova intersticijske tečnosti. Astrociti mogu promijeniti signal koji se prenosi u sinapsama blokiranjem pojedinih dijelova membrane u sinaptičkim pukotinama.Na mjestima ograničenog oštećenja mozga, astrociti obavljaju sanitarne funkcije, učestvujući u čišćenju mrtvih dijelova neurona.
Oligodendrociti, koji se vijugaju oko aksona neurona, formiraju svoju mijelinsku ovojnicu u CNS-u. Različiti oligodendrociti - Schwannove ćelije - formiraju diskontinuirani mijelinski omotač perifernih aksona.
11. Rast i razvoj neurona u ontogenezi.
Neuron se razvija iz male progenitorske ćelije koja prestaje da se deli čak i pre nego što otpusti svoje procese.
Pitanje podjele samih neurona trenutno je diskutabilno. kao i svrsishodnost ovog procesa u formiranom organizmu. Regeneracija oštećenih procesa na dijelu ćelijskog tijela je činjenica koja je u potpunosti dokazana. U pravilu, akson prvi počinje rasti, a kasnije se formiraju dendriti. Na kraju procesa razvoja nervne ćelije pojavljuje se zadebljanje nepravilnog oblika - "konus rasta", koji, naizgled, utire put kroz okolno tkivo. Konus rasta je spljošteni dio procesa nervne ćelije s mnogo tankih bodlji. Mikrošiljci imaju debljinu od 0,1-0,2 mikrona i dužinu do 50 mikrona. Za poređenje, zapamtite da je promjer ljudskog crvenog krvnog zrnca 7,3 mikrona. Široko i ravno područje konusa rasta ima širinu i dužinu od oko 5 µm. Prostori između mikrobodlji prekriveni su presavijenom membranom.
Mikrošiljci su u stalnom pokretu. Neki od njih se povlače u konus, drugi se izdužuju, odstupaju u različitim smjerovima, dodiruju podlogu i mogu se zalijepiti za nju. Neposredno ispod presavijenih područja membrane i u bodljama nalazi se gusta masa isprepletenih aktinskih filamenata, mitohondrija, mikrotubula i neurofilamenata, sličnih onima u tijelu neurona.
Vjerovatno su mikrotubule, neurofilamenti i aktinski filamenti (vidi dolje) izduženi uglavnom zbog dodavanja novosintetiziranih podjedinica u bazi neuronskog procesa. Kreću se brzinom od oko milimetar dnevno, što odgovara brzini sporog transporta aksona u zrelom neuronu. Dodan je novi membranski materijal, očigledno na kraju. Male membranske vezikule se transportuju duž procesa neurona od tijela ćelije do konusa rasta strujom brzog transporta aksona. Membranski materijal se, po svemu sudeći, sintetizira u tijelu neurona, prenosi u konus rasta u obliku vezikula, te se ovdje uključuje u plazma membranu egzocitozom, produžavajući tako proces nervnih ćelija.
Rastu aksona i dendrita obično prethodi faza migracije neurona, kada se nezreli neuroni talože i pronalaze trajno mjesto za sebe u nervnim mrežama.
Odmah ću vas obavijestiti da se ova napomena ne odnosi na perceptrone, Hopfieldove mreže ili bilo koje druge umjetne neuronske mreže. Simuliraćemo rad „prave“, „žive“, biološke neuronske mreže u kojoj se odvijaju procesi generisanja i širenja nervnih impulsa. U literaturi na engleskom jeziku takve mreže, zbog svoje razlike od umjetnih neuronskih mreža, nazivaju se spiking neuronskim mrežama, dok u literaturi na ruskom jeziku nema ustaljenog naziva. Neko ih naziva jednostavno neuronskim mrežama, neko impulsnim neuronskim mrežama, a neko ih naziva spike mrežama.Vjerovatno je većina čitalaca čula za projekte Plavi mozak i Ljudski mozak koje sponzorira Evropska unija, za koji je Vlada EU izdvojila oko milijardu eura, što ukazuje da postoji veliko interesovanje za ovu oblast. Oba projekta su usko povezana i međusobno se ukrštaju, čak imaju i zajedničkog vođu, Henryja Markrama, što može stvoriti određenu zabunu oko toga kako se razlikuju jedan od drugog. Ukratko, krajnji cilj oba projekta je razvoj modela cijelog mozga, svih ~ 86 milijardi neurona. Projekat Plavi mozak je računski dio, a ljudski mozak je više fundamentalni dio, gdje rade na prikupljanju naučnih podataka o principima mozga i stvaranju jedinstvenog modela. Da bismo se dotakli ove nauke i pokušali da uradimo nešto slično, iako u mnogo manjem obimu, napisana je ova beleška.
Na Habréu je već bilo nekoliko zanimljivih i informativnih članaka o neurobiologiji, što je vrlo drago.
1. Neurobiologija i umjetna inteligencija: prvi dio - obrazovni program.
2. Neurobiologija i umjetna inteligencija: drugi dio – inteligencija i predstavljanje informacija u mozgu.
3. Neurobiologija i umjetna inteligencija: treći dio – predstavljanje podataka i pamćenje
Ali oni se nisu bavili pitanjima kompjuterske neuronauke, ili drugim rečima, računarske neuronauke, koja uključuje kompjutersku simulaciju električne aktivnosti neurona, pa sam odlučio da popunim ovu prazninu.
Malo biologije
Rice. 1 - Šematski prikaz strukture neurona.
Prije nego što počnemo modelirati, moramo se upoznati s nekim osnovama neuronauke. Tipičan neuron se sastoji od 3 dijela: tijela (soma), dendrita i aksona. Dendriti primaju signale od drugih neurona (ovo je ulaz neurona), a akson prenosi signale od tijela neurona do drugih neurona (izlaz). Tačka kontakta između aksona jednog neurona i dendrita drugog neurona naziva se sinapsa. Signal primljen od dendrita se sabira u tijelu, a ako pređe određeni prag, tada se stvara nervni impuls ili, drugim riječima, šiljak. Ćelijsko tijelo je okruženo lipidnom membranom, koja je dobar izolator. Jonski sastav citoplazme neurona i međustanične tekućine se razlikuje. U citoplazmi je veća koncentracija kalijevih jona, a niža koncentracija natrijuma i hlora, dok je u međućelijskoj tekućini obrnuto. To je zbog rada ionskih pumpi, koje konstantno pumpaju određene vrste jona protiv gradijenta koncentracije, dok troše energiju pohranjenu u molekulima adenozin trifosfata (ATP). Najpoznatija i najistraženija od ovih pumpi je natrijum-kalijum pumpa. On dovodi 3 jona natrijuma napolje, a uzima 2 jona kalijuma unutar neurona. Slika 2 prikazuje jonski sastav neurona i označene su jonske pumpe. Zahvaljujući radu ovih pumpi, u neuronu se formira ravnotežna razlika potencijala između unutrašnje strane membrane koja je negativno naelektrisana i spoljašnje koja je pozitivno naelektrisana. 
Rice. 2 - Jonski sastav neurona i okoline
Osim pumpi, na površini neurona postoje i jonski kanali, koji se pri promjeni potencijala ili pri izlaganju hemikalijama mogu otvoriti ili zatvoriti, čime se povećavaju ili smanjuju struje određene vrste jona. Ako membranski potencijal prijeđe određeni prag, otvaraju se natrijumski kanali, a pošto je natrijuma više izvana, pojavljuje se električna struja usmjerena unutar neurona, što dodatno povećava membranski potencijal i još više otvara natrijeve kanale, naglo povećanje membrane. javlja se potencijal. Fizičari to nazivaju pozitivnim povratnim informacijama. Ali, počevši od neke potencijalne vrijednosti veće od graničnog potencijala za otvaranje natrijevih kanala, otvaraju se i kalijevi kanali, zbog čega ioni kalija počinju teći prema van, smanjujući membranski potencijal i time ga vraćaju na ravnotežnu vrijednost. Ako je početna ekscitacija manja od praga otvaranja natrijumovih kanala, tada će se neuron vratiti u svoje ravnotežno stanje. Zanimljivo je da amplituda generiranog impulsa slabo zavisi od amplitude uzbudljive struje: ili postoji puls ili ga nema, zakon je „sve ili ništa“.
Inače, princip "sve ili ništa" inspirisao je McCullocha i Pittsa da kreiraju modele umjetnih neuronskih mreža. No, područje umjetnih neuronskih mreža razvija se na svoj način, a njegov glavni cilj je najoptimalnije rješenje praktičnih problema, bez obzira na to kako je to u korelaciji s procesima obrade informacija u živom mozgu. Dok su spike neuronske mreže model kako pravi mozak radi. Možete sastaviti spike mrežu za prepoznavanje vizuelnih slika, ali klasične neuronske mreže su pogodnije za praktičnu upotrebu, jednostavnije su, brže su na računaru i izmišljeni su mnogi algoritmi za učenje za određene praktične zadatke.
Princip “sve ili ništa” jasno je prikazan na slici 3. Ispod je ulazna struja usmjerena na unutrašnju stranu neuronske membrane, a na vrhu je razlika potencijala između unutrašnje i vanjske strane membrane. Dakle, prema trenutno dominantnom konceptu u živim neuronskim mrežama, informacija se kodira u trenutku nastanka impulsa ili, kako bi fizičari rekli, faznom modulacijom. 
Rice. 3 - Stvaranje nervnog impulsa. Ispod je struja dovedena unutar ćelije u pkA, a na vrhu je membranski potencijal u mV
Moguće je pobuditi neuron, na primjer, umetanjem mikroelektrode u njega i primjenom struje unutar neurona, ali u živom mozgu do ekscitacije se obično dolazi sinaptičkim djelovanjem. Kao što je već spomenuto, neuroni su međusobno povezani pomoću sinapsi, koje se formiraju na mjestima kontakta aksona jednog neurona s dendritima drugog. Neuron iz kojeg dolazi signal naziva se presinaptički, a onaj na koji signal ide naziva se postsinaptički. Kada se impuls dogodi na presinaptičkom neuronu, on oslobađa neurotransmitere u sinaptički pukotinu, koji otvaraju natrijeve kanale na postsinaptičkom neuronu, a zatim se događa gore opisani lanac događaja koji dovodi do ekscitacije. Osim ekscitacije, neuroni također mogu inhibirati jedni druge. Ako je presinaptički neuron inhibicijski, tada će otpustiti inhibitorni neurotransmiter u sinaptičku pukotinu koja otvara hloridne kanale, a budući da hlor ima više vani, hlor teče unutar neurona, što uzrokuje negativni naboj na unutrašnjoj strani membrane. povećanje (ne zaboravite da su ioni klorida za razliku od natrijuma i kalija negativno nabijeni), dovodeći neuron u još neaktivnije stanje. U ovom stanju, neuron je teže pobuditi.
Matematički model neurona
Na osnovu gore opisanih dinamičkih mehanizama rada neurona, može se sastaviti njegov matematički model. Trenutno su kreirani različiti relativno jednostavni modeli, poput “Inregrate and Fire”, u kojima je neuron predstavljen kao kondenzator i otpornik, kao i složeniji, biološki prihvatljivi modeli, kao što je Hodgkin-Huxley model, koji je računski mnogo složeniji iu smislu analize njegove dinamike, ali mnogo preciznije opisuje dinamiku membranskog potencijala neurona. U ovom članku ćemo koristiti Izhikevičev model, koji predstavlja kompromis između računske složenosti i biofizičke vjerodostojnosti. Unatoč jednostavnosti proračuna, ovaj model može reproducirati veliki broj fenomena koji se javljaju u stvarnim neuronima. Izhikevičev model je dat kao sistem diferencijalnih jednačina (slika 4).
Rice. 4 - Izhikevič model
Gdje a, b, c, d, k, cm različiti parametri neurona. Vm je razlika potencijala između unutarnje i vanjske strane membrane, i um je pomoćna varijabla. I je vanjska jednosmjerna primijenjena struja. U ovom modelu uočavaju se svojstva karakteristična za neurone kao što su: generiranje šiljaka kao odgovor na jedan impuls eksterne struje i generiranje niza šiljaka određene frekvencije kada se na neuron primjenjuje konstantna vanjska struja. Isyn- zbir sinaptičkih struja iz svih neurona sa kojima je ovaj neuron povezan.
Ako se na presinaptičkom neuronu stvori šiljak, dolazi do skoka sinaptičke struje na postsinaptičkom neuronu, koji se eksponencijalno raspada s karakterističnim vremenom.
Pređimo na kodiranje
Dakle, prelazimo na najzanimljivije. Vrijeme je da kodirate virtuelni komad nervnog tkiva na računaru. Da bismo to učinili, numerički ćemo riješiti sistem diferencijalnih jednadžbi koje definiraju dinamiku membranskog potencijala neurona. Za integraciju ćemo koristiti Eulerovu metodu. Mi ćemo kodirati u C++, crtati koristeći skripte napisane u Pythonu koristeći Matplolib biblioteku, ali oni koji nemaju Python mogu crtati koristeći Excel.Potrebni su nam dvodimenzionalni nizovi Vms, Ums dimenzije Tsim*Nneur za pohranjivanje membranskih potencijala i pomoćnih varijabli svakog neurona, u svakom trenutku vremena, Tsim je vrijeme simulacije u brojevima, i Nneur broj neurona u mreži.
Relacije će biti pohranjene u obliku dva niza pre_con i post_con dimenzije Ncon, gdje su indeksi brojevi veza, a vrijednosti su indeksi presinaptičkih i postsinaptičkih neurona. Ncon- broj linkova.
Također nam je potreban niz za predstavljanje varijable koja modulira eksponencijalno raspadajuću postsinaptičku struju svake sinapse, za to kreiramo niz y dimenzije Ncon*Tsim.
Const float h = .5f; // korak vremena integracije u ms const int Tsim = 1000/.5f; // vrijeme simulacije u diskretnim uzorcima const int Nexc = 100; // Broj ekscitatornih neurona const int Ninh = 25; // Broj inhibitornih neurona const int Nneur = Nexc + Ninh; const int Ncon = Nneur*Nneur*0.1f; // Broj konekcija, 0,1 je vjerovatnoća veze između 2 nasumična neurona float Vms; // membranski potencijali plutaju Ums; // pomoćne varijable Izhikevičovog modela float Iex; // vanjska jednosmjerna struja primijenjena na neuronski plutajući Isyn; // sinaptička struja po neuronu int pre_conns; // indeksi presinaptičkih neurona int post_conns; // indeksi postsinaptičkih neurona float težine; // težine veze float y; // varijabilna modulirajuća sinaptička struja ovisno o šiljcima na presinapsi float psc_excxpire_time = 4.0f; // karakteristično vrijeme raspada postsinaptičke struje, ms float minWeight = 50.0f; // težine, pkA dimenzija float maxWeight = 100.0f; // Parametri neurona float Iex_max = 40.0f; // maksimalna struja primijenjena na neuron je 50 pA float a = 0,02f; float b = 0,5f; float c = -40.0f; // vrijednost membranskog potencijala na koji se vraća nakon plutajućeg šiljka d = 100.0f; float k = 0,5f; float Vr = -60.0f; float Vt = -45.0f; float Vpeak = 35.0f; // maksimalna vrijednost membranskog potencijala, pri kojoj se vraća na vrijednost sa float V0 = -60.0f; // početna vrijednost za membranski potencijal float U0 = 0.0f; // početna vrijednost za pomoćnu varijablu float Cm = 50.0f; // električni kapacitet neurona, pcF dimenzija
Kao što je već spomenuto, informacije se kodiraju u trenutku pojave impulsa, pa kreiramo nizove za pohranjivanje vremena njihovog javljanja i indeksa neurona odakle su nastali. Zatim se mogu upisati u datoteku u svrhu vizualizacije.
Float spike_times; // vrijeme kada se šikovi javljaju int spike_neurons; // indeksi neurona na kojima se pojavljuju šiljci int spike_num = 0; // broj šiljaka
Nasumično rasipamo veze i postavljamo težine.
Void init_connections()( za (int con_idx = 0; con_idx< Ncon;){
// случайно выбираем постсипантические и пресинаптические нейроны
pre_conns = rand() % Nneur;
post_conns = rand() % Nneur;
weights = (rand() % ((int)(maxWeight - minWeight)*10))/10.0f + minWeight;
if (pre_conns >= Nexc)( // ako je presinaptički neuron inhibitoran, tada je težina veze minus znak težine = -weights; ) con_idx++; ) )
Postavljanje početnih uslova za neurone i nasumično podešavanje eksterne primenjene struje. Oni neuroni za koje vanjska struja premašuje prag generiranja šiljaka će generirati šiljke na konstantnoj frekvenciji.
Void init_neurons()( za (int neur_idx = 0; neur_idx< Nneur; neur_idx++){
// случайно разбрасываем приложенные токи
Iex = (rand() % (int) (Iex_max*10))/10.0f;
Isyn = 0.0f;
Vms = V0;
Ums = U0;
}
}
Glavni dio programa sa integracijom Izhikevič modela.
Float izhik_Vm(int neuron, int vrijeme)( return (k*(Vms - Vr)*(Vms - Vt) - Ums + Iex + Isyn)/Cm; ) float izhik_Um(int neuron, int time)( return a*( b*(Vms - Vr) - Ums); ) int main()( init_connections(); init_neurons(); float expire_coeff = exp(-h/psc_excxpire_time); // za eksponencijalno opadajuću struju za (int t = 1; t< Tsim; t++){
// проходим по всем нейронам
for (int neur = 0; neur < Nneur; neur++){
Vms[t] = Vms + h*izhik_Vm(neur, t-1);
Ums[t] = Ums + h*izhik_Um(neur, t-1);
Isyn = 0.0f;
if (Vms >Vpeak)( Vms[t] = c; Ums[t] = Ums + d; spike_times = t*h; spike_neurons = neur; spike_num++; ) ) // iterirati kroz sve veze za (int con = 0; con< Ncon; con++){
y[t] = y*expire_coeff;
if (Vms] >Vpeak)( y[t] = 1.0f; ) Isyn] += y[t]*težine; ) save2file(); return 0; )
Cijeli tekst koda se može preuzeti
Jedan od ovih uređaja (prikazano na slici ispod) stimulira područja mozga koja se nalaze iza čela. Oni su odgovorni za pažnju.
U laboratorijskim uslovima takva stimulacija ne traje duže od 20 minuta. Štaviše, u eksperimentu su dozvoljeni samo oni ljudi koji su prethodno prošli rigorozni medicinski pregled.
Na kraju, mozak ispitanika biva podvrgnut uređaju za koji naučnici kažu da može proizvesti neočekivane rezultate. Na primjer, utjecaj na druge dijelove mozga ili promjena polariteta elektroda ne samo da ne može pomoći, već, naprotiv, naškoditi osobi.
Možete se povrediti. Važno je znati pravilno koristiti ovu metodu, odabrati pravo vrijeme i snagu struje, upozoravaju naučnici sa Univerziteta Oksford.
S njima se slažu i njihove kolege sa Univerziteta Swansea. Prema njima, električni stimulatori mozga mogu izazvati grčeve i promjene raspoloženja. Grupa visokog rizika uključuje osobe mlađe od 20 godina - najplodnije razdoblje razvoja mozga.
Ali najviše od svega, naučnici su uznemireni činjenicom da mnoga tehnički nadarena djeca sastavljaju takve uređaje vlastitim rukama. Na forumu Reddit.com možete pronaći postove u kojima se žale na "opečeno vlasište" i "izljeve bijesa" nakon stimulacije mozga TDCS terapijom. 
To se može dogoditi kada se prekorači propisana doza. Za razliku od pacijenata, obični ljudi su manje svjesni mogućih rizika, kaže istraživač Nick Davies sa Univerziteta Swansea.
Marketing je ispred nauke
Naučnici iz Oksforda pozivaju na veću kontrolu nad električnim moždanim stimulatorima. Neke kompanije ove gadgete pozicioniraju kao igre, iako se radi o medicinskim proizvodima koji podliježu odgovarajućoj registraciji i kontroli.
Naučnici ne žele zabraniti ili ograničiti pristup uređajima za kognitivno poboljšanje. Oni žele da korisnici znaju koje će rizike morati preuzeti u potrazi za potencijalnim nagradama.
Druga zabrinutost je da tehnologija još nije spremna za komercijalnu upotrebu. Prema neuroznanstveniku Stevenu Novellu sa Univerziteta Yale, kompanije često uzimaju neprovjerene tehnologije iz laboratorija i pokušavaju ih iznijeti na tržište, nazivajući ih "seksi".
Svaki uređaj s medicinskom funkcijom treba biti reguliran u skladu s tim. Regulativa je jedina stvar koja nas motivira da trošimo novac i vrijeme na istraživanje”, kaže Novella.
Prema naučnicima, interesovanje za tehnologiju će samo rasti. Ali dok se ne provedu dodatna istraživanja, preporučuju korištenje stimulatora mozga s oprezom.
Izvorno sa BBC.com
Članak za konkurs "bio/mol/tekst": Ćelijski procesi koji osiguravaju razmjenu informacija između neurona zahtijevaju mnogo energije. Velika potrošnja energije doprinijela je tokom evolucije odabiru najefikasnijih mehanizama za kodiranje i prijenos informacija. U ovom članku ćete saznati o teorijskom pristupu proučavanju moždane energije, o njenoj ulozi u istraživanju patologije, o tome koji su neuroni napredniji, zašto je ponekad korisno da sinapse ne „ispaljuju“, kao i kako biraju samo informacije koje su neuronu potrebne.
Generalni pokrovitelj takmičenja je kompanija: najveći dobavljač opreme, reagensa i potrošnog materijala za biološka istraživanja i proizvodnju.

Pokrovitelj nagrade publike i partner nominacije "Biomedicina danas i sutra" bila je firma "Invitro".

"Knjiga" pokrovitelj takmičenja - "Alpina non-fiction"
Poreklo pristupa
Od sredine 20. veka poznato je da mozak troši značajan deo energetskih resursa celog organizma: četvrtinu sve glukoze i ⅕ celokupnog kiseonika u slučaju višeg primata. Ovo je inspirisalo Williama Levyja i Roberta Baxtera sa Massachusetts Institute of Technology (SAD) da sprovedu teorijsku analizu energetske efikasnosti kodiranja informacija u biološkim neuronskim mrežama (slika 1). Studija se zasniva na sljedećoj hipotezi. Budući da je potrošnja energije mozga velika, korisno je da ima neurone koji rade najefikasnije – prenose samo korisne informacije i troše najmanje energije.
Ova se pretpostavka pokazala točnom: na jednostavnom modelu neuronske mreže, autori su reproducirali eksperimentalno izmjerene vrijednosti nekih parametara. Konkretno, optimalna frekvencija generiranja impulsa koju oni izračunaju varira od 6 do 43 impulsa/s - gotovo isto kao u neuronima baze hipokampusa. Mogu se podijeliti u dvije grupe prema frekvenciji impulsa: spore (~10 impulsa/s) i brze (~40 impulsa/s). Istovremeno, prva grupa značajno nadmašuje drugu. Slična slika je uočena u moždanoj kori: postoji nekoliko puta više sporih piramidalnih neurona (~4-9 impulsa/s) od brzih inhibitornih interneurona (>100 impulsa/s), . Dakle, očito, mozak "radije" koristi manje brzih neurona koji troše energiju kako ne bi potrošili sve resurse, .

Slika 1. Prikazana su dva neurona. U jednom od njih ljubičasta presinaptički protein sinaptofizin je obojen. Drugi neuron je potpuno obojen zeleni fluorescentni protein. Male svetle tačke- sinaptički kontakti između neurona. U prilogu je jedna "trunka" predstavljena bliže.
Zovu se grupe neurona povezanih sinapsama neuronske mreže, . Na primjer, u moždanoj kori, piramidalni neuroni i interneuroni formiraju opsežne mreže. Dobro koordiniran "koncertni" rad ovih ćelija određuje naše veće kognitivne i druge sposobnosti. Slične mreže, samo iz drugih vrsta neurona, raspoređene su po mozgu, međusobno su povezane na određeni način i organiziraju rad cijelog organa.
Šta su interneuroni?
Neuroni centralnog nervnog sistema se dele na aktiviranje (formiraju sinapse koje aktiviraju) i inhibitorno (formiraju inhibitorne sinapse). Potonji su u velikoj mjeri zastupljeni interneuroni , ili srednji neuroni. U moždanoj kori i hipokampusu odgovorni su za formiranje moždanih gama ritmova, koji osiguravaju koordiniran, sinhroni rad drugih neurona. Ovo je izuzetno važno za motoričke funkcije, percepciju senzornih informacija, formiranje pamćenja,.
Pronalaženje optimalnog
Zapravo, govorimo o problemu optimizacije: pronalaženju maksimuma funkcije i određivanju parametara pod kojima se ona postiže. U našem slučaju, funkcija je omjer količine korisnih informacija i troškova energije. Količina korisnih informacija može se grubo izračunati koristeći Shanonovu formulu, koja se široko koristi u teoriji informacija, . Postoje dvije metode za izračunavanje troškova energije, i oba daju uvjerljive rezultate, . Jedna od njih - "metoda brojanja jona" - zasniva se na brojanju broja Na+ jona koji su ušli u neuron tokom određenog signalnog događaja (PD ili PSP, vidi bočnu traku " Šta je akcioni potencijal”) nakon čega slijedi konverzija u broj molekula adenozin trifosfat (ATP), glavna energetska "valuta" ćelija. Drugi se temelji na opisu jonskih struja kroz membranu prema zakonima elektronike i omogućava vam da izračunate snagu ekvivalentnog električnog kola neurona, koja se zatim pretvara u troškove ATP-a.
Ove "optimalne" vrijednosti parametara zatim treba uporediti s onima izmjerenim eksperimentalno i odrediti koliko se razlikuju. Ukupna slika razlika će ukazati na stepen optimizacija datog neurona u cjelini: koliko se realne, eksperimentalno mjerene, vrijednosti parametara poklapaju s izračunatim. Što su razlike slabije, neuron je bliži optimumu i efikasnije i optimalnije radi energetski. S druge strane, poređenje specifičnih parametara će pokazati u kom je specifičnom svojstvu ovaj neuron blizak „idealu“.
Nadalje, u kontekstu energetske efikasnosti neurona, razmatraju se dva procesa na kojima se zasniva kodiranje i prijenos informacija u mozgu. Ovo je nervni impuls, ili akcioni potencijal, preko kojeg se mogu dobiti informacije poslano"primatelja" na određenoj udaljenosti (od mikrometara do jednog i po metra) i sinaptičkog prijenosa koji leži u osnovi stvarnog prijenos signal sa jednog neurona na drugi.
akcioni potencijal
akcioni potencijal (PD) je signal koji neuroni šalju jedni drugima. PD su različiti: brzi i spori, mali i veliki. Često su organizovani u duge nizove (kao slova u rečima), ili u kratke visokofrekventne „pakovanja“ (slika 2).

Slika 2. Različiti tipovi neurona generiraju različite signale. U centru- uzdužni presjek mozga sisara. Na umetcima su prikazani različiti tipovi signala snimljenih elektrofiziološkim metodama, . a - kortikalni ( Cerebralni korteks) piramidalni neuroni mogu prenositi signale niske frekvencije ( Redovno pucanje), i kratki signali eksploziva ili rafala ( rafalnom paljbom). b - Za Purkinje ćelije malog mozga ( Mali mozak) karakteriše samo rafalna aktivnost na vrlo visokoj frekvenciji. in - Relejni neuroni talamusa ( Thalamus) imaju dva načina aktivnosti: burst i tonik ( paljenje tonika). G - Neuroni srednjeg dela uzice ( MHb, Medijalna habenula) epitalamusa stvaraju tonične signale niske frekvencije.
Šta je akcioni potencijal?
- membrane i jona. Plazma membrana neurona održava neravnomjernu distribuciju tvari između stanice i vanćelijske sredine (slika 3. b) . Među ovim supstancama ima i malih jona, od kojih su K+ i Na+ važni za opisivanje PD.
U ćeliji je malo Na+ jona, ali mnogo izvana. Zbog toga stalno nastoje ući u kavez. Naprotiv, unutar ćelije ima mnogo K+ jona i oni nastoje izaći iz nje. Joni to ne mogu učiniti sami, jer je membrana za njih nepropusna. Za prolaz jona kroz membranu potrebno je otvoriti posebne proteine - jonski kanali membrane. - jonski kanali. Raznolikost kanala je ogromna. Neki od njih se otvaraju kao odgovor na promjenu membranskog potencijala, drugi - kada se veže ligand (neurotransmiter u sinapsi, na primjer), drugi - kao rezultat mehaničkih promjena u membrani, itd. Otvaranje kanala sastoji se u promjeni njegove strukture, zbog čega ioni mogu proći kroz njega. Neki kanali prolaze samo određeni tip jona, dok se drugi karakteriziraju miješanom provodljivošću.
Kanali koji "osećaju" membranski potencijal igraju ključnu ulogu u stvaranju AP - potencijalno zavisna jonski kanali. Otvaraju se kao odgovor na promjene membranskog potencijala. Među njima su nas interesantni natrijumski kanali zavisni od napona (Na-kanali), koji propuštaju samo joni Na+, i naponski zavisni kalijumovi kanali (K-kanali), koji propuštaju samo K+ jone. - Jonska struja i PD. Osnova PD je jonska struja - kretanje jona kroz jonske kanale membrane. Budući da su joni nabijeni, njihova struja dovodi do promjene ukupnog naboja unutar i izvan neurona, što odmah povlači za sobom promjenu membranskog potencijala.
Generacija AP se u pravilu javlja u početnom segmentu aksona - u onom njegovom dijelu koji je uz tijelo neurona, . Ovdje je koncentrisano mnogo Na-kanala. Ako se otvore, snažna struja Na + jona će juriti u akson, i a depolarizacija membrane - smanjenje membranskog potencijala u apsolutnoj vrijednosti (slika 3.). in). Zatim se morate vratiti na njegovu prvobitnu vrijednost - repolarizacija. Za to su odgovorni joni K+. Kada se K-kanali otvore (nešto prije AP maksimuma), K+ ioni će početi napuštati ćeliju i repolarizirati membranu.
Depolarizacija i repolarizacija su dvije glavne faze PD. Osim njih, izdvaja se još nekoliko, koji se, zbog nedostatka nužde, ovdje ne razmatraju. Detaljan opis generisanja PD može se naći u,. Kratak opis PD nalazi se iu člancima na temu "Biomolekula". - Inicijalni segment aksona i inicijacija AP.Šta dovodi do otvaranja Na-kanala u početnom segmentu aksona? Opet, promjena membranskog potencijala "dolazi" duž dendrita neurona (slika 3. a). To - postsinaptički potencijali (PSP) koji je rezultat sinaptičkog prijenosa. Ovaj proces je detaljnije objašnjen u glavnom tekstu.
- Vođenje PD. Obližnji Na-kanali neće biti ravnodušni prema AP u početnom segmentu aksona. I oni će se otvoriti kao odgovor na ovu promjenu membranskog potencijala, što će također pokrenuti AP. Potonji će, zauzvrat, izazvati sličnu "reakciju" u sljedećem segmentu aksona, dalje od tijela neurona, i tako dalje. Ovako se to dešava dirigovanje PD duž aksona, . Na kraju će dostići svoje presinaptičke završetke ( grimizne strelice na sl. 3 a) gdje može pokrenuti sinaptički prijenos.
- Potrošnja energije za stvaranje AP je manja nego za rad sinapsi. Koliko molekula adenozin trifosfata (ATP), glavne energetske "valute", košta PD? Prema jednoj procjeni, za piramidalne neurone u moždanoj kori štakora, potrošnja energije za generiranje 4 AP u sekundi je oko ⅕ ukupne potrošnje energije neurona. Ako uzmemo u obzir druge procese signalizacije, posebno sinaptički prijenos, udio će biti ⅘. Za korteks malog mozga, koji je odgovoran za motoričke funkcije, situacija je slična: potrošnja energije za generiranje izlaznog signala je 15% ukupne vrijednosti, a oko polovina je za obradu ulaznih informacija. Dakle, PD je daleko od procesa koji najviše troši energiju. Ponekad je potrebno više energije za rad sinapse. Međutim, to ne znači da proces generisanja PD ne pokazuje karakteristike energetske efikasnosti.

Slika 3. Neuron, jonski kanali i akcioni potencijal. a - Rekonstrukcija kandelabarske ćelije moždane kore pacova. plava dendriti i tijelo neurona su obojeni (plava mrlja u centru), crvena- akson (u mnogim tipovima neurona, akson je mnogo razgranatiji od dendrita). Zeleni i grimizne strelice ukazuju na smjer toka informacija: dendriti i tijelo neurona ih primaju, akson ih šalje drugim neuronima. b - Membrana neurona, kao i svaka druga ćelija, sadrži jonske kanale. Zelene šolje- joni Na +, plava- K+ joni. in - Promjene u membranskom potencijalu tokom stvaranja akcionog potencijala (AP) od strane Purkinje neurona. zelena površina: Na-kanali su otvoreni, joni Na+ ulaze u neuron, dolazi do depolarizacije. Plava oblast: K-kanali su otvoreni, K+ izlazi, dolazi do repolarizacije. Preklapanje zelene i plave regije odgovara periodu kada Na + ulazi i K + izlazi istovremeno.
PD je relativno jaka promjena membranskog potencijala poput skoka amplitude.
Analiza različitih tipova neurona (slika 4) pokazala je da neuroni beskičmenjaka nisu energetski efikasni, a neki neuroni kičmenjaka su gotovo savršeni. Prema rezultatima ovog istraživanja, pokazalo se da najviše energije imaju hipokampalni interneuroni uključeni u formiranje pamćenja i emocija, kao i talamokortikalni relejni neuroni, koji prenose glavni tok senzornih informacija od talamusa do moždane kore. efikasan.

Slika 4. Različiti neuroni su efikasni na različite načine. Slika prikazuje poređenje potrošnje energije različitih tipova neurona. Potrošnja energije se izračunava u modelima kao sa početnim (stvarnim) vrijednostima parametara ( crne kolone), a kod optimalnih, u kojima, s jedne strane, neuron obavlja svoju zadatu funkciju, s druge strane troši minimum energije ( sive trake). Pokazalo se da su dvije vrste neurona kralježnjaka najefikasnije od predstavljenih: interneuroni hipokampusa ( interneuron hipokampusa pacova, RHI) i talamokortikalni neuroni ( mišja talamokortikalna relejna ćelija, MTCR), budući da je za njih potrošnja energije u originalnom modelu najbliža potrošnji energije optimizovanog. Nasuprot tome, neuroni beskičmenjaka su manje efikasni. Legenda: SA (akson lignje) - džinovski akson lignje; CA (akson rakova) - akson rakova; MFS (mišji brzi kortikalni interneuron) - brzi kortikalni mišji interneuron; BK (Kenyon ćelija tijela gljive medonosne pčele) je Kenyon ćelija pčele u obliku pečurke.
Zašto su efikasniji? Zato što imaju malo preklapanja Na- i K-struja. Tokom generisanja PD, uvek postoji vremenski period kada su ove struje prisutne istovremeno (Sl. 3 in). U ovom slučaju praktički nema prijenosa naboja, a promjena membranskog potencijala je minimalna. Ali u svakom slučaju, ove struje se moraju „platiti“, uprkos njihovoj „beskorisnosti“ u ovom periodu. Stoga, njegovo trajanje određuje koliko se energetskih resursa troši. Što je kraći, to je upotreba energije efikasnija. Što duže, to manje efektivno. Samo kod dva gore navedena tipa neurona, zahvaljujući brzim jonskim kanalima, ovaj period je veoma kratak, a PD su najefikasniji.
Inače, interneuroni su mnogo aktivniji od većine drugih neurona u mozgu. Istovremeno su izuzetno važni za koordiniran, sinhroni rad neurona, sa kojima formiraju male lokalne mreže. Vjerovatno je visoka energetska efikasnost interneuronskih AP neka vrsta adaptacije na njihovu visoku aktivnost i ulogu u koordinaciji rada drugih neurona.
Synapse
Prijenos signala s jednog neurona na drugi događa se u posebnom kontaktu između neurona, u sinapse . Samo ćemo razmotriti hemijske sinapse (ima li još električni), budući da su vrlo česti u nervnom sistemu i važni su za regulaciju ćelijskog metabolizma, isporuku nutrijenata.
Na presinaptičkom kraju aksona, AP izaziva oslobađanje neurotransmitera u vanćelijsku okolinu – do neurona koji prima. Potonji se tome samo raduje: u dendritskoj membrani receptori - jonski kanali određene vrste - vezuju neurotransmiter, otvaraju se i dozvoljavaju različitim ionima da prolaze kroz sebe. To rezultira stvaranjem male postsinaptički potencijal(PSP) na membrani dendrita. Podseća na AP, ali je mnogo manje amplitude i javlja se zbog otvaranja drugih kanala. Mnogi od ovih malih PSP-ova, svaki iz svoje sinapse, „spuštaju se“ duž dendritske membrane do tijela neurona ( zelene strelice na sl. 3 a) i dostižu početni segment aksona, gdje izazivaju otvaranje Na-kanala i "provociraju" ga da generiše AP.
Takve sinapse se nazivaju uzbudljivo : doprinose aktivaciji neurona i stvaranju AP. Postoje također inhibitorno sinapse. Naprotiv, doprinose inhibiciji i sprečavaju stvaranje AP. Često postoje obje sinapse na istom neuronu. Određeni odnos između inhibicije i ekscitacije važan je za normalno funkcioniranje mozga, formiranje moždanih ritmova koji prate više kognitivne funkcije.
Čudno je da se oslobađanje neurotransmitera u sinapsi možda uopće neće dogoditi - ovo je vjerojatnostni proces. Neuroni štede energiju na ovaj način: sinaptički prijenos već određuje otprilike polovinu ukupne potrošnje energije neurona. Kada bi se sinapse uvijek aktivirale, sva energija bi utrošila na njihovo djelovanje i ne bi preostalo resursa za druge procese. Štaviše, niska vjerovatnoća (20-40%) otpuštanja neurotransmitera odgovara najvećoj energetskoj efikasnosti sinapsi. Omjer količine korisnih informacija i utrošene energije u ovom slučaju je maksimalan, . Dakle, ispada da "neuspjesi" igraju važnu ulogu u radu sinapsi i, shodno tome, cijelog mozga. I ne morate brinuti o prijenosu signala s ponekad "nefunkcionalnim" sinapsama, jer obično postoji mnogo sinapsi između neurona, a barem jedna od njih će raditi.
Još jedna karakteristika sinaptičkog prenosa je podela opšteg toka informacija na zasebne komponente prema frekvenciji modulacije dolaznog signala (grubo govoreći, frekvenciji dolaznih AP). To je zbog kombinacije različitih receptora na postsinaptičkoj membrani. Neki receptori se aktiviraju vrlo brzo: npr. AMPA receptori (AMPA dolazi od α- a mino-3-hidroksi-5- m etil-4-izoksazol str ropionic a cid). Ako su samo takvi receptori prisutni na postsinaptičkom neuronu, on može jasno percipirati signal visoke frekvencije (kao što je, na primjer, na slici 2. in). Najjasniji primjer su neuroni slušnog sistema koji su uključeni u određivanje lokacije izvora zvuka i precizno prepoznavanje kratkih zvukova kao što su klikovi, koji su široko zastupljeni u govoru. NMDA receptori (NMDA - od N -m etil- D -a spartate) su sporiji. Oni omogućavaju neuronima da izaberu signale niže frekvencije (slika 2.). G), kao i da se visokofrekventni niz AP percipira kao nešto ujedinjeno – takozvana integracija sinaptičkih signala. Postoje čak i sporiji metabotropni receptori, koji, kada se vežu za neurotransmiter, prenose signal lancu unutarćelijskih "drugih glasnika" za prilagođavanje širokog spektra ćelijskih procesa. Na primjer, receptori povezani sa G-proteinom su široko rasprostranjeni. Ovisno o vrsti, oni, na primjer, reguliraju broj kanala u membrani ili direktno moduliraju njihov rad.
Različite kombinacije brzih AMPA-, sporijih NMDA- i metabotropnih receptora omogućavaju neuronima da izaberu i iskoriste za njih najkorisnije informacije koje su važne za njihovo funkcioniranje. I "beskorisne" informacije se eliminišu, neuron ih ne "percipira". U tom slučaju ne morate trošiti energiju na obradu nepotrebnih informacija. Ovo je još jedan aspekt optimizacije sinaptičkog prijenosa između neurona.
Šta još?
Energetska efikasnost moždanih ćelija se takođe proučava u odnosu na njihovu morfologiju. Istraživanja pokazuju da grananje dendrita i aksona nije haotično i štedi energiju. Na primjer, akson se grana na takav način da je ukupna dužina putanje kroz koju prolazi AP najmanja. U ovom slučaju, potrošnja energije za provođenje AP duž aksona je minimalna.
Smanjenje potrošnje energije neurona također se postiže određenim omjerom inhibitornih i ekscitatornih sinapsi. Ovo je direktno povezano, na primjer, sa ishemija(patološko stanje uzrokovano poremećenim protokom krvi u žilama) mozga. U ovoj patologiji, najvjerovatnije, metabolički najaktivniji neuroni prvi otkazuju. U korteksu su predstavljeni inhibitornim interneuronima koji formiraju inhibitorne sinapse na mnogim drugim piramidalnim neuronima. Kao rezultat smrti interneurona, piramidalna inhibicija se smanjuje. Kao rezultat toga, ukupni nivo aktivnosti potonjeg se povećava (aktivirajuće sinapse se češće aktiviraju, AP se češće stvaraju). Odmah zatim dolazi do povećanja njihove potrošnje energije, što u uslovima ishemije može dovesti do smrti neurona.
Prilikom proučavanja patologija pažnja se poklanja i sinaptičkom prijenosu kao procesu koji najviše troši energiju. Na primjer, kod Parkinsonove, Huntingtonove, Alchajmerove bolesti dolazi do kvara ili transporta do sinapsi mitohondrija, koje igraju glavnu ulogu u sintezi ATP-a. U slučaju Parkinsonove bolesti, to može biti posljedica poremećaja i smrti neurona crne supstancije koja je važna za regulaciju motoričkih funkcija i tonusa mišića. Kod Huntingtonove bolesti, mutantni protein huntingtin remeti mehanizme isporuke novih mitohondrija u sinapse, što dovodi do "energetskog gladovanja" potonjih, povećane ranjivosti neurona i prekomjerne aktivacije. Sve to može uzrokovati daljnji poremećaj rada neurona, praćeno atrofijom striatuma i moždane kore. Kod Alchajmerove bolesti dolazi do poremećaja mitohondrija (paralelno sa smanjenjem broja sinapsi) zbog taloženja amiloidnih plakova. Djelovanje potonjeg na mitohondrije dovodi do oksidativnog stresa, kao i do apoptoze - stanične smrti neurona.
Još jednom o svemu
Krajem 20. stoljeća rođen je pristup proučavanju mozga u kojem se istovremeno razmatraju dvije važne karakteristike: koliko neuron (ili neuronska mreža, ili sinapsa) kodira i prenosi korisne informacije i koliko energije troši,. Njihov odnos je svojevrsni kriterijum za energetsku efikasnost neurona, neuronskih mreža i sinapsi.
Upotreba ovog kriterijuma u kompjuterskoj neuronauci dala je značajno povećanje znanja o ulozi pojedinih pojava, procesa, . Konkretno, mala vjerojatnost oslobađanja neurotransmitera u sinapsi, određena ravnoteža između inhibicije i ekscitacije neurona, oslobađanje samo određene vrste dolaznih informacija zbog određene kombinacije receptora - sve to doprinosi uštedi vrijednih energetskih resursa.
Štoviše, samo određivanje potrošnje energije signalnih procesa (na primjer, generiranje, provođenje AP, sinaptički prijenos) omogućava da se otkrije koji će od njih prije svega patiti u slučaju patološkog kršenja isporuke nutrijenata, . Budući da sinapse zahtijevaju najviše energije za rad, one prve otkazuju kod patologija kao što su ishemija, Alchajmerova i Huntingtonova bolest. Slično tome, određivanje potrošnje energije različitih tipova neurona pomaže da se otkrije koji će od njih umrijeti ranije od drugih u slučaju patologije. Na primjer, s istom ishemijom, interneuroni korteksa će prije svega otkazati. Isti ti neuroni, zbog intenzivnog metabolizma, najranjivije su ćelije tokom starenja, Alchajmerove bolesti i šizofrenije.
Hvala
Iskreno sam zahvalan mojim roditeljima Olgi Natalevič i Aleksandru Žukovu, sestrama Ljubi i Aleni, mom supervizoru Alekseju Bražeu i divnim prijateljicama u laboratoriji Evelini Nikelsparg i Olgi Slatinskoj na podršci i inspiraciji, vrednim komentarima dok sam čitao članak. Takođe sam veoma zahvalan Ani Petrenko, urednici članka, i Antonu Čugunovu, glavnom uredniku Biomolecule, na napomenama, sugestijama i komentarima.
Književnost
- Proždrljiv mozak;
- SEYMOUR S. KETY. (1957). OPŠTI METABOLIZAM MOZGA IN VIVO. Metabolizam nervnog sistema. 221-237;
- L. Sokoloff, M. Reivich, C. Kennedy, M. H. Des Rosiers, C. S. Patlak, et. al (1977). DEOKSIGLUKOZNA METODA ZA MJERENJE LOKALNE ISKORIŠĆENJA GLUKOZE U MOZKU: TEORIJA, PROCEDURA I NORMALNE VRIJEDNOSTI KOD SVJESNOG I ANESTEZIRANOG ALBINO ŠTACORA . J Neurochem. 28 , 897-916;
- Magistretti P.J. (2008). Energetski metabolizam mozga. U Fundamentalnoj neuroznanosti // Ed. Squire L.R., Berg D., Bloom F.E., du Lac S., Ghosh A., Spitzer N. San Diego: Academic Press, 2008. P. 271–297;
- Pierre J. Magistretti, Igor Allaman. (2015). Ćelijska perspektiva na metabolizam energije mozga i funkcionalno snimanje. Neuron. 86 , 883-901;
- William B Levy, Robert A. Baxter. (1996). Energetski efikasni neuronski kodovi. Neural Computation. 8 , 531-543;
- Sharp P.E. i Green C. (1994). Prostorni korelati obrazaca paljenja pojedinačnih ćelija u subikulumu štakora koji se slobodno kreće. J. Neurosci. 14 , 2339–2356;
- H. Hu, J. Gan, P. Jonas. (2014). Fast-spiking, parvalbumin+ GABAergični interneuroni: od ćelijskog dizajna do funkcije mikrokola. Nauka. 345 , 1255263-1255263;
- Oliver Kann, Ismini E Papageorgiou, Andreas Draguhn. (2014). Visokoenergetski inhibicijski interneuroni su centralni element za obradu informacija u kortikalnim mrežama. J-Cereb Blood Flow Metab. 34 , 1270-1282;
- David Attwell, Simon B. Laughlin. (2001). Energetski budžet za signalizaciju u sivoj materiji mozga. J-Cereb Blood Flow Metab. 21 , 1133-1145;
- Henry Markram, Maria Toledo-Rodriguez, Yun Wang, Anirudh Gupta, Gilad Silberberg, Caizhi Wu. (2004).