Razmotrite formulu takve supstance kao što je etilni alkohol, ko i kada ga je izneo. Američki umjetnik Mark Keller primijetio je da alkohol ima mnogo lica. Uostalom, to je i prehrambeni proizvod, i tečno gorivo, i lijek. Oni koji vole nauku o elementima već su pogodili da je riječ o najdrevnijoj tvari - etanolu. Vjeruje se da se etanol pojavio prije oko četiri hiljade godina u drevnim državama s visokim nivoom civilizacije - Drevni Egipat i Babilon. Ima mnogo rođaka i veoma je popularan u svetu.
Putovanje u prošlost etanola
Nudimo da uronite u svijet hemije i naučite više o jednom od najpoznatijih elemenata. Šta ako ne znaš mnogo o njemu?
Prvi alkohol koji je čovjek otkrio i počeo koristiti bio je etanol. Nažalost, istorija nije sačuvala ime ovog čovjeka za potomstvo. Legende kažu da je supstanca po prvi put dobijena iz soka grožđa, a otkriće se dogodilo u 11. veku. Kasnije su pronalazači alkohola bili iznenađeni njegovim čudesnim svojstvima. Takvi kvaliteti novog otkrića naveli su ih na razmišljanje o tome da supstancu nazovu "plemenitim".

Od davnina, etanol se nalazi u pićima i lijekovima. Također se koristio u nekim vjerskim obredima. U zemlji piramida prerađivali su se biljni proizvodi, ekstrahujući ovu supstancu. Ali ovo je bilo samo njegovo rješenje. Da bi povećali njegovu zasićenost, stari Kinezi su počeli destilirati supstancu. Ovaj proces je otkriven prije više od devet hiljada godina. Prije desetak hiljada godina, grožđe je poslužilo kao otkriće etanola u zemljama Istoka. Potvrda tome su natpisi na ciglenim pločama Mesopotamije.
U srednjem vijeku alkohol je bio glavna osnova u pripremi raznih lijekova. Na latinskom, srednjovjekovni hemičari su je zvali "živa voda".
Tek krajem 18. veka ruski hemičar Lovitz uspeo je da izvede hemijski eksperiment, dobivši čisti etanol. Početkom 19. veka jedan švajcarski naučnik je dobio hemijsku formulu etil alkohola, a pedeset godina kasnije profesor iz Švajcarske je predložio njegovu hemijsku strukturu, što je, naravno, bio veliki napredak u nauci.
Formula supstance ili malo nauke
Hemijski naziv ove supstance je etil alkohol, a latinski naziv je etanol.
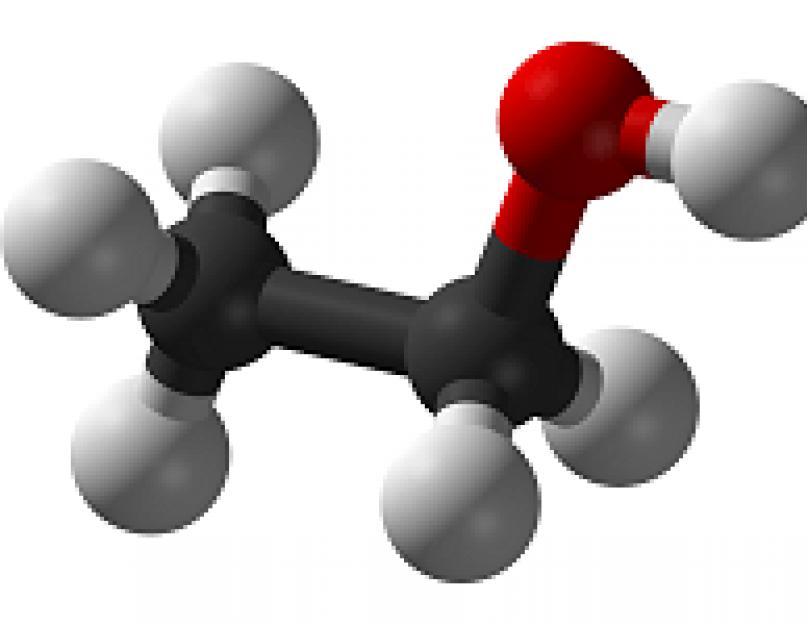
Opšta hemijska formula supstance je C 2 H 5 OH.
Šta hemijska formula govori neupućenima u ovu nauku?
Njegov hemijski sastav je tri molekula:
C je ugljenik i dva njegova atoma.
H je vodik i pet atoma.
OH je hidroksilna grupa.
Kasnije je predložena strukturna formula etilne supstance: CH 3 CH 2 OH. Ova hemijska formula ukazuje da je etanol zasićena supstanca.
Što se tiče fizičkih kvaliteta, etil alkohol je bezbojna tečnost, lako isparava, ima karakterističan miris, pekoćeg ukusa.
Njegova hemijska svojstva su sljedeća:
- lako se zapali, istovremeno oslobađajući toplinu; s velikom količinom zraka, plamen postaje plavkast;
- ulazi u reakciju odvajanja molekula vode sa sumpornom kiselinom;
- reaguje sa klasom karboksilnih kiselina i formira estre;
- stupa u interakciju sa alkalnim metalima.
Kako se proizvodi etanol?

Navodimo glavne načine:
- fermentacija organskih proizvoda, kao što je grožđe. Pod dejstvom bakterija dobija se oko 15% etanola;
- proizvodnja u savremenoj industriji omogućava ekstrakciju više od 95% etanola. Za takvu sintezu koriste se biljke čiji je sastav škrob, pšenica, krompir, kukuruz;
- tvar se također dobiva iz drveta, celuloze, pomoću kemijske reakcije njihove interakcije s vodom.
Gdje se koristi etanol?
Vjerovatno je teško imenovati bilo koju industriju, gdje god se spominje hemijski sastav C 2 H 5 OH, jer ova supstanca ima ogroman spektar primjena. U medicini je jednostavno nezamjenjiv, igrajući ulogu i konzervansa i otapala. Za uništavanje infekcija, ova supstanca je jedinstveno sredstvo tokom hirurških operacija. Neke tinkture, na primjer, valerijana, dugo se čuvaju upravo zahvaljujući C 2 H 5 OH.
Raketni motori ne mogu efikasno raditi bez etil alkohola. Uostalom, C 2 H 5 OH im služi kao gorivo.
U industriji je hemijski sastav za rastvarače, lakove, u nekim proizvodima za čišćenje u domaćinstvu za vodovod, C 2 H 5 OH je takođe prisutan u sastavu.
Kao što znate, jedan od problema modernog čovječanstva su izduvni plinovi automobila. Tako su u Brazilu hemičari riješili ovaj problem na ovaj način: etanol se dodaje u automobilsko gorivo. U ovoj zemlji skoro polovina svih automobila radi na čistom etanolu, koji se dobija pomoću mikroorganizama iz šećerne trske.
Ne radite kozmetiku bez etil alkohola. U kozmetici poput kolonjske vode, parfema, dezodoransa, u hemijskom sastavu na etiketama postoji etil alkohol.
Etanol je takođe druga vrsta alkohola. Ali u nekim pićima, za čiju proizvodnju se koristi fermentacija, c. Riječ je o kvasu, kefiru, bezalkoholnom pivu. Sadržaj alkohola u njima je manji od 0,2%. Budući da su dugo na toplom mjestu, sastav alkohola u njima se povećava čak i do 2%.
Naravno, sada svi znaju da gotovo svi konditorski proizvodi sadrže konzervanse. Ovu ulogu igra C 2 H 5 OH.
Etanol za ljude: šteta ili korist?
Alkohol, dospijevši u ljudsko tijelo kroz probavne organe, brzo se apsorbira. Nakon pet minuta širi se, djelujući negativno na sve ljudske organe.
- Tačan udarac u živce:
U velikim količinama može potisnuti djelovanje nervnog sistema.
Hronična upotreba etanola uzrokuje nedostatak takozvanog hormona sreće – serotonina.
Djelovanje etil elementa smanjuje oštrinu vida i sluha, mijenja koordinaciju ljudskih pokreta i depresira emocionalno stanje.
- Uništavanje pluća:
Izražen toksični efekat. Zaštitne funkcije organizma su smanjene, pa su zahvaćena pluća i nastaje plućna infekcija.
Postoji patologija bronha, koja se može razviti u upalu pluća. Istovremeno se bilježi većina smrtnih slučajeva nakon ovih komplikacija.
- Jednostavan način da se riješite stomaka:
Već neko vrijeme nakon ulaska u organizam izaziva upalu želučane sluznice, slično se dešava i sa dvanaestopalačnom crijevom. Stepen oštećenja jetre zavisi od količine konzumiranog alkohola. Njegove posljedice su patološka masna degeneracija jetre, razvoj alkoholne ciroze jetre. Međunarodne studije su potvrdile da alkohol izaziva nastanak malignih tumora.
- Direktan pogodak u srce:
Osobe sa kardiovaskularnim oboljenjima posebno su osjetljive na utjecaj etanola. Takvi ljudi, nakon što su popili čak i malu količinu alkohola, mogu umrijeti. Nakon duže upotrebe javljaju se patološke promjene na srcu. Zidovi krvnih sudova zadebljaju, ishrana srčanog mišića je poremećena. Mnogi alkoholičari umiru od masivnih srčanih udara zbog odumiranja srčanog mišića.
Da čujemo mišljenje stručnjaka.
Širom svijeta odavno postoji hemijska metoda za proizvodnju etanola. Ova vrijedna supstanca se koristi u mnogim područjima života. Objavljene su hiljade naučnih radova koji se bave dobrobitima i štetnostima C 2 H 5 OH. S jedne strane, male doze etanola koriste ljudskom tijelu: poboljšavaju cirkulaciju krvi, proširuju krvne žile. Ali samo mala količina. S druge strane, još jednom možemo podsjetiti da se mentalno retardirana djeca rađaju od roditelja koji piju, da je isti alkohol za čovjeka spora smrt.
Neko je primetio da se nakon što je hemičar D. Mendeljejev razblažio C 2 H 5 OH sa vodom u određenim razmerama, mnogo toga se promenilo. Profesor engleskog jezika G. Edwards primijetio je da je alkohol svuda isti.
Nije važno koju vrstu alkohola volite: skup ili jeftin. Negativan ishod zavisi od toga koliko ste konzumirali i koliko često pijete.
Američki naučnici su proučavali da automobili na etanol ispuštaju ozon u zrak. Glavni je sastojak smoga. Što je više smoga u zraku, to je veći njegov negativan utjecaj na zdravlje ljudi.
Ekspert A. Fleming duhovito naziva etil alkohol "divnim otrovom". Bez sumnje, mišljenja o etanolu su različita. Korist ili šteta bilo koje supstance zavisi od toga za šta se i u koju svrhu koristi. No, stručnjaci zaključuju: što se manje konzumira alkohol, to bolje za državu i samog čovjeka.
Etilni alkohol je jedna od najstarijih supstanci koja se pojavila prije oko 4 hiljade godina u Babilonu i Starom Egiptu. Umjetnik Mark Keller govorio je o brojnim licima etanola koji se koristi u hrani, medicini i kao tečno gorivo. I zaista jeste. Stoga je vrijedno detaljnije razmotriti kemijsku strukturu ove tvari i razmotriti njen učinak na ljudsko tijelo.
Istorijske činjenice
Etanol je bio prva vrsta alkohola koju su ljudi otkrili i počeli koristiti u svakodnevnom životu. Prema legendi, etil alkohol se prvi put dobija iz soka grožđa u 11. veku. Kasnije su se počela otkrivati zadivljujuća svojstva ove supstance, što je navelo pronalazače da je nazovu "plemenitim supstancom". Zaista, etanol se dugo koristio u lijekovima i svim vrstama pića, koristio se u vjerskim obredima.
U starom Egiptu alkohol se dobijao preradom različite biljne hrane, ali se na ovaj način mogla izolovati samo otopina etanola. Da bi se povećala koncentracija u Kini, izumljeno je da se otopina etilnog alkohola podvrgne destilaciji, koja je izumljena prije oko 9 hiljada godina.
Dugo vremena etil alkohol je bio dio svih vrsta lijekova, tako da je latinski naziv za etanol bio riječ koja u prijevodu znači "živa voda". I tek u 18. veku ruski hemičar Lovitz uspeo je da izoluje čisti etil alkohol iz rastvora.Već u 19. veku jedan švajcarski naučnik je uspeo da dobije hemijsku formulu supstance, a drugi, 50 godina kasnije, zaključio je hemijska struktura etanola.
Hemijski sastav
Etilni alkohol je hemijski naziv nastale supstance, a etanol je njena latinska oznaka. U formuli etil alkohola postoje tri molekule - 2 atoma ugljika, 5 atoma vodika i OH hidroksilna grupa. Hemijska formula etil alkohola je sljedeća - C2H5OH, a njegova strukturna formula je CH3CH2OH, što ukazuje na zasićenost etanola. Fizičke osobine etil alkohola uključuju bezbojnost, tečnu strukturu, laku isparljivost, karakterističan miris i ukus pečenja.
Glavne hemijske kvalitete tvari uključuju sljedeće:
- zapaljivost s oslobađanjem topline;
- obojenost plamena kada se zapali na otvorenom u plavo;
- reaguje sa sumpornom kiselinom, odvajajući molekule vode;
- zajedno sa klasom karboksilnih kiselina formira estre;
- reaguje sa alkalnim metalima.
Glavne metode za proizvodnju etilnog alkohola u hemiji uključuju:
- proces fermentacije organskih proizvoda, kao rezultat kojeg je moguće dobiti do 15% čistog etanola;
- industrijska proizvodnja od biljnih sirovina danas proizvodi oko 95% etilnog alkohola;
- hemijska reakcija između celuloze (drva) i vode.
Područje upotrebe supstance
Molekularna formula etilnog alkohola se široko koristi u medicini, kompleksu goriva i energije, industriji, kozmetologiji i prehrambenoj industriji. Etilni alkohol je odličan uništavač mnogih bakterija i infekcija, u stanju je da deluje kao konzervans i rastvarač. Gorivo za raketne motore proizvodi se na bazi formule etil alkohola. U industriji se etanol koristi posvuda, uvodi se u sastav većine otapala, lakova, boja, kućnih hemikalija. U Brazilu je, kako bi se riješio problem izduvnih gasova, automobilskom gorivu dodat etanol, dobijen iz šećerne trske. Hemijska formula etil alkohola prisutna je u mnogim vrstama kozmetike, kao što su parfemi, kolonjske vode, losioni i tonici. Pa, u prehrambenoj industriji glavno mjesto za etanol imaju alkoholni proizvodi, međutim, koristi se i kao konzervans za proizvodnju većine konditorskih proizvoda.
Lijek "Alcobarrier"
Uticaj na ljudski organizam
Etilni alkohol, ulazeći u ljudsko tijelo, počinje se aktivno apsorbirati i distribuirati kroz sve sisteme, negativno utječući na zdravlje. Toksično svojstvo alkohola može se manifestirati u obliku mučnine, vrtoglavice, gubitka pamćenja, lupanje srca, povraćanja, mamurluka.
Čestom upotrebom alkohola poremećeni su metabolički procesi u organizmu, pate funkcija jetre i bubrega, kardiovaskularni sistem. Međutim, najteže pati centralni nervni sistem, jer ga redovno konzumiranje alkoholnih pića potiskuje i dovodi do depresivnih funkcija sluha, vida, pogoršanja raspoloženja, dugotrajne depresije i poremećene koordinacije pokreta. Uz produženi etanol može u potpunosti zaustaviti proizvodnju serotonina, koji je odgovoran za emocionalno stanje osobe.
Hemijska formula etanola može imati izražen toksični učinak na ljudska pluća. Prilikom konzumiranja alkohola, zaštitne funkcije tijela nestaju, što rezultira oštećenjem pluća i plućnom infekcijom. Ova infekcija može dovesti do upale pluća, koja je često fatalna.
Prvi na udaru etilnog alkohola i njegovog toksičnog djelovanja uvijek je gastrointestinalni trakt, gdje je zahvaćena sluznica želuca i dvanaestopalačnog crijeva. Jetra pati od česte i teške upotrebe alkohola, razvija se ciroza koja može biti i smrtonosna. Osim toga, prema brojnim medicinskim istraživanjima, zloupotreba alkoholnih pića dovodi do pojave raka.
Uz postojeće probleme sa kardiovaskularnim sistemom, pića koja sadrže alkohol su kategorički kontraindicirana za osobu. To je ispunjeno trenutnim pogoršanjem zdravlja, pojavom srčanih i moždanih udara, pa čak i smrću. Ali čak i kada osoba nema problema s krvnim žilama, opterećenje od etanola na njih još uvijek nije malo. Dugotrajna konzumacija alkohola dovodi do nepovratnih promjena - vaskularni zidovi se debljaju, ishrana srčanog mišića je poremećena.
Za brzo i pouzdano rješavanje alkoholizma, naši čitatelji savjetuju lijek "Alcobarrier". To je prirodni lijek koji blokira žudnju za alkoholom, izazivajući trajnu averziju prema alkoholu. Uz to, Alcobarrier pokreće regenerativne procese u organima koje je alkohol počeo da uništava. Alat nema kontraindikacije, efikasnost i sigurnost lijeka dokazana je kliničkim studijama na Istraživačkom institutu za narkologiju.
U svjetskoj proizvodnji, etanol se proizvodi hemijskim putem. Koristi se u svim sektorima nacionalne ekonomije, ali sporovi o tome koliko je etilni alkohol koristan ili štetan i dalje ne jenjavaju. Za ljudsko zdravlje u malim dozama ova tvar može biti korisna - širi krvne žile, poboljšava cirkulaciju, pomaže kod raznih bolesti u obliku ljekovitih tinktura, međutim, ako se etanol redovito koristi, stvara ovisnost i počinje trovati organizam.
Zloupotreba alkohola je štetna u svakom slučaju, bez obzira da li osoba pije jeftinu votku ili skupi konjak. Brzo širenje kroz krvožilni sistem pomaže etilnom alkoholu da prodre u sve kutove organa, narušavajući njihovu funkciju. Zato je vrlo važna sposobnost pravilnog izračunavanja doze alkoholnih pića koja ne dovodi do negativnih posljedica. Pošto alkohol izaziva ovisnost, ne može to svako učiniti. Bolje je uopće ne koristiti etanol u obliku alkohola, već ga koristiti u onim područjima gdje se mnoge stvari ne bi mogle postići bez izuma ove supstance.
Nijedan praznik nije potpun bez alkoholnih pića. I, naravno, svi znaju da je ispijanje etilnog alkohola dio svakog alkoholnog pića. On je taj koji čovjeku donosi osjećaj ugodne euforije i opuštenosti te najteže simptome intoksikacije u slučaju pretjerane upotrebe. Ali malo alkohola sa sobom nosi smrt.
To je zbog proizvodnje surogat alkohola, gdje se ne koristi etil alkohol, već metil alkohol, toksičan i izuzetno otrovan proizvod. Obje vrste spojeva praktički se ne razlikuju po izgledu, samo je njihov kemijski sastav različit. Hajde da shvatimo koja je formula pijenja alkohola u hemiji i koja je razlika između njega i metil alkohola.
Kako bi se izbjeglo trovanje sa smrtnim ishodom, treba razlikovati etilni alkohol od metil alkohola.
Porijeklo poznanstva s alkoholom ima korijene u legendarnoj biblijskoj prošlosti. Noa je, nakon što je probao fermentirani sok od grožđa, po prvi put upoznao osjećaj mamurluka. Od tog trenutka počinje trijumfalna povorka alkoholnih proizvoda, razvoj vinske kulture i brojni eksperimenti s alkoholom.
Spiritus vini - ovo je naziv za pijenje alkohola, koji je počeo nastajati destilacijom. Odnosno, destilacija i isparavanje tečnosti, nakon čega sledi taloženje pare u tečni oblik.
Formula za etanol ustanovljena je 1833
Polazište vinarstva i proizvodnje alkoholnih pića je XIV vijek. Od tada su razne zemlje počele da dobijaju "čarobnu" tečnost stvaranjem i razvojem brojnih tehnika. Naredne godine mogu se pripisati važnim fazama širenja etanola, kako se naučno naziva konzumiranje alkohola, i njegovog razvoja:
- XIV vijek (30-te godine). Po prvi put, francuski alhemičar Arno de Villeger otkrio je vinski alkohol, naučnik ga je uspio izolirati od vina.
- XIV vijek (80-te). Jedan talijanski trgovac upoznao je stare Slovene sa spojem etilnog alkohola, donijevši ovu tvar u Moskvu.
- XVI vijek (20-te godine). Legendarni švicarski doktor, alhemičar Paracelsus uhvatio se u koštac sa proučavanjem svojstava etanola i otkrio njegovu glavnu sposobnost - uspavljivanja.
- XVIII vijek. Po prvi put su hipnotička svojstva etil alkohola testirana na ljudima. Uz nju je prvo uspavan pacijent koji se pripremao za složenu operaciju.
Od tog trenutka počinje nagli rast industrije alkohola. Samo na teritoriji naše zemlje, do početka revolucije, aktivno je radilo više od 3.000 destilerija. Istina, tokom Drugog svetskog rata njihov broj je naglo opao, za skoro 90%. Preporod je počeo tek krajem 40-ih godina prošlog veka. Počeli su pamtiti stare tehnologije i razvijati nove.
Sorte alkohola
Alkohol ima mnogo različitih modifikacija. Neke vrste alkohola su u bliskom kontaktu sa prehrambenim tehnologijama, druge su otrovne. Da bi se upoznalo njihovo djelovanje i utjecaj na ljudski organizam, treba razumjeti njihove glavne karakteristike.
hrana (ili piće)
Ili etil alkohol. Dobiva se metodom rektifikacije (postupkom odvajanja višekomponentnih smjesa korištenjem izmjene topline između tekućine i pare). Kao sirovine za njegovu pripremu uzimaju se različite vrste žitarica. Hemijska formula pijenja etil alkohola je sljedeća: C2H5OH.
Kako djeluje etilni alkohol
Alkohol u hrani, koji je dio alkohola, u većini slučajeva doživljava se kao votka. Upravo njih mnogi pojedinci zlostavljaju, dovodeći sebe do trajne ovisnosti o alkoholu.
Etanol za hranu također ima svoje varijante (ovise o vrsti sirovina koje su korištene). Klasifikacija konzumiranja alkohola ima sljedeće vrste:
Alkohol stepena I (ili medicinski)
Ne koristi se za proizvodnju alkoholnih pića. Ovo jedinjenje je namenjeno za upotrebu isključivo u medicinske svrhe kao antiseptik, dezinfekcija operativnih i hirurških instrumenata.
Alpha
Alkoholna smjesa najvišeg kvaliteta. Za njegovu proizvodnju uzima se odabrana visokokvalitetna pšenica ili raž. Na bazi Alpha alkohola proizvode se elitna alkoholna pića super premium klase. Na primjer:
- rum Bacardi;
- Absolut vodka;
- viski Jack Daniels;
- Viski Johnnie Walker.
Suite
Za proizvodnju etanola za piće ovog nivoa koriste se krompir i žitarice, s tim da zapremina krompirovog skroba na izlazu ne bi trebalo da prelazi 35%. Alkoholno jedinjenje prolazi kroz nekoliko faza filtracije. Proizvodi vrhunsku votku. kao što su:
- Husky;
- Rainbow;
- Beluga;
- Mamut;
- Nemiroff;
- kapital;
- rusko zlato;
- Ruski standard.
Ova vodka pića imaju nekoliko stepena zaštite.. Imaju poseban oblik boce, posebno dizajnirane holograme, jedinstveni čep.
Kako provjeriti kvalitetu proizvoda od votke
Extra
Na osnovu toga prave klasičnu i poznatu votku srednjeg cjenovnog segmenta. Ovaj alkohol za piće se razblažuje (njegova nerazređena jačina je oko 95%) i, pored toga, podvrgava se dodatnom prečišćavanju. Konačni proizvod ima manji sadržaj estera i metanola. Alkohol na bazi ovog spoja smatra se ekološki prihvatljivim proizvodom, iako nije skup kao alkohol na bazi Alpha ili Luxa.
Osnova
Praktično ne ustupa vodku etanole Extra i Alpha. Ima istu visoku čvrstoću (oko 95%). Vodka napravljena od ovog alkoholnog pića je najpopularniji proizvod, jer je i najpristupačniji (srednji cjenovni segment tržišta). Alkohol ove marke proizvodi se od krumpira i žitarica, uzimajući u obzir da volumen krumpirovog škroba u rezultirajućem proizvodu ne prelazi 60%.
Etilni alkohol se široko koristi u medicini
Alkohol najviše kategorije čišćenja
Izrađuje se na bazi mješavine sljedećih proizvoda:
- kukuruz;
- krompir;
- melasa;
- šećerna repa.
Ovo jedinjenje u toku tehnološkog procesa se podvrgava minimalnoj preradi i filtriranju od raznih nečistoća i fuzelnih ulja. Koristi se za pravljenje jeftine votke ekonomske klase, raznih tinktura i likera.
Metil alkohol (ili tehnički)
Bezbojna, prozirna tvar, slična mirisu klasičnom etanolu. Ali, za razliku od potonjeg, metanol je vrlo otrovno jedinjenje. Hemijska formula metanola (ili drvenog alkohola) je CH3OH. Kada uđe u ljudski organizam, ovo jedinjenje izaziva akutno trovanje. Nije isključen ni smrtni ishod.
Šta je metil alkohol
Prema statistikama, godišnje se dijagnostikuje oko 1.500 slučajeva trovanja metil alkoholom. Svaka peta intoksikacija završila je smrću osobe.
Metil alkohol nema nikakve veze sa proizvodnjom alkoholnih proizvoda i prehrambenom industrijom. Ali surogat alkohol se često razrjeđuje ovim jeftinim lijekom kako bi se smanjila cijena dobivenih proizvoda. U interakciji s organskim strukturama, metanol se pretvara u strašni otrov koji je već ubio mnoge živote.
Kako razlikovati alkohole
Izuzetno je teško razlikovati otrovni industrijski alkohol od alkohola. Iz tog razloga se javljaju slučajevi trovanja sa smrtnim ishodom. Kada se metanol koristi pod maskom etanola za pripremu alkoholnih pića.
Ali jedinjenja alkohola se i dalje mogu razlikovati. Postoje jednostavni načini za to, koji se mogu primijeniti kod kuće.
- Uz pomoć vatre. Ovo je najlakši način provjere. Samo zapalite alkoholno piće. Etanol gori plavim plamenom, ali je boja gorućeg metanola zelena.
- Koristeći krompir. Parče sirovog krompira prelijte alkoholom i ostavite 2-3 sata. Ako se boja povrća nije promijenila, votka je odličnog kvaliteta i može se sigurno konzumirati za namjeravanu svrhu. Ali u slučaju kada je krompir dobio ružičastu nijansu, to je posljedica prisustva industrijskog alkohola u alkoholu.
- Korištenje bakarne žice. Žicu treba usijati i spustiti u tečnost. Ako se tokom šištanja pojavi oštar odbojan miris, metanol je prisutan u alkoholu. Etil alkohol neće mirisati ni na koji način.
- Mjerenjem tačke ključanja. Tačku ključanja alkohola treba mjeriti konvencionalnim termometrom. Istovremeno, imajte na umu da metanol ključa na +64⁰S, a etanol na +78⁰S.
- Primjena sode i joda. Alkohol koji se testira sipajte u prozirnu posudu. Dodajte mu prstohvat obične sode bikarbone. Dobro promešajte i dodajte jod. Sada pogledajte tečnost u svetlu. Ako u njemu ima taloga, to je dokaz "čistoće" alkohola. Etanol, u interakciji s jodoformom (jod + soda), daje žućkastu suspenziju. Ali metanol se uopće ne mijenja i ostaje transparentan.
- Uz pomoć kalijum permanganata. Dodajte nekoliko kristala kalijum permanganata u alkohol koji se testira. Čim se otopi i tečnost postane ružičasta, zagrijte je. Ako se pri zagrijavanju oslobađaju mjehurići plina, to je otrovni metil alkohol.
Ali treba imati na umu da sve ove i slične kućne metode neće raditi ako se industrijski alkohol u početku pomiješa s etanolom u jednom proizvodu. U ovom slučaju može pomoći samo hemijski pregled. I odgovoran pristup kupovini alkohola.
Ako se pomoć ne pruži, smrt od trovanja metanolom nastupa nakon 2-3 sata
Kako ne biste kupovali potencijalno opasan alkohol, kupujte alkohol samo na provjerenim mjestima, specijalizovanim prodavnicama koje ulijevaju povjerenje. Izbjegavajte podzemne trgovine i male štandove. Tamo se vrlo često distribuiraju lažnjaci.
Načini upotrebe etanola
Etilni alkohol se koristi ne samo u alkoholnoj industriji koju mnogi vole. Njegova upotreba je raznolika i prilično radoznala. Pogledajte samo neke od glavnih upotreba etanola:
- gorivo (raketni motori s unutrašnjim sagorijevanjem);
- hemijska (osnova za proizvodnju mnogih različitih lijekova);
- parfimerija (prilikom stvaranja raznih parfemskih kompozicija i koncentrata);
- boja i lak (kao otapalo, dio je antifriza, kućnih deterdženata, perača vjetrobrana);
- hrana (osim za proizvodnju alkohola, uspješno se koristi u proizvodnji sirćeta, raznih aroma);
- medicina (najpopularnija oblast primene, kao antiseptik za dezinfekciju rana, sa veštačkom ventilacijom pluća kao sredstvo protiv pene, deo je anestezije i anestezije, raznih lekovitih tinktura, antibiotika i ekstrakata).
Inače, etil alkohol se koristi i kao protuotrov za trovanje metanolom. Efikasan je protivotrov u slučaju trovanja industrijskom alkoholom. Bilo bi korisno podsjetiti se na glavne znakove trovanja alkoholnim surogatima:
- jaka glavobolja;
- obilno iscrpljujuće povraćanje;
- prodoran bol u abdomenu;
- osjećaj potpune slabosti, imobilizacije;
- respiratorna depresija, osoba ponekad ne može udahnuti.
Usput, potpuno isti simptomi mogu se naići iu slučaju obične intoksikacije alkoholom. Stoga se treba fokusirati na količinu alkohola koju uzimate. Tehnički alkohol daje razvoj ove simptomatologije, ulazeći u ljudsko tijelo čak iu malim količinama (od 30 ml, ovo je standardni volumen obične čaše).
U tom slučaju treba odmah pozvati hitnu pomoć. Imajte na umu da ako se ne pruži kvalificirana pomoć, rizik od smrti je vrlo visok.
Sumirajući, može se shvatiti da je vrlo važno biti u stanju razumjeti vrste alkohola i razlikovati toksično jedinjenje od etanola za piće. Ne zaboravite da čak i uz konzumaciju skromne količine toksičnog metanola, izlažete svoj život riziku i dovodite svoje tijelo do smrtne linije.
(etil alkohol, vinski alkohol) - organsko jedinjenje, predstavnik niza monohidroksilnih alkohola sastava C 2 H 5 OH (skraćeno EtOH). U normalnim uslovima, to je bezbojna, zapaljiva tečnost. Prema nacionalnom standardu Ukrajine DSTU 4221: 2003 Etanol je toksična supstanca sa narkotičkim dejstvom, po stepenu uticaja na ljudski organizam spada u četvrtu klasu opasnih materija. Ima kancerogena svojstva.
Etanol je glavni aktivni sastojak u alkoholnim pićima, koja se obično proizvode fermentacijom ugljikohidrata. Za industrijske potrebe, etilni alkohol se često sintetizira iz sirovine nafte i plina katalitičkom hidratacijom etilena. Osim u proizvodnji prehrambenih proizvoda, etanol se u velikim količinama koristi kao gorivo, rastvarač, antiseptik, te kao sirovina za proizvodnju drugih industrijski važnih supstanci.
Priča
Etanol je čovječanstvo koristilo od davnina. Igrao je ulogu sastavnog dijela pića, lijekova, kao sedativ i afrodizijak, a učestvovao je i u vjerskim obredima.
U starom Egiptu dobivao se fermentacijom biljnog materijala. Na ovaj način se dobija samo razblažen rastvor alkohola. Kako bi se povećala koncentracija u Kini, izumljena je metoda destilacije. Prema slikama na kineskoj keramici, pića napravljena od fermentisane mešavine pirinča, voća i meda napravljena su pre 9.000 godina. Otprilike u isto vrijeme, na Bliskom istoku, alkohol se dobijao iz grožđa i ječma, o čemu svjedoče zapisi na glinenim pločama u Mezopotamiji.
U srednjem vijeku etilni alkohol je igrao ulogu osnove za pripremu brojnih lijekova i tinktura. Alhemičari su oduvijek koristili etanol u svom radu, dajući mu naziv lat. aquavitae, to je živa voda.
Čisti etanol je prvi put nabavio 1796. godine rusko-njemački hemičar Tovy Yegorovich Lovits. Prema opisu vodećeg naučnika tog vremena Antoinea Laurenta Lavoisiera, jedinjenje koje se proučavalo sastojalo se od hemijskih elemenata ugljenika, vodonika i kiseonika. Godine 1808. švicarski biohemičar Nicolas Theodore de Saussure uspostavio je hemijsku formulu za etanol, a pedeset godina kasnije, škotski hemičar Archibald Scott Cooper predložio je njenu strukturu.
Prvu sintetičku metodu za proizvodnju etilena samostalno su razvili engleski hemičar Henry Gennel i francuski farmaceut Georges-Simon Seryulla 1826. godine. A 1828. godine, engleski fizičar i hemičar Michael Faraday dobio je etanol katalitičkom hidratacijom etena, nusproizvoda prerade nafte i plina. Ova metoda je bila osnova mnogih metoda koje se do danas koriste u proizvodnji etanola.
struktura
Oba atoma ugljika u molekuli etanola, uključujući atom koji je povezan sa hidroksilnom grupom, su u stanju sp 3 hibridizacije. C-C udaljenost je 1,512 angstroma.
U zavisnosti od položaja hidroksilne grupe u odnosu na drugi deo molekula, postoje bože- (fr. gauche) i trans forme.trans form karakteriziran položajem O-H veze hidroksilne grupe u istoj ravni sa C-C vezom i jednom od C-H veza. AT bože-formiraju atom vodonika u hidroksilnoj grupi okrenut u stranu. dipolni moment za bože forme je 1,68 D, i za trans forme- 1.44D.
Rasprostranjenost u prirodi
Etanol je otpadni proizvod nekih gljivica. Među njima su glavne vrste Saccharomyces, Schizosaccharomyces, kao i Kluyveromyces. Jedan od najpoznatijih predstavnika ovih klasa je vrsta Saccharomyces cerevisiae, koji ima trivijalni naziv pivski kvasac. Druge uobičajene vrste uključuju Saccharomyces pastorianus, Saccharomyces anamensis, Schizosaccharomyces pombe, Candida utilis sviđa. Neke bakterije također stvaraju etanol, npr. Zymomonas mobilis.
Godine 1975. astronomi su izvijestili da su pronašli značajne akumulacije etanola u oblaku plina i prašine Sagittarius B2. Prema naučnicima, broj tamo dostupnih molekula etanola znatno premašuje količinu alkohola dobijenog u čitavoj istoriji čovečanstva. Pronađen etanol trans form molekula, a 1996. zabilježen je u bože-forma.
Među mogućim načinima stvaranja etanola u međuzvjezdanom mediju, posebno je navedena njegova sinteza iz metana i metil kationa pod djelovanjem zračenja:
Drugi potencijalni način je reakcija metilnog kationa s formaldehidom, što je također uobičajeno u svemiru:
fizička svojstva
Etanol je bezbojna tečnost sa blagim "alkoholnim" mirisom. Isparljiv je i zapaljiv. Može se mešati u bilo kojoj proporciji sa vodom, etrima, acetonom, benzenom. Etil alkohol je dobar rastvarač za mnoge organske i neorganske supstance.
Formira azeotropnu mešavinu sa vodom: 95,6% alkohola i 4,4% vode. Bezvodni etanol je blago higroskopan: da bi postigao stabilnost, u stanju je apsorbirati 0,3-0,4% vode.
primanje
hidratacija etilena
Postoje dva glavna načina za dobijanje etanola iz etilena. Istorijski gledano, metod indirektne hidratacije izumio je 1930. godine Union Carbide. Drugi, razvijen 1970-ih, dizajniran je kao metoda bez kiseline (bez upotrebe sumporne kiseline).
indirektna hidratacija
Proizvodnja etanola iz etilena upotrebom sumporne kiseline odvija se u tri faze. Prvo, etilen se apsorbira koncentriranom kiselinom, formirajući estere etil sulfata ili dietil sulfata:
Apsorpcija se vrši 95-98% rastvorom kiseline na temperaturi od 80°C i pritisku od 1,3-1,5 MPa. Ova interakcija je egzotermna, tako da se zidovi reaktora moraju hladiti. Prisustvo etil sulfata u kiseloj otopini omogućava značajno povećanje brzine apsorpcije, jer je topljivost etilena u etil sulfatu mnogo veća nego u čistoj kiselini.
U drugoj fazi, nastali produkti reakcije prolaze kroz hidrolizu i razlažu se sa stvaranjem alkohola i kiseline. Međutim, isključena je interakcija dva osnovna estera, što dovodi do stvaranja trećeg, dietila:
Nakon tretmana sumporne kiseline sa apsorbovanim etil i dietil sulfatom u dovoljnoj količini vode, rastvor dobija koncentraciju od oko 50-60%. Produkti hidrolize se šalju u kolone za odvajanje: razrijeđena kiselina ostaje na dnu spremnika, a plinovita mješavina alkohola i Eterna je na vrhu. Željena smjesa se ispere vodom ili razrijeđenim rastvorom natrijum hidroksida, a zatim se prečisti destilacijom.
Posljednji korak je vraćanje koncentracije razrijeđene kiseline. Ovaj korak je jedan od najskupljih u cjelokupnoj sintezi. Sa sistemom isparivača kiseline moguće je povećati koncentraciju kiseline do 90%. Povećanje ovog pokazatelja na potrebnih 98% vrši se miješanjem sa oleumom (koncentracija 103%).
Ozbiljan problem za metodu indirektne hidratacije je stvaranje ugljičnih supstanci u kiselini, koje značajno utiču na njenu koncentraciju. Korištenje koncentrirane kiseline također uzrokuje koroziju na opremi, pa su neki dijelovi opreme izrađeni od silicija, legura tantala, olova itd.
direktna hidratacija
Sinteza prema shemi direktne hidratacije provodi se pomoću katalizatora. Ovdje postoje dva oblika interakcije:
- gasoviti reaktanti dolaze u kontakt sa čvrstim ili tečnim katalizatorom (proces gasne faze)
- i tečni i gasoviti reaktanti su u kontaktu sa čvrstim ili tečnim katalizatorom (mišanofazni proces).
Etanol se uglavnom sintetiše nakon procesa u gasnoj fazi. Izlazni etilen i voda prolaze preko ugljičnog katalizatora zasićenog fosfornom kiselinom:
Na uobičajenim temperaturama samo mala količina etanola može biti u plinovitoj fazi, a povećanje temperature će dovesti do smanjenja njegove koncentracije. Moguće je izjednačiti ravnotežu reakcije primjenom Le Chatelier-Brown principa – povećanjem pritiska u reakcionoj smjesi i smanjenjem broja molekula u sistemu. Optimalni uslovi za interakciju su temperatura od 250-300°C i pritisak od 6,1-7,1 MPa.
Produkt reakcije može biti podvrgnut intermolekularnoj dehidraciji, što dovodi do stvaranja dietil etera:
Ako ugljikohidratna sirovina sadrži primjesu acetilena, ona se hidratizira u etanol:
Prisustvo etanola je nepoželjno, jer se iz njega stvara krotonaldehid, što negativno utječe na kvalitetu etanola, čak iu količini dijelova na milijun:
dobijanje fermentacijom
Ekstrakcija etanola fermentacijom (fermentacijom) šećernih supstanci je najstarija. Za njegovu proizvodnju može se koristiti bilo koji proizvod koji sadrži šećer ili tvari iz kojih se može dobiti (na primjer, škrob). Kao proizvodi koji sadrže šećer koriste se voćni i šećer od šećerne trske, šećerna repa, melasa, a škrobni proizvodi su krompir, žitarice pšenice, raži i kukuruza. Celuloza se takođe koristi kao sirovina (iz poljoprivrednog otpada, industrije celuloze i papira itd.).
Ekstrakti škroba i šećera
Za pretvaranje škroba u slatke tvari, prvo se podvrgava hidrolizi. U tu svrhu, sirovine (pire krompir ili brašno) se kuvaju vrelom vodom kako bi se ubrzalo bubrenje škroba. Sirovini se dodaje i enzim, pod čijim se uticajem skrob kondenzuje, odnosno pretvara u glukozu.
Kao enzim koristi se dijastaza sadržana u proklijalim žitaricama ili drugim amilazama gljivičnog porijekla.
Druga faza, koja je slična dobivanju alkohola iz šećera, je anaerobna fermentacija, odnosno pretvaranje u alkohol i ugljični dioksid:
Ovdje se reakcija odvija pod djelovanjem mikroorganizama: gljivica (kvasca) ili bakterija.
Među kvascima koji se koriste u procesu, aktivno mjesto zauzimaju Saccharomyces cerevisiae(tzv. pivski kvasac). Prilikom njihove upotrebe važni su kiselost okoline i temperatura - utiču na rast kvasca, prinos etanola, stvaranje nusproizvoda i kontaminaciju bakterijama. Obično se takva fermentacija u industrijskoj proizvodnji provodi pri pH 4-6. Pri pH vrijednosti manjoj od 5, rast bakterija u mediju je snažno potisnut; za rast kvasca Saccharomyces cerevisiae kiselost treba održavati u rasponu od 2,4-8,6 sa optimalnom vrijednošću od 4,5, a proces fermentacije ima veći intenzitet u rasponu od 3,5-6.
Većina kvasaca koji se koriste u proizvodnji etanola imaju optimalnu temperaturu rasta od oko 39-40°C, a maksimum se vidi u umu Kluyveromyces marxianus- 49°C. Budući da je proces fermentacije egzoterman (586 J toplote se oslobađa iz 1 g apsorbovane glukoze), upotreba kvasca sa najvišom optimalnom temperaturom rasta štedi novac na hlađenju reakcionog sistema. Važna stvar je opskrba malim količinama kisika za sintezu nezasićenih masnih kiselina i ergosterola kvascem, koji doprinose njihovom rastu i dobroj propusnosti stanica. U nedostatku kisika, nedostatak kiselina i sterola dovest će do promjena u fiziologiji kvasca za samo nekoliko generacija.
Bakterije se također koriste u sintezi etanola, posebno uobičajene vrste Zymomonas mobilis, koji imaju visoku stopu rasta, visok prinos finalnog proizvoda i ne zavise od opskrbe kisikom.
Ekstrakti iz celuloze
I celuloza i škrob su polisaharidi, polimeri ugljikohidrata, ali je sinteza etanola iz celuloze mnogo teža zbog njegove niske sklonosti hidrolizi. Struktura mu je sličnija kristalnoj, što otežava raskidanje veza unutar polimera, a u biljkama je zaštićen od hidrolitičke razgradnje slojem lignina (nakon tretmana celuloze kiselinom, hidrolizira se samo 15% ukupne mase) . Otpad sirovine takođe sadrži hemicelulozu, koja se sastoji uglavnom od pentoza.
Preoperativna obrada uključuje mljevenje, natapanje sirovina za bubrenje. Zatim se zagreva u autoklavu sa 0,3-0,5% kiseline pod pritiskom od 7-10 atm. Kao kiselina se najčešće koristi sumporna kiselina, rjeđe hlorovodonična kiselina. Na kraju procesa, kiselina se koncentriše u poseban rezervoar i vraća u proizvodnju, a lignin se filtrira i pročišćava ispiranjem.
Ovako dobijen etil alkohol tzv hidroliza. Koristi se samo u tehničke svrhe, jer sadrži niz štetnih nečistoća, uključujući metil alkohol, aceton itd.
Također, za razliku od kisele hidrolize, koristi se enzimski metoda. Ovdje dolazi do hidrolize pod djelovanjem gljiva poput Trichoderma viride. Predtretman uključuje uklanjanje ligninske ovojnice djelovanjem otapala kadoxenu (rastvor 5-7% kadmijum oksida i 28% etilendiamina) i tretman tečnim amonijakom pod visokim pritiskom, koji uzburkava vlakna u celulozi, olakšavaju prodiranje enzima. U nekim slučajevima moguće je postići stopostotnu preradu celuloze.
druge metode
Hidroliza halogeniranih ugljovodonika
Etanol nastaje hidrolizom halogeniranog etana. Izvodi se u vodi ili u vodenom rastvoru alkalija. U prvom slučaju reakcija je obrnuta, au drugom može doći do eliminacije (cijepanja) halogenovodonika:
Konverzija singasa
Ekstrakcija etanola iz sintetskog gasa je slična metodi za dobijanje metanola Fischer-Tropsch postupkom:
Reakcija se odvija na temperaturi od 125-175°C i pritisku od 1,42 MPa koristeći katalizator tipa gvožđa u prahu.
Obnavljanje organskih jedinjenja
Redukcija aldehida i kiselina je prilično uobičajena metoda za dobivanje alkohola, uključujući etanol:
Katalitička redukcija se vrši preko Raney nikla, platine; u laboratorijskim uslovima, litijum aluminijum hidrid i natrijum borohidrid stagniraju.
prečišćavanje etanola
Sintetizirani etanol je obično mješavina vode i alkohola. Njegovo pročišćavanje i dehidracija počinje destilacijom (rektifikacijom), koja može dostići koncentraciju od 95,6% vol. Dobivena smjesa je azeotropna i ne može se pročistiti naknadnom destilacijom. Za dodatnu dehidraciju koristite benzen, cikloheksan ili heptan. Njihovo prisustvo stvara nove azeotropne mješavine s niskom tačkom ključanja, što omogućava dobivanje bezvodnog etanola.
U industrijskim razmjerima, za dehidraciju se mogu koristiti molekularna sita, čije su pore propusne za molekule vode, ali ne i za etanol. Takva sita mogu biti umjetni ili prirodni zeoliti (npr. klinoptilolit). 75% adsorbovanih molekula je voda, preostalih 25% je etanol, koji se zatim ponovo vraća u destilacioni sistem.
Koristi se i membranska metoda koja se sastoji u odvajanju mješavine vode i alkohola zagrijane na 60 ° C polupropusnom membranom koja ne propušta etanol. Ova operacija se izvodi pod pritiskom manjim od 1 kPa. Kao rezultat odvajanja nastaje etanol sa koncentracijom od 99,85% i rastvor koji je prošao kroz membranu sa koncentracijom od 23%. Kondenzirana otopina membrane može se ponovo rektirati.
Klasifikacija etanola
Dobiveni alkohol se konvencionalno dijeli u četiri klase prema svom sastavu:
- industrijski etanol (96,5% vol.) - proizvod za industrijsku i tehničku upotrebu: kao otapalo, gorivo itd. Da bi se spriječila njegova upotreba, obično mu se dodaju tvari neugodnog mirisa, na primjer, piridin u količini od 0,5 -1% (izvršiti denaturacija). Takođe može imati slabu metilljubičastu boju radi lakše identifikacije;
- denaturirani alkohol je tehnički proizvod sa koncentracijom etanola od 88% vol., koji ima značajnu količinu nečistoća. Shodno tome denaturira i mrlje. Koristi se u rasvjeti i grijanju;
- visokokvalitetni alkohol (96,0-96,5% vol.) - pročišćeni etanol, koji se koristi za potrebe farmaceutskih proizvoda, u proizvodnji kozmetike za prehranu;
- apsolutni etanol (99,7-99,8% vol.) - vrlo čist etanol, koristi se u farmaceutskim proizvodima, aerosolima.
U Ukrajini, ocjene dobivenog rektificiranog etanola regulirane su standardom DSTU 4221: 2003 "Rektificirani etil alkohol". U zavisnosti od stepena prečišćavanja razlikuju se četiri varijante: "Pšenična suza", "Lux", "Extra" i "Više pročišćenja".
| index | "pšenična suza" | "Lux" | "ekstra" | "viša čistoća" |
|---|---|---|---|---|
| Volumenski udio etil alkohola, na temperaturi od 20 °C,%, ne manji od | 96,3 | 96,3 | 96,3 | 96,0 |
| Masena koncentracija aldehida, izračunata kao acetaldehid u bezvodnom alkoholu, mg/dm³, ne veća od | 2,0 | 2,0 | 2,0 | 2,0 |
| Masena koncentracija fuzelnog ulja: propil, izopropil, butil, izobutil i izoamil alkohol u smislu mješavine propil, izobutil i izoamil alkohola (3:1:1) u bezvodnom alkoholu, mg/dm³, ne više | 2,0 | 2,0 | 2,0 | 2,0 |
| Masena koncentracija fuzelnog ulja u smislu mješavine izobutil i izoamil alkohola (1:1) u bezvodnom alkoholu, mg/dm³, ne više | 2,0 | 2,0 | 2,0 | 2,0 |
| Masena koncentracija etera, izražena u octenom etil etru u bezvodnom alkoholu, mg/dm³, ne više od | 1,5 | 2,0 | 3,0 | 5,0 |
| Volumenski udio metil alkohola u odnosu na bezvodni alkohol,%, ne više | 0,005 | 0,01 | 0,02 | 0,03 |
| Masena koncentracija slobodnih kiselina (bez CO2), izražena u octenoj kiselini u bezvodnom alkoholu, mg/dm³, ne više od | 8,0 | 8,0 | 12,0 | 15,0 |
Hemijska svojstva
Etanol je monohidrični primarni alkohol i hidroksilna grupa daje većinu njegovih hemijskih svojstava. Dakle, etanol može sudjelovati u reakcijama dehidracije - i intramolekularnim i intermolekularnim:
Prilikom interakcije s drugim alkoholima nastaje mješavina tri estera:
Sa karboksilnim kiselinama, etanol u prisustvu koncentrovane sumporne kiseline stvara estre:
Kao rezultat dodavanja etanola acetilenu, sintetizira se viniletil eter:
Pokazujući svoja kisela svojstva, etanol reaguje s alkalnim metalima (na primjer, natrijem) i alkalijama da nastane etoksid:
Ova reakcija se odvija u bezvodnom okruženju jer se hidroksid formira brže od etoksida.
Manje aktivni metali - aluminij i magnezij - također stupaju u interakciju s etanolom, ali samo u prisustvu živinog katalizatora:
Hidroksilna grupa prisutna u molekuli može se zamijeniti halogenim kiselinama sa stvaranjem halogenih derivata etana:
Etanol se oksidira u etanal, a zatim u octenu kiselinu, rezultat potpune oksidacije (na primjer, sagorijevanje etanola) su ugljični dioksid i voda:
Tretiranjem etanola amonijakom na 300 °C u kiseloj sredini nastaju supstituirani amini: primarne, sekundarne, tercijarne ili čak kvaternarne amonijeve soli (ovisno o omjeru reaktanata):
Etanol je sirovina za sintezu butadiena. Reakcija se izvodi na temperaturi od 370-390°C i u prisustvu katalizatora - MgO-SiO 2 ili Al 2 O 3 -SiO 2 (sa selektivnošću od 70%):
biološko djelovanje
metabolizam
Gotovo sav konzumirani alkohol (90-98%) se metabolizira u tijelu, a samo mali dio (2-10%) se izlučuje nepromijenjen: urinom, zrakom, znojem, pljuvačkom. Potrošnja etanola dovodi do prekomjernog mokrenja: svakih 10 g alkohola doprinosi gubitku 100 ml tečnosti iz tijela, ne doprinosi uklanjanju alkohola iz tijela. Glavni dio etanola koji ulazi u tijelo ulazi u jetru, gdje prolazi biološku transformaciju u mikrosomima.
U prvoj fazi metabolizma iz etanola nastaje acetaldehid. Ovo se dešava pod dejstvom alkohol dehidrogenaze (ADH), enzima čiji je kofaktor nikotinamid (NAD). Nakon toga, acetaldehid nastao iz etanola oksidira se u acetat u mitohondrijima pomoću enzima aldehid dehidrogenaze, koji koristi NAD kao koenzim, koji se vezivanjem protona reducira u NAD N. U ovoj fazi interakcija se događa mnogo brže nego u prethodni. Acetat ulazi u Krebsov ciklus, gdje se razlaže na CO 2 i H 2 O. Aldehid dehidrogenaza se nalazi ne samo u jetri, već iu drugim organima, uključujući mozak. Kod odrasle, zdrave osobe, ADH razgrađuje oko 10 g alkohola na sat.
Pored glavnog metaboličkog procesa, etanol se oksidira i na dva druga načina. Jedan od njih se javlja uz učešće mikrosomalne oksidaze u kombinaciji sa redukovanim nikotinamid adenin dinukleotid fosfatom (NADP), dok se drugi javlja uz učešće katalaze u kombinaciji sa vodikovim peroksidom. Oba puta dovode do stvaranja toksičnog aldehida, koji ima kancerogena svojstva i deset puta je toksičniji od etanola.
Uticaj na tijelo
Dolazeći u ljudsko tijelo kroz jednjak, etanol se brzo apsorbira. U želucu se apsorbira 20% početnog etanola, au tankom crijevu - 80%. Nakon apsorpcije, ulazi u krvotok u roku od 5 minuta, šireći se krvotokom po cijelom tijelu.
Centralni nervni sistem. Etanol deprimira funkciju CNS-a kao i drugi anestetici. Unatoč popularnom vjerovanju, etanol ne stimulira djelovanje nervnog sistema: ako dođe do ekscitacije, onda je njihova pojava posljedica suprotstavljanja inhibitornim procesima. U normalnim dozama, etanol djeluje uglavnom na aktivirajuću funkciju retikularne formacije moždanog debla, a samo velike doze direktno potiskuju funkciju moždane kore.
Hronična upotreba etanola uzrokuje nedostatak serotonina. Funkcionalno smanjenje aktivnosti ovog sistema sprečava razvoj tolerancije i, obrnuto, povećanje njegove aktivnosti, povećanje nivoa serotonina ubrzava razvoj tolerancije na alkohol. Pod uticajem etanola dolazi do poremećaja metabolizma dopamina, koji je uključen u sintezu norepinefrina i koordinira pokrete, emocionalna i mentalna stanja. Takođe, etanol negativno utiče na fizičke i mentalne sposobnosti: smanjuje oštrinu vida i sluha, narušava koordinaciju i stabilnost mišića i usporava vreme reakcije na iritaciju.
Respiratornog sistema. Etanol ima izražen toksični efekat na respiratorni sistem. Oštećenje pluća utiče na razvoj bronhopulmonalne infekcije zbog smanjenja zaštitnih funkcija organizma. Negativan utjecaj alkohola povezan je sa inhibicijom fagocitoze i stvaranjem antitijela, pospješujući prodor bakterija u respiratorni trakt i sl. Bronhopulmonalne patologije mogu se razviti u pojavu akutne pneumonije, koja ima značajan postotak smrtnih slučajeva.
Kardiovaskularni sistem. Pod djelovanjem etanola rastvaraju se lipidi staničnih membrana, posebno ćelija miokarda. Kao rezultat, povećava se propusnost membrane i poremećena je izmjena jona natrijuma, kalija, magnezija i kalcija. Ovo slabi kontraktilnost srčanog mišića.
Probavni sustav. Jedna doza dovodi do akutnog hemoragičnog erozivnog gastritisa; sličan efekat etanola na sluznicu duodenuma. Već minut nakon ulaska u želudac pacova, etanol je izazvao difuznu hiperemiju želučane sluznice.
Jetra. Stepen oštećenja jetre etanolom direktno zavisi od količine konzumiranog alkohola. Kao rezultat njegovog djelovanja mogu se pojaviti steatoza, fibroza, alkoholni hepatitis i ciroza, koji često završavaju razvojem hepatocelularnog karcinoma. Dakle, prema Međunarodnoj agenciji za istraživanje raka, etanol ima kancerogeno djelovanje.
Jedan od rezultata dugotrajnog izlaganja etanolu je povećanje volumena crvenih krvnih zrnaca – makrocitoza uzrokovana toksičnim djelovanjem acetaldehida, nedostatkom folne kiseline i hiperlipidemije.
alkoholizam
Etanol je osnova alkoholnih pića. Njihova dugotrajna upotreba izaziva pojavu alkoholizma.
Alkoholizam je skup pojava koje karakteriziraju kliničku sliku ovisnosti o alkoholu (tj. proizvodima koji sadrže etanol). Među simptomima i manifestacijama takve zavisnosti su: tolerancija organizma na alkohol, fizička zavisnost, apstinencijalni sindrom pri prestanku ili smanjenju konzumacije, nekontrolisana i privremena prekomerna konzumacija.
Postoje tri faze u napredovanju alkoholizma:
- osoba nema žudnju za alkoholom, dolazi do gubitka kontrole tokom konzumiranja, prelaska na sistematsku konzumaciju, povećanja tolerancije alkohola, pojavljuju se početni poremećaji u mentalnoj sferi;
- javlja se fizička zavisnost sa gubitkom mere, nastajanjem psihopatskog sindroma, poremećajem sistema tela (kardiovaskularni, genitourinarni, respiratorni) i organa (pojava gastritisa, hepatitisa)
- ovisnost o alkoholu je psihička, javlja se jaka fizička privlačnost kao manifestacija apstinencijalnog sindroma, pojava halucinacija, nepovratna oštećenja unutrašnjih organa (ciroza jetre, bolesti srca, encefalopatija itd.).
Uticaj na trudnoću
Rizik od abnormalnosti u razvoju fetusa direktno je proporcionalan količini alkohola konzumiranog tokom trudnoće.
Etanol lako prolazi kroz placentu, pa njegov sadržaj u krvi majke i fetusa brzo dostiže isti nivo. Akumulira se u fetalnim tkivima bogatim fosfolipidima, u mozgu, a takođe i u eritrocitima. Uklanjanje alkohola iz organizma vrši se uz pomoć jetrenih enzima, a kod nerođenog djeteta nastaje tek u drugoj polovini trudnoće majke. Štetno djelovanje etanola na fetus povezano je sa nezrelošću zaštitnog mehanizma i povećanom vaskularnom permeabilnosti i sl. Od posebnog značaja su kritični periodi embrionalnog razvoja, kada osetljivost embriona i fetusa na strane supstance dostiže svoj maksimum. Toksičan učinak etanola je uzrok usporavanja razvoja ili čak smrti embrija.
Konzumacija etanola tokom trudnoće povezana je sa fetalnim (fertilnim) teratogenim efektima. Utjecaj alkohola se očituje u narušavanju ukupnog razvoja fetusa, rođenju djeteta tjelesne težine i visine manje od normalne, mentalne inferiornosti. Posebno, djeca pogođena teratogenim djelovanjem etanola imaju izmijenjene crte lica: uske palpebralne pukotine, tanku gornju usnu, pojavu mikrocefalije i retrognatije, nedostatak filtera i razne anomalije uha. Fizičke modifikacije nadopunjuju nerazvijenost mozga, sklonost konvulzivnim napadima, cerebralni edem, loša koordinacija pokreta, smanjena inteligencija i urođene srčane mane. Ovaj efekat etanola naziva se fetalni alkoholni sindrom, FAS (ili fetalni alkoholni sindrom).
Interakcija s lijekovima
Etanol ima sposobnost pojačavanja djelovanja antibiotika, antihistaminika, barbiturata, mišićnih relaksansa, a također izaziva negativnu reakciju organizma.
| klasa droga | droga | Vrsta interakcije sa etanolom, posljedice |
|---|---|---|
| analgetici | aspirin Acetaminophen | Aspirin pojačava pražnjenje želuca, što dovodi do brze apsorpcije alkohola u tankom crijevu, a može i usporiti djelovanje alkohol dehidrogenaze u želucu. Etanol pojačava metabolizam acetaminofena, čiji su produkt otrovne tvari koje oštećuju jetru. Može uzrokovati ubrzan rad srca, bol u trbuhu, čir na želucu, |
| antibiotici | Eritromicin Izoniazid Ketokonazol Metronidazol | Eritromicin povećava pražnjenje želuca, što dovodi do brze apsorpcije alkohola u tankom crijevu; Zajedno sa izoniazidom, alkohol povećava rizik od oboljenja jetre. Prate ga glavobolja, mučnina, nagle promene krvnog pritiska |
| antihistaminici | Difenhidramin Clemastine Promethazine | Etanol pojačava dejstvo lekova na centralni nervni sistem, izazivajući pojavu letargije, smanjenu pokretljivost, kombinovano dejstvo je izraženije kod starijih osoba. |
| barbiturati | fenobarbital | Slabost tijela, vrtoglavica, opasnost od konvulzivnog napada. Hronična konzumacija alkohola povećava nivo metabolizma citokroma P-450 barbiturata. |
| Tablete za spavanje (benzodiazepini) | diazepam lorazepam oksazepam | Etanol pojačava dejstvo lekova na centralni nervni sistem, izazivajući probleme sa pamćenjem, letargiju, smanjene motoričke sposobnosti, usporavanje ili otežano disanje; |
| protuupalni lijekovi | Diklofenak Ibuprofen Naproksen | Konzumacija etanola povećava rizik od krvarenja u želucu, peptičkih ulkusa |
| Blokatori H2 receptora | Nizatidin Ranitidin Cimetidin | Lijekovi inhibiraju djelovanje alkohol dehidrogenaze i doprinose probavnim smetnjama u želucu, što dovodi do povećanog sadržaja etanola u krvi. |
aplikacija
Etanol ima široku primenu, među kojima su najznačajnije proizvodnja alkoholnih pića, upotreba kao rastvarača, goriva i sinteza drugih hemikalija.
gorivo
Prvi automobil koji je mogao da radi na etanol dizajnirao je Henry Ford 1920. godine - model Ford T. Međutim, tada ova inovacija nije dobila potreban razvoj zbog tehničkih i ekonomskih problema: proizvodnja čistog etanola bila je preskupa, a upotreba nedovoljno prečišćenog alkohola pomiješanog sa ugljovodoničnim gorivom bila je ograničena u određenoj mjeri - na niskim temperaturama voda nerastvorljiva u benzinu se smrzavala, začepljujući rezervoar za gorivo.
Sada, sa tehnologijom za proizvodnju jeftinog etanola, zamjena tradicionalnog benzina ili dizel goriva etanolom, ili korištenje kao aditiva, postala je široko rasprostranjena u svijetu. Svjetska proizvodnja etanola za potrebe industrije goriva u 2014. godini iznosila je 24750000000 galona.
rastvarač
Etanol je najvažniji rastvarač nakon vode. Njegova glavna primjena je proizvodnja kozmetike, parfema, tenzida i dezinficijensa, farmaceutskih proizvoda, raznih premaza. U te svrhe koristi se etanol sintetičkog i enzimskog porijekla.
antiseptik
Etanol je najstariji antiseptik poznat čovječanstvu. Njegovu sposobnost da dezinficira rane uočili su drevni grčki ljekar Klaudije Galen, a kasnije i srednjovjekovni francuski hirurg Guy de Chauliac.
Etanol ispoljava baktericidno djelovanje u koncentracijama od 30% i više, ovisno o vrsti bakterije, sadržaju vode i vremenu djelovanja. Prema studijama, efekat etanola je najefikasniji pri njegovoj koncentraciji od 60-70% - i u prisustvu vode i u njenom odsustvu. Upravo taj sadržaj etanola imaju sredstva za dezinfekciju ruku u domaćinstvu. Upotreba visoke koncentracije (na primjer, 90% otopine) za dezinfekciju kože je nepraktična, jer u takvim koncentracijama etanol pokazuje svoja taninska svojstva, dok se antiseptička svojstva smanjuju.
Princip djelovanja etanola na mikroorganizme vjerovatno je djelovanje na njihove membrane i brza denaturacija proteina, što dovodi do poremećaja u metabolizmu bakterija i daljeg uništavanja stanica. Etanol pokazuje visoko biocidno djelovanje protiv vegetativnih bakterija (uključujući mikobakterije), virusa, gljivica, ali ne i spora.
Zbog nedostatka sporicidnog djelovanja, etanol se ne može koristiti za sterilizaciju, ali su njegova svojstva dovoljna za preventivnu dezinfekciju površina, tretman kože i sl.
Precipitacija nukleinske kiseline
Etanol se široko koristi u molekularnoj biologiji za precipitaciju i koncentraciju DNK i RNK. Koristi se u kombinaciji s puferskim otopinama soli koje sadrže jednostavne jednostruko nabijene katione (na primjer, katione natrija). Tipična je upotreba natrijum acetatnog pufera od 0,3 mol/L sa pH 5,2 (na 4°C) i etanola - apsolutnog i 70% (na -20°C).
Za precipitaciju nukleinskih kiselina, njihov uzorak se pomiješa sa puferskom otopinom i apsolutnim etanolom i hladi na -20 °C sat vremena, nakon čega se centrifugira. Nakon što pipetom odvojite višak tečnosti sa površine, dodajte 70% rastvor etanola i ponovite centrifugiranje i odvajanje tečnosti. Ostatak se isparava na temperaturi od 37°C na vodenom kupatilu i na taj način se dobija koncentrisana supstanca.
protuotrov
Zbog svoje sposobnosti stvaranja estera u interakciji s alkoholima, etanol se koristi kao dostupan protuotrov za trovanje metanolom, etilen glikolom i dietilen glikolom. Etanol se u organizam unosi oralno ili intravenozno, a doza za primjenu se izračunava na osnovu toga da njegova koncentracija u krvnom serumu treba dostići 10-15 mg/l.
Rizik pri upotrebi etanola leži u inhibiciji aktivnosti centralnog nervnog sistema, pojavi hipoglikemije (zbog smanjenja glukoneogeneze) i mučnini. Kod intravenske primjene može doći do flebitisa, hipertenzije, hiponatremije. Upotreba takvog antidota zahtijeva stalno praćenje sadržaja etanola u serumu i razine glukoze u venskoj krvi.
Sinteza drugih supstanci
U industriji se etanol koristi za proizvodnju etanala, butadiena, dietil etera, etil acetata, etilamina i slično.
Povezani video zapisi
Etanol - šta je ovo supstanca? Koja je njegova upotreba i kako se proizvodi? Etanol je svima poznatiji pod drugim imenom - alkohol. Naravno, ovo nije sasvim ispravna oznaka. Ali u međuvremenu, pod riječju "alkohol" mislimo na "etanol". Čak su i naši preci znali za njegovo postojanje. Dobili su ga procesom fermentacije. Korišteni su razni proizvodi od žitarica do bobičastog voća. Ali u nastaloj Bragi, kako su se u stara vremena zvala alkoholna pića, količina etanola nije prelazila 15 posto. Čisti alkohol se mogao izolovati tek nakon proučavanja procesa destilacije.
Etanol - šta je to?
Etanol je monohidrični alkohol. U normalnim uslovima, to je isparljiva, bezbojna, zapaljiva tečnost specifičnog mirisa i ukusa. Etanol je našao široku primenu u industriji, medicini i svakodnevnom životu. Odlično je dezinfekciono sredstvo. Alkohol se koristi kao gorivo i kao rastvarač. Ali najviše od svega, formula etanola C2H5OH poznata je ljubiteljima alkoholnih pića. Upravo u ovom području ova supstanca je našla široku primjenu. Ali ne zaboravite da je alkohol kao aktivni sastojak u alkoholnim pićima jak depresiv. Ova psihoaktivna supstanca može deprimirati centralni nervni sistem i uzrokovati jaku ovisnost.
Danas je teško pronaći industriju u kojoj se etanol ne bi koristio. Teško je nabrojati sve za šta je alkohol toliko koristan. Ali najviše od svega, njegova svojstva su bila cijenjena u farmaceutskim proizvodima. Etanol je glavna komponenta gotovo svih ljekovitih tinktura. Mnogi "bakini recepti" za liječenje ljudskih tegoba temelje se na ovoj tvari. Sve korisne tvari crpi iz biljaka, akumulirajući ih. Ovo svojstvo alkohola našlo je primjenu u proizvodnji domaćih biljnih i bobičastih tinktura. I iako su ovo alkoholna pića, u umjerenim količinama donose zdravstvene prednosti.
Prednosti etanola
Formula etanola svima je poznata još od školskih časova hemije. Ali evo prednosti ove hemikalije, neće svi odmah odgovoriti. Zapravo, teško je zamisliti industriju u kojoj se alkohol ne bi koristio. Prije svega, etanol se u medicini koristi kao snažno dezinficijens. Tretiraju operativnu površinu i rane. Alkohol štetno djeluje na gotovo sve grupe mikroorganizama. Ali etanol se ne koristi samo u hirurgiji. Neophodan je za proizvodnju ljekovitih ekstrakata i tinktura.
U malim dozama alkohol je blagotvoran za ljudski organizam. Pomaže u razrjeđivanju krvi, poboljšanju cirkulacije krvi i širenju krvnih žila. Koristi se čak i za prevenciju kardiovaskularnih bolesti. Etanol pomaže u poboljšanju rada gastrointestinalnog trakta. Ali samo u zaista malim dozama.
U posebnim slučajevima, psihotropni učinak alkohola može ugušiti najteže bolove. Etanol je našao primenu u kozmetologiji. Zbog izraženih antiseptičkih svojstava uključen je u gotovo sve losione za čišćenje problematične i masne kože.
Šteta etanola
Etanol je alkohol proizveden fermentacijom. Prekomjernom upotrebom može izazvati teška toksikološka trovanja, pa čak i komu. Ova supstanca je dio alkoholnih pića. Alkohol izaziva najjaču psihičku i fizičku ovisnost. Alkoholizam se smatra bolešću. Šteta etanola odmah je povezana sa scenama divljeg pijanstva. Prekomjerna konzumacija pića koja sadrže alkohol dovodi ne samo do trovanja hranom. Sve je mnogo komplikovanije. Učestalim konzumiranjem alkohola zahvaćeni su gotovo svi sistemi organa. Od gladovanja kiseonikom, koje uzrokuje etanol, moždane ćelije umiru u velikom broju. Javlja se U ranim fazama, pamćenje slabi. Tada osoba razvije bolesti bubrega, jetre, crijeva, želuca, krvnih sudova i srca. Kod muškaraca dolazi do gubitka potencije. U posljednjim fazama alkoholičara otkriva se deformacija psihe.
Istorija alkohola
Etanol - šta je to supstanca i kako je dobijena? Ne znaju svi da se koristi još od praistorije. Bio je dio alkoholnih pića. Istina, njegova koncentracija je bila mala. Ali u međuvremenu, u Kini su pronađeni tragovi alkohola na grnčariji staroj 9.000 godina. Ovo jasno ukazuje da su ljudi u doba neolita pili pića koja su sadržavala alkohol.
Prvi slučaj zabilježen je u 12. vijeku u Salernu. Istina, bila je to mješavina vode i alkohola. Čisti etanol izolovao je Johann Tobias Lovitz 1796. godine. Koristio je metodu filtriranja aktivnog uglja. Dugo vremena je proizvodnja etanola ovom metodom ostala jedina metoda. Formulu za alkohol izračunao je Nicolo-Théodore de Saussure, a Antoine Lavoisier opisao je kao jedinjenje ugljika. U 19. i 20. veku, mnogi naučnici su proučavali etanol. Proučena su sva njegova svojstva. Trenutno je postao široko rasprostranjen i koristi se u gotovo svim sferama ljudske aktivnosti.
Dobivanje etanola alkoholnom fermentacijom
Možda najpoznatiji način proizvodnje etanola je alkoholna fermentacija. To je moguće samo kada se koriste organski proizvodi koji sadrže veliku količinu ugljikohidrata, kao što su grožđe, jabuke, bobičasto voće. Još jedna važna komponenta za aktivnu fermentaciju je prisustvo kvasca, enzima i bakterija. Prerada krompira, kukuruza, pirinča izgleda isto. Za dobijanje gorivog alkohola koristi se sirovi šećer koji se proizvodi od trske. Reakcija je prilično složena. Kao rezultat fermentacije, dobiva se otopina koja ne sadrži više od 16% etanola. Ne može se postići veća koncentracija. To je zbog činjenice da kvasac ne može preživjeti u zasićenijim otopinama. Dakle, nastali etanol mora biti podvrgnut procesima pročišćavanja i koncentriranja. Obično se koriste procesi destilacije.
Za dobivanje etanola koristite vrstu kvasca Saccharomyces cerevisiae različitih sojeva. U principu, svi oni mogu aktivirati ovaj proces. Kao hranjivi supstrat može se koristiti piljevina ili, alternativno, otopina dobivena od njih.
Gorivo
Mnogi ljudi znaju za svojstva koja ima etanol. Da je u pitanju alkohol ili dezinfekciono sredstvo, takođe je opšte poznato. Ali alkohol je takođe gorivo. Koristi se u raketnim motorima. Dobro poznata činjenica – tokom Prvog svetskog rata 70% vodenog etanola je korišćeno kao gorivo za prvu nemačku balističku raketu na svetu – V-2.
Trenutno je alkohol postao sve rašireniji. Kao gorivo koristi se u motorima sa unutrašnjim sagorevanjem, za grejne uređaje. U laboratorijama se sipa u alkoholne lampe. Katalitička oksidacija etanola koristi se za proizvodnju jastučića za grijanje, vojnih i turističkih. Ograničeni alkohol se koristi u mješavini s tekućim naftnim gorivima zbog svoje higroskopnosti.
Etanol u hemijskoj industriji
Etanol se široko koristi u hemijskoj industriji. Služi kao sirovina za proizvodnju supstanci kao što su dietil etar, sirćetna kiselina, hloroform, etilen, acetaldehid, tetraetil olovo, etil acetat. U industriji boja i lakova, etanol se široko koristi kao otapalo. Alkohol je glavni sastojak perača vjetrobrana i antifriza. Alkohol se takođe koristi u kućnim hemikalijama. Koristi se u deterdžentima i sredstvima za čišćenje. Posebno je čest kao komponenta u tekućinama za njegu vodovoda i stakla.
Etilni alkohol u medicini
Etilni alkohol se može pripisati antisepticima. Štetno djeluje na gotovo sve grupe mikroorganizama. Uništava ćelije bakterija i mikroskopskih gljivica. Upotreba etanola u medicini je gotovo univerzalna. Ovo je odlično sredstvo za sušenje i dezinfekciju. Zbog svojstava štavljenja, alkohol (96%) se koristi za tretiranje operacionih stolova i ruku hirurga.
Etanol je rastvarač za lijekove. Široko se koristi za proizvodnju tinktura i ekstrakata od ljekovitog bilja i drugih biljnih materijala. Minimalna koncentracija alkohola u takvim supstancama ne prelazi 18 posto. Etanol se često koristi kao konzervans.
Etil alkohol je takođe odličan za trljanje. Tokom groznice, proizvodi efekat hlađenja. Vrlo često se alkohol koristi za zagrijavanje obloga. Istovremeno je apsolutno siguran, nema crvenila i opekotina na koži. Osim toga, etanol se koristi kao sredstvo protiv pjene kada se kisik dovodi umjetno tokom ventilacije pluća. Alkohol je također sastavni dio opće anestezije, koji se može koristiti u slučaju nestašice lijekova.
Čudno, ali medicinski etanol se koristi kao protuotrov za trovanje otrovnim alkoholima, poput metanola ili etilen glikola. Njegovo djelovanje je zbog činjenice da u prisustvu nekoliko supstrata, enzim alkohol dehidrogenaza vrši samo kompetitivnu oksidaciju. Zbog toga se nakon neposrednog uzimanja etanola, nakon toksičnog metanola ili etilen glikola, opaža smanjenje trenutne koncentracije metabolita koji truju tijelo. Za metanol je to mravlja kiselina i formaldehid, a za etilen glikol oksalna kiselina.
prehrambena industrija
Dakle, kako doći do etanola bilo je poznato našim precima. Ali najviše se koristio tek u 19. i 20. vijeku. Uz vodu, etanol je osnova gotovo svih alkoholnih pića, prvenstveno votke, džina, ruma, konjaka, viskija i piva. U malim količinama, alkohol se nalazi i u pićima koja se dobijaju fermentacijom, na primjer, u kefiru, kumisu i kvasu. Ali nisu klasifikovani kao alkohol, jer je koncentracija alkohola u njima vrlo niska. Dakle, sadržaj etanola u svježem kefiru ne prelazi 0,12%. Ali ako se slegne, tada koncentracija može porasti do 1%. U kvasu ima nešto više etil alkohola (do 1,2%). Najviše alkohola se nalazi u kumisu. U svježem mliječnom proizvodu njegova koncentracija je od 1 do 3%, au taloženom dostiže 4,5%.
Etil alkohol je dobar rastvarač. Ovo svojstvo omogućava da se koristi u prehrambenoj industriji. Etanol je rastvarač za mirise. Osim toga, može se koristiti kao konzervans za pekarske proizvode. Registrovan je kao aditiv za hranu E1510. Etanol ima energetsku vrijednost od 7,1 kcal/g.
Uticaj etanola na ljudski organizam
Proizvodnja etanola je uspostavljena u cijelom svijetu. Ova vrijedna tvar se koristi u mnogim područjima ljudskog života. su medicina. Maramice impregnirane ovom supstancom koriste se kao dezinficijens. Ali kakav učinak etanol ima na naše tijelo kada ga progutamo? Da li je to korisno ili štetno? Ova pitanja zahtijevaju detaljnu studiju. Svi znaju da čovječanstvo vekovima konzumira alkoholna pića. Ali tek u prošlom vijeku problem alkoholizma je dobio velike dimenzije. Naši su preci pili kašu, medovinu, pa čak i sada tako popularno pivo, ali sva su ta pića sadržavala nizak procenat etanola. Stoga nisu mogli uzrokovati značajnu štetu zdravlju. Ali nakon što je Dmitrij Ivanovič Mendeljejev razrijedio alkohol vodom u određenim omjerima, sve se promijenilo.
Trenutno je alkoholizam problem u gotovo svim zemljama svijeta. Jednom u tijelu, alkohol ima patološki učinak na gotovo sve organe bez izuzetka. Ovisno o koncentraciji, dozi, putu ulaska i trajanju izlaganja, etanol može ispoljiti toksično i narkotično djelovanje. U stanju je da poremeti funkcionisanje kardiovaskularnog sistema, doprinosi nastanku bolesti probavnog trakta, uključujući čir na želucu i dvanaestopalačnom crevu. Pod narkotičkim dejstvom podrazumeva se sposobnost alkohola da izazove stupor, neosetljivost na bol i inhibiciju funkcija centralnog nervnog sistema. Osim toga, osoba ima alkoholno uzbuđenje, vrlo brzo postaje zavisna. U nekim slučajevima, prekomjerna konzumacija etanola može uzrokovati komu.
Šta se dešava u našem organizmu kada pijemo alkohol? Molekul etanola je sposoban da ošteti centralni nervni sistem. Pod uticajem alkohola dolazi do oslobađanja hormona endorfina u nucleus accumbens, a kod osoba sa izraženim alkoholizmom i u orbitofrontalnom korteksu. Ali, ipak, unatoč tome, etanol nije prepoznat kao narkotična tvar, iako pokazuje sve odgovarajuće radnje. Etilni alkohol nije uvršten na međunarodnu listu kontrolisanih supstanci. I to je kontroverzno pitanje, jer u određenim dozama, odnosno 12 grama supstance na 1 kilogram tjelesne težine, etanol dovodi prvo do akutnog trovanja, a potom i smrti.
Koje bolesti uzrokuje etanol?
Sam rastvor etanola nije kancerogen. Ali njegov glavni metabolit, acetaldehid, je toksična i mutagena supstanca. Osim toga, ima i kancerogena svojstva i provocira razvoj raka. Njegovi kvaliteti su proučavani u laboratorijskim uslovima na eksperimentalnim životinjama. Ovi naučni radovi doveli su do vrlo zanimljivih, ali istovremeno i alarmantnih rezultata. Ispostavilo se da acetaldehid nije samo kancerogen, on može oštetiti DNK.
Dugotrajna upotreba alkoholnih pića može uzrokovati bolesti kao što su gastritis, ciroza jetre, čir na dvanaestercu, rak želuca, jednjaka, malog i rektuma, te kardiovaskularne bolesti kod ljudi. Redovno unošenje etanola u organizam može izazvati oksidativno oštećenje neurona mozga. Kao rezultat oštećenja, oni umiru. Zloupotreba pića koja sadrže alkohol dovodi do alkoholizma i kliničke smrti. Ljudi koji redovno piju alkohol imaju veći rizik od srčanog i moždanog udara.
Ali to nisu sva svojstva etanola. Ova supstanca je prirodni metabolit. U malim količinama može se sintetizirati u tkivima ljudskog tijela. Naziva se istinitim.Također nastaje kao rezultat razgradnje ugljikohidratne hrane u gastrointestinalnom traktu. Takav etanol naziva se "uslovno endogeni alkohol". Može li običan alkotest odrediti alkohol koji se sintetizirao u tijelu? Teoretski, ovo je moguće. Njegova količina rijetko prelazi 0,18 ppm. Ova vrijednost je na donjoj granici najmodernijih mjernih instrumenata.