Metan je prvi predstavnik niza alkana sa formulom CH4. To je prirodni plin bez boje i mirisa. Zbog svojih fizičkih i hemijskih svojstava, metan se koristi kao gorivo.
Struktura
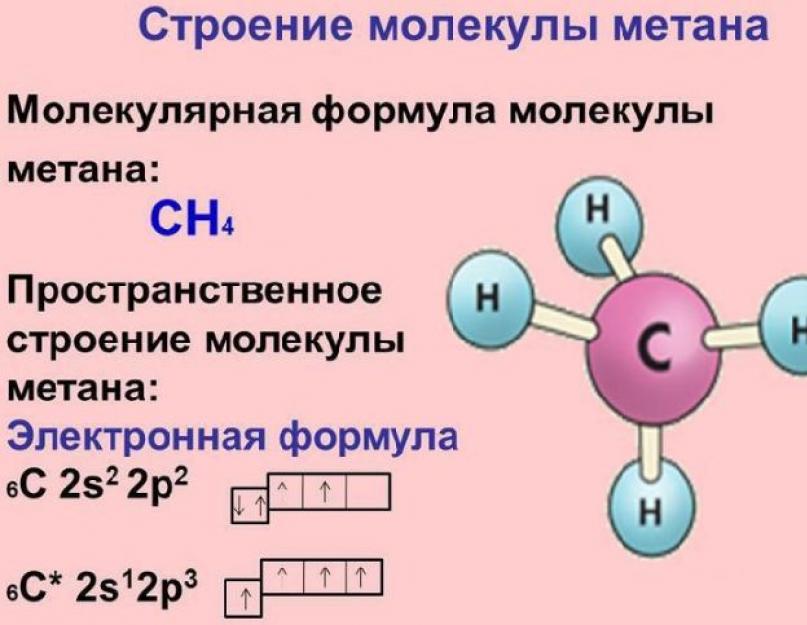
Molekula metana je tetraedar, u čijoj sredini se nalazi ugljik povezan jednostavnim (jednostrukim) σ-vezama s atomima vodika. Struktura i svojstva molekula metana važni su za razumijevanje cijele organske hemije, jer većina organskih jedinjenja sadrži metil grupe -CH 2 .

Rice. 1. Struktura molekula metana.
Metan formira homologni niz alkana. Svaki naredni homolog razlikuje se od prethodnog za jednu -CH 2 grupu.
Zbog tetraedarske konfiguracije, dugi molekuli alkana izgledaju kao zakrivljeni lanci.
Potvrda
Metan je uobičajen gas u svemiru. Nalazi se u prirodnom i povezanom plinu, nastaje na dnu mora i oslobađa se kao krajnji proizvod vitalne aktivnosti crijevnih bakterija. Metan je dio atmosfere džinovskih planeta. Na površini Titana - Saturnovog mjeseca - nalaze se etan-metanska jezera i rijeke.

Rice. 2. Satelit Titan.
U industriji se metan izoluje iz prirodnog gasa i dobija se koksom (kalcinacijom) uglja.
U laboratoriji, metan nastaje zagrijavanjem suhog natrijum hidroksida sa sirćetnom kiselinom, a takođe i topljenjem acetata sa natrijum hidroksidom:
- 2NaOH + CH 3 COOH → Na 2 CO 3 + H 2 O + CH 4;
- CH 3 COONa + NaOH → CH 4 + Na 2 CO 3.
Metan je prvi otkrio u močvarama fizičar Alessandro Volta 1776. godine. Dvije godine kasnije izolirao je čisti metan iz močvarnog plina.
Svojstva
Glavna fizička svojstva:
- lakši od vazduha;
- bez mirisa i ukusa;
- slabo rastvorljiv u vodi;
- molekulska težina - 16;
- tačka topljenja -182,49°C;
- tačka ključanja -161,56 °C;
- tačka paljenja - 87,8°C;
- temperatura samozapaljenja - 537,8 ° C.
Metan određuje fizičko-hemijska svojstva homolognog niza alkana. U normalnim uslovima, metan i njegovi homolozi su neaktivni i reaguju pod dejstvom visoke temperature i katalizatora. Dodatni uslovi su neophodni za cepanje C-H veze.
Glavne reakcije metana:
- nitracija:
CH 4 + HONO 2 → CH 3 -NO 2 + H 2 O;
- halogeniranje:
CH 4 + Cl 2 → CH 3 Cl + HCl;
- sulfohlorisanje:
CH 4 + SO 2 + Cl 2 → CH 3 -SO 2 Cl + HCl;
- katalitička oksidacija pod dejstvom soli bakra i mangana:
2CH 4 + O 2 → 2CH 3 OH;
- potpuna oksidacija (sagorevanje):
CH 4 + 2O 2 → CO 2 + 2H 2 O + Q;
- oksidacija parom:
CH 4 + H 2 O → CO + 3H 2;
- kreking (metoda rafinacije nafte):
2CH 4 → HC≡CH + 3H 2 .

Rice. 3. Sagorijevanje metana.
Koncentracija metana u zraku je više od 4% eksplozivna. Stoga se metan posebno daje miris miješanjem plina s tiolima koji sadrže sumpor. Ovo pomaže u kontroli curenja gasa za domaćinstvo.
Šta smo naučili?
Metan je najjednostavniji predstavnik klase alkana, formirajući homologni niz. To je bezbojni zapaljivi plin dobiven iz prirodnog plina i proizveden koksom uglja. Metan se koristi kao gorivo. Samozapaljiv na visokim temperaturama. Gas je podložan nitraciji, halogeniranju, sulfohloriranju, oksidaciji pod dejstvom katalizatora, pare, sagorevanju, kao i krekiranju koji se koristi u preradi nafte.
Metan (močvarski gas; CH 4) je najjednostavniji zasićeni ugljovodonik. Bezbojan gas bez mirisa, tačka topljenja -182,48°. Metan se lako zapali; Mešavina metana i vazduha je eksplozivna.
Metan je glavna komponenta prirodnog gasa (60-99%), vatrenog gasa (35-40%), kao i raznih produkata anaerobne razgradnje organske materije, kao što su močvarni gas, gasovi za navodnjavanje. Metan se proizvodi u velikim količinama tokom koksovanja uglja, hidrogenacije uglja i drugih industrijskih procesa.
Metan se koristi kao gorivo za gasifikaciju, kao i za industrijsku sintezu velikih ugljovodonika. težina. Sa nepotpunim sagorevanjem ili katalitičkom oksidacijom metana, on formira metanol (vidi. Metil alkohol), (vidi), acetilen (vidi). Metan se također koristi u proizvodnji čađi, metil hlorida, klorobromobenzena, nitrometana i drugih proizvoda.
Metan se nalazi u crijevnim plinovima (kao rezultat fermentacije metana), u krvi životinja i ljudi.
Metan je najinertnije jedinjenje iz grupe parafinskih ugljovodonika. Fiziološki metan je indiferentan i može izazvati trovanje samo u vrlo visokim koncentracijama (zbog niske rastvorljivosti metana u vodi i krvi). Istovremeno, toksični efekat metana se manifestuje i pri nižim koncentracijama metana u vazduhu. Dakle, pri sadržaju 25-30% metana u zraku javljaju se prvi znaci (povećan rad srca, pojačano disanje, poremećena koordinacija finih pokreta mišića itd.). Veće koncentracije metana u zraku uzrokuju glavobolju osobe. Toksičan efekat metana se u potpunosti manifestuje samo pri povišenom pritisku (2-3 atm).
Prva pomoć kod akutnog trovanja: uklanjanje unesrećenog iz štetne atmosfere. Jastučići za grijanje. U nedostatku disanja, odmah (prije dolaska ljekara) vještačko disanje, koje prestaje tek nakon pojave znakova ukočenosti.
Hronično djelovanje metana. Kod radnika u ili u industrijama u kojima su u zraku prisutni metan i drugi ugljovodonici metanskog niza, opisani su uočljivi pomaci izvana (pozitivan očno-srčani refleks, izražen atropinski test,). Međutim, kronična izloženost metanu ne uzrokuje ozbiljne organske promjene, iako neki istraživači pripisuju pojavu nistagmusa kod rudara dugotrajnoj izloženosti metanu.
Prevencija trovanja metanom. U podzemnim radovima nije dozvoljen sadržaj metana iznad 0,75 vol.%. S povećanjem sadržaja metana, radnici moraju biti uklonjeni bez greške, a prostorije moraju biti ventilirane. Glavna mjera za sprječavanje nakupljanja metana u rudnicima je postojanje dobre ventilacije. Za ličnu zaštitu potrebno je koristiti kacige s prinudnim dovodom zraka ili aparat za disanje opremljen dovodom zraka.
Atom ugljika u molekuli metana je u stanju sp3-hibridizacije.Kao rezultat preklapanja četiri hibridne orbitale atoma ugljika sa s-orbitalama atoma vodika, formira se vrlo jaka molekula metana.
Plin metan je bezbojan i bez mirisa, lakši od zraka, slabo rastvorljiv u vodi. Zasićeni ugljovodonici mogu sagorjeti, stvarajući ugljični monoksid (IV) i vodu. Metan gori blijedo plavkastim plamenom: CH4 + 2O2 = 2H2O
U mješavini sa zrakom (ili kisikom, posebno u volumnom omjeru 1:2, što se vidi iz jednačine reakcije), metan stvara eksplozivne smjese, pa je opasan i u svakodnevnom životu (curenje plina kroz slavine) a u rudnicima.U slucaju nepotpunog sagorevanja metan nastaje cad.Tako se dobija u industrijskim uslovima.U prisustvu katalizatora pri oksidaciji metana dobijaju se metil alkohol i formaldehid
S jakim zagrijavanjem, metan se razgrađuje prema jednadžbi: CH4 = C + 2H2
U pećima posebnog dizajna, razgradnja metana može se provesti do međuproizvoda, acilena:
2CH4=C2H 2+3H2
Metan karakteriziraju supstitucijske reakcije.Na svjetlosti ili na običnoj temperaturi halogeni - klor i brom - postepeno (u fazama) istiskuju vodonik iz molekule metana, formirajući takozvane derivate halogena.Atomi hlora zamjenjuju atome vodika u njemu formiranje mješavine različitih spojeva:
CH3Cl-klorometan (metil hlorid), CH2Cl2-dihlorometan, CHCl3-triklorometan, CCl4-tetraklorometan
Iz ove smjese može se izdvojiti svako jedinjenje.Kloroform i tetraklorometan su važni kao rastvarači za smole, masti, gumu i druge organske supstance.
Formiranje halogenih derivata metana odvija se lančanim mehanizmom slobodnih radikala. Pod djelovanjem svjetlosti, molekule klora se razlažu u anorganske radikale: Cl2 \u003d 2Cl
Neorganski Cl radikal oduzima atom vodonika jednim elektronom iz molekule metana, formirajući HCl i slobodni radikal CH3 H H
H:C_| H+Cl=H:C+HCl
h| H
Slobodni radikal stupa u interakciju sa molekulom hlora Cl2, formirajući halogen derivat i radikal hlora:
CH3+Cl_| Cl=CH3-Cl+Cl
Metan je na normalnoj temperaturi otporniji na kiseline, lužine i mnoge oksidirajuće agense, ali reagira s dušičnom kiselinom:
CH4+HNO3=CH3NO2+H2O
nitrometan
Metan nije sposoban za reakcije adicije, jer su sve valencije u njegovoj molekuli zasićene.
Gore navedene supstitucijske reakcije su praćene kidanjem C-H veza.Međutim, poznati su procesi u kojima ne dolazi samo do cijepanja C-H veza, već i lanca atoma ugljika (za homologe metana).Ove reakcije se odvijaju na visokim temperaturama iu prisustvo katalizatora. Na primjer:
C4H10+H2 - proces dehidrogenacije
C4H10-|
C2H6 + C2H4 pucanje
Dobivanje metana.
Metan je široko rasprostranjen u prirodi, glavni je sastojak mnogih zapaljivih gasova, prirodnih (90-98%) i veštačkih, koji se oslobađaju tokom suve destilacije drveta, treseta, uglja, kao i prilikom krekiranja nafte.
Metan se oslobađa sa dna močvara i iz ugljenih slojeva u rudnicima, gdje nastaje sporim razlaganjem biljnih ostataka bez pristupa zraka, pa se metan često naziva močvarnim plinom ili ložištem.
U laboratorijskim uslovima, metan se dobija zagrevanjem mešavine natrijum acetata sa natrijum hidroksidom:
200*C
CH3|COONa +NaO|H=Na2CO3 + CH4|
ili kada aluminij karbid stupi u interakciju s vodom:
Al4C3 +12H2O=4Al(OH)3 +3CH4|
U potonjem slučaju, metan je vrlo čist.
Metan se može dobiti iz jednostavnih supstanci zagrijavanjem u prisustvu katalizatora: Ni
C+2H2=CH4
Kao i sinteza na bazi vodenog gasa
Ni
CO+3H2=CH4+H2O
Homolozi metana, poput metana, dobijaju se u laboratorijskim uslovima kalcinacijom soli odgovarajućih organskih kiselina sa alkalijama.Druga metoda je Wurtzova reakcija, tj. zagrijavanje monohalogenih derivata metalnim natrijem, na primjer
C2H5 |Br+2Na+Br|C2H5= C2H5-C2H5+2NaBr
U tehnici proizvodnje sintetičkog benzina (mješavina ugljovodonika koja sadrži 6-10 atoma ugljika) koristi se sinteza iz ugljičnog monoksida (II) i vodonika u prisustvu katalizatora (jedinjenja kobalta) i pod povišenim tlakom. izraženo jednačinom:
200*S
nCO+(2n+1)H2=CnH2n+2+nH2O
Primena alkana
Zbog svoje visoke kalorične vrijednosti metan se u velikim količinama troši kao gorivo (u gasu za domaćinstvo i u industriji. Supstance koje se dobijaju iz njega imaju široku upotrebu: vodonik, acilen, čađ. Služi kao sirovina za proizvodnju formaldehida, metil alkohol, kao i razni sintetički proizvodi
Od velikog industrijskog značaja je oksidacija viših zasićenih ugljovodonika-parafina sa brojem atoma ugljenika 20-25.Na taj način se dobijaju sintetičke masne kiseline različite dužine lanca koje se koriste za proizvodnju sapuna, raznih deterdženata, maziva. , lakovi i emajli.
Tečni ugljovodonici se koriste kao gorivo (u sastavu su benzina i kerozina) Alkani se široko koriste u organskoj sintezi.
Metan gori u vazduhu plavičastog plamena, dok se oslobađa energija od oko 39 MJ po 1m 3 . Forme sa vazduhom eksplozivne smjese. Posebno je opasan metan koji se oslobađa prilikom podzemnog otkopavanja mineralnih naslaga u rudnike, kao i u fabrikama za preradu uglja i briketa, u pogonima za sijanje. Dakle, pri sadržaju do 5-6% u zraku, metan gori u blizini izvora topline (temperatura paljenja 650-750 ° C), od 5-6% do 14-16% eksplodira, više od 16% može izgorjeti sa prilivom kiseonika izvana. Smanjenje koncentracije metana u ovom slučaju može dovesti do eksplozije. Osim toga, značajno povećanje koncentracije metana u zraku uzrokuje gušenje (na primjer, koncentracija metana od 43% odgovara 12% O 2).
Eksplozivno sagorevanje se širi brzinom od 500-700 gospođa; pritisak gasa tokom eksplozije u zatvorenoj zapremini je 1 Mn/m 2 . Nakon kontakta sa izvorom toplote, paljenje metana dolazi sa izvesnim zakašnjenjem. Izrada sigurnosnih eksploziva i električne opreme otporne na eksploziju temelji se na ovoj osobini. Na lokalitetima opasnim zbog prisustva metana (uglavnom rudnici uglja), tzv. gasni režim.
Na 150–200 °C i pritisku od 30–90 atm, metan se oksidira u mravlja kiselina.
Metan formira inkluzione spojeve - gasne hidrate, široko rasprostranjene u prirodi.
Primena metana
Metan je termički najstabilniji zasićeni ugljovodonik. Široko se koristi kao kućno i industrijsko gorivo i kao sirovina za industriju. . Dakle, kloriranjem metana nastaju metil hlorid, metilen hlorid, hloroform, tetrahlorid ugljenika.
Nepotpuno sagorevanje metana dovodi do čađi , u katalitičkoj oksidaciji - formaldehid , pri interakciji sa sumporom - ugljičnim disulfidom .
Termičko-oksidativno krekiranje i elektrokrekiranje metana važne su industrijske metode za proizvodnju acetilena. .
Katalitička oksidacija mješavine metana s amonijakom je u osnovi industrijske proizvodnje cijanovodonične kiseline . Metan se koristi kao izvor vodonika u proizvodnji amonijaka, kao i za proizvodnju vodenog gasa (tzv. sintezni gas): CH 4 + H 2 O → CO + 3H 2, koji se koristi za industrijsku sintezu ugljovodonika, alkoholi, aldehidi itd. Važan derivat metana - nitrometan .
Metan i efekat staklene bašte
Metan je stakleničkih plinova. Ako se stupanj utjecaja ugljičnog dioksida na klimu uvjetno uzme kao jedan, tada će aktivnost staklenika metana biti 23 jedinice. Sadržaj metana u atmosferi je vrlo brzo rastao u posljednja dva stoljeća.
Sada se prosječni sadržaj metana CH 4 u modernoj atmosferi procjenjuje na 1,8 ppm ( delova na milion, dijelovi na milion). I, iako je to 200 puta manje od sadržaja ugljičnog dioksida (CO 2) u njemu, po molekuli plina, efekat staklene bašte metana – odnosno njegov doprinos rasipanju i zadržavanju topline koju zrači Zemlja zagrijana sunce - znatno je više nego od CO 2 . Osim toga, metan apsorbira Zemljino zračenje u onim "prozorima" spektra koji su transparentni za druge stakleničke plinove. Bez stakleničkih gasova - CO 2 , vodene pare, metana i nekih drugih nečistoća, prosječna temperatura na površini Zemlje bila bi samo -23°C, a sada je oko +15°C.
Metan curi na dno okeana kroz pukotine u zemljinoj kori, a oslobađa se u značajnim količinama tokom rudarenja i kada se pale šume. Nedavno je otkriven novi, potpuno neočekivani izvor metana - više biljke, ali mehanizmi nastanka i značaj ovog procesa za same biljke još nisu razjašnjeni.
Metan je organski gas bez boje i mirisa. CH 4 - ovo je njegova hemijska formula, a masa supstance je manja od mase vazduha. Otapanje u vodi je sporo. Govoreći o organskoj prirodi metana, to znači da je skoro 95% slučajeva njegovog pojavljivanja prirodne prirode. Na primjer, oslobađa se tokom razgradnje biljnih ostataka. Stoga nije iznenađujuće što su mnoge njegove karakteristike proučavane i prije Novog doba, kada su ljudi promatrali mjehuriće zraka na površini stajaćih vodenih tijela. Ti mjehurići su bili upravo metan oslobođen tokom propadanja biljaka na dnu močvare.
Ostali prirodni izvori gasa uključuju:
- Stoka. Bakterije koje žive u njihovim želucima u procesu života emituju metan, a njegov udio čini 20% svih atmosferskih plinova.
- Biljke. Metan je esencijalna supstanca koja se oslobađa tokom fotosinteze.
- Insekti. Termiti su najaktivniji emiteri metana.
- Mines. Ispod zemljine površine neprestano se odvija spora razgradnja uglja pri čemu nastaje metan.
- Naftne bušotine. Sadržaj ovog gasa u nafti je jednostavno ogroman.
- Vulkani. Vjerovatno se tamo formira i metan zbog činjenice da se praistorijska organska tvar aktivno raspada.
- Ocean. Duboko ispod vode nalaze se pukotine kroz koje može prodrijeti metan.
- Goruće šume.
- Industrija. Uprkos očiglednoj aktivnosti ovih preduzeća, njihovo učešće u emisiji u ukupnoj masi je zanemarljivo.
Svi ovi primjeri jasno potvrđuju činjenicu da je metan stalno bio u atmosferi, njegova pojava nije povezana s početkom aktivne ljudske aktivnosti. Zato je prisustvo metana na planeti znak da na njoj možda ima života ili je nekada postojao.
Međutim, "prirodnost" ovog gasa ne znači da nam ne donosi nikakvu štetu. Njegove pare, posebno u visokim koncentracijama, prilično su sposobne dovesti do smrti osobe. U ranim fazama razvoja rudarske industrije često su zabilježene eksplozije ili teška trovanja rudara metanom. Ako pratite informacije u medijima, onda se ovi događaji dešavaju u savremenom svijetu. Da bi se mogućnost trovanja metanom svela na najmanju moguću mjeru, na prvi znak potrebno je naručiti stručnu analizu zraka u prostoriji, uz pomoć koje će biti moguće precizno odrediti koncentraciju.
Metan u savremenom svetu
Plin se široko koristi u modernom svijetu:
- Motori sa unutrašnjim sagorevanjem često rade na metan.
- Plin omogućava proizvodnju mnogih lijekova, uključujući antiseptike i tablete za spavanje.
- Metan je osnova formaldehida i metanola, koji se koriste za proizvodnju gnojiva i mnogih drugih tvari.
- Bez metana je nemoguće napraviti aparate za gašenje požara i rastvarače.
- Cijanovodonična kiselina nije samo otrov, ona nalazi i široku praktičnu primenu, a njen proces proizvodnje zasniva se na oksidaciji mešavine metana i amonijaka.
Metan i njegova opasnost po ljudski organizam
Opasnost od metana leži u sljedećim faktorima:
- Eksplozivnost. Upravo je to svojstvo dalo naziv "eksplozivni plin". Akumulacija metana, najmanja iskra - sve to može dovesti do razorne eksplozije. Zato se na mjestima gdje se bilježe nakupine ili emisije ovog plina ne smije pušiti, koristite otvorene izvore plamena. Ali ponekad ni ove sigurnosne mjere nisu dovoljne, gas i dalje oduzima ljudske živote.
- Već smo spomenuli svojstva da se metan može akumulirati u rudnicima. Uglavnom se može naći u šupljinama između velikih slojeva stijena, kao i u šupljinama koje rudari stvaraju tokom procesa rudarenja. Što je ekstrakcija aktivnija, to je intenzivnija emisija metana, pa su radnici rudnika ti koji najčešće umiru od ovog gasa.
- Eksplozije nisu cijela opasnost, metan može izazvati i teško trovanje. Udisanje velikih količina dovodi do nedostatka kiseonika u krvi, "zujanja" u ušima, osećaja "livene" glave. Povećanje koncentracije ubrzava rad srca, osoba osjeća opću slabost, pati od mučnine, a koža može pocrvenjeti. Najteže posljedice su nesvjestica, bljedilo, konvulzije, pa čak i smrt.
- Nažalost, u svom čistom obliku metan nema miris, pa ga je teško otkriti. Aroma "metana" koju možemo osjetiti zasluga je posebnih mirisa koji njegovu upotrebu čine sigurnijom i kontroliranijom.
- Naravno, u rudnicima se metanu ne dodaju mirisi. Od davnina, ljudi su koristili posebne metode da zabilježe njegovo prisustvo u zraku. Prvi rudari su, na primjer, sa sobom ponijeli kanarinca. Ako je ptica prestala pjevati ili je čak umrla, onda je hitno potrebno napustiti klanje.
- Pedesetih godina prošlog stoljeća počeli su se koristiti posebni instrumenti za precizno određivanje postotka metana u mješavini zraka. Međutim, iskusni radnici kažu da je kanarinac još bolji način od novovjekovnih aparata. Naravno, moderni uređaji su osjetljiviji i kompaktniji, ponekad se montiraju direktno u rudarske kacige, poput lampi. U rudnicima su instalirani i stacionarni senzori koji stalno prenose informacije stručnjacima. Opasne nadmorske visine dovode do momentalnog nestanka struje i evakuacije osoblja. Sada se koriste i posebne instalacije koje su sposobne lokalizirati detonaciju ugljene prašine u najranijim fazama. Prije početka radne smjene, količina metana u rudniku se smanjuje na izuzetno sigurne razine.
Ispostavilo se da opasnost od metana za ljude dolazi sa dvije strane odjednom. Sklonost detonaciji, otrovnost, odsustvo mirisa i boje - sve to čini "eksplozivni plin" nevjerovatno opasnim. Kako se ne bi suočili s njegovim najgorim stranama, vrijedi unaprijed naručiti ekološku procjenu koja može utvrditi nivo koncentracije metana u zraku.