> Koliko atoma ima u svemiru?
Saznati, koliko atoma ima u svemiru: kako je izračunato, veličina vidljivog svemira, istorija rađanja i razvoja sa fotografijom, broj zvijezda, masa, istraživanje.
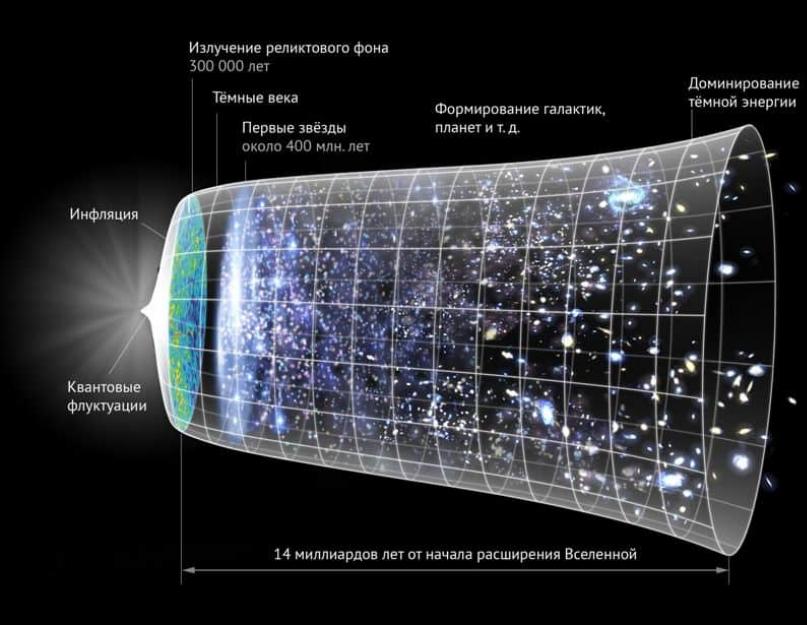
Sigurno svi znaju da je Univerzum veliko mjesto. Prema općim procjenama, pred nama je otvoreno samo 93 milijarde svjetlosnih godina (“Vidljivi svemir”). Ovo je ogroman broj, pogotovo ako ne zaboravite da je to samo dio koji je dostupan našim uređajima. A, s obzirom na takve količine, ne bi bilo čudno pretpostaviti da bi količina supstance također trebala biti značajna.
Zanimljivo je početi proučavati problem u maloj mjeri. Na kraju krajeva, naš Univerzum sadrži 120-300 sekstiliona zvijezda (1,2 ili 3 x 10 23). Ako sve povećamo na nivo atoma, onda će ti brojevi izgledati jednostavno nezamislivi. Koliko atoma ima u svemiru?
Prema proračunima, ispada da je Univerzum ispunjen sa 10 78 -10 82 atoma. Ali čak ni ovi pokazatelji ne odražavaju koliko tvari sadrži. Gore je spomenuto da možemo shvatiti 46 milijardi svjetlosnih godina u bilo kojem smjeru, što znači da ne možemo vidjeti cijelu sliku. Osim toga, svemir se stalno širi, što objekte udaljava od nas.
Ne tako davno, njemački superkompjuter došao je do rezultata o postojanju 500 milijardi galaksija u vidnom polju. Ako se okrenemo konzervativnim izvorima, dobićemo 300 milijardi. Jedna galaksija može sadržavati 400 milijardi zvijezda, tako da ukupan broj u svemiru može doseći 1,2 x 10 23 - 100 sekstiliona.
Prosječna težina zvijezde je 10 35 grama. Ukupna težina je 10 58 grama. Proračuni pokazuju da svaki gram sadrži 10 24 protona, odnosno isti broj atoma vodika (jedan vodonik sadrži jedan proton). Ukupno dobijamo 10 82 vodonika.
Kao osnovu uzimamo vidljivi Univerzum, unutar kojeg ovu količinu treba ravnomjerno rasporediti (preko 300 miliona svjetlosnih godina). Ali u manjem obimu, materija će stvoriti nakupine blistave materije za koje svi znamo.
Ukratko, većina atoma svemira koncentrirana je u zvijezdama koje stvaraju galaksije, spajaju se u jata, koja zauzvrat formiraju superjata i sve to upotpunjuju formiranjem Velikog zida. Ovo je kada se uveća. Ako krenete u suprotnom smjeru i uzmete manje razmjere, tada su klasteri ispunjeni oblacima sa prašinom, plinom i drugim materijama.

Materija ima tendenciju da se širi izotropno. To jest, sva nebeska područja su ista i svaka sadrži istu količinu. Prostor je zasićen talasom snažnog izotropnog zračenja, izjednačenog sa 2,725 K (nešto iznad apsolutne nule).
Kosmološki princip kaže da je univerzum homogen. Na osnovu toga, može se tvrditi da će zakoni fizike jednako vrijediti bilo gdje u svemiru i da ih ne treba kršiti u velikim razmjerima. Ova ideja je također podstaknuta zapažanjima koja pokazuju evoluciju strukture svemira nakon Velikog praska.
Istraživači su se složili da je većina materije nastala u trenutku Velikog praska, a ekspanzija ne dodaje novu materiju. Mehanizmi u posljednjih 13,7 milijardi godina su ekspanzija i disperzija glavnih masa.
Ali teorija je komplikovana zbog ekvivalencije Ajnštajnove mase i energije, koja je formirana iz opšte teorije relativnosti (dodatak mase postepeno povećava količinu energije).

Međutim, gustoća svemira ostaje stabilna. Moderna doseže 9,9 x 10 30 grama po cm 3. Ovde je koncentrisano 68,3% tamne energije, 26,8% tamne materije i 4,9% svetleće materije. Ispada da je gustina jedan atom vodika na 4 m 3.
Naučnici još uvijek ne mogu dešifrirati svojstva, pa je nemoguće sa sigurnošću reći da li su ravnomjerno raspoređeni ili formiraju guste nakupine. No, vjeruje se da tamna materija usporava širenje, ali tamna energija radi na ubrzanju.
Svi ovi brojevi, u pogledu broja atoma u svemiru, su gruba procjena. Ne zaboravite glavnu ideju: govorimo o proračunima vidljivog Univerzuma.
Težnja ka najnižem energetskom stanju je opšte svojstvo materije. Vjerovatno znate za planinske snježne lavine i kamenjare. Njihova energija je toliko velika da može da odnese mostove, kuće i druge velike i izdržljive strukture sa lica zemlje. Razlog za ovaj strašni fenomen prirode je taj što masa snijega ili kamenja teži da zauzme stanje s najnižom energijom, a potencijalna energija fizičkog tijela u podnožju planine je manja nego na padini ili vrhu.
Atomi stvaraju veze međusobno iz istog razloga: ukupna energija povezanih atoma manja je od energije istih atoma u slobodnom stanju. Ovo je vrlo sretna okolnost za vas i mene - uostalom, da nije bilo dobitka u energiji kada se atomi spajaju u molekule, tada bi samo atomi elemenata ispunili Univerzum, a pojava jednostavnih i složenih molekula neophodnih za postojanje života bi bilo nemoguće.
Međutim, atomi se ne mogu proizvoljno vezati jedni za druge. Svaki atom je sposoban da se veže sa određenim brojem drugih atoma, a vezani atomi su raspoređeni u prostoru na strogo definisan način. Razlog za ova ograničenja treba tražiti u svojstvima elektronskih omotača atoma, odnosno u svojstvima vanjski elektronske ljuske koje atomi koriste za međusobnu interakciju.
Završena vanjska elektronska ljuska ima manju (tj. korisniju za atom) energiju od nepotpune. Prema pravilu okteta, završena ljuska sadrži 8 elektrona:

Ovo su vanjske elektronske ljuske atoma plemenitog plina, s izuzetkom helijuma (n = 1) , čija se završena ljuska sastoji od dva s-elektrona (1s 2 ) samo zato str - ne postoji podnivo na 1. nivou.
Spoljne ljuske svih elemenata, osim plemenitih gasova, su NEKOMPLETNE iu procesu hemijske interakcije su, ako je moguće, KOMPLETNE.
Da bi došlo do takvog "završetka", atomi moraju ili davati elektrone jedni drugima ili ih dijeliti. To prisiljava atome da budu jedan pored drugog, tj. biti hemijski vezani.
Postoji nekoliko pojmova za tipove hemijskih veza: kovalentni, polarni kovalentni, jonski, metalni, donor-akceptor, vodonik i neke druge. Međutim, kao što ćemo vidjeti, sve metode međusobnog vezivanja čestica tvari imaju zajedničku prirodu - to je davanje vlastitih elektrona za zajedničku upotrebu (strožije - socijalizacija elektrona), što je često dopunjeno elektrostatičkom interakcijom između suprotnih naboja koji nastaju tokom prelaza elektrona. Ponekad sile privlačenja između pojedinačnih čestica mogu biti čisto elektrostatičke. Ovo nije samo privlačnost između jona, već i različite međumolekularne interakcije.
Hemija je nauka o supstancama i njihovim transformacijama jedna u drugu.
Supstance su hemijski čiste supstance
Hemijski čista supstanca je skup molekula koji imaju isti kvalitativni i kvantitativni sastav i istu strukturu.
CH 3 -O-CH 3 -
CH 3 -CH 2 -OH
Molekula - najmanje čestice supstance koje imaju sva njena hemijska svojstva; molekul se sastoji od atoma.
Atom su hemijski nedjeljive čestice koje čine molekule. (za plemenite gasove, molekula i atom su isti, He, Ar)
Atom je električki neutralna čestica koja se sastoji od pozitivno nabijenog jezgra, oko kojeg su negativno nabijeni elektroni raspoređeni prema svojim strogo definiranim zakonima. Štaviše, ukupni naboj elektrona jednak je naboju jezgra.
Jezgro atoma sastoji se od pozitivno nabijenih protona (p) i neutrona (n) koji ne nose nikakav naboj. Uobičajeni naziv za neutrone i protone je nukleoni. Masa protona i neutrona je skoro ista.
Elektroni (e-) nose negativan naboj jednak naboju protona. Masa e - je otprilike 0,05% mase protona i neutrona. Dakle, čitava masa atoma je koncentrisana u njegovom jezgru.
Broj p u atomu, jednak naboju jezgra, naziva se redni broj (Z), budući da je atom električno neutralan, broj e je jednak broju p.
Maseni broj (A) atoma je zbir protona i neutrona u jezgru. Prema tome, broj neutrona u atomu jednak je razlici između A i Z. (maseni broj atoma i serijski broj) (N=A-Z).
17 35 Cl p=17, N=18, Z=17. 17p + , 18n 0 , 17e - .
Nukleoni
Hemijska svojstva atoma određena su njihovom elektronskom strukturom (broj elektrona), koja je jednaka atomskom broju (nuklearni naboj). Stoga se svi atomi s istim nuklearnim nabojem ponašaju kemijski na isti način i računaju se kao atomi istog kemijskog elementa.
Element je skup atoma sa istim nuklearnim nabojem. (110 hemijskih elemenata).
Atomi, koji imaju isti nuklearni naboj, mogu se razlikovati po masenom broju, što je povezano s različitim brojem neutrona u njihovim jezgrama.
Atomi koji imaju isti Z, ali različite masene brojeve nazivaju se izotopi.
17 35 Cl 17 37 Cl
Izotopi vodonika H:
Oznaka: 1 1 N 1 2 D 1 3 T
Naziv: protij deuterijum tricijum
Sastav jezgra: 1p 1p+1n 1p+2n
Protijum i deuterijum su stabilni
Raspad tricijuma (radioaktivan) Koristi se u hidrogenskim bombama.
Jedinica za atomsku masu. Avogadrov broj. Moljac.
Mase atoma i molekula su vrlo male (otprilike 10 -28 do 10 -24 g), za praktičan prikaz ovih masa preporučljivo je uvesti vlastitu mjernu jedinicu, što bi dovelo do pogodne i poznate skale.
Budući da je masa atoma koncentrisana u njegovom jezgru, koje se sastoji od protona i neutrona gotovo identične mase, logično je uzeti masu jednog nukleona kao jediničnu masu atoma.
Dogovorili smo se da uzmemo jednu dvanaestinu izotopa ugljika, koji ima simetričnu strukturu jezgra (6p + 6n), kao jedinicu mase atoma i molekula. Ova jedinica se naziva jedinica atomske mase (amu), numerički je jednaka masi jednog nukleona. Na ovoj skali, mase atoma su bliske cjelobrojnim vrijednostima: He-4; Al-27; Ra-226 amu……
Izračunajte masu 1 amu u gramima.
1/12 (12 C) ![]() \u003d \u003d 1,66 * 10 -24 g / a.u.m
\u003d \u003d 1,66 * 10 -24 g / a.u.m
Izračunajmo koliko amu sadrži 1g.
N A = 6,02 *-Avogadrov broj
Rezultirajući omjer se naziva Avogadro broj, on pokazuje koliko a.m.u. sadrži 1g.
Atomske mase date u periodnom sistemu izražene su u amu
Molekularna masa je masa molekula, izražena u amu, nalazi se kao zbir masa svih atoma koji čine ovaj molekul.
m (1 molekul H 2 SO 4) \u003d 1 * 2 + 32 * 1 + 16 * 4 = 98 amu
Za prijelaz sa a.m.u. na 1 g, koji se praktično koristi u hemiji, uveden je podjelni proračun količine tvari, a svaki dio sadrži broj N A strukturnih jedinica (atoma, molekula, jona, elektrona). U ovom slučaju, masa takvog dijela, nazvanog 1 mol, izražena u gramima, numerički je jednaka atomskoj ili molekularnoj masi, izraženoj u amu.
Nađimo masu 1 mol H 2 SO 4:
M (1 mol H 2 SO 4) \u003d
98a.u.m*1,66**6,02*=
Kao što vidite, molekularna i molarna masa su numerički jednake.
1 mol- količina tvari koja sadrži Avogadro broj strukturnih jedinica (atoma, molekula, jona).
Molekularna težina (M) je masa 1 mola supstance, izražena u gramima.
Količina supstance-V (mol); masa supstance m(g); molarna masa M (g/mol) - povezana omjerom: V =;
2H 2 O+ O 2 2H 2 O
2 mol 1 mol
2.Osnovni zakoni hemije
Zakon konstantnosti sastava supstance - hemijski čista supstanca, bez obzira na način pripreme, uvek ima stalan kvalitativni i kvantitativni sastav.
CH3+2O2=CO2+2H2O
NaOH+HCl=NaCl+H2O
Supstance sa konstantnim sastavom nazivaju se daltoniti. Izuzetno, poznate su tvari konstantnog sastava - bertoliti (oksidi, karbidi, nitridi)
Zakon održanja mase (Lomonosov) - masa tvari koje su ušle u reakciju uvijek je jednaka masi produkta reakcije. Iz ovoga slijedi da atomi ne nestaju tokom reakcije i ne nastaju, već prelaze iz jedne supstance u drugu. Ovo je osnova za odabir koeficijenata u jednadžbi hemijske reakcije, broj atoma svakog elementa u levom i desnom delu jednačine treba da bude jednak.
Zakon ekvivalentnosti - u hemijskim reakcijama supstance reaguju i nastaju u količinama jednakim ekvivalentu (Koliko se ekvivalenata jedne supstance potroši, potpuno isti ekvivalenti se troše ili formiraju od druge supstance).
Ekvivalent je količina supstance koja dodaje, zamenjuje, oslobađa jedan mol atoma H (jona) tokom reakcije. Ekvivalentna masa izražena u gramima naziva se ekvivalentna masa (E).
Zakoni o gasu
Daltonov zakon - ukupni pritisak mješavine plinova jednak je zbiru parcijalnih pritisaka svih komponenti plinske mješavine.
![]()
Avogadrov zakon - jednake zapremine različitih gasova pod istim uslovima sadrže jednak broj molekula.
Posljedica: jedan mol bilo kojeg plina u normalnim uvjetima (t=0 stepeni ili 273K i P=1 atmosfera ili 101255 Pascal ili 760 mmHg. Stub.) zauzima V=22,4 litara.
V koji zauzima jedan mol gasa naziva se molarni volumen Vm.
Poznavajući zapreminu gasa (gasne mešavine) i Vm pod datim uslovima, lako je izračunati količinu gasa (gasne mešavine) =V/Vm.
Mendeljejev-Klapejronova jednačina povezuje količinu gasa sa uslovima pod kojima se nalazi. pV=(m/M)*RT= *RT
Kada se koristi ova jednadžba, sve fizičke veličine moraju biti izražene u SI: p-pritisak gasa (pascal), V-zapremina gasa (litri), m- gasna masa (kg.), M-molarna masa (kg/mol), T - apsolutna temperatura (K), Nu-količina gasa (mol), R- gasna konstanta = 8,31 J / (mol * K).
D - relativna gustoća jednog plina u odnosu na drugi - omjer M plina i M plina, odabran kao standard, pokazuje koliko je puta jedan plin teži od drugog D \u003d M1 / M2.
Načini izražavanja sastava mješavine tvari.
Maseni udio W- omjer mase tvari i mase cijele smjese W = ((m in-va) / (m otopina)) * 100%
Molni udio æ - omjer broja in-va, prema ukupnom broju svih stoljeća. u smjesi.
Većina hemijskih elemenata u prirodi prisutna je kao mešavina različitih izotopa; znajući izotopski sastav hemijskog elementa, izražen u molskim frakcijama, izračunati ponderisanu prosečnu vrednost atomske mase ovog elementa, koja se prevodi u ISCE. A= Σ (æi*Ai)= æ1*A1+ æ2*A2+…+ æn*An , gdje je æi molski udio i-tog izotopa, Ai je atomska masa i-tog izotopa.
Zapreminski udio (φ) - omjer Vi i zapremine cijele smjese. φi=Vi/VΣ
Poznavajući volumetrijski sastav gasne mešavine, izračunava se Mav gasne mešavine. Mav= Σ (φi*Mi)= φ1*M1+ φ2*M2+…+ φn*Mn
Atom je najmanja čestica hemijske supstance koja je sposobna da zadrži svoja svojstva. Riječ "atom" dolazi od starogrčkog "atomos", što znači "nedjeljiv". U zavisnosti od toga koliko i koje čestice ima u atomu, možete odrediti hemijski element.
Ukratko o strukturi atoma
Kao što možete ukratko navesti osnovne informacije o čestici sa jednim jezgrom, koja je pozitivno naelektrisana. Oko ovog jezgra je negativno nabijen oblak elektrona. Svaki atom u svom normalnom stanju je neutralan. Veličina ove čestice može se u potpunosti odrediti veličinom elektronskog oblaka koji okružuje jezgro.
Samo jezgro se, pak, sastoji od manjih čestica - protona i neutrona. Protoni su pozitivno nabijeni. Neutroni nemaju naboj. Međutim, protoni se, zajedno s neutronima, kombiniraju u jednu kategoriju i nazivaju se nukleoni. Ako su osnovne informacije o strukturi atoma potrebne ukratko, onda se te informacije mogu ograničiti na navedene podatke..

Prve informacije o atomu
Činjenica da se materija može sastojati od malih čestica sumnjali su čak i stari Grci. Vjerovali su da se sve što postoji sastoji od atoma. Međutim, ovo gledište je bilo čisto filozofske prirode i ne može se tumačiti naučno.
Jedan engleski naučnik prvi je došao do osnovnih podataka o strukturi atoma, koji je bio u stanju da otkrije da dva hemijska elementa mogu da ulaze u različite omjere, a svaka takva kombinacija predstavljaće novu supstancu. Na primjer, osam dijelova elementa kisika stvara ugljični dioksid. Četiri dijela kiseonika su ugljični monoksid.
Dalton je 1803. otkrio takozvani zakon višestrukih odnosa u hemiji. Uz pomoć indirektnih mjerenja (pošto se tada ni jedan atom nije mogao ispitati pod tadašnjim mikroskopom), Dalton je zaključio o relativnoj težini atoma.

Rutherfordovo istraživanje
Gotovo stoljeće kasnije, osnovne informacije o strukturi atoma potvrdio je još jedan engleski hemičar - naučnik je predložio model elektronske ljuske najmanjih čestica.
U to vrijeme, Rutherfordov "Planetarni model atoma" bio je jedan od najvažnijih koraka koje je hemija mogla poduzeti. Osnovni podaci o strukturi atoma svjedočili su da je sličan Sunčevom sistemu: čestice-elektroni rotiraju oko jezgra po strogo određenim orbitama, baš kao što to rade planete.
Elektronska ljuska atoma i formule atoma hemijskih elemenata
Elektronska ljuska svakog od atoma sadrži tačno onoliko elektrona koliko ima protona u njegovom jezgru. Zato je atom neutralan. Godine 1913. drugi naučnik je dobio osnovne informacije o strukturi atoma. Formula Nielsa Bora bila je slična Rutherfordovoj. Prema njegovom konceptu, elektroni se također okreću oko jezgra smještenog u centru. Bohr je finalizirao Rutherfordovu teoriju, uveo sklad u njene činjenice.
Već tada su sastavljene formule nekih hemikalija. Na primjer, shematski je struktura atoma dušika označena kao 1s 2 2s 2 2p 3, a struktura atoma natrija izražena je formulom 1s 2 2s 2 2p 6 3s 1. Kroz ove formule možete vidjeti koliko se elektrona kreće u svakoj od orbitala određene kemikalije.

Schrödinger model
Međutim, tada je ovaj atomski model zastario. Osnovne informacije o strukturi atoma, danas poznate nauci, uveliko su postale dostupne zahvaljujući istraživanju austrijskog fizičara
Predložio je novi model njegove strukture - talasni. Do tog vremena, naučnici su već dokazali da je elektron obdaren ne samo prirodom čestice, već ima i svojstva talasa.
Međutim, Schrödinger i Rutherfordov model također ima neke opšte odredbe. Njihove teorije su slične po tome što elektroni postoje na određenim nivoima.
Takvi nivoi se takođe nazivaju elektronskim slojevima. Broj nivoa se može koristiti za karakterizaciju energije elektrona. Što je sloj viši, ima više energije. Svi nivoi se broje odozdo prema gore, tako da broj nivoa odgovara njegovoj energiji. Svaki od slojeva u elektronskoj ljusci atoma ima svoje podnivoe. U ovom slučaju, prvi nivo može imati jedan podnivo, drugi - dva, treći - tri i tako dalje (vidi gornje elektronske formule dušika i natrijuma).

Čak i manje čestice
U ovom trenutku, naravno, otkrivene su čak i manje čestice od elektrona, protona i neutrona. Poznato je da se proton sastoji od kvarkova. Postoje još manje čestice svemira - na primjer, neutrino, koji je sto puta manji od kvarka i milijardu puta manji od protona.
Neutrino je tako mala čestica da je 10 septiliona puta manja od, na primjer, Tyrannosaurus rexa. Sam tiranosaurus je isto toliko puta manji od cijelog vidljivog svemira.
Osnovni podaci o strukturi atoma: radioaktivnost
Oduvijek je bilo poznato da nijedna kemijska reakcija ne može promijeniti jedan element u drugi. Ali u procesu radioaktivne emisije, to se događa spontano.
Radioaktivnošću se naziva sposobnost jezgara atoma da se pretvore u druge jezgre - stabilnije. Kada su ljudi dobili osnovne informacije o strukturi atoma, izotopi bi u određenoj mjeri mogli poslužiti kao oličenje snova srednjovjekovnih alhemičara.
Prilikom raspada izotopa emituje se radioaktivno zračenje. Ovaj fenomen je prvi otkrio Becquerel. Glavni tip radioaktivnog zračenja je alfa raspad. Oslobađa alfa česticu. Postoji i beta raspad, u kojem se beta čestica izbacuje iz jezgra atoma, respektivno.
Prirodni i umjetni izotopi
Trenutno je poznato oko 40 prirodnih izotopa. Većina ih se nalazi u tri kategorije: uranijum-radij, torijum i aktinijum. Svi ovi izotopi se mogu naći u prirodi - u stijenama, tlu, zraku. No, osim njih, poznato je i oko hiljadu umjetno dobivenih izotopa koji se dobivaju u nuklearnim reaktorima. Mnogi od ovih izotopa se koriste u medicini, posebno u dijagnostici..

Proporcije unutar atoma
Ako zamislimo atom čija će veličina biti uporediva s veličinom međunarodnog sportskog stadiona, tada možemo vizualno dobiti sljedeće proporcije. Elektroni atoma na takvom "stadionu" će se nalaziti na samom vrhu tribina. Svaki će biti manji od glave igle. Tada će se jezgro nalaziti u središtu ovog polja, a njegova veličina neće biti veća od veličine zrna graška.
Ponekad se ljudi pitaju kako atom zaista izgleda. Zapravo, bukvalno ne liči ni na šta – ne iz razloga što se u nauci koriste nedovoljno dobri mikroskopi. Dimenzije atoma su u onim područjima gdje koncept "vidljivosti" jednostavno ne postoji.
Atomi su veoma mali. Ali koliko su zapravo male ove dimenzije? Činjenica je da najmanje zrno soli koje je ljudsko oko jedva vidljivo sadrži oko jedan kvintilion atoma.
Ako zamislimo atom takve veličine koji bi mogao stati u ljudsku ruku, onda bi pored njega bili virusi dugi 300 metara. Bakterije bi bile dugačke 3 km, a ljudska kosa debela 150 km. U ležećem položaju mogao je ići izvan granica zemljine atmosfere. A kada bi takve proporcije bile stvarne, onda bi ljudska kosa po dužini mogla doseći mjesec. Ovo je tako složen i zanimljiv atom, čije proučavanje naučnici nastavljaju proučavati do danas.
DEFINICIJA
Atom je najmanja hemijska čestica.
Raznolikost hemijskih jedinjenja je posledica različite kombinacije atoma hemijskih elemenata u molekule i nemolekularne supstance. Sposobnost atoma da uđe u hemijska jedinjenja, njegova hemijska i fizička svojstva određena su strukturom atoma. U tom smislu, za hemiju je od najveće važnosti unutrašnja struktura atoma i, prije svega, struktura njegove elektronske ljuske.
Modeli strukture atoma
Početkom 19. stoljeća D. Dalton je oživio atomističku teoriju, oslanjajući se na do tada poznate fundamentalne zakone hemije (stalnost sastava, višestruki omjeri i ekvivalenti). Prvi eksperimenti su izvedeni radi proučavanja strukture materije. Međutim, uprkos napravljenim otkrićima (atomi istog elementa imaju ista svojstva, a atomi drugih elemenata imaju različita svojstva, uveden je koncept atomske mase), atom se smatrao nedjeljivim.
Nakon dobijanja eksperimentalnih dokaza (kraj XIX - početak XX veka) o složenosti strukture atoma (fotoelektrični efekat, katoda i rendgensko zračenje, radioaktivnost), otkriveno je da se atom sastoji od negativno i pozitivno naelektrisanih čestica koje su u interakciji sa jedan drugog.
Ova otkrića su dala poticaj za stvaranje prvih modela strukture atoma. Predložen je jedan od prvih modela J. Thomson(1904) (Sl. 1): atom je predstavljen kao "more pozitivnog elektriciteta" s elektronima koji osciliraju u njemu.
Nakon eksperimenata sa α-česticama, 1911. Rutherford je predložio tzv planetarni model struktura atoma (slika 1), slična strukturi Sunčevog sistema. Prema planetarnom modelu, u centru atoma nalazi se vrlo malo jezgro sa nabojem Z e, čija je veličina otprilike 1.000.000 puta manja od veličine samog atoma. Jezgro sadrži gotovo cijelu masu atoma i ima pozitivan naboj. Elektroni se kreću po orbitama oko jezgra, čiji je broj određen nabojem jezgra. Vanjska putanja elektrona određuje vanjske dimenzije atoma. Prečnik atoma je 10 -8 cm, dok je prečnik jezgra mnogo manji -10 -12 cm.
Rice. 1 Modeli strukture atoma prema Thomsonu i Rutherfordu
Eksperimenti na proučavanju atomskih spektra pokazali su nesavršenost planetarnog modela strukture atoma, jer je ovaj model u suprotnosti sa linijskom strukturom atomskih spektra. Na osnovu Rutherfordovog modela, Ajnštajnove teorije svetlosnih kvanta i kvantne teorije zračenja, Planck Niels Bohr (1913.) formulisano postulate, koji sadrži atomska teorija(Sl. 2): elektron može rotirati oko jezgra ne u bilo kojoj, već samo u nekim određenim orbitama (stacionarnim), krećući se po takvoj orbiti, ne emituje elektromagnetnu energiju, zračenje (apsorpcija ili emisija kvanta elektromagnetnog energija) nastaje tokom prijelaza (skok) elektrona iz jedne orbite u drugu.

Rice. 2. Model strukture atoma prema N. Bohru
Akumulirani eksperimentalni materijal koji karakteriše strukturu atoma pokazao je da se svojstva elektrona, kao i drugih mikro-objekata, ne mogu opisati na osnovu koncepata klasične mehanike. Mikročestice se pokoravaju zakonima kvantne mehanike, što je postalo osnova za stvaranje savremeni model strukture atoma.
Glavne teze kvantne mehanike:
- energiju emituju i apsorbuju tela u odvojenim delovima - kvanti, pa se energija čestica naglo menja;
- elektroni i druge mikročestice imaju dualnu prirodu - ispoljava svojstva i čestica i talasa (dualizam čestica-talas);
— kvantna mehanika negira postojanje određenih orbita za mikročestice (nemoguće je odrediti tačan položaj elektrona koji se kreću, jer se oni kreću u prostoru u blizini jezgra, može se odrediti samo vjerovatnoća pronalaska elektrona u različitim dijelovima prostora).
Prostor u blizini jezgra, u kojem je vjerovatnoća pronalaska elektrona dovoljno visoka (90%), naziva se orbitalni.
kvantni brojevi. Paulijev princip. Pravila Klečkovskog
Stanje elektrona u atomu može se opisati pomoću četiri kvantni brojevi.
n je glavni kvantni broj. Karakterizira ukupnu energiju elektrona u atomu i broj energetskog nivoa. n poprima cjelobrojne vrijednosti od 1 do ∞. Elektron ima najmanju energiju pri n=1; sa povećanjem n - energije. Stanje atoma, kada su njegovi elektroni na takvim energetskim nivoima da je njihova ukupna energija minimalna, naziva se osnovno stanje. Stanja s višim vrijednostima nazivaju se uzbuđenim. Nivoi energije su označeni arapskim brojevima prema vrijednosti n. Elektroni se mogu rasporediti u sedam nivoa, stoga, u stvarnosti, n postoji od 1 do 7. Glavni kvantni broj određuje veličinu elektronskog oblaka i određuje prosječni radijus elektrona u atomu.
l je orbitalni kvantni broj. Karakteriše rezervu energije elektrona u podnivou i oblik orbitale (tabela 1). Prihvata cjelobrojne vrijednosti od 0 do n-1. l zavisi od n. Ako je n=1, onda je l=0, što znači da na 1. nivou postoji 1. podnivo.

ja je magnetski kvantni broj. Karakterizira orijentaciju orbitale u prostoru. Prihvata cjelobrojne vrijednosti od –l preko 0 do +l. Dakle, kada je l=1 (p-orbitala), m e poprima vrijednosti -1, 0, 1, a orijentacija orbitale može biti različita (slika 3).

Rice. 3. Jedna od mogućih orijentacija u p-orbitalnom prostoru
s je spin kvantni broj. Karakterizira vlastitu rotaciju elektrona oko ose. Uzima vrijednosti -1/2(↓) i +1/2 (). Dva elektrona u istoj orbitali imaju antiparalelne spinove.
Određuje se stanje elektrona u atomima Paulijev princip: atom ne može imati dva elektrona sa istim skupom svih kvantnih brojeva. Redoslijed punjenja orbitala elektronima je određen Pravila Klečkovskog: orbitale se popunjavaju elektronima uzlaznim redoslijedom zbira (n + l) za ove orbitale, ako je zbir (n + l) isti, tada se prva popunjava orbitala s nižom vrijednošću n.
Međutim, atom obično sadrži ne jedan, već nekoliko elektrona, a kako bi se uzela u obzir njihova međusobna interakcija, koristi se koncept efektivnog naboja jezgra - na elektron vanjskog nivoa djeluje naboj koji je manji od naboja jezgra, zbog čega unutrašnji elektroni štite vanjske.
Glavne karakteristike atoma: atomski radijus (kovalentni, metalni, van der Waalsov, jonski), afinitet prema elektronu, jonizacioni potencijal, magnetni moment.
Elektronske formule atoma
Svi elektroni atoma formiraju njegovu elektronsku ljusku. Prikazana je struktura elektronske ljuske elektronska formula, koji pokazuje distribuciju elektrona po energetskim nivoima i podnivoima. Broj elektrona u podnivou je označen brojem koji je napisan u gornjem desnom uglu slova koje označava podnivo. Na primjer, atom vodonika ima jedan elektron, koji se nalazi na s-podnivou 1. energetskog nivoa: 1s 1. Elektronska formula helijuma koji sadrži dva elektrona zapisuje se na sljedeći način: 1s 2.
Za elemente drugog perioda, elektroni ispunjavaju 2. energetski nivo, koji ne može sadržavati više od 8 elektrona. Prvo, elektroni ispunjavaju s-podnivo, zatim p-podnivo. Na primjer:
5 B 1s 2 2s 2 2p 1
Odnos elektronske strukture atoma sa pozicijom elementa u periodnom sistemu
Elektronska formula elementa određena je njegovom pozicijom u Periodnom sistemu D.I. Mendeljejev. Dakle, broj perioda odgovara elementima drugog perioda, elektroni ispunjavaju 2. energetski nivo, koji ne može sadržavati više od 8 elektrona. Prvo, elektroni ispunjavaju elemente drugog perioda, elektroni ispunjavaju 2. energetski nivo, koji ne može sadržavati više od 8 elektrona. Prvo, elektroni ispunjavaju s-podnivo, zatim p-podnivo. Na primjer:
5 B 1s 2 2s 2 2p 1
Za atome nekih elemenata uočen je fenomen "curenja" elektrona sa vanjskog energetskog nivoa na pretposljednji. Elektronsko klizanje se javlja u atomima bakra, hroma, paladija i nekih drugih elemenata. Na primjer:
24 Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
energetski nivo koji ne može sadržavati više od 8 elektrona. Prvo, elektroni ispunjavaju s-podnivo, zatim p-podnivo. Na primjer:
5 B 1s 2 2s 2 2p 1
Broj grupe za elemente glavnih podgrupa jednak je broju elektrona na vanjskom energetskom nivou, takvi elektroni se nazivaju valentnim elektronima (sudjeluju u formiranju kemijske veze). Valentni elektroni elemenata bočnih podgrupa mogu biti elektroni vanjskog energetskog nivoa i d-podnivoa pretposljednjeg nivoa. Broj grupe elemenata bočnih podgrupa III-VII grupa, kao i za Fe, Ru, Os, odgovara ukupnom broju elektrona u s-podnivou vanjskog energetskog nivoa i d-podnivou pretposljednji nivo
Zadaci:
Nacrtajte elektronske formule atoma fosfora, rubidijuma i cirkonija. Navedite valentne elektrone.
odgovor:
15 P 1s 2 2s 2 2p 6 3s 2 3p 3 Valentni elektroni 3s 2 3p 3
37 Rb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1 Valentni elektroni 5s 1
40 Zr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 2 5s 2 Valentni elektroni 4d 2 5s 2