Aldehidi i njihova hemijska svojstva
Aldehidi su one organske tvari čije molekule sadrže karbonilnu grupu vezanu za najmanje jedan atom vodika i ugljikovodični radikal.
Hemijska svojstva aldehida su unaprijed određena u njihovoj molekuli prisustvom karbonilne grupe. U tom smislu, reakcije adicije se mogu uočiti u molekulu karbonilne grupe.
Tako, na primjer, ako uzmete i prođete paru formaldehida zajedno sa vodonikom preko zagrijanog nikalnog katalizatora, tada će se dodati vodik i formaldehid će se reducirati u metil alkohol. Osim toga, polarna priroda ove veze također dovodi do takve reakcije aldehida kao što je dodavanje vode.
A sada pogledajmo sve karakteristike reakcija na dodavanje vode. Treba napomenuti da se atomu ugljika karbonilne grupe dodaje hidroksilna grupa, koja nosi djelomično pozitivan naboj zbog elektronskog para atoma kisika.

Kod ovog dodatka karakteristične su sljedeće reakcije:
Prvo dolazi do hidrogenacije i formiraju se primarni alkoholi RCH2OH.
Drugo, dodaju se alkoholi i formiraju se hemiacetali R-CH (OH) - OR. A u prisustvu hlorovodonika HCl, koji deluje kao katalizator, i uz višak alkohola, opažamo stvaranje acetala RCH (OR) 2;
Treće, dodaje se natrijum hidrosulfit NaHSO3 i formiraju se derivati hidrosulfitnih aldehida. Tokom oksidacije aldehida mogu se uočiti takve posebne reakcije kao što su interakcija s amonijačnim rastvorom srebrnog (I) oksida i sa bakar (II) hidroksidom i stvaranje karboksilnih kiselina.
Polimerizaciju aldehida karakteriziraju takve posebne reakcije kao što su linearna i ciklična polimerizacija.
Ako govorimo o hemijskim svojstvima aldehida, treba spomenuti i reakciju oksidacije. Takve reakcije uključuju reakciju "srebrnog ogledala" i reakciju semafora.
Neobičnu reakciju "srebrnog ogledala" možete promatrati provodeći zanimljiv eksperiment u učionici. Da biste to učinili, potrebna vam je čisto oprana epruveta u koju treba uliti nekoliko mililitara otopine amonijaka srebrnog oksida, a zatim u nju dodati četiri ili pet kapi formalina. Sljedeći korak u ovom eksperimentu je stavljanje epruvete u čašu tople vode i tada možete vidjeti kako se na zidovima epruvete pojavljuje sjajni sloj. Ova rezultujuća prevlaka je talog metalnog srebra.

A evo i takozvane "semaforske" reakcije:

Fizička svojstva aldehida
Sada počnimo gledati fizička svojstva aldehida. Koja svojstva imaju ove supstance? Treba napomenuti da su neki jednostavni aldehidi bezbojni plinovi, složeniji su u obliku tekućine, ali viši aldehidi su čvrste tvari. Što je veća molekularna težina aldehida, to je viša tačka ključanja. Tako, na primjer, propionaldehid dostiže tačku ključanja na 48,8 stepeni, ali propil alkohol ključa na 97,8 0C.
Ako govorimo o gustoći aldehida, onda je ona manja od jedinice. Na primjer, sirćetni i mravlji aldehid imaju tendenciju da se dobro otapaju u vodi, dok složeniji aldehidi imaju slabiju sposobnost rastvaranja.
Aldehidi, koji spadaju u najnižu kategoriju, imaju oštar i neprijatan miris, dok se čvrsti i nerastvorljivi u vodi, naprotiv, odlikuju prijatnim cvetnim mirisom.
Pronalaženje aldehida u prirodi
U prirodi se posvuda nalaze predstavnici različitih grupa aldehida. Prisutni su u zelenim dijelovima biljaka. Ovo je jedna od najjednostavnijih grupa aldehida, koja uključuje mravlji aldehid CH2O.
Postoje i aldehidi složenijeg sastava. Ove vrste uključuju vanilin ili grožđani šećer.
Ali budući da aldehidi imaju sposobnost da lako ulaze u sve vrste interakcija, imaju tendenciju oksidacije i redukcije, može se sa sigurnošću reći da su aldehidi vrlo sposobni za različite reakcije i stoga su izuzetno rijetki u svom čistom obliku. Ali njihovi derivati se mogu naći svuda, kako u biljnom tako i u životinjskom okruženju.

Primena aldehida
Grupa aldehida prisutna je u brojnim prirodnim supstancama. Njihova prepoznatljiva karakteristika, barem za mnoge od njih, je miris. Tako, na primjer, predstavnici viših aldehida imaju različite arome i dio su eteričnih ulja. Pa, kao što već znate, takva ulja su prisutna u cvjetnim, začinskim i mirisnim biljkama, voću i voću. Našli su široku upotrebu u proizvodnji industrijske robe i u proizvodnji parfema.
Alifatski aldehid CH3(CH2)7C(H)=O se može naći u eteričnim uljima citrusa. Takvi aldehidi imaju miris narandže, a koriste se u prehrambenoj industriji kao aroma, kao i u kozmetici, parfimeriji i kućnoj hemiji, kao miris.
Mravlja aldehid je bezbojni plin koji ima oštar, specifičan miris i lako je rastvorljiv u vodi. Takav vodeni rastvor formaldehida naziva se i formalin. Formaldehid je vrlo toksičan, ali se u medicini koristi u razrijeđenom obliku kao dezinficijens. Koristi se za dezinfekciju instrumenata, a njegov slab rastvor koristi se za pranje kože kod jakog znojenja.
Osim toga, formaldehid se koristi u štavljenju kože, jer ima sposobnost spajanja sa proteinskim supstancama koje su prisutne u koži.
U poljoprivredi se formaldehid dokazao u preradi zrna prije sjetve. Koristi se za proizvodnju plastike koja je toliko neophodna za tehnologiju i domaće potrebe.
Sirćetni aldehid je bezbojna tečnost koja ima miris trule jabuke i lako je rastvorljiva u vodi. Koristi se za proizvodnju octene kiseline i drugih tvari. No, budući da je otrovna supstanca, može izazvati trovanje organizma ili upalu sluznice očiju i dišnih puteva.
Organske droge
Proučavamo lijekove podijeljene u grupe prema hemijskoj klasifikaciji. Prednost ove klasifikacije je mogućnost da se identifikuju i proučavaju opšti obrasci u razvoju metoda za dobijanje lekova koji čine grupu, metode farmaceutske analize zasnovane na fizičkim i hemijskim svojstvima supstanci, uspostavljanje veze između hemijske strukture i farmakološko djelovanje.
Svi lijekovi se dijele na neorganske i organske. Neorganski se, pak, klasificiraju prema položaju elemenata u PS. A organski se dijele na derivate alifatskog, alicikličkog, aromatičnog i heterocikličkog niza, od kojih je svaki podijeljen na klase: ugljovodonici, halogeni derivati ugljovodonika, alkoholi, aldehidi, ketoni, kiseline, eteri, jednostavni i složeni itd.
ALIFATSKA JEDINJENJA KAO HP.
Preparati aldehida i njihovih derivata. Ugljikohidrati
Aldehidi
Ova grupa spojeva uključuje organske ljekovite tvari koje sadrže aldehidnu grupu, ili njihove funkcionalne derivate.
Opća formula:
Farmakološka svojstva
Uvođenje aldehidne grupe u strukturu organskog spoja daje mu narkotički i antiseptički učinak. U tome je djelovanje aldehida slično djelovanju alkohola. Ali za razliku od alkohola, aldehidna grupa povećava toksičnost spoja.
Faktori koji utječu na strukturu na farmakološko djelovanje :
produljenje alkil radikala povećava aktivnost, ali istovremeno se povećava toksičnost;
uvođenje nezasićene veze i halogena ima isti efekat;
stvaranje hidratiziranog oblika aldehida dovodi do smanjenja toksičnosti. Ali sposobnost stvaranja stabilnog hidratiziranog oblika očituje se samo u derivatima klora i aldehida. Dakle, formaldehid je protoplazmatski otrov, koristi se za dezinfekciju, acetaldehid i hloral se ne koriste u medicini zbog svoje visoke toksičnosti, a hloralhidrat je lijek koji se koristi kao hipnotik, sedativ.
Jačina narkotičkog (farmakološkog) djelovanja i toksičnosti rasla je od formaldehida do acetaldehida i klorala. Formiranje hidratiziranog oblika (kloral hidrata) može dramatično smanjiti toksičnost, uz održavanje farmakološkog učinka.
Po fizičkom stanju aldehidi mogu biti gasoviti (niske molekularne težine), tečnosti i čvrste materije. Niske molekularne težine imaju oštar neugodan miris, visoke molekularne težine - ugodan cvjetni.
Hemijska svojstva
U hemijskom smislu, to su vrlo reaktivne supstance, zbog prisustva karbonilne grupe u njihovoj molekuli.
Visoka reaktivnost aldehida se objašnjava:
a) prisustvo polarizovane dvostruke veze
b) dipolni moment karbonila
c) prisustvo djelomičnog pozitivnog naboja na atomu ugljika karbonila
σ -
σ + H
Dvostruka veza između C i O, za razliku od dvostruke veze između dva ugljika, snažno je polarizirana, budući da kisik ima mnogo veću elektronegativnost od ugljika, a gustoća elektrona π veze se pomjera prema kisiku. Ovako visoka polarizacija određuje elektrofilna svojstva ugljenika karbonilne grupe i njegovu sposobnost da reaguje sa nukleofilnim jedinjenjima (da uđe u nukleofilne reakcije adicije). Kiseonik grupe ima nukleofilna svojstva.
Karakteristične su reakcije oksidacije i nukleofilne adicije
I. Reakcije oksidacije.
Aldehidilako su oksidirani. Oksidacija aldehida u kiseline odvija pod uticajem kako jakai slabi oksidanti .
Mnogi metali - srebro, živa, bizmut, bakar - reduciraju se iz rastvora njihovih soli, posebno u prisustvu alkalija. Ovo razlikuje aldehide od drugih organskih spojeva sposobnih za oksidaciju - alkohola, nezasićenih spojeva, za čiju oksidaciju su potrebni jači oksidanti. Stoga se oksidacijske reakcije aldehida sa kompleksnim katjonima žive, bakra, srebra u alkalnom mediju mogu koristiti za dokazivanje autentičnosti aldehida.
I. 1 .Reakcijasa rastvorom srebrnog nitrata amonijaka (reakcija srebrnog ogledala) preporučuje FS za potvrdu autentičnosti supstanci sa aldehidnom grupom.Osnova je oksidacija aldehida u kiselinu i redukcija Ag+ u Ag↓.
AgNO 3 + 2NH 4 OH → NO 3 + 2H 2 O
NSON+ 2NO 3 + H 2 O → HCOONH 4 + 2Ag↓+ 2NH 4 NO 3 + NH 3
Formaldehid, oksidiran do amonijumove soli mravlje kiseline, reducira se u metalno srebro koje se taložina zidovima epruvete briljantna plaketa "ogledala" ili sivi sediment.

I. 2. Reakcijasa Fehlingovim reagensom (kompleksno jedinjenje bakra (II) sa kalijum-natrijumom soli vinske kiseline). Aldehidi redukuju jedinjenje bakra (II) u bakrov (I) oksid, formira se ciglocrveni talog. pripremljeno prije upotrebe).
Reagens za obaranje 1 - rastvor CuSO 4
Fellingov reagens 2 - alkalni rastvor kalijum-natrijumove soli vinske kiseline
Prilikom miješanja 1:1 reagensa za obaranje 1 i 2 formira se kompleksno jedinjenje plavog bakra (II) sa kalij-natrijum soli vinske kiseline:

plavo bojenje
Kada se aldehid doda i zagrije, plava boja reagensa nestaje, formira se međuprodukt - žuti talog bakar (I) hidroksida, koji se odmah raspada u crveni talog bakrenog (I) oksida i vode.
2KNa+ R- COH+2NaOH+ 2KOH→ R- COONa+4KNaC4H4O6 + 2 CuOH ↓ +H2O
2 CuOH ↓ →Cu 2 O ↓ + H2O
žuti precipitat cigla crveni precipitat

Udžbenici imaju drugačiju opću shemu reakcija
I. 3. Reakcijasa Nesslerovim reagensom (alkalni rastvor tetrajodomerkurata (II) kalijuma). Formaldehid reducira ion žive u metalnu živu - tamno sivi talog.
R-COH + K 2 +3KOH → R-COOK + 4KI + hg↓ + 2H2O
Šta su uopšte aldehidi? Odgovor na ovo pitanje nije tako jednostavan kao što se na prvi pogled čini. Pitajte iskusnog ljubitelja parfema o tome - najvjerovatnije će vam reći o sintetičkim materijalima neopisivog mirisa koji je miris učinio tako neobičnim, apstraktnim i inovativnim.
Hemičar ili čak običan učenik jedanaestog razreda koji je redovno pohađao časove hemije takođe neće mnogo razmišljati i reći da su aldehidi klasa organskih jedinjenja koja sadrži grupu -CHO, koja se naziva aldehidna grupa. Svi aldehidi imaju zajednička hemijska svojstva, kao što je lako oksidacija i formiranje odgovarajućih kiselina. Ovo je osnova reakcije srebrnog ogledala - sjetite se kada se epruveta zagrije i na površini stakla se pojavi sjajni metalni sloj. Riječ "aldehid", koju je skovao njemački hemičar Eustace von Liebig, je skraćenica alkohol dehidrogenatum,što znači " alkohol bez vodonika».
U trivijalnim nazivima aldehida često* (vidi fusnotu) ili je prisutna sama riječ "aldehid" ili sufiks -al , na primjer, "aldehid za knedle", "zhabaldehyde", "pokergal". Supstance kao što su vanilin i heliotropin su takođe aldehidi sa hemijske tačke gledišta. Općenito, parfimer u svom arsenalu ima ogromnu količinu aldehida s potpuno drugačijim mirisima: melonal miriše na dinju adoksal miriše na more i bjelanjak, citronellal- limunska trava, liral- đurđevak tripl- zelena trava. Tu su ciklamenaldehid, cinamaldehid, anis, kuma, mandarina.
Dobro, pitate, kakve veze Chanel ima s tim? Ako ima toliko aldehida i svi različito mirišu, šta je onda ta “aldehidna nota”, kako miriše i koji specifični aldehidi su uključeni u Chanel br. 5? Sjećate se Kharmsove "Anegdote iz života Puškina": "Puškin se zaljubio u Žukovskog i počeo ga prijateljski zvati Žukov"? Ono što parfimeri često prijateljski nazivaju samo aldehidima, zapravo, podvrsta i poseban slučaj: zasićeni alifatski ili takozvani masni aldehidi. Obično se nazivaju prema broju atoma ugljika u molekuli. Kod "aldehida C-7", odn heptanal, - sedam atoma ugljika, u "aldehidu C-10", dekanal, kao što možete pretpostaviti, deset.
Chanel br. 5 sadrži mješavinu aldehida " C-11 undecylic" ili "S-110"(nedekanalni) , "C-11 undecilenic"(10-nedecenalno) i S-12(dodekanal). Vrijedi napomenuti da su se aldehidi pojavili u sastavu parfema mnogo prije pojave ovog legendarnog mirisa [ Chanel br. 5 izašao je 1921. godine]. Mnogi istoričari parfimerije slažu se da su aldehidi prvi put upotrijebljeni u stvaranju, tačnije, u njegovom ponovnom izdanju iz 1905. godine, koje je kreirao parfimer Pierre Armigeant. Aldehida ima i u (1912) iu Bouquet de Catherine (1913) moskovske fabrike Alphonse Rallet & Co, koju je, kao i Chanel br. 5, kreirao parfimer Ernest Bo (inače, rođeni Moskovljanin). Ali Chanel je nesumnjivo postao glavni aldehidni miris svih vremena i naroda, što je dovelo do ogromnog broja imitacija i kopija.

Masne aldehide objedinjuje karakterističan voštani miris, sličan mirisu ugašene svijeće (zapravo, ovaj miris svijeće nastaje zbog masnih aldehida, proizvoda nepotpunog sagorijevanja parafina). Miris masnih aldehida je veoma intenzivan i oštar, postaje prijatan kada se razblaži na 1% ili manje. Miris dekanala (C-10) ima prizvuk poletnosti, miris aldehida C-12 ima nijanse ljiljana i ljubičica. Kod najjednostavnijih aldehida, formaldehida i acetaldehida, miris je izuzetno oštar i prilično neugodan (ipak, aromatisti koriste čak i acetaldehid koji je uključen u neke aditive za okus), u heksanalu (C-6 aldehid) već se može razlikovati relativno ugodno zeleno i aspekti jabuke. Masni aldehidi, koji imaju 15 ili više atoma ugljika u lancu, već su gotovo bez mirisa.
Miris masnih aldehida ima još jedno zajedničko svojstvo - određenu "sapunavost". Aldehidi se dugo aktivno koriste za mirise sapuna zbog svoje niske cijene, intenziteta mirisa i sposobnosti da dobro prikriju neugodne mirise na bazi sapuna. Često se miris aldehida povezuje sa apstraktnom čistoćom ili osjećajem svježe ispeglanog rublja.

Još jedna važna stvar na koju vrijedi obratiti posebnu pažnju je da aldehidi nisu nešto umjetno, već rezultat ljudskog rada. Mnogi od njih su široko rasprostranjeni u prirodi. Decanal se, na primjer, nalazi u eteričnim uljima agruma (do 4% u narandži!), četinara i mnogih cvjetnih biljaka, a dosta ga ima i u eteričnom ulju korijandera. Nezasićeni alifatski aldehidi su također sveprisutni u prirodi, imaju još intenzivniji miris, na primjer, (E)-2-decenal je odgovoran za karakterističan miris cilantra, zaista je često prisutan u "hemijskom oružju" stjenica, a derivat epoksida, trans-4,5-epoksi-(E)-2-decenal, izaziva karakterističan miris krvi, koji mu daje izražen metalni izgled. Po mirisu ove supstance grabežljivci prate svoj plijen.
Nakon uspjeha prvih cvjetno-aldehidnih mirisa, kemičari su neumorno radili na sintetiziranju novih materijala sa sličnim mirisnim svojstvima. Godine 1905. Francuzi E.E. Blaise i L. Huillon (Bull.Soc.Chim.Fr. 1905, 33, 928) sintetizirali su gama-undekalakton, nešto kasnije, 1908., sličan rad su objavila dva ruska hemičara A.A. Žukov i P.I. Šestakov (ZhRHO 40, 830, 1908). Ovaj spoj je imao zanimljivu aromu, koja je podsjećala na miris zrele breskve zagrijane na suncu - voćni, voštani i pomalo kokosovo-kremasti.
Proizvođači su odlučili da ovu supstancu prodaju pod nazivom "aldehid C-14" kako bi zadovoljili žeđ parfimera za novim "aldehidima sa brojevima" s jedne strane, as druge strane kako bi doveli u zabludu konkurenciju, jer zapravo od hemijske tačke gledišta, to nije bio aldehid. , već lakton (ciklički estar), a atoma u molekuli ovog jedinjenja nije 14, već 11. Kao u šali, „ne u šahu, već u preferenciji , nisam pobedio, ali sam izgubio.”

Takozvani "aldehid C-14" debitovao je u Guerlain Mitsouko sa velikim uspehom 1919. godine, a nešto kasnije pojavili su se novi slični materijali: "aldehid C-16 (jagoda)", "aldehid C-18 (kokos) ", "aldehid C-20 (grimizno)" i neke druge. Tako ispada da je, s jedne strane, skoro svaka treća mirisna tvar aldehid, a s druge strane neki od najvažnijih aldehida uopće nisu aldehidi.
* Hemičari koriste nekoliko vrsta imena. Prvi tip je sistematski, ili nomenklaturni. Naziv nomenklature je neka vrsta šifre, algoritma, zahvaljujući kojem je moguće rekreirati strukturu tvari, odnosno razumjeti koji su atomi i kako su povezani unutar molekule. Svako ime odgovara jednoj strukturi i obrnuto - za svaku supstancu postoji samo jedan naziv nomenklature. Aldehidi, prema nomenklaturi, moraju imati sufiks "al". Jedini, ali vrlo značajan nedostatak takvih imena je njihova glomaznost. Na primjer, iso e super o kojem se prošli put raspravljalo, prema pravilima nomenklature, trebalo bi da se zove „1-(1,2,3,4,5,6,7,8-oktahidro-2,3,8,8, -tetrametil-2-naftil )etanon-1". Teško je zamisliti u šta bi se pretvorila svakodnevica laboratorija da su hemičari koristili samo nazive po nomenklaturi („Vasilije, molim te dodaj tu bocu cis-3-dimetilmetoksi...”).
Iz tog razloga se češće koriste trivijalni nazivi. Trivijalno ime je, takoreći, nadimak, nadimak neke supstance. Ne govori nam ništa o strukturi i strukturi, ali je kratak i nezaboravan. Vanilin, diklorvos, promedol, paraben - sve su to trivijalni nazivi. Različite kompanije mogu izdati isto jedinjenje pod različitim imenima, obično se takvi nazivi nazivaju zaštitni znakovi. 2acetiloksibenzojeva kiselina je naziv po nomenklaturi, acetilsalicilna kiselina je trivijalna, a aspirin je robna marka. Proizvođači sintetičkih mirisa vole davati svojim materijalima svijetla, zvučna imena. Često se aldehidi (sa hemijske tačke gledišta) imenuju sa sufiksom "al" na kraju. Ali znajući ljubav parfimera prema aldehidima, ponekad se imena sa "al" daju tvarima koje su nešto sasvim drugo. Na primjer, Clonal, proizvod iz IFF-a, zapravo je nitril, a Mystikal, zarobljeni materijal iz Givaudana, je karboksilna kiselina. U suštini isti trik kao sa "aldehidom C-14".
JEDINJENJA KOJA SADRŽE KISENIK
KARBONILNA JEDINJENJA
ALDEHID I
Organska jedinjenja čije molekule sadrže karbonilnu grupunazivaju se karbonilna jedinjenja. Ovisno o prirodi supstituenata povezanih s karbonilnom grupom, karbonilni spojevi se dijele na aldehide, ketone, karboksilne kiseline i njihove funkcionalne derivate.
ALDEHIDI
Aldehidi su organska jedinjenja koja sadrže karbonilnu grupu u kojoj je atom ugljika vezan za radikal i jedan atom vodika, odnosno opću formulu aldehida. Izuzetak je mravlji aldehid., u kojem, kao što se može vidjeti,R= H.
izomerizam
Aldehide karakterizira izomerija ugljikovodičnih radikala, koji mogu imati i normalan (nerazgranati) lanac i razgranati, kao i međuklasna izomerija sa ketonima. Na primjer ,
|
O |
O |
O |
|
|
butirni aldehid |
izobutirna |
metil etil keton ili |
|
Potvrda
1.
Najčešće korištene metode za dobivanje aldehida su oksidacija i katalitička dehidrogenacija primarnih alkohola.
a) Oksidacija primarnih alkohola.
Kao što se može vidjeti, daljom oksidacijom nastaju kiseline. Ove reakcije su već date kada se razmatraju hemijska svojstva alkohola.
b) Dehidrogenacija primarnih alkohola. Reakcija se izvodi propuštanjem alkoholne pare zagrijane na 200-300°C° Sa katalizatorom koji koristi bakar, nikl, kobalt itd.
2. Razvijena je metoda za proizvodnju acetaldehida oksidacijom etilena atmosferskim kisikom u prisustvu soli bakra i paladija.
3. Sirćetni aldehid se dobija hidratacijom acetilena prema Kučerovskoj reakciji.
|
O |
||
|
HC º CH + H 2 O –– HgSO 4 ® –– ® CH 3 –C |
||
|
|
I |
Reakcija Kučerova je već detaljno razmatrana prilikom proučavanja hemijskih svojstava acetilenskih ugljovodonika.
4. Aldehidi se dobijaju hidrolizom dihalogenih derivata ugljovodonika, ali samo onih kod kojih se oba atoma halogena nalaze na jednom od terminalnih atoma ugljenika.
|
CH 3 -CH 2 - |
2H 2 O ® + 2 HCl |
|||
|
1,1-dihloropropan |
1,1-propandiol |
|||
Kada voda djeluje na dihaloalkil u alkalnoj ili kiseloj sredini, njena reakcija hidrolize prolazi kroz fazu formiranja dihidričnog alkohola koji sadrži dvije hidroksilne grupe na jednom atomu ugljika.
Takvi alkoholi zbog svoje nestabilnosti u trenutku stvaranja gube vodu i formiraju aldehide.
Physical Properties
Najjednostavniji aldehid formic - gas vrlo oštrog mirisa. Ostali niži aldehidi su tečnosti koje su lako rastvorljive u vodi. Aldehidi imaju zagušljiv miris, koji uz ponovljeno razrjeđivanje postaje prijatan, podsjećajući na miris voća. Aldehidi ključaju na nižoj temperaturi od alkohola sa istim brojem atoma ugljika. to c zbog odsustva vodoničnih veza u aldehidima. Istovremeno, tačka ključanja aldehida je viša od one ugljikovodika koja odgovara molekularnoj težini, što je povezano s visokim polaritetom aldehida.
Fizička svojstva nekih aldehida prikazana su u tabeli.
Table . Fizička svojstva nekih aldehida
|
Ime |
Formula |
t° ključanja, |
t° kvadrat, |
d4 20 |
|
Formic |
O |
92,0 |
21,0 |
0,815 |
|
Acetic |
O |
123,5 |
21,0 |
0,780 |
|
propionska |
O |
102,0 |
48,8 |
0,807 |
|
Ulje |
O |
99,0 |
75,7 |
0,817 |
|
izobutirna |
O |
65,9 |
64,0 |
0,794 |
Hemijska svojstva
Aldehide karakteriše visoka reaktivnost. Većina njihovih reakcija je zbog prisustva karbonilne grupe. Atom ugljika u karbonilnoj grupi je u stanju sp2- hibridizacija i forme tri s - veze (jedna od njih je veza C–O ), koji se nalaze u istoj ravni pod uglom od 120° jedni prema drugima.

Shema strukture karbonilne grupe
Dvostruka veza karbonilne grupe je po fizičkoj prirodi slična dvostrukoj vezi između atoma ugljika, tj. s- i str - veze, od kojih posljednju formiraju p-elektroni atoma ugljika i kisika. Zbog veće elektronegativnosti atoma kisika u odnosu na atom ugljika, veza C=O jako polarizirana zbog pomaka elektronske gustine str - vezuje se za atom kiseonika, usled čega je delimično negativan ( d-) , a na atomu ugljika - djelomično pozitivno ( d + ) naplaćuje: .
Zbog polarizacije, atom ugljika karbonilne grupe ima elektrofilna svojstva i može reagirati s nukleofilnim reagensima. Najvažnije reakcije aldehida su reakcije nukleofilne adicije na dvostrukoj vezi karbonilne grupe.
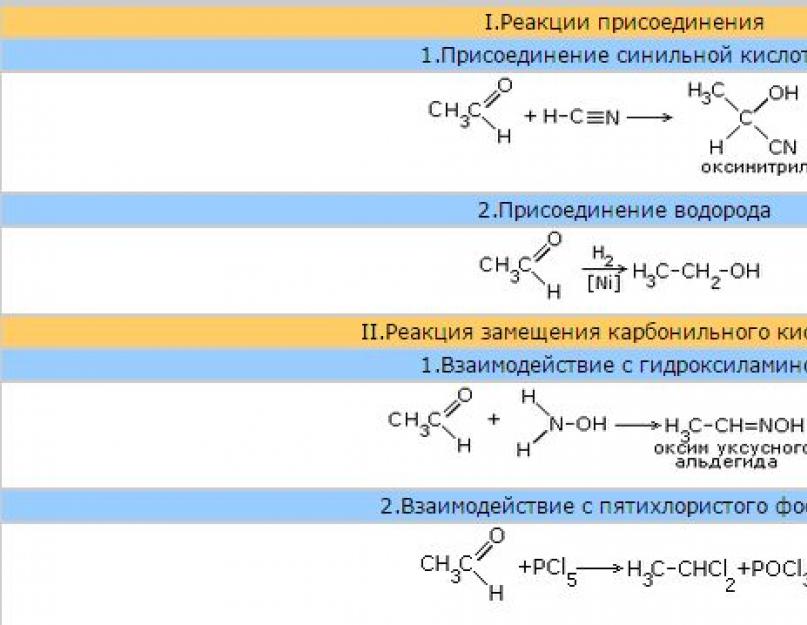
1. Jedna od tipičnih nukleofilnih reakcija adicije aldehidaje dodatak cijanovodonične (cijanovodonične) kiseline dovodi do formiranja a - oksinitrili.
Ova reakcija se koristi za produžavanje lanca ugljika i proizvodnju a - hidroksi kiseline.
2.
Dodatak natrijum hidrosulfitadaje kristalne supstance koje se obično nazivaju hidrosulfitnim derivatima aldehida.
Spomenuti derivati se lako hidroliziraju u bilo kojoj sredini, što dovodi do originalnog karbonilnog spoja. Dakle, kada se zagrije s otopinom sode, formira se hidrosulfitni derivat acetaldehida, sam acetaldehid.
Ovo svojstvo se koristi za pročišćavanje aldehida i njihovo izolovanje iz mješavina.
3.
Dodatak alkoholado aldehida dovodi do stvaranja hemiacetala - spojeva,u kojoj je atom ugljika vezan i za hidroksil (–OH) i za alkoksi (–O R ) grupe.
Kada se hemiacetali tretiraju viškom alkohola u kiseloj sredini, nastaju acetali - spojevi u kojima je atom ugljika vezan za dvije alkoksi grupe (reakcija nalikuje sintezi etera iz alkohola).
Za razliku od etera, acetale hidroliziraju kiseline dajući alkohol i aldehid.
4. Dodatak vodonikado aldehida se vrši u prisustvu katalizatora ( Ni, Co, Pd itd.) i dovodi do stvaranja primarnih alkohola.
Litijum aluminijum hidrid se sve više koristi kao redukciono sredstvo. LiAlH 4 i natrijum borohidrid NaBH4.
Osim reakcija adicije na karbonilnoj grupi, aldehide karakteriziraju i reakcije oksidacije.
5. Oksidacija . Aldehidi se lako oksidiraju i formiraju odgovarajuće karboksilne kiseline.
a) rastvor amonijaka srebrnog oksida[ Ag (NH 3 ) 2 ] OH kada se zagrije s aldehidima, oksidira aldehid u kiselinu (u obliku njegove amonijeve soli) sa stvaranjem slobodnog metalnog srebra. Redukovano srebro se taloži u tankom sloju na zidove hemijske posude u kojoj se odvija reakcija i dobija se srebrno ogledalo. Ova reakcija, koja se stoga naziva "srebrno ogledalo", služi kao kvalitativna reakcija na aldehide.
b) Druga karakteristična reakcija je oksidacija aldehida bakrenim hidroksidom ( II).
Kada se plavi bakar hidroksid zagreje ( II ) sa rastvorom acetaldehida, crvenim talogom bakrovog oksida ( I ). U ovom slučaju, acetaldehid se oksidira u octenu kiselinu, a bakar s oksidacijskim stanjem +2 reducira se u bakar s oksidacijskim stanjem +1. Među aldehidima posebno mjesto zauzima mravlji aldehid (formaldehid). Zbog odsustva mravljeg aldehidnog radikala, ima neka specifična svojstva. Oksidacija formaldehida se, na primjer, provodi do ugljičnog dioksida CO 2 .
Formaldehid se lako polimerizira u ciklične i linearne polimere. Dakle, u kiseloj sredini formira ciklički trimer - trioksimetilen.
Suvi gasoviti formaldehid u prisustvu katalizatora formira poliformaldehid visoke molekularne težine. Polimerizacija formaldehida liči na polimerizaciju alkena.
|
O –– kat® |
H |
H |
|
…–H 2 C–O (H 2 C–O) n H 2 C–O–… |
U vodenim rastvorima, formaldehid formira polimer koji se naziva paraform.
n CH 2 \u003d O + H 2 O ® HOCH 2 ( OCH 2 ) n-2 OCH 2 OH
(paraforma)
Od posebne je praktične važnosti reakcija polikondenzacije formaldehida sa fenolom da se formiraju fenol-formaldehidne smole. Pod djelovanjem alkalnih ili kiselih katalizatora na mješavinu fenola i formaldehida dolazi do kondenzacije u orto i para pozicijama.
Rast molekula uslijed kondenzacije fenola s formaldehidom odvija se pri normalnoj temperaturi u linearnom smjeru.
|
|
CH2OH |
||||
itd.
Ukupno, reakcija polikondenzacije fenola s formaldehidom može se predstaviti na sljedeći način:
|
O+(n+1) |
katalizator |
|
NH2O |
||||
|
–––––––– ® |
Fenol-formaldehidne smole su prve industrijske sintetičke smole, čija je proizvodnja pod nazivom "bakelit" prvi put započela 1909. godine. Fenol-formaldehidne smole se koriste u proizvodnji raznih plastičnih masa. U kombinaciji s raznim punilima, takve plastike nazivaju se fenolima. Osim toga, fenol-formaldehidne smole se koriste u proizvodnji raznih ljepila i lakova, termoizolacijskih materijala, drvene plastike, kalupa itd.
Aplikacija
Mnogo je već rečeno o upotrebi formaldehida. Osim toga, koristi se za dobijanje urea smola interakcijom sa ureom, na osnovu kojih se proizvodi plastika koja je neophodna za potrebe elektrotehnike. Otopine formaldehida (formalina) koriste se u kožnoj industriji za štavljenje kože, za dezinfekciju žitnih i povrtarskih skladišta, plastenika, legla, za doradu sjemena prije sjetve, za skladištenje anatomskih preparata, kao i u proizvodnji određenih lijekova.
Sirćetni aldehid je sirovina za proizvodnju octene kiseline, anhidrida octene kiseline, etil alkohola, etil acetata i drugih vrijednih proizvoda u industrijskim razmjerima, te raznih sintetičkih smola kada se kondenziraju s aminima i fenolima.
KETONI
Ketoni su spojevi u kojima je karbonilna grupa vezana za dva ugljikovodična radikala. Opća formula ketona, gdje je R može odgovarati sa R".
izomerizam
Ketone karakterizira izomerija ugljikovodičnih radikala, izomerija položaja karbonilne grupe i međuklasna izomerija s aldehidima.
Potvrda
Gotovo sve metode pripreme aldehida (vidi "") su također primjenjive na ketone.
1. Oksidacija sekundarnih alkohola.
2. Dehidrogenacija sekundarnih alkohola.
3. Hidratacija homologa acetilena (reakcija Kučerova).
4. Hidroliza dihalogeniranih ugljovodonikakoji sadrži oba atoma halogena na jednom od srednjih atoma ugljika u lancu.
|
CH 3 - |
Cl |
||
|
CH 3 - |
O |
5.
Ketoni se također dobijaju pirolizom kalcijevih soli karboksilnih kiselina kada se zagrijavaju.O
II
CH 3 -C
I
O
Physical Properties
Niži ketoni su tečnosti koje su lako rastvorljive u vodi. U principu, ketoni imaju ugodan miris, koji podsjeća na miris cvijeća. Poput aldehida, ketoni ključaju na nižoj temperaturi od odgovarajućih alkohola, ali višoj od ugljikovodika. Fizička svojstva nekih ketona prikazana su u tabeli.
Table. Fizička svojstva nekih ketona
|
Ime |
Formula |
t° kvadrat, |
t° ključanja, |
d4 20 |
|
Aceton (dimetil keton) 42,0 |
102,7 |
0,816 |
Hemijska svojstva
Kao i aldehidi, ketoni su vrlo reaktivni. Hemijska aktivnost aldehida i ketona je veća, što je veći pozitivni naboj na atomu ugljika karbonilne grupe. Radikali koji povećavaju ovaj pozitivni naboj naglo povećavaju reaktivnost aldehida i ketona, dok radikali koji smanjuju pozitivni naboj imaju suprotan učinak. U ketonima, dvije alkilne grupe doniraju elektrone, što pokazuje zašto su ketoni manje aktivni u reakcijama nukleofilne adicije u odnosu na aldehide.
Primjeri reakcija ovog tipa za aldehide su detaljno razmatrani ranije (vidi ""), stoga ćemo, dajući neke primjere reakcija nukleofilne adicije na karbonilnoj grupi ketona, obratiti pažnju samo na razlike u njihovim kemijskim svojstvima od aldehida.
1. Pristupanje cijanovodonične kiseline.
|
R |
Oh |
Treba napomenuti da samo metil ketoni reaguju sa natrijum hidrosulfitom, odnosno ketoni koji imaju grupisanje CH3.
3.
U poređenju sa aldehidima, ketoni ne reaguju sa alkoholima.
4. Dodatak vodonika. Dodatak vodonika ketonima dovodi do stvaranja sekundarnih alkohola.
5. Ketone je mnogo teže oksidirati od aldehida. Kiseonik zraka i slabi oksidanti ne oksidiraju ketone. Ketoni ne daju reakciju "srebrnog ogledala" i ne reaguju sa bakar hidroksidom ( II ). Pod dejstvom jakih oksidacionih sredstava u teškim uslovima, ugljični lanac molekula ketona se uništava u blizini karbonilne grupe i nastaju kiseline (ponekad ketoni, zavisno od strukture originalnog ketona) sa manjim brojem atoma ugljika.
|
|
|
|
Aplikacija
Aceton, najjednostavniji predstavnik ketona, ima najširu industrijsku primjenu. Aceton je vrijedan rastvarač koji se koristi u industriji boja i lakova, u proizvodnji rajona, filma i bezdimnog praha. Takođe služi kao sirovina u proizvodnji metakrilne kiseline, metil metakrilata (proizvodnja nelomljivog organskog stakla), metil izobutil ketona, itd.
KRAJ SEKCIJE
Struktura aldehida i ketona

Aldehidi- organske supstance čije molekule sadrže karbonilnu grupu:

vezan za atom vodika i ugljikovodični radikal. Opća formula za aldehide je:

U najjednostavnijem aldehidu, ulogu ugljikovodičnih radikala igra drugi atom vodika:
 Formaldehid
Formaldehid Karbonilna grupa vezana za atom vodika često se naziva aldehid:

Ketoni su organske tvari u čijim je molekulima karbonilna grupa vezana za dva ugljikovodična radikala. Očigledno, opšta formula za ketone je:

Karbonilna grupa ketona se naziva keto grupa.
U najjednostavnijem ketonu, acetonu, karbonilna grupa je vezana za dva metil radikala:

Nomenklatura i izomerizam aldehida i ketona
U zavisnosti od strukture ugljikovodičnih radikala povezanih s aldehidnom grupom, postoje zasićeni, nezasićeni, aromatični, heterociklični i drugi aldehidi:
U skladu s IUPAC nomenklaturom, nazivi zasićenih aldehida formiraju se od imena alkana s istim brojem atoma ugljika iz molekule pomoću sufiksa -al. Na primjer:
Numeracija atomi ugljika glavnog lanca počinju od atoma ugljika aldehidne grupe. Stoga se aldehidna grupa uvijek nalazi na prvom atomu ugljika i nije potrebno naznačiti njen položaj.
Uz sistematsku nomenklaturu, koriste se i trivijalni nazivi široko rasprostranjenih aldehida. Ova imena obično potiču od imena karboksilnih kiselina koje odgovaraju aldehidima.
Za naslov ketoni prema sistematskoj nomenklaturi, keto grupa se označava sufiksom -on i broj koji označava broj atoma ugljika karbonilne grupe (numeracija treba da počne od kraja lanca najbližeg keto grupi).
Na primjer:
Za aldehidi karakterističan je samo jedan tip strukturne izomerije - izomerija ugljeničnog skeleta, što je moguće sa butanalom, i za ketoni- takođe izomerija karbonilnog položaja. Osim toga, oni su također karakterizirani međuklasni izomerizam(propanal i propanon).
Fizička svojstva aldehida i ketona

U molekuli aldehida ili ketona, zbog veće elektronegativnosti atoma kisika u odnosu na atom ugljika, veza C=O je visoko polarizovan zbog pomaka elektronske gustine π-veze na kisik:

Aldehidi i ketoni polarne supstance sa viškom elektronske gustine na atomu kiseonika. Niži članovi niza aldehida i ketona (formaldehid, acetaldehid, aceton) su beskonačno rastvorljivi u vodi. Njihove tačke ključanja su niže od onih kod odgovarajućih alkohola. To je zbog činjenice da u molekulama aldehida i ketona, za razliku od alkohola, nema mobilnih atoma vodika i ne formiraju asocijacije zbog vodikovih veza.
Niži aldehidi imaju oštar miris; aldehidi koji sadrže od četiri do šest atoma ugljika u lancu imaju neugodan miris; viši aldehidi i ketoni imaju cvjetni miris i koriste se u parfimeriji.
Prisustvo aldehidne grupe u molekulu određuje karakteristična svojstva aldehida.
reakcije oporavka.
1. Dodatak vodonika na molekule aldehida nastaje na dvostrukoj vezi u karbonilnoj grupi:

Produkt hidrogenacije aldehida su primarni alkoholi, ketoni su sekundarni alkoholi.
Dakle, kada se acetaldehid hidrogeniše na nikalnom katalizatoru, nastaje etil alkohol, a kada se hidrogeniše aceton, nastaje propanol-2.

2. Hidrogenacija aldehida- reakcija redukcije, u kojoj se smanjuje stupanj oksidacije atoma ugljika uključenog u karbonilnu grupu.
Reakcije oksidacije.
Aldehidi se ne mogu samo reducirati, već i oksidirati. Kada se oksidiraju, aldehidi stvaraju karboksilne kiseline. Šematski se ovaj proces može predstaviti na sljedeći način:

1. Oksidacija atmosferskim kiseonikom. Na primjer, propionska kiselina nastaje iz propionaldehida (propanal):

2. Oksidacija slabim oksidantima(rastvor amonijaka srebrnog oksida). U pojednostavljenom obliku, ovaj proces se može izraziti jednadžbom reakcije:

Na primjer:

Tačnije, ovaj proces se ogleda u jednadžbama:

Ako je površina posude u kojoj se odvija reakcija prethodno odmašćena, tada je srebro nastalo tokom reakcije prekriva ravnomjernim tankim filmom. Stoga se ova reakcija naziva reakcija "srebrnog ogledala". Široko se koristi za izradu ogledala, posrebrenih ukrasa i božićnih ukrasa.
3. Oksidacija sa svježe istaloženim bakar (II) hidroksidom. Oksidirajući aldehid, Cu 2+ se redukuje u Cu +. Bakar (I) hidroksid CuOH koji nastaje tokom reakcije odmah se razlaže na crveni bakar (I) oksid i vodu.

Ova reakcija, kao reakcija srebrno ogledalo“, koristi se za detekciju aldehida.
Ketoni se ne oksidiraju ni atmosferskim kisikom ni tako slabim oksidacijskim sredstvom kao što je amonijačna otopina srebrnog oksida.
Hemijska svojstva aldehida i kiselina - sažetak


Pojedinačni predstavnici aldehida i njihovo značenje
Formaldehid(metanal, mravlji aldehid HCHO) je bezbojni plin oštrog mirisa i točke ključanja od -21°C, lako se otopi u vodi. Formaldehid je otrovan! Otopina formaldehida u vodi (40%) naziva se formalin i koristi se za formaldehidnu i octenu dezinfekciju. U poljoprivredi se formalin koristi za doradu sjemena, u kožnoj industriji - za preradu kože. Za proizvodnju se koristi formaldehid urotropin- lekovita supstanca. Ponekad se komprimiran u obliku briketa, urotropin koristi kao gorivo (suhi alkohol). Velika količina formaldehida se troši u proizvodnji fenol-formaldehidnih smola i nekih drugih supstanci.
Sirćetni aldehid(etanal, acetaldehid CH 3 CHO) - tečnost oštrog, neprijatnog mirisa i tačke ključanja od 21 ° C, dobro ćemo rastvoriti u vodi. Sirćetna kiselina i niz drugih tvari dobivaju se iz acetaldehida u industrijskim razmjerima, koristi se za proizvodnju raznih plastičnih i acetatnih vlakana. Sirćetni aldehid je otrovan!

Grupa atoma -

pozvao karboksilnu grupu, ili karboksil.
Organske kiseline koje sadrže jednu karboksilnu grupu u molekulu su jednobazni.
Opća formula za ove kiseline je RCOOH, na primjer:

Karboksilne kiseline koje sadrže dvije karboksilne grupe nazivaju se dibasic. To uključuje, na primjer, oksalnu i jantarnu kiselinu:

Postoje također polybasic karboksilne kiseline koje sadrže više od dvije karboksilne grupe. To uključuje, na primjer, trobazičnu limunsku kiselinu:

U zavisnosti od prirode ugljikovodičnih radikala, karboksilne kiseline se dijele na marginalni, nezasićeni, aromatični.
ograničavajući, ili zasićene, karboksilne kiseline su, na primjer, propanoična (propionska) kiselina:

ili nam već poznata jantarna kiselina.
Očigledno, zasićene karboksilne kiseline ne sadrže π-veze u ugljikovodičnom radikalu.
U molekulima nezasićenih karboksilnih kiselina, karboksilna grupa je vezana za nezasićeni, nezasićeni ugljikovodični radikal, na primjer, u akrilnim (propenskim) molekulima
CH 2 \u003d CH-COOH
ili oleinska
CH 3 -(CH 2) 7 -CH \u003d CH-(CH 2) 7 -COOH
i druge kiseline.
Kao što se može vidjeti iz formule benzojeve kiseline, to je aromatično, budući da sadrži aromatični (benzenski) prsten u molekuli:


Naziv karboksilne kiseline nastaje od naziva odgovarajućeg alkana (alkana s istim brojem ugljikovih atoma u molekuli) uz dodatak sufiksa -ov— , kraj -i ja i riječi kiselina. Numeracija atoma ugljika počinje karboksilnom grupom. Na primjer:

Broj karboksilnih grupa je u nazivu naznačen prefiksima di-, tri-, tetra-:
Mnoge kiseline također imaju povijesno razvijena, ili trivijalna, imena.
Sastav graničnih jednobaznih karboksilnih kiselina biće izražen općom formulom C n H 2n O 2, ili C n H 2n+1 COOH, ili RCOOH.
Fizička svojstva karboksilnih kiselina
Niže kiseline, odnosno kiseline s relativno malom molekulskom težinom, koje sadrže do četiri atoma ugljika u molekulu, su tekućine karakterističnog oštrog mirisa (na primjer, miris octene kiseline). Kiseline koje sadrže od 4 do 9 atoma ugljika su viskozne uljne tekućine s neugodnim mirisom; koji sadrže više od 9 atoma ugljika u molekuli - čvrste tvari koje se ne otapaju u vodi. Tačke ključanja graničnih jednobaznih karboksilnih kiselina povećavaju se s povećanjem broja ugljikovih atoma u molekuli i, posljedično, s povećanjem relativne molekulske težine. Dakle, tačka ključanja mravlje kiseline je 100,8 °C, sirćetne kiseline - 118 °C, propionske kiseline - 141 °C.
Najjednostavnija karboksilna kiselina, mravlja HCOOH, koja ima malu relativnu molekulsku masu (M r (HCOOH) = 46), u normalnim uslovima je tečnost sa tačkom ključanja od 100,8 °C. Istovremeno, butan (M r (C 4 H 10) \u003d 58) je gasovit pod istim uslovima i ima tačku ključanja od -0,5 ° C. Ovo neslaganje između tačaka ključanja i relativne molekulske težine objašnjava se formiranje dimera karboksilnih kiselina u kojoj su dva molekula kiseline vezana za dva vodonične veze:

Pojava vodikovih veza postaje jasna kada se razmotri struktura molekula karboksilne kiseline.
Molekule zasićenih jednobaznih karboksilnih kiselina sadrže polarnu grupu atoma - karboksil

I praktično nepolarni ugljikovodični radikal. Karboksilnu grupu privlače molekule vode, formirajući s njima vodikove veze:

Mravlja i sirćetna kiselina su beskonačno rastvorljive u vodi. Očigledno, s povećanjem broja atoma u ugljikovodičnom radikalu, topljivost karboksilnih kiselina opada.
Hemijska svojstva karboksilnih kiselina
Opća svojstva karakteristična za klasu kiselina (i organskih i neorganskih) posljedica su prisustva u molekulima hidroksilne grupe koja sadrži jaku polarnu vezu između atoma vodika i kisika. Razmotrimo ova svojstva na primjeru organskih kiselina rastvorljivih u vodi.
1. Disocijacija sa stvaranjem vodikovih kationa i anjona kiselinskog ostatka:
Preciznije, ovaj proces je opisan jednadžbom koja uzima u obzir učešće molekula vode u njemu:
Ravnoteža disocijacije karboksilnih kiselina je pomjerena ulijevo; velika većina njih su slabi elektroliti. Međutim, kiseli okus, na primjer, octene i mravlje kiseline nastaje zbog disocijacije na vodikove katione i anjone kiselih ostataka.
Očigledno, prisustvo "kiselog" vodonika, odnosno vodonika karboksilne grupe, u molekulima karboksilnih kiselina određuje i druga karakteristična svojstva.
2. Interakcija sa metalima stoji u elektrohemijskom nizu napona do vodonika:
Dakle, željezo reducira vodonik iz octene kiseline:
3. Interakcija sa bazičnim oksidima sa stvaranjem soli i vode:
4. Interakcija sa metalnim hidroksidima sa stvaranjem soli i vode (reakcija neutralizacije):
5. Interakcija sa solima slabijih kiselina sa formiranjem potonjeg. Dakle, octena kiselina istiskuje stearinsku kiselinu iz natrijevog stearata i ugljičnu kiselinu iz kalijevog karbonata:

6. Interakcija karboksilnih kiselina sa alkoholima sa stvaranjem estera - reakcija esterifikacije (jedna od najvažnijih reakcija karakterističnih za karboksilne kiseline):
Interakciju karboksilnih kiselina sa alkoholima kataliziraju vodikovi katjoni.
Reakcija esterifikacije je reverzibilna. Ravnoteža se pomiče prema stvaranju estera u prisustvu sredstava za odvodnjavanje i kada se ester ukloni iz reakcione smjese.
U reakciji reverzne esterifikacije, koja se naziva hidroliza estera (reakcija estera s vodom), nastaju kiselina i alkohol:

Očigledno, polihidrični alkoholi, na primjer, glicerol, također mogu reagirati s karboksilnim kiselinama, odnosno ući u reakciju esterifikacije:

Sve karboksilne kiseline (osim mravlje), zajedno sa karboksilnom grupom, sadrže ugljovodonični ostatak u svojim molekulima. Naravno, to ne može a da ne utiče na svojstva kiselina, koja su određena prirodom ugljikovodičnih ostataka.
7. Reakcije adicije višestrukih veza- u njih ulaze nezasićene karboksilne kiseline. Na primjer, reakcija dodavanja vodika je hidrogenacija. Za kiselinu koja sadrži jednu n-vezu u radikalu, jednačina se može napisati u opštem obliku:
Dakle, kada se oleinska kiselina hidrogenira, nastaje zasićena stearinska kiselina:
Nezasićene karboksilne kiseline, kao i druga nezasićena jedinjenja, dodaju halogene dvostrukoj vezi. Na primjer, akrilna kiselina obezbojava bromnu vodu:

8. Reakcije supstitucije (sa halogenima)- zasićene karboksilne kiseline mogu ući u njih. Na primjer, reakcijom octene kiseline sa hlorom mogu se dobiti različiti hlorni derivati kiselina:

Hemijska svojstva karboksilnih kiselina - kompendij



Pojedinačni predstavnici karboksilnih kiselina i njihov značaj
Mravlja (metanska) kiselina HCOOH- tečnost oštrog mirisa i tačke ključanja od 100,8 ° C, vrlo rastvorljiva u vodi.
Mravlja kiselina je otrovna i izaziva opekotine ako dođe u dodir s kožom! Ubodna tečnost koju luče mravi sadrži ovu kiselinu.
Mravlja kiselina ima dezinfekcijsko svojstvo i stoga nalazi svoju primjenu u prehrambenoj, kožnoj i farmaceutskoj industriji, te medicini. Koristi se za bojenje tekstila i papira.
Sirćetna (etanska) kiselina CH 3 COOH- bezbojna tečnost karakterističnog oštrog mirisa, koja se može mešati sa vodom u bilo kom odnosu. Vodene otopine octene kiseline u prodaji su pod nazivom ocat (3-5% otopina) i sirćetna esencija (70-80% otopina) i imaju široku primjenu u prehrambenoj industriji. Sirćetna kiselina je dobar rastvarač za mnoge organske materije i stoga se koristi u bojanju, u industriji kože i industriji boja i lakova. Osim toga, octena kiselina je sirovina za proizvodnju mnogih tehnički važnih organskih spojeva: na primjer, koristi se za dobivanje tvari koje se koriste za suzbijanje korova - herbicida. Sirćetna kiselina je glavna komponenta vinskog octa, čiji karakterističan miris je zbog nje. To je proizvod oksidacije etanola i nastaje iz njega kada se vino čuva na zraku.
Najvažniji predstavnici monobaznih kiselina sa najvišim limitom su palmitinska C 15 H 31 COOH i stearinska C 17 H 35 COOH kiseline. Za razliku od nižih kiselina, ove supstance su čvrste, slabo rastvorljive u vodi.
Međutim, njihove soli - stearati i palmitati - su vrlo topljive i imaju deterdžentni učinak, zbog čega se nazivaju i sapunima. Jasno je da se ove tvari proizvode u velikim razmjerima.
Od nezasićenih viših karboksilnih kiselina najvažnija je oleinska kiselina C 17 H 33 COOH, ili CH 3 - (CH 2) 7 - CH \u003d CH - (CH 2) 7 COOH. To je tečnost nalik ulju bez ukusa i mirisa. Njegove soli se široko koriste u tehnologiji.
Najjednostavniji predstavnik dvobaznih karboksilnih kiselina je oksalna (etandijeva) kiselina HOOC-COOH, čije se soli nalaze u mnogim biljkama, kao što su kiseljak i oksalis. Oksalna kiselina je bezbojna kristalna supstanca, dobro rastvorljiva u vodi. Koristi se u poliranju metala, u industriji obrade drveta i kože.
Referentni materijal za polaganje ispita:
periodni sistem
Tabela rastvorljivosti