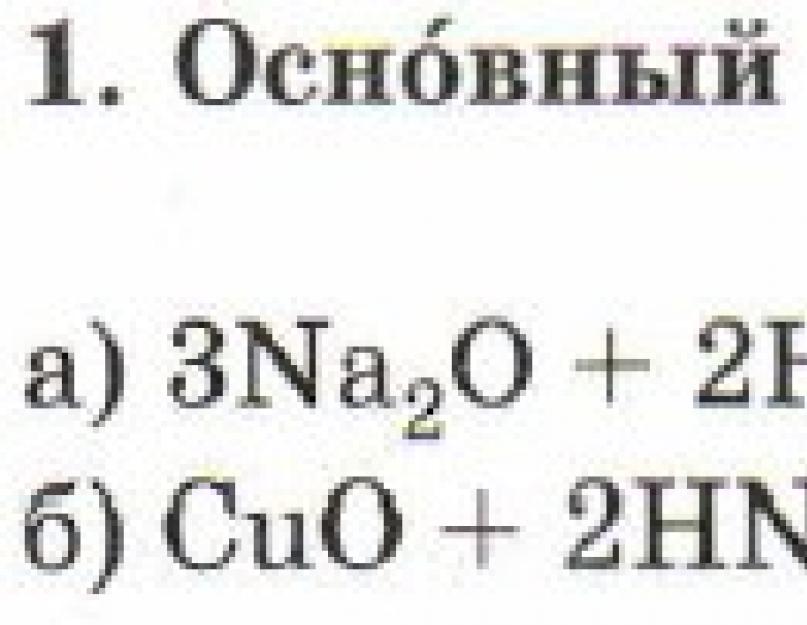Oksid- binarno jedinjenje hemijskog elementa sa kiseonikom u -2 oksidacionom stanju, u kojem je sam kiseonik vezan samo za manje elektronegativan element
Nomenklatura oksida
Nazivi oksida konstruirani su na ovaj način: prvo se izgovara riječ "oksid", a zatim se naziva element koji ga formira. Ako element ima promjenjivu valenciju, onda je označen rimskim brojem u zagradama na kraju imena:
Na I 2 O - natrijum oksid; Ca II O - kalcijum oksid;
S IV O 2 - sumpor oksid (IV); S VI O 3 - sumporov oksid (VI).
Klasifikacija oksida
Prema svojim hemijskim svojstvima, oksidi se dijele u dvije grupe:
1. Ne stvara soli (indiferentan)– ne stvaraju soli, na primjer: NO, CO, H2O;
2.Formiranje soli, koji se, pak, dijele na:
– main
- to su oksidi tipičnih metala sa oksidacionim stanjem +1, +2 (grupe I i II glavnih podgrupa, osim berilija) i oksidi metala u minimalnom oksidacionom stanju ako metal ima promenljivo oksidaciono stanje (CrO, MnO);
– kiselo
- to su oksidi tipičnih nemetala (CO 2, SO 3, N 2 O 5) i metali u maksimalnom oksidacionom stanju jednakom broju grupe u PSE D.I. Mendeljejeva (CrO 3, Mn 2 O 7);
– amfoterni oksidi
(koji imaju bazična i kisela svojstva, u zavisnosti od reakcionih uslova) su oksidi metala BeO, Al 2 O 3, ZnO i metali sekundarnih podgrupa u srednjem oksidacionom stanju (Cr 2 O 3, MnO 2).
Osnovni oksidi
Main pozvao oksidi, koji stvaraju soli u interakciji s kiselinama ili kiselim oksidima.Osnovni oksidi odgovaraju bazama.
Na primjer , kalcijum oksid CaO odgovara kalcijum hidroksidu Ca (OH) 2, kadmijum oksidu CdO - kadmijum hidroksidu Cd (OH) 2.
Hemijska svojstva osnovnih oksida
1. Bazni oksidi stupaju u interakciju s vodom i formiraju baze.
Uslov reakcije: Moraju se formirati rastvorljive baze!
Na 2 O + H 2 O → 2NaOH
CaO + H 2 O → Ca (OH) 2
Al 2 O 3 + H 2 O → reakcija se ne odvija, jer se mora formirati Al(OH) 3, koji je nerastvorljiv.
2. Interakcija sa kiselinama za stvaranje soli i vode:
CaO + H 2 SO 4 → CaSO 4 + H 2 O.
3. Interakcija sa kiselim oksidima za stvaranje soli:
CaO + SiO 2 → CaSiO 3
4. Interakcija sa amfoternim oksidima:
SaO + Al 2 O 3 → Sa (AlO 2) 2
Kiseli oksidi
Kisela pozvao oksidi, koji stvaraju soli u interakciji s bazama ili bazičnim oksidima.Odgovaraju kiselinama.
Na primjer
, sumporov oksid (IV) odgovara sumpornoj kiselini H2SO3.
Hemijska svojstva kiselinskih oksida
1. Interakcija s vodom za stvaranje kiseline:Uslovi reakcije: treba da se formira rastvorljiva kiselina.
P 2 O 5 + 3H 2 O → 2H 3 PO 4
2. Interakcija sa alkalijama za stvaranje soli i vode:
Uslovi reakcije: alkalija je ta koja stupa u interakciju sa kiselim oksidom, odnosno rastvorljivom bazom.
SO 3 + 2NaOH → Na 2 SO 4 + H 2 O
3. Interakcija sa bazičnim oksidima za stvaranje soli:
SO 3 + Na 2 O → Na 2 SO 4
Amfoterni oksidi
Zovu se oksidi čiji hidratni spojevi pokazuju svojstva kiselina i baza amfoterično.Na primjer: aluminijum oksid Al2O3,mangan (IV) oksid MnO2.
Koncept "oksida" uključuje beskonačnu raznolikost supstanci: tečnost, kao što je vodonik oksid ili voda; čvrste materije, kao što je silicijum oksid (IV) - pesak i mnoge vrste kvarca, uključujući kalcedon i ametist, gorski kristal i morion; plinoviti, na primjer ugljični oksidi (IV) i (II) - ugljični dioksid i ugljični monoksid.
Prema svojim hemijskim svojstvima, svi oksidi se dijele na soli koji stvaraju i ne stvaraju soli.
Malo je oksida koji ne stvaraju sol. Oni uključuju nemetalne elemente, na primjer: dušikove okside (I) i (II) - N 2 O i NO, ugljični monoksid (II) - CO i neke druge.
Oksidi koji tvore soli dijele se na bazične, kisele i amfoterne okside. Sa ovim drugim ćete se upoznati u 9. razredu.
| Bazni oksidi su oni oksidi koji odgovaraju bazama. |
Na primjer,
U glavne okside spadaju metalni oksidi sa niskim stepenom oksidacije (+1 i +2), odnosno metalni oksidi grupa IA i IIA periodnog sistema D. I. Mendeljejeva, HgO, MnO i neki drugi. Svi osnovni oksidi su čvrste materije.
Tipične reakcije bazičnih oksida

Laboratorijski eksperiment br. 27
Interakcija bazičnih oksida sa kiselinama
Stavite malo (otprilike veličine glave šibice) prah bakarnog oksida (II) u epruvetu. Obratite pažnju na njegovu boju.
U epruvetu sa bakar (II) oksidom sipajte 1-2 ml rastvora sumporne kiseline. Da biste ubrzali reakciju, lagano zagrijte sadržaj epruvete. Šta gledaš?
Stavite 1-2 kapi dobivene otopine na staklenu ili porculansku ploču pomoću staklene šipke ili pipete i isparite. Šta se formira na staklenoj ploči?
Napišite molekularne i ionske jednadžbe za reakcije između bakrovog(II) oksida i sumporne kiseline.


Rice. 144.
Interakcija bazičnog oksida s vodom
Ova reakcija se odvija samo ako se formira rastvorljiva baza - alkalija, dakle CuO + H 2 O ≠, pošto je Cu (OH) 2 nerastvorljiv.

Rice. 145.
Reakcija kiselog oksida sa vodom Laboratorijski eksperiment br. 28
Interakcija bazičnih oksida sa vodom
U dvije epruvete sipajte 2-3 ml destilovane vode. Dodajte 2-3 kapi rastvora fenolftaleina u svaku epruvetu.
Stavite malo (ne više od polovine glave šibice) kalcijum oksida u prvu epruvetu, a bakar oksida (II) u drugu.
Pomiješajte sadržaj epruveta. Šta gledaš?
Napravite molekularne i ionske jednadžbe izvedenih reakcija.
Formulirajte zaključak o interakciji bazičnih oksida s vodom.
Kiseli oksidi uključuju okside nemetala:

kao i metalni oksidi s visokim oksidacijskim stanjem, na primjer:

Laboratorijski eksperiment br. 29
Interakcija kiselih oksida sa alkalijama
U epruvetu sipajte 2 ml krečne vode. Opišite rješenje.
Pomoću cijevi sa fino izvučenim krajem uduvajte zrak koji izdišete kroz krečnu vodu u epruveti. Šta gledaš?
Napišite molekularne i ionske jednadžbe za reakciju.
Koja je suština reakcije alkalija sa kiselim oksidom?

Međutim, ova reakcija je moguća samo ako je kiseli oksid topiv u vodi. A ako uzmete silicijum oksid (IV), onda reakcija praktički neće ići:
Laboratorijski eksperiment br. 30
Interakcija kiselih oksida s vodom
U 1. epruvetu sipajte 2-3 ml destilovane vode, a u 2. epruvetu gaziranu vodu (rastvor ugljen monoksida (IV) u vodi).
Stavite malu količinu (na vrh lopatice) silicijum oksida (IV) u 1. epruvetu. Dodajte 2-3 kapi rastvora lakmusa u svaku epruvetu. Pomiješajte sadržaj epruveta. Šta gledaš?
Napišite molekularne jednačine za izvedene reakcije.
Formulirajte zaključak o interakciji kiselih oksida s vodom.
Ključne riječi i fraze
- Oksidi ne tvore soli i soli.
- Oksidi su bazični i kiseli.
- Tipična svojstva bazičnih oksida: njihova interakcija s kiselinama, kiselim oksidima i vodom.
- Tipična svojstva kiselinskih oksida: njihova interakcija s bazama, bazičnim oksidima i vodom.
- Uslovi za reakcije kiselih i baznih oksida sa vodom.
Rad sa računarom
- Pogledajte elektronsku aplikaciju. Proučite materijal lekcije i dovršite predložene zadatke.
- Pretražujte na Internetu adrese e-pošte koje mogu poslužiti kao dodatni izvori koji otkrivaju sadržaj ključnih riječi i fraza pasusa. Ponudite učitelju svoju pomoć u pripremi nove lekcije – napravite izvještaj o ključnim riječima i frazama sljedećeg pasusa.
Pitanja i zadaci
Podjela baza u grupe prema različitim kriterijima prikazana je u tabeli 11.
Tabela 11
Osnovna klasifikacija
Sve baze, osim otopine amonijaka u vodi, su čvrste tvari različitih boja. Na primer, kalcijum hidroksid Ca (OH) 2 je bela, bakar (II) hidroksid Cu (OH) 2 je plava, nikl (II) hidroksid Ni (OH) 2 je zelena, gvožđe (III) hidroksid Fe (OH) 3 je crveno-braon, itd.
Vodeni rastvor amonijaka NH 3 H 2 O, za razliku od drugih baza, ne sadrži katjone metala, već složeni jednostruko nabijeni amonijev kation NH - 4 i postoji samo u rastvoru (ovaj rastvor vam je poznat kao amonijak). Lako se razlaže na amonijak i vodu:
Međutim, bez obzira koliko su baze različite, sve se sastoje od metalnih jona i hidrokso grupa, čiji je broj jednak oksidacionom stanju metala.
Sve baze, a prvenstveno alkalije (jaki elektroliti), tokom disocijacije formiraju OH hidroksidne jone, koji određuju niz zajedničkih svojstava: sapunavost na dodir, promjenu boje indikatora (lakmus, metilnarandža i fenolftalein), interakciju sa drugim supstancama.
Tipične bazne reakcije

Prva reakcija (univerzalna) razmatrana je u § 38.
Laboratorijski eksperiment br. 23
Interakcija alkalija sa kiselinama
- Zapišite dvije jednačine molekularne reakcije, čija je suština izražena sljedećom ionskom jednačinom:
H + + OH - \u003d H 2 O.
Izvedite reakcije čije ste jednačine napravili. Zapamtite koje su tvari (osim kiselina i alkalija) potrebne za promatranje ovih kemijskih reakcija.
Druga reakcija se odvija između alkalija i oksida nemetala, koji odgovaraju kiselinama, npr.
Odgovara
![]()
![]() itd.
itd.
Kada oksidi interaguju s bazama, nastaju soli odgovarajućih kiselina i vode:


Rice. 141.
Interakcija alkalija sa nemetalnim oksidom
Laboratorijski eksperiment br. 24
Interakcija alkalija sa oksidima nemetala
Ponovite eksperiment koji ste ranije radili. U epruvetu sipajte 2-3 ml bistrog rastvora krečne vode.
U nju stavite slamčicu za sok, koja služi kao cijev za odvod plina. Lagano provucite izdahnuti vazduh kroz rastvor. Šta gledaš?
Zapišite molekularne i ionske jednačine reakcije.

Rice. 142.
Interakcija alkalija sa solima:
a - sa stvaranjem taloga; b - sa stvaranjem gasa
Treća reakcija je tipična reakcija ionske izmjene i događa se samo ako je rezultat talog ili se oslobađa plin, na primjer:

Laboratorijski eksperiment br. 25
Interakcija alkalija sa solima
- U tri epruvete sipajte 1-2 ml rastvora supstanci u paru: 1. epruveta - natrijum hidroksid i amonijum hlorid; 2. epruveta - kalijum hidroksid i gvožđe sulfat (III); 3. epruveta - natrijum hidroksid i barijum hlorid.
Zagrijte sadržaj 1. epruvete i po mirisu identificirajte jedan od produkta reakcije.
Formulirajte zaključak o mogućnosti interakcije alkalija sa solima.
Nerastvorljive baze se raspadaju kada se zagrijavaju na metalni oksid i vodu, što nije tipično za alkalije, na primjer:
Fe (OH) 2 \u003d FeO + H 2 O.
Laboratorijski eksperiment br. 26
Priprema i svojstva nerastvorljivih baza
U dve epruvete sipajte 1 ml rastvora bakar (II) sulfata ili hlorida. Dodajte 3-4 kapi rastvora natrijum hidroksida u svaku epruvetu. Opišite nastali bakar(II) hidroksid.
Bilješka. Ostavite epruvete sa dobijenim bakar (II) hidroksidom za sledeće eksperimente.
Napišite molekularne i ionske jednadžbe za reakciju. Navedite vrstu reakcije na osnovu "broja i sastava polaznih materijala i produkta reakcije".
U jednu od epruveta sa bakar (II) hidroksidom dobijenim u prethodnom eksperimentu dodajte 1-2 ml hlorovodonične kiseline. Šta gledaš?
Pipetom stavite 1-2 kapi dobivene otopine na staklenu ili porculansku ploču i pomoću klešta za lončić pažljivo isparite. Ispitajte kristale koji se formiraju. Obratite pažnju na njihovu boju.
Napišite molekularne i ionske jednadžbe za reakciju. Navedite vrstu reakcije na osnovu "broja i sastava polaznih materijala i produkta reakcije", "učešća katalizatora" i "reverzibilnosti hemijske reakcije".
Zagrijte jednu od epruveta sa bakar-hidroksidom dobijenim ranije ili koji je dao nastavnik () (Sl. 143). Šta gledaš?

Rice. 143.
Razgradnja bakar (II) hidroksida pri zagrijavanju
Napravite jednadžbu za reakciju, navedite uvjet njenog nastanka i vrstu reakcije prema znakovima "broj i sastav polaznih materijala i produkata reakcije", "oslobađanje ili apsorpcija topline" i "reverzibilnost kemijske reakcije". ".
Ključne riječi i fraze
- Osnovna klasifikacija.
- Tipična svojstva baza: njihova interakcija sa kiselinama, oksidima nemetala, solima.
- Tipično svojstvo nerastvorljivih baza: raspadanje pri zagrevanju.
- Uslovi za tipične bazne reakcije.
Rad sa računarom
- Pogledajte elektronsku aplikaciju. Proučite materijal lekcije i dovršite predložene zadatke.
- Pretražujte na Internetu adrese e-pošte koje mogu poslužiti kao dodatni izvori koji otkrivaju sadržaj ključnih riječi i fraza pasusa. Ponudite učitelju svoju pomoć u pripremi nove lekcije – napravite izvještaj o ključnim riječima i frazama sljedećeg pasusa.
Pitanja i zadaci

Ulaznica 1.
1. Osnovni hemijski pojmovi (na primeru bilo koje hemijske formule).
1. Složena supstanca – sastoji se od različitih hemijskih elemenata.
2. 5 (koeficijent) molekula složene supstance.
3. Kvalitativni sastav složene supstance - sastoji se od vodonika i kiseonika.
4. Kvantitativni sastav 1 molekula: 2 atoma H i jedan O atom; 5 molekula: 10 H atoma i 5 O atoma.
5. Molarna masa M (H 2 O) = 1 * 2 + 16 = 18 g / mol
6. Masa 5 molekula m (H 2 O) \u003d 5 * 18 \u003d 90 g
7. Maseni udio vodonika u molekuli: w = = = 0,3333 (33,33%)
2.
Elementi podgrupe kiseonika - kiseonik O, sumpor S, selen Se, telur Te, polonijum Ro- imaju zajednički naziv "halkogeni", što znači "rađanje ruda".
Struktura i svojstva atoma.
Atomi sumpora, kao i atomi kiseonika i svi drugi elementi glavne podgrupe grupe VI Periodnog sistema D. I. Mendeljejeva, sadrže 6 elektrona na vanjskom energetskom nivou, od kojih su 2 elektrona nesparena.
Jednostavne supstance Alotropija kiseonika su jednostavne supstance kiseonik O 2 i ozon O 3.
Sumpor, kao i kisik, karakterizira alotropija. Ovo je rombični i plastični sumpor.
Hemijska svojstva Sumpor može biti i oksidacijski i redukcijski agens.
1. U odnosu na redukcione agense - vodonik, metale, sumpor ispoljava oksidaciona svojstva i poprima oksidaciono stanje -2. U normalnim uslovima, sumpor reaguje sa svim alkalnim i zemnoalkalnim metalima, bakrom, živom, srebrom, na primer:
H 2 + S = H 2 S.
2. Međutim, u poređenju sa kiseonikom i fluorom, sumpor je redukciono sredstvo, formirajući spojeve sa oksidacionim stanjem +4, +6.
Sumpor gori plavkastim plamenom, formirajući sumporov oksid (IV):
S + O 2 \u003d SO 2.
Ovo jedinjenje je opšte poznato kao sumporov dioksid.
3.
Ca + N 2 ®Ca 3 N 2
Cu + H 2 SO 4 (konc) ® CuSO 4 + SO 2 + H 2 O
Ulaznica 2.
1. Otkriće D.I. Mendeljejevljev periodični zakon. Periodični sistem hemijskih elemenata.
D. I. Mendeljejev je rasporedio sve hemijske elemente poznate do vremena otkrića Periodnog zakona u nizu, prema porastu njihovih atomskih masa, i zabeležio segmente u njemu - periode , u kojoj su se svojstva elemenata i supstanci koje od njih formiraju mijenjale na sličan način, naime (modernim riječima):
1) oslabljena metalna svojstva;
2) poboljšana su nemetalna svojstva;
3) stepen oksidacije elementa u višim oksidima povećan sa +1 na +7;
4) oksidi od bazičnih do amfoternih zamenjeni su kiselim;
5) hidroksidi iz alkalija preko amfoternih hidroksida su zamijenjeni sve jačim kiselinama.
Na osnovu ovih zapažanja, D. I. Mendeljejev je 1869. zaključio – formulisao je periodični zakon:
svojstva hemijskih elemenata i njihovo formiranje supstance su u periodici zavisno od njihove atomske težine. U modernom obliku atomske mase elemenata zamijenjen sa nuklearno punjenje.
2. Podgrupa ugljika: struktura i svojstva atoma ugljika, jednostavne tvari koje stvara ugljik, hemijska svojstva ugljika.
Podgrupa ugljenika (grupa 4 A) - ugljenik, silicijum, germanijum, kalaj, olovo.
Ugljenik C je prvi element glavne podgrupe grupe IV periodnog sistema D. I. Mendeljejeva. Njegovi atomi sadrže 4 elektrona na vanjskom energetskom nivou, tako da mogu prihvatiti četiri elektrona, dok stiču oksidacijsko stanje od -4, odnosno pokazuju oksidirajuća svojstva i doniraju svoje elektrone više elektronegativnim elementima, odnosno pokazuju redukciona svojstva, stječući na ovom oksidaciono stanje je +4.
Ugljik je jednostavna supstanca. Ugljik formira alotropske modifikacije - dijamant i grafit. Struktura slična grafitu čađ i ugalj. Ugalj, zbog svoje porozne površine, ima sposobnost da apsorbuje gasove i rastvorene materije. Ovo svojstvo nekih supstanci naziva se adsorpcija.
Hemijska svojstva ugljika.
Dijamant i grafit se kombinuju sa kiseonikom na veoma visokim temperaturama. Čađ i ugalj mnogo lakše stupaju u interakciju s kisikom, izgarajući u njemu. Ali u svakom slučaju, rezultat takve interakcije je isti - nastaje ugljični dioksid:
C + O 2 \u003d CO 2
S metalima, ugljik stvara karbide kada se zagrijava, na primjer:
4Al + 3C \u003d Al 4 C 3
3. Koristite karakterističnu reakciju da dokažete prisustvo karbonatnog jona u natrijevom karbonatu.
CO 3 2- + H + (bilo koja kiselina) ® CO 2 + H 2 O
Oslobađa se teški bezbojni gas koji gasi zapaljenu šibicu.
Ulaznica 3.
1. Teorija strukture atoma: planetarni model strukture atoma, raspodjela elektrona po energetskim razinama na primjeru elementa glavne i sekundarne podgrupe.
Planetarni model atoma (Rutherfordov model)
 |
Nukleus: protoni (p+) i neutroni (n 0).
Koncept elektronske ljuske atoma (elektronski slojevi, nivoi energije)
U elektronskoj ljusci razlikuju se slojevi na kojima će se nalaziti elektroni s različitim energetskim rezervama, pa se nazivaju i nivoi energije.
Broj ovih nivoa u atomu hemijskog elementa = odgovarajući broj perioda u tabeli D. I. Mendeljejeva:

atom Al, element 3. perioda, ima tri nivoa. Svaki nivo može primiti određeni maksimalni broj elektrona: 1. - 2e - , 2. - 8e - , i iako je maksimalni broj elektrona koji mogu stati na 3. nivo 18, atomi elemenata ovog perioda mogu na njega, kao i atomi elemenata 2. perioda, postaviti samo 8e - .
Zovu se energetski nivoi koji sadrže maksimalan broj elektrona završeno. Ako sadrže manje elektrona, onda su ovi nivoi nekompletni.
Elementi bočnih podgrupa uvijek imaju 2 elektrona na vanjskom nivou (sa izuzetkom Cr i Cu, oni imaju 1 elektron). Na kraju se popunjava pred-vanjski nivo:

2. Podgrupa halogena: struktura i svojstva atoma.
Elementi glavne podgrupe VII grupe periodnog sistema D. I. Mendeljejeva, ujedinjeni pod opštim imenom halogeni, fluor F, hlor Cl, brom Br, jod I, astatin At (retko se nalaze u prirodi) su tipični nemetali. To je razumljivo, jer njihovi atomi sadrže sedam elektrona na vanjskom energetskom nivou, a nedostaje im samo jedan elektron da ga dovrše. Atomi halogena, kada su u interakciji sa metalima, prihvataju elektron od atoma metala. Ovo stvara soli. Otuda i zajednički naziv podgrupe "halogeni", tj. "rađanje soli".
Halogeni su veoma jaki oksidanti. Fluor u hemijskim reakcijama ispoljava samo oksidaciona svojstva, a karakteriše ga samo oksidaciono stanje -1 u jedinjenjima. Preostali halogeni također mogu pokazati redukciona svojstva pri interakciji s više elektronegativnih elemenata - fluorom, kisikom, dušikom. Istovremeno, njihova oksidaciona stanja mogu poprimiti vrijednosti +1, +3, +5,
7. Redukciona svojstva halogena povećavaju se od hlora do joda, što je povezano sa povećanjem radijusa njihovih atoma: atomi hlora su otprilike jedan i po puta manji od atoma joda.
Halogeni su jednostavne supstance Svi halogeni postoje u slobodnom stanju u obliku dvoatomskih molekula F 2, Cl 2, Br 2, I 2. Fluor i hlor su gasovi, brom je tečnost, jod je čvrsta supstanca. Od F 2 do I 2, intenzitet boje halogena raste. Kristali joda imaju metalni sjaj.
3. Koristite karakterističnu reakciju da dokažete prisustvo sulfatnih jona u natrijevom sulfatu.
SO 4 2- + Ba 2+ (rastvorljiva so barijuma) ® BaSO 4 ¯
Bijeli fini kristalni talog
Ulaznica 4.
1. Pravila za određivanje oksidacionih stanja.
Elementi koji imaju konstantno oksidaciono stanje:
1. I grupa A: Li + , Na + , K + , Rb + , Cs + .
2. II grupa A: Be +2, Mg +2, Ca +2, Zn +2, Sr +2, Cd +2, Ba +2.
3. III grupa A: Al +3
6. H +1 (MeH -1)
7. Za jednostavne supstance, s.d. = 0.
Za preostale elemente d.d. razmotriti
H2 +1 S X O 4 - 2 : dakle sumpor nema konstantu d.d., pa ga uzimamo kao X.
+1 *2 + X + (-2 ) * 4 = 0
Viši S.O. = broj grupe (osim O, F)
Najniži s.d. = broj grupe - 8 (Me nema niži s.d.)
2. Hemijska svojstva halogena - jednostavnih supstanci.
Hemijska aktivnost halogena, kao nemetala, slabi od fluora do joda.
Svaki halogen je najjači oksidant u svom periodu. Oksidirajuća svojstva halogena jasno su vidljiva kada su u interakciji s metalima. Ovo stvara soli. Dakle, fluor već u normalnim uslovima reaguje sa većinom metala, a kada se zagreje - sa zlatom, srebrom, platinom, poznatim po svojoj hemijskoj pasivnosti. Aluminij i cink se pale u atmosferi fluora:
0 0 +2 -1
Zn + F 2 = ZnF 2 .
Preostali halogeni reagiraju s metalima uglavnom kada se zagrijavaju.
Smanjenje oksidacijskih i povećanje redukcijskih svojstava halogena od fluora do joda može se suditi i po njihovoj sposobnosti da se međusobno istiskuju iz otopina soli.
Dakle, klor istiskuje brom i jod iz otopina njihovih soli, na primjer:
Cl 2 + 2NaBr \u003d 2NaCl + Br 2.
3. Napravite molekularne i jonske jednačine reakcija između supstanci: olovo (II) nitrat i kalijum sulfat, gvožđe (III) hlorid i srebro nitrat.
Ulaznica 5.
1. Klasifikacija hemijskih reakcija prema broju početnih supstanci i produkta reakcije.
2. Hidrohalidi i halogenvodične kiseline i njihove soli.
H 2 + G 2 \u003d 2NG
(G - konvencionalna hemijska oznaka halogena).
Svi vodonik halogenidi (njihova opšta formula može se napisati kao NG) su bezbojni gasovi, oštrog mirisa i toksični. Vrlo dobro se rastvaraju u vodi i dime se u vlažnom zraku, jer privlače vodenu paru u zraku, formirajući magloviti oblak.
Rastvori halogenovodonika u vodi su kiseline, to su HF - fluorovodonična ili fluorovodonična kiselina, HC1 - hlorovodonična ili hlorovodonična kiselina, HBr - bromovodična kiselina, HI - jodovodična kiselina. Najjača od halogenovodoničnih kiselina je jodovodična, a najslabija fluorovodonična.
Soli halogenovodoničnih kiselina Halogene kiseline formiraju soli: fluoride, hloride, bromide i jodide. Hloridi, bromidi i jodidi mnogih metala su visoko rastvorljivi u vodi.
Za određivanje iona klorida, bromida i jodida u otopini i njihovo razlikovanje koristi se reakcija sa srebrovim nitratom.
3. Izračunajte maseni udio kisika u natrijevom sulfatu.
| Dato: Na 2 SO 4 | Rješenje: W O = = |
| WO - ? % |
Odgovor: maseni udio kiseonika je 45,1%.
Ulaznica 6.
1. Elektroliti i neelektroliti.
Prema vodljivosti električne struje, sve tvari se dijele na elektrolite i neelektrolite.
Elektroliti su supstance čiji rastvori provode struju. To uključuje kiseline, baze, soli. Ove supstance provode struju, jer. može disociirati na kation i anjon:
Kiseline: HAn H + + An -
Baze: MON M + + OH -
Soli: MAn → M + + An -
Indeks nakon jednostavnog jona ili zagrade postaje koeficijent
Ca 3 (PO 4) 2 → 3Ca 2+ + 2 (PO 4) 3-
Neelektroliti uključuju sve ostalo - jednostavne tvari, okside, gotovo sve organske tvari.
2.
Fizička svojstva metala određena su njihovom strukturom: prisustvom slobodnih elektrona u kristalnoj rešetki. Zahvaljujući slobodnim elektronima, svi metali imaju električnu provodljivost, toplotnu provodljivost i metalni sjaj.
elektro- i toplotna provodljivost. Elektroni koji se nasumično kreću u metalu pod utjecajem primijenjenog električnog napona dobijaju usmjereno kretanje, uslijed čega nastaje električna struja. Srebro, bakar, kao i zlato, aluminijum i željezo imaju najveću električnu provodljivost; najmanji - mangan, olovo, živa.
Najčešće, istim redoslijedom kao i električna provodljivost, mijenja se i toplinska provodljivost metala. To je zbog velike pokretljivosti slobodnih elektrona, koji, sudarajući se s vibrirajućim ionima i atomima, razmjenjuju energiju s njima. Zbog toga dolazi do brzog izjednačavanja temperature u cijelom komadu metala.
Metalni sjaj. Elektroni koji ispunjavaju međuatomski prostor reflektiraju svjetlosne zrake, a ne propuštaju, kao staklo, tako da svi metali u kristalnom stanju imaju metalni sjaj.
Ostale osobine - tvrdoća, gustina, taljivost, plastičnost - su različite.
3. Dajte opis jednog od elemenata - metala (natrijum, kalcijum, aluminijum ili gvožđe) (sve po izboru).
KARAKTERISTIKE METALNOG ELEMENTA NA PRIMJERU ALUMINIJA
1. Položaj u periodičnom sistemu.Aluminijum(serijski broj 13 ) je element 3 tačka, main podgrupe 3
2. Broj protona u atomu aluminijum jednaki 13 , broj elektrona - 13 , broj neutrona u izotopu 27 13 Al - 27-13 =14, nuklearno punjenje +13 , raspodjela elektrona po nivoima 2, 8, 3 .
3. Jednostavna supstanca.Aluminijum- ovo je amfoterni metal. atomi aluminijum show restorative svojstva.
4. Viši oksid, njegov karakter. Aluminijum formira najviši oksid, čija je formula Al2O3. Po svojstvima, ovo amfoterni oksid.
4. Viši hidroksid, njegova priroda. Aluminijum formira najviši hidroksid, čija je formula Al(OH)3. Po svojstvima amfoterna baza.
Ulaznica 7.
1. Koncept jakih i slabih elektrolita.
Elektroliti uključuju soli, kiseline, baze.
Sve soli su jaki elektroliti, tj. dobro provode struju. Stoga je u jednadžbi disocijacije samo jedna strelica postavljena u smjeru raspada na ione
MAn→ M + + An -
Jake baze su alkalije, tj. baze rastvorljive u vodi.
Ca (OH) 2 → Ca 2+ +2 (OH) -
Nerastvorni i slabo rastvorljivi su slabi, pa prilikom pisanja jednadžbe disocijacije stavljaju znak reverzibilnosti (pored iona postoje i molekuli)
PON M + + OH -
Jake kiseline uključuju HCl, HBr, HI, H 2 SO 4 , HNO 3 , HClO 4 , HClO 3 .
2. Legure.
To su materijali sa karakterističnim svojstvima, koji se sastoje od dvije ili više komponenti, od kojih je barem jedna metal.
U metalurgiji se željezo i sve njegove legure svrstavaju u jednu grupu tzv crni metali; ostali metali i njihove legure imaju tehnički naziv obojeni metali.
Velika većina legura željeza (ili željeznih) sadrži ugljik. Dijele se na liveno gvožđe i čelik.
Liveno gvožde- legura na bazi željeza koja sadrži više od 2% ugljika, kao i mangan, silicijum, fosfor i sumpor. Liveno gvožđe je mnogo tvrđe od gvožđa, obično je veoma lomljivo, nije kovano i lomi se pri udaru. Ova legura se koristi za izradu raznih masivnih delova livenjem, tzv liveno gvožde, i za preradu u čelik - sirovo gvožđe.
Ovisno o stanju ugljika u leguri, razlikuju se sivi i bijeli liveni gvožđe.
Čelik je legura na bazi željeza koja sadrži manje od 2% ugljika. Hemijski sastav čelika podijeljen je u dvije glavne vrste: ugljenični i doped.
Primjeri obojenih legura mogu biti: nihrom, tretnik lem, win, duralumin.
Duralumin- legura aluminijuma (95%), magnezijuma, bakra i mangana. Veoma lagana i jaka legura. Po snazi je jednak čeliku, ali tri puta lakši od njega. Koristi se u konstrukciji aviona.
3. Dajte opis jednog od elemenata - nemetala (hlor, sumpor, fosfor, azot, ugljenik, silicijum) (sve po izboru).
KARAKTERISTIKE NEMETALNOG ELEMENTA NA PRIMJERU SUMPORA
1. Pozicija u periodnom sistemuSumpor(serijski broj 16 ) je element 3 tačka, main podgrupe 6 grupe Periodnog sistema.
2.Struktura atoma, njegova svojstva. Broj protona u atomu sumpora je 16 , broj elektrona - 16 , broj neutrona u izotopu 32 16 S - 32-16 =16, nuklearno punjenje +16 , raspodjela elektrona na nivoima 2, 8, 6.
3. Jednostavna supstanca. Sumpor je nemetalni. Izlažu se atomi sumpora oksidativno svojstva.
3.Viši oksid, njegov karakter. Sumpor tvori najviši oksid, čija je formula SO 3. Po svojstvima, ovo kiselina oksid.
4.Viši hidroksid, njegov karakter. Sumpor stvara najviši hidroksid, čija je formula H2SO4. Po svojstvima kiselina.
Ulaznica 8.
1. Oksidi: njihov sastav, klasifikacija i nazivi.
oksidi- to su binarna jedinjenja, na drugom mestu su kiseonik sa oksidacionim stanjem -2.
Ovisno o tome koji element je prvi, oksidi se dijele u tri grupe:
1) Osnovni. To su oksidi, u kojima je metal na prvom mjestu: CaO, Na 2 O.
2) Kiselina. To su oksidi, u kojima je na prvom mjestu nemetal: P 2 O 5.
3) Amfoterni. To su oksidi u kojima je amfoterni element (prijelazni metal) na prvom methu: Al 2 O 3, Fe 2 O 3
Osnovni oksidi odgovaraju bazama. Na primjer, Na 2 O - NaOH. Kiseli oksidi odgovaraju kiselinama: P 2 O 5 - H 3 PO 4.
Imena se sastoje od naziva kiseonika (na latinskom) - oksid, i naziva prvog elementa, koji označava stepen oksidacije (ako je promenljiv)
P 2 +5 O 5 fosfor (V) oksid, Fe 2 +3 O 3 željezo (III) oksid
2. Podgrupa kiseonika: struktura i svojstva atoma, jednostavne supstance, hemijska svojstva sumpora.
Pogledajte kartu 1, pitanje 2 za odgovor.
3. Upotrijebite karakterističnu reakciju da dokažete prisustvo hloridnog jona u kalijevom hloridu.
Cl - + Ag + (rastvorljiva sol srebra) ® Ag Cl ¯
Bijeli sediment skute
Ulaznica 9.
1. Kiseline. Nazivi i formule kiselina.
kiseline su složene neorganske supstance sastavljene od vodikov katjon i anjon kiselinskog ostatka.
Hcl - hlorovodonična
HNO 3 - azot
H 2 SO 4 - sumporna
H 2 CO 3 - ugalj
H 3 PO 4 - fosforni
2. Legure.
Pogledajte kartu 7, pitanje 2 za odgovor.
3. Dajte opis jednog od elemenata - metala (litijum, magnezijum, kalijum ili aluminijum) (sve po izboru).
Pogledajte kartu 6, pitanje 3 za primjer odgovora.
Ulaznica 10.
1. Položaj metala u periodnom sistemu hemijskih elemenata D.I. Mendeljejev, struktura njihovih atoma i kristala.
Me su jednostavne supstance koje lako doniraju elektrone. Za glavne podgrupe:

Me uključuje sve elemente sekundarnih podgrupa. Ovakav položaj Me u periodnom sistemu povezan je sa njihovom strukturom: mali broj elektrona na vanjskom nivou (1-3), koji je u glavnim podgrupama određen brojem grupe, au sporednim - konstantno 2 elektrona. . Druga karakteristika za Me je veliki radijus (raste u tabeli od vrha do dna).
U kristalnoj rešetki Me ima slobodne elektrone, koji su odgovorni za glavna fizička svojstva Me:

2. Temelji u svjetlu TED-a; njihova klasifikacija i hem. svojstva.
Baze su elektroliti koji nakon disocijacije formiraju metalni kation i anjon kiselinskog ostatka.
klasifikacija:
1. Baze nerastvorljive u vodi.
2. Alkalije - rastvorljive u vodi.
Tipične bazne reakcije
1 . Baza + kiselina® sol + voda.
(reakcija razmjene)
Hl + NaOH \u003d NaCl + H 2 O
H + + OH - \u003d H 2 O (reakcija neutralizacije).
2. Baza + kiselinski oksid®sol + voda.
(reakcija razmjene)
2NaOH + N 2 O 5 \u003d 2NaNO 3 + H 2 O
2OH - + N 2 O 5 = 2NO 3 - + H 2 O;
3 . Lužina + sol ® nova baza + nova sol.
(reakcija razmjene)
2KOH + CuSO 4 = = Cu(OH) 2 ¯+ K 2 SO 4
Cu 2+ + 2OH - = = Cu (OH) 2 ¯
4. Baze koje su nerastvorljive u vodi se razlažu kada se zagreju na metalni oksid i vodu, što nije tipično za alkalije, na primer:
Cu (OH) 2 ¯ \u003d CuO + H 2 O
3. Rasporedite koeficijente u reakcionim šemama koristeći metodu elektronske ravnoteže. Navesti oksidaciono sredstvo i redukciono sredstvo, procese oksidacije i redukcije.
Al + O 2 ® Al 2 O 3
HNO 3 + P® H 3 PO 4 + NO 2 + H 2 O
Prilikom pripreme za ispit pogledajte rješenje u laboratorijskom dnevniku - praktični rad br.2.
Ulaznica 11.
1. Metoda elektronske ravnoteže.
Al 0+ O2 0 ® Al 2 +3 O 3 -2
Ispisujemo elemente koji su promijenili s.d.
Al 0 - 3e - → Al +3 4 Al 0 - redukciono sredstvo, proces oksidacije
O 2 0 +2 * 2e - → 2O -2 3 O 2 0 - oksidant, proces redukcije
Bilješka. Ako jednostavna supstanca ima indeks (2), onda se prenosi na elektronsku vagu.
Reakciju izjednačavamo pomoću koeficijenata iz elektronske ravnoteže (4, 3):
4Al + 3O 2 ® 2 Al 2 O 3
2. Opća hemijska svojstva metala. Elektrohemijski nizovi napona metala i interakcija metala sa rastvorima kiselina i soli.
Metali su redukcioni agensi. Redukciona svojstva pokazuju se u reakcijama sa jednostavnim i složenim supstancama.
I. Sa jednostavnim - nemetalima
2Na + S = Na 2 S natrijum sulfid
II. Sa kompleksom: voda, kiseline, rastvori soli (reakcije supstitucije). Prilikom pisanja svih ovih reakcija potrebno je uzeti u obzir niz aktivnosti (elektrohemijski niz) metala.
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H 2), Cu, Hg, Ag, Au.
1. Metali koji se nalaze levo od vodonika u naponskom nizu istiskuju ga iz kiselih rastvora, a oni desno, po pravilu, ne istiskuju vodonik iz kiselih rastvora:
Zn + 2HCl \u003d ZnCl 2 + H 2.
2. Svaki metal istiskuje druge metale iz rastvora soli koji se nalaze desno od njega u nizu napona, a sam može biti istisnut metalima koji se nalaze levo, na primer:
Fe + CuSO 4 \u003d FeSO 4 + Cu,
Cu + HgCl 2 \u003d Hg + CuCl 2.
3. Odrediti masu ugljičnog monoksida (IV) količinom tvari od 2 mmol.
Odgovor: 88 mg ugljen monoksida (IV).
Ulaznica 12.
1. Hidroliza soli katjonom.
MAN + HOH = MOH + HAN
sol bazične kiseline
Sol se podvrgava hidrolizi ako je formira barem jedan slab ion. Ako je slab kation (od slabe baze), tada se hidroliza naziva kationom.
Slabe baze su nerastvorljive u vodi.
Na primjer, FeCl 3 je sol koju formiraju jaka kiselina (HCl) i slaba baza (Fe(OH) 3)
FeCl3Û Fe 3+ +3Cl -
slab kation
Fe 3+ + H + OH - Û Fe OH 2+ + H+
4. Utvrdite da je medij rastvora kisel
Ovo je slučaj hidroliza katjonom.
2. Opća fizička svojstva metala.
Pogledajte kartu za odgovor 6 , pitanje 2.
3. Izvršite reakcije koje potvrđuju da sumporna kiselina sadrži vodikove katione i sulfatne anione.
H 2 SO 4 Û 2H + + SO 4 2-
H + - metilnarandžasta (pocrveni) ili lakmus (pocrveni)
SO 4 2- + Ba 2+ ® Ba SO 4 ¯ (bijeli fini kristalni talog)
Ulaznica 13.
1. Hidroliza soli anjonom.
Hidroliza soli je interakcija rastvorljive soli sa vodom.
MAN + HOH = MOH + HAN
sol bazične kiseline
Sol se podvrgava hidrolizi ako je formira barem jedan slab ion. Ako je slab anion (iz slabe kiseline), tada se hidroliza naziva anion.
Jake kiseline: H 2 SO 4 , HNO 3 , HClO 3 , HClO 4 , HCl, HBr, HI
Ostali su slabi.
Na primjer, Na 2 CO 3 - Sol se sastoji od slabe kiseline i jake baze
1. Napišite jednačinu disocijacije soli. Na 2 CO 3Û 2Na ++ CO 3 2-
slab anjon
2. Odaberite slab ion: kation ili anion.
3. Zabilježite njegovu interakciju s vodom. CO 3 2- + H + OH - Û HCO 3 - + ON -
4. Odredite okruženje rješenja: ON -- alkalna sredina, H + - kisela sredina, odsustvo H + i OH - neutralna.
Ovo je slučaj anjonska hidroliza.
2. Opća hemijska svojstva metala.
Pogledajte kartu 11, pitanje 2 za odgovor.
3. Koliko grama joda i alkohola treba uzeti da se pripremi 30 g 5% rastvora tinkture joda?
Prilikom pripreme za ispit pogledajte rješenje u laboratorijskom dnevniku - praktični rad br.1.
Ulaznica 14.
1 . Izrada formula hemijskih supstanci prema stepenu oksidacije.
1. Zapišite oksidaciona stanja:
Za prvi element, konstanta je najveća (po broju grupe) ili varijabla (navedena u nazivu supstance)
Za drugi - najniži (- (8-br. gr.)), ili prema tabeli rastvorljivosti (za grupu elemenata);
2. Unakrsno rušimo oksidaciona stanja - dobijamo indekse (ako je potrebno - smanjimo).
Na primjer.
1) čine aluminijum oksid: Al 2 +3 O 3 -2
2) dopunski olovni (IV) sulfid: Pb 2 +4 S 4 -2 → PbS 2
3) praviti kalcijum sulfat: Ca +2 SO 4 -2
2. podgrupa halogena.
Kada se pripremate za ispit, pogledajte odgovor u listiću 3, pitanje 2.
3. Izvršite reakcije koje potvrđuju kvalitativni sastav barij hlorida.
BaCl 2 Û Ba 2+ + 2Cl -
Ba 2+ + SO 4 2-® Ba SO 4 ¯ (bijeli fini kristalni talog)
Sl - + Ag + ® Ag Sl ¯ (bijeli sirasti talog)
Ulaznica 15.
1. Reakcije jonske izmjene.
Da bi se snimila reakcija jonske razmene, mora se slediti sledeći algoritam.
1. Napišite jednačinu molekularne reakcije
Fe(NO 3) 3 + 3NaOH = Fe(OH) 3 + 3NaNO 3
2. Provjerite mogućnost reakcije (produkti reakcije: talog, plin ili voda)
Fe(NO 3) 3 + 3NaOH = Fe(OH) 3↓ + 3NaNO3
3. Zapišite jednačinu ionske reakcije, ne zaboravljajući:
Ostavljamo u obliku molekula - slabog elektrolita (H 2 O) i neelektrolita, taloga ili plina;
Odnosi se koeficijent ispred formule neke supstance oba jona!
· Formule poliatomskih (kompleksnih) jona se ne razbijaju: OH - , CO3 2- , PO4 3- itd.
Indeks nakon jednostavnog jona ili zagrada ide u ionskoj jednadžbi u koeficijent prije njega
Fe 3+ + 3(NO 3) - + 3Na + + 3OH - = Fe(OH)3↓ + 3Na + + NO 3 -
4. "Smanjiti" slično
Fe3+ + 3NO3 - + 3Na++ 3OH - = Fe(OH)3↓ + 3Na+ + NE 3 -
5. Prepišite redukovanu ionsku jednačinu
Fe 3+ + 3OH - \u003d Fe(OH)3↓
2. Opće karakteristike alkalnih metala: struktura atoma i fizička svojstva jednostavnih supstanci.
Sporazum
Pravila za registraciju korisnika na sajtu "ZNAK KVALITETA":
Zabranjeno je registrovati korisnike sa nadimcima kao što su: 111111, 123456, ytsukenb, lox, itd.;
Zabranjena je ponovna registracija na sajtu (kreiranje duplikata naloga);
Zabranjeno je koristiti tuđe podatke;
Zabranjeno je korištenje tuđih e-mail adresa;
Pravila ponašanja na stranici, forumu i u komentarima:
1.2. Objavljivanje ličnih podataka drugih korisnika u upitniku.
1.3. Bilo kakve destruktivne radnje u vezi sa ovim resursom (destruktivne skripte, pogađanje lozinke, kršenje sigurnosnog sistema, itd.).
1.4. Upotreba opscenih riječi i izraza kao nadimka; izrazi koji krše zakone Ruske Federacije, norme etike i morala; riječi i fraze slične nadimcima administracije i moderatora.
4. Prekršaji 2. kategorije: kažnjivi potpunom zabranom slanja bilo koje vrste poruka do 7 dana. 4.1 Postavljanje informacija koje potpadaju pod Krivični zakon Ruske Federacije, Upravni zakonik Ruske Federacije i suprotno Ustavu Ruske Federacije.
4.2. Propaganda u bilo kom obliku ekstremizma, nasilja, okrutnosti, fašizma, nacizma, terorizma, rasizma; raspirivanje međunacionalne, međureligijske i društvene mržnje.
4.3. Netačna diskusija o radu i vređanje autora tekstova i beleški objavljenih na stranicama "ZNAKA KVALITETA".
4.4. Prijetnje članovima foruma.
4.5. Plasiranje namjerno lažnih informacija, kleveta i drugih informacija koje diskredituju čast i dostojanstvo kako korisnika tako i drugih ljudi.
4.6. Pornografija u avatarima, porukama i citatima, kao i linkovi na pornografske slike i resurse.
4.7. Otvorena diskusija o postupanju administracije i moderatora.
4.8. Javna rasprava i evaluacija postojećih pravila u bilo kom obliku.
5.1. Mat i vulgarnost.
5.2. Provokacije (lični napadi, lična diskreditacija, formiranje negativne emocionalne reakcije) i uznemiravanje učesnika u diskusiji (sistematska upotreba provokacija u odnosu na jednog ili više učesnika).
5.3. Provociranje korisnika da se međusobno sukobljavaju.
5.4. Bezobrazluk i bezobrazluk prema sagovornicima.
5.5. Prelazak na pojedinca i razjašnjavanje ličnih odnosa na temama foruma.
5.6. Poplava (identične ili besmislene poruke).
5.7. Namjerno pogrešno napisane nadimke i imena drugih korisnika na uvredljiv način.
5.8. Uređivanje citiranih poruka, iskrivljavanje njihovog značenja.
5.9. Objavljivanje lične prepiske bez izričitog pristanka sagovornika.
5.11. Destruktivno trolovanje je svrsishodna transformacija rasprave u okršaj.
6.1. Preveliko citiranje (pretjerano citiranje) poruka.
6.2. Upotreba crvenog fonta, namijenjenog za ispravke i komentare moderatora.
6.3. Nastavak rasprave o temama koje je zatvorio moderator ili administrator.
6.4. Kreiranje tema koje nemaju semantički sadržaj ili su provokativnog sadržaja.
6.5. Kreiranje naslova teme ili poruke u cijelosti ili djelimično velikim slovima ili na stranom jeziku. Izuzetak su naslovi stalnih tema i teme koje otvaraju moderatori.
6.6. Kreiranje natpisa u fontu većem od fonta posta i korištenje više od jedne boje palete u naslovu.
7. Sankcije koje se primjenjuju na prekršioce Pravila Foruma
7.1. Privremena ili trajna zabrana pristupa Forumu.
7.4. Brisanje naloga.
7.5. IP blokiranje.
8. Napomene
8.1 Primjena sankcija od strane moderatora i administracije može se izvršiti bez objašnjenja.
8.2. Ova pravila su podložna promjenama, o čemu će svi članovi stranice biti izvijestili.
8.3. Korisnicima je zabranjeno korištenje klonova u periodu kada je glavni nadimak blokiran. U tom slučaju, klon je blokiran na neodređeno vrijeme, a glavni nadimak će dobiti dodatni dan.
8.4 Poruku koja sadrži nepristojan jezik može urediti moderator ili administrator.
9. Administracija Administracija sajta "ZNAK KVALITET" zadržava pravo brisanja bilo koje poruke i teme bez objašnjenja. Administracija sajta zadržava pravo da uređuje poruke i profil korisnika ukoliko informacije u njima samo delimično krše pravila foruma. Ova ovlaštenja se odnose na moderatore i administratore. Uprava zadržava pravo da po potrebi izmijeni ili dopuni ova Pravila. Nepoznavanje pravila ne oslobađa korisnika odgovornosti za njihovo kršenje. Administracija stranice nije u mogućnosti provjeriti sve informacije koje objavljuju korisnici. Sve poruke odražavaju samo mišljenje autora i ne mogu se koristiti za procjenu mišljenja svih učesnika foruma u cjelini. Poruke osoblja i moderatora sajta su izraz njihovog ličnog mišljenja i možda se ne poklapaju sa mišljenjem urednika i menadžmenta sajta.