Химическими веществами называют то, из чего состоит окружающий нас мир.
Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние (твердое, жидкое или газообразное), теплопроводность, теплоемкость, растворимость в различных средах (вода, спирт и др.), плотность, цвет, вкус и т.д.
Превращения одних химических веществ в другие вещества называют химическими явлениями или химическими реакциями. Следует отметить, что существуют также и физические явления, которые, очевидно, сопровождаются изменением каких-либо физических свойств вещества без его превращения в другие вещества. К физическим явлениям, например, относятся плавление льда, замерзание или испарение воды и др.
О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и (или) света.
Так, например, вывод о протекании химических реакций можно сделать, наблюдая:
Образование осадка при кипячении воды, называемого в быту накипью;
Выделение тепла и света при горении костра;
Изменение цвета среза свежего яблока на воздухе;
Образование газовых пузырьков при брожении теста и т.д.
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Сама идея о существовании таких единиц материи возникла еще в древней Греции в умах античных философов, что собственно и объясняет происхождение термина «атом», поскольку «атомос» в буквальном переводе с греческого означает «неделимый».
Тем не менее, вопреки идее древнегреческих философов, атомы не являются абсолютным минимумом материи, т.е. сами имеют сложное строение.
Каждый атом состоит из так называемых субатомных частиц – протонов, нейтронов и электронов, обозначаемых соответственно символами p + , n o и e − . Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Что касается качественного устройства атома, то у каждого атома все протоны и нейтроны сосредоточены в так называемом ядре, вокруг которого электроны образуют электронную оболочку.
Протон и нейтрон обладают практически одинаковыми массами, т.е. m p ≈ m n , а масса электрона почти в 2000 раз меньше массы каждого из них, т.е. m p /m e ≈ m n /m e ≈ 2000.
Поскольку фундаментальным свойством атома является его электронейтральность, а заряд одного электрона равен заряду одного протона, из этого можно сделать вывод о том, что количество электронов в любом атоме равно количеству протонов.
Так, например, в таблице ниже представлен возможный состав атомов:
Вид атомов с одинаковым зарядом ядер, т.е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
Каждый химический элемент имеет свое название и индивидуальный символ, который читается определенным образом. Так, например, самый простой химический элемент, атомы которого содержат в ядре только один протон, имеет название «водород» и обозначается символом «Н», что читается как «аш», а химический элемент с зарядом ядра +7 (т.е. содержащий 7 протонов) — «азот», имеет символ «N» , который читается как «эн».
Как можно заметить из представленной выше таблицы, атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Так, например, химический элемент водород имеет три изотопа – 1 Н, 2 Н и 3 Н. Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1 Н вообще нет нейтронов (1-1=0), в изотопе 2 Н – 1 нейтрон (2-1=1) и в изотопе 3 Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2 Н практически в два раза тяжелее изотопа 1 Н, а изотоп 3 Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2 Н и 3 Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2 Н дали название дейтерий и присвоили символ D, а изотопу 3 Н дали название тритий и присвоили символ Т.
Если принять массу протона и нейтрона за единицу, а массой электрона пренебречь, фактически верхний левый индекс помимо суммарного количества протонов и нейтронов в атоме можно считать его массой, в связи с чем этот индекс называют массовым числом и обозначают символом А. Поскольку за заряд ядра любого атома отвечают протоны, а заряд каждого протона условно считается равным +1, количество протонов в ядре называют зарядовым числом (Z). Обозначив количество нейтронов в атоме буквой N, математически взаимосвязь между массовым числом, зарядовым числом и количеством нейтронов можно выразить как:
Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Графически одну атомную орбиталь принято обозначать в виде квадратной ячейки:
Квантовая механика имеет крайне сложный математический аппарат, поэтому в рамках школьного курса химии рассматриваются только лишь следствия квантово-механической теории.
Согласно этим следствиям, любую атомную орбиталь и находящийся на ней электрон полностью характеризуют 4 квантовых числа.
- Главное квантовое число – n — определяет общую энергию электрона на данной орбитали. Диапазон значений главного квантового числа – все натуральные числа, т.е. n = 1,2,3,4, 5 и т.д.
- Орбитальное квантовое число — l – характеризует форму атомной орбитали и может принимать любые целочисленные значения от 0 до n-1, где n, напомним, — это главное квантовое число.
Орбитали с l = 0 называют s -орбиталями . s-Орбитали имеют сферическую форму и не обладают направленностью в пространстве:
Орбитали с l = 1 называются p -орбиталями . Данные орбитали обладают формой трехмерной восьмерки, т.е. формой, полученной вращением восьмерки вокруг оси симметрии, и внешне напоминают гантель:
Орбитали с l = 2 называются d -орбиталями , а с l = 3 – f -орбиталями . Их строение намного более сложное.
3) Магнитное квантовое число – m l – определяет пространственную ориентацию конкретной атомной орбитали и выражает проекцию орбитального момента импульса на направление магнитного поля. Магнитное квантовое число m l соответствует ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля и может принимать любые целочисленные значения от –l до +l, включая 0, т.е. общее количество возможных значений равно (2l+1). Так, например, при l = 0 m l = 0 (одно значение), при l = 1 m l = -1, 0, +1 (три значения), при l = 2 m l = -2, -1, 0, +1, +2 (пять значений магнитного квантового числа) и т.д.
Так, например, p-орбитали, т.е. орбитали с орбитальным квантовым числом l = 1, имеющие форму «трехмерной восьмерки», соответствуют трем значениям магнитного квантового числа (-1, 0, +1), что, в свою очередь, соответствует трем перпендикулярным друг другу направлениям в пространстве.
4) Спиновое квантовое число (или просто спин) — m s — условно можно считать отвечающим за направление вращения электрона в атоме, оно может принимать значения. Электроны с разными спинами обозначают вертикальными стрелками, направленными в разные стороны: ↓ и .
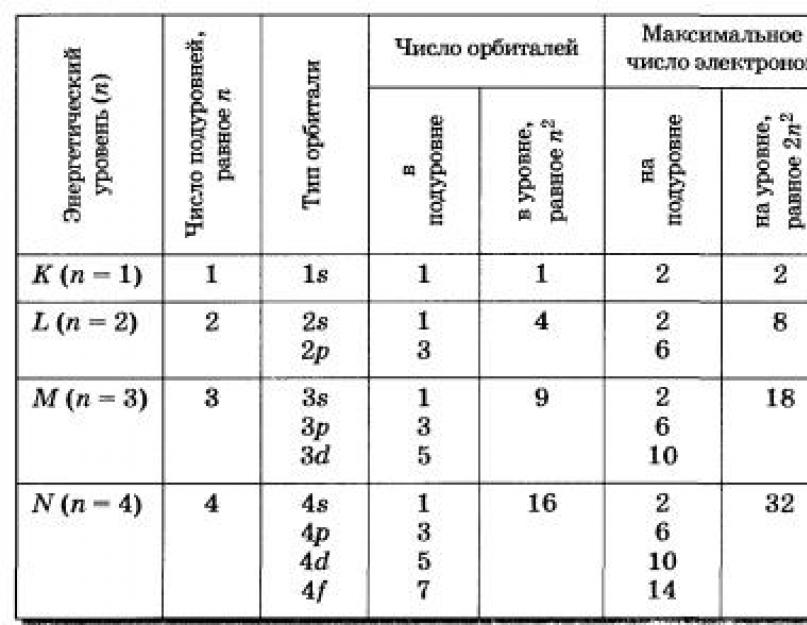
Совокупность всех орбиталей в атоме, имеющих одно и то же значение главного квантового числа, называют энергетическим уровнем или электронной оболочкой. Любой произвольный энергетический уровень с некоторым номером n состоит из n 2 орбиталей.
Множество орбиталей с одинаковыми значениями главного квантового числа и орбитального квантового числа представляет собой энергетический подуровень.
Каждый энергетический уровень, которому соответствует главное квантовое число n, содержит n подуровней. В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:
Каждой орбитали соответствует индивидуальный строго определенный набор трех квантовых чисел n, l и m l .
Распределение электронов по орбиталям называют электронной конфигурацией.
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
- Принцип минимума энергии : электроны заполняют орбитали, начиная с подуровня с наименьшей энергией. Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Для того чтобы проще запомнить данную последовательность заполнения электронных подуровней, весьма удобна следующая графическая иллюстрация:
- Принцип Паули : на каждой орбитали может находиться не более двух электронов.
Если на орбитали находится один электрон, то он называется неспаренным, а если два, то их называют электронной парой.
- Правило Хунда : наиболее устойчивое состояние атома является такое, при котором в пределах одного подуровня атом обладает максимально возможным числом неспаренных электронов. Такое наиболее устойчивое состояние атома называется основным состоянием.
Фактически вышесказанное означает то, что, например, размещение 1-го, 2-х, 3-х и 4-х электронов на трех орбиталях p-подуровня будет осуществляться следующим образом:
Заполнение атомных орбиталей от водорода, имеющего зарядовое число равное 1, до криптона (Kr) с зарядовым числом 36 будет осуществляться следующим образом:
Подобное изображение порядка заполнения атомных орбиталей называется энергетической диаграммой. Исходя из электронных диаграмм отдельных элементов, можно записать их так называемые электронные формулы (конфигурации). Так, например, элемент с 15ю протонами и, как следствие, 15ю электронами, т.е. фосфор (P), будет иметь следующий вид энергетической диаграммы:
При переводе в электронную формулу атома фосфора примет вид:
15 P = 1s 2 2s 2 2p 6 3s 2 3p 3
Цифрами нормального размера слева от символа подуровня показан номер энергетического уровня, а верхними индексами справа от символа подуровня показано количество электронов на соответствующем подуровне.
Ниже приведены электронные формул первых 36 элементов периодической системы Д.И. Менделеева.
| период | № элемента | символ | название | электронная формула |
| I | 1 | H | водород | 1s 1 |
| 2 | He | гелий | 1s 2 | |
| II | 3 | Li | литий | 1s 2 2s 1 |
| 4 | Be | бериллий | 1s 2 2s 2 | |
| 5 | B | бор | 1s 2 2s 2 2p 1 | |
| 6 | C | углерод | 1s 2 2s 2 2p 2 | |
| 7 | N | азот | 1s 2 2s 2 2p 3 | |
| 8 | O | кислород | 1s 2 2s 2 2p 4 | |
| 9 | F | фтор | 1s 2 2s 2 2p 5 | |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 | |
| III | 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 | |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| IV | 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
Как уже было сказано, в основном своем состоянии электроны в атомных орбиталях расположены согласно принципу наименьшей энергии. Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
5 B = 1s 2 2s 2 2p 1
А в возбужденном состояниии (*), т.е. при сообщении некоторой энергии атому бора, его электронная конфигурация и энергетическая диаграмма будут выглядеть так:
5 B* = 1s 2 2s 1 2p 2
В зависимости от того, какой подуровень в атоме заполняется последним, химические элементы делят на s, p, d или f.
Нахождение s, p, d и f-элементов в таблице Д.И. Менделеева:
- У s-элементов последний заполняемый s-подуровень. К данным элементам относятся элементы главных (слева в ячейке таблицы) подгрупп I и II групп.
- У p-элементов заполняется p-подуровень. К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп.
- d-Элементы расположены между s – и p-элементами в больших периодах.
- f-Элементы называют лантаноидами и актиноидами. Они вынесены вниз таблицы Д.И. Менделеева.
>> Химия: Электронные конфигурации атомов химических элементов
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского «веретено»), то есть обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемой оси: по часовой или против часовой стрелки. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, то есть электроны с противоположными спинами.
На рисунке 5 показана схема подразделения энергетических уровней на подуровни.
s-Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода (s = 1) располагается на этой ор-битали и неспарен. Поэтому его электронная формула или электронная конфигурация будет записываться так: 1s 1 . В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой (1 ...), латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа вверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной s-орбитали, эта формула: 1s 2 .
Электронная оболочка атома гелия завершена и очень устойчива. Гелий - это благородный газ.
На втором энергетическом уровне (n = 2) имеется четыре орбитали: одна s и три р. Электроны s-орбитали второго уровня (2s-орбитали) обладают более высокой энергией, так как находятся на большем расстоянии от ядра, чем электроны 1s-орбитали (n = 2).
Вообще, для каждого значения n существует одна s-орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения n.
р-Орбиталь имеет форму гантели или объемной восьмерки. Все три р-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с n = 2, имеет три р-орбитали. С увеличением значения n электроны анимают р-орбитали, расположенные на больших расстояниях от ядра и направленные по осям х, у, г.
У элементов второго периода (n = 2) заполняется сначала одна в-орбиталь, а затем три р-орбитали. Электронная формула 1л: 1s 2 2s 1 . Электрон слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион Li+.
В атоме бериллия Ве 0 четвертый электрон также размещается на 2s-орбитали: 1s 2 2s 2 . Два внешних электрона атома бериллия легко отрываются - Ве 0 при этом окисляется в катион Ве 2+ .
У атома бора пятый электрон занимает 2р-орбиталь: 1s 2 2s 2 2р 1 . Далее у атомов С, N, О, Е идет заполнение 2р-орбиталей, которое заканчивается у благородного газа неона: 1s 2 2s 2 2р 6 .
У элементов третьего периода заполняются соответственно Зв- и Зр-орбитали. Пять d-орбиталей третьего уровня при этом остаются свободными:
11 Nа 1s 2 2s 2 Зв1; 17С11в22822р63р5; 18Аг П^Ёр^Зр6.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно 4я- и 5я-орбитали: 19 К 2, 8, 8, 1; 38 Sr 2, 8, 18, 8, 2. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие 3d- и 4d- орбитали соответственно (у элементов побочных подгрупп): 23 V 2, 8, 11, 2; 26 Tr 2, 8, 14, 2; 40 Zr 2, 8, 18, 10, 2; 43 Тг 2, 8, 18, 13, 2. Как правило, тогда, когда будет заполнен предыдущий d-подуровень, начнет заполняться внешний (соответственно 4р- и 5р) р-подуровень.
У элементов больших периодов - шестого и незавершенного седьмого - электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступят на внешний в-подуровень: 56 Ва 2, 8, 18, 18, 8, 2; 87Гг 2, 8, 18, 32, 18, 8, 1; следующий один электрон (у Nа и Ас) на предыдущий (p-подуровень: 57 Lа 2, 8, 18, 18, 9, 2 и 89 Ас 2, 8, 18, 32, 18, 9, 2.
Затем последующие 14 электронов поступят на третий снаружи энергетический уровень на 4f- и 5f-орбитали соответственно у лантаноидов и актиноидов.
Затем снова начнет застраиваться второй снаружи энергетический уровень (d-подуровень): у элементов побочных подгрупп: 73 Та 2, 8,18, 32,11, 2; 104 Rf 2, 8,18, 32, 32,10, 2, - и, наконец, только после полного заполнения десятью электронами сйгоду-ровня будет снова заполняться внешний р-подуровень:
86 Rn 2, 8, 18, 32, 18, 8.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек - записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными.
В заключение еще раз рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева . Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
В атоме гелия первый электронный слой завершен - в нем 2 электрона.
Водород и гелий - s-элементы, у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен и электроны заполняют е- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s-, а затем р) и правилами Паули и Хунда (табл. 2).
В атоме неона второй электронный слой завершен - в нем 8 электронов.
Таблица 2 Строение электронных оболочек атомов элементов второго периода

Окончание табл. 2
Li, Ве - в-элементы.
В, С, N, О, F, Nе - р-элементы, у этих атомов заполняются электронами р-орбитали.
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать Зs-, 3р- и Зd-подуровни (табл. 3).
Таблица 3 Строение электронных оболочек атомов элементов третьего периода

У атома магния достраивается Зs-электронная орбиталь. Nа и Mg- s-элементы.
В атоме аргона на внешнем слое (третьем электронном слое) 8 электронов. Как внешний слой, он завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными Зd-орбитали.
Все элементы от Аl до Аг - р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень (табл. 4), так как он имеет меньшую энергию, чем Зй-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода: 1) обозначим условно графическую электронную формулу аргона так:
Аr;
2) не будем изображать подуровни, которые у этих атомов не заполняются.
Таблица 4 Строение электронных оболочек атомов элементов четвертого периода


К, Са - s-элементы, входящие в главные подгруппы. У атомов от Sс до Zn заполняется электронами Зй-подуровень. Это Зй-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4я- на Зй-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций Зd 5 и Зd 10:
В атоме цинка третий электронный слой завершен - в нем заполнены все подуровни 3s, Зр и Зd, всего на них 18 электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень: Элементы от Gа до Кr - р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое, как вы знаете, может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f- подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s-> 4d -> 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41 Nb, 42 MO и т.д.
В шестом и седьмом периодах появляются элементы, то есть элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-Элементы называют лантаноидами.
5f-Элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55 Сs и 56 Ва - 6s-элементы;
57 Lа... 6s 2 5d 1 - 5d-элемент; 58 Се - 71 Lu - 4f-элементы; 72 Hf - 80 Нg - 5d-элементы; 81 Тl- 86 Rn - 6р-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f подуровней, то есть nf 7 и nf 14 .
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства или блока (рис. 7).
1) s-Элементы; заполняется электронами в-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
2) р-элементы; заполняется электронами р-подуровень внешнего уровня атома; к р элементам относятся элементы главных подгрупп III-VIII групп;
3) d-элементы; заполняется электронами d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I-VIII групп, то есть элементы вставных декад больших периодов, расположенные между s- и р-элементами. Их также называют переходными элементами;
4) f-элементы, заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
1. Что было бы, если бы принцип Паули не соблюдался?
2. Что было бы, если бы правило Хунда не соблюдалось?
3. Составьте схемы электронного строения, электронные формулы и графические электронные формулы атомов следующих химических элементов: Са, Fе, Zr, Sn, Nb, Hf, Ра.
4. Напишите электронную формулу элемента № 110, используя символ соответствующего благородного газа.
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные урокиЭлектронные конфигурации атомов
Электроны в атоме занимают уровни, подуровни и орбитали согласно следующим правилам.
Правило Паули . В одном атоме два электрона не могут иметь четыре одинаковых квантовых числа. Они должны отличаться, по меньшей мере, одним квантовым числом.
Орбиталь содержит электроны с определенными числами n, l, m l и электроны на ней могут отличаться только квантовым числом m s , имеющим два значения +1/2 и -1/2. Поэтому на орбитали могут располагаться не более двух электронов.
На подуровне электроны имеют определенные n и l и различаются числами m l и m s . Поскольку m l может принимать 2l+1 значение, а m s - 2 значения, то на подуровне может содержаться не более 2(2l+1) электронов. Отсюда максимальные числа электронов на s-, p-, d-, f-подуровнях равны соответственно 2, 6, 10, 14 электронов.
Аналогично на уровне содержится не более 2n 2 электронов и максимальное число электронов на четырех первых уровнях не должно превышать 2, 8, 18 и 32 электронов соответственно.
Правило наименьшей энергии. Последовательное заполнение уровней должно происходить так, чтобы обеспечить минимальную энергию атома. Каждый электрон занимает свободную орбиталь с наименьшей энергией.
Правило Клечковского . Заполнение электронных подуровней осуществляется в порядке возрастания суммы (n+l), а в случае одинаковой суммы (n+l) - в порядке возрастания числа n.
Графическая форма правила Клечковского.
Cогласно правилу Клечковского заполнение подуровней осуществляется в следующем порядке: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s,...
Хотя заполнение подуровней происходит по правилу Клечковского, в электронной формуле подуровни записываются последовательно по уровням: 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f и т.д. Это связано с тем, что энергия заполненных уровней определяется квантовым числом n: чем больше n, тем больше энергия и для полностью заполненных уровней мы имеем Е 3d Уменьшение энергии подуровней с меньшими n и большими l в случае, если они заполнены полностью или наполовину, приводит для ряда атомов к электронным конфигурациям, отличающимся от предсказанных по правилу Клечковского. Так для Cr и Cu мы имеем на валентном уровне распределение: Cr(24e) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 и Cu(29e) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 , а не Cr(24e) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s 2 и Cu(29e) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 . Правило Гунда
. Заполнение орбиталей данного подуровня осуществляется так, чтобы суммарный спин был максимален. Орбитали данного подуровня заполняются сначала по одному электрону. Например, для конфигурации р 2 заполнение p x 1 p y 1 с суммарным спином s = 1/2 + 1/2 = 1 предпочтительнее (т.е. ему соответствует меньшая энергия), чем заполнение p x 2 с суммарным спином s = 1/2 - 1/2 = 0. - более выгодно, ¯ - менее выгодно. Электронные конфигурации атомов можно записать по уровням, подуровням, орбиталям. В последнем случае орбиталь обычно обозначают квантовой ячейкой, а электроны - стрелками, имеющими то или иное направление в зависимости от величины m s . Например, электронная формула Р(15е) может быть записана: а) по уровням)2)8)5 б) по подуровням 1s 2 2s 2 2p 6 3s 2 3p 3 в) по орбиталям 1s 2 2s 2 2p x 2 2p y 2 2p z 2 3s 2 3p x 1 3p y 1 3p z 1 или ¯ ¯ ¯ ¯ ¯ ¯ Пример.
Записать электронные формулы Ti(22e) и As(33e) по подуровням. Титан находится в 4 периоде, поэтому записываем подуровни до 4р: 1s2s2p3s3p3d4s4p и заполняем их электронами до их общего числа 22, при этом незаполненные подуровни в окончательную формулу не включаем. Получаем. Первоначально элементы в Периодической таблице химических элементов Д.И. Менделеева были расположены в соответствии с их атомными массами и химическими
свойствами, но на самом деле оказалось, что решающую роль играет не масса атома, а заряд ядра и, соответственно, число электронов в нейтральном атоме. Наиболее устойчивое состояние электрона в атоме химического элемента соответствует минимуму его энергии, а любое другое состояние называется возбужденным,
в нем электрон может самопроизвольно переходить на уровень с более низкой энергией. Рассмотрим, как распределяются электроны в атоме по орбиталям, т.е. электронную конфигурацию многоэлектронного атома в основном состоянии. Для построения
электронной конфигурации пользуются следующими принципами заполнения орбиталей электронами: — принцип (запрет) Паули – в атоме не может быть двух электронов с одинаковым набором всех 4-х квантовых чисел; — принцип наименьшей энергии (правила Клечковского) – орбитали заполняют электронами в порядке возрастания энергии орбиталей (рис. 1). Рис. 1. Распределение орбиталей водородоподобного атома по энергиям; n – главное квантовое число. Энергия орбитали зависит от суммы (n + l). Орбитали заполняются электронами в порядке возрастания суммы (n + l) для этих ортиталей. Так, для подуровней 3d
и 4s суммы (n + l) будут равны 5 и 4, соответственно, вследствие чего, первой будет заполняться 4s орбиталь. Если сумма (n + l) одинакова для двух
орбиталей, то первой заполняется орбиталь с меньшим значением n. Так, для 3d и 4p орбиталей сумма (n + l) будет равна 5 для каждой орбитали, но первой
заполняется 3d орбиталь. В соответствии с этими правилами порядок заполнения орбиталей будет следующим: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d<4f<6p<7s<6d<5f<7p Семейство элемента определяется по орбитали, заполняемой электронами в последнюю очередь, в соответствии с энергией. Однако, нельзя записывать электронные
формулы в соответствии с энергетическим рядом. 41 Nb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 3 5s 2 правильная
запись электронной конфигурации 41 Nb 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 3 неверная
запись электронной конфигурации Для первых пяти d – элементов валентными (т.е., электроны, отвечающие за образование химической связи) являются сумма электронов на d и s, заполненных
электронами в последнюю очередь. Для p – элементов валентными являются сумма электронов, находящихся на s и p подуровнях. Для s-элементов валентыми
являются электроны, находящиеся на s подуровне внешнего энергетического уровня. — правило Хунда – при одном значении l электроны заполняют орбитали таким образом, чтобы суммарный спин был максимальным (рис. 2) Рис. 2. Изменение энергии у 1s -, 2s – 2p – орбиталей атомов 2-го периода Периодической системы. Примеры построения электронных конфигураций атомов приведены в таблице 1. Таблица 1. Примеры построения электронных конфигураций атомов Электронная конфигурация Применяемые правила Принцип Паули, правила Клечковского Правило Хунда 1s 2 2s 2 2p 6 4s 1 Правила Клечковского Электронная конфигурация элемента это запись распределения электронов в его атомах по оболочкам, подоболочкам и орбиталям. Электронная конфигурация обычно записывается для атомов в их основном состоянии. Электронная конфигурация атома, у которого один или несколько электронов находятся в возбужденном состоянии, называется возбужденной конфигурацией. Для определения конкретной электронной конфигурации элемента в основном состоянии существуют следующие три правила: Правило 1: принцип заполнения. Согласно принципу заполнения, электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми. Водород; атомный номер = 1; число электронов = 1 Этот единственный в атоме водорода электрон должен занимать s-орбиталь К-обо-лочки, поскольку из всех возможных орбиталей она имеет самую низкую энергию (см. рис. 1.21). Электрон на этой s-орбитали называется ls-электрон. Водород в основном состоянии имеет электронную конфигурацию Is1. Правило 2: принцип запрета Паули
. Согласно этому принципу, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа). Литий; атомный номер = 3; число электронов = 3 Орбиталь с самой низкой энергией-это 1s-орбиталъ. Она может принять на себя только два электрона. У этих электронов должны быть неодинаковые спины. Если обозначать спин +1/2 стрелкой, направленной вверх, а спин -1/2 стрелкой, направленной вниз, то два электрона с противоположными (антипараллельными) спинами на одной орбитали схематически можно представить записью (рис. 1.27) На одной орбитали не могут находиться два электрона с одинаковыми (параллельными) спинами: Третий электрон в атоме лития должен занимать орбиталь, следующую по энергии за самой низкой орбиталью, т.е. 2в-орбиталь. Таким образом, литий имеет электронную конфигурацию Is22s1. Правило 3: правило Гунда
. Согласно этому правилу, заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заполнение орбиталей парами электронов с противоположными спинами. Азот; атомный номер = 7; число электронов = 7 Азот имеет электронную конфигурацию ls22s22p3. Три электрона, находящиеся на 2р-подоболочке, должны располагаться поодиночке на каждой из трех 2р-орбиталей. При этом все три электрона должны иметь параллельные спины (рис. 1.22). В табл. 1.6 показаны электронные конфигурации элементов с атомными номерами от 1 до 20. Таблица 1.6. Электронные конфигурации основного состояния для элементов с атомным номером от 1 до 20
Примеры построения электронных конфигураций атомов