Fizička svojstva ozona su vrlo karakteristična: to je lako eksplozivan plin plave boje. Litar ozona teži oko 2 grama, a zraka - 1,3 grama. Dakle, ozon je teži od vazduha. Tačka topljenja ozona je minus 192,7ºS. Ovaj „otopljeni“ ozon je tamnoplava tečnost. Ozonski "led" ima tamnoplavu boju sa ljubičastom nijansom i postaje neproziran kada je debljina veća od 1 mm. Tačka ključanja ozona je minus 112ºS. U gasovitom stanju ozon je dijamagnetičan, tj. nema magnetna svojstva, a u tečnom stanju je slabo paramagnetna. Rastvorljivost ozona u otopljenoj vodi je 15 puta veća od rastvorljivosti kiseonika i iznosi približno 1,1 g/l. 2,5 grama ozona se rastvara u litru sirćetne kiseline na sobnoj temperaturi. Takođe se dobro otapa u eteričnim uljima, terpentinu, ugljen tetrahlorid. Miris ozona se osjeća pri koncentracijama iznad 15 µg/m3 zraka. U minimalnim koncentracijama doživljava se kao „miris svježine“, u višim koncentracijama poprima oštru, iritantnu nijansu.
Ozon se formira iz kiseonika prema sledećoj formuli: 3O2 + 68 kcal → 2O3. Klasični primjeri stvaranja ozona: pod uticajem munje tokom grmljavine; pod uticajem sunčeve svetlosti u gornjim slojevima atmosfere. Ozon se također može formirati tijekom bilo kojeg procesa praćenog oslobađanjem atomskog kisika, na primjer, tokom razgradnje vodikovog peroksida. Industrijska sinteza ozona uključuje korištenje električnih pražnjenja na niskim temperaturama. Tehnologije za proizvodnju ozona mogu se razlikovati jedna od druge. Dakle, za proizvodnju ozona koji se koristi u medicinske svrhe koristi se samo čisti (bez nečistoća) medicinski kisik. Odvajanje nastalog ozona od nečistoća kisika obično nije teško zbog razlika u fizičkim svojstvima (ozon se lakše ukapljuje). Ako određeni kvalitativni i kvantitativni parametri reakcije nisu potrebni, onda dobivanje ozona ne predstavlja posebne poteškoće.
Molekul O3 je nestabilan i prilično se brzo pretvara u O2 uz oslobađanje topline. U malim koncentracijama i bez stranih nečistoća, ozon se razgrađuje sporo, pri velikim koncentracijama razgrađuje eksplozivno. Alkohol se odmah zapali u kontaktu s njim. Zagrijavanje i kontakt ozona čak i s neznatnim količinama oksidacijskog supstrata (organske tvari, neki metali ili njihovi oksidi) naglo ubrzava njegovu razgradnju. Ozon se može dugo čuvati na -78ºS u prisustvu stabilizatora (mala količina HNO3), kao iu posudama od stakla, neke plastike ili plemenitih metala.
Ozon je najjači oksidant. Razlog za ovaj fenomen leži u činjenici da atomski kiseonik nastaje tokom procesa raspadanja. Takav kisik je mnogo agresivniji od molekularnog kisika, jer u molekuli kisika nedostatak elektrona na vanjskom nivou zbog njihove kolektivne upotrebe molekularne orbitale nije toliko primjetan.
Još u 18. veku primećeno je da živa u prisustvu ozona gubi sjaj i lepi se za staklo, tj. oksidira. A kada se ozon prođe kroz vodeni rastvor kalijum jodida, gasni jod počinje da se oslobađa. Isti "trikovi" nisu funkcionisali sa čistim kiseonikom. Nakon toga su otkrivena svojstva ozona, koja je čovječanstvo odmah usvojilo: ozon se pokazao odličnim antiseptikom, ozon je brzo uklonio organske tvari bilo kojeg porijekla (parfemi i kozmetika, biološke tekućine) iz vode, počeo se široko koristiti u industriji i svakodnevnom životu, te se pokazao kao alternativa zubnoj bušilici.
U 21. veku upotreba ozona u svim oblastima ljudskog života i aktivnosti raste i razvija se, pa smo svjedoci njegove transformacije iz egzotike u poznato sredstvo za svakodnevni rad. OZON O3, alotropni oblik kiseonika.
Priznanica i fizička svojstva ozona.
Naučnici su prvi put saznali za postojanje nepoznatog gasa kada su počeli eksperimentisati sa elektrostatičkim mašinama. To se dogodilo u 17. veku. Ali novi gas su počeli da proučavaju tek krajem sledećeg veka. Godine 1785, holandski fizičar Martin van Marum dobio je ozon propuštanjem električnih varnica kroz kiseonik. Naziv ozon pojavio se tek 1840. godine; izumio ga je švajcarski hemičar Christian Schönbein, izvodeći ga iz grčke reči ozon – miris. Hemijski sastav ovog gasa nije se razlikovao od kiseonika, ali je bio mnogo agresivniji. Tako je odmah oksidirao bezbojni kalijum jodid, oslobađajući smeđi jod; Schönbein je koristio ovu reakciju da odredi ozon prema stepenu plavetnila papira natopljenog rastvorom kalijum jodida i škroba. Čak i živa i srebro, koji su neaktivni na sobnoj temperaturi, oksidiraju se u prisustvu ozona.
Ispostavilo se da se molekule ozona, kao i kisik, sastoje samo od atoma kisika, ali ne dva, već tri. Kiseonik O2 i ozon O3 su jedini primer stvaranja dva gasa jednim hemijskim elementom (u normalnim uslovima) jednostavne supstance. U molekulu O3 atomi se nalaze pod uglom, pa su ovi molekuli polarni. Ozon se dobija kao rezultat „lepljenja“ slobodnih atoma kiseonika za molekule O2, koje nastaju od molekula kiseonika pod uticajem električnih pražnjenja, ultraljubičastih zraka, gama zraka, brzih elektrona i drugih visokoenergetskih čestica. Uvijek se osjeća miris ozona u blizini električnih mašina koje rade, u kojima četke "iskre", i u blizini baktericidnih živino-kvarcnih lampi koje emituju ultraljubičasto svjetlo. Atomi kiseonika se oslobađaju i tokom nekih hemijske reakcije. Ozon nastaje u malim količinama pri elektrolizi zakiseljene vode, pri sporoj oksidaciji vlažnog bijelog fosfora u zraku, pri razgradnji jedinjenja sa visokim sadržajem kisika (KMnO4, K2Cr2O7 itd.), pri djelovanju fluora na vodu ili koncentriranu sumpornu kiselinu na barijum peroksidu. Atomi kiseonika su uvek prisutni u plamenu, pa ako usmerite mlaz komprimirani zrak preko plamena plamenika kiseonika, u vazduhu će se detektovati karakterističan miris ozona.
Reakcija 3O2 → 2O3 je visoko endotermna: da bi se dobio 1 mol ozona, potrebno je potrošiti 142 kJ. Obrnuta reakcija se javlja oslobađanjem energije i provodi se vrlo lako. Shodno tome, ozon je nestabilan. U odsustvu nečistoća, ozon se polako razgrađuje na temperaturi od 70°C i brzo iznad 100°C. Brzina razgradnje ozona se značajno povećava u prisustvu katalizatora. To mogu biti plinovi (na primjer, dušikov oksid, hlor) i mnoge čvrste materije (čak i zidovi posude). Stoga je čisti ozon teško dobiti, a rad s njim opasan zbog mogućnosti eksplozije.
Nije iznenađujuće da su mnoge decenije nakon otkrića ozona, čak i njegove osnovne fizičke konstante bile nepoznate: dugo vremena niko nije mogao da dobije čisti ozon. Kao što je D. I. Mendeljejev napisao u svom udžbeniku Osnovi hemije, „uz sve metode pripreme gasa ozona, njegov sadržaj u kiseoniku je uvek beznačajan, obično samo nekoliko desetina procenta, retko 2%, i samo sa veoma niske temperature dostiže 20%.“ Tek 1880. su francuski naučnici J. Gotfeil i P. Chappuis dobili ozon iz čistog kiseonika na temperaturi od minus 23 °C. Ispostavilo se da u debelom sloju ozon ima prekrasnu plavu boju. Kada se ohlađeni ozonirani kisik polagano komprimirao, plin je postao tamnoplav, a nakon brzog otpuštanja tlaka temperatura je još više pala i nastale su tamnoljubičaste kapljice tekućeg ozona. Ako se plin nije brzo ohladio ili komprimirao, ozon se odmah, žutim bljeskom, pretvorio u kisik.
Kasnije je razvijena pogodna metoda za sintezu ozona. Ako se koncentrirana otopina perhlorne, fosforne ili sumporne kiseline podvrgne elektrolizi sa ohlađenom anodom od platine ili olovo(IV) oksida, plin koji se oslobađa na anodi će sadržavati do 50% ozona. Fizičke konstante ozona su također poboljšane. Ukapljuje se mnogo lakše od kiseonika - na temperaturi od -112°C (kiseonik - na -183°C). Na -192,7°C ozon se stvrdnjava. Čvrsti ozon je plavo-crne boje.
Eksperimenti sa ozonom su opasni. Gas ozon može eksplodirati ako njegova koncentracija u zraku prelazi 9%. Tečni i čvrsti ozon još lakše eksplodiraju, posebno kada su u kontaktu sa oksidirajućim supstancama. Ozon se može skladištiti na niskim temperaturama u obliku otopina u fluoriranim ugljovodonicima (freonima). Takva rješenja su plave boje.
Hemijska svojstva ozona.
Ozon se odlikuje izuzetno visokom reaktivnošću. Ozon je jedan od najjačih oksidacionih agenasa i drugi je u tom pogledu samo fluor i kiseonik fluorid OF2. Aktivni princip ozona kao oksidacionog sredstva je atomski kiseonik, koji nastaje tokom raspada molekula ozona. Stoga, djelujući kao oksidant, molekula ozona u pravilu "koristi" samo jedan atom kisika, a druga dva se oslobađaju u obliku slobodnog kisika, na primjer, 2KI + O3 + H2O → I2 + 2KOH + O2. Dolazi i do oksidacije mnogih drugih spojeva. Međutim, postoje izuzeci kada molekula ozona koristi sva tri atoma kiseonika koja ima za oksidaciju, na primer, 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3.
Vrlo važna razlika između ozona i kisika je u tome što ozon eksponira oksidirajuća svojstva već na sobnoj temperaturi. Na primjer, PbS i Pb(OH)2 ne reagiraju s kisikom u normalnim uvjetima, dok se u prisustvu ozona sulfid pretvara u PbSO4, a hidroksid u PbO2. Ako se koncentrirana otopina amonijaka ulije u posudu s ozonom, pojavit će se bijeli dim - to je amonijak koji oksidira ozon i stvara amonijev nitrit NH4NO2. Posebno karakteristična za ozon je sposobnost da „crni“ srebrne predmete sa stvaranjem AgO i Ag2O3.
Dodavanjem jednog elektrona i pretvaranjem u negativni ion O3-, molekul ozona postaje stabilniji. "Soli ozonske kiseline" ili ozonid koji sadrže takve anione poznati su dugo vremena - formiraju ih svi alkalni metali osim litijuma, a stabilnost ozonida se povećava od natrija do cezija. Poznati su i neki ozonidi zemnoalkalnih metala, na primjer Ca(O3)2. Ako se struja plina ozona usmjeri na površinu čvrste suhe lužine, formira se narandžasto-crvena kora koja sadrži ozonide, na primjer, 4KOH + 4O3 → 4KO3 + O2 + 2H2O. U isto vrijeme, čvrsta alkalija efikasno veže vodu, što štiti ozonid od trenutne hidrolize. Međutim, sa viškom vode, ozonidi se brzo razlažu: 4KO3+ 2H2O → 4KOH + 5O2. Razgradnja se takođe dešava tokom skladištenja: 2KO3 → 2KO2 + O2. Ozonidi su vrlo topljivi u tekućem amonijaku, što im je omogućilo izolaciju u čistom obliku i proučavanje njihovih svojstava.
Organske supstance sa kojima ozon dolazi u kontakt se obično uništavaju. Dakle, ozon, za razliku od hlora, može razdvojiti benzenski prsten. Kada radite s ozonom, ne možete koristiti gumene cijevi i crijeva - oni će odmah postati propusni. Reakcije ozona s organskim spojevima oslobađaju velike količine energije. Na primjer, eter, alkohol, vata natopljena terpentinom, metan i mnoge druge tvari spontano se zapale u dodiru s ozoniranim zrakom, a miješanje ozona sa etilenom dovodi do jake eksplozije.
Primjena ozona.
Ozon ne „sagoreva“ uvek organsku materiju; u nekim slučajevima moguće je provesti specifične reakcije sa visoko razrijeđenim ozonom. Na primjer, prilikom ozoniranja oleinske kiseline (nalazi se u velikim količinama u biljna ulja) Nastaje azelainska kiselina HOOC(CH2)7COOH koja se koristi za proizvodnju visokokvalitetnih mazivih ulja, sintetičkih vlakana i plastifikatora za plastiku. Slično se dobija i adipinska kiselina koja se koristi u sintezi najlona. Godine 1855. Schönbein je otkrio reakciju nezasićenih jedinjenja koja sadrže dvostruke C=C veze sa ozonom, ali je tek 1925. njemački hemičar H. Staudinger ustanovio mehanizam ove reakcije. Molekul ozona se veže za dvostruku vezu i formira ozonid - ovaj put organski, a atom kisika zamjenjuje jednu od C=C veza, a -O-O- grupa zauzima mjesto druge. Iako su neki organski ozonidi izolirani u čistom obliku (na primjer, etilen ozonid), ova reakcija se obično izvodi u razrijeđenoj otopini, jer su slobodni ozonidi vrlo nestabilni eksploziva. Organski hemičari visoko cijene reakciju ozoniranja nezasićenih spojeva; zadaci sa ovom reakcijom se često nude čak i na školska takmičenja. Činjenica je da kada se ozonid razgradi s vodom, nastaju dvije molekule aldehida ili ketona koje je lako identificirati i dalje utvrditi strukturu izvornog nezasićenog spoja. Tako su hemičari početkom 20. veka ustanovili strukturu mnogih važnih organskih jedinjenja, uključujući i prirodna, koja sadrže C=C veze.
Važno područje primjene ozona je dezinfekcija vode za piće. Obično je voda hlorisana. Međutim, neke nečistoće u vodi pod uticajem hlora pretvaraju se u jedinjenja veoma neprijatnog mirisa. Stoga se već dugo predlaže da se klor zamijeni ozonom. Ozonirana voda ne dobija nikakav strani miris ili ukus; Kada se mnoga organska jedinjenja potpuno oksidiraju ozonom, nastaju samo ugljični dioksid i voda. Očišćeno ozonom i otpadne vode. Proizvodi oksidacije ozona čak i zagađivača kao što su fenoli, cijanidi, surfaktanti, sulfiti, hloramini su bezopasna jedinjenja bez boje i mirisa. Višak ozona se prilično brzo raspada i stvara kisik. Međutim, ozoniranje vode je skuplje od hloriranja; Osim toga, ozon se ne može transportirati i mora se proizvoditi na mjestu upotrebe.
Ozon u atmosferi.
U Zemljinoj atmosferi ima malo ozona - 4 milijarde tona, tj. u prosjeku samo 1 mg/m3. Koncentracija ozona raste s udaljenosti od Zemljine površine i dostiže maksimum u stratosferi, na visini od 20-25 km - to je "ozonski omotač". Kada bi se sav ozon iz atmosfere prikupio na površini Zemlje pri normalnom pritisku, rezultujući sloj bi bio debeo samo oko 2-3 mm. A tako male količine ozona u zraku zapravo podržavaju život na Zemlji. Ozon stvara "zaštitni ekran" koji sprečava da tvrde ultraljubičaste zrake sunca, koje su destruktivne za sva živa bića, dođu do površine Zemlje.
Posljednjih decenija mnogo se pažnje posvećuje pojavi takozvanih „ozonskih rupa“ – područja sa značajno smanjenim nivoom stratosferskog ozona. Kroz takav "propusni" štit, oštrije ultraljubičasto zračenje sa Sunca dopire do površine Zemlje. Zbog toga naučnici već duže vrijeme prate ozon u atmosferi. Godine 1930., engleski geofizičar S. Chapman, da bi objasnio stalnu koncentraciju ozona u stratosferi, predložio je shemu od četiri reakcije (ove reakcije su nazvane Chapmanov ciklus, u kojem M označava svaki atom ili molekulu koji nosi višak energije) :
O + O + M → O2 + M
O + O3 → 2O2
O3 → O2 + O.
Prva i četvrta reakcija ovog ciklusa su fotohemijske, nastaju pod uticajem sunčevog zračenja. Za razlaganje molekule kiseonika na atome potrebno je zračenje talasne dužine manje od 242 nm, dok se ozon raspada kada se svetlost apsorbuje u području od 240-320 nm (potonja reakcija nas precizno štiti od tvrdog ultraljubičastog zračenja, jer kiseonik ne ne apsorbuje u ovom spektralnom području). Preostale dvije reakcije su termičke, tj. ići bez uticaja svetlosti. Vrlo je važno da treća reakcija, koja vodi do nestanka ozona, ima energiju aktivacije; to znači da se brzina takve reakcije može povećati djelovanjem katalizatora. Kako se pokazalo, glavni katalizator razgradnje ozona je dušikov oksid NO. Nastaje u gornjim slojevima atmosfere od dušika i kisika pod utjecajem najžešćeg sunčevog zračenja. Kada uđe u ozonosferu, ulazi u ciklus od dvije reakcije O3 + NO → NO2 + O2, NO2 + O → NO + O2, uslijed čega se njegov sadržaj u atmosferi ne mijenja, a stacionarna koncentracija ozona opada. Postoje i drugi ciklusi koji dovode do smanjenja sadržaja ozona u stratosferi, na primjer, uz učešće hlora:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
Ozon takođe uništavaju prašina i gasovi, koji velike količine ulaze u atmosferu tokom vulkanskih erupcija. IN U poslednje vreme Sugerirano je da je ozon također efikasan u uništavanju vodonika koji se oslobađa zemljine kore. Kombinacija svih reakcija nastajanja i raspada ozona dovodi do činjenice da je prosječni životni vijek molekula ozona u stratosferi oko tri sata.
Smatra se da osim prirodnih, postoje i vještački faktori koji utiču na ozonski omotač. Dobro poznati primjer su freoni, koji su izvori atoma hlora. Freoni su ugljikovodici u kojima su atomi vodika zamijenjeni atomima fluora i hlora. Koriste se u rashladnoj tehnici i za punjenje aerosol limenki. Konačno, freoni ulaze u zrak i polako se uzdižu sve više i više uz zračne struje, konačno dostižući ozonski omotač. Razlažući se pod utjecajem sunčevog zračenja, sami freoni počinju katalitički razlagati ozon. Još se ne zna tačno u kojoj meri su freoni krivi za „ozonsku rupu“, a ipak se odavno preduzimaju mere za ograničavanje njihove upotrebe.
Proračuni pokazuju da se za 60-70 godina koncentracija ozona u stratosferi može smanjiti za 25%. A istovremeno će se povećati koncentracija ozona u prizemnom sloju - troposferi, što je također loše, jer su ozon i proizvodi njegovih transformacija u zraku otrovni. Glavni izvor ozona u troposferi je prijenos stratosferskog ozona sa vazdušnim masama u niže slojeve. Svake godine otprilike 1,6 milijardi tona ozona uđe u prizemni sloj. Životni vijek molekula ozona u donjem dijelu atmosfere je mnogo duži - više od 100 dana, jer je intenzitet ultraljubičastog sunčevog zračenja koje uništava ozon manji u prizemnom sloju. Obično je u troposferi vrlo malo ozona: u čistom svježem zraku njegova koncentracija je u prosjeku samo 0,016 μg/l. Koncentracija ozona u vazduhu ne zavisi samo od nadmorske visine, već i od terena. Dakle, uvijek ima više ozona iznad okeana nego nad kopnom, budući da se ozon tamo sporije raspada. Merenja u Sočiju su pokazala da je vazduh morska obala sadrži 20% više ozona nego u šumi udaljenoj 2 km od obale.
Moderni ljudi udišu znatno više ozona nego njihovi preci. Glavni razlog za to je povećanje količine metana i dušikovih oksida u zraku. Dakle, sadržaj metana u atmosferi konstantno raste od sredine 19. stoljeća, kada je počela upotreba prirodnog plina. U atmosferi zagađenoj dušičnim oksidima, metan ulazi u složeni lanac transformacija uz učešće kisika i vodene pare, čiji se rezultat može izraziti jednadžbom CH4 + 4O2 → HCHO + H2O + 2O3. Drugi ugljovodonici takođe mogu delovati kao metan, na primer oni koji se nalaze u izduvnim gasovima automobila tokom nepotpuno sagorevanje benzin. Kao rezultat toga, koncentracija ozona u zraku velikih gradova se deset puta povećala u posljednjih nekoliko decenija.
Oduvijek se vjerovalo da se tokom grmljavine koncentracija ozona u zraku naglo povećava, jer munja pospješuje pretvaranje kisika u ozon. U stvari, povećanje je neznatno i ne nastaje tokom grmljavine, već nekoliko sati prije nje. Za vrijeme grmljavine i nekoliko sati nakon nje koncentracija ozona se smanjuje. To se objašnjava činjenicom da se prije grmljavine javlja snažno vertikalno miješanje. vazdušne mase, tako da dodatni ozon dolazi iz gornjih slojeva. Osim toga, prije grmljavine povećava se jačina električnog polja i stvaraju se uvjeti za stvaranje koronskog pražnjenja na vrhovima raznih objekata, na primjer, vrhovima grana. Ovo također doprinosi stvaranju ozona. I onda tokom razvoja thundercloud Ispod njega nastaju snažne uzlazne struje zraka koje smanjuju sadržaj ozona direktno ispod oblaka.
Zanimljivo pitanje o sadržaju ozona u zraku četinarske šume. Na primjer, na kursu neorganska hemija G. Remy može pročitati da je “ozonizirani zrak četinarskih šuma” fikcija. je li tako? Naravno, nijedna biljka ne proizvodi ozon. Ali biljke, posebno četinjača, ispuštaju mnogo hlapljivih organskih spojeva u zrak, uključujući nezasićene ugljikovodike klase terpena (ima ih mnogo u terpentinu). Dakle, u vrućem danu, bor oslobađa 16 mikrograma terpena na sat za svaki gram suhe težine iglica. Terpene oslobađaju ne samo četinari, već i neka listopadna drveća, uključujući topolu i eukaliptus. A neka tropska stabla mogu osloboditi 45 mcg terpena na 1 g suhe mase lišća na sat. Kao rezultat toga, jedan hektar četinarske šume može osloboditi do 4 kg organske tvari dnevno, a oko 2 kg listopadne šume. Šumska površina Zemlje je milione hektara, a sve one emituju stotine hiljada tona različitih ugljovodonika, uključujući terpene, godišnje. A ugljikovodici, kao što je pokazano na primjeru metana, pod utjecajem sunčevog zračenja i u prisustvu drugih nečistoća doprinose stvaranju ozona. Kao što su eksperimenti pokazali, terpeni su, pod odgovarajućim uslovima, zaista vrlo aktivno uključeni u ciklus atmosferskih fotohemijskih reakcija sa stvaranjem ozona. Dakle, ozon u crnogoričnoj šumi uopće nije fikcija, već eksperimentalna činjenica.
Ozon i zdravlje.
Kako je lijepo prošetati nakon grmljavine! Vazduh je čist i svež, njegovi okrepljujući potoci kao da teku u pluća bez ikakvog napora. „Miriše na ozon“, često kažu u takvim slučajevima. “Veoma dobro za zdravlje.” je li tako?
Nekada se ozon sigurno smatrao korisnim za zdravlje. Ali ako njegova koncentracija prijeđe određeni prag, može uzrokovati mnogo neugodnih posljedica. Ovisno o koncentraciji i vremenu udisanja, ozon izaziva promjene na plućima, iritaciju sluzokože očiju i nosa, glavobolju, vrtoglavicu i pad krvnog tlaka; Ozon smanjuje otpornost organizma na bakterijske infekcije respiratornog trakta. Maksimalna dozvoljena koncentracija u vazduhu je samo 0,1 μg/l, što znači da je ozon mnogo opasniji od hlora! Ako provedete nekoliko sati u prostoriji sa koncentracijom ozona od samo 0,4 μg/l, mogu se javiti bol u grudima, kašalj, nesanica, a oštrina vida može se smanjiti. Ako dugo udišete ozon u koncentraciji većoj od 2 μg/l, posljedice mogu biti teže - čak i tromost i pad srčane aktivnosti. Kada je sadržaj ozona 8-9 μg/l, nakon nekoliko sati nastaje plućni edem, koji je prepun fatalan. Ali takve male količine supstance obično je teško analizirati konvencionalnim hemijskim metodama. Na sreću, osoba osjeća prisustvo ozona čak i pri vrlo niskim koncentracijama - oko 1 μg/l, pri kojima škrobni jodni papir još neće poplaviti. Nekim ljudima miris ozona u niskim koncentracijama podsjeća na miris klora, drugima - na sumpor-dioksid, trećima - na bijeli luk.
Nije samo ozon toksičan. Njegovim učešćem u vazduhu nastaje, na primer, peroksiacetil nitrat (PAN) CH3-CO-OONO2 - supstanca koja ima jak nadražujuće dejstvo, uključujući i suzenje, otežava disanje, au većim koncentracijama izaziva paralizu srca. PAN je jedna od komponenti takozvanog fotohemijskog smoga koji nastaje ljeti u zagađenom zraku (ova riječ je izvedena od engleskog smoke – dim i fog – magla). Koncentracija ozona u smogu može doseći 2 µg/l, što je 20 puta više od maksimalno dozvoljene granice. Takođe treba uzeti u obzir da je kombinovani efekat ozona i azotnih oksida u vazduhu desetine puta jači od svake supstance posebno. Nije iznenađujuće da su posljedice ovakvog smoga veliki gradovi može biti katastrofalno, pogotovo ako se vazduh iznad grada ne prodire „promajem“ i formira se zona stagnacije. Tako je u Londonu 1952. godine više od 4.000 ljudi umrlo od smoga u roku od nekoliko dana. A smog u Njujorku 1963. ubio je 350 ljudi. Bilo je sličnih priča u Tokiju, druge glavni gradovi. Nisu samo ljudi ti koji pate od atmosferskog ozona. Američki istraživači su, na primjer, pokazali da je u područjima s visokim nivoom ozona u zraku životni vijek automobilskih guma i drugih proizvoda od gume značajno smanjen.
Kako smanjiti sadržaj ozona u prizemnom sloju? Teško da je realno smanjiti ispuštanje metana u atmosferu. Ostaje još jedan način - smanjiti emisije dušikovih oksida, bez kojih se ne može odvijati ciklus reakcija koje dovode do ozona. Ovaj put također nije lak, jer dušične okside ne emituju samo automobili, već i (uglavnom) termoelektrane.
Izvori ozona nisu samo na ulici. Formira se u rendgenskim sobama, u prostorijama za fizioterapiju (izvor su joj živino-kvarcne lampe), tokom rada opreme za kopiranje (kopir aparata), laserskih štampača (ovdje je razlog njegovog nastanka visokonaponsko pražnjenje). Ozon je neizbježan pratilac proizvodnje perhidrolnog i argonskog elektrolučnog zavarivanja. Za smanjenje štetnog djelovanja ozona potrebno je imati ventilacionu opremu u blizini ultraljubičastih lampi i dobru ventilaciju prostorije.
Pa ipak, teško je ispravno smatrati ozon nesumnjivo štetnim po zdravlje. Sve zavisi od njegove koncentracije. Istraživanja su pokazala da svježi zrak vrlo slabo svijetli u mraku; Razlog za sjaj su oksidacijske reakcije koje uključuju ozon. Sjaj je uočen i pri mućkanju vode u tikvici u koju je prethodno bio uveden ozonizovani kiseonik. Ovaj sjaj je uvijek povezan s prisustvom malih količina organskih nečistoća u zraku ili vodi. Kada se svježi zrak pomiješa sa izdahnutim dahom osobe, intenzitet sjaja se desetostruko povećava! I to nije iznenađujuće: u izdahnutom zraku pronađene su mikronečistoće etilena, benzena, acetaldehida, formaldehida, acetona i mravlje kiseline. Oni su „naglašeni“ ozonom. Istovremeno, „ustajalo“, tj. potpuno lišen ozona, iako vrlo čist, zrak ne proizvodi sjaj, a osoba ga doživljava kao “zamućen”. Takav vazduh se može uporediti sa destilovanom vodom: veoma je čist, praktično bez nečistoća, a piti ga je štetno. Dakle, potpuno odsustvo ozona u zraku je, po svemu sudeći, nepovoljno i za čovjeka, jer povećava sadržaj mikroorganizama u njemu i dovodi do nakupljanja štetnih tvari i neugodnih mirisa, koje ozon uništava. Tako postaje jasna potreba za redovnim i dugotrajnim provjetravanjem prostorija, čak i ako u njoj nema ljudi: uostalom, ozon koji uđe u prostoriju ne ostaje dugo u njoj - djelomično se raspada, a dobrim dijelom taloži (adsorbira) na zidovima i drugim površinama. Teško je reći koliko ozona treba da bude u prostoriji. Međutim, u minimalnim koncentracijama, ozon je vjerovatno neophodan i koristan.
Dakle, ozon je tempirana bomba. Ako se pravilno koristi, služit će čovječanstvu, ali ako ga počnete koristiti u druge svrhe, odmah će dovesti do globalna katastrofa i Zemlja će se pretvoriti u planetu poput Marsa.
Kada se električne iskre propuštaju kroz kisik ili zrak, pojavljuje se karakterističan miris, čiji je uzrok stvaranje nove tvari - ozona. Ozon se može dobiti iz potpuno čistog suhog kisika; slijedi da se sastoji samo od kisika i predstavlja njegovu alotropsku modifikaciju.
Molekularna masa ozona je 48. Atomska masa kiseonika je 16; dakle, molekul ozona se sastoji od tri atoma kiseonika.
Za proizvodnju ozona koriste djelovanje tihih električnih pražnjenja na kisik. Uređaji koji služe za ovu svrhu nazivaju se ozonizatori.
Rice. 110. Šema strukture molekula ozona.

Rice. 111. Dijagram orbitala centralnog atoma kiseonika u molekulu ozona.
U normalnim uslovima, ozon je gas. Može se odvojiti od kiseonika jakim hlađenjem; Ozon se kondenzuje u plavu tečnost koja ključa na .
Rastvorljivost ozona u vodi je mnogo veća od rastvorljivosti kiseonika: 100 zapremina vode otapa 49 zapremina ozona.
Formiranje ozona iz kiseonika može se izraziti jednadžbom
iz čega slijedi da je standardna entalpija stvaranja ozona pozitivna i jednaka . Osim toga, kao što pokazuju koeficijenti jednačine, tokom ove reakcije dobijaju se dva molekula iz tri molekula gasa, odnosno smanjuje se entropija sistema. Kao rezultat toga, standardna promjena Gibbsove energije u reakciji koja se razmatra je također pozitivna (163). Dakle, reakcija pretvaranja kiseonika u ozon ne može se dogoditi spontano: potrebna je energija za njeno sprovođenje. Obrnuta reakcija - razgradnja ozona - događa se spontano, jer se tokom ovog procesa Gibbsova energija sistema smanjuje. Drugim riječima, ozon je nestabilna supstanca.
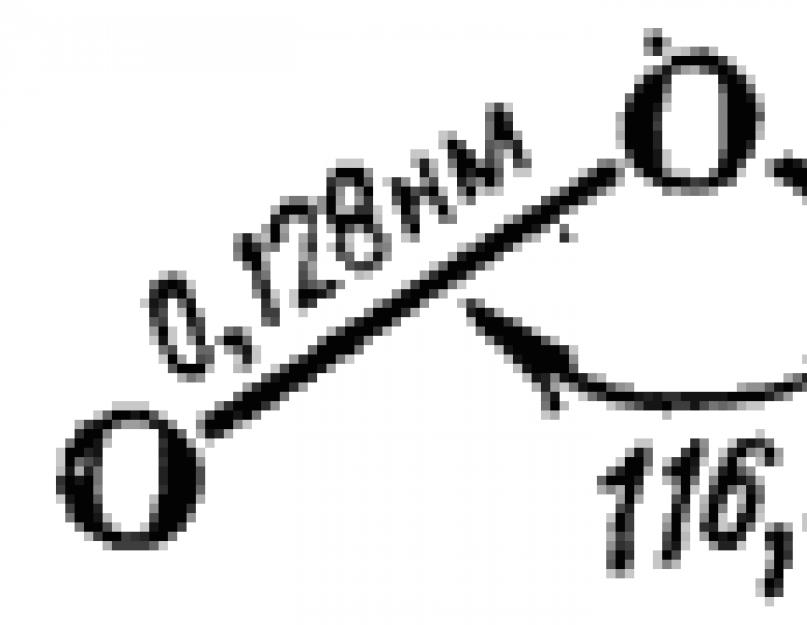
Molekul ozona je izgrađen u obliku jednakokračnog trougla. Njegova struktura je shematski prikazana na Sl. 110. Blizina ugla na vrhu trougla do 120° ukazuje da je centralni atom kiseonika ovde u stanju -hibridizacije. U skladu s tim, sa stanovišta BC metode, formiranje molekula se može opisati na sljedeći način.
Hibridna -orbitala centralnog atoma, koja sadrži jedan elektron (slika 111, lijevo), preklapa se sa -orbitalom jednog od vanjskih atoma kisika, što rezultira formiranjem -veze. -orbitala centralnog atoma koja ne učestvuje u hibridizaciji, orijentisana okomito na ravan molekule i koja takođe sadrži nespareni elektron, preklapa se sa slično lociranom -orbitalom istog najudaljenijeg atoma kiseonika, što dovodi do formiranja -veza. Konačno, djelujući kao donor elektronskog para koji zauzima jedan od hibridne orbitale(Sl. 111, desno), centralni atom kiseonika formira vezu sa drugim spoljnim atomom kiseonika prema metodi donor-akceptor.
Rezultirajuća struktura odgovara valentnom dijagramu A, na kojem su usamljeni parovi elektrona označeni tačkama, a - i - veze su označene slovima.

Prema shemi A, veze centralnog atoma kisika sa dva vanjska atoma su nejednake - jedna je dvostruka, a druga jednostavna. Međutim, ista dužina ovih veza (slika 110) ukazuje na njihovu ekvivalentnost. Stoga, zajedno sa šemom A, struktura molekula ozona može se podjednako dobro opisati šemom B. Sa stanovišta metode superponiranja valentnih šema (vidi § 44), to znači da je u stvarnosti struktura molekula ozona među shemama A i B i može se predstaviti u obliku:
Ovdje isprekidane linije označavaju delokalizaciju -elektronskog para, tj. da pripada sva tri atoma kisika. Prema tome, -veza u molekulu ozona je trocentrična.
Razmatranje strukture molekula ozona sa stanovišta MO metode takođe dovodi do zaključka da se ovde formira trocentrična vezivna molekularna orbitala.
Ozon je jedan od najjačih oksidansa. Oksidira sve metale osim zlata i platine, kao i većinu nemetala. Niže okside pretvara u više, a metalne sulfide u njihove sulfate. Tokom većine ovih reakcija, molekul ozona gubi jedan atom kisika i postaje molekul.
Ozon oslobađa jod iz rastvora kalijum jodida:
Ako komad papira natopljen otopinama KI i škroba stavite u zrak koji sadrži ozon, on odmah postaje plav. Ova reakcija se koristi za otkrivanje ozona.
Kao jako oksidaciono sredstvo, ozon ubija bakterije i stoga se koristi za dezinfekciju vode i dezinfekciju vazduha.
Ozon je otrovan. Maksimalni dozvoljeni sadržaj u vazduhu je jednak . Pri ovoj koncentraciji jasno se osjeća njegov miris. U prizemnom sloju atmosfere sadržaj ozona obično leži u granicama u kojima se formira u električnim pražnjenjima.
1. Šta znamo o OZONU?
Ozon (od grčkog ozon - miris) je plavi plin oštrog mirisa, jak oksidant. Ozon je alotrop kiseonika. Molekularna formula O3. 2,5 puta teži od kiseonika. Koristi se za dezinfekciju vode, hrane i vazduha.
Tehnologije
Na osnovu tehnologije korona ozona razvijen je multifunkcionalni anjonski ozonizator Green World, koji koristi ozon za dezinfekciju i sterilizaciju.
Karakteristike hemijskog elementa ozona
ozon, naučni naziv od kojih se O3 dobija spajanjem tri atoma kiseonika.Ima visoke oksidacione funkcije, koje su efikasne u dezinfekciji i stearilizaciji. Sposoban je uništiti većinu bakterija u vodi i zraku. Smatra se efikasnim dezinficijensom i antiseptikom. Ozon je važna komponenta atmosfere. Naša atmosfera sadrži 0,01 ppm-0,04 ppm ozona, koji uravnotežuje nivo bakterija u prirodi. Ozon se prirodno proizvodi i udarima groma tokom grmljavine. Prilikom električnog pražnjenja munje javlja se prijatan slatkast miris koji nazivamo svjež zrak.
Molekuli ozona su nestabilni i vrlo brzo se raspadaju na molekule kiseonika. Ovaj kvalitet čini ozon vrijednim pročišćivačem plina i vode. Molekuli ozona se spajaju s molekulima drugih supstanci i raspadaju, na kraju oksidirajući organska jedinjenja, pretvarajući ih u bezopasni ugljični dioksid i vodu. Budući da se ozon lako razlaže na molekule kisika, značajno je manje toksičan od drugih dezinficijensa kao što je klor. Nazivaju ga i „najčistijim oksidantom i dezinficijensom“.
Svojstva ozona - ubija mikroorganizme
1. ubija bakterije
a) ubija većinu bakterija coli i stafilokoka u zraku
b) ubija 99,7% coli bakterija i 99,9% stafilokoka na površini predmeta
c) ubija 100% coli bakterija, stafilokoka i mikroba iz grupe salmonele u fosfatnim jedinjenjima
d) ubija 100% coli bakterija u vodi
2. uništava spore bakterija
a) uništava brevibacteiumspore
b) sposobnost uništavanja bakterija u zraku
c) ubija 99,999% brevibacteiumspore u vodi
3. uništava viruse
a) uništava 99,99% HBsAg i 100% HAAg
b) uništava virus gripa u zraku
c) uništava PVI i virus hepatitisa A u vodi u roku od nekoliko sekundi ili minuta
d) uništava SA-11 virus u vodi
e) kada koncentracija ozona u krvnom serumu dostigne 4 mg/l, on je sposoban da uništi HIV u 106cd50/ml
a) ubija 100% aspergillusversicolor i penicillium
b) ubija 100% aspergillusnigera, fusariumoxysporumf.sp.melonogea i fusariumoxysporumf.sp. lycopersici
c) ubija bakterije aspergillus niger i candida
2. Kako nastaje ozon u prirodi?
Nastaje od molekularnog kiseonika (O2) tokom električnog pražnjenja ili pod uticajem ultraljubičastog zračenja. To je posebno uočljivo na mjestima bogatim kisikom: u šumi, u priobalnom području ili u blizini vodopada. Kada je izložen sunčevoj svjetlosti, kisik u kapi vode pretvara se u ozon. Ozon možete osjetiti i nakon grmljavine, kada nastaje električnim pražnjenjem.
3. Zašto se zrak čini čistijim nakon grmljavine?
Ozon oksidira organske nečistoće i dezinficira zrak, dajući ugodnu svježinu (miris grmljavine). Karakterističan miris ozona javlja se u koncentracijama od 10-7%.
4. Šta je ozonosfera? Kakav je njegov uticaj na život na planeti?
Najveći dio ozona u atmosferi nalazi se na nadmorskoj visini od 10 do 50 km s maksimalnom koncentracijom na nadmorskoj visini od 20-25 km, formirajući sloj koji se naziva ozonosfera.
Ozonosfera odbija tvrdo ultraljubičasto zračenje i štiti žive organizme od štetnog djelovanja zračenja. Život na kopnu postao je moguć zahvaljujući stvaranju ozona iz atmosferskog kiseonika.
5. Kada je ozon otkriven i kakva je istorija njegove upotrebe?
Ozon je prvi put opisan 1785. Holandski fizičar Mac Van Marum.
Godine 1832 prof. Sa Univerziteta u Bazelu, Schonbein je objavio knjigu “Proizvodnja ozona hemijskim metodama”. Dao mu je ime "ozon" od grčkog "miris".
Godine 1857 Werner von Siemens dizajnirao je prvu tehničku instalaciju za prečišćavanje vode za piće. Od tada je ozoniranje omogućilo dobijanje higijenski čiste vode.
Do 1977 Širom svijeta radi više od 1.000 postrojenja za ozoniranje pitke vode. Trenutno se 95% vode za piće u Evropi tretira ozonom. Ozoniranje je postalo široko rasprostranjeno u Kanadi i SAD-u. U Rusiji postoji nekoliko velikih stanica koje se koriste za prečišćavanje vode za piće, pripremu vode iz bazena i dubinsku obradu otpadnih voda u reciklažnom vodosnabdijevanju autopraonica.
Ozon je prvi put korišten kao antiseptik tokom Prvog svjetskog rata.
Od 1935 počeo koristiti rektalnu primjenu ozonsko-kiseoničke mješavine za liječenje raznih crijevnih bolesti (proktitis, hemoroidi, ulcerozni kolitis, fistule, supresija patogenih mikroorganizama, obnavljanje crijevne flore).
Proučavanje djelovanja ozona omogućilo je njegovu primjenu u hirurškoj praksi za infektivne lezije, liječenje tuberkuloze, pneumonije, hepatitisa, herpes infekcije, anemije itd.
U Moskvi 1992 pod vodstvom zaslužnog naučnika Ruske Federacije, doktora medicinskih nauka. Zmyzgova A..V. Stvoren je Naučno-praktični centar za ozonoterapiju, gdje se ozon koristi za liječenje širokog spektra bolesti. Nastavlja se razvoj efikasnih metoda koje ne oštećuju ozon pomoću ozona. Danas se ozon smatra popularnim i efektivna sredstva dezinfekcija vode, vazduha i prečišćavanje hrane. Mješavine kisika i ozona se također koriste u liječenju raznih bolesti, kozmetologiji i mnogim područjima ekonomije.
6. Da li je moguće udisati ozon? Da li je ozon štetan gas?
Zaista, udisanje visokih koncentracija ozona je opasno, može izgorjeti sluznicu dišnih organa.
Ozon je jako oksidaciono sredstvo. Ovdje leže njegova pozitivna i štetna svojstva. Sve zavisi od koncentracije, tj. o postotku sadržaja ozona u zraku. Njegovo dejstvo je poput vatre... U malim količinama podržava i leči, u velikim količinama može uništiti.
7. U kojim slučajevima se koriste niske i visoke koncentracije ozona?
Relativno visoke koncentracije se koriste za dezinfekciju, dok niže koncentracije ozona ne oštećuju proteinske strukture i pospješuju zacjeljivanje.
8. Kakav je efekat ozona na viruse?
Ozon potiskuje (inaktivira) virus izvan i unutar ćelije, djelimično uništavajući njenu ljusku. Proces njegove reprodukcije se zaustavlja i sposobnost virusa da se povežu sa ćelijama tijela je poremećena.
9. Kako se manifestuje baktericidno svojstvo ozona kada je izložen mikroorganizmima?
Kada su mikroorganizmi, uključujući kvasac, izloženi ozonu, njihova stanična membrana je lokalno oštećena, što dovodi do njihove smrti ili nemogućnosti reprodukcije. Uočeno je povećanje osjetljivosti mikroorganizama na antibiotike.
Eksperimenti su pokazali da plin ozon ubija gotovo sve vrste bakterija, virusa, plijesni i gljivica sličnih kvascu i protozoa. Ozon u koncentracijama od 1 do 5 mg/l dovodi do smrti 99,9% Escherichia coli, streptokoka, mukobakterija, filokoka, Escherichia coli i Pseudomonas aeruginosa, Proteus, Klebsiella itd. u roku od 4-20 minuta.
10. Kako ozon djeluje u neživoj prirodi?
Ozon reaguje sa većinom organskih i neorganskih supstanci. Tijekom reakcija nastaju kisik, voda, ugljični oksidi i viši oksidi drugih elemenata. Svi ovi proizvodi ne zagađuju okoliš okruženje i ne dovode do stvaranja kancerogenih supstanci, za razliku od jedinjenja hlora i fluora.
11. Da li jedinjenja koja nastaju u stambenim prostorijama tokom ozoniranja vazduha mogu biti opasna?
Koncentracije ozona koje stvara ozonizator u domaćinstvu dovode do stvaranja bezopasnih spojeva u stambenim područjima. Kao rezultat ozoniranja prostorije povećava se sadržaj kisika u zraku i dolazi do čišćenja virusa i bakterija.
12. Koja jedinjenja nastaju kao rezultat ozoniranja vazduha u zatvorenom prostoru?
Većina spojeva oko nas reagira s ozonom, što rezultira stvaranjem bezopasnih spojeva.
Većina ih se razgrađuje na ugljični dioksid, vodu i slobodni kisik. U nekim slučajevima nastaju neaktivna (bezopasna) jedinjenja (oksidi). Postoje i takozvane nereagensne supstance - oksidi titana, silicija, kalcijuma itd. Ne reaguju sa ozonom.
13. Da li je potrebno ozonirati vazduh u klimatizovanim prostorijama?
Nakon prolaska zraka kroz klima-uređaje i uređaje za grijanje, sadržaj kisika u zraku se smanjuje, a nivo toksičnih komponenti zraka ne smanjuje. Osim toga, sami stari klima uređaji su izvor zagađenja i infekcija. “Sindrom zatvorene sobe” - glavobolja, umor, česte respiratorne bolesti. Ozoniranje takvih prostorija jednostavno je neophodno.
14. Da li se klima uređaj može dezinfikovati?
Da, možeš.
15. Da li je upotreba ozoniranja zraka efikasna za uklanjanje mirisa iz zadimljenih prostorija i prostorija nakon renoviranja (mirisi boje, laka)?
Da, efikasan je. Tretman treba provesti nekoliko puta, u kombinaciji s mokrim čišćenjem.
16. Koje su koncentracije ozona štetne za bakterije i gljivice u kućnom zraku?
Koncentracija od 50 čestica ozona na 100.000.000 čestica zraka značajno smanjuje zagađenje zraka. Posebno jak uticaj ispostavilo se da je na Escherichia coli, salmoneli, stafilokoku, candidi, aspergilusu.
17. Da li su sprovedene studije o efektima ozoniranog vazduha na ljude?
Konkretno, opisan je eksperiment koji je vođen tokom 5 mjeseci sa dvije grupe ljudi – kontrolnom i testnom.
Vazduh u prostoriji ispitne grupe bio je ispunjen ozonom u koncentraciji od 15 čestica ozona na 1000000000 čestica vazduha. Svi ispitanici su primijetili dobro zdravlje i nestanak razdražljivosti. Ljekari su primijetili povećanje nivoa kiseonika u krvi, jačanje imunološkog sistema, normalizaciju krvnog pritiska i nestanak mnogih simptoma stresa.
18. Da li je ozon štetan za tjelesne ćelije?
Koncentracije ozona koje stvaraju kućni ozonizatori potiskuju viruse i mikroorganizme, ali ne oštećuju tjelesne stanice, jer Ozon ne oštećuje kožu. Zdrave ćelije ljudskog organizma imaju prirodnu zaštitu od štetnog dejstva oksidacije (antioksidans). Drugim riječima, djelovanje ozona je selektivno u odnosu na žive organizme.
Ovo ne isključuje primjenu mjera predostrožnosti. Tokom procesa ozoniranja boravak u prostoriji je nepoželjan, a nakon ozoniranja prostoriju treba provjetriti. Ozonizator se mora postaviti na mjesto nedostupno djeci ili se mora osigurati da se ne može uključiti.
19. Kolika je produktivnost ozonizatora?
U normalnom režimu - 200 mg/sat, u poboljšanom režimu - 400 mg/sat. Kolika je koncentracija ozona u prostoriji kao rezultat rada ozonizatora? Koncentracija zavisi od zapremine prostorije, lokacije ozonizatora, vlažnosti vazduha i temperature. Ozon nije stabilan plin i brzo se razgrađuje, tako da koncentracija ozona u velikoj mjeri ovisi o vremenu. Približni podaci 0,01 - 0,04 Rrm.
20. Koje se koncentracije ozona u zraku smatraju graničnim?
Koncentracije ozona u rasponu od 0,5 - 2,5 RRm (0,0001 mg/l) smatraju se sigurnim.
21. Za šta se koristi ozoniranje vode?
Ozon se koristi za dezinfekciju, uklanjanje nečistoća, mirisa i boje vode.
1. Za razliku od hlorisanja i fluorisanja vode, prilikom ozoniranja u vodu se ne unosi ništa strano (ozon se brzo raspada). Istovremeno, mineralni sastav i pH ostaju nepromijenjeni.
2. Ozon ima najveća dezinfekciona svojstva protiv patogena.
3. Organske materije u vodi se uništavaju, čime se sprečava dalji razvoj mikroorganizmi.
4. Većina hemikalija se uništava bez stvaranja štetnih jedinjenja. To uključuje pesticide, herbicide, naftne derivate, deterdžente, jedinjenja sumpora i hlora, koji su kancerogeni.
5. Metali, uključujući gvožđe, mangan, aluminijum, itd., oksidiraju se u neaktivna jedinjenja.Oksidi se talože i lako se filtriraju.
6. Brzo raspadajući ozon se pretvara u kiseonik, poboljšavajući ukus i lekovita svojstva vode.
23. Kolika je kiselost vode koja je podvrgnuta ozoniranju?
Voda ima blago alkalnu reakciju pH = 7,5 - 9,0. Ova voda se preporučuje za piće.
24. Koliko se povećava sadržaj kiseonika u vodi nakon ozoniranja?
Sadržaj kiseonika u vodi se povećava 12 puta.
25. Koliko brzo se ozon raspada u vazduhu i vodi?
U vazduhu nakon 10 minuta. Koncentracija ozona se smanjuje za pola, stvarajući kisik i vodu.
U vodi nakon 20-30 minuta. Ozon se raspada na pola, formirajući hidroksilnu grupu i vodu.
26. Kako zagrevanje vode utiče na sadržaj kiseonika u njoj?
Sadržaj kisika u vodi se smanjuje nakon zagrijavanja.
27. Šta određuje koncentraciju ozona u vodi?
Koncentracija ozona zavisi od nečistoća, temperature, kiselosti vode, materijala i geometrije posude.
28. Zašto se koristi molekul O 3, a ne O 2 ?
Ozon je otprilike 10 puta rastvorljiviji u vodi od kiseonika i dobro je očuvan. Što je niža temperatura vode, to je duže vrijeme skladištenja.
29. Zašto je korisno piti vodu sa kiseonikom?
Upotreba ozona povećava potrošnju glukoze u tkivima i organima, povećava zasićenost krvne plazme kiseonikom, smanjuje stepen gladovanja kiseonikom i poboljšava mikrocirkulaciju.
Ozon ima pozitivan učinak na metabolizam jetre i bubrega. Podržava funkcionisanje srčanog mišića. Smanjuje brzinu disanja i povećava volumen disanja.
30. Za šta je namijenjen kućni ozonizator?
Ozonizator u domaćinstvu se može koristiti za:
dezinfekcija i dezodoracija vazduha u stambenim prostorijama, kupatilima i toaletima, svlačionicama, plakarima, frižiderima i dr.;
prerada hrane (meso, riba, jaja, povrće i voće);
poboljšanje kvaliteta vode (dezinfekcija, obogaćivanje kiseonikom, eliminacija hlora i drugih štetnih nečistoća);
kućna kozmetologija (eliminacija peruti, akni, grgljanje, pranje zuba, otklanjanje gljivičnih oboljenja, priprema ozoniranog ulja);
briga o kućnim ljubimcima i ribama;
glazura sobne biljke i tretman sjemena;
izbjeljivanje i dodavanje boje posteljini;
obrada cipela.
31. Kakav je efekat upotrebe ozona u medicinskoj praksi?
Ozon ima antibakterijski i antivirusni učinak (inaktivacija virusa i uništavanje spora).
Ozon aktivira i normalizuje brojne biohemijske procese.
Efekat dobijen ozonom terapijom karakteriše:
aktiviranje procesa detoksikacije, dolazi do supresije
aktivnost vanjskih i unutrašnjih toksina;
aktivacija metaboličkih procesa (metabolički procesi);
povećana mikrocirkulacija (opskrba krvlju
poboljšanje reoloških svojstava krvi (krv postaje pokretna);
ima izražen analgetski efekat.
32. Kako ozon utiče na ljudski imunitet?
Povećava se ćelijski i humoralni imunitet. Aktivira se fagocitoza, pojačava se sinteza interferona i drugih nespecifičnih sistema organizma.
33. Kako ozoniranje utiče na metaboličke procese?
Upotreba ozona povećava potrošnju glukoze u tkivima i organima, povećava zasićenost krvne plazme kiseonikom, smanjuje stepen gladovanja kiseonikom i poboljšava mikrocirkulaciju. Ozon ima pozitivan učinak na metabolizam jetre i bubrega. Podržava funkcionisanje srčanog mišića. Smanjuje brzinu disanja i povećava volumen disanja.
34. Ozon se stvara tokom zavarivanja i tokom rada fotokopir aparata. Da li je ovaj ozon štetan?
Da, štetan je, jer stvara opasne nečistoće. Ozon koji proizvodi ozonizator je čist i stoga bezopasan.
35. Postoji li razlika između industrijskih, medicinskih i kućnih ozonizatora?
Industrijski ozonizatori proizvode visoku koncentraciju ozona, što je opasno za kućnu upotrebu.
Medicinski i kućni ozonizatori slični su u pokazateljima učinka, ali medicinski su dizajnirani za duži kontinuirani rad.
36. Koje su uporedne karakteristike dezinfekcije kada se koriste ultraljubičaste jedinice i ozonizatori?
Ozon je, po svojim svojstvima uništavanja bakterija i virusa, 2,5 - 6 puta efikasniji od ultraljubičastih zraka i 300 - 600 puta efikasniji od hlora. Štoviše, za razliku od hlora, ozon uništava čak i ciste crva i viruse herpesa i tuberkuloze.
Ozon uklanja organske i kemijske tvari iz vode, razgrađujući ih na vodu, ugljični dioksid, stvarajući talog neaktivnih elemenata.
Ozon lako oksidira soli željeza i mangana, stvarajući netopive tvari koje se eliminiraju taloženjem ili filtracijom. Kao rezultat toga, ozonirana voda je sigurna, bistra i dobrog okusa.
37. Da li je moguće dezinfikovati posuđe ozonom?
Da! Dobro je dezinficirati dječje posuđe, posuđe za konzerviranje itd. Da biste to učinili, stavite posuđe u posudu s vodom, spustite zračni kanal s razdjelnikom. Obradite 10-15 minuta.
38. Od kojih materijala treba napraviti pribor za ozoniranje?
Staklo, keramika, drvo, plastika, emajlirani (bez strugotina ili pukotina). Nemojte koristiti metalno posuđe, uključujući aluminijumsko i bakreno posuđe. Guma ne podnosi kontakt sa ozonom.
Anionski ozonizator američke korporacije Green World pomoći će vam ne samo da održite, već i značajno poboljšate svoje zdravlje. Imate priliku da koristite nezamjenjiv uređaj u svom domu - anionski ozonizator, koji objedinjuje sve kvalitete i funkcionalnost i ionizatora zraka i ozonizatora (multifunkcionalnog...
Ozonizator za automobil je opremljen rasvjetom i aromom. Načini ozoniranja i jonizacije mogu se uključiti istovremeno. Ovi načini se također mogu omogućiti odvojeno. Ovaj ozonizator je neophodan tokom dugih putovanja, kada se umor vozača povećava, vid i pamćenje pogoršavaju. Ozonator ublažava pospanost, daje snagu zbog priliva...
OZON O3 (od grčkog ozon-miris) je alotropska modifikacija kiseonika koja može postojati u sva tri agregatna stanja. Ozon je nestabilno jedinjenje, pa čak i na sobnoj temperaturi polako se razlaže u molekularni kiseonik, ali ozon nije radikal.
Fizička svojstva
Molekulska težina = 47,9982 g/mol. Gas ozon ima gustinu od 2,144 10-3 g/cm3 pri pritisku od 1 atm i 29°C.
Ozon je posebna supstanca. Izuzetno je nestabilan i sa povećanjem koncentracije lako disproporcije prema opštoj shemi: 2O3 -> 3O2.U gasovitom obliku ozon ima plavičastu nijansu, uočljivu kada vazduh sadrži 15-20% ozona.
Ozon at normalnim uslovima- gas oštrog mirisa. Pri vrlo niskim koncentracijama, miris ozona se percipira kao ugodno svjež, ali postaje neprijatan kako koncentracija raste. Miris smrznutog veša je miris ozona. Lako se naviknuti.
Njegova glavna količina je koncentrisana u takozvanom "ozonskom pojasu" na nadmorskoj visini od 15-30 km. Na površini zemlje, koncentracija ozona je mnogo niža i apsolutno je sigurna za živa bića; postoji čak i mišljenje da njegovo potpuno odsustvo također negativno utječe na performanse osobe.
Pri koncentracijama od oko 10 MAC, ozon se jako dobro osjeća, ali nakon nekoliko minuta osjećaj nestaje gotovo u potpunosti. Ovo morate imati na umu kada radite s njim.
Međutim, ozon osigurava i očuvanje života na Zemlji, jer Ozonski omotač zadržava najrazorniji dio sunčevog ultraljubičastog zračenja s talasnom dužinom manjom od 300 nm za žive organizme i biljke, a uz CO2 apsorbira infracrveno zračenje Zemlje, sprječavajući njeno hlađenje.
Ozon je rastvorljiviji u vodi od kiseonika. U vodi se ozon razlaže mnogo brže nego u gasnoj fazi, a prisustvo nečistoća, posebno metalnih jona, ima izuzetno veliki uticaj na brzinu razgradnje.
Fig1. Razgradnja ozona u razne vrste voda na temperaturi od 20°C (1 - bidestilat; 2 - destilat; 3 - voda iz slavine; 4 - filtrirana jezerska voda)
Silikagel i aluminijumski gel dobro adsorbuju ozon. Pri parcijalnom pritisku ozona, na primjer 20 mm Hg. art., a na 0°C silika gel apsorbira oko 0,19% ozona po težini. Na niskim temperaturama, adsorpcija je primjetno oslabljena. U adsorbiranom stanju, ozon je vrlo stabilan. Potencijal jonizacije ozona je 12,8 eV.
Hemijska svojstva ozona
Odlikuju ih dvije glavne karakteristike - nestabilnost i sposobnost oksidacije. Pomiješan sa zrakom u malim koncentracijama, razgrađuje se relativno sporo, ali s povećanjem temperature njegova razgradnja se ubrzava i na temperaturama iznad 100°C postaje vrlo brza.
Prisustvo NO2, Cl u vazduhu, kao i katalitičko dejstvo oksida metala - srebra, bakra, gvožđa, mangana - ubrzavaju razgradnju ozona. Ozon ima tako jaka oksidirajuća svojstva jer se jedan od atoma kisika vrlo lako odvaja od svoje molekule. Lako se pretvara u kiseonik.
Ozon oksidira većinu metala na uobičajenim temperaturama. Kiseli vodeni rastvori ozona su prilično stabilni; u alkalnim rastvorima ozon se brzo uništava. Metali promenljive valencije (Mn, Co, Fe, itd.), mnogi oksidi, peroksidi i hidroksidi efikasno uništavaju ozon. Većina metalnih površina je obložena oksidnim filmom u najvišoj valentnoj fazi metala (na primjer, PbO2, AgO ili Ag2O3, HgO).
Ozon oksidira sve metale, osim metala zlata i platinske grupe, reaguje sa većinom drugih elemenata, razgrađuje halogenovodonike (osim HF), pretvara niže okside u više itd.
Ne oksidira zlato, platinu, iridijum, leguru 75%Fe + 25%Cr. Pretvara crni olovni sulfid PbS u bijeli sulfat PbSO4, anhidrid arsena As2O3 u anhidrid arsena As2O5, itd.
Reakcija ozona sa ionima metala promjenjive valencije (Mn, Cr i Co) u poslednjih godina nalazi praktičnu primenu za sintezu međuproizvoda za boje, vitamin PP (izonikotinska kiselina) itd. Mješavine soli mangana i hroma u kiseloj otopini koja sadrži spoj koji se može oksidirati (na primjer, metilpiridini) oksidiraju se ozonom. U ovom slučaju, joni Cr3+ se transformišu u Cr6+ i oksidiraju metilpiridine samo na metilnim grupama. U nedostatku soli metala, uglavnom se uništava aromatično jezgro.
Ozon takođe reaguje sa mnogim gasovima koji su prisutni u atmosferi. Vodonik sulfid H2S, kada se kombinuje sa ozonom, oslobađa slobodni sumpor, sumpordioksid SO2 se pretvara u sumpor dioksid SO3; dušikov oksid N2O - u oksid NO, dušikov oksid NO se brzo oksidira u NO2, zauzvrat NO2 također reagira sa ozonom, i na kraju nastaje N2O5; amonijak NH3 - u dušično-amonijačnu sol NH4NO3.
Jedna od najvažnijih reakcija ozona sa neorganskim supstancama je njegova razgradnja kalijum jodida. Ova reakcija se široko koristi za kvantitativno određivanje ozona.
Ozon u nekim slučajevima reaguje sa čvrstim supstancama, stvarajući ozonide. Izolovani su ozonidi alkalnih metala i zemnoalkalnih metala: stroncijum, barijum i temperatura njihove stabilizacije raste u naznačenom nizu; Ca(O3) 2 je stabilan na 238 K, Ba(O3) 2 na 273 K. Ozonidi se razlažu u superoksid, na primjer NaO3 -> NaO2 + 1/2O2. Razni ozonidi nastaju i tokom reakcija ozona sa organskim jedinjenjima.
Ozon oksidira brojne organske tvari, zasićene, nezasićene i cikličke ugljikovodike. Objavljeni su brojni radovi o sastavu produkta reakcije ozona sa raznim aromatičnim ugljovodonicima: benzolom, ksilenima, naftalenom, fenantrenom, antracenom, benzantracenom, difenilaminom, kinolinom, akrilnom kiselinom itd. Obezbojuje indigo i mnoge druge organske boje, kojima se koristi čak i za izbjeljivanje tkanina.
Brzina reakcije ozona s dvostrukom C=C vezom je 100 000 puta veća od brzine reakcije ozona s jednostrukom vezom C-C veza. Stoga su guma i guma prvenstveno pod utjecajem ozona. Ozon reaguje sa dvostrukom vezom i formira intermedijarni kompleks:

Ova reakcija se odvija prilično brzo čak i na temperaturama ispod 0°C. U slučaju zasićenih spojeva, ozon pokreće uobičajenu reakciju oksidacije:

Zanimljiva je interakcija ozona sa nekim organskim bojama koje snažno fluoresciraju u prisustvu ozona u zraku. To su, na primjer, eihrozin, riboflavin i luminol (triaminoftalhidrazid), a posebno rodamin-B i njemu sličan rodamin-C.
Visoka oksidaciona svojstva ozona, uništavanje organskih supstanci i oksidacija metala (posebno gvožđa) u nerastvorljiv oblik, sposobnost razlaganja gasovitih jedinjenja rastvorljivih u vodi, zasićenja vodenih rastvora kiseonikom, niska otpornost ozona u vodi i samouništenje njegovih opasnih svojstava za ljude - sve to zajedno čini ozon najatraktivnijom supstancom za pripremu vode za domaćinstvo i tretman raznih otpadnih voda.
Sinteza ozona
Ozon se formira u plinovitom okruženju koje sadrži kisik ako se pojave uvjeti pod kojima se kisik disocira na atome. To je moguće u svim oblicima električnog pražnjenja: sjaj, luk, iskra, korona, površina, barijera, bez elektroda itd. Glavni uzrok disocijacije je sudar molekularnog kisika s elektronima ubrzanim u električnom polju.
Osim pražnjenja, disocijaciju kiseonika izazivaju UV zračenje talasne dužine manje od 240 nm i razne čestice visoke energije: alfa, beta, gama čestice, rendgenske zrake itd. Ozon se također proizvodi elektrolizom vode.
U gotovo svim izvorima stvaranja ozona postoji grupa reakcija uslijed kojih se ozon razgrađuje. Oni ometaju stvaranje ozona, ali zaista postoje i moraju se uzeti u obzir. To uključuje termičku razgradnju u volumenu i na zidovima reaktora, njegove reakcije s radikalima i pobuđenim česticama, reakcije s aditivima i nečistoćama koje mogu doći u kontakt s kisikom i ozonom.
Kompletan mehanizam sastoji se od značajnog broja reakcija. Prave instalacije, bez obzira na kojem principu rade, pokazuju visoke troškove energije za proizvodnju ozona. Efikasnost generatora ozona zavisi od vrste snage - ukupne ili aktivne - jedinica mase proizvedenog ozona se izračunava u.
Barijerno pražnjenje
Barijerno pražnjenje se podrazumijeva kao pražnjenje koje se javlja između dva dielektrika ili dielektrika i metala. Zbog činjenice da je električni krug prekinut dielektrikom, napajanje se napaja samo izmjeničnom strujom. Prvi ozonizator blizak modernim je 1897. godine predložio Siemens.
Pri niskim učincima, ozonizator ne treba da se hladi, jer se stvorena toplota odnosi protokom kiseonika i ozona. IN industrijska proizvodnja Ozon se također sintetiše u lučnim ozonizatorima (plazmatronima), u generatorima sjajnog ozona (laseri) i površinskom pražnjenju.
Fotohemijska metoda
Najveći dio ozona proizvedenog na Zemlji u prirodi nastaje fotokemijski. IN praktične aktivnosti Kod ljudi, metode fotohemijske sinteze igraju manju ulogu od sinteze barijernog pražnjenja. Glavna oblast njihove upotrebe je dobijanje srednjih i niskih koncentracija ozona. Takve koncentracije ozona su potrebne, na primjer, prilikom ispitivanja gumenih proizvoda na otpornost na pucanje pod utjecajem atmosferskog ozona. U praksi se za proizvodnju ozona ovom metodom koriste živine i ekscimer ksenonske lampe.
Metoda elektrolitičke sinteze
Prvi spomen stvaranja ozona u elektrolitskim procesima datira iz 1907. godine. Međutim, do danas mehanizam njegovog nastanka ostaje nejasan.
Obično se vodeni rastvori perhlorne ili sumporne kiseline koriste kao elektrolit; elektrode su napravljene od platine. Upotreba kiselina sa oznakom O18 pokazala je da one ne odustaju od kiseonika prilikom stvaranja ozona. Stoga bi bruto dijagram trebao uzeti u obzir samo razgradnju vode:
H2O + O2 -> O3 + 2H+ + e-
sa mogućim srednjim stvaranjem jona ili radikala.
Formiranje ozona pod uticajem jonizujućeg zračenja
Ozon nastaje nizom procesa koji uključuju ekscitaciju molekula kisika bilo svjetlošću ili električnim poljem. Pri zračenju kiseonikom jonizujuće zračenje mogu se pojaviti i pobuđeni molekuli i uočeno je stvaranje ozona. Stvaranje ozona pod uticajem jonizujućeg zračenja još uvek nije korišćeno za sintezu ozona.
Formiranje ozona u mikrotalasnom polju
Kada je mlaz kiseonika prošao kroz mikrotalasno polje, uočeno je stvaranje ozona. Ovaj proces je malo proučavan, iako se generatori bazirani na ovom fenomenu često koriste u laboratorijskoj praksi.
Upotreba ozona u svakodnevnom životu i njegovo djelovanje na čovjeka
Ozoniranje vode, zraka i drugih tvari
Ozonirana voda ne sadrži toksične halogenemetane - tipične nečistoće sterilizacije vode hlorom. Proces ozoniranja se izvodi u pjenušavim kupkama ili mikserima, u kojima se voda pročišćena od suspendiranih tvari miješa s ozoniranim zrakom ili kisikom. Nedostatak procesa je brzo uništavanje O3 u vodi (poluživot 15-30 minuta).
Ozoniranje se također koristi u Prehrambena industrija za sterilizaciju frižidera, magacina, otklanjanje neprijatnih mirisa; u medicinskoj praksi - za dezinfekciju otvorenih rana i liječenje određenih kroničnih bolesti (trofični čirevi, gljivične bolesti), ozoniranje venske krvi, fiziološke otopine.
Moderni ozonizatori, u kojima se ozon proizvodi električnim pražnjenjem u zraku ili kisiku, sastoje se od generatora ozona i izvora energije i sastavni su dio ozonizatorskih instalacija, koje osim ozonizatora uključuju i pomoćne uređaje.
Trenutno je ozon gas koji se koristi u tzv. ozonskim tehnologijama: prečišćavanje i priprema vode za piće, tretman otpadnih voda (kućne i industrijske otpadne vode), otpadni gasovi itd.
Ovisno o tehnologiji korištenja ozona, produktivnost ozonizatora može se kretati od frakcija grama do desetina kilograma ozona na sat. Specijalni ozonizatori se koriste za gasnu sterilizaciju medicinskih instrumenata i male opreme. Sterilizacija se vrši u veštački vlažnoj ozonsko-kiseoničnoj sredini koja ispunjava sterilizacionu komoru. Ciklus sterilizacije sastoji se od faze zamjene zraka u komori za sterilizaciju vlažnom smjesom ozon-kiseonik, faze izlaganja sterilizaciji i faze zamjene ozonsko-kiseoničke smjese u komori mikrobiološki pročišćenim zrakom.
Ozonizatori koji se koriste u medicini za ozonsku terapiju imaju širok raspon regulacije koncentracije ozonsko-kiseoničke smjese. Garantovana tačnost generisane koncentracije mešavine ozon-kiseonik kontroliše se sistemom automatizacije ozonatora i automatski se održava.
Biološki efekat ozona
Biološki učinak ozona ovisi o načinu njegove primjene, dozi i koncentraciji. Mnogi od njegovih učinaka u različitim rasponima koncentracije javljaju se u različitim stepenima. Terapeutski učinak ozonoterapije temelji se na upotrebi mješavina ozon-kiseonik. Visok redoks potencijal ozona određuje njegovo sistemsko (obnavljanje homeostaze kiseonika) i lokalno (izraženo dezinfekciono) terapijsko dejstvo.
Ozon je prvi upotrijebio A. Wolff kao antiseptik 1915. za liječenje inficiranih rana. Poslednjih godina ozonoterapija se uspešno primenjuje u gotovo svim oblastima medicine: hitnoj i gnojnoj hirurgiji, opštoj i infektivnu terapiju, ginekologija, urologija, gastroenterologija, dermatologija, kozmetologija itd. Upotreba ozona je zbog njegovog jedinstvenog spektra djelovanja na organizam, uklj. imunomodulatorno, protuupalno, baktericidno, antivirusno, fungicidno, itd.
Međutim, ne može se poreći da su metode upotrebe ozona u medicini, uprkos očiglednim prednostima u mnogim biološkim pokazateljima, još uvijek široka primena nisu primili. Prema literaturnim podacima, visoke koncentracije ozona su apsolutno baktericidne za gotovo sve sojeve mikroorganizama. Stoga se ozon koristi u kliničkoj praksi kao univerzalni antiseptik za saniranje infektivnih i upalnih žarišta različite etiologije i lokalizacije.
Literatura sadrži podatke o povećanju efikasnosti antiseptičkih lijekova nakon njihovog ozoniranja u liječenju akutnih gnojnih hirurških bolesti.
Zaključci o upotrebi ozona u domaćinstvima
Prije svega, potrebno je bezuvjetno potvrditi činjenicu korištenja ozona u praksi liječenja u mnogim područjima medicine, kao terapeutskog i dezinficijensa, ali se još ne može govoriti o njegovoj širokoj upotrebi.
Ljudi percipiraju ozon s najmanje alergijskih nuspojava. Čak i ako se u literaturi mogu pronaći reference na individualnu netoleranciju na O3, ovi se slučajevi ni na koji način ne mogu porediti, na primjer, s antibakterijskim lijekovima koji sadrže klor i drugim halogenim lijekovima.
Ozon je troatomni kiseonik i ekološki je najprihvatljiviji. Ko ne poznaje njegov "svjež" miris - u vrelim ljetnim danima nakon grmljavine?! Svaki živi organizam doživljava svoju stalnu prisutnost u Zemljinoj atmosferi.
Recenzija je sastavljena na osnovu materijala sa interneta.
Naučnici su prvi put saznali za postojanje nepoznatog gasa kada su počeli eksperimentisati sa elektrostatičkim mašinama. To se dogodilo u 17. veku. Ali novi gas su počeli da proučavaju tek krajem sledećeg veka. Godine 1785, holandski fizičar Martin van Marum dobio je ozon propuštanjem električnih varnica kroz kiseonik. Naziv ozon pojavio se tek 1840. godine; izumio ga je švajcarski hemičar Christian Schönbein, izvodeći ga iz grčke reči ozon – miris. Hemijski sastav ovog gasa nije se razlikovao od kiseonika, ali je bio mnogo agresivniji. Tako je odmah oksidirao bezbojni kalijum jodid, oslobađajući smeđi jod; Schönbein je koristio ovu reakciju da odredi ozon prema stepenu plavetnila papira natopljenog rastvorom kalijum jodida i škroba. Čak i živa i srebro, koji su neaktivni na sobnoj temperaturi, oksidiraju se u prisustvu ozona.
Ispostavilo se da se molekule ozona, kao i kisik, sastoje samo od atoma kisika, ali ne dva, već tri. Kiseonik O2 i ozon O3 su jedini primer formiranja dve gasovite (u normalnim uslovima) jednostavne supstance jednim hemijskim elementom. U molekulu O3 atomi se nalaze pod uglom, pa su ovi molekuli polarni. Ozon se dobija kao rezultat „lepljenja“ slobodnih atoma kiseonika za molekule O2, koje nastaju od molekula kiseonika pod uticajem električnih pražnjenja, ultraljubičastih zraka, gama zraka, brzih elektrona i drugih visokoenergetskih čestica. Uvijek se osjeća miris ozona u blizini električnih mašina koje rade, u kojima četke "iskre", i u blizini baktericidnih živino-kvarcnih lampi koje emituju ultraljubičasto svjetlo. Atomi kiseonika se takođe oslobađaju tokom određenih hemijskih reakcija. Ozon nastaje u malim količinama pri elektrolizi zakiseljene vode, pri sporoj oksidaciji vlažnog bijelog fosfora u zraku, pri razgradnji jedinjenja sa visokim sadržajem kisika (KMnO4, K2Cr2O7 itd.), pri djelovanju fluora na vodu ili koncentriranu sumpornu kiselinu na barijum peroksidu. Atomi kiseonika su uvek prisutni u plamenu, pa ako usmerite mlaz komprimovanog vazduha preko plamena plamenika kiseonika, u vazduhu će se detektovati karakterističan miris ozona.
Reakcija 3O2 → 2O3 je visoko endotermna: da bi se dobio 1 mol ozona, potrebno je potrošiti 142 kJ. Obrnuta reakcija se javlja oslobađanjem energije i provodi se vrlo lako. Shodno tome, ozon je nestabilan. U odsustvu nečistoća, ozon se polako razgrađuje na temperaturi od 70°C i brzo iznad 100°C. Brzina razgradnje ozona se značajno povećava u prisustvu katalizatora. To mogu biti plinovi (na primjer, dušikov oksid, hlor) i mnoge čvrste materije (čak i zidovi posude). Stoga je čisti ozon teško dobiti, a rad s njim opasan zbog mogućnosti eksplozije.
Nije iznenađujuće da su mnoge decenije nakon otkrića ozona, čak i njegove osnovne fizičke konstante bile nepoznate: dugo vremena niko nije mogao da dobije čisti ozon. Kako je D.I. Mendeljejev napisao u svom udžbeniku Osnovi hemije, „sa svim metodama pripreme gasa ozona, njegov sadržaj u kiseoniku je uvek beznačajan, obično samo nekoliko desetina procenta, retko 2%, a tek na veoma niskim temperaturama dostiže 20%.” Tek 1880. su francuski naučnici J. Gotfeil i P. Chappuis dobili ozon iz čistog kiseonika na temperaturi od minus 23 °C. Ispostavilo se da u debelom sloju ozon ima prekrasnu plavu boju. Kada se ohlađeni ozonirani kisik polagano komprimirao, plin je postao tamnoplav, a nakon brzog otpuštanja tlaka temperatura je još više pala i nastale su tamnoljubičaste kapljice tekućeg ozona. Ako se plin nije brzo ohladio ili komprimirao, ozon se odmah, žutim bljeskom, pretvorio u kisik.
Kasnije je razvijena pogodna metoda za sintezu ozona. Ako se koncentrirana otopina perhlorne, fosforne ili sumporne kiseline podvrgne elektrolizi sa ohlađenom anodom od platine ili olovo(IV) oksida, plin koji se oslobađa na anodi će sadržavati do 50% ozona. Fizičke konstante ozona su također poboljšane. Ukapljuje se mnogo lakše od kiseonika - na temperaturi od -112°C (kiseonik - na -183°C). Na –192,7° C ozon se stvrdnjava. Čvrsti ozon je plavo-crne boje.
Eksperimenti sa ozonom su opasni. Gas ozon može eksplodirati ako njegova koncentracija u zraku prelazi 9%. Tečni i čvrsti ozon još lakše eksplodiraju, posebno kada su u kontaktu sa oksidirajućim supstancama. Ozon se može skladištiti na niskim temperaturama u obliku otopina u fluoriranim ugljovodonicima (freonima). Takva rješenja su plave boje.
Hemijska svojstva ozona.
Ozon se odlikuje izuzetno visokom reaktivnošću. Ozon je jedan od najjačih oksidacionih agenasa i drugi je u tom pogledu samo fluor i kiseonik fluorid OF2. Aktivni princip ozona kao oksidacionog sredstva je atomski kiseonik, koji nastaje tokom raspada molekula ozona. Stoga, djelujući kao oksidant, molekula ozona u pravilu "koristi" samo jedan atom kisika, a druga dva se oslobađaju u obliku slobodnog kisika, na primjer, 2KI + O3 + H2O → I2 + 2KOH + O2. Dolazi i do oksidacije mnogih drugih spojeva. Međutim, postoje izuzeci kada molekula ozona koristi sva tri atoma kiseonika koja ima za oksidaciju, na primer, 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3.
Vrlo važna razlika između ozona i kisika je u tome što ozon pokazuje oksidirajuća svojstva već na sobnoj temperaturi. Na primjer, PbS i Pb(OH)2 ne reagiraju s kisikom u normalnim uvjetima, dok se u prisustvu ozona sulfid pretvara u PbSO4, a hidroksid u PbO2. Ako se koncentrirana otopina amonijaka ulije u posudu s ozonom, pojavit će se bijeli dim - to je amonijak koji oksidira ozon i stvara amonijev nitrit NH4NO2. Posebno karakteristična za ozon je sposobnost da „crni“ srebrne predmete sa stvaranjem AgO i Ag2O3.
Dodavanjem jednog elektrona i pretvaranjem u negativni O3– jon, molekul ozona postaje stabilniji. "Soli ozonske kiseline" ili ozonid koji sadrže takve anione poznati su dugo vremena - formiraju ih svi alkalni metali osim litijuma, a stabilnost ozonida se povećava od natrija do cezija. Poznati su i neki ozonidi zemnoalkalnih metala, na primjer Ca(O3)2. Ako se struja plina ozona usmjeri na površinu čvrste suhe lužine, formira se narandžasto-crvena kora koja sadrži ozonide, na primjer, 4KOH + 4O3 → 4KO3 + O2 + 2H2O. U isto vrijeme, čvrsta alkalija efikasno veže vodu, što štiti ozonid od trenutne hidrolize. Međutim, sa viškom vode, ozonidi se brzo razlažu: 4KO3+ 2H2O → 4KOH + 5O2. Razgradnja se takođe dešava tokom skladištenja: 2KO3 → 2KO2 + O2. Ozonidi su vrlo topljivi u tekućem amonijaku, što im je omogućilo izolaciju u čistom obliku i proučavanje njihovih svojstava.
Organske supstance sa kojima ozon dolazi u kontakt se obično uništavaju. Dakle, ozon, za razliku od hlora, može razdvojiti benzenski prsten. Kada radite s ozonom, ne možete koristiti gumene cijevi i crijeva - oni će odmah postati propusni. Reakcije ozona s organskim spojevima oslobađaju velike količine energije. Na primjer, eter, alkohol, vata natopljena terpentinom, metan i mnoge druge tvari spontano se zapale u dodiru s ozoniranim zrakom, a miješanje ozona sa etilenom dovodi do jake eksplozije.
Primjena ozona.
Ozon ne „sagoreva“ uvek organsku materiju; u nekim slučajevima moguće je provesti specifične reakcije sa visoko razrijeđenim ozonom. Na primjer, kada se ozonira oleinska kiselina (u velikim količinama se nalazi u biljnim uljima), nastaje azelainska kiselina HOOC(CH2)7COOH, koja se koristi za proizvodnju visokokvalitetnih ulja za podmazivanje, sintetičkih vlakana i plastifikatora. Slično se dobija i adipinska kiselina koja se koristi u sintezi najlona. Godine 1855. Schönbein je otkrio reakciju nezasićenih jedinjenja koja sadrže dvostruke C=C veze sa ozonom, ali je tek 1925. njemački hemičar H. Staudinger ustanovio mehanizam ove reakcije. Molekul ozona se veže na dvostruku vezu i formira ozonid - ovaj put organski, a atom kisika zamjenjuje jednu od C=C veza, a –O–O– grupa zauzima mjesto druge. Iako su neki organski ozonidi izolirani u čistom obliku (na primjer, etilen ozonid), ova reakcija se obično provodi u razrijeđenoj otopini, budući da su slobodni ozonidi vrlo nestabilni eksplozivi. Organski hemičari visoko cijene reakciju ozoniranja nezasićenih spojeva; Problemi sa ovom reakcijom se često nude čak i na školskim takmičenjima. Činjenica je da kada se ozonid razgradi s vodom, nastaju dvije molekule aldehida ili ketona koje je lako identificirati i dalje utvrditi strukturu izvornog nezasićenog spoja. Tako su hemičari početkom 20. veka ustanovili strukturu mnogih važnih organskih jedinjenja, uključujući i prirodna, koja sadrže C=C veze.
Važno područje primjene ozona je dezinfekcija vode za piće. Obično je voda hlorisana. Međutim, neke nečistoće u vodi pod uticajem hlora pretvaraju se u jedinjenja veoma neprijatnog mirisa. Stoga se već dugo predlaže da se klor zamijeni ozonom. Ozonirana voda ne dobija nikakav strani miris ili ukus; Kada se mnoga organska jedinjenja potpuno oksidiraju ozonom, nastaju samo ugljični dioksid i voda. Ozon takođe pročišćava otpadne vode. Proizvodi oksidacije ozona čak i zagađivača kao što su fenoli, cijanidi, surfaktanti, sulfiti, hloramini su bezopasna jedinjenja bez boje i mirisa. Višak ozona se prilično brzo raspada i stvara kisik. Međutim, ozoniranje vode je skuplje od hloriranja; Osim toga, ozon se ne može transportirati i mora se proizvoditi na mjestu upotrebe.
Ozon u atmosferi.
U Zemljinoj atmosferi ima malo ozona - 4 milijarde tona, tj. u prosjeku samo 1 mg/m3. Koncentracija ozona raste s udaljenosti od Zemljine površine i dostiže maksimum u stratosferi, na visini od 20-25 km - to je "ozonski omotač". Kada bi se sav ozon iz atmosfere prikupio na površini Zemlje pri normalnom pritisku, rezultujući sloj bi bio debeo samo oko 2-3 mm. A tako male količine ozona u zraku zapravo podržavaju život na Zemlji. Ozon stvara "zaštitni ekran" koji sprečava da tvrde ultraljubičaste zrake sunca, koje su destruktivne za sva živa bića, dođu do površine Zemlje.
Posljednjih decenija mnogo se pažnje posvećuje pojavi takozvanih „ozonskih rupa“ – područja sa značajno smanjenim nivoom stratosferskog ozona. Kroz takav "propusni" štit, oštrije ultraljubičasto zračenje sa Sunca dopire do površine Zemlje. Zbog toga naučnici već duže vrijeme prate ozon u atmosferi. Godine 1930., engleski geofizičar S. Chapman, da bi objasnio stalnu koncentraciju ozona u stratosferi, predložio je shemu od četiri reakcije (ove reakcije su nazvane Chapmanov ciklus, u kojem M označava svaki atom ili molekulu koji nosi višak energije) :
O2 → 2O
O + O + M → O2 + M
O + O3 → 2O2
O3 → O2 + O.
Prva i četvrta reakcija ovog ciklusa su fotohemijske, nastaju pod uticajem sunčevog zračenja. Za razlaganje molekule kiseonika na atome potrebno je zračenje talasne dužine manje od 242 nm, dok se ozon raspada kada se svetlost apsorbuje u području od 240-320 nm (potonja reakcija nas precizno štiti od tvrdog ultraljubičastog zračenja, jer kiseonik ne ne apsorbuje u ovom spektralnom području). Preostale dvije reakcije su termičke, tj. ići bez uticaja svetlosti. Vrlo je važno da treća reakcija, koja vodi do nestanka ozona, ima energiju aktivacije; to znači da se brzina takve reakcije može povećati djelovanjem katalizatora. Kako se pokazalo, glavni katalizator razgradnje ozona je dušikov oksid NO. Nastaje u gornjim slojevima atmosfere od dušika i kisika pod utjecajem najžešćeg sunčevog zračenja. Kada uđe u ozonosferu, ulazi u ciklus od dvije reakcije O3 + NO → NO2 + O2, NO2 + O → NO + O2, uslijed čega se njegov sadržaj u atmosferi ne mijenja, a stacionarna koncentracija ozona opada. Postoje i drugi ciklusi koji dovode do smanjenja sadržaja ozona u stratosferi, na primjer, uz učešće hlora:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
Ozon takođe uništavaju prašina i gasovi koji u velikim količinama ulaze u atmosferu tokom vulkanskih erupcija. Nedavno se sugerisalo da je ozon takođe efikasan u uništavanju vodonika koji se oslobađa iz zemljine kore. Kombinacija svih reakcija nastajanja i raspada ozona dovodi do činjenice da je prosječni životni vijek molekula ozona u stratosferi oko tri sata.
Smatra se da osim prirodnih, postoje i vještački faktori koji utiču na ozonski omotač. Dobro poznati primjer su freoni, koji su izvori atoma hlora. Freoni su ugljikovodici u kojima su atomi vodika zamijenjeni atomima fluora i hlora. Koriste se u rashladnoj tehnici i za punjenje aerosol limenki. Konačno, freoni ulaze u zrak i polako se uzdižu sve više i više uz zračne struje, konačno dostižući ozonski omotač. Razlažući se pod utjecajem sunčevog zračenja, sami freoni počinju katalitički razlagati ozon. Još se ne zna tačno u kojoj meri su freoni krivi za „ozonsku rupu“, a ipak se odavno preduzimaju mere za ograničavanje njihove upotrebe.
Proračuni pokazuju da se za 60-70 godina koncentracija ozona u stratosferi može smanjiti za 25%. A istovremeno će se povećati koncentracija ozona u prizemnom sloju – troposferi, što je također loše, jer su ozon i proizvodi njegovih transformacija u zraku otrovni. Glavni izvor ozona u troposferi je prijenos stratosferskog ozona sa vazdušnim masama u niže slojeve. Svake godine otprilike 1,6 milijardi tona ozona uđe u prizemni sloj. Životni vijek molekula ozona u donjem dijelu atmosfere je mnogo duži - više od 100 dana, jer je intenzitet ultraljubičastog sunčevog zračenja koje uništava ozon manji u prizemnom sloju. Obično je u troposferi vrlo malo ozona: u čistom svježem zraku njegova koncentracija je u prosjeku samo 0,016 μg/l. Koncentracija ozona u vazduhu ne zavisi samo od nadmorske visine, već i od terena. Dakle, uvijek ima više ozona iznad okeana nego nad kopnom, budući da se ozon tamo sporije raspada. Mjerenja u Sočiju pokazala su da zrak u blizini morske obale sadrži 20% više ozona nego u šumi udaljenoj 2 km od obale.
Moderni ljudi udišu znatno više ozona nego njihovi preci. Glavni razlog za to je povećanje količine metana i dušikovih oksida u zraku. Dakle, sadržaj metana u atmosferi konstantno raste od sredine 19. stoljeća, kada je počela upotreba prirodnog plina. U atmosferi zagađenoj dušičnim oksidima, metan ulazi u složeni lanac transformacija uz učešće kisika i vodene pare, čiji se rezultat može izraziti jednadžbom CH4 + 4O2 → HCHO + H2O + 2O3. Drugi ugljovodonici takođe mogu delovati kao metan, na primer, oni sadržani u izduvnim gasovima automobila tokom nepotpunog sagorevanja benzina. Kao rezultat toga, koncentracija ozona u zraku velikih gradova se deset puta povećala u posljednjih nekoliko decenija.
Oduvijek se vjerovalo da se tokom grmljavine koncentracija ozona u zraku naglo povećava, jer munja pospješuje pretvaranje kisika u ozon. U stvari, povećanje je neznatno i ne nastaje tokom grmljavine, već nekoliko sati prije nje. Za vrijeme grmljavine i nekoliko sati nakon nje koncentracija ozona se smanjuje. To se objašnjava činjenicom da prije grmljavine dolazi do snažnog vertikalnog miješanja zračnih masa, tako da dodatna količina ozona dolazi iz gornjih slojeva. Osim toga, prije grmljavine povećava se jačina električnog polja i stvaraju se uvjeti za stvaranje koronskog pražnjenja na vrhovima raznih objekata, na primjer, vrhovima grana. Ovo također doprinosi stvaranju ozona. A zatim, kako se grmljavinski oblak razvija, ispod njega nastaju moćne uzlazne struje zraka koje smanjuju sadržaj ozona direktno ispod oblaka.
Zanimljivo je pitanje o sadržaju ozona u zraku četinarskih šuma. Na primjer, u Kursu neorganske hemije G. Remyja možete pročitati da je “ozonizirani zrak četinarskih šuma” fikcija. je li tako? Naravno, nijedna biljka ne proizvodi ozon. Ali biljke, posebno četinjača, ispuštaju mnogo hlapljivih organskih spojeva u zrak, uključujući nezasićene ugljikovodike klase terpena (ima ih mnogo u terpentinu). Dakle, u vrućem danu, bor oslobađa 16 mikrograma terpena na sat za svaki gram suhe težine iglica. Terpene oslobađaju ne samo četinari, već i neka listopadna drveća, uključujući topolu i eukaliptus. A neka tropska stabla mogu osloboditi 45 mcg terpena na 1 g suhe mase lišća na sat. Kao rezultat toga, jedan hektar četinarske šume može osloboditi do 4 kg organske tvari dnevno, a oko 2 kg listopadne šume. Šumska površina Zemlje je milione hektara, a sve one emituju stotine hiljada tona različitih ugljovodonika, uključujući terpene, godišnje. A ugljikovodici, kao što je pokazano na primjeru metana, pod utjecajem sunčevog zračenja i u prisustvu drugih nečistoća doprinose stvaranju ozona. Kao što su eksperimenti pokazali, terpeni su, pod odgovarajućim uslovima, zaista vrlo aktivno uključeni u ciklus atmosferskih fotohemijskih reakcija sa stvaranjem ozona. Dakle, ozon u crnogoričnoj šumi uopće nije fikcija, već eksperimentalna činjenica.
Ozon i zdravlje.
Kako je lijepo prošetati nakon grmljavine! Vazduh je čist i svež, njegovi okrepljujući potoci kao da teku u pluća bez ikakvog napora. „Miriše na ozon“, često kažu u takvim slučajevima. “Veoma dobro za zdravlje.” je li tako?
Ozon se nekada smatrao korisnim za zdravlje. Ali ako njegova koncentracija prijeđe određeni prag, može uzrokovati mnogo neugodnih posljedica. Ovisno o koncentraciji i vremenu udisanja, ozon izaziva promjene na plućima, iritaciju sluzokože očiju i nosa, glavobolju, vrtoglavicu i pad krvnog tlaka; Ozon smanjuje otpornost organizma na bakterijske infekcije respiratornog trakta. Maksimalna dozvoljena koncentracija u vazduhu je samo 0,1 μg/l, što znači da je ozon mnogo opasniji od hlora! Ako provedete nekoliko sati u prostoriji sa koncentracijom ozona od samo 0,4 μg/l, mogu se javiti bol u grudima, kašalj, nesanica, a oštrina vida može se smanjiti. Ako dugo udišete ozon u koncentraciji većoj od 2 μg/l, posljedice mogu biti teže - čak i tromost i pad srčane aktivnosti. Kada je sadržaj ozona 8-9 μg/l, u roku od nekoliko sati nastaje plućni edem, koji može biti fatalan. Ali takve male količine supstance obično je teško analizirati konvencionalnim hemijskim metodama. Na sreću, osoba osjeća prisutnost ozona čak i pri vrlo niskim koncentracijama - oko 1 µg/l, pri kojima škrobni jodni papir još neće poplaviti. Nekim ljudima miris ozona u niskim koncentracijama podsjeća na miris klora, drugima - na sumpor-dioksid, trećima - na bijeli luk.
Nije samo ozon toksičan. Njegovim učešćem u vazduhu, na primer, nastaje peroksiacetil nitrat (PAN) CH3–CO–OONO2, supstanca koja ima jako iritativno dejstvo, uključujući suzenje, otežava disanje, au većim koncentracijama izaziva paralizu srca. PAN je jedna od komponenti takozvanog fotohemijskog smoga koji nastaje ljeti u zagađenom zraku (ova riječ je izvedena od engleskog smoke – dim i fog – magla). Koncentracija ozona u smogu može doseći 2 µg/l, što je 20 puta više od maksimalno dozvoljene granice. Takođe treba uzeti u obzir da je kombinovani efekat ozona i azotnih oksida u vazduhu desetine puta jači od svake supstance posebno. Nije iznenađujuće da posljedice ovakvog smoga u velikim gradovima mogu biti katastrofalne, pogotovo ako se zrak iznad grada ne prodire „promajem“ i formira se zona stagnacije. Tako je u Londonu 1952. godine više od 4.000 ljudi umrlo od smoga u roku od nekoliko dana. A smog u Njujorku 1963. ubio je 350 ljudi. Bilo je sličnih priča u Tokiju i drugim velikim gradovima. Nisu samo ljudi ti koji pate od atmosferskog ozona. Američki istraživači su, na primjer, pokazali da je u područjima s visokim nivoom ozona u zraku životni vijek automobilskih guma i drugih proizvoda od gume značajno smanjen.
Kako smanjiti sadržaj ozona u prizemnom sloju? Teško da je realno smanjiti ispuštanje metana u atmosferu. Preostaje još jedan način da se smanji emisija dušikovih oksida, bez kojih se ne može odvijati ciklus reakcija koje dovode do ozona. Ovaj put također nije lak, jer dušične okside ne emituju samo automobili, već i (uglavnom) termoelektrane.
Izvori ozona nisu samo na ulici. Formira se u rendgenskim sobama, u prostorijama za fizioterapiju (izvor su joj živino-kvarcne lampe), tokom rada opreme za kopiranje (kopir aparata), laserskih štampača (ovdje je razlog njegovog nastanka visokonaponsko pražnjenje). Ozon je neizbježan pratilac u proizvodnji perhidrolnog i argon-lučnog zavarivanja. Za smanjenje štetnog djelovanja ozona potrebno je imati ventilacionu opremu u blizini ultraljubičastih lampi i dobru ventilaciju prostorije.
Pa ipak, teško je ispravno smatrati ozon apsolutno štetnim po zdravlje. Sve zavisi od njegove koncentracije. Istraživanja su pokazala da svježi zrak vrlo slabo svijetli u mraku; Uzrok sjaja su oksidacijske reakcije koje uključuju ozon. Sjaj je uočen i pri mućkanju vode u tikvici u koju je prethodno bio uveden ozonizovani kiseonik. Ovaj sjaj je uvijek povezan s prisustvom malih količina organskih nečistoća u zraku ili vodi. Kada se svježi zrak pomiješa sa izdahnutim dahom osobe, intenzitet sjaja se desetostruko povećava! I to nije iznenađujuće: u izdahnutom zraku pronađene su mikronečistoće etilena, benzena, acetaldehida, formaldehida, acetona i mravlje kiseline. Oni su „naglašeni“ ozonom. Istovremeno, „ustajalo“, tj. potpuno lišen ozona, iako vrlo čist, zrak ne proizvodi sjaj, a osoba ga doživljava kao “zamućen”. Takav vazduh se može uporediti sa destilovanom vodom: veoma je čist, praktično bez nečistoća, a piti ga je štetno. Dakle, potpuno odsustvo ozona u zraku je, po svemu sudeći, nepovoljno i za čovjeka, jer povećava sadržaj mikroorganizama u njemu i dovodi do nakupljanja štetnih tvari i neugodnih mirisa, koje ozon uništava. Tako postaje jasna potreba za redovnim i dugotrajnim provjetravanjem prostorija, čak i ako u njemu nema ljudi: uostalom, ozon koji uđe u prostoriju ne ostaje dugo u njoj - djelomično se raspada, a uvelike se taloži. (adsorbira) na zidovima i drugim površinama. Teško je reći koliko ozona treba da bude u prostoriji. Međutim, u minimalnim koncentracijama, ozon je vjerovatno neophodan i koristan.
Ilya Leenson