Ugljenik je šesti element Mendeljejevog periodnog sistema. Njegova atomska težina je 12.
Ugljenik je u drugom periodu Mendeljejevskog sistema i u četvrtoj grupi ovog sistema.
Broj perioda nam govori da se šest elektrona ugljenika nalazi na dva energetska nivoa.
A broj četvrte grupe kaže da ugljenik ima četiri elektrona na svom vanjskom energetskom nivou. Dvije od njih su uparene s-elektrona, a druga dva nisu uparena R-elektroni.
Struktura vanjskog elektronskog sloja atoma ugljika može se izraziti sljedećim šemama:
Svaka ćelija na ovim dijagramima označava zasebnu elektronsku orbitalu, strelica označava elektron koji se nalazi u orbitali. Dvije strelice unutar jedne ćelije su dva elektrona smještena u istoj orbitali, ali sa suprotnim okretima.
Kada je atom pobuđen (kada mu se prenosi energija), jedan od uparenih S-elektroni zauzeti R-orbitalni.
Pobuđeni atom ugljika može sudjelovati u formiranju četiri kovalentne veze. Stoga, u velikoj većini svojih jedinjenja, ugljenik pokazuje valencu od četiri.
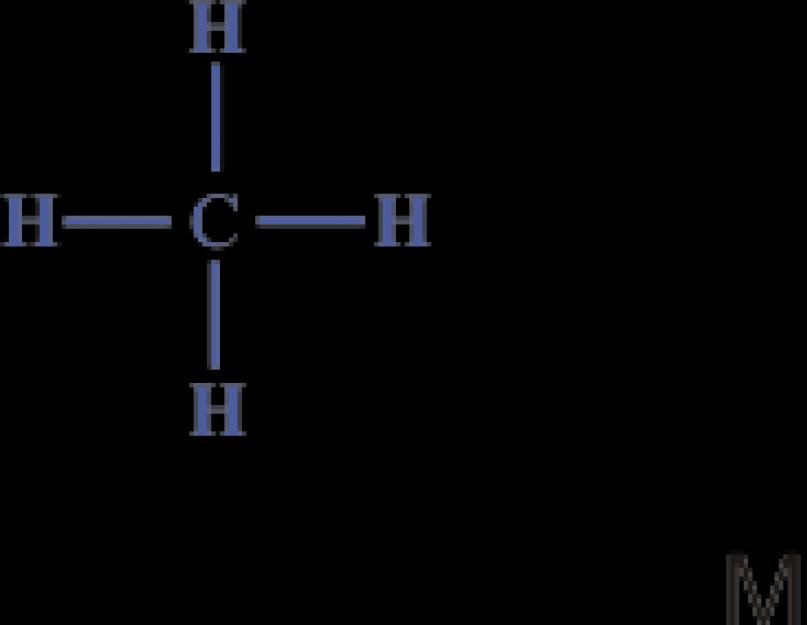
Dakle, najjednostavnije organsko jedinjenje, ugljovodonik metan, ima sastav CH 4. Njegova struktura se može izraziti strukturnim ili elektronskim formulama:

Elektronska formula pokazuje da atom ugljika u molekuli metana ima stabilnu vanjsku ljusku od osam elektrona, a atomi vodika imaju stabilnu ljusku od dva elektrona.
Sve četiri kovalentne ugljične veze u metanu (i u drugim sličnim spojevima) su ekvivalentne i simetrično usmjerene u prostoru. Atom ugljika nalazi se, takoreći, u središtu tetraedra (pravilne četverokutne piramide), a četiri atoma povezana s njim (u slučaju metana, četiri atoma vodika) nalaze se u vrhovima tetraedra.

Uglovi između smjerova bilo kojeg para veza su isti i iznose 109 stepeni 28 minuta.
To se objašnjava činjenicom da u atomu ugljika, kada formira kovalentne veze sa četiri druga atoma, od jednog s- i tri str-orbitale kao rezultat sp 3-hibridizacijom nastaju četiri hibrida simetrično smještena u prostoru sp 3-orbitale izdužene prema vrhovima tetraedra.

Karakteristike svojstava ugljika.
Broj elektrona na vanjskom energetskom nivou je glavni faktor koji određuje hemijska svojstva elementa.
Na lijevoj strani periodnog sistema nalaze se elementi sa nisko popunjenim vanjskim elektronskim nivoom. Elementi prve grupe imaju jedan elektron na vanjskom nivou, elementi druge grupe imaju dva.
Elementi ove dvije grupe su metali. Lako se oksidiraju, tj. gube svoje vanjske elektrone i postaju pozitivni ioni.
Na desnoj strani periodnog sistema, naprotiv, postoje nemetali (oksidanti). U poređenju sa metalima, imaju jezgro sa većim brojem protona. Ovako masivno jezgro pruža mnogo jače povlačenje svog elektronskog oblaka.
Takvi elementi s velikim poteškoćama gube svoje elektrone, ali nisu skloni da pridruže dodatne elektrone s drugih atoma, tj. oksidiraju ih, a istovremeno se pretvaraju u negativni ion.
Kako se broj grupe u periodnom sistemu povećava, metalna svojstva elemenata slabe, a njihova sposobnost da oksidiraju druge elemente se povećava.
Ugljik je u četvrtoj grupi, tj. tačno u sredini između metala, koji lako odustaju od elektrona, i nemetala, koji lako dobijaju te elektrone.
Iz tog razloga ugljenik nema izraženu tendenciju doniranja ili dobijanja elektrona.
Karbonski lanci.
Izuzetno svojstvo ugljika, koje određuje raznolikost organska jedinjenja, je sposobnost njegovih atoma da se međusobno povežu jakim kovalentnim vezama, formirajući ugljikova kola praktički neograničene dužine.

Pored ugljika, lanci identičnih atoma formirani su od njegovog analoga iz grupe IV - silicija. Međutim, takvi lanci ne sadrže više od šest atoma Si. Poznati su dugi lanci atoma sumpora, ali jedinjenja koja ih sadrže su krhka.
Valencije atoma ugljika koje se ne koriste za međusobno povezivanje koriste se za dodavanje drugih atoma ili grupa (kod ugljikovodika - za dodavanje vodika).
Dakle, ugljovodonici etan ( C 2 H 6) i propan ( C 3 H 8) sadrže lance od dva i tri atoma ugljika, respektivno. Njihova struktura je izražena sljedećim strukturnim i elektronskim formulama:

Poznati su spojevi koji sadrže stotine ili više atoma ugljika u svojim lancima.
Zbog tetraedarske orijentacije ugljikovih veza, njegovi atomi uključeni u lanac nisu smješteni u pravoj liniji, već u cik-cak uzorku. Štoviše, zbog mogućnosti rotacije atoma oko ose veze, lanac u svemiru može zauzeti raznih oblika(konformacije):

Ova struktura lanaca omogućava da se terminalni ili drugi nesusedni atomi ugljika približe jedan drugom. Kao rezultat stvaranja veza između ovih atoma, ugljikovi lanci se mogu zatvoriti u prstenove (cikluse), na primjer:

Dakle, raznolikost organskih jedinjenja određena je i činjenicom da su sa istim brojem atoma ugljenika u molekulu moguća jedinjenja sa otvorenim, otvorenim lancem atoma ugljenika, kao i supstance čiji molekuli sadrže cikluse.
Jednostavne i višestruke veze.
Kovalentne veze između atoma ugljika formirane jednim parom generaliziranih elektrona nazivaju se jednostavne veze.

Veza između atoma ugljika može se izvesti ne jednim, već dva ili tri zajednička para elektrona. Tada dobijamo lance sa višestrukim – dvostrukim ili trostrukim vezama. Ove veze se mogu prikazati na sljedeći način:
Najjednostavniji spojevi koji sadrže višestruke veze su ugljikovodici etilen(sa dvostrukom vezom) i acetilen(sa trostrukom vezom):

Ugljikovodici s višestrukim vezama nazivaju se nezasićeni ili nezasićeni. Etilen i acetilen su prvi predstavnici dva homologna niza - etilen i acetilen ugljovodonika.
U ovom članku ćemo pogledati element koji je dio periodnog sistema D.I. Mendeljejeva, odnosno ugljenika. U modernoj nomenklaturi označen je simbolom C, uvršten je u četrnaestu grupu i "učesnik" je drugog perioda, ima šesti serijski broj i svoj a.u.m. = 12,0107.
Atomske orbitale i njihova hibridizacija
Pogledajmo ugljenik sa njegovim orbitalama i njihovom hibridizacijom - njegovim glavnim karakteristikama, zahvaljujući kojima još uvek zadivljuje naučnike širom sveta. Kakva je njihova struktura?
Hibridizacija atoma ugljika je raspoređena na način da valentni elektroni zauzimaju pozicije u tri orbitale, i to: jedna je u 2s orbitali, a dva su u 2p orbitali. Posljednje dvije od tri orbitale formiraju ugao od 90 stepeni jedna u odnosu na drugu, a orbitala 2s ima sfernu simetriju. Međutim, ovaj oblik uređenja orbitala koji se razmatra ne dozvoljava nam da shvatimo zašto ugljenik, kada ulazi u organska jedinjenja, formira uglove od 120, 180 i 109,5 stepeni. Formula za elektronsku strukturu atoma ugljika izražava se u sljedećem obliku: (He) 2s 2 2p 2.
Razrješenje nastale kontradikcije izvršeno je uvođenjem u promet koncepta hibridizacije atomskih orbitala. Da bi se razumjela trokutasta, varijantna priroda C-a, bilo je potrebno stvoriti tri oblika reprezentacije o njegovoj hibridizaciji. Glavni doprinos nastanku i razvoju ovog koncepta dao je Linus Pauling.

Fizička svojstva
Struktura atoma ugljika određuje prisustvo brojnih fizičkih karakteristika. Atomi ovog elementa tvore jednostavnu tvar - ugljik, koja ima modifikacije. Varijacije u promjenama u njegovoj strukturi mogu rezultujućoj tvari dati različite kvalitativne karakteristike. Razlog dostupnosti velika količina modifikacije ugljenika leži u njegovoj sposobnosti da uspostavi i formira različite vrste veza hemijske prirode.
Struktura atoma ugljika može varirati, što mu omogućava da ima određeni broj izotopskih oblika. Ugljik koji se nalazi u prirodi formiran je pomoću dva stabilna izotopa - 12 C i 13 C - i izotopa sa radioaktivnim svojstvima - 14 C. Potonji izotop je koncentrisan u gornjim slojevima Zemljine kore iu atmosferi. Zbog uticaja kosmičkog zračenja, odnosno njegovih neutrona, na jezgro atoma azota, nastaje radioaktivni izotop 14 C. Nakon sredine pedesetih godina dvadesetog veka, počeo je da ulazi u okolinu kao stvoreni proizvod koji je napravio čovek. tokom rada nuklearnih elektrana i kao rezultat upotrebe hidrogenske bombe. Upravo na procesu raspadanja 14 C zasniva se tehnika radiokarbonskog datiranja, koja je pronašla svoje široka primena u arheologiji i geologiji.
Modifikacija ugljika u alotropskom obliku
U prirodi postoje mnoge tvari koje sadrže ugljik. Čovjek koristi strukturu atoma ugljika za svoje potrebe kada stvara različite tvari, uključujući:
- Kristalni ugljik (dijamanti, ugljične nanocijevi, vlakna i žice, fulerini, itd.).
- Amorfni uglji (aktivni ugljen i ugalj, različite vrste koks, čađa, čađ, nanopjena i antracit).
- Klasterski oblici ugljika (dikarboni, nanokonusi i jedinjenja astralena).
Strukturne karakteristike atomske strukture

Elektronska struktura atoma ugljika može imati različite geometrije, koje zavise od nivoa hibridizacije orbitala koje posjeduje. Postoje 3 glavne vrste geometrije:
- Tetraedarski - nastao zbog pomaka četiri elektrona, od kojih je jedan s-elektron, a tri pripadaju p-elektronima. C atom zauzima centralnu poziciju u tetraedru i povezan je sa četiri ekvivalentne sigma veze sa drugim atomima koji zauzimaju vrh ovog tetraedra. Ovaj geometrijski raspored ugljika može proizvesti alotrope kao što su dijamant i lonsdaleit.
- Trigonalni - svoj izgled duguje pomaku tri orbitale, od kojih je jedna s-, a dvije p-. Ovdje postoje tri sigma veze, koje su jedna s drugom u ekvivalentnom položaju; leže u zajedničkoj ravni i održavaju ugao od 120 stepeni jedan prema drugom. Slobodna p-orbitala se nalazi okomito na ravan sigma veze. Grafit ima sličnu strukturnu geometriju.
- Dijagonalno - pojavljuje se zbog miješanja s- i p-elektrona (sp hibridizacija). Elektronski oblaci se protežu duž općeg smjera i poprimaju oblik asimetrične bučice. Slobodni elektroni stvaraju π veze. Ova geometrijska struktura u ugljiku dovodi do pojave karbina, posebnog oblika modifikacije.
Atomi ugljika u prirodi
Čovjek je dugo razmatrao strukturu i svojstva atoma ugljika i koristi se za dobivanje velikog broja različitih tvari. Atomi ovog elementa, zbog svoje jedinstvene sposobnosti formiranja različitih kemijskih veza i prisutnosti orbitalne hibridizacije, stvaraju mnogo različitih alotropskih modifikacija uz sudjelovanje samo jednog elementa, od atoma istog tipa - ugljika.

U prirodi se ugljenik nalazi u zemljine kore; ima oblik dijamanata, grafita, raznih zapaljivih materijala prirodni resursi na primjer, nafta, antracit, mrki ugalj, škriljac, treset itd. Dio gasova koje ljudi koriste u energetska industrija. Ugljik u svom dioksidu ispunjava hidrosferu i atmosferu Zemlje, dostižući do 0,046% u zraku, a do šezdeset puta više u vodi.
U ljudskom tijelu, C se nalazi u količini približno jednakoj 21%, a izlučuje se uglavnom urinom i izdahnutim zrakom. Isti element učestvuje u biološkom ciklusu, apsorbuje ga biljke i troše ga tokom fotosinteze.
Atomi ugljika, zbog svoje sposobnosti da uspostave različite kovalentne veze i od njih grade lance, pa čak i cikluse, mogu stvoriti ogromnu količinu organskih tvari. Osim toga, ovaj element je dio solarna atmosfera, koji se nalazi u jedinjenjima sa vodonikom i azotom.
Svojstva hemijske prirode

Pogledajmo sada strukturu i svojstva atoma ugljika sa hemijske tačke gledišta.
Važno je znati da ugljik pokazuje inertna svojstva u normalnim temperaturnim uvjetima, ali nam može pokazati svojstva redukcije pod utjecajem visoke temperature. Glavna oksidaciona stanja su: + - 4, ponekad +2, a takođe i +3.
Učestvuje u reakcijama sa velikim brojem elemenata. Može reagovati sa vodom, vodonikom, halogenima, alkalnim metalima, kiselinama, fluorom, sumporom itd.
Struktura atoma ugljika stvara nevjerovatno ogroman broj tvari, odvojenih u posebnu klasu. Takva jedinjenja nazivaju se organskim i baziraju se na C. To je moguće zbog svojstva atoma ovog elementa da formiraju polimerne lance. Među najpoznatijim i najobimnijim grupama su proteini (proteini), masti, ugljikohidrati i ugljovodonična jedinjenja.
Metode rada
Zbog jedinstvene strukture atoma ugljika i njegovih pratećih svojstava, element se naširoko koristi od strane ljudi, na primjer, u stvaranju olovaka, metalnih lonaca za topljenje - ovdje se koristi grafit. Dijamanti se koriste kao abrazivi, nakit, burgije itd.
Farmakologija i medicina također se bave upotrebom ugljika u raznim spojevima. Ovaj element je dio čelika, služi kao osnova za svaku organsku tvar, učestvuje u procesu fotosinteze itd.
Toksičnost elementa

Struktura atoma elementa ugljika podrazumijeva prisustvo opasnog efekta na živu materiju. Ugljik ulazi u svijet oko nas kao rezultat sagorijevanja uglja u termoelektranama, uključuje se u plinove koje proizvode automobili, u slučaju koncentrata uglja itd.
Procenat sadržaja ugljika u aerosolima je visok, što za sobom povlači povećanje procenta oboljelih. Najčešće su zahvaćeni gornji respiratorni trakt i pluća. Neke bolesti se mogu klasificirati kao profesionalne, na primjer, bronhitis prašine i bolesti grupe pneumokonioza.
14 C je toksičan, a jačina njegovog uticaja je određena interakcijom zračenja sa β-česticama. Ovaj atom je uključen u sastav bioloških molekula, uključujući i one koje se nalaze u deoksi- i ribonukleinske kiseline. Prihvatljiva količina od 14 C u vazduhu radni prostor smatra se da je nivo 1,3 Bq/l. Maksimalna količina ugljika koji ulazi u tijelo tokom disanja odgovara 3,2 * 10 8 Bq/god.
C – 1s 2 2s 2 2p 2 ili 1s 2 2s 2 2p x 1 2p y 1 2p z 0
U grafičkom obliku:
Atom ugljika u pobuđenom stanju ima sljedeću elektronsku formulu:
*C – 1s 2 2s 1 2p 3 ili 1s 2 2s 1 2p x 1 2p y 1 2p z 1
U obliku ćelija: 
Oblik s- i p-orbitala


Atomska orbitala- područje prostora u kojem će se najvjerovatnije naći elektron, sa odgovarajućim kvantnim brojevima.
To je trodimenzionalna "karta konture" elektrona u kojoj valna funkcija određuje relativnu vjerovatnoću pronalaska elektrona u toj određenoj tački orbite.
Relativna veličina atomskih orbitala raste kako se povećava njihova energija ( glavni kvantni broj- n), a njihov oblik i orijentaciju u prostoru određuju kvantni brojevi l i m. Elektrone u orbitalama karakteriše spin kvantni broj. Svaka orbitala ne može sadržavati više od 2 elektrona sa suprotnim spinovima.
Prilikom formiranja veza s drugim atomima, atom ugljika transformiše svoju elektronsku ljusku tako da se formiraju najjače veze, a samim tim se oslobađa što više energije, a sistem dobija najveću stabilnost.
Za promjenu elektronske ljuske atoma potrebna je energija, koja se zatim kompenzira stvaranjem jačih veza.
Transformacija elektronske ljuske (hibridizacija) može biti uglavnom od 3 vrste, ovisno o broju atoma s kojima atom ugljika stvara veze.
Vrste hibridizacije:
sp 3 – Hibridizacija (valentno stanje)– atom stvara veze sa 4 susjedna atoma (tetraedarska hibridizacija):
Elektronska formula sp 3 – hibridnog atoma ugljika:
*S –1s 2 2(sp 3) 4 u obliku ćelija ![]()

Ugao veze između hibridnih orbitala je ~109°.
Stereohemijska formula atoma ugljika:
sp 2 – Hibridizacija (valentno stanje)– atom stvara veze sa 3 susjedna atoma (trigonalna hibridizacija):
Elektronska formula sp 2 – hibridnog atoma ugljika:
*S –1s 2 2(sp 2) 3 2p 1 u obliku ćelija 
Ugao veze između hibridnih orbitala je ~120°.
Stereohemijska formula sp 2 - hibridnog atoma ugljika:
sp – Hibridizacija (valentno stanje) – atom stvara veze sa 2 susjedna atoma (linearna hibridizacija):
Elektronska formula sp – hibridnog atoma ugljika:
*S –1s 2 2(sp) 2 2p 2 u obliku ćelija
Ugao veze između hibridnih orbitala je ~180°.
Stereohemijska formula:
S-orbitala je uključena u sve vrste hibridizacije, jer ima minimalnu energiju.
Preuređenje elektronskog oblaka omogućava stvaranje najjačih mogućih veza i minimalnu interakciju atoma u nastaloj molekuli. Gde hibridne orbitale možda nisu identične, ali uglovi veze mogu biti različiti, na primjer CH 2 Cl 2 i CCl 4
2. Klasifikacija i nomenklatura organskih jedinjenja. Vrste izomerizma u organskim molekulima.
Klasifikacija izomera
Strukturno (različiti red povezivanja atoma)
Stereoizomerizam (različiti raspored atoma u prostoru)
Krugovi 1. Višestruke priključke
2. Odredbe funkcionalne grupe
3. Konfiguracija
4. Konformacijski
2.Strukturni izomerizam.
Strukturni izomeri su izomeri koji imaju isti kvalitativni i kvantitativni sastav, ali se razlikuju po hemijskoj strukturi.
Strukturna izomerija određuje raznolikost organskih jedinjenja, posebno alkane. Sa povećanjem broja ugljikovih atoma u molekulima alkana, broj strukturnih izomera brzo raste. Dakle, za heksan (C 6 H 14) je 5, za nonan (C 9 H 20) - 35.
Atomi ugljika se razlikuju po lokaciji u lancu. Atom ugljika na početku lanca vezan je za jedan atom ugljika i naziva se primarni. Ugljikov atom vezan za dva atoma ugljika - sekundarno, sa tri – tercijarni, sa četiri – kvartarni. Alkani pravog lanca sadrže samo primarne i sekundarne atome ugljika, dok razgranati alkani sadrže i tercijarne i kvaternarne atome ugljika.
Vrste strukturnih izomerizma.
- Izomerija ugljeničnog lanca:
- Izomerizam položaja višestruke veze
Izomerizam položaja funkcionalne grupe
Metameri– jedinjenja koja pripadaju istoj klasi jedinjenja, ali imaju različite radikale:
H 3 C – O – C 3 H 7 – metilpropil etar,
H 5 C 2 – O – C 2 H 5 – dietil etar
- Međuklasni izomerizam. Unatoč istom kvalitativnom i kvantitativnom sastavu molekula, struktura tvari je različita.
H 2 C = CH – CH = CH 2 butadien -1,3 HC = C - CH 2 – CH 3 – butin-1
Strukturni izomerizam također određuje raznolikost ugljikovodičnih radikala. Izomerija radikala počinje s propanom, za koji su moguća dva radikala. Ako se atom vodika oduzme od primarnog atoma ugljika, dobije se radikal propil (n-propil). Ako se atom vodika oduzme od sekundarnog atoma ugljika, dobije se radikal izopropil.
prostorni izomerizam (stereoizomerizam)
To je postojanje izomera koji imaju isti sastav i red povezanosti atoma, ali se razlikuju po prirodi rasporeda atoma ili grupa atoma u prostoru u odnosu jedan na drugog.
Ovu vrstu izomerizma opisali su L. Pasteur (1848), J. Van't Hoff, Le Bel (1874).
U realnim uslovima, sama molekula i njeni pojedinačni delovi (atomi, grupe atoma) su u stanju vibraciono-rotacionog kretanja, a to kretanje u velikoj meri menja relativni raspored atoma u molekulu. U ovom trenutku se hemijske veze rastežu i uglovi veze se menjaju, pa nastaju različite konfiguracije i konformacije molekula.
Stoga se prostorni izomeri dijele na dvije vrste: konformacijske i konfiguracijske.
Konfiguracije su red po kojem su atomi raspoređeni u prostoru bez uzimanja u obzir razlika koje su rezultat rotacije oko pojedinačnih veza. Ovi izomeri postoje u različitim konformacijama.
Konformacije su vrlo nestabilni dinamički oblici iste molekule koji nastaju kao rezultat rotacije atoma ili grupa atoma oko jednostrukih veza, uslijed čega atomi zauzimaju različite prostorne položaje. Svaku konformaciju molekula karakterizira specifična konfiguracija.
Ϭ veza dozvoljava rotaciju oko nje, tako da jedan molekul može imati mnogo konformacija. Od mnogih konformacija, samo šest se uzima u obzir, jer Minimalnim uglom rotacije smatra se ugao jednak 60°, koji se naziva ugao torzije.
Postoje: pomračene i inhibirane konformacije.
Pomračena konformacija nastaje kada su identični supstituenti locirani na minimalna udaljenost međusobne sile odbijanja proizlaze jedna iz druge i između njih, a molekul mora imati veliku zalihu energije da održi ovu konformaciju. Ova konformacija je energetski nepovoljna.
Inhibirana konformacija – nastaje kada su identični supstituenti jedan od drugog što je moguće udaljeniji i molekul ima minimalnu rezervu energije. Ova konformacija je energetski povoljna.
P 
 Prvo jedinjenje za koje je poznato postojanje konformacionih izomera je etan. Njegova struktura u prostoru prikazana je formulom perspektive ili Newmanovom formulom:
Prvo jedinjenje za koje je poznato postojanje konformacionih izomera je etan. Njegova struktura u prostoru prikazana je formulom perspektive ili Newmanovom formulom:
C 2 H 6
zamagljeno inhibirano
konformacija konformacija
 Newmanove projekcijske formule.
Newmanove projekcijske formule.
Nama najbliži atom ugljika označen je tačkom u središtu kruga, krug predstavlja udaljeni atom ugljika. Tri veze svakog atoma su prikazane kao linije koje se razilaze od središta kruga - za najbliži atom ugljika i male - za udaljeni atom ugljika.
U dugim ugljikovim lancima moguća je rotacija oko nekoliko C–C veza. Dakle, cijeli lanac može prihvatiti razne geometrijski oblici. Prema podacima rendgenske difrakcije, dugi lanci zasićenih ugljovodonika imaju cik-cak i konformaciju u obliku kandže. Na primjer: palmitinska (C 15 H 31 COOH) i stearinska (C 17 H 35 COOH) kiseline u cik-cak konformacijama su dio lipida ćelijskih membrana, a molekuli monosaharida u rastvoru poprimaju konformaciju u obliku kandže.
Konformacije cikličkih jedinjenja
Ciklične veze karakteriziraju kutni naponi povezani s prisustvom zatvorenog ciklusa.
Ako smatramo da su ciklusi ravni, onda će za mnoge od njih uglovi veze značajno odstupati od normalnih. Naprezanje uzrokovano odstupanjem uglova veze između atoma ugljika u prstenu od normalna vrijednost, zvao ugao ili Bayer's.
Na primjer, u cikloheksanu atomi ugljika su u sp 3 hibridnom stanju i, shodno tome, ugao veze bi trebao biti jednak 109 o 28 /. Ako bi atomi ugljika ležali u istoj ravni, tada bi u ravninskom prstenu unutrašnji uglovi veze bili jednaki 120°, a svi atomi vodika bi bili u pomračenoj konformaciji. Ali cikloheksan ne može biti ravan zbog prisustva jakih ugaonih i torzijskih naprezanja. Razvija manje napregnute neplanarne konformacije zbog djelomične rotacije oko ϭ-veza, među kojima su konformacije stabilnije fotelje I kupke.
Konformacija stolice je energetski najpovoljnija, jer nema okludirane pozicije atoma vodika i ugljika. Raspored H atoma svih C atoma je isti kao u inhibiranoj konformaciji etana. U ovoj konformaciji, svi atomi vodika su otvoreni i dostupni za reakcije.
Konformacija kupke je energetski manje povoljna, jer 2 para C atoma (C-2 i C-3), (C-5 i C-6) koji leže u bazi imaju H atome u pomračenoj konformaciji, stoga ova konformacija ima veliku rezerva energije i nestabilna.
C 6 H 12 cikloheksan
Oblik "stolice" je energetski korisniji od "kade".
- Optički izomerizam.
Krajem 19. stoljeća otkriveno je da su mnoga organska jedinjenja sposobna da rotiraju ravninu polariziranog snopa lijevo i desno. Odnosno, svjetlosni snop koji pada na molekulu stupa u interakciju s njenim elektronskim omotačima i dolazi do polarizacije elektrona, što dovodi do promjene smjera oscilacija u električnom polju. Ako supstanca rotira ravan vibracije u smjeru kazaljke na satu, naziva se desnorotirajući(+) ako je suprotno od kazaljke na satu - ljevoruk(-). Ove supstance su nazvane optički izomeri. Optički aktivni izomeri sadrže asimetrični atom ugljika (kiralni) - to je atom koji sadrži četiri različita supstituenta. Drugi važan uslov je odsustvo svih vrsta simetrije (os, ravan). To uključuje mnoge hidroksi i aminokiseline
Istraživanja su pokazala da se takvi spojevi razlikuju po redoslijedu supstituenata na atomima ugljika u sp 3 hibridizaciji.
P  Najjednostavniji spoj je mliječna kiselina (2-hidroksipropanoična kiselina)
Najjednostavniji spoj je mliječna kiselina (2-hidroksipropanoična kiselina)
Stereoizomeri čije su molekule povezane jedna s drugom kao objekt i nekompatibilna zrcalna slika ili kao lijeva i desna ruka nazivaju se enantiomeri(optički izomeri, zrcalni izomeri, antipodi i fenomen se zove enantiomerizam. Sve hemijske i fizička svojstva enantiomeri su isti, osim dva: rotacija ravni polarizirane svjetlosti (u polarimetarskom uređaju) i biološka aktivnost.
Apsolutna konfiguracija molekula određena je složenim fizičko-hemijskim metodama.
Relativna konfiguracija optički aktivnih jedinjenja određena je poređenjem sa standardom gliceraldehida. Optički aktivne tvari koje imaju konfiguraciju desnorotatornog ili levorotatornog gliceraldehida (M. Rozanov, 1906) nazivaju se tvarima D- i L-serije. Jednaka mješavina desno- i levorotirajućih izomera jednog spoja naziva se racemat i optički je neaktivna.
Istraživanja su pokazala da se znak rotacije svjetlosti ne može povezati s pripadanjem tvari D- i L-seriji on se utvrđuje samo eksperimentalno u instrumentima - polarimetrima. Na primjer, L-mliječna kiselina ima ugao rotacije od +3,8 o, D-mliječna kiselina - -3,8 o.
Enantiomeri su prikazani korištenjem Fischerovih formula.
- Ugljični lanac je predstavljen vertikalnom linijom.
- Viša funkcionalna grupa se nalazi na vrhu, a mlađa funkcionalna grupa na dnu.
- Asimetrični atom ugljika predstavljen je vodoravnom linijom na čijim se krajevima nalaze supstituenti.
- Broj izomera je određen formulom 2 n, n je broj asimetričnih atoma ugljika.

 L-red D-red
L-red D-red
Među enantiomerima mogu postojati simetrične molekule koje nemaju optičku aktivnost, a nazivaju se mezoizomeri.
 Na primjer: Vinska kuća Na primjer: Vinska kuća |

| D – (+) – red L – (–) – red | Mezovinnaya k-ta |
Racemat – sok od grožđa
Optički izomeri koji nisu zrcalni izomeri, koji se razlikuju po konfiguraciji nekoliko, ali ne svih asimetričnih C atoma, koji imaju različita fizička i hemijska svojstva, nazivaju se s- di-A-stereoizomeri.
p-dijastereomeri (geometrijski izomeri) su stereomeri koji imaju p-vezu u molekulu. Nalaze se u alkenima, nezasićenim jedinjenjima višeg ugljika, nezasićenim dikarbonskim jedinjenjima. Na primjer:

Cis-buten-2 Trans-buten-2
Biološka aktivnost organskih supstanci je povezana sa njihovom strukturom. Na primjer:

cis-butendiična kiselina, trans-butendiična kiselina,
maleinska kiselina - fumarna kiselina - netoksična,
vrlo otrovan u tijelu
Sva prirodna nezasićena jedinjenja višeg ugljenika su cis-izomeri.
Koncept konjugiranih sistema. Koncept aromatičnosti organskih molekula. Hückelovo pravilo. Aromatičnost benzenoidnih (benzen i naftalen) i heterocikličnih (furan, tiofen, pirol, pirazol, imidazol, piridin, pirimidin, purin) jedinjenja.
Teorija hemijske strukture A.M. Butlerov. Elektronska struktura atoma ugljika i vrste hibridizacije.
Godine 1861. A.M. Butlerov je predložio teoriju hemijske strukture organskih jedinjenja, koja se sastoji od sledećih osnovnih principa.
1. U molekulima supstanci postoji strogi slijed hemijskog vezivanja atoma, koji se naziva hemijska struktura.
2. Hemijska svojstva supstance su određene prirodom njihovih elementarnih komponenti, njihovom količinom i hemijskom strukturom.
3. Ako supstance istog sastava i molekulske mase imaju različite strukture, onda se javlja fenomen izomerizma.
4. Budući da se u specifičnim reakcijama mijenjaju samo neki dijelovi molekula, proučavanje strukture proizvoda pomaže u određivanju strukture originalnog molekula.
5. Hemijska priroda (reaktivnost) pojedinih atoma u molekulu se mijenja u zavisnosti od okoline, tj. ovisno o tome s kojim su atomima drugih elemenata povezani.
Atom ugljika u pobuđenom stanju sadrži četiri nesparena elektrona na svom vanjskom energetskom nivou i sposoban je da formira četiri kovalentne veze.
Hibridne orbitale učestvuju u formiranju veza.
Prvo valentno stanje je sp3 hibridizacija. Kao rezultat hibridizacije uz učešće jedne s i tri p orbitale atoma ugljika, formiraju se četiri ekvivalentne sp3-hibridne orbitale, usmjerene na vrhove tetraedra pod uglovima od 109,5°:
U stanju sp3 hibridizacije, atom ugljika formira četiri s-veze sa četiri supstituenta i ima tetraedarsku konfiguraciju sa uglovima veze jednakim ili blizu 109,5°. (npr. metan)
Drugo valentno stanje je sp2 hibridizacija. Kao rezultat hibridizacije uz učešće jedne s- i dvije p-orbitale atoma ugljika, formiraju se tri ekvivalentne sp2-hibridne orbitale, koje leže u istoj ravni pod uglovima od 120°, a p-orbitala ne učestvuje u hibridizacija se nalazi okomito na ravan hibridnih orbitala.
U stanju sp2-hibridizacije, atom ugljika formira tri s-veze zbog hibridnih orbitala i jednu p-vezu zbog p-orbitale koja nije uključena u hibridizaciju i ima tri supstituenta. (npr. etilen)
Treće valentno stanje ugljika je sp-hibridizacija. Kao rezultat hibridizacije uz učešće jedne s- i jedne p-orbitale, formiraju se dvije ekvivalentne sp-hibridne orbitale, koje leže pod uglom od 1800, a p-orbitale koje ne učestvuju u hibridizaciji nalaze se okomito na ravan hibridne orbitale i jedna na drugu. U stanju sp-hibridizacije, atom ugljika formira dvije s-veze zbog hibridnih orbitala i dvije p-veze zbog p-orbitala koje ne učestvuju u hibridizaciji i ima dva supstituenta. (npr. acetilen)
Koncept konfiguracije molekula. Optički ili zrcalni izomerizam. Elementi simetrije molekula (os, ravan, centar). Asimetrični atom ugljika kao centar kiralnosti. Optička aktivnost i specifična rotacija tvari.



Molekuli sa jednim centrom kiralnosti (enantiomerizam). Gliceraldehid kao konfiguracijski standard. Formule Fischerove projekcije. Relativna i apsolutna konfiguracija. D-, L- i R-, S-sistemi. Koncept racemata.
Enantiomeri su stereoizomeri koji su međusobno povezani, poput objekta i nekompatibilne zrcalne slike.
Samo kiralni molekuli mogu postojati kao enantiomeri.
Kiralnost je svojstvo objekta da bude nekompatibilan sa svojim zrcalnu sliku. Kiralni (od grčkog cheir - ruka), ili asimetrični predmeti su leva i desna ruka, kao i rukavice, čizme itd. Ovi upareni predmeti predstavljaju predmet i njegovu sliku u ogledalu (slika 7.1, a). Takvi predmeti se ne mogu u potpunosti kombinirati jedni s drugima.
Istovremeno, oko nas postoji mnogo objekata koji su kompatibilni sa svojom zrcalnom slikom, tj. akiralni su (simetrični), na primjer tanjiri, kašike, čaše itd. Akiralni objekti imaju barem jednu ravan simetrije, koja dijeli objekat na dva ogledalu identična dela (vidi sliku 7.1, b).
Slični odnosi se primjećuju i u svijetu molekula, odnosno molekuli se dijele na kiralne i ahiralne. Akiralne molekule imaju ravni simetrije, a kiralne molekule nemaju.
Kiralni molekuli imaju jedan ili više centara kiralnosti. U organskim jedinjenjima centar kiralnosti najčešće djeluje kao asimetrični atom ugljika.
Asimetrični atom ugljika je onaj koji je vezan za četiri različita atoma ili grupe.
Kada se prikazuje stereohemijska formula molekula, simbol "C" za asimetrični atom ugljenika se obično izostavlja.

Da biste prikazali konfiguracijske izomere na ravni, možete koristiti stereokemijske formule. Međutim, zgodnije je koristiti jednostavnije za pisanje Formule Fischerove projekcije(jednostavnije - Fischerove projekcije).
Tetraedarski model jednog od enantiomera pozicioniran je u prostoru tako da je lanac atoma ugljika u vertikalnom položaju, a karboksilna grupa na vrhu. Veze sa neugljeničnim supstituentima (H i OH) u hiralnom centru treba da budu usmerene ka posmatraču. Nakon toga, model se projektuje na ravan. Simbol asimetričnog atoma je izostavljen kao tačka preseka vertikalnih i horizontalnih linija.
Tetraedarski model kiralne molekule može se pozicionirati u prostoru na različite načine prije projekcije. Potrebno je samo da veze koje formiraju horizontalnu liniju na projekciji budu usmjerene prema posmatraču, a vertikalne veze - izvan ravnine crteža.
U formuli za projekciju, dozvoljeno je zamijeniti mjesta bilo koja dva supstituenta u istom kiralnom centru paran broj puta (dovoljne su dvije permutacije);
Da li je moguće rotirati formulu projekcije za 180 u ravni crteža? (što je ekvivalentno dvije permutacije), ali ne za 90?.
Iza standard konfiguracije uzet je gliceraldehid. Njegov levorotirajući enantiomer je bio proizvoljno pripisuje formuli (I). Ova konfiguracija atoma ugljika označena je slovom l (od lat. laevus- lijevo). Desnorotirajući enantiomer je prema tome dobio formulu (II), a konfiguracija je označena slovom d (iz latinskog. dexter- desno).
Imajte na umu da je u standardnoj projekcijskoj formuli l-gliceraldehida OH grupa na lijevoj strani, dok je u d-gliceraldehidu desno.

Određivanje d- ili l-serije drugih strukturno povezanih optički aktivnih jedinjenja vrši se poređenjem konfiguracije njihovog asimetričnog atoma sa konfiguracijom d- ili l-gliceraldehida. Na primjer, u jednom od enantiomera mliječne kiseline (I) u projekcijskoj formuli OH grupa je lijevo, kao u l-gliceraldehidu, stoga je enantiomer (I) klasifikovan kao l-serija. Iz istih razloga, enantiomer (II) je klasifikovan kao d-serija. Dakle, iz poređenja Fisherovih projekcija utvrđujemo relativno konfiguraciju

Treba napomenuti da l-gliceraldehid ima lijevu rotaciju, a l-mliječna kiselina desnu (i ovo nije izoliran slučaj). Štaviše, ista supstanca može biti levo ili desno, u zavisnosti od uslova određivanja (različiti rastvarači, temperatura).
Znak rotacije ravni polarizovane svetlosti nije povezan sa članstvom u d- ili l-stereohemijskom nizu.
Praktično određivanje relativne konfiguracije optički aktivnih spojeva provodi se primjenom kemijskih reakcija: ili se ispitivana tvar pretvara u gliceraldehid (ili u drugu tvar s poznatom relativnom konfiguracijom), ili, obrnuto, ispitivana tvar se dobiva iz d- ili l -gliceraldehid. Naravno, tokom svih ovih reakcija konfiguracija asimetričnog atoma ugljenika ne bi trebalo da se menja.
Proizvoljno pripisivanje lijevog i desnog gliceraldehida konvencionalnim konfiguracijama bio je iznuđen korak. U to vrijeme nije bila poznata apsolutna konfiguracija nijednog kiralnog spoja. Uspostavljanje apsolutne konfiguracije postalo je moguće samo zahvaljujući razvoju fizičko-hemijskih metoda, posebno analize rendgenske difrakcije, uz pomoć kojih je 1951. godine prvi put utvrđena apsolutna konfiguracija kiralne molekule - to je bila sol (+) -vinska kiselina. Nakon ovoga, postalo je jasno da je apsolutna konfiguracija d- i l-gliceraldehida zaista ono što im je prvobitno bilo pripisano.
D,l-sistem se trenutno koristi za α-amino kiseline, hidroksi kiseline i (uz neke dodatke) za ugljikohidrate
Sistem označavanja R,S-konfiguracije. D,L-sistem je vrlo ograničene upotrebe, jer je često nemoguće povezati konfiguraciju bilo kojeg spoja s gliceraldehidom. Univerzalni sistem za označavanje konfiguracije kiralnih centara je R,S-sistem (od lat. rectus- ravno, zlokobno- lijevo). Zasnovan je na pravilo niza, na osnovu senioriteta supstituenata povezanih sa centrom kiralnosti.
Starost supstituenata određena je atomskim brojem elementa koji je direktno povezan sa centrom kiralnosti - što je veći, to je supstituent stariji.
Dakle, OH grupa je starija od NH 2, koja je, zauzvrat, starija od bilo koje alkil grupe, pa čak i COOH, budući da je u potonjoj atom ugljika vezan za asimetrični centar. Ako su atomski brojevi isti, grupa čiji atom pored ugljika ima veći atomski broj smatra se starijim, a ako je ovaj atom (obično kisik) povezan dvostrukom vezom, broji se dvaput. Kao rezultat, sljedeće grupe su raspoređene u opadajućem redoslijedu prioriteta: -COOH > -CH=O > -CH2OH.
Da bi se odredila konfiguracija, tetraedarski model jedinjenja postavlja se u prostor tako da je najniži supstituent (u većini slučajeva to je atom vodonika) najdalje od posmatrača. Ako se senioritet tri preostala supstituenta smanji u smjeru kazaljke na satu, tada se centru kiralnosti dodjeljuje R-konfiguracija (slika 7.4, a), ako je u smjeru suprotnom od kazaljke na satu -S-konfiguracija (vidi sliku 7.4, b), kako je vidi vozač za volanom (vidi sliku 7.4, V).

Rice. 7.4. Određivanje konfiguracije enantiomera mliječne kiseline po R,S- sistem (objašnjenje u tekstu)
Za označavanje konfiguracije prema RS sistemu možete koristiti Fisher projekcije. Da biste to učinili, projekcija se transformira tako da
Pitanje 9
Kiselost i bazičnost organskih jedinjenja.
Za procjenu kiselosti i bazičnosti organskih jedinjenja od najvećeg su značaja dvije teorije – Brønstedova i Luisova teorija.
Prema Lewisovoj teoriji, kisela i bazična svojstva jedinjenja određena su njihovom sposobnošću da prihvate ili doniraju par elektrona za formiranje veze. Prema Lewisovom principu, kiseline i baze se dijele na tvrde i meke.
Lewisove kiseline mogu biti atomi, molekuli ili kationi koji imaju praznu orbitalu i sposobne su prihvatiti par elektrona kako bi formirale kovalentnu vezu.
Lewisove kiseline su akceptori elektronskih parova; Lewisove baze su donori elektronskih parova. Lewisove baze (atom, molekula ili anion) moraju imati najmanje jedan par valentnih elektrona koje mogu pružiti partneru da formira kovalentnu vezu. Sve Lewisove baze su nukleofilni reagensi.
Prema Bronstedovoj teoriji (protolitička teorija), kiselost i bazičnost jedinjenja povezana je s prijenosom H+ protona. Kiselina i baza formiraju konjugirani kiselinsko-bazni par, u kojem što je kiselina jača, to je njena konjugirana baza slabija, i obrnuto, što je baza jača, to je njena konjugirana kiselina slabija.
Bronstedove kiseline (protinske kiseline) su neutralne molekule ili joni sposobni da doniraju proton (donori protona).
Bronstedove baze su neutralne molekule ili ioni koji mogu prihvatiti proton (akceptori protona).
Kiselost i bazičnost nisu apsolutna, već relativna svojstva jedinjenja: kisela svojstva se otkrivaju samo u prisustvu baze; osnovna svojstva - samo u prisustvu kiseline. Voda se obično koristi kao otapalo kada se proučava kiselinsko-bazna ravnoteža.
U zavisnosti od prirode elementa sa kojim je proton povezan, razlikuju se OH kiseline (karboksilne kiseline, fenoli, alkoholi), SH kiseline (tioli), NH kiseline (amini, amidi, imidi), CH kiseline (ugljovodonici i njihovi derivati ). Element i s njim povezani atom vodika nazivaju se kiselinsko mjesto. U svim slučajevima postoji pomak u gustini elektrona od atoma vodika ka elektronegativnijem atomu, proton je manje-više lako odvojiti. Što je veća elektronegativnost elementa za koji je vezan proton, to je spoj kiseliji (dakle, karboksilne kiseline su jače kiseline od tiola ili amina).
Prisustvo grupa koje povlače elektrone u molekulu, koje imaju negativne elektronske efekte, povećavaju pozitivni naboj na protonu, što dovodi do povećanih kiselinskih svojstava.
Da bi se formirala kovalentna veza sa protonom, Brønstedove baze moraju da obezbede ili usamljeni par elektrona ili p-vezujuće elektrone. U skladu s tim, Bronstedove fondacije se dijele na P-baza i p-baza.
n-baze mogu biti neutralne ili negativno nabijene. Po pravilu, anioni imaju jače bazični karakter od neutralnih supstanci. To jest, amidni jon NH 2 - ili hidroksidni jon HO - je superiorniji u bazičnosti od amonijaka NH 3 i vode H 2 O.
U p-bazama, koje uključuju alkene, alkadiene, arene, centar bazičnosti, tj. Mjesto vezivanja protona su elektroni p-veze. Ovo su vrlo slabe baze jer protonirani elektronski parovi nisu slobodni.
Prisustvo supstituenata koji doniraju elektrone povećava bazičnost organskih jedinjenja.
1. Zavisnost kiselosti od heteroatoma.
Priroda heteroatoma se razumije kao njegova elektronegativnost (E.O.) i polarizabilnost. Što je veći (E.O.), lakše dolazi do heterolitičkog cijepanja u molekulu. U periodima s lijeva na desno, kako se naboj jezgra povećava, (E.O) raste, tj. sposobnost elemenata da drže negativan naboj. Kao rezultat pomaka u gustini elektrona, veza između atoma je polarizirana. Što je više elektrona i što je veći radijus atoma, što su elektroni vanjskog energetskog nivoa udaljeniji od jezgra, veća je polarizabilnost i veća kiselost.
Primjer: CH- NH- OH- SH-
povećanje E.O. i kiselosti
C, N, O su elementi istog perioda. E.O. raste tokom perioda, povećava se kiselost. U ovom slučaju polarizacija neće uticati na kiselost.
Polarizabilnost atoma u periodu se neznatno mijenja, pa je glavni faktor koji određuje kiselost E.O.
Sada razmislite o OH-SH-
povećana kiselost
O, S - su u istoj grupi, radijus u grupi se povećava od vrha do dna, stoga se povećava i polarizabilnost atoma, što dovodi do povećanja kiselosti. S ima veći atomski radijus od O, tako da tioli pokazuju jače kisele osobine u odnosu na alkohole.
2. Utjecaj ugljikovodičnih radikala i supstituenata prisutnih u njemu
Supstituenti koji povlače elektrone (E.A.). doprinose delokalizaciji elektronske gustine, što dovodi do stabilnosti anjona i, shodno tome, povećanja kiselosti.
Supstituenti koji doniraju elektrone (ED). naprotiv, doprinose koncentraciji elektronske gustine u kiselinskom centru, što dovodi do smanjenja kiselosti i povećanja bazičnosti.
Efekat rastvarača.
Interakcija molekula ili jona otopljene tvari s otapalom naziva se proces rješenje. Stabilnost anjona značajno ovisi o njegovoj solvataciji u otopini: što je ion više solvatiran, to je stabilniji, a što je solvatacija veća, to je manja veličina jona i manja je delokalizacija negativnog naboja u njemu.
Svojstva kiselina
1. C aktivni metali:
HO-CH 2 -CH 2 -OH + 2Na → H 2 + NaO-CH 2 -CH 2 -ONa (natrijum glikolat)
2. Sa bakar(II) hidroksidom – visokokvalitetna reakcija!

Kvalitativna reakcija na dihidrične i polihidrične alkohole (diolni fragment) je reakcija sa Cu(OH)2 u alkalnom mediju, koja rezultira stvaranjem kompleksnog spoja bakar glikolata u otopini koja daje plavu boju.
Pojednostavljeni dijagram

Osnovna svojstva
1. Sa halogenovodonična kiselina
HO-CH 2 -CH 2 -OH + 2HCl H+↔ Cl-CH 2 -CH 2 -Cl + 2H 2 O
Sa azotnom kiselinom

Trinitroglicerin - osnova dinamita
Etilen glikol otrovan - jak otrov! Depresira centralni nervni sistem i utiče na bubrege.
Glicerin (propantriol-1,2,3)– nije otrovno. Bez mirisa. Dobro se meša sa vodom. Rasprostranjeno u divljim životinjama. Ima važnu ulogu u metaboličkim procesima, jer je dio masti (lipida) životinjskih i biljnih tkiva. Koristi se kao komponenta masti za omekšavanje kože.
Polihidrični ciklički alkohol inozitol pripada vitaminima sličnim spojevima (vitamini B) i strukturna je komponenta kompleksnih lipida - fosfatidilinozitola.
Za dobijanje se koristi etilendiamin etilendiamintetrasirćetna kiselina interakcija sa hloroctene kiseline. Njegove soli sa masne kiseline koriste se kao omekšivači u proizvodnji tekstil. U proizvodnji se koristi i etilendiamin boje,emulgatori, stabilizatori lateksi, plastifikatori I fungicidi. Etilendiamin toksično; maksimalno dozvoljena koncentracija njegov isparenja u vazduhu je 0,001 mg/l.
Od poliamina najpoznatiji je tetrametilendiamin, tj putrescine H2N(CH2)4NH2, i pentametilendiamin, ili cadaverine H2N(CH2)5NH2. Dugo su se smatrali kadaverskim otrovima, tj. tvari koje nastaju tijekom dekarboksilacije diaminokiselina i uzrokuju toksičnost trulih proteina.
12. Fenoli Opće karakteristike.

Elektronska struktura karbonilne grupe. Reakcije nukleofilne adicije AN na karbonilnoj grupi. Reakcije dodavanja vode, cijanovodonične kiseline, alkohola, natrijum bisulfita. Mehanizam aldolne kondenzacije i Cannizzaro reakcija.

Struktura karbonilne grupe C=O.
· Svojstva aldehida i ketona određena su strukturom karbonilne grupe >C=O.
C=O veza je visoko polarna. Njegov dipolni moment je znatno veći od onog kod C–O veze u alkoholima. Elektroni višestruke veze C=O, posebno pokretljiviji p-elektroni, pomeraju se prema elektronegativnom atomu kiseonika, što dovodi do pojave delimičnog negativnog naboja na njemu. Karbonil ugljenik dobija delimičan pozitivan naboj.
· Dakle, ugljenik je napadnut od strane nukleofilnih reagensa, a kiseonik od elektrofilnih reagensa, uključujući H+.
Molekulima aldehida i ketona nedostaju atomi vodika koji bi mogli formirati vodikove veze. Zbog toga su njihove tačke ključanja niže od onih kod odgovarajućih alkohola. Metanal (formaldehid) je gas, aldehidi C 2 -C 5 i ketoni C 3 -C 4 su tečnosti, više supstance su čvrste materije. Niži homolozi su topljivi u vodi zbog stvaranja vodikovih veza između atoma vodika molekula vode i karbonilnih atoma kisika. Kako se ugljikovodični radikal povećava, topljivost u vodi se smanjuje.
Nukleofilna adicija
Za aldehide i ketone najtipičnije su reakcije nukleofilne adicije A N.
opći opis mehanizam nukleofilne adicije A N
Lakoća nukleofilnog napada na atom ugljika karbonilne grupe aldehida ili ketona ovisi o veličini parcijalnog
pozitivan naboj na atomu ugljika, njegovu prostornu dostupnost i kiselo-bazna svojstva okoline.

Uzimajući u obzir elektronske efekte grupa povezanih s karbonilnim atomom ugljika, vrijednost parcijalnog pozitivnog naboja δ+ na njemu u aldehidima i ketonima opada sljedećim redoslijedom:

Prostorna dostupnost karbonilnog atoma ugljika smanjuje se kada se vodonik zamijeni glomaznijim organskim radikalima, tako da su aldehidi reaktivniji od ketona.

Opća shema reakcija nukleofilne adicije A N na karbonilnu grupu uključuje nukleofilni napad na karbonil atom ugljika, nakon čega slijedi dodavanje elektrofila atomu kisika.
U kiseloj sredini, aktivnost karbonilne grupe općenito se povećava jer protoniranje atoma kisika stvara pozitivan naboj na atomu ugljika. Kiselinska kataliza se obično koristi kada napadački nukleofil ima nisku aktivnost.
Prema gore navedenom mehanizmu, odvija se niz važnih reakcija aldehida i ketona.

Dodatak alkohola. Alkoholi se lako formiraju u interakciji s aldehidima hemiacetali. Hemiacetali obično nisu izolirani zbog svoje nestabilnosti. Kada postoji višak alkohola u kiseloj sredini, hemiacetali se pretvaraju u acetali.

Upotreba kiselog katalizatora u konverziji hemiacetala u acetal je jasna iz reakcionog mehanizma datog u nastavku. Centralno mjesto u njemu zauzima formiranje karbokatjona (I), stabiliziranog zbog sudjelovanja usamljenog para elektrona susjednog atoma kisika (+M-efekat C 2 H 5 O grupe).

Reakcije formiranja hemiacetala i acetala su reverzibilne, tako da se acetali i hemiacetali lako hidroliziraju viškom vode u kiseloj sredini. Hemiacetali su stabilni u alkalnom okruženju, budući da je alkoksidion teže odlazeća grupa od hidroksidnog jona.
Priključak vode. Dodatak vode karbonilnoj grupi - hidratacija- reverzibilna reakcija. Stepen hidratacije aldehida ili ketona u vodenom rastvoru zavisi od strukture supstrata.

Triklorocteni aldehid (kloral) je potpuno hidriran. Trihlorometil grupa koja povlači elektrone toliko stabilizuje hloralhidrat da ova kristalna supstanca odvaja vodu samo tokom destilacije u prisustvu dehidrirajućih supstanci - sumporne kiseline itd.

Dodatak amina i njihovih derivata. Amini i druga jedinjenja koja sadrže azot opšte formule NH2X (X = R, NHR) reaguju sa aldehidima i ketonima u dva stupnja. Prvo se formiraju nukleofilni adicijski produkti, koji zatim, zbog nestabilnosti, eliminiraju vodu. U tom smislu, ovaj proces se generalno klasifikuje kao reakcija vezanost-eliminacija.

U slučaju primarnih amina, supstituirani imines(takođe se zovu Šifove baze).
Imini su intermedijarni proizvodi mnogih enzimskih procesa. Proizvodnja imina prolazi kroz fazu stvaranja amino alkohola, koji su relativno stabilni, na primjer, kada formaldehid reaguje sa α-amino kiselinama (vidjeti 12.1.4).
Imini su intermedijarni proizvodi u proizvodnji amina iz aldehida i ketona reduktivna aminacija. Ovo opšta metoda sastoji se od redukcije mješavine karbonilnog spoja s amonijakom (ili aminom). Proces se odvija prema shemi adicija-eliminacija s formiranjem imina, koji se zatim reducira u amin.
Kada aldehidi i ketoni reagiraju s derivatima hidrazina, oni proizvode hidrazoni. Ova reakcija se može koristiti za izolaciju aldehida i ketona iz mješavina i njihovu hromatografsku identifikaciju.


Šifove baze i druga slična jedinjenja lako se hidroliziraju vodenim rastvorima mineralnih kiselina da bi se formirali početni proizvodi.
Formiranje bisulfitnih jedinjenja Dodavanjem molekule kiselog natrijevog sulfida (bisulfita) dobijaju se takozvana bisulfitna jedinjenja, pri čemu se kisiku karbonilne grupe dodaje vodik, a atomu ugljika SO 2 ONa ostatak:
U bisulfitnim jedinjenjima, atom sumpora je direktno vezan za ugljik.

CANIZZARO REACTION, oksidacija-redukcija disproporcija aldehida pod uticajem alkalija sa stvaranjem primarnih alkohola i ugljenih kiselina, na primer:

Cannizzarov predloženi mehanizam za homogenu reakciju. okruženje uključuje fazu prijenosa hidrida 
Za aromatične aldehida, ne može se isključiti mogućnost učešća u Cannizzarovoj reakciji anjona radikala nastalih kao rezultat prijenosa jednog elektrona. Reakcija slična Cannizzaro reakciji javlja se s intramolom. disproporcija a-ketoaldehida u prisustvu. alkalije (Cannizzaro prearanžiranje): 
deaminacija,
Intramolekularna deaminacija
R-CH 2 – CH(NH 2) - COOH→ R- CH=CH-COOH + NH 3
α,β – nezasićena kiselina
Hidrolitička deaminacija
R-CH(NH 2) – COOH +H 2 O → R – CH(OH) – COOH + NH 3
α - hidroksi kiselina
Oksidativna deaminacija
R-CH(NH 2) – COOH +1/2 O 2 → R –C(O) – COOH + NH 3
α-keto kiselina
Formiranje kompleksa sa metalima.α-Aminokiseline formiraju intrakompleksne soli sa katjonima teških metala. Sa svježe pripremljenim bakar(II) hidroksidom, sve α-amino kiseline pod blagim uvjetima daju dobro kristalizirajuće intrakompleksne (kelatne) plave bakrene(II) soli:

U takvim solima, ion bakra je povezan koordinacijskim vezama s amino grupama.
Formiranje peptidne veze.
Intermolekularna interakcija α-amino kiselina dovodi do stvaranja peptida. Kada dvije α-amino kiseline interaguju, nastaje dipeptid.

Intermolekularna interakcija tri α-aminokiseline dovodi do stvaranja tripeptida itd.

Fragmenti molekula aminokiselina koji formiraju peptidni lanac nazivaju se aminokiselinskim ostacima, a CO-NH veza se naziva peptidnu vezu.
22. Dekarboksilacija α-amino kiselina – stvaranje biogenih amina i bioregulatora (histamin, triptamin).
Neke aminokiseline i njihovi derivati mogu biti podvrgnuti dekarboksilaciji - uklanjanju oc-karboksilne grupe. U tkivima sisara može doći do dekarboksilacije većeg broja aminokiselina ili njihovih derivata: Tri, Tyr, Val, Gis, Glu, Cis, Apr itd. Reakcioni produkti su CO 2 i amini koji imaju izražen biološki efekat na organizam. (biogeni amini):

Reakcije dekarboksilacije su ireverzibilne i kataliziraju ih enzimi dekarboksilaze. Protetička grupa dekarboksilaza u životinjskim ćelijama je piridoksal fosfat.
Amini nastali dekarboksilacijom aminokiselina su često biološki aktivne tvari. Djeluju kao neurotransmiteri (serotonin, dopamin, GABA, itd.), hormoni (noradrenalin, adrenalin) i lokalni regulatorni faktori (histamin, karnozin, spermin itd.).
Histamin nastaje dekarboksilacijom aminokiseline histidina. Sintetiše se u mastocitima, akumulira se u sekretornim granulama i oslobađa se kada su ćelije iritirane.

Histamin ima različita biološka dejstva: izaziva vazodilataciju, snižava krvni pritisak, povećava propusnost tkiva, izaziva lokalni edem, stimuliše sekreciju želuca i ima bronhospatsko dejstvo. U visokim koncentracijama je posrednik upalnih i alergijskih reakcija.
Serotonin nastaje dekarboksilacijom hidroksitriptofana. Sintetizira se u kromafinskim stanicama, u nekim jezgrama subkortikalnih struktura i trombocitima.

Dejstvo serotonina: izaziva vazospazam, povišen krvni pritisak, stimuliše pokretljivost creva, učestvuje u termoregulaciji, mehanizmima spavanja, izvor je za sintezu hormona melatonina, utiče na mentalne reakcije čoveka. Dakle, kod shizofrenije dolazi do poremećaja u metabolizmu serotonina.
Kateholamini (dopamin, adrenalin, norepinefrin) se sintetiziraju iz aminokiseline tirozin.
Dopamin je ekscitatorni neurotransmiter kada mu nedostaje, razvija se Parkinsonova bolest (adinamija, ukočenost, tremor). Adrenalin izaziva vazospazam, povećava krvni pritisak, stimuliše rad srca i hormon je.
Norepinefrin prvenstveno obavlja funkcije neurotransmitera.
Poliamini (spermin, spermidin) se sintetiziraju iz ornitina i metionina, dio su hromatina i uključeni su u regulaciju procesa translacije, transkripcije i replikacije.
Budući da su biogeni amini vrlo aktivni, brzo se inaktiviraju u tkivima. Razgradnja biogenih amina provodi se na nekoliko načina: oksidacija, metilacija, deaminacija. Glavni metod inaktivacije biogenih amina je oksidativno deaminiranje pod uticajem enzima amin oksidaza (monoaminooksidaze, poliamin oksidaze).
![]()
Aminokiseline mogu biti kovalentno povezane jedna s drugom pomoću peptidnih veza. Karboksilna grupa jedne aminokiseline kovalentno je vezana za amino grupu druge aminokiseline. Ovo stvara vezu R-CO-NH-R, nazvanu peptidna veza. U ovom slučaju, molekul vode se odvaja.
O- i N-glukozidi. Hidroliza glukozida. Fosfati monosaharida. Acilacija amino šećera. Oksidacija monosaharida. Priprema glukoznih osazona. Restorativna svojstva al-doze. Ksilitol, sorbitol. Askorbinska kiselina.
Glikozidi su derivati cikličkih oblika ugljikohidrata u kojima je hemiacetalna hidroksilna grupa zamijenjena OR grupom.
Neugljikohidratna komponenta – aglikon. Veza između anomernog centra i –OR grupe je glikozidna.
Furanozidi se dijele na piranozide.
Glikozidi glukoze nazivaju se glukozidi, ribozni glikozidi se nazivaju ribozidima, itd.
GLIKOZIDI
s a x a r aglikona
(obično monosaharid) (alkohol, aromatična jedinjenja, steroidi, itd.)
Glikozid sinigrin; hidroliza:
Vanilin glikozid; hidroliza:
Fosfati su monosaharidi.
Velika važnost imaju estre fosforne kiseline - fosfate. Nalaze se u svim biljnim i životinjskim organizmima i metabolički su aktivni oblici monosaharida. Najvažniju ulogu imaju D-glukoza i D-fruktoza fosfati.
Oksidacija glukoze u neutralnom, blago kiselom okruženju:

Oksidacija jakim oksidantom:

Oksidacija glukoze u alkalnoj sredini.
Tollensov okrug:
To je γ-laktonska kiselina.
Sadrži u voću, posebno citrusima, bobičastom voću (šipak, crna ribizla), povrću, mleku.
Pokazuje jaka kisela svojstva
zbog jedne od hidroksilnih grupa endiolnog fragmenta.
Kada se formiraju soli, γ-laktonski prsten se ne otvara.
Ima jaka regenerativna svojstva. Dehidroaskorbinska kiselina nastala prilikom njene oksidacije lako se redukuje u askorbinsku kiselinu. Ovaj proces osigurava niz redoks reakcija u tijelu.

Organska hemija je hemija atoma ugljenika. Broj organskih jedinjenja je desetine puta veći od neorganskih, što se samo može objasniti karakteristike atoma ugljika :
a) on je unutra sredina skale elektronegativnosti i drugi period, stoga mu je neisplativo davati svoje i prihvatati tuđe elektrone i steći pozitivan ili negativan naboj;
b) posebna struktura elektronske ljuske – nema elektronskih parova i slobodnih orbitala (postoji još samo jedan atom slične strukture – vodonik, zbog čega ugljik i vodonik vjerovatno formiraju toliko jedinjenja – ugljovodonika).
Elektronska struktura atoma ugljika
C – 1s 2 2s 2 2p 2 ili 1s 2 2s 2 2p x 1 2p y 1 2p z 0
U grafičkom obliku:
Atom ugljika u pobuđenom stanju ima sljedeću elektronsku formulu:
*C – 1s 2 2s 1 2p 3 ili 1s 2 2s 1 2p x 1 2p y 1 2p z 1
U obliku ćelija: 
Oblik s- i p-orbitala


Atomska orbitala - područje prostora u kojem će se najvjerovatnije naći elektron, sa odgovarajućim kvantnim brojevima.
To je trodimenzionalna "karta konture" elektrona u kojoj valna funkcija određuje relativnu vjerovatnoću pronalaska elektrona u toj određenoj tački orbite.
Relativna veličina atomskih orbitala raste kako se povećava njihova energija ( glavni kvantni broj- n), a njihov oblik i orijentaciju u prostoru određuju kvantni brojevi l i m. Elektrone u orbitalama karakteriše spin kvantni broj. Svaka orbitala ne može sadržavati više od 2 elektrona sa suprotnim spinovima.
Prilikom formiranja veza s drugim atomima, atom ugljika transformiše svoju elektronsku ljusku tako da se formiraju najjače veze, a samim tim se oslobađa što više energije, a sistem dobija najveću stabilnost.
Za promjenu elektronske ljuske atoma potrebna je energija, koja se zatim kompenzira stvaranjem jačih veza.
Transformacija elektronske ljuske (hibridizacija) može biti uglavnom od 3 vrste, ovisno o broju atoma s kojima atom ugljika stvara veze.
Vrste hibridizacije:
sp 3 – atom stvara veze sa 4 susjedna atoma (tetraedarska hibridizacija):
Elektronska formula sp 3 – hibridnog atoma ugljika:
*S –1s 2 2(sp 3) 4 u obliku ćelija 

Ugao veze između hibridnih orbitala je ~109°.
Stereohemijska formula atoma ugljika:

sp 2 – Hibridizacija (valentno stanje)– atom stvara veze sa 3 susjedna atoma (trigonalna hibridizacija):
Elektronska formula sp 2 – hibridnog atoma ugljika:
*S –1s 2 2(sp 2) 3 2p 1 u obliku ćelija 
Ugao veze između hibridnih orbitala je ~120°.
Stereohemijska formula sp 2 - hibridnog atoma ugljika:

sp– Hibridizacija (valentno stanje) – atom stvara veze sa 2 susjedna atoma (linearna hibridizacija):
Elektronska formula sp – hibridnog atoma ugljika:
*S –1s 2 2(sp) 2 2p 2 u obliku ćelija 
Ugao veze između hibridnih orbitala je ~180°.
Stereohemijska formula:

S-orbitala je uključena u sve vrste hibridizacije, jer ima minimalnu energiju.
Preuređenje elektronskog oblaka omogućava stvaranje najjačih mogućih veza i minimalnu interakciju atoma u nastaloj molekuli. Gde hibridne orbitale možda nisu identične, ali uglovi veze mogu biti različiti, na primjer CH 2 Cl 2 i CCl 4
2. Kovalentne veze u jedinjenjima ugljenika
Kovalentne veze, svojstva, metode i razlozi nastanka - školski program.
Samo da te podsjetim:
1. Education Communications između atoma se može smatrati kao rezultat preklapanja njihovih atomskih orbitala, a što je efikasnije (što je veći integral preklapanja), to je veza jača.
Prema izračunatim podacima, relativna efikasnost preklapanja atomskih orbitala S rel raste na sljedeći način:

Stoga, korištenje hibridnih orbitala, kao što su sp 3 ugljikove orbitale, za formiranje veza sa četiri atoma vodika rezultira jačim vezama.
2. Kovalentne veze u jedinjenjima ugljenika formiraju se na dva načina:
A)Ako se dvije atomske orbitale preklapaju duž svojih glavnih osa, rezultirajuća veza se naziva - σ bond.
Geometrija. Dakle, kada se formiraju veze sa atomima vodika u metanu, četiri hibridne sp 3 ~ orbitale atoma ugljika se preklapaju sa s-orbitalama četiri atoma vodika, formirajući četiri identične jake σ veze smještene pod uglom od 109°28" prema svakoj drugo (standardni tetraedarski ugao) Slična striktno simetrična tetraedarska struktura takođe nastaje, na primer, tokom formiranja CCl 4 ako atomi koji formiraju veze sa ugljenikom nisu isti, na primer u slučaju CH 2 C1 2, prostorna; struktura će se malo razlikovati od potpuno simetrične, iako u suštini ostaje tetraedarska.
σ dužina veze između atoma ugljika ovisi o hibridizaciji atoma i smanjuje se tokom prijelaza sa sp 3 - hibridizacije na sp. Ovo se objašnjava činjenicom da je s orbitala bliža jezgru nego p orbitala, dakle, što je veći njen udio u hibridnoj orbitali, to je kraća, a samim tim i kraća nastala veza.
B) Ako su dva atomska str -orbitale koje se nalaze paralelno jedna s drugom vrše bočno preklapanje iznad i ispod ravnine u kojoj se atomi nalaze, tada se nastala veza naziva - π (pi) -komunikacija


Bočno preklapanje atomske orbitale su manje efikasne od preklapanja duž glavne ose, tako da π - veze su manje jake od σ - veze. To se posebno očituje u činjenici da je energija dvostruke veze ugljik-ugljik manja od dvostruke energije jednostruke veze. Tako je energija C-C veze u etanu 347 kJ/mol, dok je energija veze C = C u etenu samo 598 kJ/mol, a ne ~700 kJ/mol.
Stepen bočnog preklapanja dvije atomske 2p orbitale , a samim tim i snage π -veze su maksimalne ako postoje dva atoma ugljika i četiri vezana za njih atomi se nalaze striktno u jednoj ravni, odnosno ako oni komplanarno , jer su samo u ovom slučaju atomske 2p orbitale tačno paralelne jedna s drugom i stoga su sposobne za maksimalno preklapanje. Svako odstupanje od komplanarnog stanja zbog rotacije okolo σ -veza koja povezuje dva atoma ugljika dovest će do smanjenja stepena preklapanja i, shodno tome, do smanjenja čvrstoće π -veza, koja na taj način pomaže u održavanju ravnosti molekula.
Rotacija oko dvostruke veze ugljik-ugljik nije moguće.
Distribucija π -elektroni iznad i ispod ravni molekula znače postojanje područja negativnog naboja, spreman za interakciju sa svim reagensima s nedostatkom elektrona.
Atomi kiseonika, azota itd. takođe imaju različita valentna stanja (hibridizacija), a njihovi elektronski parovi mogu biti i u hibridnim i u p-orbitalama.