يسمى توزيع الإلكترونات على AOs المختلفة التكوين الإلكتروني للذرة. التكوين الإلكتروني بأقل طاقة يتوافق مع الحالة الأساسية atom ، تشير التكوينات المتبقية إلى الدول المتحمسة.
يتم تصوير التكوين الإلكتروني للذرة بطريقتين - في شكل صيغ إلكترونية ومخططات حيود الإلكترون. عند كتابة الصيغ الإلكترونية ، يتم استخدام الأرقام الكمية الأساسية والمدارية. يُشار إلى المستوى الفرعي برقم الكم الرئيسي (رقم) ورقم الكم المداري (الحرف المقابل). يميز عدد الإلكترونات في المستوى الفرعي الحرف المرتفع. على سبيل المثال ، بالنسبة للحالة الأرضية لذرة الهيدروجين ، فإن الصيغة الإلكترونية هي: 1 س 1 .
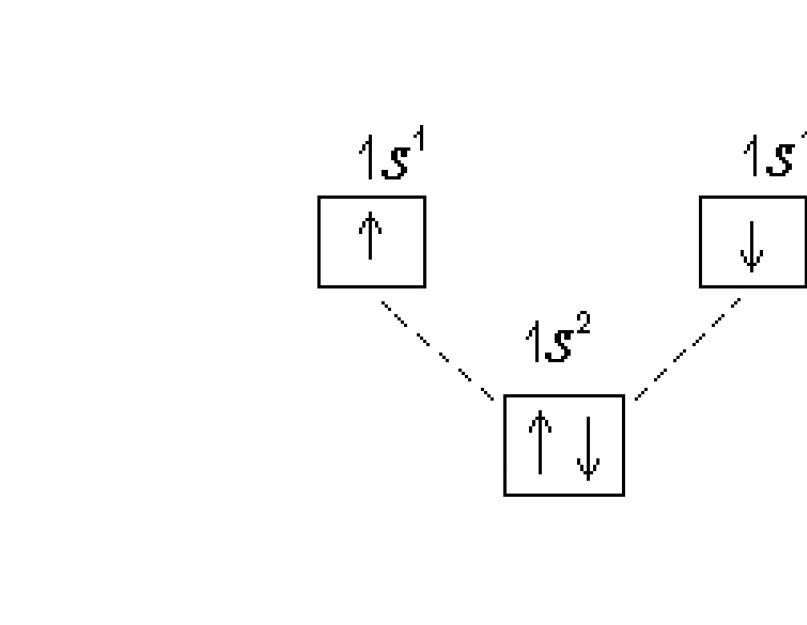
يمكن وصف بنية المستويات الإلكترونية بشكل كامل باستخدام مخططات حيود الإلكترون ، حيث يتم تمثيل التوزيع على المستويات الفرعية في شكل خلايا كمومية. في هذه الحالة ، يُصوَّر المدار تقليديًا على أنه مربع ، يتم وضع علامة المستوى الفرعي بالقرب منه. يجب تعويض المستويات الفرعية في كل مستوى قليلاً في الارتفاع ، لأن طاقتها مختلفة نوعًا ما. يتم تمثيل الإلكترونات بالسهام أو ↓ اعتمادًا على علامة رقم الكم المغزلي. مخطط حيود الإلكترون لذرة الهيدروجين:
مبدأ بناء التكوينات الإلكترونية للذرات متعددة الإلكترونات هو إضافة البروتونات والإلكترونات إلى ذرة الهيدروجين. يخضع توزيع الإلكترونات على مستويات الطاقة والمستويات الفرعية للقواعد المدروسة سابقًا: مبدأ أقل طاقة ، مبدأ باولي وقاعدة هوند.
مع الأخذ في الاعتبار بنية التكوينات الإلكترونية للذرات ، يمكن تقسيم جميع العناصر المعروفة ، وفقًا لقيمة العدد الكمي المداري للمستوى الفرعي المملوء الأخير ، إلى أربع مجموعات: س-عناصر، ص-عناصر، د-عناصر، F-عناصر.
في ذرة الهيليوم هو (Z = 2) يشغل الإلكترون الثاني 1 س-داربيتال ، صيغته الإلكترونية: 1 س 2. الرسم التخطيطي الإلكتروني:

ينهي الهيليوم أول فترة أقصر من الجدول الدوري للعناصر. يتم الإشارة إلى التكوين الإلكتروني للهيليوم.
الفترة الثانية تفتح الليثيوم Li (Z = 3) ، صيغته الإلكترونية:  الرسم التخطيطي الإلكتروني:
الرسم التخطيطي الإلكتروني:

فيما يلي مخططات مبسطة لانحراف الإلكترون لذرات العناصر التي تقع مداراتها من نفس مستوى الطاقة على نفس الارتفاع. لا يتم عرض المستويات الفرعية الداخلية المملوءة بالكامل.
يتبع الليثيوم البريليوم Be (Z = 4) ، حيث يملأ إلكترون إضافي 2 سمداري. تكون الصيغة الإلكترونية: 2 س 2

في الحالة الأرضية ، يحتل إلكترون البورون التالي B (z = 5) 2 ر-وربيتال ، الخامس: 1 س 2 2س 2 2صواحد ؛ نمط حيود الإلكترون:

العناصر الخمسة التالية لها تكوينات إلكترونية:
ج (ض = 6): 2 س 2 2ص 2N (Z = 7): 2 س 2 2ص 3

O (Z = 8): 2 س 2 2ص 4 F (Z = 9): 2 س 2 2ص 5

ني (Z = 10): 2 س 2 2ص 6

يتم تحديد التكوينات الإلكترونية المقدمة بواسطة قاعدة Hund.
تمتلئ مستويات الطاقة الأولى والثانية من النيون بالكامل. دعنا نحدد تكوينه الإلكتروني وسنستخدم المزيد لإيجاز تسجيل الصيغ الإلكترونية لذرات العناصر.
يفتح الصوديوم Na (Z = 11) و Mg (Z = 12) الفترة الثالثة. تحتل الإلكترونات الخارجية 3 سمداري:
Na (Z = 11): 3 س 1

ملغ (ض = 12): 3 س 2

ثم نبدأ بالألمنيوم (Z = 13) ، 3 ر-المستوى الفرعي. الفترة الثالثة تنتهي بـ الأرجون Ar (Z = 18):
Al (Z = 13): 3 س 2 3ص 1

Ar (Z = 18): 3 س 2 3ص 6

تختلف عناصر الفترة الثالثة عن عناصر الفترة الثانية من حيث أنها تحتوي على 3 عناصر مجانية د- المدرات التي يمكن أن تشارك في تكوين رابطة كيميائية. هذا يفسر حالات التكافؤ التي تظهرها العناصر.
في الفترة الرابعة حسب القاعدة ( ن+ل) ، في البوتاسيوم K (Z = 19) والكالسيوم Ca (Z = 20) تحتل الإلكترونات 4 س- المستوى الفرعي ، وليس 3 د. بدءًا من scandium Sc (Z = 21) وانتهاءً بالزنك Zn (Z = 30) ، 3 د- المستوى الفرعي:
الصيغ الإلكترونية د- يمكن تمثيل العناصر في شكل أيوني: يتم سرد المستويات الفرعية بترتيب تصاعدي للعدد الكمي الرئيسي ، وبثابت ن- من أجل زيادة عدد الكم المداري. على سبيل المثال ، بالنسبة إلى Zn ، سيبدو هذا الإدخال كما يلي:  كل من هذين الإدخالين متكافئان ، لكن معادلة الزنك التي تم تقديمها مسبقًا تعكس بشكل صحيح الترتيب الذي يتم به ملء المستويات الفرعية.
كل من هذين الإدخالين متكافئان ، لكن معادلة الزنك التي تم تقديمها مسبقًا تعكس بشكل صحيح الترتيب الذي يتم به ملء المستويات الفرعية.
الصف 3 د- العناصر الموجودة في الكروم Cr (Z = 24) يوجد انحراف عن القاعدة ( ن+ل). وفقًا لهذه القاعدة ، يجب أن يبدو تكوين Cr كما يلي:  تم العثور على تكوينها الحقيقي
تم العثور على تكوينها الحقيقي  في بعض الأحيان يسمى هذا التأثير "فشل" الإلكترون. يتم تفسير التأثيرات المماثلة من خلال زيادة الاستقرار بمقدار النصف ( ص
3 ,
د
5 ,
F
7) وبشكل كامل ( ص
6 ,
د
10 ,
F
14) المستويات الفرعية المكتملة.
في بعض الأحيان يسمى هذا التأثير "فشل" الإلكترون. يتم تفسير التأثيرات المماثلة من خلال زيادة الاستقرار بمقدار النصف ( ص
3 ,
د
5 ,
F
7) وبشكل كامل ( ص
6 ,
د
10 ,
F
14) المستويات الفرعية المكتملة.
الانحرافات عن القاعدة ( ن+ل) في عناصر أخرى (الجدول 2). هذا يرجع إلى حقيقة أنه مع زيادة الرقم الكمي الرئيسي ، تقل الفروق بين طاقات المستويات الفرعية.
يأتي بعد ذلك ملء 4 ص-المستوى الفرعي (Ga - Kr). الفترة الرابعة تحتوي على 18 عنصرًا فقط. وبالمثل ، يملأ 5 س-, 4د- و 5 ص- المستويات الفرعية من 18 عنصرًا من الفترة الخامسة. لاحظ أن الطاقة 5 س- و 4 د-المستويات الفرعية قريبة جدًا ، والإلكترون بـ 5 س- المستوى الفرعي يمكن أن ينتقل بسهولة إلى 4 د-المستوى الفرعي. يوم 5 س-المستوى الفرعي Nb و Mo و Tc و Ru و Rh و Ag لديه إلكترون واحد فقط. في حالة أساسية 5 س- لم يتم ملء المستوى الفرعي Pd. لوحظ وجود "تراجع" بين إلكترونين.
الجدول 2
استثناءات من ( ن+ل) - قواعد أول 86 عنصرًا
|
التكوين الإلكترونية |
||
|
حسب القاعدة ( ن+ل) |
فِعلي |
|
|
4س 2 3د 4 4س 2 3د 9 5س 2 4د 3 5س 2 4د 4 5س 2 4د 5 5س 2 4د 6 5س 2 4د 7 5س 2 4د 8 5س 2 4د 9 6س 2 4F 1 5د 0 6س 2 4F 2 5د 0 6س 2 4F 8 5د 0 6س 2 4F 14 5د 7 6س 2 4F 14 5د 8 6س 2 4F 14 5د 9 |
4س 1 3د 5 4س 1 3د 10 5س 1 4د 4 5س 1 4د 5 5س 1 4د 6 5س 1 4د 7 5س 1 4د 8 5س 0 4د 10 5س 1 4د 10 6س 2 4F 0 5د 1 6س 2 4F 1 5د 1 6س 2 4F 7 5د 1 6س 0 4F 14 5د 9 6س 1 4F 14 5د 9 6س 1 4F 14 5د 10 |
|
في الفترة السادسة بعد الملء 6 س-المستوى الفرعي للسيزيوم Cs (Z = 55) والباريوم Ba (Z = 56) الإلكترون التالي ، وفقًا للقاعدة ( ن+ل) ، يجب أن يستغرق 4 F-المستوى الفرعي. ومع ذلك ، في lanthanum La (Z = 57) ، يدخل الإلكترون 5 د-المستوى الفرعي. نصف مملوء (4 F 7) 4F- زاد المستوى الفرعي من الاستقرار ، وبالتالي ، الجادولينيوم Gd (Z = 64) ، بعد europium Eu (Z = 63) ، بمقدار 4 F- يحتفظ المستوى الفرعي بالعدد السابق من الإلكترونات (7) ، ويصل الإلكترون الجديد إلى 5 د-المستوى الفرعي ، كسر القاعدة ( ن+ل). في terbium Tb (Z = 65) ، يحتل الإلكترون التالي 4 F-المستوى الفرعي وهناك انتقال إلكترون من 5 د- المستوى الفرعي (التكوين 4 F 9 6س 2). حشوة 4 F- ينتهي المستوى الفرعي عند ytterbium Yb (Z = 70). يحتل الإلكترون التالي لذرة اللوتيتيوم Lu 5 د-المستوى الفرعي. يختلف تكوينه الإلكتروني عن تكوين ذرة اللانثانم فقط من خلال ملئه بالكامل بـ 4 F-المستوى الفرعي.
حاليًا ، في النظام الدوري للعناصر D.I. Mendeleev ، تحت scandium Sc و yttrium Y ، يقع اللوتيتيوم (بدلاً من اللانثانم) أحيانًا كأول د- العنصر ، وجميع العناصر الأربعة عشر الموجودة أمامه ، بما في ذلك اللانثانم ، ووضعه في مجموعة خاصة اللانثانيداتما وراء الجدول الدوري للعناصر.
يتم تحديد الخصائص الكيميائية للعناصر بشكل أساسي من خلال بنية المستويات الإلكترونية الخارجية. تغيير في عدد الإلكترونات في الثالث خارج 4 F- المستوى الفرعي له تأثير ضئيل على الخصائص الكيميائية للعناصر. لذلك كل 4 Fالعناصر متشابهة في خصائصها. ثم في الفترة السادسة هناك ملء 5 د-المستوى الفرعي (Hf - Hg) و 6 ص-المستوى الفرعي (Tl - Rn).
في الفترة السابعة 7 س- المستوى الفرعي مملوء بالفرنسية Fr (Z = 87) والراديوم Ra (Z = 88). الأكتينيوم له انحراف عن القاعدة ( ن+ل) ، والإلكترون التالي يملأ 6 د- المستوى الفرعي ، وليس 5 F. يتبع ذلك مجموعة من العناصر (ث - لا) مع تعبئة 5 F- المستويات الفرعية التي تشكل الأسرة الأكتينيدات. لاحظ أن 6 د- و 5 F- تحتوي المستويات الفرعية على طاقات قريبة لدرجة أن التكوين الإلكتروني لذرات الأكتينيد غالبًا لا يخضع للقاعدة ( ن+ل). لكن في هذه الحالة ، قيمة التكوين الدقيقة هي 5 F ر 5د م ليس مهمًا جدًا ، نظرًا لأن له تأثيرًا ضعيفًا على الخصائص الكيميائية للعنصر.
Lawrencium Lr (Z = 103) لديه إلكترون جديد عند 6 د-المستوى الفرعي. يتم وضع هذا العنصر أحيانًا في الجدول الدوري تحت مادة اللوتيتيوم. الفترة السابعة لم تكتمل. العناصر من 104 إلى 109 غير مستقرة وخصائصها غير معروفة. وهكذا ، مع زيادة شحنة النواة ، تتكرر بشكل دوري الهياكل الإلكترونية المماثلة للمستويات الخارجية. في هذا الصدد ، ينبغي للمرء أن يتوقع أيضًا تغييرات دورية في خصائص العناصر المختلفة.
التغيير الدوري في خواص ذرات العناصر الكيميائية
تتجلى الخصائص الكيميائية لذرات العناصر أثناء تفاعلها. تحدد أنواع تكوينات مستويات الطاقة الخارجية للذرات السمات الرئيسية لسلوكها الكيميائي.
خصائص ذرة كل عنصر التي تحدد سلوكه في التفاعلات الكيميائية هي طاقة التأين ، تقارب الإلكترون ، الكهربية.
طاقة التأين هي الطاقة اللازمة لفصل وإزالة الإلكترون من الذرة. كلما انخفضت طاقة التأين ، زادت القوة المختزلة للذرة. لذلك ، فإن طاقة التأين هي مقياس لقدرة الذرة المختزلة.
تسمى طاقة التأين المطلوبة لفصل الإلكترون الأول طاقة التأين الأولى I 1. الطاقة المطلوبة لفصل الإلكترون الثاني تسمى طاقة التأين الثانية I 2 ، إلخ. في هذه الحالة ، تحدث التفاوتات التالية
أنا 1< I 2 < I 3 .
يحدث انفصال وإزالة الإلكترون من ذرة محايدة بسهولة أكبر من أيون مشحون.
تتوافق القيمة القصوى لطاقة التأين مع الغازات النبيلة. المعادن القلوية لها الحد الأدنى من قيمة طاقة التأين.
خلال فترة واحدة ، تختلف طاقة التأين بشكل غير رئوي. في البداية ، يتناقص عند الانتقال من العناصر s إلى العناصر p الأولى. ثم ، في العناصر p اللاحقة ، يزداد.
داخل مجموعة واحدة ، مع زيادة العدد الترتيبي للعنصر ، تنخفض طاقة التأين ، ويرجع ذلك إلى زيادة المسافة بين المستوى الخارجي والنواة.
تقارب الإلكترون هو الطاقة (التي يرمز إليها بـ E) التي يتم إطلاقها عندما يتصل الإلكترون بالذرة. عندما تقبل الذرة إلكترونًا ، فإنها تصبح أيونًا سالب الشحنة. يزداد تقارب الإلكترون في فترة ما ، بينما في المجموعة ، كقاعدة عامة ، يتناقص.
الهالوجينات لها أعلى تقارب للإلكترون. من خلال ربط الإلكترون المفقود لإكمال الغلاف ، يكتسبون التكوين الكامل لذرة الغاز النبيل.
الكهربية هي مجموع طاقة التأين وتقارب الإلكترون
تزداد الكهربية مع فترة وتقل مع مجموعة فرعية.
الذرات والأيونات ليس لها حدود محددة بدقة بسبب الطبيعة الموجية للإلكترون. لذلك ، يتم تحديد نصف قطر الذرات والأيونات بشروط.
لوحظ أكبر زيادة في نصف قطر الذرات في عناصر من فترات زمنية صغيرة ، حيث يتم ملء مستوى الطاقة الخارجية فقط ، وهو أمر نموذجي للعناصر s و p. بالنسبة للعناصر d و f ، لوحظ زيادة أكثر سلاسة في نصف القطر مع زيادة الشحنة النووية.
داخل مجموعة فرعية ، يزيد نصف القطر الذري مع زيادة عدد مستويات الطاقة.
بنية غلاف الإلكترون لذرات عناصر الفترات الأربع الأولى: $ s- $ ، $ p- $ و $ d- $ العناصر. التكوين الإلكتروني للذرة. حالات الذرات الأرضية والمتحركة
نشأ مفهوم الذرة في العالم القديم للإشارة إلى جسيمات المادة. في اليونانية ، تعني الذرة "غير قابل للتجزئة".
الإلكترونات
توصل الفيزيائي الأيرلندي ستوني ، على أساس التجارب ، إلى استنتاج مفاده أن الكهرباء تحملها أصغر الجسيمات الموجودة في ذرات جميع العناصر الكيميائية. في عام 1891 دولارًا أمريكيًا ، اقترح ستوني تسمية هذه الجسيمات الإلكترونات، والتي تعني في اليونانية "العنبر".
بعد سنوات قليلة من تسمية الإلكترون باسمه ، أثبت الفيزيائي الإنجليزي جوزيف طومسون والفيزيائي الفرنسي جان بيرين أن الإلكترونات تحمل شحنة سالبة. هذه أصغر شحنة سالبة ، والتي تؤخذ في الكيمياء على أنها الوحدة $ (- 1) $. تمكن طومسون حتى من تحديد سرعة الإلكترون (تساوي سرعة الضوء - 300000 دولار كم / ثانية) وكتلة الإلكترون (أقل بمقدار 1836 دولارًا مرة من كتلة ذرة الهيدروجين).
قام طومسون وبيرين بتوصيل أقطاب مصدر تيار بصفحتين معدنتين - كاثود وأنود ، ملحومان في أنبوب زجاجي ، يتم تفريغ الهواء منه. عندما تم تطبيق جهد يبلغ حوالي 10 آلاف فولت على لوحات القطب ، وميض تفريغ ضوئي في الأنبوب ، وتطايرت الجسيمات من القطب السالب (القطب السالب) إلى القطب الموجب (القطب الموجب) ، والذي أطلق عليه العلماء لأول مرة أشعة الكاثود، ثم اكتشف أنه كان تيارًا من الإلكترونات. تتسبب الإلكترونات ، التي تصطدم بمواد خاصة مطبقة ، على سبيل المثال ، على شاشة التلفزيون ، في توهج.
تم التوصل إلى استنتاج مفاده أن الإلكترونات تهرب من ذرات المادة التي يتكون منها الكاثود.
يمكن أيضًا الحصول على الإلكترونات الحرة أو تدفقها بطرق أخرى ، على سبيل المثال ، عن طريق تسخين سلك معدني أو عن طريق تسليط الضوء على المعادن المكونة من عناصر المجموعة الفرعية الرئيسية للمجموعة الأولى من الجدول الدوري (على سبيل المثال ، السيزيوم).
حالة الإلكترونات في الذرة
تُفهم حالة الإلكترون في الذرة على أنها مجموعة من المعلومات حول طاقةإلكترون محدد في الفضاءالذي يقع فيه. نحن نعلم بالفعل أن الإلكترون في الذرة ليس له مسار للحركة ، أي يمكن الحديث عنه فقط الاحتمالاتإيجاده في الفراغ حول النواة. يمكن أن توجد في أي جزء من هذا الفضاء المحيط بالنواة ، وتعتبر مجمل مواقعها المختلفة بمثابة سحابة إلكترونية ذات كثافة شحنة سالبة معينة. من الناحية المجازية ، يمكن تخيل هذا على النحو التالي: إذا كان من الممكن تصوير موضع إلكترون في ذرة في المئات أو المليون من الثانية ، كما في الصورة النهائية ، فسيتم تمثيل الإلكترون في هذه الصور كنقطة. سيؤدي تراكب عدد لا يحصى من هذه الصور إلى صورة لسحابة إلكترونية بأعلى كثافة حيث توجد معظم هذه النقاط.
يوضح الشكل "قطعًا" بكثافة الإلكترون في ذرة هيدروجين تمر عبر النواة ، ويحد الكرة بخط متقطع ، بداخله احتمال العثور على إلكترون هو 90٪ دولار. يغطي الكفاف الأقرب للنواة منطقة الفضاء التي يكون فيها احتمال العثور على إلكترون 10٪ $ ، واحتمال العثور على إلكترون داخل الكفاف الثاني من النواة هو $ 20٪ $ ، داخل الثالث - $ 30 ٪ $ ، إلخ. هناك بعض عدم اليقين في حالة الإلكترون. لوصف هذه الحالة الخاصة ، قدم الفيزيائي الألماني دبليو هايزنبرغ مفهوم مبدأ عدم اليقين، بمعنى آخر. أظهر أنه من المستحيل تحديد طاقة وموقع الإلكترون في وقت واحد وبدقة. كلما تم تحديد طاقة الإلكترون بشكل أكثر دقة ، كلما كان موضعه غير مؤكد ، والعكس صحيح ، بعد تحديد الموقع ، من المستحيل تحديد طاقة الإلكترون. منطقة احتمالية الكشف عن الإلكترون ليس لها حدود واضحة. ومع ذلك ، من الممكن تحديد المساحة التي يكون فيها احتمال العثور على الإلكترون هو الحد الأقصى.
يُطلق على الفراغ حول النواة الذرية ، والذي يُرجح أن يوجد فيه الإلكترون ، اسم المدار.

يحتوي على ما يقرب من 90٪ دولارًا أمريكيًا من السحابة الإلكترونية ، مما يعني أن حوالي 90٪ دولارًا أمريكيًا من الوقت الذي يكون فيه الإلكترون في هذا الجزء من الفضاء. وفقًا للنموذج ، يتم تمييز 4 دولارات من أنواع المدارات المعروفة حاليًا ، والتي يُشار إليها بالأحرف اللاتينية $ s و p و d $ و $ f $. يظهر تمثيل رسومي لبعض أشكال المدارات الإلكترونية في الشكل.

إن أهم ما يميز حركة الإلكترون في مدار معين هو طاقة ارتباطه بالنواة. تشكل الإلكترونات ذات قيم الطاقة المتشابهة واحدة طبقة إلكترونية، أو مستوى الطاقة. يتم ترقيم مستويات الطاقة بدءًا من النواة: 1 دولار و 2 و 3 و 4 و 5 و 6 دولارات و 7 دولارات.
العدد الصحيح $ n $ الذي يشير إلى رقم مستوى الطاقة يسمى رقم الكم الأساسي.
يميز طاقة الإلكترونات التي تشغل مستوى طاقة معين. تمتلك إلكترونات المستوى الأول من الطاقة ، الأقرب إلى النواة ، أقل طاقة. بالمقارنة مع إلكترونات المستوى الأول ، تتميز إلكترونات المستويات التالية بكمية كبيرة من الطاقة. وبالتالي ، فإن إلكترونات المستوى الخارجي هي الأقل ارتباطًا بقوة بنواة الذرة.
عدد مستويات الطاقة (الطبقات الإلكترونية) في الذرة يساوي عدد الفترة في نظام D. I. Mendeleev ، التي ينتمي إليها العنصر الكيميائي: ذرات عناصر الفترة الأولى لها مستوى طاقة واحد ؛ الفترة الثانية - اثنان ؛ الفترة السابعة - سبعة.
يتم تحديد أكبر عدد من الإلكترونات في مستوى الطاقة بالصيغة:
حيث $ N $ هو الحد الأقصى لعدد الإلكترونات ؛ $ n $ هو رقم المستوى أو رقم الكم الرئيسي. وبالتالي: لا يمكن أن يحتوي مستوى الطاقة الأول الأقرب للنواة على أكثر من إلكترونين ؛ في الثانية - لا يزيد عن 8 دولارات ؛ في اليوم الثالث - لا يزيد عن 18 دولارًا أمريكيًا ؛ في الرابع - لا يزيد عن 32 دولارًا. وكيف يتم ترتيب مستويات الطاقة (الطبقات الإلكترونية) بدورها؟
بدءًا من مستوى الطاقة الثاني $ (n = 2) $ ، يتم تقسيم كل مستوى إلى مستويات فرعية (طبقات فرعية) ، تختلف قليلاً عن بعضها البعض بواسطة طاقة الربط مع النواة.
عدد المستويات الفرعية يساوي قيمة رقم الكم الرئيسي:يحتوي مستوى الطاقة الأول على مستوى فرعي واحد ؛ الثاني - اثنان ؛ الثالث - ثلاثة ؛ الرابع هو أربعة. المستويات الفرعية ، بدورها ، تتشكل بواسطة المدارات.
كل قيمة $ n $ تتوافق مع عدد المدارات التي تساوي $ n ^ 2 $. وفقًا للبيانات الواردة في الجدول ، من الممكن تتبع العلاقة بين الرقم الكمي الرئيسي $ n $ وعدد المستويات الفرعية ، ونوع وعدد المدارات ، والحد الأقصى لعدد الإلكترونات لكل مستوى فرعي ومستوى.
العدد الكمي الرئيسي ، أنواع وعدد المدارات ، العدد الأقصى للإلكترونات في المستويات الفرعية والمستويات.
| مستوى الطاقة $ (n) $ | عدد المستويات الفرعية يساوي $ n $ | النوع المداري | عدد المدارات | العدد الأقصى للإلكترونات | ||
| في المستوى الثانوي | في مستوى يساوي $ n ^ 2 $ | في المستوى الثانوي | عند مستوى يساوي $ n ^ 2 $ | |||
| كلفن (ن = 1) دولار | $1$ | 1s دولار | $1$ | $1$ | $2$ | $2$ |
| L دولار (ن = 2) دولار | $2$ | 2s دولار | $1$ | $4$ | $2$ | $8$ |
| 2 بنس دولار | $3$ | $6$ | ||||
| M دولار (ن = 3) دولار | $3$ | 3s دولار | $1$ | $9$ | $2$ | $18$ |
| 3 بنس دولار | $3$ | $6$ | ||||
| $ 3d $ | $5$ | $10$ | ||||
| دولار N (ن = 4) دولار | $4$ | 4 دولارات أمريكية | $1$ | $16$ | $2$ | $32$ |
| 4 بنس دولار | $3$ | $6$ | ||||
| 4 د دولار | $5$ | $10$ | ||||
| 4f دولار | $7$ | $14$ | ||||
من المعتاد تعيين المستويات الفرعية بالحروف اللاتينية ، وكذلك شكل المدارات التي تتكون منها: $ s ، p ، d ، f $. لذا:
- المستوى الفرعي $ s $ - المستوى الفرعي الأول من كل مستوى طاقة أقرب إلى النواة الذرية ، يتكون من $ s $ -orbital ؛
- $ p $ -sublevel - المستوى الفرعي الثاني لكل منهما ، باستثناء المستوى الأول ، مستوى الطاقة ، يتكون من ثلاثة $ p $ -orbitals ؛
- المستوى الفرعي $ d $ - المستوى الفرعي الثالث لكل منهما ، بدءًا من مستوى الطاقة الثالث ، يتكون من خمسة $ d $ -orbitals ؛
- المستوى الفرعي $ f $ لكل منهما ، بدءًا من مستوى الطاقة الرابع ، يتكون من سبعة $ f $ -orbitals.
نواة الذرة
لكن ليست الإلكترونات وحدها جزءًا من الذرات. اكتشف الفيزيائي هنري بيكريل أن معدنًا طبيعيًا يحتوي على ملح اليورانيوم ينبعث منه أيضًا إشعاع غير معروف ، ويضيء أفلامًا فوتوغرافية مغلقة عن الضوء. تم استدعاء هذه الظاهرة النشاط الإشعاعي.
هناك ثلاثة أنواع من الأشعة المشعة:
- صفائح $ α $ ، والتي تتكون من جزيئات $ α $ التي لها شحنة أكبر بمقدار $ 2 مرة من شحنة الإلكترون ، ولكن بعلامة موجبة ، وكتلة أكبر بمقدار $ 4 مرات من كتلة ذرة الهيدروجين ؛
- المصفوفات $ β $ هي دفق من الإلكترونات ؛
- المصفوفات $ γ $ هي موجات كهرومغناطيسية ذات كتلة ضئيلة ولا تحمل شحنة كهربائية.
وبالتالي ، فإن الذرة لها بنية معقدة - فهي تتكون من نواة موجبة الشحنة وإلكترونات.
كيف يتم ترتيب الذرة؟
في عام 1910 في كامبريدج ، بالقرب من لندن ، درس إرنست رذرفورد مع طلابه وزملائه نثر جزيئات $ α $ التي تمر عبر رقائق ذهبية رقيقة وتسقط على الشاشة. عادة ما تنحرف جسيمات ألفا عن الاتجاه الأصلي بمقدار درجة واحدة فقط ، مما يؤكد ، كما يبدو ، توحيد وتوحيد خصائص ذرات الذهب. وفجأة لاحظ الباحثون أن بعض الجسيمات $ α $ غيرت اتجاه مسارها فجأة ، كما لو كانت تواجه نوعًا من العوائق.
من خلال وضع الشاشة أمام الرقاقة ، كان رذرفورد قادرًا على اكتشاف حتى تلك الحالات النادرة عندما تحلق جزيئات $ α $ ، المنعكسة من ذرات الذهب ، في الاتجاه المعاكس.
أظهرت الحسابات أن الظواهر المرصودة يمكن أن تحدث إذا تركزت الكتلة الكاملة للذرة وكل شحنتها الموجبة في نواة مركزية صغيرة. نصف قطر النواة ، كما اتضح ، أصغر 100000 مرة من نصف قطر الذرة بأكملها ، تلك المنطقة التي توجد بها إلكترونات لها شحنة سالبة. إذا طبقنا مقارنة مجازية ، فيمكن تشبيه الحجم الكامل للذرة بملعب لوجنيكي ، ويمكن تشبيه النواة بكرة القدم الموجودة في وسط الملعب.
ذرة أي عنصر كيميائي يمكن مقارنتها بنظام شمسي صغير. لذلك ، يسمى هذا النموذج من الذرة ، الذي اقترحه رذرفورد ، كوكبي.
البروتونات والنيوترونات
اتضح أن النواة الذرية الدقيقة ، حيث تتركز كتلة الذرة بأكملها ، تتكون من نوعين من الجسيمات - البروتونات والنيوترونات.
البروتوناتلها شحنة مساوية لشحنة الإلكترونات ، ولكنها معاكسة في العلامة $ (+ 1) $ ، وكتلة مساوية لكتلة ذرة الهيدروجين (وهي مقبولة في الكيمياء كوحدة). يتم الإشارة إلى البروتونات بواسطة $ ↙ (1) ↖ (1) p $ (أو $ р + $). نيوتروناتلا تحمل شحنة ، فهي محايدة ولها كتلة مساوية لكتلة البروتون ، أي 1 دولار. يتم الإشارة إلى النيوترونات بواسطة $ ↙ (0) ↖ (1) n $ (أو $ n ^ 0 $).
تسمى البروتونات والنيوترونات بشكل جماعي النكليونات(من اللات. نواة- نواة).
يسمى مجموع عدد البروتونات والنيوترونات في الذرة العدد الكتلي. على سبيل المثال ، العدد الكتلي لذرة الألومنيوم:

نظرًا لأنه يمكن إهمال كتلة الإلكترون ، التي لا تكاد تذكر ، فمن الواضح أن كتلة الذرة بأكملها تتركز في النواة. يشار إلى الإلكترونات على النحو التالي: $ e↖ (-) $.
نظرًا لأن الذرة محايدة كهربائيًا ، فمن الواضح أيضًا ذلك أن عدد البروتونات والإلكترونات في الذرة هو نفسه. إنه يساوي العدد الذري للعنصر الكيميائيالمخصصة لها في الجدول الدوري. على سبيل المثال ، تحتوي نواة ذرة حديد على 26 دولارًا من البروتونات ، وتدور الإلكترونات البالغة 26 دولارًا حول النواة. وكيف نحدد عدد النيوترونات؟
كما تعلم ، فإن كتلة الذرة هي مجموع كتلة البروتونات والنيوترونات. معرفة الرقم الترتيبي للعنصر $ (Z) $ ، أي عدد البروتونات والعدد الكتلي $ (A) $ يساوي مجموع أعداد البروتونات والنيوترونات ، يمكنك إيجاد عدد النيوترونات $ (N) $ باستخدام الصيغة:
على سبيل المثال ، عدد النيوترونات في ذرة الحديد هو:
$56 – 26 = 30$.
يوضح الجدول الخصائص الرئيسية للجسيمات الأولية.
الخصائص الأساسية للجسيمات الأولية.
النظائر
تسمى أنواع ذرات نفس العنصر التي لها نفس الشحنة النووية ولكن بأعداد كتل مختلفة نظائر.
كلمة النظيريتكون من كلمتين يونانيتين: ايزوس- نفس و توبوس- مكان ، يعني "احتلال مكان واحد" (خلية) في النظام الدوري للعناصر.
العناصر الكيميائية الموجودة في الطبيعة عبارة عن مزيج من النظائر. وهكذا ، يحتوي الكربون على ثلاثة نظائر كتلتها $ 12 ، 13 ، 14 $ ؛ الأكسجين - ثلاثة نظائر كتلتها 16 دولارًا ، 17 دولارًا ، 18 دولارًا ، إلخ.
عادةً ما تُعطى في النظام الدوري ، الكتلة الذرية النسبية لعنصر كيميائي هي متوسط قيمة الكتل الذرية لمزيج طبيعي من نظائر عنصر معين ، مع الأخذ في الاعتبار وفرتها النسبية في الطبيعة ، وبالتالي ، فإن قيم غالبًا ما تكون الكتل الذرية جزئية. على سبيل المثال ، ذرات الكلور الطبيعية عبارة عن مزيج من نظيرين - 35 دولارًا (هناك 75٪ دولارًا في الطبيعة) و 37 دولارًا (هناك 25٪ دولارًا) ؛ لذلك ، الكتلة الذرية النسبية للكلور هي $ 35.5 $. تتم كتابة نظائر الكلور على النحو التالي:
$ ↖ (35) ↙ (17) (Cl) $ و $ ↖ (37) ↙ (17) (Cl) $
الخصائص الكيميائية لنظائر الكلور هي نفسها تمامًا نظائر معظم العناصر الكيميائية ، مثل البوتاسيوم والأرجون:
$ ↖ (39) ↙ (19) (K) $ و $ ↖ (40) ↙ (19) (K) $ ، $ ↖ (39) ↙ (18) (Ar) $ و $ ↖ (40) ↙ (18) ) (عربي) $
ومع ذلك ، تختلف نظائر الهيدروجين اختلافًا كبيرًا في الخصائص بسبب الزيادة الهائلة في كتلتها الذرية النسبية ؛ حتى أنهم أعطوا أسماء فردية وعلامات كيميائية: البروتيوم - $ ↖ (1) ↙ (1) (H) $؛ الديوتيريوم - $ ↖ (2) ↙ (1) (H) $ أو $ ↖ (2) ↙ (1) (D) $ ؛ التريتيوم - $ ↖ (3) ↙ (1) (H) $ أو $ ↖ (3) ↙ (1) (T) $.

من الممكن الآن إعطاء تعريف حديث وأكثر صرامة وعلميًا للعنصر الكيميائي.
العنصر الكيميائي عبارة عن مجموعة من الذرات لها نفس الشحنة النووية.
هيكل قذائف الإلكترون لذرات عناصر الفترات الأربع الأولى
لنأخذ في الاعتبار رسم خرائط التكوينات الإلكترونية لذرات العناصر حسب فترات نظام D. I. Mendeleev.
عناصر الفترة الأولى.
توضح مخططات التركيب الإلكتروني للذرات توزيع الإلكترونات على الطبقات الإلكترونية (مستويات الطاقة).

تظهر الصيغ الإلكترونية للذرات توزيع الإلكترونات على مستويات الطاقة والمستويات الفرعية.
تُظهر الصيغ الإلكترونية الرسومية للذرات توزيع الإلكترونات ليس فقط في المستويات والمستويات الفرعية ، ولكن أيضًا في المدارات.

في ذرة الهيليوم ، تكتمل الطبقة الأولى من الإلكترون - وتحتوي على 2 دولار من الإلكترونات.
الهيدروجين والهيليوم عبارة عن عناصر $ s $ ، هذه الذرات لها $ s $ -orbitals مملوءة بالإلكترونات.
عناصر الفترة الثانية.
بالنسبة لجميع عناصر الفترة الثانية ، يتم ملء طبقة الإلكترون الأولى ، وتملأ الإلكترونات مداري $ s- $ و $ p $ لطبقة الإلكترون الثانية وفقًا لمبدأ أقل طاقة (أول $ s $ ، ثم $ p $) وقواعد Pauli و Hund.
في ذرة النيون ، اكتملت طبقة الإلكترون الثانية - تحتوي على إلكترونات بقيمة 8 دولارات.
عناصر الفترة الثالثة.
بالنسبة لذرات عناصر الفترة الثالثة ، اكتملت الطبقتان الإلكترونيتان الأولى والثانية ، لذلك تمتلئ طبقة الإلكترون الثالثة ، حيث يمكن أن تحتل الإلكترونات مستويات فرعية 3s و 3 p و 3 d.
هيكل قذائف الإلكترون لذرات عناصر الفترة الثالثة.
اكتمال مدار الإلكترون 3.5 دولار في ذرة المغنيسيوم. $ Na $ و $ Mg $ عناصر $ s $.
بالنسبة للألمنيوم والعناصر اللاحقة ، فإن المستوى الفرعي $ 3d $ مليء بالإلكترونات.
| $ ↙ (18) (عربي) $ الأرجون |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) s ^ 2 (3) p ^ 6 $ |  |
في ذرة الأرجون ، تحتوي الطبقة الخارجية (طبقة الإلكترون الثالثة) على $ 8 إلكترونات. عندما تكتمل الطبقة الخارجية ، ولكن في المجموع ، في طبقة الإلكترون الثالثة ، كما تعلم بالفعل ، يمكن أن يكون هناك 18 إلكترونًا ، مما يعني أن عناصر الفترة الثالثة بها 3d $ -orbitals تركت شاغرة.
كل العناصر من $ Al $ إلى $ Ar $ - $ p $ -عناصر.
$ s- $ و $ r $ -عناصرشكل المجموعات الفرعية الرئيسيةفي النظام الدوري.
عناصر الفترة الرابعة.
تحتوي ذرات البوتاسيوم والكالسيوم على طبقة إلكترون رابعة ، ويتم ملء المستوى الفرعي $ 4s $ ، لأن لديها طاقة أقل من المستوى الفرعي $ 3 D $. لتبسيط المعادلات الإلكترونية الرسومية لذرات عناصر الفترة الرابعة:
- نشير بشكل مشروط إلى الصيغة الإلكترونية الرسومية للأرجون على النحو التالي: $ Ar $؛
- لن نصور المستويات الثانوية غير المملوءة لهذه الذرات.
$ K ، Ca $ - $ s $ -عناصر،المدرجة في المجموعات الفرعية الرئيسية. بالنسبة للذرات من $ Sc $ إلى $ Zn $ ، فإن المستوى الفرعي ثلاثي الأبعاد مملوء بالإلكترونات. هذه عناصر $ 3d $. تم تضمينها في مجموعات فرعية جانبية ،تمتلئ طبقة الإلكترون قبل الخارجية ، يشار إليها عناصر الانتقال.
انتبه إلى بنية غلاف الإلكترون لذرات الكروم والنحاس. في نفوسهم ، "ينخفض" إلكترون واحد من المستوى الفرعي $ 4s- $ إلى المستوى الفرعي $ 3d $ ، وهو ما يفسره استقرار الطاقة الأكبر للتكوينات الإلكترونية الناتجة $ 3d ^ 5 $ و $ 3d ^ (10) $:
$ ↙ (24) (Cr) $ 1s ^ (2) 2s ^ (2) 2p ^ (6) 3s ^ (2) 3p ^ (6) 3d ^ (4) 4s ^ (2)… $ 
$ ↙ (29) (Cu) $ 1s ^ (2) 2s ^ (2) 2p ^ (6) 3s ^ (2) 3p ^ (6) 3d ^ (9) 4s ^ (2)… $ 
| رمز العنصر والرقم التسلسلي والاسم | رسم تخطيطي للهيكل الإلكتروني | الصيغة الإلكترونية | الصيغة الإلكترونية الرسومية |
| $ ↙ (19) (K) $ البوتاسيوم |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 1 $ | |
| $ ↙ (20) (C) $ الكالسيوم |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 2 $ | |
| $ ↙ (21) (Sc) $ سكانديوم |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 1 (3) d ^ 1 $ أو $ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) ص ^ 6 (3) د ^ 1 (4) ق ^ 1 $ |  |
| $ ↙ (22) (Ti) $ تيتانيوم |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 2 (3) d ^ 2 $ أو $ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) ص ^ 6 (3) د ^ 2 (4) ق ^ 2 $ |  |
| $ ↙ (23) (V) $ الفاناديوم |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 2 (3) d ^ 3 $ أو $ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) ص ^ 6 (3) د ^ 3 (4) ق ^ 2 $ |  |
| $ ↙ (24) (Cr) $ كروم |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 1 (3) d ^ 5 $ أو $ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) ص ^ 6 (3) د ^ 5 (4) ق ^ 1 $ |  |
| $ ↙ (29) (Сu) $ Chromium |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 1 (3) d ^ (10) $ أو $ 1s ^ 2 (2) s ^ 2 (2) ) ص ^ 6 (3) ص ^ 6 (3) د ^ (10) (4) ق ^ 1 $ |  |
| $ ↙ (30) (Zn) $ زنك |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 2 (3) d ^ (10) $ أو $ 1s ^ 2 (2) s ^ 2 (2) ) ص ^ 6 (3) ص ^ 6 (3) د ^ (10) (4) ق ^ 2 $ |  |
| $ ↙ (31) (Ga) $ جاليوم |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 2 (3) d ^ (10) 4p ^ (1) $ أو $ 1s ^ 2 (2) ق ^ 2 (2) ص ^ 6 (3) ص ^ 6 (3) د ^ (10) (4) ق ^ (2) 4p ^ (1) $ |  |
| $ ↙ (36) (كرونا) $ كريبتون |  |
$ 1s ^ 2 (2) s ^ 2 (2) p ^ 6 (3) p ^ 6 (4) s ^ 2 (3) d ^ (10) 4p ^ 6 $ أو $ 1s ^ 2 (2) s ^ 2 (2) ص ^ 6 (3) ص ^ 6 (3) د ^ (10) (4) ق ^ (2) 4p ^ 6 $ |  |
في ذرة الزنك ، اكتملت طبقة الإلكترون الثالثة - تم ملء جميع المستويات الفرعية $ 3s و 3p $ و $ 3d $ فيها ، في المجموع هناك 18 دولارًا من الإلكترونات عليها.
في العناصر التالية للزنك ، يستمر ملء الطبقة الرابعة من الإلكترون ، المستوى الفرعي $ 4p $. العناصر من $ Ga $ إلى $ Kr $ - $ r $ -عناصر.
اكتملت الطبقة الخارجية (الرابعة) من ذرة الكريبتون ، وتحتوي على 8 دولارات من الإلكترونات. لكن فقط في الطبقة الرابعة من الإلكترون ، كما تعلم ، يمكن أن يكون هناك 32 دولارًا من الإلكترونات ؛ لا تزال ذرة الكريبتون بها مستويات فرعية من 4 د - دولار و 4 دولارات أمريكية شاغرة.
تملأ عناصر الفترة الخامسة المستويات الفرعية بالترتيب التالي: $ 5s → 4d → 5р $. وهناك أيضًا استثناءات تتعلق "بفشل" الإلكترونات ، لـ $ ↙ (41) Nb $ ، $ ↙ (42) Mo $ ، $ ↙ (44) Ru $ ، $ ↙ (45) Rh $ ، $ ↙ ( 46) Pd $، $ ↙ (47) Ag $. يظهر $ f $ في الفترتين السادسة والسابعة -عناصر، بمعنى آخر. العناصر التي يتم ملء مستوياتها الفرعية من $ 4f- $ و $ 5f $ للطبقة الإلكترونية الخارجية الثالثة ، على التوالي.
4f دولار -عناصراتصل اللانثانيدات.
5f دولار -عناصراتصل الأكتينيدات.
ترتيب ملء المستويات الفرعية الإلكترونية في ذرات عناصر الفترة السادسة: $ (55) Cs $ و $ (56) Ba $ - $ 6s $ -elements ؛ $ ↙ (57) La ... 6s ^ (2) 5d ^ (1) $ - $ 5d $ -element ؛ $ ↙ (58) Ce $ - $ ↙ (71) Lu - 4f $ -elements ؛ $ ↙ (72) Hf $ - $ ↙ (80) Hg - 5d $ -elements؛ $ ↙ (81) Т1 $ - $ ↙ (86) Rn - 6d $ -elements. ولكن هنا ، أيضًا ، هناك عناصر يتم فيها انتهاك ترتيب ملء مدارات الإلكترون ، والتي ، على سبيل المثال ، ترتبط باستقرار أكبر للطاقة بمقدار النصف وتمتلئ تمامًا بالمستويات الفرعية $ f $ ، أي. $ nf ^ 7 $ و $ nf ^ (14) $.
اعتمادًا على المستوى الفرعي للذرة المملوء بالإلكترونات أخيرًا ، يتم تقسيم جميع العناصر ، كما فهمت بالفعل ، إلى أربع مجموعات أو كتل إلكترونية:
- $ s $ -عناصر؛المستوى الفرعي $ s $ للمستوى الخارجي للذرة مملوء بالإلكترونات ؛ $ s $ - تشمل العناصر الهيدروجين والهيليوم وعناصر المجموعات الفرعية الرئيسية للمجموعتين الأولى والثانية ؛
- $ r $ -عناصر؛المستوى الفرعي $ p $ للمستوى الخارجي للذرة مملوء بالإلكترونات ؛ تتضمن العناصر $ p عناصر المجموعات الفرعية الرئيسية للمجموعات من الثالث إلى الثامن ؛
- $ د $ -عناصر؛المستوى الفرعي $ d $ للمستوى السابق للخارج للذرة مملوء بالإلكترونات ؛ تشمل العناصر $ d $ عناصر المجموعات الفرعية الثانوية للمجموعات من الأول إلى الثامن ، أي عناصر من عقود مقسمة من فترات كبيرة تقع بين $ s- $ و $ p- $ عناصر. يطلق عليهم أيضا عناصر انتقالية
- $ و $ -عناصر؛$ f- $ المستوى الفرعي من المستوى الثالث للذرة في الخارج مملوء بالإلكترونات ؛ وتشمل هذه اللانثانيدات والأكتينيدات.

التكوين الإلكتروني للذرة. حالات الذرات الأرضية والمتحركة
قام الفيزيائي السويسري دبليو باولي في عام 1925 دولارًا بتأسيس ذلك يمكن أن تحتوي الذرة على إلكترونين على الأكثر في مدار واحد.وجود يدور معاكسة (متوازنة) (مترجمة من الإنجليزية كمغزل) ، أي امتلاك مثل هذه الخصائص التي يمكن تخيلها بشكل مشروط مثل دوران الإلكترون حول محوره التخيلي في اتجاه عقارب الساعة أو عكس اتجاه عقارب الساعة. هذا المبدأ يسمى مبدأ باولي.
إذا كان هناك إلكترون واحد في المدار ، فسيتم استدعاؤه غير زوجي، إذا كان اثنان ، ثم هذا إقران الإلكترونات، بمعنى آخر. الإلكترونات ذات الدورات المعاكسة.
يوضح الشكل مخططًا لتقسيم مستويات الطاقة إلى مستويات فرعية.

$ s- $ المداري، كما تعلم ، له شكل كروي. يقع إلكترون ذرة الهيدروجين $ (n = 1) $ على هذا المدار وغير مزاوج. وفقا لهذا له صيغة إلكترونية، أو التكوين الإلكترونية، تتم كتابته على النحو التالي: $ 1s ^ 1 $. في الصيغ الإلكترونية ، يُشار إلى رقم مستوى الطاقة بالرقم الموجود أمام الحرف $ (1 ...) $ ، والمستوى الفرعي (النوع المداري) يُرمز إليه بالحرف اللاتيني ، والرقم المكتوب إلى يُظهر يمين الحرف (كأسس) عدد الإلكترونات في المستوى الفرعي.
بالنسبة لذرة الهيليوم He ، التي تحتوي على إلكترونين مقترنين في نفس المدار $ s- $ ، هذه الصيغة هي: $ 1s ^ 2 $. الغلاف الإلكتروني لذرة الهليوم كامل ومستقر للغاية. الهيليوم غاز نبيل. مستوى الطاقة الثاني $ (n = 2) $ له أربعة مدارات ، واحد $ s $ وثلاثة $ p $. المستوى الثاني من الإلكترونات المدارية $ s $ ($ 2s $ -orbitals) لديها طاقة أعلى ، لأن تقع على مسافة أكبر من النواة من إلكترونات $ 1s $ -orbital $ (n = 2) $. بشكل عام ، لكل قيمة $ n $ يوجد مدار $ s- $ ، ولكن مع مقدار مماثل من طاقة الإلكترون عليه ، وبالتالي ، بقطر مناظر ، ينمو بقيمة $ n $. $ s- الزيادات المدارية $ ، كما تعلم بالفعل ، لها شكل كروي. يقع إلكترون ذرة الهيدروجين $ (n = 1) $ على هذا المدار وغير مزاوج. لذلك ، تتم كتابة صيغته الإلكترونية ، أو التكوين الإلكتروني ، على النحو التالي: $ 1s ^ 1 $. في الصيغ الإلكترونية ، يُشار إلى رقم مستوى الطاقة بالرقم الموجود أمام الحرف $ (1 ...) $ ، والمستوى الفرعي (النوع المداري) يُرمز إليه بالحرف اللاتيني ، والرقم المكتوب إلى يُظهر يمين الحرف (كأسس) عدد الإلكترونات في المستوى الفرعي.
بالنسبة لذرة الهليوم $ He $ ، التي تحتوي على إلكترونين مقترنين في نفس المدار $ s- $ ، هذه الصيغة هي: $ 1s ^ 2 $. الغلاف الإلكتروني لذرة الهليوم كامل ومستقر للغاية. الهيليوم غاز نبيل. مستوى الطاقة الثاني $ (n = 2) $ له أربعة مدارات ، واحد $ s $ وثلاثة $ p $. الإلكترونات من $ s- $ المدارات من المستوى الثاني ($ 2s $ -orbitals) لديها طاقة أعلى ، لأن تقع على مسافة أكبر من النواة من إلكترونات $ 1s $ -orbital $ (n = 2) $. بشكل عام ، لكل قيمة $ n $ يوجد مدار واحد $ s- $ ، ولكن مع مقدار مماثل من طاقة الإلكترون عليه ، وبالتالي ، بقطر مناظر ، يزداد كلما زادت قيمة $ n $. 
$ r- $ المداريلها شكل الدمبل ، أو حجم ثمانية. تقع جميع الأشكال الثلاثة $ p $ -orbital في الذرة بشكل متعامد بشكل متبادل على طول الإحداثيات المكانية المرسومة عبر نواة الذرة. يجب التأكيد مرة أخرى على أن كل مستوى طاقة (طبقة إلكترونية) ، بدءًا من $ n = 2 $ ، يحتوي على ثلاثة $ p $ -orbitals. مع زيادة قيمة $ n $ ، تحتل الإلكترونات $ p $ -orbitals الموجودة على مسافات كبيرة من النواة وموجهة على طول المحاور $ x و y و z $.
بالنسبة لعناصر الفترة الثانية $ (n = 2) $ ، يتم تعبئة المدورة الأولى $ s $ -orbital ، ثم ثلاثة $ p $ -orbitals ؛ الصيغة الإلكترونية $ Li: 1s ^ (2) 2s ^ (1) $. الإلكترون $ 2 ^ 1 $ أقل ارتباطًا بالنواة الذرية ، لذلك يمكن لذرة الليثيوم التخلص منها بسهولة (كما تتذكر على الأرجح ، تسمى هذه العملية الأكسدة) ، وتتحول إلى أيون الليثيوم $ Li ^ + $.
في ذرة البريليوم Be ، يتم وضع الإلكترون الرابع أيضًا في مدار $ 2s $: $ 1s ^ (2) 2s ^ (2) $. يمكن فصل الإلكترونين الخارجيين لذرة البريليوم بسهولة - يتأكسد $ B ^ 0 $ في الموجبة $ Be ^ (2 +) $.
يحتل الإلكترون الخامس من ذرة البورون 2p $ -orbital: $ 1s ^ (2) 2s ^ (2) 2p ^ (1) $. بعد ذلك ، تمتلئ المدارات $ 2p $ للذرات $ C و N و O و F $ ، والتي تنتهي بغاز النيون النبيل: $ 1s ^ (2) 2s ^ (2) 2p ^ (6) $.
بالنسبة لعناصر الفترة الثالثة ، يتم ملء المدارات من 3 دولار إلى دولار و 3 بنسات دولار على التوالي. خمسة $ d $ -orbitals من المستوى الثالث تبقى مجانية:
$ ↙ (11) Na 1s ^ (2) 2s ^ (2) 2p ^ (6) 3s ^ (1) $ ،
$ ↙ (17) Cl 1s ^ (2) 2s ^ (2) 2p ^ (6) 3s ^ (2) 3p ^ (5) $ ،
$ ↙ (18) Ar 1s ^ (2) 2s ^ (2) 2p ^ (6) 3s ^ (2) 3p ^ (6) $.
في بعض الأحيان ، في الرسوم البيانية التي تصور توزيع الإلكترونات في الذرات ، يشار فقط إلى عدد الإلكترونات في كل مستوى طاقة ، أي كتابة صيغ إلكترونية مختصرة لذرات العناصر الكيميائية ، على عكس الصيغ الإلكترونية الكاملة أعلاه ، على سبيل المثال:
$ ↙ (11) Na 2، 8، 1؛ $ ↙ (17) Cl 2، 8، 7؛ $ ↙ (18) أر 2، 8، 8 $.
بالنسبة للعناصر ذات الفترات الكبيرة (الرابعة والخامسة) ، يشغل الإلكترونان الأولين على التوالي 4s- $ و 5s $ -orbitals: $ ↙ (19) K 2 ، 8 ، 8 ، 1 ؛ $ ↙ (38) ريال 2 ، 8 ، 18 ، 8 ، 2 دولار. بدءًا من العنصر الثالث لكل فترة كبيرة ، ستنتقل الإلكترونات العشرة التالية إلى المدارات السابقة $ 3d- $ و $ 4d- $ ، على التوالي (لعناصر المجموعات الفرعية الثانوية): $ ↙ (23) V 2، 8، 11 ، 2؛ $ ↙ (26) Fr 2، 8، 14، 2؛ $ ↙ (40) Zr 2، 8، 18، 10، 2؛ $ ↙ (43) Tc 2، 8، 18، 13، 2 دولار. كقاعدة عامة ، عند ملء المستوى الفرعي $ d $ السابق ، سيبدأ ملء المستوى الخارجي (على التوالي $ 4p- $ و $ 5p- $) $ p- $: $ ↙ (33) كـ 2، 8، 18 ، 5 ؛ $ ↙ (52) تي 2 ، 8 ، 18 ، 18 ، 6 دولار.
بالنسبة لعناصر الفترات الكبيرة - السادس والسابع غير المكتمل - تمتلئ المستويات الإلكترونية والمستويات الفرعية بالإلكترونات ، كقاعدة عامة ، على النحو التالي: أول إلكترونين يدخلان المستوى الثانوي $ s- $: $ ↙ (56) Ba 2، 8 ، 18 ، 18 ، 8 ، 2 ؛ $ ↙ (87) فرنك 2 ، 8 ، 18 ، 32 ، 18 ، 8 ، 1 دولار ؛ الإلكترون التالي (مقابل $ La $ و $ Ca $) إلى المستوى الفرعي السابق $ d $: $ ↙ (57) La 2 و 8 و 18 و 18 و 9 و 2 $ و $ (89) Ac 2 ، 8 ، 18 ، 32 ، 18 ، 9 ، 2 دولار.
بعد ذلك ستدخل الإلكترونات التالية البالغة قيمتها 14 دولارًا إلى مستوى الطاقة الثالث من الخارج ، المدارات $ 4f $ و $ 5f $ لمدارات lantonides و actinides ، على التوالي: $ ↙ (64) Gd 2 ، 8 ، 18 ، 25 ، 9 ، 2 ؛ $ ↙ (92) U 2، 8، 18، 32، 21، 9، 2 دولار.
ثم يبدأ مستوى الطاقة الثاني من الخارج ($ d $ - المستوى الفرعي) بالتراكم مرة أخرى لعناصر المجموعات الفرعية الجانبية: $ (73) Ta 2، 8، 18، 32، 11، 2؛ $ ( 104) بنادق 2 ، 8 ، 18 ، 32 ، 32 ، 10 ، 2 دولار. وأخيرًا ، فقط بعد امتلاء المستوى الفرعي $ d $ بالكامل بعشرة إلكترونات ، سيتم ملء المستوى الفرعي $ p $ مرة أخرى: $ ↙ (86) Rn 2 ، 8 ، 18 ، 32 ، 18 ، 8 $.
في كثير من الأحيان ، يتم تصوير بنية غلاف الإلكترون للذرات باستخدام الطاقة أو الخلايا الكمومية - يكتبون ما يسمى الصيغ الإلكترونية الرسومية. بالنسبة لهذا السجل ، يتم استخدام الترميز التالي: يتم الإشارة إلى كل خلية كمية بواسطة خلية تتوافق مع مدار واحد ؛ يشار إلى كل إلكترون بواسطة سهم يتوافق مع اتجاه الدوران. عند كتابة صيغة إلكترونية رسومية ، يجب تذكر قاعدتين: مبدأ باولي، وفقًا لذلك لا يمكن أن تحتوي الخلية (المدارية) على أكثر من إلكترونين ، ولكن مع دوران مضاد للتوازي ، و حكم F. Hund، وفقًا لمبدأ احتلال الإلكترونات للخلايا الحرة أولاً واحدة تلو الأخرى وفي نفس الوقت يكون لها نفس قيمة الدوران ، وعندها فقط يكون الزوج ، ولكن السبينات ، وفقًا لمبدأ باولي ، سيتم توجيهها بشكل معاكس بالفعل.
مهمة 1. اكتب التكوينات الإلكترونية للعناصر التالية: N ، سي، F e ، Kr ، Te ، W.
المحلول. تزداد طاقة المدارات الذرية بالترتيب التالي:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
في كل قذيفة s (مدار واحد) لا يمكن أن يكون هناك أكثر من إلكترونين ، على الغلاف p (ثلاثة مدارات) - لا يزيد عن ستة ، على قذيفة d (خمسة مدارات) - لا يزيد عن 10 وعلى f-shell (سبعة مدارات) - لا يزيد عن 14.
في الحالة الأرضية للذرة ، تحتل الإلكترونات مدارات ذات طاقة أقل. عدد الإلكترونات يساوي شحنة النواة (الذرة ككل محايدة) والعدد الذري للعنصر. على سبيل المثال ، تحتوي ذرة النيتروجين على 7 إلكترونات ، اثنان منها في مدارات 1 ثانية ، واثنان في مدارات 2 ثانية ، والإلكترونات الثلاثة المتبقية في مدارات 2p. التكوين الإلكتروني لذرة النيتروجين:
7 N: 1s 2 2s 2 2p 3. التكوينات الإلكترونية للعناصر الأخرى:
14 Si: 1s 2 2s 2 2p 6 3s 2 3p 2 ،
26 ه : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6،
36 ك r: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6،
52 هؤلاء : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 4 ،
74 هؤلاء : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4.
المهمة 2. ما هو الغاز الخامل وأيونات العناصر التي لها نفس التكوين الإلكتروني للجسيم الناتج عن إزالة جميع إلكترونات التكافؤ من ذرة الكالسيوم؟
المحلول. غلاف الإلكترون لذرة الكالسيوم له البنية 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2. عند إزالة إلكترونين من التكافؤ ، يتم تكوين أيون Ca 2+ بالتكوين 1s 2 2s 2 2p 6 3s 2 3p 6. الذرة لها نفس التكوين الإلكتروني أروالأيونات S 2- ، Cl - ، K + ، Sc 3+ ، إلخ.
المهمة 3. هل يمكن أن تكون إلكترونات أيون Al 3+ في المدارات التالية: أ) 2 ع ؛ ب) 1 ص ؛ ج) 3D؟
المحلول. التكوين الإلكتروني لذرة الألومنيوم: 1s 2 2s 2 2p 6 3s 2 3p 1. يتكون أيون Al 3+ عند إزالة ثلاثة إلكترونات تكافؤ من ذرة الألومنيوم وله التكوين الإلكتروني 1s 2 2s 2 2p 6.
أ) الإلكترونات موجودة بالفعل في المدار 2p ؛
ب) وفقًا للقيود المفروضة على العدد الكمي l (l = 0 ، 1 ، ... n -1) ، عند n = 1 ، فقط القيمة l = 0 ممكنة ، لذلك ، المدار 1p غير موجود ؛
ج) يمكن أن تكون الإلكترونات في مدار ثلاثي الأبعاد إذا كان الأيون في حالة الإثارة.
المهمة 4.اكتب التكوين الإلكتروني لذرة النيون في الحالة المثارة الأولى.
المحلول. التكوين الإلكتروني لذرة النيون في الحالة الأرضية هو 1s 2 2s 2 2p 6. يتم الحصول على الحالة المثارة الأولى عن طريق انتقال إلكترون واحد من أعلى مدار مشغول (2p) إلى أدنى مدار حر (3s). التكوين الإلكتروني لذرة النيون في الحالة المثارة الأولى هو 1s 2 2s 2 2p 5 3s 1.
المهمة 5. ما هو تكوين نوى النظائر 12 ج و 13 ج ، 14 ن ، 15 ن؟
المحلول. عدد البروتونات في النواة يساوي العدد الذري للعنصر وهو نفسه لجميع نظائر هذا العنصر. عدد النيوترونات يساوي عدد الكتلة (المشار إليه في أعلى يسار رقم العنصر) مطروحًا منه عدد البروتونات. النظائر المختلفة لنفس العنصر لها أعداد مختلفة من النيوترونات.
تكوين هذه النوى:
12 ج: 6 ع + 6 ن ؛ 13 ج: 6 ص + 7 ن ؛ 14 N: 7p + 7n ؛ 15N: 7p + 8n.
التكوين الإلكترونية- صيغة ترتيب الإلكترونات في أغلفة إلكترونية مختلفة لذرة عنصر أو جزيء كيميائي.
عادة ما يتم كتابة التكوين الإلكتروني للذرات في حالتها الأساسية. لتحديد التكوين الإلكتروني لعنصر ما ، توجد القواعد التالية:
- مبدأ التعبئة. وفقًا لمبدأ الملء ، تملأ الإلكترونات الموجودة في الحالة الأرضية للذرة المدارات في سلسلة من مستويات الطاقة المدارية المتزايدة. يتم دائمًا ملء مدارات الطاقة الأقل أولاً.
- مبدأ استبعاد باولي. وفقًا لهذا المبدأ ، لا يمكن أن يكون أكثر من إلكترونين في أي مدار ، وبعد ذلك فقط إذا كان لديهم دوران معاكسة (أرقام دوران غير متساوية).
- حكم هوند. وفقًا لهذه القاعدة ، يبدأ ملء مدارات إحدى القشرة الفرعية بإلكترونات مفردة مع دوران متوازي (نفس الإشارة) ، وفقط بعد أن احتلت الإلكترونات المفردة جميع المدارات ، فإن الملء النهائي للمدارات بأزواج من الإلكترونات ذات الدورات المعاكسة يمكن أن يحدث.
من وجهة نظر ميكانيكا الكم ، فإن التكوين الإلكتروني عبارة عن قائمة كاملة بوظائف الموجة أحادية الإلكترون ، والتي من خلالها ، بدرجة كافية من الدقة ، يمكن تكوين الدالة الموجية الكاملة للذرة (بالتقريب لـ مجال متسق ذاتيًا).
بشكل عام ، الذرة ، كنظام مركب ، لا يمكن وصفها بالكامل إلا من خلال وظيفة الموجة الكاملة. ومع ذلك ، فإن مثل هذا الوصف مستحيل عمليًا بالنسبة للذرات الأكثر تعقيدًا من ذرة الهيدروجين ، وهي أبسط ذرات العناصر الكيميائية. الوصف التقريبي الملائم هو الأسلوب الميداني المتسق ذاتيًا. تقدم هذه الطريقة مفهوم الدالة الموجية لكل إلكترون. تتم كتابة الدالة الموجية للنظام بأكمله كمنتج متناظر بشكل صحيح لوظائف موجة الإلكترون الواحد. عند حساب الدالة الموجية لكل إلكترون ، يتم أخذ مجال جميع الإلكترونات الأخرى في الاعتبار كإمكانات خارجية ، والتي تعتمد بدورها على الوظائف الموجية لهذه الإلكترونات الأخرى.
نتيجة لتطبيق طريقة المجال المتسقة ذاتيًا ، يتم الحصول على نظام معقد من المعادلات التكاملية التفاضلية غير الخطية ، والتي لا يزال من الصعب حلها. ومع ذلك ، فإن معادلات المجال المتسقة ذاتيًا لها تناظر دوراني للمشكلة الأصلية (أي أنها متماثلة كرويًا). هذا يجعل من الممكن تصنيف وظائف موجة الإلكترون الواحد التي تشكل وظيفة الموجة الكاملة للذرة.
بادئ ذي بدء ، كما هو الحال في أي جهد متماثل مركزيًا ، يمكن تمييز الدالة الموجية في حقل متسق ذاتيًا من خلال العدد الكمي للزخم الزاوي الكلي ل (displaystyle l)والعدد الكمي لإسقاط الزخم الزاوي على بعض المحاور م (displaystyle m). وظائف الموجة بقيم مختلفة م (displaystyle m)تتوافق مع نفس مستوى الطاقة ، أي أنها تتدهور. أيضًا ، يتوافق مستوى طاقة واحد مع حالات ذات إسقاطات مختلفة للإلكترون يدور على أي محور. الإجمالي لمستوى طاقة معين 2 (2 l + 1) (displaystyle 2 (2l + 1))وظائف الموجة. علاوة على ذلك ، بالنسبة لقيمة معينة للزخم الزاوي ، يمكن إعادة ترقيم مستويات الطاقة. عن طريق القياس مع ذرة الهيدروجين ، من المعتاد ترقيم مستويات الطاقة لبعضها ل (displaystyle l)تبدأ ب n = l + 1 (displaystyle n = l + 1). تسمى القائمة الكاملة للأرقام الكمية لوظائف الموجة أحادية الإلكترون ، والتي يمكن من خلالها تكوين الدالة الموجية للذرة ، التكوين الإلكتروني. لأن كل شيء يتدهور في عدد الكم م (displaystyle m)وفي الدوران ، يكفي الإشارة إلى العدد الإجمالي للإلكترونات في الحالة بالبيانات n (displaystyle n), ل (displaystyle l).
موسوعي يوتيوب
-
1 / 5
لأسباب تاريخية ، في صيغة التكوين الإلكترونية ، الرقم الكمي ل (displaystyle l)مكتوبة بأحرف لاتينية. الدولة مع يشار إليها بالحرف ث (displaystyle s), * (displaystyle p): l = 1 (displaystyle l = 1), د (displaystyle d): l = 2 (displaystyle l = 2), و (displaystyle f): l = 3 (displaystyle l = 3), ز (displaystyle g): l = 4 (displaystyle l = 4)وهكذا دواليك أبجديًا. على يسار الرقم ل (displaystyle l)اكتب رقما n (displaystyle n)وفوق الرقم ل (displaystyle l)هو عدد الإلكترونات في حالة البيانات n (displaystyle n)و ل (displaystyle l). فمثلا 2 ث 2 (displaystyle 2s ^ (2))يتوافق مع إلكترونين في حالة مع n = 2 (displaystyle n = 2), م = 0 (displaystyle l = 0). نظرًا للراحة العملية (انظر قاعدة Klechkovsky) ، في الصيغة الكاملة للتكوين الإلكتروني ، تتم كتابة الشروط بترتيب تصاعدي للرقم الكمي n (displaystyle n)، ثم الرقم الكمي ل (displaystyle l)، فمثلا 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3 (displaystyle 1s ^ (2) 2s ^ (2) 2p ^ (6) 3s ^ (2) 3p ^ (3)). نظرًا لأن مثل هذا الترميز زائد إلى حد ما ، في بعض الأحيان يتم تقليل الصيغة إلى 1 s 2 2 s 2 p 6 3 s 2 p 3 (\ displaystyle 1s ^ (2) 2s ^ (2) p ^ (6) 3s ^ (2) p ^ (3))، أي حذف الرقم n (displaystyle n)حيث يمكن تخمينه من مصطلح ترتيب القاعدة.
القانون الدوري وهيكل الذرة
ينطلق جميع المشاركين في بنية الذرة في أي من دراساتهم من الأدوات التي يوفرها لهم القانون الدوري ، والتي اكتشفها الكيميائي د. فقط في فهمهم لهذا القانون ، يستخدم الفيزيائيون وعلماء الرياضيات "لغتهم" لتفسير التبعيات التي أظهرها (على الرغم من أن الحكمة السخرية إلى حد ما من قبل جي دبليو جيبس حول هذا الموضوع معروفة) ، ولكن في نفس الوقت معزولون عن الكيميائيين الذين يدرسون المادة ، مع كل كمال ومزايا وعالمية أجهزتهم ، لا يستطيع الفيزيائيون ولا الرياضيون بالطبع بناء أبحاثهم الخاصة.
كما لوحظ تفاعل ممثلي هذه التخصصات في زيادة تطوير الموضوع. أعطى اكتشاف الدورية الثانوية من قبل E.V Biron (1915) جانبًا آخر في فهم القضايا المتعلقة بانتظام بنية أغلفة الإلكترون. S. A. Shukarev ، طالب من E. V. Biron و
التكوين الإلكتروني للذرة هويوضح توزيع الطاقة ē. المستويات والمستويات الفرعية.
1s 1 ← رقم ē مع شكل سحابة معين
↖ شكل سحابة إلكترونية
مستوى الطاقة
الصيغ الإلكترونية الرسومية (صور التركيب الإلكتروني للذرة) -
يوضح توزيع الطاقة ē. المستويات والمستويات الفرعية والمدارات.
أنا فترة:+1 ن
أين - ē ، ↓ - مع يدور عكسي ، مداري.
عند كتابة صيغة إلكترونية رسومية ، يجب على المرء أن يتذكر قاعدة Pauli و حكم هند "إذا كان هناك العديد من المدارات الحرة داخل مستوى فرعي واحد ، فسيتم وضع كل منها على مدار منفصل وفقط في حالة عدم وجود مدارات حرة يتم دمجها في أزواج."
(العمل بالصيغ الإلكترونية والرسومية الإلكترونية).
فمثلا، H +1 1s 1 ؛ هو +2 1s 2 ؛ Li +3 1s 2 2s 1 ؛ Na +11 1s 2 2s 2 2p 6 3s 1 ؛ Ar +18 1s 2 2s 2 2p 6 3s 2 3p 6 ؛
أنا فترة:الهيدروجين والهيليوم - عناصر ق، مدارهم s مملوء بالإلكترونات.
الفترة الثانية: Li و Be هما عناصر s
B ، C ، N ، O ، F ، Ne - عناصر p
اعتمادًا على المستوى الفرعي للذرة المملوء بالإلكترونات أخيرًا ، يتم تقسيم جميع العناصر إلى 4 مجموعات أو كتل إلكترونية:
1) عناصر ق – لديهم المستوى الفرعي ē-mi s للطبقة الخارجية للذرة ؛ وتشمل هذه الهيدروجين والهيليوم و e-you gl.p / gr. المجموعات الأولى والثانية.
2) عناصر ف -يملأون المستوى العالمي للإلكترون من المستوى الخارجي للذرة ؛ وتشمل هذه عناصر gl.p / gr. الثالث - الثامن المجموعات.
3) د-العناصر -فيهم ، المستوى الفرعي d للمستوى السابق للخارج للذرة مملوء بالإلكترونات ؛ وتشمل هذه e-you poboch.p / gr. . مجموعات I-VIII ، أي عقود المكون الإضافي el-you ذات الفترات الكبيرة ، الواقعة بين العنصرين s و p ، وتسمى أيضًا عناصر الانتقال.
4) و العناصر- المستوى الفرعي f للمستوى الثالث من الذرة بالخارج مملوء بالإلكترونات ؛ وتشمل هذه اللانثانيدات (4 عناصر f) والأكتينيدات (5 عناصر f).
ذرات النحاس والكروم لها "فشل" ēمن المستوى 4s- إلى المستوى الفرعي 3d ، والذي يفسره استقرار الطاقة الأكبر للتكوينات الإلكترونية الناتجة 3d 5 و 3 d 10:
29 نحاس 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 24 كر 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
لقد ثبت تجريبياً أن حالات الذرات التي تكون فيها المدارات p- ، d- ، f نصف ممتلئة (p 3 ، d 5 ، f 7) ، تمامًا (p 6 ، d 10 ، f 14) أو حرة ، زادت من الاستقرار. يفسر هذا التحولات - "الانخفاضات" - للإلكترونات بين المدارات المتقاربة. لوحظت نفس الانحرافات في نظير الكروم - الموليبدينوم ، وكذلك في عناصر المجموعة الفرعية النحاسية - الفضة والذهب. فريد في هذا الصدد هو البلاديوم ، الذي لا تحتوي ذرته على إلكترونات 5s على الإطلاق وله أثر. التكوين: 46 Pd 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10.
أسئلة لضبط النفس
1. ما هي السحابة الإلكترونية؟
2. ما هو الفرق بين 1s-orbital و 2s-orbital؟
3. ما هو رقم الكم الرئيسي؟ كيف تتصل برقم الفترة؟
4. ما هو المستوى الفرعي وكيف يرتبط هذا المفهوم برقم الفترة؟
5. تكوين التكوينات الإلكترونية لذرات العناصر 4-6 من فترة PSCE.
6. يؤلف التكوين الإلكتروني لذرات المغنيسيوم والنيون.
7. حدد الذرة التي تنتمي إلى التكوين الإلكتروني 1S 2 2S 2 2p 6 3S 1، 1S 2 2S 2 2p 6 3S 2، 1S 2 2S 2 2p 4، 1S 2 2S 1
خطة الدرس رقم 7
تأديب:كيمياء.
عنوان:
الغرض من الدرس:دراسة آليات تكوين الروابط الأيونية والتساهمية ، للنظر في المشابك البلورية الأيونية والذرية والجزيئية.
النتائج المخطط لها
موضوعات:امتلاك المفاهيم الكيميائية الأساسية: الرابطة الكيميائية ، والأيونات ، والمشابك البلورية ، والاستخدام الواثق للمصطلحات والرموز الكيميائية ؛ تكوين القدرة على إعطاء تقديرات كمية وإجراء الحسابات وفقًا للصيغ والمعادلات الكيميائية ؛
ميتاسوبجيكت:استخدام أنواع مختلفة من النشاط المعرفي والعمليات الفكرية الأساسية: تجميع التكوينات الإلكترونية لذرات العناصر الكيميائية.
شخصي:القدرة على استخدام إنجازات العلوم الكيميائية الحديثة والتقنيات الكيميائية لزيادة التطور الفكري للفرد في النشاط المهني المختار ؛
معيار الوقت:ساعاتين
نوع الفصل:محاضرة.
خطة الدرس:
1. الكاتيونات ، تتكون من الذرات نتيجة عملية الأكسدة. الأنيونات ، تتكون من الذرات نتيجة لعملية الاختزال. الرابطة الأيونية ، كرابطة بين الكاتيونات والأنيونات بسبب الجذب الكهروستاتيكي.
2. تصنيف الأيونات: عن طريق التركيب ، وعلامة الشحنة ، ووجود قشرة هيدراتية.
3. المشابك البلورية الأيونية. خصائص المواد ذات النوع الأيوني من الشبكة البلورية.
4. آلية تكوين الرابطة التساهمية (التبادل والمتبرع المتقبل).
5. الكهربية. الروابط التساهمية القطبية وغير القطبية. تعدد الرابطة التساهمية.
6. المشابك البلورية الجزيئية والذرية. خواص المواد ذات المشابك البلورية الجزيئية والذرية.
معدات:نماذج من المشابك البلورية ، كتاب مدرسي ، نظام دوري للعناصر الكيميائية بواسطة DIMendeleev.
المؤلفات:
1. كيمياء الصف 11: كتاب مدرسي. للتعليم العام المنظمات G.E. رودزيتيس ، إف جي. فيلدمان. - م: التنوير 2014. -208 ص: Ill ..
2. كيمياء المهن والتخصصات الفنية الشخصية: كتاب مدرسي للطلاب. المؤسسات المتوسطة. الأستاذ. التعليم / O.S.Gabrielyan، I.G. أوستروموف. - الطبعة الخامسة ، ممحاة. - م: مركز النشر "الأكاديمية" ، 2017. - 272 صفحة ، ملونة. سوف.
المحاضر: Tubaltseva Yu.N.
الموضوع 7.الرابطة الكيميائية الأيونية والتساهمية.
1) الكاتيونات ، تتكون من الذرات نتيجة عملية الأكسدة. الأنيونات ، تتكون من الذرات نتيجة لعملية الاختزال. الرابطة الأيونية ، كرابطة بين الكاتيونات والأنيونات بسبب الجذب الكهروستاتيكي.
2) تصنيف الأيونات: عن طريق التركيب ، وعلامة الشحنة ، ووجود قشرة رطبة.
3) المشابك البلورية الأيونية. خصائص المواد ذات النوع الأيوني من الشبكة البلورية.
4) آلية تكوين الرابطة التساهمية (التبادل والمتبرع المتقبل).
5) الكهربية. الروابط التساهمية القطبية وغير القطبية. تعدد الرابطة التساهمية.
6) المشابك البلورية الجزيئية والذرية. خواص المواد ذات المشابك البلورية الجزيئية والذرية.
الكاتيونات ، تتكون من الذرات نتيجة عملية الأكسدة. الأنيونات ، تتكون من الذرات نتيجة لعملية الاختزال. الرابطة الأيونية ، كرابطة بين الكاتيونات والأنيونات بسبب الجذب الكهروستاتيكي.
الرابطة الكيميائية هي تفاعل الذرات التي تحدد ثبات الجسيم الكيميائي أو البلورة ككل. تتكون الرابطة الكيميائية بسبب التفاعل الكهروستاتيكي بين الجسيمات المشحونة: الكاتيونات والأنيونات والنواة والإلكترونات. عندما تقترب الذرات من بعضها البعض ، تبدأ القوى الجاذبة في العمل بين نواة ذرة وإلكترونات أخرى ، وكذلك قوى التنافر بين النوى وبين الإلكترونات. على مسافة ما ، تتوازن هذه القوى مع بعضها البعض ، ويتكون جسيم كيميائي مستقر.
عندما تتشكل رابطة كيميائية ، يمكن أن تحدث إعادة توزيع كبيرة لكثافة الإلكترون للذرات في المركب مقارنة بالذرات الحرة. في الحالة المحدودة ، يؤدي هذا إلى تكوين جسيمات مشحونة - أيونات (من "الأيون" اليوناني - ذاهب).
تفاعل الأيونات:
إذا فقدت الذرة إلكترونًا واحدًا أو أكثر ، فإنها تتحول إلى أيون موجب - كاتيون (مترجم من اليونانية - "النزول إلى الأسفل). هذه هي الطريقة التي تتشكل بها كاتيونات الهيدروجين H + ، والليثيوم Li + ، والباريوم Ba 2+. اكتساب الإلكترونات ، تتحول الذرات إلى أيونات سالبة - الأنيونات (من "الأنيون" اليوناني - الصعود) ومن أمثلة الأنيونات أيون الفلوريد F - ، أيون الكبريتيد S 2 -.
الكاتيونات والأنيونات قادرة على جذب بعضها البعض. في هذه الحالة ، تحدث رابطة كيميائية ، وتتشكل مركبات كيميائية. يسمى هذا النوع من الروابط الكيميائية الرابطة الأيونية:
الرابطة الأيونية ، كقاعدة عامة ، تحدث بين ذرات المعادن النموذجية وغير المعدنية النموذجية. من الخصائص المميزة لذرات المعادن أنها تتبرع بسهولة بإلكترونات التكافؤ ، في حين أن الذرات غير المعدنية قادرة على ربطها بسهولة.
ضع في اعتبارك حدوث رابطة أيونية ، على سبيل المثال ، بين ذرات الصوديوم وذرات الكلور في كلوريد الصوديوم كلوريد الصوديوم.
يؤدي انفصال الإلكترون عن ذرة الصوديوم إلى تكوين أيون موجب الشحنة - كاتيون الصوديوم Na.
تؤدي إضافة إلكترون إلى ذرة الكلور إلى تكوين أيون سالب الشحنة - أنيون الكلور Cl -.
بين أيونات الصوديوم والكلوريد المتكونة ، والتي لها شحنة معاكسة ، ينشأ جذب إلكتروستاتيكي ، ونتيجة لذلك يتم تكوين مركب - كلوريد الصوديوم مع نوع أيوني من الرابطة الكيميائية.
الرابطة الأيونية - هذه رابطة كيميائية ، يتم إجراؤها بسبب التفاعل الكهروستاتيكي للأيونات المشحونة.
وبالتالي ، يتم تقليل عملية تكوين الرابطة الأيونية إلى انتقال الإلكترونات من ذرات الصوديوم إلى ذرات الكلور مع تكوين أيونات مشحونة معاكسة مع تكوينات إلكترونية كاملة للطبقات الخارجية.
1. ذرات المعادن ، التي تتخلى عن الإلكترونات الخارجية ، تتحول إلى أيونات موجبة:
حيث n هو عدد الإلكترونات في الطبقة الخارجية للذرة ، المقابلة لرقم مجموعة العنصر الكيميائي.
2. ذرات غير فلزية تقبل الإلكترونات المفقودة قبل اكتمال طبقة الإلكترون الخارجية، إلى أيونات سالبة:

3. تنشأ رابطة بين أيونات مشحونة بشكل معاكس ، وهذا ما يسمىأيوني.

2. تصنيف الأيونات: عن طريق التركيب ، وعلامة الشحنة ، ووجود قشرة هيدراتية.
التصنيف الأيوني:
1. وفقًا لعلامة الشحنة: الكاتيونات (موجبة ، K + ، Ca2 + ، H +) والأنيونات (سالبة ، S2- ، Cl- ، I-).
2. بالتكوين: معقد (،) وبسيط (Na + ، F-)© 2015-2019 الموقع
جميع الحقوق تنتمي إلى مؤلفيها. لا يدعي هذا الموقع حقوق التأليف ، ولكنه يوفر الاستخدام المجاني.
تاريخ إنشاء الصفحة: 2017-12-12