يتحرك جهد الفعل على طول المحور العصبي بسبب الانتشار الطولي للتيار. كل جزء من الغشاء ، يولد دافعًا وفقًا لمبدأ "كل شيء أو لا شيء" ، يثير القسم المجاور بإزالته من الاستقطاب. لفهم آلية انتشار النبضات ، وكذلك الانتقال والتكامل التشابكي ، من الضروري فهم مبدأ الانتشار السلبي للنبضات على طول العصب.
أثناء تحركه على طول المحور العصبي أو التغصنات ، يفقد التيار قوته. يعتمد الانخفاض في القيمة الحالية على عدد من الأسباب ، في المقام الأول على قطر وخصائص غشاء الألياف العصبية. يكون انتشار التيار الطولي أكبر ، وكلما زاد قطر الألياف وزادت مقاومة الغشاء. تؤثر الخصائص السعوية للغشاء على المسار الزمني للإشارات الكهربائية ، فضلاً عن انتشار التيار. لتقدير المسافة التي يمكن أن تنتشر فيها إمكانات العتبة الفرعية ، من الضروري معرفة هندسة وخصائص غشاء الخلايا العصبية ، بالإضافة إلى المسار الزمني للتغيير المحتمل.
محاور لأنواع عديدة من الخلايا العصبية في الفقاريات مغطاة بغلاف من المايلين ، الذي يتمتع بمقاومة عالية وسعة منخفضة. يلعب غمد المايلين دور اللف العازل للسلك ويجبر التيار على التحرك على طول الغشاء. في هذه الحالة ، ينتقل التيار بسرعة من إحدى عقدة Ranvier (جزء قصير من الغشاء خالي من المايلين) إلى عقدة أخرى ، وتزداد سرعة التوصيل. تم العثور على الألياف النخاعية في مناطق من الشبكة العصبية حيث تلعب سرعة التوصيل دورًا مهمًا.
يمكن أيضًا أن تنتقل الإشارات الكهربائية من خلية عصبية إلى أخرى في أماكن الاتصال الوثيق بينها ، تسمى تقاطعات الفجوة. يتدفق التيار في مثل هذه الوصلات عبر قنوات خاصة ، وصلات.
الخواص الكهربائية السلبية للأغشية العصبية والعضليةتمت مناقشة ميزات نفاذية الأغشية العصبية وكيفية مساهمتها في توليد إمكانات العمل في الفصول السابقة. في هذا الفصل ، سوف نركز بشكل أساسي على كيفية انتشار التيارات على طول الألياف العصبية وتشكيل اختلافات محتملة محلية.
تلعب الخواص الكهربائية السلبية للخلايا العصبية ، أي مقاومة الغشاء وسعته ، بالإضافة إلى مقاومة السيتوبلازم ، دورًا مهمًا في إرسال الإشارات العصبية. في أعضاء الإحساس ، هذه الخصائص هي الرابط بين التحفيز الحسي وتوليد النبضات ؛ على مستوى المحور العصبي ، فإنها تسمح للاندفاع بالانتشار ؛ على المستوى المشبكي ، يحددون قدرة الخلايا العصبية بعد المشبكي على إضافة وطرح إمكانات التشابك التي تحدث عند مدخلات متشابكة متعددة ، سواء بالقرب من جسم الخلية أو في التشعبات الأبعد. لفهم هذه العمليات ، تحتاج إلى معرفة مبادئ انتشار الإشارات الكهربائية على طول العمليات العصبية. في هذا الفصل ، سنركز بشكل أساسي على الألياف العصبية ذات القطر الثابت طوال طولها ، أي على الموصلات الأسطوانية. بالإضافة إلى ذلك ، بالنسبة لهذا الوصف ، سنفترض أنه في حالة عدم وجود تجديد ، يكون الغشاء سلبيًا بالفعل ، أي أن التغييرات المحتملة التي لا تصل إلى مستوى العتبة لا تنشط الموصلات المعتمدة على الجهد وبالتالي لا تغير مقاومة الغشاء . تنطبق هذه المبادئ أيضًا على الهياكل الأكثر تعقيدًا مثل العرش المحوري أو العرش المتفرعة ذات الخصائص الكهربائية غير المنتظمة. إن دور هذه الهياكل في عمل الجهاز العصبي مهم للغاية ، لكن الوصف الكمي لخصائصها الكهربائية يتطلب تحليلًا أكثر تعقيدًا.
خصائص الكابلات للألياف العصبية والعضلية
تتكون الألياف العصبية الأسطوانية من نفس مكونات كبل كهربائي تحت الماء: موصل أساسي وغمد عازل محاط بوسط موصل. ومع ذلك ، فإن الاختلاف الكمي بين هذين النظامين كبير جدًا. عادة ما يكون قلب الكبل مصنوعًا من النحاس أو المعدن ذي الموصلية العالية جدًا ، بينما يكون الغلاف مصنوعًا من البلاستيك أو مواد أخرى ذات مقاومة عالية جدًا. بالإضافة إلى ذلك ، عادة ما تكون القشرة سميكة جدًا وبالتالي فهي ذات سعة منخفضة. يمكن أن ينتقل الجهد المطبق على مثل هذا السلك عبر مسافة كبيرة نظرًا لحقيقة أن مقاومة النحاس صغيرة ، مثلها مثل الخسائر عبر الغلاف. محتوى الألياف العصبية هو محلول ملحي ، مشابه في التركيز للبيئة خارج الخلية ، وعلى عكس النحاس ، لديه توصيل ضعيف. غشاء الخلية ، بدوره ، ليس عازلًا جيدًا ولديه سعة عالية بسبب سمكه الصغير. لا يمتد الجهد المطبق على الألياف العصبية لمسافة كبيرة لسببين:
1) موصلية محتوى الألياف صغيرة ، وبالتالي فإن المقاومة الحالية كبيرة ؛
2) يتبدد التيار المتدفق على طول السيتوبلازم بسبب التسرب عبر الغشاء ، والذي لا يوفر عزلًا كافيًا.
بدأ اللورد كلفن تحليل تيار الكابلات فيما يتعلق بالاتصالات الهاتفية عبر المحيط الأطلسي وقام بتحسينه أوليفر هيفيسايد. في نهاية القرن العشرين. كان Heaviside أول من أخذ في الاعتبار أهمية التسرب الحالي من خلال غلاف عازل مكافئ لغشاء الخلية ، كما قام بالعديد من الإضافات المهمة لنظرية الكابلات ، بما في ذلك مفهوم المعاوقة. تم استخدام نظرية الكابلات لأول مرة للألياف العصبية بواسطة Hodgkin and Rushton ، اللذان قاما بشكل تجريبي بقياس انتشار جهد الفعل في محور الكركند باستخدام أقطاب كهربائية خارج الخلية. في وقت لاحق ، تم استخدام الأقطاب الكهربائية داخل الخلايا لإجراء قياسات مماثلة في عدد من الألياف العصبية والعضلية.
القاعدة الأساسية هنا هي قانون أوم: التيار i ، الذي يمر عبر المقاومة r ، يخلق جهدًا ν = ir. أدناه ، سننظر أيضًا في تأثير سعة الغشاء على الحجم والمسار الزمني لانتشار التيار الطولي.
تيار الكابل
من أجل فهم أفضل لمبادئ تدفق التيار عبر كابل ، دعنا نتخيل كيف تنتشر الحرارة على طول قضيب معدني في غلاف عازل للحرارة ، يتم وضعه في وسط موصل (على سبيل المثال ، الماء). إذا تم تسخين القضيب من طرف واحد ، فإن الحرارة تنتشر على طول القضيب ، وعندما تنتشر ، تتبدد جزئيًا في البيئة ، مخترقة من خلال الغلاف. كلما ابتعدت درجة الحرارة عن النهاية الساخنة ؛ مع انخفاض درجة الحرارة ، ينخفض معدل تبديد الحرارة. شريطة أن يكون للبيئة موصلية حرارية عالية ، فإن المسافة التي تنتشر فيها الحرارة ستعتمد بشكل أساسي على معلمتين:
1) من التوصيل الحراري للقضيب
2) على خصائص العزل للقشرة.
يعمل التدفق الحالي في الكبل بطريقة مماثلة. يتسبب الجهد المطبق على أحد طرفي الكبل في تدفق تيار على طول القضيب في الاتجاه الطولي ، والذي يتم فقده جزئيًا عبر الغلاف إلى البيئة. كلما ابتعد الجهد عن النهاية ، قل التيار. ستعتمد المسافة التي سينتشر خلالها التيار على موصلية القضيب ومدى فعالية الغمد في منع فقدان التيار. سيسمح الغلاف ذو المقاومة المنخفضة بتدفق كل التيار إلى البيئة. سيسمح الغلاف ذو المقاومة الأعلى للتيار بالانتقال لمسافة أكبر.
يتم نقل التيار في المحور العصبي بواسطة الأيونات: عندما يتم حقن التيار في الألياف العصبية (مثل محوار جراد البحر) من خلال قطب كهربائي دقيق ، فإن الشحنات الموجبة المحقونة سوف تطرد الكاتيونات الأخرى وتجذب الأنيونات. البوتاسيوم هو أكثر الأيونات الصغيرة وفرة داخل الخلية ، وبالتالي يحمل التيار عبر الغشاء. يتدفق التيار طوليًا على طول المحور العصبي ، وبينما ينتقل ، يُفقد جزء منه بسبب حركة الأيونات عبر الغشاء. في الغشاء ذو المقاومة المنخفضة والموصلية الأيونية العالية ، يُفقد معظم التيار قبل أن يتاح له الوقت لقطع أي مسافة كبيرة. مع مقاومة الغشاء الأعلى ، سينتشر التيار على طول المحور العصبي لمسافة أكبر قبل أن يتبدد في البيئة.
الاستثارة هي قدرة النسيج على الاستجابة للتهيج بتفاعل خاص بالأنسجة. الإثارة هي انتقال الأنسجة المندفعة من حالة الراحة الوظيفية إلى نشاط محدد (لتوليد النبضات العصبية وتوصيل النبضات العصبية ، للأنسجة العضلية - الانقباض ، للأنسجة الغدية - إفراز الغدة). في هذا القسم ، سنلقي نظرة على بنية ووظيفة الأنسجة العصبية والعضلية.
الخلية العصبية هي رابط في السلسلة العصبية. لا تؤدي الخلايا العصبية الفردية ، أو الخلايا العصبية ، وظائفها كوحدات معزولة ، مثل خلايا الكبد أو الكلى. يتمثل عمل 50 مليار خلية عصبية في الدماغ البشري في أنها تتلقى إشارات من بعض الخلايا العصبية الأخرى وتنقلها إلى خلايا ثالثة. يتم دمج الخلايا المرسلة والمستقبلة في دوائر أو شبكات عصبية. يمكن أن ترسل خلية عصبية واحدة مع نظام متفرع من العمليات عند الإخراج (بنية متباينة) الإشارة المستلمة عند الإدخال إلى ألف أو حتى أكثر من الخلايا العصبية الأخرى. وبنفس الطريقة ، يمكن لبعض الخلايا العصبية الأخرى تلقي معلومات إدخال من الخلايا العصبية الأخرى باستخدام توصيلات إدخال واحدة أو عدة أو العديد من توصيلات الإدخال إذا تقاربت المسارات المتقاربة عليها.
تسمى الوصلات الفعلية للخلايا العصبية - نقاط محددة على سطح الخلايا حيث يحدث الاتصال المشابك.المواد الكيميائية التي يتم إطلاقها في نقاط الاشتباك العصبي الناقلات العصبية- إغلاق الدائرة بين الخلايا العصبية الملامسة وهي وسطاء كيميائيون لنقل الإثارة العصبية بين الخلايا العصبية ذات المشابك الكيميائية. لاحقًا ، سوف نتعلم أن الطرق التي يتم بها نقل المعلومات بين الخلايا العصبية يمكن أن تكون مختلفة.
1. الخلايا العصبية هي خلية.
للخلايا العصبية عدد من السمات المشتركة بين جميع خلايا الجسم (الشكل 1).
أرز. 1. خلية عادية (أ) وخلايا عصبية (ب).
مثلهم ، يحتوي العصبون على غشاء بلازما يحدد حدود الخلية الفردية. بمساعدة الغشاء والآليات الجزيئية الموجودة فيه ، تتفاعل الخلايا العصبية مع الخلايا الأخرى وتدرك التغييرات في بيئتها المحلية. بمساعدة الخصائص الانتقائية للقنوات الأيونية الغشائية ونظام النقل الأيوني النشط والسلبي ، تنظم الخلية الضغط الاسموزي داخل الخلايا ، وبالتالي تحافظ على شكلها ، وتضمن أيضًا دخول العناصر المعدنية والمغذيات والغازات إلى الخلية للاحتياجات داخل الخلايا ، يتم إنشاء الإمكانات الكهربائية على غشاء الخلية الذي يقوم عليه وظيفة الخلايا العصبية والخلايا الأخرى. يحيط الغشاء من جميع الجوانب بالمحتويات الداخلية للخلية ، والتي تسمى السيتوبلازم. يحتوي السيتوبلازم على النواة والعضيات السيتوبلازمية الضرورية لوجود الخلية وأداء عملها: الميتوكوندريا ، الأنابيب الدقيقة ، اللييفات العصبية ، الشبكة الإندوبلازمية.
تزود الميتوكوندريا الخلية بالطاقة. باستخدام السكر والأكسجين ، يصنعون جزيئات خاصة عالية الطاقة (ATP) تستهلكها الخلية حسب الحاجة. الأنابيب الدقيقة ، الهياكل الداعمة الرقيقة ، تساعد الخلايا العصبية في الحفاظ على شكلها ويُعتقد أنها تشارك في النقل المحوري. بمساعدة الشبكة الإندوبلازمية - وهي شبكة من الأنابيب الغشائية الداخلية - والهياكل الموجودة عليها - الريبوسومات - تقوم الخلية بتجميع المواد اللازمة لنشاطها الحيوي ، وتوزيعها في الخلية وإفرازها خارجها. تؤدي اللييفات العصبية وظائف الدعم ، وتوفر حركة اتجاهية للأطراف (الفروع الطرفية) للمحاور وهي إحدى الروابط في آلية النقل المحوري (انظر أدناه).
تحتوي نواة الخلية العصبية على معلومات وراثية مشفرة في التركيب الكيميائي للجينات. وفقًا لهذه المعلومات ، تقوم الخلية المكونة بالكامل بتجميع مواد معينة تحدد شكل وكيمياء ووظيفة هذه الخلية طوال حياتها ، نظرًا لأن الخلية العصبية غير قادرة على الانقسام.
على عكس الخلايا الأخرى ، تمتلك الخلايا العصبية حدودًا غير منتظمة: لها عمليات ذات أطوال مختلفة ، وغالبًا ما تكون عديدة ومتفرعة. هذه العمليات هي "أسلاك" حية بمساعدة الشبكات العصبية التي تتشكل. يتم أيضًا تنفيذ وظائف هذه الأسلاك بواسطة أغشية أجسام الخلايا العصبية.
تختلف الشبكات العصبية للكائن الحي للحيوانات والبشر اختلافًا جوهريًا عن الشبكات الكهربائية التقنية (بما في ذلك شبكات الهاتف والتلغراف والإنترنت): فهي لا تحتوي على مولدات مركزية للتيار الكهربائي تغذيها. تنشأ التيارات الكهربائية على الأغشية الجزيئية (الأغشية) للخلايا ، بسبب الخاصية المحددة لهذه الأغشية ، لتوليد الإمكانات الكهربائية باستمرار ، وفي خلايا الأنسجة القابلة للاستثارة (الأعصاب والعضلات) توصلها أيضًا بطولها.
تحتوي الخلية العصبية على عملية رئيسية واحدة - محور عصبي ، تنقل من خلاله المعلومات إلى خلية أخرى ، والعديد من التشعبات ، والتي من خلالها تتلقى الخلية المعلومات الواردة. يمكن أن يتفرع كل من المحور العصبي والتشعبات ؛ لوحظ تفرع واسع بشكل خاص في التشعبات. على التشعبات وعلى سطح الجزء المركزي للخلية المحيطة بالنواة ، المسمى بجسم الخلايا العصبية ، توجد مشابك مدخلات مكونة من محاور عصبية أخرى. تشكل نهايات المحور العصبي أو فروعه (أطرافه) مثل هذه المشابك على سطح أغشية الخلايا الأخرى. تحتوي هذه النهايات على عضيات تسمى الحويصلات المشبكية ، حيث تتراكم جزيئات الوسيط الذي يطلقه العصبون في المشبك في الخلية المستقبلة. في المحاوير ، لا توجد عضيات خلوية تصنع البروتين ، لذلك تموت هذه العملية الخالية من الاتصال بجسم الخلية.
تسمى العمليات الطويلة للخلايا العصبية بالألياف العصبية.
2. موصل أو مولد التيار الكهربائي؟ الوظائف الكهربية لغشاء الخلية.
إذا تم إدخال مسرى مكروي في ليف عصبي مستريح وإغلاقه في قطب كهربائي ثانٍ تم إدخاله على الجانب الخارجي من الغشاء ، فإن جهاز التسجيل سيُظهر فرقًا محتملاً من 60 إلى 90 ملي فولت ، ويكون الجانب الداخلي من الغشاء سالبًا شحنة ، والجانب الخارجي له شحنة موجبة. يسمى هذا الاختلاف المحتمل في الفيزيولوجيا الكهربية بجهد الراحة (RP). ما هي القوى التي تفصل الشحنات على جانبي الغشاء ، والتي تولد قطبية كهربية؟ تم تقديم إجابة مقنعة على هذا السؤال من قبل العلماء الإنجليز أ.
من أجل فهم جوهر القضية بشكل أفضل ، يجب على المرء أن ينطلق من حقيقة أنه في جسم الحيوانات والبشر ، كل خلية محاطة بمحلول من مزيج من الأملاح المختلفة ، وخاصة الكلوريدات والفوسفات من الصوديوم والبوتاسيوم والمغنيسيوم ، وما إلى ذلك ، وكذلك مركباتها العضوية. تم العثور على نفس المركبات داخل الخلية ، في السيتوبلازم. وإذا كانت الخلية سلبية تجاه هذه الحقيقة ، فلن يكون لها أي عواقب على حياتها ونشاطها ، ولن تكون هناك شحنات حول الغشاء ، لأن تركيز الأملاح وبالتالي أيوناتها على جانبي غشاءها سيكون نفس الشيء. وتجدر الإشارة ، مع ذلك ، إلى أن الحياة نفسها في مثل هذه الحالة ستكون مستحيلة.
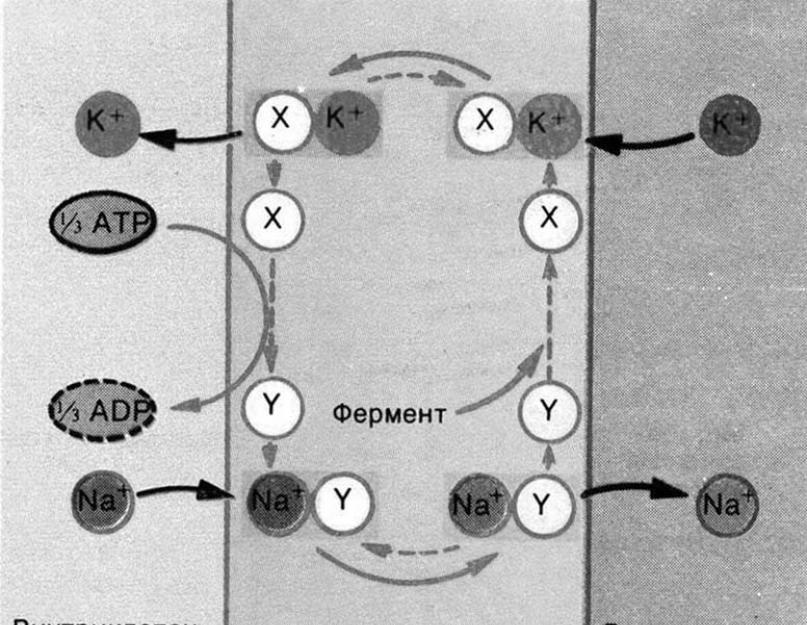
ولكن وجد أن غشاء الخلية لديه القدرة على نقل أيونات البوتاسيوم إلى الخلية وأيونات الصوديوم - للخارج مقابل تدرج التركيز باستخدام نظام النقل النشط. يتم توفير هذه القدرة من خلال عمل مضخات البوتاسيوم والصوديوم المدمجة في الغشاء ، والتي تستخدم طاقة ATP لعملها (الشكل 2).

أرز. 2. مخطط تشغيل المضخة الأيونية.
في دورة واحدة ، تخرج المضخة 3 أيونات Na + من الخلية وتعيد 2 K + أيونات بداخلها ، مما يؤدي إلى إنفاق طاقة جزيء ATP واحد لهذا العمل. بالطبع ، يتم تقسيم جزيء ATP في هذه الحالة بتكوين جزيء ADP وبقايا الفوسفات. وهكذا ، تخلق الخلية كميات غير متوازنة من الصوديوم والبوتاسيوم حول غشاءها: داخل الغشاء ، يتم تكوين تركيز أيونات البوتاسيوم أكبر بـ 30-50 مرة من الخارج ، وأيونات الصوديوم في السائل خارج الخلية أكثر بعشر مرات من السيتوبلازم في الخلية. ومع ذلك ، فإن هذا في حد ذاته يخلق اختلافًا في تركيزات الكاتيونات ، ولكن ليس الشحنات.
يتم توفير الجزء الثاني من عملية الاستقطاب (في الوقت الذي يتم تنفيذه بالتزامن مع الأول) من خلال شبه نفاذية ، أو بعبارة أخرى ، النفاذية الانتقائية (الانتقائية) للغشاء للأيونات المختلفة. في حالة الراحة ، يمر الغشاء بحرية بأيونات K + ، بشكل سيئ للغاية - أيونات Na + وهو غير منفذ تمامًا للأنيونات الكبيرة من الأحماض العضوية والبروتينات. يؤدي الترتيب غير المتوازن لأيونات البوتاسيوم والصوديوم حول الغشاء ، الذي تم إنشاؤه بواسطة مضخات الأيونات ، إلى عملية سلبية - انتشار هذه الكاتيونات على طول تدرج التركيز. داخل الخلية ، تتحرك أيونات البوتاسيوم نحو الغشاء ، وتتجاوز الأيونات السالبة الأقل حركة ، وتصل إلى جانبها الخارجي. نتيجة لذلك ، يتم إنشاء شحنة كهربائية سالبة على الجانب الداخلي من الغشاء ، وعلى جانبها الخارجي ، فإن الشحنة الموجبة الناتجة عن أيونات الصوديوم ويقدر فرق الجهد المقدر بينها بـ 80-100 مللي فولت. انتشار أيونات الصوديوم في الخلية أضعف بكثير (25 مرة) من البوتاسيوم ، لكنه لا يزال موجودًا ويسبب نفس التأثير ، ولكنه موجه داخل الخلية ، ونتيجة لذلك يقلل إلى حد ما من إمكانات البوتاسيوم المحسوبة للغشاء. لذلك ، فإن جهد غشاء الراحة الناتج (RP) هو 50-90 مللي فولت. (تين. 3)

أرز. 3. الشحنة الكهربائية للغشاء.
ستؤدي تدفقات الانتشار المماثلة لأيونات الصوديوم والبوتاسيوم حتماً إلى معادلة تركيزات الأيونات على جانبي الغشاء. ومع ذلك ، لا يحدث هذا في الخلية الحية ، لأن مضخات الأيونات تنقل الأيونات باستمرار ضد التدرجات الحالية ، وتحافظ على تركيزها وتدرجاتها الكهروكيميائية ، وبالتالي ، إمكانات الراحة. ربما تكون هذه إحدى العلامات الوظيفية الرئيسية والأكثر أهمية للحياة. وقف عمل المضخات الأيونية في غشاء الخلية يعني وقف جميع العمليات الحيوية أي موت الخلية.
3. مكهرب حياة الخلايا. دور إمكانات الراحة في حياة الخلية.
لماذا تحتاج الخلية العادية للكهرباء؟ من المعروف أنه في جسم الإنسان والحيوان ، بالإضافة إلى الأعصاب والعضلات ، توجد خلايا الجلد والأعضاء الداخلية والأنسجة المحيطة. لقد ثبت أن كل منهم لديه إمكانات غشاء ، على التوالي ، من 15 إلى 50 مللي فولت. وبالتالي ، فإن الخلايا العصبية ليست محتكرة فيما يتعلق بوجود الإمكانات الكهربائية فيها ، وبالتالي استخدام الكهرباء في نشاط حياتها. لماذا تحتاج الخلايا للكهرباء؟ دعونا نحاول أن نتخيل كيف سيبدو إذا سألنا ، لنقل ، ربة منزل ، لماذا تحتاج إلى الكهرباء؟ أو لماذا يحتاج مصنع صناعي حديث ، على سبيل المثال ، في الطابق الثاني من المبنى ، إلى الكهرباء؟
بالإضافة إلى الماء وبعض الإلكتروليتات التي تمر عبر غشاء الخلية بحرية ، تحتاج الخلية إلى عناصر غذائية مثل السكريات والأحماض الأمينية وبعض العناصر المعدنية التي لا تستطيع اختراق الخلية وفقًا لقوانين الانتشار. في الواقع ، في عملية التطور ، يمكن للخلية الحصول على غشاء يسمح لجميع الأيونات وجزيئات المواد العضوية بالمرور بحرية ، وسيتم حل جميع مشكلات تزويد الخلية بالمغذيات وفقًا لقوانين الانتشار. لماذا لم يحدث هذا بالفعل؟ أولاً ، وفقًا لقوانين الانتشار ، لا تتحرك الأيونات وجزيئات المواد داخل الخلية إلا إذا كانت أكثر تركيزًا في الخارج ، وثانيًا ، لا يتحمل النشاط الحيوي للخلية الانقطاعات في توفير المادة الضرورية ، والتي يمكن أن تحدث من وقت إلى آخر. الوقت بسبب تناقصه في البيئة.ثالثًا ، المحاذاة على جانبي غشاء الخلية لمنتجات التمثيل الغذائي الضارة بالخلية لن يكون لها تأثير ضار على الخلية فحسب ، بل ستقلل أيضًا من تركيز المواد الضرورية للخلية في البيئة الخارجية ، مما يتسبب في تدفقها العكسي من الخلية. تبين أن المصالح الحيوية للخلية غير متوافقة مع عنصر "السوق" هذا ، وتطور الخلية جعل غشاءها قابلاً للاختراق بشكل انتقائي لبعض الأيونات ومنحها مركبات نشطة لـ "استيراد" مواد أخرى إلى الخلية ، مثل وكذلك "لتصدير" المنتجات الأيضية التي لا تحتاجها من الخلية. لم يكن على الخلية أن تختار نوع الطاقة لتضمن تشغيل وسائل النقل: فالكهرباء كانت معروفة لها قبل ملايين السنين من العالم اليوناني القديم تاليس ، الذي أشار إلى قدرة العنبر المفرك بالحرير على جذب الأشياء الخفيفة. و
تُبنى جزيئات البروتين الحاملة في غشاء الخلية كمركبات ، وتقوم بنقل العناصر الغذائية إلى الخلية بالطريقة التالية (الشكل 4).

أرز. 4. مخطط النقل الغشائي.
على السطح الخارجي للغشاء ، يربط جزيء البروتين الحامل جزيء مغذي وأيون الصوديوم بنفسه ، وبالتالي يكتسب شحنة موجبة. المجال الكهربائي للغشاء ، الذي يحول الجزيء الحامل حول محوره الافتراضي ، يوجه قطبه الموجب الشحنة إلى داخل الغشاء. هنا يفقد أيون الصوديوم شحنته ويترك الخلية الحاملة ، مما يؤدي إلى التخلص من الجزيء المحايد من المغذيات المنقولة منه. يبقى المغذي داخل الخلية ، بينما يتم ضخ الصوديوم للخارج ، مما ينتج عنه شحنة موجبة على السطح الخارجي للغشاء.
توجد بروتينات حاملة مختلفة لنقل مختلف السكريات والأحماض الأمينية إلى الخلية ، ولكن جميعها تستخدم أيونات الصوديوم وغشاء الراحة المحتمل في الخلايا الحيوانية. تستخدم البكتيريا أيونات الهيدروجين بدلاً من الصوديوم
يتم استخدام النقل الكهربائي لإزالة بعض المواد من الخلية ، ويكون الكالسيوم الزائد في الخلية ، إذا لم تتمكن مضخة الكالسيوم من التعامل مع إزالته ، أمرًا خطيرًا. تم تنشيط نظام الطوارئ بالخلية. في هذه الحالة ، يربط بروتين حامل خاص أيون الكالسيوم بالجزء داخل الخلايا ، وثلاثة أيونات الصوديوم بالخارج. يقوم المجال الكهربائي للغشاء بتدوير الجزيء الحامل بمقدار 180 درجة ويتم التخلص من الكالسيوم. على عكس مضخات البوتاسيوم والصوديوم ، التي تستخدم طاقة ATP لعملها وفي نفس الوقت تخلق مجالًا كهربائيًا (إمكانات كهربائية) على الغشاء ، تعمل البروتينات الحاملة المذكورة أعلاه كمحركات كهربائية تستخدم الطاقة الكهربائية للغشاء المحتملة لعملهم.
ترتبط آليات النقل النشط للمغذيات إلى الخلية بالضرورة بحياتها ، ولا شك في أنها يجب أن تكون قد نشأت جنبًا إلى جنب مع ظهور الخلية. يعد نقل الإشارات من خلية إلى أخرى حاجة لاحقة للتطور ، لذلك من المعقول أن نفترض أنه عند ظهور مثل هذه الحاجة ، فإن الخلايا العصبية ، بعد تعديل غشاءها إلى حد ما ، تستخدم إمكانات الغشاء لوظيفة جديدة - نقل الإشارة. ماذا كان هذا التعديل؟
4. التغيرات في إمكانات الغشاء. إمكانات العمل.
في عام 1939 ، قام موظفو المحطة البحرية في بليموث (إنجلترا) أ. المعدات في ذلك الوقت. اتضح أنه في حالة السكون ، يكون فرق الجهد على الغشاء حوالي 80 مللي فولت ، وعند الإثارة ، لا يفرغ الغشاء ، كما افترض برنشتاين ، ولكنه يعيد الشحن: شحنته السالبة في الخارج ، والشحنات الموجبة في الداخل. في هذه الحالة ، يظهر فرق جهد يبلغ حوالي 40 مللي فولت على الغشاء. هذا يعني أنه عند الإثارة ، لا تتغير الإمكانات بقيمة RI ، أي لا تنخفض إلى الصفر ، ولكن بمجموع PP والإمكانات الناشئة حديثًا مع الإشارة المعاكسة (الشكل 8). كان يسمى هذا الفائض من PD على PP تجاوزًا (تجاوز اللغة الإنجليزية - فائض).
من أجل شرح هذه الإمكانية "الإضافية" ، طرح هودجكين وهكسلي فرضية ، كان جوهرها أنه عند الإثارة ، لا يفقد الغشاء تمامًا نفاذه الانتقائي فحسب ، بل يغيره: من كونه قابلًا للنفاذ بشكل أساسي لأيونات K + ، يصبح الغشاء منفذاً بشكل أساسي لأيونات الصوديوم. ونظرًا لوجود المزيد من الأخير خارج الغشاء ، فإنهم يندفعون إلى الداخل ويعيدون شحن الغشاء.
تم إجراء الاختبار الأول للفرضية بواسطة A.Hodgkin و B. Katz بعد انقطاع طويل بسبب الحرب في عام 1949. أظهرت الدراسات أن سعة AP تعتمد على التغيير في تركيز أيونات الصوديوم بنفس الطريقة التي تعتمد بها قيمة PP على تركيز أيونات K + ، أي يطيع صيغة نيرنست.
بعد ذلك ، كان من الضروري معرفة كيف تتغير نفاذية غشاء البوتاسيوم والصوديوم فعليًا أثناء الإثارة ، وعلى أي ظروف تعتمد هذه التغييرات. اقترح هودجكين وهكسلي أن نفاذية الغشاء تتحدد بشرطين: إمكانات الغشاء والوقت المنقضي منذ التغيير في الجهد. كانت نتيجة التحقق الطويل والشاق من هذا الافتراض تأكيدًا تجريبيًا على أن آلية جميع الظواهر المرتبطة بالإثارة تستند بالفعل إلى خاصية الغشاء: نفاذية انتقائية متغيرة لأيونات البوتاسيوم والصوديوم. تم إنشاء نظرية لحدوث AP في ظل ظروف مختلفة وحالات أولية للغشاء ، أي "نظرية الغشاء الحديثة" ، وتسمى أيضًا نموذج X-X. أعاد النموذج بشكل صحيح إنتاج ظواهر مثل الانكسار ، وعتبة الإثارة ، وفرط استقطاب الألياف بعد النبض ، وما إلى ذلك.
ومع ذلك ، لا تزال الأسئلة بلا إجابة: ما هي آلية تغيير نفاذية الغشاء ، وكيف يتم ترتيب هذا القسم الرفيع؟ بدأ الاختراق في أسرار بنية الغشاء وآلياته الوظيفية لاحقًا ، عندما ظهر علم جديد - البيولوجيا الجزيئية.
هيكل الغشاء. الغشاء السيتوبلازمي عبارة عن غشاء جزيئي سلبي يتكون من طبقتين من جزيئات الدهون ؛ يحتوي على جزيئات بروتينية تؤدي الوظائف النشطة للقنوات والمضخات الأيونية ، والجزيئات الحاملة ، والمستقبلات ، وما إلى ذلك في الغشاء. الطبقة ثنائية الجزيئية من الدهون تعزل الخلية عن البيئة وهي أيضًا عازل كهربائي. يتم إجراء اتصال الخلية بالبيئة وجميع الوظائف النشطة لغشاءها بمساعدة جزيئات البروتين المضمنة في الغشاء (الشكل 5)

أرز. 5. الغشاء البلازمي للخلية
توفر جزيئات بروتينية معينة قدرة الحساسية الموضعية للغشاء لتأثيرات المنبهات والاستجابة المناسبة لهذه التأثيرات. يتكون التعديل التطوري لغشاء الخلية العصبية من إنشاء آليات لتغيير موضعي في إمكانات الغشاء على الغشاء ، متبوعًا بانتشار يشبه الموجة لهذا التغيير على طول الغشاء. القدرة الأخيرة تمتلكها أيضًا أغشية الخلايا للأنسجة الأخرى.
القنوات الأيونية. يتم تحديد الخواص الكهربائية النشطة لغشاء الخلية بواسطة جزيئات البروتين الموجودة فيه ، والتي تشكل "مسامًا" في الغشاء الدهني تكون متجانسة وغير منفذة للجزيئات والأيونات ، والتي يمكن لهذه الجسيمات أن تمر من خلالها في ظل ظروف معينة. تسمى تلك المسام التي تمر من خلالها أيونات البوتاسيوم والصوديوم قنوات أيونات البوتاسيوم والصوديوم ، على التوالي.
تتكون القنوات الأيونية من فئة خاصة من جزيئات البروتين قادرة على تمييز أيوناتها وفتح أو إغلاق مسارها عبر الغشاء تحت تأثير جهد الغشاء المناسب. اكتشف عالم الفيزياء الحيوية الإنجليزي ب. هيل أن قطر قناة البوتاسيوم يبلغ حوالي 0.3 نانومتر ، في حين أن فجوة مرور الأيونات أكبر قليلاً بالنسبة لقناة الصوديوم. على عكس قناة الصوديوم K + ، فإنها تفتقر إلى آلية تعطيل. وتجدر الإشارة إلى أن مرور هذا أو ذاك إلى القناة لا يتحدد بقطر الأخير ، بل بخصائصه الوظيفية وإمكانات الغشاء الكهربائية.
يمكن تخيل القناة الأيونية على أنها أنبوب من خلال مدمج في الغشاء (الشكل 6)

أرز. 6. مخطط القناة الأيونية.
بالقرب من الطرف الخارجي ، يحتوي الأنبوب على "مصراع" أو "بوابة" ، يتم التحكم في موضعه بواسطة جهد الغشاء ، ويتم شحن "المصراع" ، وبالتالي ، عندما تتغير الإمكانات (أثناء إزالة الاستقطاب) ، يمكن أن يفتح مدخل القناة للأيون المقابل. يُعتقد أن بوابات القناة عبارة عن مجموعة مشحونة من ذرات جزيء بروتين يمكن أن تتحرك في مجال كهربائي ، مما يفتح الطريق أمام أيونات البوتاسيوم أو الصوديوم. يجب أن يكون إزاحة هذه المجموعة المشحونة مصحوبًا بتيار كهربائي صغير مؤقت ؛ تم تسجيل هذا التيار في قنوات الصوديوم في التجربة وسمي "تيار البوابة"). عند دراسة قنوات الصوديوم ، تبين أن آليات البوابة وتعطيلها تقع في نهايات مختلفة من القناة. بعد إزالة النهاية الداخلية للقناة باستخدام إنزيم برونز ، استمرت القناة في فتح بوابة الصوديوم تحت تأثير إزالة الاستقطاب ، لكنها لم يتم تعطيلها.
تم تحديد كثافة قنوات الصوديوم في الغشاء. كان هناك حوالي 50 منهم لكل ميكرومتر مربع من الغشاء (مثل هذه المنطقة من الغشاء يمكن أن تستوعب عدة ملايين من جزيئات الدهون).
بالإضافة إلى قنوات البوتاسيوم والصوديوم ، تحتوي أغشية الخلايا على قنوات للكالسيوم والكلوريد وأيونات أخرى. يفسر التغيير التدريجي في نفاذية الغشاء ، على سبيل المثال ، أيونات البوتاسيوم ، من خلال حقيقة أن القنوات المقابلة ، بالإضافة إلى الحالات "المفتوحة" و "المغلقة" ، لها بعض الحالات الأخرى ، أي أن القنوات تتميز بالطبيعة الاحتمالية للعمل والتي تم تأكيدها تجريبياً. في البداية ، كان يُفترض أن القناة الأيونية هي آلية بيولوجية مستقرة مدمجة في الغشاء وتعمل لفترة طويلة ، ولكن فيما بعد اتضح أن قنوات البروتين تعمل فقط لمدة يوم تقريبًا ، ثم يتم تفكيكها و يحل محله الريبوسومات المركبة الأخرى للخلية وفقًا لأوامر الرنا المرسال. لقد وجد أن بروتينات القناة لا يتم إدخالها بشكل عشوائي في الغشاء ، حيث يتم نقل القنوات الأيونية المختلفة بواسطة الخلية إلى المكان الصحيح تمامًا.
بالإضافة إلى القنوات التي يتم التحكم في فتحها وإغلاقها بواسطة إمكانات الغشاء الكهربائي ، هناك قنوات أيونية يتم التحكم فيها بواسطة مواد كيميائية (وليس فقط الناقلات العصبية في المشابك) التي تعمل على الغشاء خارج الخلية وداخلها. على سبيل المثال ، تؤدي زيادة تركيز الأدينوزين أحادي الفوسفات (cAMP) في بعض الخلايا العصبية إلى فتح القنوات وإزالة استقطاب الخلية ، ويحفز الأدرينالين زيادة هذا التركيز. لا يمكن للخلية التحكم في تشغيل القنوات الأيونية فحسب ، بل يمكنها أيضًا تعديلها وتغيير خصائصها من خلال التفاعلات الكيميائية الحيوية التي يتم التحكم فيها. تحدث مثل هذه العمليات ، على سبيل المثال ، أثناء التدريب.
التغييرات المحتملة الغشاء . يمتلك غشاء الخلية القدرة على الاستجابة للتهيج عن طريق تغيير إمكانية الراحة - وهي عملية سريعة النمو لإزالة الاستقطاب الموضعي. تعتمد درجة إزالة الاستقطاب على شدة المنبه ، وفي الخلايا العصبية والعضلية يمكن أن تنتهي باختفاء كامل قصير المدى لإمكانات الغشاء في منطقة التنبيه ، يليه انعكاس القطبية ثم عودة الاستقطاب ، أي استعادة الحالة الأصلية. تسمى هذه الظاهرة بإمكانية الفعل. يُطلق على مستوى إمكانات الغشاء التي تؤدي عندها زيادة أخرى في قوة التحفيز والمزيد من الاستقطاب إلى إمكانية فعلية اسم العتبة ، ويُطلق على الحافز المقابل اسم العتبة.
مستويات إزالة الاستقطاب من الغشاء. إذا كانت قوة التحفيز المؤثر على الغشاء لا تتجاوز 0.5 من قيمة التحفيز العتبة ، فسيتم ملاحظة إزالة الاستقطاب من الغشاء فقط أثناء عمل المنبه. هذه الظاهرة تسمى الجهد الكهربائي (الشكل 7)
أرز. 7. الجهد الكهربائي.
النفاذية الأيونية للغشاء عمليا لا تتغير. مع زيادة قوة الحافز إلى 0.9 عتبة ، تستمر عملية إزالة الاستقطاب على طول منحنى على شكل حرف S ، وتستمر في الزيادة لبعض الوقت بعد توقف المنبه ، ولكن بعد ذلك تتوقف ببطء. يسمى رد فعل غشاء الخلية هذا بالاستجابة الموضعية. الاستجابة المحلية غير قادرة على التكاثر. ومع ذلك ، عند تطبيق عدة محفزات عتبة فرعية بفاصل زمني أقل من مدة استجابة موضعية واحدة ، يتم تلخيص الأخير ويزداد استقطاب الغشاء ، والذي يمكن أن يؤدي في الخلايا العصبية والعضلية إلى ظهور جهد فعل. لا يمكن للخلايا الظهارية توليد جهد فعل. رد فعلهم على عمل منبه من أي قوة يقتصر على استجابة محلية.
عندما يتعرض غشاء التحفيز لقوة عتبة أو فوقية ، تنخفض إمكانات الغشاء بمقدار 20-40 مللي فولت مقارنة بإمكانية الراحة ، أي يصل إلى بعض القيمة الحرجة. إذا لم تنخفض قوة التحفيز في نفس الوقت ، فإن المسام (القنوات) الخاصة بأيونات الصوديوم تفتح فجأة في الغشاء ، وتزداد نفاذية هذه الكاتيونات بعشرات ، بل مئات المرات. على طول التركيز والتدرجات الكهروكيميائية ، تندفع أيونات الصوديوم إلى الخلية مثل الانهيار الجليدي ، وتحمل شحنة موجبة معها. على الجانب الخارجي من الغشاء في مكان متحمس ، بدلاً من الشحنات الإيجابية ، يتم إنشاء الشحنات السالبة بسبب وجود الأنيونات الكبيرة من الأحماض العضوية والبروتينات. يرى الجانب الداخلي من الغشاء هذا التدفق الشبيه بالانهيار من كاتيونات الصوديوم كحقن للتيار الكهربائي بعلامة موجبة.
يؤدي تراكم أيونات الصوديوم على الجانب الداخلي للغشاء أولاً إلى معادلة شحنتها السالبة ، أي إلى إزالة الاستقطاب ، ثم إلى إنشاء شحنة موجبة في هذا المكان: يتم استبدال إزالة الاستقطاب بانعكاس الشحنة (الشكل 8).

أرز. 8. إمكانية العمل.
تصبح إمكانات الغشاء في موقع التحفيز إيجابية. تسمى هذه المرحلة الإيجابية من إمكانات الغشاء التجاوز أو السنبلة ، والارتفاع على المنحنى المحتمل هو 40-50 مللي فولت. بيانياً ، هذا هو الفرع الصاعد لمنحنى جهد الفعل. في هذه اللحظة ، يحدث تعطيل لقنوات الصوديوم ، وتتوقف نفاذية غشاء أيونات الصوديوم ، مما يفسح المجال لزيادة توصيل البوتاسيوم. يؤدي التدفق المتزايد لأيونات البوتاسيوم إلى الخارج إلى استعادة القطبية الأصلية ، مما يتسبب في إعادة استقطاب الغشاء ، ومضخات الصوديوم التي تعمل بعد ذلك ، والتي تضخ أيونات الصوديوم خارج الخلية ، تكمل عملية إعادة الاستقطاب.

أرز. 9. تغيير في استثارة غشاء الألياف العصبية
خلال جهد الفعل.
بيانياً ، تميز هذه العمليات الفرع التنازلي لمنحنى جهد الفعل. يؤدي تدفق أيونات الصوديوم إلى الجانب الخارجي من الغشاء إلى بعض الزيادة في إمكانات الغشاء مقارنة بالإمكانات الأولية. هذا هو ما يسمى ب. "تتبع فرط الاستقطاب" من الغشاء. خلال هذه الفترة ، التي تسمى فترة المقاومة ، يكون الغشاء غير حساس لإعادة التنبيه. هذه الحقيقة لها نتيجتان. أولاً ، عدم حساسية هذا الجزء من الغشاء للتهيج المتكرر لا يسمح للاندفاع من القسم المجاور بالعودة ، وثانيًا ، لا تسبب التيارات الكهربائية عالية التردد إثارة (إمكانات العمل) في العصب ، ولكن تسخن فقط أقسام الأنسجة المقابلة (والعصب نفسه أيضًا).).
يتم تعريف اتساع منحنى جهد الفعل على أنه مجموع قيم إمكانات غشاء الراحة وفائضها - التجاوز بعد انعكاس الشحنة. على سبيل المثال ، مع DP من -80mV وتجاوز +50 mV ، ستكون سعة PD 130 مللي فولت ، ولا تؤخذ علامات مكوناتها في الاعتبار. مدة الـ AP على غشاء الألياف العصبية هي 1-3 مللي ثانية ، والعضلات - حتى 8 مللي ثانية ، وعضلة القلب - 300 مللي ثانية.
تعطيل نظام Na + . في محوار الحبار ، مع إزالة الاستقطاب المستمر ، تبدأ نفاذية غشاء أيونات الصوديوم في الانخفاض بعد 0.5 مللي ثانية ؛ في الخلايا العصبية الفقارية ، تكون هذه الفترة أقل بخمس مرات. يسمى هذا الانخفاض السريع في نفاذية الغشاء لأيونات الصوديوم بالتثبيط. لوحظ الحد الأقصى من نفاذية غشاء أيونات الصوديوم عند مستوى إزالة الاستقطاب حوالي 30-40 مللي فولت أكثر سلبية من احتمالية الراحة. عند الإمكانات الأولية ، تكون 20-30 ملي فولت أكثر إيجابية من إمكانات الراحة ، ونظام الصوديوم معطل تمامًا ولا يمكن لأي إزالة الاستقطاب تنشيطه.
يؤثر التعطيل المحتمل لنظام Na بشكل حاسم على استثارة الخلية في ظل ظروف مختلفة. لذلك ، إذا أصبح PP لخلايا الثدييات أكثر إيجابية من -50 ملي فولت (على سبيل المثال ، مع نقص الأكسجين أو تحت تأثير مرخيات العضلات) ، فإن توصيل الصوديوم يصبح غير نشط تمامًا وتصبح الخلية غير مهتزة. عندما يزيد تركيز Ca 2+ ، تصبح الخلية أقل إثارة ، وعندما تنخفض ، تزداد استثارة الخلية. هذه الزيادة في الاستثارة تكمن وراء متلازمات التكزز والحالات الأخرى المرتبطة بنقص الكالسيوم المتأين في الدم ؛ في هذه الحالة ، تحدث تقلصات وتشنجات لا إرادية للعضلات.
5. حركة الإثارة على طول الألياف العصبية.
وفقًا للمفاهيم الحديثة ، يتم تفسير انتشار الإثارة على طول الألياف العصبية والعضلية من خلال توليد جهود فعل على أغشيتها وتأثير التيارات الكهربائية المحلية الناتجة على الأجزاء المجاورة من الغشاء. في حالة حدوث جهد فعل على أي جزء من الغشاء خلال فترة صعود منحنى AP إلى ذروته (التجاوز) ، يصبح هذا الجزء من الغشاء مولدًا بيولوجيًا للتيار الكهربائي ، وداخله يتدفق تيار موجب إلى الخارج الغشاء في الخلية. مصدر التيار الكهربائي هو التدفق السريع لأيونات الصوديوم عبر الغشاء.
على الجانب الداخلي من الغشاء ، يتدفق تيار كهربائي موجب ، معادل لشحناته السالبة ، نحو مناطق غير مستثارة ، متغلبًا على مقاومة السيتوبلازم ، يتدفق في نفس الوقت إلى جانبه الخارجي ، حيث يتدفق بالفعل نحو المنطقة المثارة ، باستخدام السائل خارج الخلية. سلك (الشكل 9 ، أ).
تستخدم هذه التيارات السيتوبلازم وغشاء الخلية كسلك كهربائي سلبي مع عزل رديء ، وتوضع في بيئة موصلة للكهرباء ، وتسمى كهربائي التيارات. طالما أن قوة هذه التيارات أقل من العتبة ، فإنها لا تسبب إمكانية فعلية وتسمى أيضًا التيارات المحلية. ولكن إذا كانت قوتهم ، حتى مسافة معينة من مكان جيلهم ، على سبيل المثال ، من مكان حدوث AP السابق ، تتجاوز قيمة العتبة عدة مرات ، فإن هذه التيارات تحفز إزالة الاستقطاب في القسم المجاور من غشاء ، متبوعًا بظهور جهد فعل هنا. في المستقبل ، يتكرر كل هذا في القسم المجاور التالي ؛ يتحرك الإثارة في موجات على طول الغشاء. وهكذا ، عندما يتم إرسال إشارة على طول الألياف العصبية ، تحدث عمليتان متفاعلتان. العملية الأولى هي إثارة الغشاء ، أي توليد AP - بسبب محدد ، أي الخصائص الكهربية النشطة لغشاء الخلايا القابلة للاستثارة. الثاني - نقل الإشارة على طول الألياف من المنطقة المثارة إلى المنطقة غير المثارة - هو كهربائي بحت ويرجع إلى خواصه الكهربائية السلبية ، عندما تتصرف الألياف العصبية كموصل سلبي للجهود الكهربائية. يسمى توصيل الإثارة على طول الألياف العصبية باستخدام العملية الأولى بالنبض ، والثاني - بلا نبض أو كهربائي. تحدث طريقة الإرسال غير النبضي في شبكات عصبية معينة ، حيث يلزم إرسالها عبر مسافات معينة قصيرة إلى حد ما (انظر أدناه). أثناء التوصيل النبضي ، تعمل الألياف العصبية مثل سلسلة من أجهزة الترحيل المتصلة بواسطة موصل ، تنتقل على طوله الجهود الكهربائية من مكرر إلى مكرر. ومع ذلك ، نظرًا لأن الألياف العصبية يمكن أن تنقل إشارة بطريقة كهربائية بحتة ، إذن ، أولاً ، لماذا تحتاج إلى مكررات وسيطة ، وثانيًا ، إذا كانت لا تزال هناك حاجة إليها ، فإلى متى يجب أن تكون المسافات بين نقاط الترحيل للألياف العصبية يكون؟
طول الألياف العصبية ثابت . على عكس الكبل ذي النواة المعدنية الموجودة في الهواء ، حيث يتم إنفاق الجهد فقط للتغلب على مقاومة النواة نفسها ، في الألياف العصبية ، يتم إنفاق الجهد على مقاومة "قلب" الكبل - axoplasm ، عزله - الغشاء وعلى تسرب التيار عبر مسام الغشاء أثناء السائل خارج الخلية. لذلك ، تنخفض قوة الإشارة الأولية تدريجياً وتضعف الإشارة. يُطلق على طول مقطع الألياف العصبية الذي تتناقص فيه القوة الحالية التي نشأت في موقع الإثارة بعامل e طوله الثابت ويُشار إليه بالحرف اليوناني l-lambda. يشير الحرف e إلى قاعدة اللوغاريتمات الطبيعية ، والتي تبلغ تقريبًا 2.718. في الخلايا العصبية ، يتراوح الطول الثابت للألياف العصبية من 0.1 إلى 5 ملم. على سبيل المثال ، على مسافة 4 لامبدا ، فإن سعة الجهد الكهربائي هي 2 ٪ فقط من الجهد الأولي. وبالتالي ، في الألياف العصبية على مسافة 1 متر ، لن تختفي تمامًا القدرة الكهربية فحسب ، بل وأيضًا الإشارة الناتجة عن AP. لذلك ، من أجل نشر إشارة القوة الأولية ، يجب تضخيمها. لكن بعد كل شيء ، لا يصل طول الألياف العصبية دائمًا إلى متر واحد. في الحشرات الصغيرة ، يبلغ الطول الثابت للألياف العصبية 250 ميكرونًا ، والتي تمثل في ذبابة الفاكهة 20 ٪ من جسمها. وعند هذه المسافة ، ستتلاشى الإشارة الأصلية 2.718 مرة فقط. هذا القدر من التوهين لا يتعارض مع إرسال الإشارة. لكن هذا الطول هو سمة للعديد من الخلايا العصبية في دماغ الفقاريات. تمتلك الحيوانات العليا خلايا عصبية مفتوحة لا تولد AP على طولها ، ولكنها موصلة سلبية للإمكانات الكهربية (الخلايا العصبية الشبكية ، على سبيل المثال).
ثابت الزمن . لذلك ، من أجل تحديد المسافة التي يمكن أن تنتقل عبرها إشارة على طول ألياف عصبية عديمة النبض ، أي طريقة Electrotonic ، في كل مرة تحتاج إلى أخذ وحدة طول - ثابت الطول ، أو ثابت التخميد ( ل) الألياف العصبية.
ومع ذلك ، فإن ثابت التخميد مناسب فقط للتيار المباشر. ولكن مع التيار المباشر ، لا يمكن نقل أي معلومات ؛ هذا يتطلب التيار المتردد. عند تحديد سرعة انتشار الإشارة على طول الألياف العصبية بمشاركة التيار المتردد ، يجب أن يؤخذ في الاعتبار أن غشاءه يحتوي على سعة كهربائية (الشكل 10) ، والتي يجب تفريغها قبل أن تصل ذروة سعة التيار المتردد إلى الحد الأقصى.
لهذا ، يجب إنفاق قدر معين من الوقت. خلال هذا الوقت ، لا يفرغ التيار سعات هذا الجزء من الغشاء فحسب ، بل يتدفق أيضًا للخارج (في الفضاء بين الخلايا). لذلك ، مع تيار متناوب سريع التغير ، ستكون كفاءة تفريغ الغشاء أقل ، وبالتالي فإن الإشارة تتحلل بشكل أسرع.
يتم تحديد معدل اضمحلال الإشارة في هذه الحالة باستخدام ما يسمى. ثابت الوقت (t) يساوي ناتج المقاومة (Rm) للغشاء وسعته المحددة (Cm) ، أي
t = RmCm يتم تحديد ثابت الوقت للجهد الكهربائي بالوقت الذي تصل فيه الإمكانات إلى المستوى 1 / e ، 37٪ من اتساعها النهائي ؛ يعني t = 10 مللي ثانية أنه بالنسبة لليف عصبي معين ، فإن توهين إشارة لمدة 10 مللي ثانية يتناسب مع طولها الثابت (l). سيتم إرسال مثل هذه الإشارة في هذه الألياف عمليًا ، مثل التيار المباشر ، ولكن بالنسبة للألياف العصبية ذات t = 0.5 ثانية (الخلايا العصبية الرخوية) ، ستكون هذه الإشارة "سريعة" بالفعل ، أي سوف تتحلل على مسافة أقصر. في الفقاريات ، في الخلايا المختلفة ، يتراوح ثابت الوقت (t) من 5 إلى 50 مللي ثانية.
وبالتالي ، من أجل إرسال إشارة بطيئة بدرجة كافية مقارنة بثابت الوقت (t) وعلى مسافة مماثلة لثابت التوهين (l) ، فإن الطريقة الكهروترونية (عديمة النبض) لنقل الإشارة مناسبة تمامًا. إذا كانت المسافة التي يجب إرسال الإشارة عبرها أكبر بكثير من ثابت التوهين ، فإن تضخيمها مطلوب ، أي الإرسال مع التوليد المتسلسل لإمكانات العمل - التشوير النبضي. يختار Evolution من بين هذه الطرق الطريقة التي تضمن بأفضل طريقة إرسال إشارة ذات قوة كافية إلى الطرف المتلقي للألياف العصبية ، أو تستخدم كلتا الطريقتين في وقت واحد ، وبالتالي ضمان موثوقية الإشارة.
ومع ذلك ، لضمان الوظيفة الفعالة للألياف العصبية ، لا يلزم الاعتماد على الموثوقية فحسب ، بل يلزم أيضًا الالتزام بمواعيد إرسال الإشارات ، الأمر الذي يتطلب سرعة نقل عالية بما فيه الكفاية.
سرعة الإرسال الكهربائي. تم تقديم هذا المفهوم في عام 1946 من قبل أ. هودجكين وف. راشتون]. بادئ ذي بدء ، كان من الضروري معرفة ما يجب فهمه بسرعة النغمة الكهربائية؟ إذا أخذنا في الاعتبار الوقت الذي تظهر فيه إشارة صغيرة عشوائية في الألياف العصبية على مسافة معينة من موقع التهيج ، فستكون هذه هي سرعة الضوء. ومع ذلك ، لا يمكن استقبال إشارة من هذه القوة المنخفضة ، لأنه في مكان الاستقبال يجب أن يكون لها قوة عتبة ، وبالتالي فإن إشارة هذه القوة والسرعة المشار إليها للنغمة الكهربائية غير مجدية.
خصائص الألياف العصبية ككابل ، غشاءه عبارة عن سلسلة من السعات الكهربائية (الشكل 9 ، أ و 10 ،

أرز. 10. انتشار الإثارة على طول الألياف العصبية.
يوضح أن انتشار إمكانات الغشاء على طول الألياف العصبية يتم عن طريق التفريغ المتتالي لهذه القدرات ، والتي تتطلب تيارًا ذا قوة كافية في كل قسم من الألياف ؛ إلى النقطة التالية ، لا يمكن الوصول إلى تيار بهذه القوة إلا بعد تفريغ السعة السابقة ، ومع تفريغ المزيد والمزيد من السعات البعيدة بالتتابع ، يقترب التوزيع المحتمل من قيمة ثابتة معينة (الشكل 11).

أرز. 11. سرعة انتشار الإثارة على طول الألياف العصبية.
على الرسم البياني ، يتم التعبير عن هذه القيمة من خلال منحنى أسي ، مما يوضح أن مدى سرعة اقتراب نمط التوزيع المحتمل على طول الألياف العصبية من القيمة الثابتة يعتمد على سرعة الوصول إلى نقطة معينة من إشارة الألياف التي يمكن استقبالها. هذه السرعة تعتمد على الوقت الثابت ( ر) وثوابت التخميد ( ل). الاكثر ر, يتدفق التيار الأقل عبر الغشاء إلى السائل بين الخلايا المحيط بالألياف لكل وحدة طول من الغشاء ، وبالتالي ، كلما كان التيار المتبقي أسرع في تفريغ السعة التالية ، وكلما زادت السعة (وبالتالي ل) ، سيكون أبطأ تفريغه ، وبالتالي تقريب المنحنى المحتمل في هذا القسم إلى قيمة ثابتة.
المنحنى الأسي في الشكل. يوضح الشكل 2-11 أنه من المستحيل تحديد السرعة في اللحظة التي يتم فيها الوصول إلى القيمة الثابتة للإمكانات في نقطة ما ، لأن وقت الوصول إليه يميل إلى اللانهاية. لذلك ، اختار هودجكين وراشتون تعريفًا مشروطًا لسرعة النغمة الكهربائية. للقيام بذلك ، استخدموا أسًا مضغوطًا مرتين للقيم الثابتة لإمكانات الغشاء (في الشكل 2-11 ، يشار إليها بالصلبان). يمكن ملاحظة ذلك عند نقطة البداية أتصبح الإمكانية مساوية لـ 0.5 من القيمة الثابتة في وقت أبكر مما هي عليه عند نقاط أخرى من الألياف ، وتزيد هذه المرة بشكل موحد بمقدار 0.5 رعلى مسافة في لوبالتالي ، فإن معدل إرسال الإشارات الكهروتونينية هو المعدل الذي ينتشر فيه نصف القيمة الثابتة لإمكانات الغشاء على طول الألياف العصبية. يتم التعبير عنها بالصيغة: V = 2 ل/ر، بمعنى آخر. يساوي ضعف الطول الثابت للغشاء مقسومًا على ثابت وقته.
إذا قبلت ل= 2.5 مم و ر\ u003d 50 مللي ثانية ، ستكون سرعة النغمة الكهربائية 100 مم في الثانية.
من أجل انتشار الإشارات الكهروتونية في ليف عصبي حقيقي ، يجب مراعاة التفاصيل المهمة: يجب أن يكون اتساع إمكانات الغشاء الأولي أقل من العتبة. تؤدي القيمة فوق العتبة لإمكانات الغشاء على الفور إلى جعل الغشاء في حالة من الإثارة ، أي يتسبب في إزالة الاستقطاب ، يليه توليد جهد فعل ، وهو ما نلاحظه في الألياف العصبية العادية].
نبض التوصيل من الإثارة . يحدث توصيل النبضة العصبية على طول الألياف العصبية نتيجة لعمليتين متناوبتين: النشط - إثارة الغشاء والسلبي - نقل الجهد الكهربائي على طول الجزء غير المتحمس من الألياف. لذلك ، فإن سرعة النبضات الموصلة على طول الألياف هي قيمة مركبة وتتكون من سرعة النغمة الكهربائية والوقت الذي يقضيه في توليد إمكانات الفعل. كلما زادت سرعة النغمة الكهربائية ، زادت سرعة انتشار الإشارة على طول الألياف التي لا تزال غير متحمسة ، مما يحافظ على القيمة الفائقة ، أي قيمة قادرة على تحفيز توليد إمكانات فعلية. وهذا بدوره يعتمد على الخصائص النشطة للألياف: عامل الأمان ومعدل توليد النبض.
عامل الأمان هو نسبة اتساع جهد الفعل إلى عتبة الإثارة للألياف. من الواضح أنه كلما زادت سعة AP وانخفضت عتبة إثارة الغشاء ، زادت المسافة التي تستطيع AP تنشيط الجزء غير المتحمس من الغشاء. وأخيرًا ، كلما تقدمت عمليات توليد AP بشكل أسرع ، كلما كان التأخير الزمني لإعادة الإرسال أقصر ، وبالتالي زادت سرعة التوصيل.
ما هي الفرص التي كان لدى التطور لزيادة سرعة توصيل الإثارة على طول الألياف العصبية؟
لا يمكن زيادة سعة AP بشكل كبير لسببين مهمين. أولاً ، لهذا سيكون من الضروري زيادة الفرق في تركيز أيونات البوتاسيوم داخل الألياف وخارجها مئات المرات ، وبالتالي زيادة تكاليف الطاقة لمضخات الأيونات ، والتي ستكون غير متناسبة مع النتائج المحققة ، وثانيًا ، لإهمال قدرات الغشاء الذي لا توجد حياة في الطبيعة بشكل عام. النقطة هنا هي هذا. تبلغ سعة AP حوالي 0.1 فولت ، نظرًا لسمك الغشاء (10 نانومتر) ، تكون شدة المجال عليه 109 فولت.إذا زادت سعة AP عدة مرات ، فسيتم ثقب الغشاء. من المستحيل أيضًا تقليل عتبة الإثارة بشكل كبير ، لأن. يجب أن يكون فوق مستوى التقلبات الطبيعية لإمكانات غشاء الراحة ، ما يسمى. تتدفق "ضوضاء" الغشاء المرتبطة بالحركة غير المتساوية لأيون K + عبر الغشاء.
لذلك ، تحت تصرف التطور طريقتان لزيادة معدل انتشار الإثارة في الألياف العصبية: إما عن طريق تغيير قطرها ، أو عن طريق زيادة المسافة بين نقاط توليد AP ، أي محطات الترحيل للألياف العصبية.
رأينا أعلاه أن معدل الانتشار الكهربائي للإمكانات يتناسب مع الجذر التربيعي للقطر ، أي أنه عندما يتضاعف قطر الألياف أربع مرات ، فإن سرعة انتشار الإشارة على طوله سوف تتضاعف: مع قطر ليف يبلغ 200 ميكرومتر ، تكون السرعة 20 م / ث ، مع زيادة قطر الألياف إلى 2 مم ، ستزيد هذه السرعة إلى 60 تصلب متعدد. ومع ذلك ، فإن هذا الأخير في كائن حي معقد يؤدي إلى تشوش الأنسجة بألياف عصبية ذات قطر كبير ، والتي لن تكون غير اقتصادية فحسب ، بل غير عقلانية من وجهة نظر شكل ووظيفة هذه الأنسجة. لذلك ، اختار التطور الطريقة الثانية - طريقة توصيل الملح أو الإثارة بين محطات الترحيل للألياف العصبية المعزولة عن بعضها البعض. تصل سرعة التوصيل النبضي في ألياف النخاع الرقيقة التي يبلغ قطرها 20 ميكرومتر إلى 120 م / ث. كيف يتم ضمان هذه الزيادة في سرعة التوصيل؟
تختلف الألياف الميالينية عن الألياف العادية في أن أقسامها الطويلة إلى حد ما مغطاة بعزل جيد (المايلين). تتناوب هذه المناطق الميالينية بانتظام مع قصيرة (2 ميكرومتر) غير معزولة ، ما يسمى. عُقد رانفييه ، حيث يكون غشاء الألياف فيها خاليًا من العزل. يبلغ طول المقاطع الداخلية حوالي 100 أقطار من الألياف المحددة ؛ يتكون العزل من الخلايا الغنية بالمايلين ، والتي ، مثل الشريط العازل ، تلف الألياف العصبية عدة مرات ، مما يجعل من المستحيل تدفق الأيونات عبر الغشاء في هذه المناطق. في عمليات الاعتراض ، يكون الغشاء متخصصًا لتوليد إمكانات العمل وهو مصدر حالي ؛ كثافة قنوات Na هنا 100 مرة أعلى من كثافة الألياف غير اللحمية (الشكل 12).

أرز. 12. اعتراضات رانفييه.
يصل التيار المتولد في التقاطع دون خسائر كبيرة إلى التقاطع التالي ويتدفق هناك ، ويثير توليد AP على غشاءه ، وهو المصدر الحالي لمنطقة التقاطع التالية. وبالتالي ، عندما يتم إزاحة إمكانات الغشاء ، لا يمر التيار عبر غشاء المناطق الخلالية وينتشر الدافع في هذه المناطق إلكترونيًا ، مع استهلاك وقت صفر تقريبًا (0.05-0.07 مللي ثانية) وتقريباً بدون توهين (بدون إنقاص). يحدث التأخير في التوصيل فقط عند التقاطعات ، حيث يجب أن يصل الجهد الكهربائي إلى قوة العتبة ويتسبب في توليد جهد فعل. لا يوفر جهاز الألياف العصبية هذا سرعة عالية للإثارة فحسب ، بل إنه اقتصادي للغاية أيضًا: تعمل المضخات الأيونية فقط في حالات الاعتراض
اختارت الطبيعة طول القسم الداخلي الذي يساوي 100 أقطار من هذه الألياف. نظرًا لكونه ليس الأفضل من الناحية النظرية ، فهو يضمن التوصيل النبضي حتى في حالة فقد نشاط الغشاء لواحد أو أكثر من اعتراضات. حسنًا ، ماذا عن سماكة العزل؟
حدد Rushton (1951) أن معدل انتشار جهد الفعل في الألياف العصبية سيكون مثاليًا عندما تكون نسبة القطر الداخلي للجزء المايليلي من الألياف إلى قطرها الخارجي 0.6-0.7 ؛ يتم تحديد هذا المؤشر من خلال الصيغة:
إلىبالجملة = 1/2 هـ، حيث K هي نسبة الأقطار ، و ه= 2,718 . أكدت القياسات الفعلية للألياف العصبية الحقيقية بواسطة أخصائيي الأنسجة هذه البيانات.
6. تصنيف الألياف العصبية حسب السرعة.
على أساس دراسات الفيزيولوجيا الكهربية للأعصاب التي حصل عليها Erlanger و Gasser ، يتم تقسيم جميع الألياف العصبية إلى ثلاث مجموعات - A و B و C ، ويتم تمييز أربع مجموعات فرعية في المجموعة A (الجدول 1).
يمكن أن يحتوي العصب على عدد كبير من الألياف العصبية ، تختلف في سرعة التوصيل واتجاه حركة النبضات. على سبيل المثال ، يحتوي عصب الطرف السفلي عند الإنسان على ألياف عصبية تختلف في الوظيفة والقطر وسرعة التوصيل النبضي. يتم تحديد إمكانات عمل هذا العصب من خلال مجموعة كاملة من مجموعات الألياف وسرعات توصيل النبضات العصبية على طولها. عندما يتم تطبيق تهيج يمكن أن يثير الألياف العصبية لجميع المجموعات ، يتم تسجيل جهد الفعل المركب للعصب بأكمله.
الجدول 1. تصنيف الألياف العصبية حسب Erlanger و Gasser].
|
وظائف الألياف |
متوسط قطر الألياف ، ميكرومتر |
متوسط سرعة التوصيل ، م / ث |
|
|
الألياف الحسية والحركية للعضلات الهيكلية |
|||
|
ألياف اللمس والضغط واردة |
|||
|
مغازل العضلات الحركية |
|||
|
الآلام ودرجات الحرارة الحساسة للبشرة |
|||
|
متعاطفة قبل الميلاد |
|||
|
متعاطفة ما بعد العقدة |
على سبيل المثال ، يحتوي عصب الطرف الخلفي على ألياف عصبية ذات وظيفة وقطر وسرعة مختلفة. يتم تحديد إمكانات عمل هذا العصب من خلال مجموعة كاملة من مجموعات الألياف وسرعات توصيل النبضات العصبية. عندما يتم تطبيق تهيج يمكن أن يثير الألياف العصبية لجميع المجموعات ، يتم تسجيل جهد الفعل المركب للعصب بأكمله.
7. توليد الإثارة في المستقبلات.
في الكائن الحي ، يتم تنفيذ تأثير المنبهات الطبيعية في أعضاء حسية خاصة ، والمحفزات هي الضوء والصوت والضغط ودرجة الحرارة والتغيرات في درجة الحموضة في البيئة وما إلى ذلك. تسمى الخلايا التي تميز بين هذه المحفزات وترسل معلومات عنها إلى الجهاز العصبي المستقبلات.
تحت تأثير المنبه على خلية مستقبلية ، يكون غشاء عمليات الإدراك الخاص بها غير مستقطب ، وبقوة تحفيز كبيرة بما فيه الكفاية ، ما يسمى بـ. مستقبلات محتملة. على عكس أغشية الخلايا المثيرة الأخرى ، فإن مدة إمكانات المستقبل تتوافق مع مدة التعرض للمثير ، ويتوافق اتساعها مع شدة التحفيز.
تنتشر إمكانات المستقبل إلكترونيًا إلى قاعدة جسم الخلية المستقبلة ، حيث ينشأ محورها العصبي ، وهنا يتسبب في إزالة الاستقطاب الذي يتجاوز مستوى العتبة ؛ إمكانية العمل يحدث. على وجه التحديد في هذه الحالة ما يلي: منحنى إعادة استقطاب الغشاء في نهاية جهد الفعل ينخفض كثيرًا عن المستوى الأولي ، ويحدث فرط استقطاب الغشاء ، ومنحنى نزع الاستقطاب الذي يحدث مرة أخرى يصل إلى مستوى العتبة: يحدث جهد الفعل التالي. وبالتالي ، فإن الاستقطاب المستمر لغشاء الإدخال لخلية المستقبل الناجم عن التحفيز يؤدي إلى توليد سلسلة من جهود الفعل على غشاء الخرج ، والتي تنتشر بعد ذلك على طول المحور العصبي. تتوافق مدة إصدار سلسلة AP مع مدة عمل الحافز ، ويتوافق تكرار النبضات في السلسلة مع شدة عملها. لذلك يتم نقل إمكانات العمل في شكل رمز تردد إلى الجهاز العصبي المركزي حول حجم ومدة المنبه.
المستقبلات التي تشكل كلاً منفردًا مع محور عصبي لخلية عصبية حساسة تسمى الابتدائية ؛ ترتبط المستقبلات الثانوية بمحور الخلية العصبية عن طريق المشابك ، ويتم تحويل إمكانات المستقبل إلى سلسلة من إمكانات العمل في النهايات المستقبلة (نهايات) للخلية العصبية تحت تأثير الوسيط الصادر عن مستقبل. يتم تحديد مدة وتكرار السلسلة في هذه الحالة من خلال مدة الإصدار ومقدار الوسيط.
8. نقل الإثارة بين الخلايا.
تسمى الهياكل التي تنشأ عند نقطة الاتصال بين نهاية محور عصبي لخلية عصبية وغشاء الخلية التالية (عضلة أو غدية أو عصبية) نقاط الاشتباك العصبي. يتضمن التكوين ، المسمى المشبك ، أغشية الخلايا الملامسة - قبل المشبكي وما بعد المشبكي ، والتي يوجد بينهما مسافة 10-50 نانومتر (100-500 أ) - الشق المشبكي. مثل هذا العرض للفجوة يجعل من المستحيل النقل الكهربائي للإثارة من خلية إلى أخرى بسبب الفقد الكبير للتيار في السائل الخلالي. يمكن أن يلعب الانتقال الكيميائي للإثارة في نقاط الاشتباك العصبي دور الآلية التي تعزز الإثارة. يعتمد على كمية الوسيط المنطلق ، وعلى مدة إطلاقه ، حساسية الغشاء المدرك. كل هذا يمكن تعديله على النحو الأمثل عن طريق التطور ، وبالتالي ، يعمل المشبك على مبدأ الصمام الذي يسمح بإثارة عنصر معين شدة بالمرور.
الأهمية البيولوجية لنقاط الاشتباك العصبي . بدون المشابك كصمامات ، لن يكون النشاط المنظم للجهاز العصبي المركزي ممكنًا. يمكن تعديل كفاءة الإرسال المتشابك. على سبيل المثال ، يتحسن انتقال الإثارة مع الاستخدام المتكرر للمشبك.
تلعب الطريقة المشبكية للوصلات العصبية دورًا مهمًا في تطوير وتشكيل الجهاز العصبي للكائنات الحية في عمليات تكوين النشوء والتكوين. في عملية التكوُّن ، يتطور الجهاز العصبي المركزي للفرد ويتحسن إلى عمر معين عن طريق إضافة خلايا عصبية جديدة وظهور وتأسيس روابط متشابكة داخلية عصبية جديدة بينهما ، وهو ما سيكون مستحيلًا في حالة الثابت الثابت بين الخلايا. الوصلات المورفولوجية.
أخيرًا ، نقاط الاشتباك العصبي هي نقاط تطبيق للعديد من المواد الدوائية التي تمنع انتقال الإثارة ، بما في ذلك المواد ذات الأصل الداخلي التي لها أهمية دوائية وممرضة إيجابية. سيتم مناقشتها عند النظر في وظيفة هياكل الدماغ.
ضع في اعتبارك آلية الانتقال المشبكي على مثال المشبك العصبي العضلي.
مفرق عصبي عضلي مع. من الناحية التخطيطية ، يظهر هيكل المشبك العصبي العضلي في الشكل. 13.
أرز. 13. المشبك العصبي العضلي (الكيميائي).
تشكل محاور الخلايا العصبية الحركية للحبل الشوكي والنواة الحركية للنخاع المستطيل والدماغ المتوسط مشابك مع ألياف العضلات الهيكلية. يتكون الغشاء قبل المشبكي من العديد من الفروع الطرفية للمحور العصبي التي فقدت غمد المايلين. ينتمي الغشاء بعد المشبكي الموجود في منطقة المشبك إلى الألياف العضلية ويسمى الصفيحة النهائية. تحتوي الحويصلات المشبكية في أطراف المحاور السميكة على مادة الأسيتيل كولين الكيميائية.
تحت تأثير جهد الفعل للمحور ، يتم إطلاق أستيل كولين من الحويصلات المشبكية من خلال غشاء ما قبل المشبكي ، والذي ، بعد مروره عبر الشق المشبكي ، يتسبب في إزالة استقطاب الصفيحة الطرفية وظهور إمكانات محلية للوحة النهاية - PCP. هذا الأخير يختلف عن جهد الفعل في عدد من الخصائص. تدوم لفترة أطول ، لأن منحنىها ، الذي يقع على الجانب السلبي من الحد الفاصل ، يتميز بارتفاع حاد لمدة 1-1.5 مللي ثانية وانحدار بطيء ، يستمر 3.5-6 مللي ثانية. لا يطيع PEP قانون الكل أو لا شيء ؛ تعتمد اتساعه على كمية الوسيط المنطلق في المشبك وحساسية الغشاء بعد المشبكي تجاهه. مع تواتر كافٍ لإمكانات العمل التي تصل إلى الغشاء قبل المشبكي ، يتم تلخيص كمية الناقل العصبي المنطلق في المشبك ، وبالتالي ، EPC ، مما يحفز ظهور جهد فعل على غشاء الألياف العضلية.
من أجل الإطلاق الطبيعي للوسيط في المشبك ، من الضروري وجود أيونات الكالسيوم. إن سبب إطلاق الوسيط في الشق المشبكي ليس إزالة الاستقطاب من الغشاء قبل المشبكي نفسه ، ولكن إزالة الاستقطاب يفتح الطريق للكالسيوم في الطرف قبل المشبكي. إذا قمت بإزالة الكالسيوم من البيئة الخارجية ، فلن يعمل المشبك الكيميائي تحت أي إزالة للاستقطاب. تتم دراسة آلية عمل أيونات الكالسيوم 2+ عند إطلاق الوسيط. لقد ثبت أن إطلاقه في المشبك يسبقه زيادة حادة في نفاذية الغشاء قبل المشبكي لأيونات الكالسيوم ، والتي تخترق بسرعة في الطرف قبل المشبكي للمحور. بعد أن تؤدي أيونات الكالسيوم 2+ وظيفتها ، يتم ضخها من المحور العصبي بواسطة مضخات الكالسيوم الأيونية ، والتي يحافظ تشغيلها باستمرار على تركيز غير متوازن لأيونات الكالسيوم حول الغشاء.
يتم توليد الطاقة اللازمة لتشغيل المضخات في الميتوكوندريا للمحطات المحورية ، والتي يتم إنفاقها أيضًا على إعادة تركيب أستيل كولين من الكولين وحمض الخليك في نفس المحطات.
حصار الانتقال العصبي العضلي . يمنع التخدير الموضعي (نوفوكائين) توصيل الإثارة في نهايات العصب قبل المشبكي. يمنع توكسين البوتولينوم إطلاق الوسيط ، لأنه يمنع نفاذية الغشاء قبل المشبكي لأيونات الكالسيوم. تعمل أيونات المغنيسيوم بالمثل على الغشاء. سم الأفعى ، على سبيل المثال ، أ-بونغاروتوكسين ، سم الكيرار يمنع مستقبلات الأسيتيل كولين في الغشاء بعد المشبكي ، بشكل لا رجعة فيه (سم الأفعى) أو بشكل قابل للعكس (سم الكاراري) ، ملزمة لهم. تمنع مركبات الفسفور العضوي في الجرعات السامة إنزيم الكولينستريز ، الذي عادةً ما يكسر الأسيتيل كولين بعد أن يؤدي وظيفته. في الوقت نفسه ، يعمل الإنزيم الذي لم ينقسم بمرور الوقت في المشبك لفترة طويلة بحيث يحدث تعطيل مستقبلات الغشاء بعد المشبكي للوسيط.
تم عزل بروتين يسمى Latrotoxin من سم عنكبوت karakurt ، وهو أساسًا قنوات الكالسيوم غير المغلقة. يتم تضمينه في الغشاء قبل المشبكي ويبدأ في السماح بدخول الكالسيوم إلى الطرف. نتيجة لذلك ، يتم استنفاد احتياطيات الأسيتيل كولين في الطرف تمامًا ولا يمكن للجهاز العصبي أن يتسبب في تقلصات العضلات (بما في ذلك الجهاز التنفسي).
تُستخدم بعض المواد التي تمنع انتقال التشابك العصبي في التخدير والإجراءات الطبية الأخرى لإرخاء العضلات. هذه المواد تسمى مرخيات.
المشابك الكهربائية . بالإضافة إلى المشابك الكيميائية ، تم العثور على المشابك الكهربائية في الحيوانات. في ES ، تمر تدفقات الأيونات من المحاور الطرفية إلى الخلية المستهدفة مباشرة عبر قنوات خاصة في الأنابيب الخاصة بأجهزة "الالتحام" لبروتين غشاء معين - connexons. تشكل جزيئات بروتين Connectin بنية خاصة في أغشية المحوار الطرفية والغشاء بعد المشبكي للخلية المستهدفة - connexon ، والتي تتكون من ستة جزيئات ولها قناة بداخلها. يتصل اثنان من أغشية المشبك المتجاور ببعضهما البعض ويفتح ثقب في كل منهما - وهي قناة كانت مغلقة سابقًا (تشبه هذه العملية فتح الفتحات أثناء الالتحام). تمثل هذه القناة مقاومة منخفضة لمرور الأيونات. هناك العديد من الروابط في ES. وهكذا ، يربط ES خليتين بالعديد من الأنابيب الرفيعة التي يبلغ قطرها حوالي 1-1.5 نانومتر ، تمر داخل جزيئات البروتين (الشكل 14 ، د).

أرز. 14. المشابك الكهربائية.
تمتلئ المسافة بين الروابط في الشق المشبكي لـ ES بعازل. في الطيور ، في سلسلة الخلايا العصبية التي توفر رد فعل التلميذ للضوء ، تمتلئ فجوة المشابك الكهربائية بالمايلين.
السمة المميزة لـ ES هي سرعتها. الميزة الثانية المميزة لـ ES هي أنها تمرر الإشارة في كلا الاتجاهين ، أي هم متماثلون. ومع ذلك ، هناك ECs تتشكل من أغشية ذات خصائص تصحيح تنقل إشارة في اتجاه واحد ، بالإضافة إلى المشابك الكيميائية المتناظرة ، حيث توجد حويصلات ذات وسيط على جانبي الشق المشبكي. غالبًا ما توجد ES في اللافقاريات والفقاريات السفلية (cyclostomes والأسماك).
أجهزة مثل نقاط الاشتباك العصبي. تلعب الأجهزة مثل المشابك دورًا مهمًا في حياة مجموعة متنوعة من الأنسجة والأعضاء. على سبيل المثال ، ترتبط خلايا القلب في مجموعة متنوعة من الحيوانات بقنوات من نفس بروتين الرابط الذي يشكل قنوات في ES. في هذه الحالة ، تسمى منطقة الاتصال الخلوي جهة اتصال عالية النفاذية (المشبك هو جهة اتصال يكون فيها أحد المشاركين على الأقل عبارة عن خلية عصبية). ترتبط خلايا العضلات الملساء للأعضاء الداخلية بنظام من الروابط. ترتبط الخلايا غير القابلة للاستثارة (خلايا الظهارة والغدد والكبد وما إلى ذلك) أيضًا عن طريق جهات اتصال عالية النفاذية. في الواقع ، معظم أنسجة الجسم ليست مجموعات من خلايا مفردة ، بل هي مجموعة مفردة يمكن فيها للخلايا أن تتبادل الجزيئات المختلفة من خلال قنوات اتصالات عالية النفاذية. نتيجة لهذا ، نوع من "المساعدة الخلوية المتبادلة" ممكن في الأنسجة. على سبيل المثال ، إذا كانت المضخات الغشائية لا تعمل بشكل جيد في الخلية ، فإن جيرانها "يتشاركون" في احتياطيهم الأيوني معها من خلال قنوات ملامسات عالية النفاذية وتحافظ على إمكاناتها في الراحة.
لا تعتبر Connexons أنابيب ثابتة ، ولكنها هياكل ديناميكية: يمكن فتح قنوات connexon وإغلاقها تحت تأثير عوامل مختلفة. تم توضيح الآلية الجزيئية لإغلاق هذه القناة. يتكون connexon من 6 وحدات فرعية يمكن أن تتحرك بالنسبة لبعضها البعض (انظر الشكل 2-12 ، ب) ، بينما يمكن إغلاق الثقب ؛ هذا الجهاز يشبه إلى حد بعيد جهاز الحجاب الحاجز للكاميرا مع البتلات المتحركة. في حالة تعرض أي خلية لأضرار جسيمة في الغشاء ولا تستطيع آليات دفاعها التعامل مع فائض ، على سبيل المثال ، الكالسيوم القادم من البيئة ، مما يؤدي إلى موت الخلية ، يكون تركيز عالي من يؤثر الكالسيوم الموجود داخل هذه الخلية على الروابط مع الخلايا المجاورة ، حيث يتم إغلاق قنواتها ويتم فصل الخلايا المجاورة عن الجار التالف. قال أحد العلماء المشهورين: "خلايا القلب تعمل معًا وتموت واحدة تلو الأخرى". الآن نحن نعرف لماذا هذا ممكن.
إن ديناميكية العلاقات مهمة ليس فقط للبقاء على قيد الحياة. لقد ثبت أنه يمكن العثور على جهات اتصال عالية النفاذية بالفعل في المراحل الأولى من تطور أجنة الحيوانات المختلفة ؛ تتواصل الخلايا التي نشأت بالفعل أثناء التكسير الأول للبيضة مع بعضها البعض ، وعند مدخل مزيد من التطور إما تظهر أو تختفي. تؤثر الخلايا على بعضها البعض ببعض المواد ، ثم يتم عزل أجزاء من الجنين عن بعضها البعض ثم يتطور نسيج متجانس من خلايا متطابقة في هذه المناطق ؛ ثم يتم توصيل هذه المناطق مرة أخرى عن طريق الاتصالات مع الجيران ، وكل هذا اللعب المعقد للاتصالات يؤدي وظائف معينة في تنظيم التطور الطبيعي. يشير كل هذا إلى أن الإشارات في ES هي "مهنة" ثانوية للهيكل ، والتي ، مثل مضخات الأيونات ، تلعب دورًا عامًا وأساسيًا في تطوير الكائنات الحية وعمل أنسجتها.
وبالمثل ، يتم استخدام مبدأ تشغيل المشابك الكيميائية في الكائنات الحية ليس فقط لنقل المعلومات ، ولكن أيضًا لأغراض أخرى. وبالتالي ، تستخدم مجموعة متنوعة من الخلايا الإفرازية أيونات Ca2 + لتنظيم إطلاق الإفراز ، تمامًا كما هو الحال في المشابك الكيميائية ، تُستخدم هذه العملية لتحرير وسيط. لاحظ أن خلايا العديد من الغدد قابلة للإثارة كهربائيًا.
ضع في اعتبارك ، على سبيل المثال ، عمل خلايا البنكرياس البائية التي تنتج الأنسولين. توجد على سطح هذه الخلايا مستقبلات تستجيب لمستوى الجلوكوز في السائل الخلالي المحيط بها. إذا كان مستوى الجلوكوز في الدم أعلى من المعدل الطبيعي ، فعندئذ تحت تأثير هذه المستقبلات ، تتخلص الخلايا من الاستقطاب (نتيجة لإغلاق قنوات البوتاسيوم) وتنشأ فيها إمكانات العمل. ، تنشأ بسبب فتح قنوات Ca. في نفس الوقت تدخل أيونات الكالسيوم إلى الخلية مما يؤدي إلى إطلاق الأنسولين في الدم كما في حالة النهايات العصبية يؤدي إلى إطلاق وسيط. كما تم توضيح دور الكالسيوم في إفراز مواد مختلفة ، وخاصة الهرمونات ، في العديد من الغدد الأخرى. وتجدر الإشارة إلى أن الآلية الموصوفة لحدوث إمكانات العمل في خلايا البنكرياس ربما تحدث أيضًا في خلايا منطقة ما تحت المهاد ، والتي تستجيب لمستويات مختلفة من تركيز هرمونات معينة ،
تطلق مجموعة متنوعة من خلايا الجسم مواد مختلفة في بيئتها ؛ بادئ ذي بدء ، هذه خلايا غدة. يتم تعبئة هذه المواد في حاويات غشائية - حويصلات ، ويتم تنظيم إطلاقها بواسطة أيونات Ca2 + ، التي تدخل الخلية من خلال قنوات الكالسيوم الخاصة. نتيجة للتطور ، بدأت الخلايا العصبية في استخدام هذه الآلية في بناء المشابك الكيميائية ؛ تحتوي الحاويات على ناقل عصبي ، ومن ثم يتم تنظيم إطلاقه بنفس طريقة إفراز الهرمونات والمواد الأخرى ، ومن وجهة النظر هذه الخلايا العصبية ذات المشابك الكيميائية هي أحد خيارات الخلايا الإفرازية ، والوسيط هو سرهم ، الذي لا يتم إطلاقه فقط في مجرى الدم ، ويدخل مستهلكين محددين تمامًا من خلال شق متشابك. من ناحية أخرى ، فإن عمل الخلايا الغدية يشبه عمل الخلايا العصبية ، لكن إمكانات عملها تعمل على فتح قنوات الكالسيوم والسماح بدخول أيونات الكالسيوم. نلاحظ نفس الشيء في خلايا العضلات ، حيث يفتح جهد الفعل بوابة أيونات Ca 2+ ، مما يؤدي إلى عملية الانكماش.
وهكذا ، أولاً ، نرى مرة أخرى تشابهًا وثيقًا للآليات التي تستخدمها خلايا الجسم المختلفة لأغراض مختلفة ، وثانيًا ، بالنظر إلى الأمام ، يمكننا أن نقترح أن سر التلوين العاطفي للأحاسيس وأعلى مظهر من مظاهر العصبية نشاط الدماغ البشري هو الإحساس بالوعي والتفكير - يقع بالضبط في هذه الوحدة من وظائف الخلايا العصبية. أولئك. في خصائصها لتكون عصبية (تولد وتوصيل النبضات الكهربائية) وخلية إفرازية.
9. اعتماد وظيفة الخلايا العصبية على شكلها.
يتم تحديد الوظائف الفسيولوجية للخلية العصبية إلى حد كبير من خلال خصائصها الكهربائية. نحن نعلم بالفعل أن الخلايا العصبية تأتي في مجموعة متنوعة من الأشكال ، حيث تكون محاورها عبارة عن كبلات أسطوانية بشكل أساسي وأن أجسامها كروية بشكل أو بآخر. بمقارنة الخصائص الكهربائية للكرة والأسطوانة المكونة من أغشية متطابقة ، سنرى مدى أهمية الدور في تحديد هذه الخصائص من خلال شكل الخلية القابلة للاستثارة.
يمكن تقسيم المعلمات الكهربائية التي تميز الخلية العصبية إلى مجموعتين: 1) معلمات تميز مادة الغشاء والسيتوبلازم - المقاومة المحددة للغشاء (Rm) ، التي تساوي 1-10 kOhm / cm2 ، السعة الكهربائية المحددة لها (1 μF / cm2) ومقاومة حشوية محددة (Ri) تبلغ حوالي 100 أوم.سم ؛ لا تعتمد هذه المعلمات على شكل الخلية ؛ 2) معلمات النظام ؛ أنها تميز الألياف أو الخلية أو نظام الخلايا ذات الصلة ككل وتعتمد على الحجم والشكل ؛ إحدى معلمات النظام هي مقاومة المدخلات - Rin
مقاومة المدخلات هي نسبة انزياح إمكانات الغشاء للخلية إلى قيمة التيار الكهربائي المار فيها: Rin = DV / I. وبالتالي ، فإن مقاومة الإدخال هي تناظرية للمقاومة المعتادة لجزء من الألياف العصبية.
يتم التعبير عن مقاومة المدخلات للمحور العصبي (الأسطوانة) بالصيغة:
رين \ u003d 1 / p 2 (Rm Ri) / 8a3 ،أين أ-نصف قطر محور عصبي .
في هذه الصيغة ، Rm و Ri هما مقاومة الغشاء المحوري والسيتوبلازم ، على التوالي ، أي معلمات المجموعة الأولى ؛ يتم تحديد كل شيء آخر من خلال هندسة الألياف كأسطوانة بطول أكبر بكثير من نصف القطر. وماذا لو كان قفص كروي نصف قطره a مصنوعًا من نفس المادة؟ لقد ثبت أنه حتى في الخلايا الكروية الكبيرة جدًا (قطرها 1 مم) فإن مقاومة السيتوبلازم لا تتجاوز 0.1٪ من مقاومة الغشاء ؛ في الخلايا الكروية ذات القطر الأصغر بكثير (جميع الخلايا العصبية متشابهة) ، يمكن تجاهل مقاومة السيتوبلازم ، وتعتمد مقاومة المدخلات الفعلية للخلية الكروية فقط على مقاومة غشاءها ونصف قطرها: Rin = Rm / 4 pa3
وبالتالي ، بالنسبة للخلية الكروية ، فإن مقاومة الإدخال تتناسب طرديًا مع مقاومة الغشاء ، لذلك إذا ، عندما تكون الخلية متحمسة ، تقل المقاومة المحددة لغشاءها ، على سبيل المثال ، بمعامل 36 ، فإن مقاومة المدخلات سينخفض النظام أيضًا بمعامل 36.
بالنسبة للألياف ، تتناسب مقاومة الإدخال مع 2Rm فقط ، لذلك إذا انخفضت مقاومة الغشاء أيضًا عند الإثارة بمعامل 36 ، فإن مقاومة الإدخال ستتغير فقط بمعامل 6.
كيف يؤثر كل هذا على وظيفة العصبون؟ في الخلية الكروية ، لا يختفي جهد الغشاء على الفور ، كما هو الحال في الألياف الأسطوانية ، ولكن ببطء - أضعافًا مضاعفة.تتناسب إمكانات ما بعد المشبك في المشابك بشكل مباشر مع مقاومة الإدخال للغشاء بعد المشبكي ، وبالتالي ، في خلية كروية بقطر من 10 ميكرون ، ستكون إمكانات ما بعد المشبك أكبر 100 مرة من خلية قطرها 100 ميكرومتر. تكون كفاءة المشابك الاستثارة أقل ، وكلما انخفضت ممانعات مدخلاتها. يقلل وسيط المشبك المثبط في الخلية الكروية من مقاومة المدخلات للغشاء ما بعد المشبكي ، وبالتالي يقلل من فعالية النبضات الاستثارية ؛ في الألياف الأسطوانية ، يكون هذا التأثير أصغر بكثير.
يؤدي الانخفاض البطيء في إمكانات الغشاء على غشاء الخلية الكروية إلى زيادة كفاءة التجميع المؤقت فيه بشكل كبير. الأشكال والأحجام المختلفة لأجسام الخلايا العصبية في القشرة الدماغية - ظاهرة ليست عرضية!
موصلية الألياف العصبية مع تغير قطرها. يتضح أنه في نفس الألياف ، قبل توسعها ، يتباطأ الدافع العصبي ويقل اتساعها ؛ عندما تتمدد الألياف ست مرات ، لا يمكن أن يمر PD من خلال هذا التمدد. على العكس من ذلك ، عندما تضيق الألياف ، حيث تقترب من نقطة التضييق ، تزداد سرعة النبض ، ويزداد اتساعها. تعد الزيادة في سعة AP في نهاية الطرف مهمة جدًا لتشغيل المشابك الكيميائية ، لأنها تحسن ظروف إطلاق الوسطاء. إذا تفرعت المحاور الضيقة إلى فرعين ، يكون قطرها الإجمالي أقل من القطر عند نقطة التفرع ، ثم يتسارع AP قبل التفرع ، وإذا كان القطر الإجمالي للفروع أكبر - تتباطأ سرعة PD وقد يتم حظرها. الموصلية من التشعبات. في اتجاه الإثارة ، تبدأ التشعبات كأفرع رفيعة متعددة ، تندمج مرارًا وتكرارًا في فروع أكثر سمكًا ، وتنتهي على جسم العصبون مع جذوع سميكة. طول التشعبات أكبر بعشرات المرات من قطر جسم الخلايا العصبية ، ويمكن أن يكون سمك الفروع الطرفية كسورًا من ميكرومتر. في بعض التشعبات ، يكون الغشاء غير مهتاج (لا يولد AP) ويمكنه نقل الإشارات إلكترونيًا فقط ككابل سلبي ؛ وفي حالات أخرى ، يكون قادرًا على توليد وتسيير إمكانات العمل مثل محور عصبي ، ولكن في اتجاه العصبون هيئة. في الحالة الأولى ، كما يعتقد العلماء ، توجد العديد من نقاط الاشتباك العصبي في فروع طرفية رفيعة ، ويصل العمل المشترك لهذه المشابك إلى جسم الخلية العصبية. أظهر التقييم الكمي أن كفاءة المشابك العصبية أقل من 3 إلى 5 مرات فقط من نقاط الاشتباك العصبي الموجودة على جسم الخلية العصبية. نصف قطر المحطة التغصنية وبالتالي مقاومة المدخلات الكبيرة (انظر أعلاه). هذه القوة كافية لتعويض ضعف الإشارة أثناء تحركها في اتجاه تمدد التشعبات.
في الخلايا العصبية التي تكون أغشيتها التغصنية قادرة على توليد وتوصيل إمكانات العمل ، تؤدي الكفاءة العالية المماثلة لنقاط الاشتباك العصبي الشجيري إلى حقيقة أن عددًا قليلاً فقط من المشابك العصبية سيجلب إمكانات الغشاء إلى العتبة وتتسبب في حدوث AP في هذا الفرع ، والذي سيبدأ في الانتشار لجسم الخلية. سيعتمد مصيرها الإضافي على خصائص العقد المتفرعة التي يجب أن تمررها في طريقها إلى جسم الخلية العصبية ، على عدد وتوقيت إمكانات العمل التي تصل إلى المواقع المتفرعة على طول الفروع الأخرى ، إلخ. نتيجة لذلك ، يعمل هذا النوع من الخلايا كدائرة منطقية معقدة. تعمل الخلايا ذات النظام المعقد من التشعبات كعناصر معقدة للغاية في الكمبيوتر.
وظائف العمود الفقري شجيري . توجد على التشعبات في العديد من الخلايا العصبية تكوينات خاصة تسمى. أشواك. هذه التكوينات الشبيهة بالفطر على شكل رأس على ساق رفيع هي نتوء غشاء الخلية للتغصنات ، حيث يتشكل المشبك الكيميائي مع طرف من عصبون آخر. يعتقد العلماء أن وظيفة العمود الفقري هي كما يلي. في حالة وجود غشاء غير قابل للاستثارة ، تقلل الأشواك بشكل كبير من التأثير المتبادل للمشابك المجاورة على الغشاء ما بعد المشبكي للتغصنات ، والتي في حالة عدم وجود أشواك ، سيكون هناك انخفاض كبير في مقاومة المدخلات من طرف التغصنات وبالتالي ، انخفاض في مستوى إمكانات الغشاء. أظهرت الحسابات أنه على الرغم من أن المشابك الشوكية أقل كفاءة بشكل فردي من المشابك الموجودة مباشرة على التغصنات ، فإن التأثير الإجمالي لعملهم أعلى بشكل ملحوظ.
إذا كان غشاء العمود الفقري منفعلًا ، فيمكن أن يعمل كمضخم للإرسال المتشابك. بسبب نحافة الرقبة ، فإن مقاومة المدخلات للعمود الفقري عالية جدًا ، ويمكن لمشبك واحد أن يطلق جهدًا في الرأس ، والذي سيرسل تيارًا كهربائيًا أقوى بكثير إلى التغصنات من تيار المشبك.
10. وظائف الخلايا العصبية.
تمتلئ المساحة بين الخلايا العصبية في الجهاز العصبي المركزي بخلايا دعم متخصصة تسمى الخلايا الدبقية. عددهم 5-10 مرات أعلى من الخلايا العصبية. تشكل الخلايا الدبقية أيضًا أغلفة المايلين للمحاور العصبية الطرفية للخلايا العصبية.
تنقسم الخلايا الدبقية إلى مجموعتين - الخلايا النجمية والخلايا الدبقية قليلة التغصن. تقوم الخلايا النجمية بتطهير الفضاء خارج الخلية من الخلايا العصبية من الأيونات والوسطاء الزائدة ، وبالتالي تعمل كمانع في حالة زيادة تركيز أيونات الكالسيوم خارج الخلية وتزيل "التداخل" الكيميائي في عمل الخلايا العصبية. لم يتم إثبات الوظيفة الغذائية للخلايا الدبقية فيما يتعلق بالخلايا العصبية ، على الرغم من أنها يمكن أن تغير وصول الأكسجين والجلوكوز إلى الخلايا العصبية. منع التدفقات المقابلة للسائل الخلالي. يمكن للخلايا النجمية تغيير الإشارات المرسلة في المشابك عن طريق منع أقسام فردية من الأغشية في الشقوق المشبكية ، وفي الأماكن التي يكون فيها تلف الدماغ محدودًا ، تؤدي الخلايا النجمية وظائف صحية ، وتشارك في تنظيف الأجزاء الميتة من الخلايا العصبية.
الخلايا الدبقية قليلة التغصن ، الملتفة حول محاور الخلايا العصبية ، تشكل غلاف الميالين الخاص بها في الجهاز العصبي المركزي. تشكل مجموعة متنوعة من الخلايا قليلة التغصن - خلايا شوان - غمدًا ميلينًا متقطعًا من المحاور الطرفية.
11. نمو وتطور الخلايا العصبية في عملية التكوُّن.
تتطور الخلية العصبية من خلية سلفية صغيرة تتوقف عن الانقسام حتى قبل أن تطلق عملياتها.
إن مسألة تقسيم العصبونات نفسها قابلة للنقاش حاليًا. فضلا عن نفعية هذه العملية في الكائن الحي. إن تجديد العمليات التالفة من جانب جسم الخلية حقيقة تم إثباتها بالكامل. كقاعدة عامة ، يبدأ المحور العصبي في النمو أولاً ، وتتشكل التشعبات لاحقًا. في نهاية عملية التطور للخلية العصبية ، تظهر سماكة غير منتظمة الشكل - "مخروط النمو" ، والذي يبدو أنه يمهد الطريق عبر الأنسجة المحيطة. مخروط النمو هو جزء مسطح من عملية الخلية العصبية مع العديد من الأشواك الرقيقة. يبلغ سمك الميكروسكوب 0.1-0.2 ميكرون ويصل طوله إلى 50 ميكرون. للمقارنة ، تذكر أن قطر خلية الدم الحمراء البشرية هو 7.3 ميكرون. المساحة الواسعة والمسطحة لمخروط النمو يبلغ عرضها وطولها حوالي 5 ميكرومتر. الفراغات بين microspines مغطاة بغشاء مطوي.
الميكروسبيك في حركة مستمرة. بعضها يتراجع إلى المخروط ، والبعض الآخر يطول ، وينحرف في اتجاهات مختلفة ، ويلمس الركيزة ويمكن أن يلتصق بها. مباشرة أسفل المناطق المطوية من الغشاء وفي العمود الفقري توجد كتلة كثيفة من خيوط الأكتين المتشابكة والميتوكوندريا والأنابيب الدقيقة والخيوط العصبية ، على غرار تلك الموجودة في جسم الخلايا العصبية.
على الأرجح ، يتم استطالة الأنابيب الدقيقة والألياف العصبية وخيوط الأكتين (انظر أدناه) بشكل رئيسي بسبب إضافة الوحدات الفرعية المركبة حديثًا في قاعدة عملية الخلايا العصبية. إنها تتحرك بسرعة حوالي ملليمتر واحد في اليوم ، وهو ما يتوافق مع سرعة النقل المحوري البطيء في الخلايا العصبية الناضجة. تمت إضافة مادة غشائية جديدة ، على ما يبدو في النهاية. يتم نقل الحويصلات الغشائية الصغيرة على طول عملية الخلايا العصبية من جسم الخلية إلى مخروط النمو بواسطة تيار من النقل المحوري السريع. مادة الغشاء ، على ما يبدو ، يتم تصنيعها في جسم الخلية العصبية ، ويتم نقلها إلى مخروط النمو في شكل حويصلات ، ويتم تضمينها هنا في غشاء البلازما عن طريق طرد الخلايا ، وبالتالي إطالة عملية الخلية العصبية.
عادة ما يسبق نمو المحاور والتشعبات مرحلة من الهجرة العصبية ، عندما تستقر الخلايا العصبية غير الناضجة وتجد مكانًا دائمًا لها في الشبكات العصبية.
سأخبرك على الفور أن هذه الملاحظة لا تتعلق بالمستشعرات أو شبكات هوبفيلد أو أي شبكات عصبية اصطناعية أخرى. سنقوم بمحاكاة عمل شبكة عصبية بيولوجية "حقيقية" و "حية" حيث تحدث عمليات توليد وانتشار النبضات العصبية. في أدبيات اللغة الإنجليزية ، تسمى هذه الشبكات ، نظرًا لاختلافها عن الشبكات العصبية الاصطناعية ، بالشبكات العصبية المتصاعدة ، بينما لا يوجد اسم محدد في أدبيات اللغة الروسية. شخص ما يسميها ببساطة شبكات عصبية ، ويطلق عليها شخص ما شبكات عصبية دافعة ، ويطلق عليها شخص ما شبكات سبايك.ربما سمع معظم القراء عن مشروع Blue Brain والعقل البشري برعاية الاتحاد الأوروبي ، حيث خصصت حكومة الاتحاد الأوروبي للمشروع الأخير حوالي مليار يورو ، مما يشير إلى اهتمام كبير بهذا المجال. كلا المشروعين مرتبطان ارتباطًا وثيقًا ويتقاطعان مع بعضهما البعض ، بل إن لديهما قائد مشترك ، هنري ماركرام ، والذي يمكن أن يخلق بعض الارتباك حول كيفية اختلافهما عن بعضهما البعض. باختصار ، الهدف النهائي لكلا المشروعين هو تطوير نموذج للدماغ كله ، حوالي 86 مليار خلية عصبية. مشروع Blue Brain هو الجزء الحسابي ، والدماغ البشري هو جزء أساسي ، حيث يعملون على جمع البيانات العلمية حول مبادئ الدماغ وإنشاء نموذج واحد. من أجل لمس هذا العلم ومحاولة القيام بشيء مماثل ، وإن كان على نطاق أصغر بكثير ، تمت كتابة هذه الملاحظة.
كانت هناك بالفعل العديد من المقالات الشيقة والغنية بالمعلومات حول علم الأعصاب على حبري ، وهو أمر ممتع للغاية.
1. علم الأعصاب والذكاء الاصطناعي: الجزء الأول - البرنامج التعليمي.
2. علم الأعصاب والذكاء الاصطناعي: الجزء الثاني - الذكاء وتمثيل المعلومات في الدماغ.
3. علم الأعصاب والذكاء الاصطناعي: الجزء الثالث - تمثيل البيانات والذاكرة
لكنهم لم يتطرقوا إلى قضايا علم الأعصاب الحسابي ، أو بعبارة أخرى ، علم الأعصاب الحسابي ، والذي يتضمن محاكاة الكمبيوتر للنشاط الكهربائي للخلايا العصبية ، لذلك قررت سد هذه الفجوة.
قليلا من علم الأحياء
أرز. 1 - تمثيل تخطيطي لبنية الخلايا العصبية.
قبل أن نبدأ النمذجة ، نحتاج إلى التعرف على بعض أساسيات علم الأعصاب. تتكون الخلية العصبية النموذجية من 3 أجزاء: الجسم (سوما) والتشعبات والمحاور. تستقبل التشعبات إشارات من الخلايا العصبية الأخرى (هذا هو مدخل الخلايا العصبية) ، وينقل المحور العصبي الإشارات من جسم الخلية العصبية إلى الخلايا العصبية الأخرى (الإخراج). تسمى نقطة الاتصال بين محور عصبون واحد وتغصن خلية عصبية أخرى بالمشابك. يتم تلخيص الإشارة الواردة من التشعبات في الجسم ، وإذا تجاوزت عتبة معينة ، يتم إنشاء نبضة عصبية أو ، بعبارة أخرى ، ارتفاع. يحيط بجسم الخلية غشاء دهني ، وهو عازل جيد. تختلف التركيبات الأيونية للسيتوبلازم العصبي والسائل بين الخلايا. في السيتوبلازم ، يكون تركيز أيونات البوتاسيوم أعلى ، ويكون تركيز الصوديوم والكلور أقل ، بينما في السائل بين الخلايا يكون العكس هو الصحيح. ويرجع ذلك إلى عمل المضخات الأيونية ، التي تضخ باستمرار أنواعًا معينة من الأيونات ضد تدرج التركيز ، بينما تستهلك الطاقة المخزنة في جزيئات Adenosine TriPhosphate (ATP). أشهر هذه المضخات وأكثرها دراسة هي مضخة الصوديوم والبوتاسيوم. يجلب 3 أيونات الصوديوم إلى الخارج ، ويأخذ 2 أيونات البوتاسيوم داخل العصبون. يوضح الشكل 2 التركيب الأيوني للخلايا العصبية ويتم تمييز مضخات الأيونات. بفضل عمل هذه المضخات ، يتشكل فرق جهد التوازن في الخلايا العصبية بين الجانب الداخلي من الغشاء ، وهو سالب الشحنة ، والجانب الخارجي ، وهو موجب الشحنة. 
أرز. 2 - التركيب الأيوني للخلايا العصبية والبيئة
بالإضافة إلى المضخات ، توجد أيضًا قنوات أيونية على سطح الخلايا العصبية ، والتي يمكن أن تفتح أو تغلق عند التغيرات المحتملة أو عند تعرضها للمواد الكيميائية ، وبالتالي تزيد أو تنقص تيارات نوع معين من الأيونات. إذا تجاوزت إمكانات الغشاء حدًا معينًا ، فتفتح قنوات الصوديوم ، ونظرًا لوجود المزيد من الصوديوم في الخارج ، يظهر تيار كهربائي موجه داخل الخلية العصبية ، مما يزيد من إمكانات الغشاء ويفتح قنوات الصوديوم بشكل أكبر ، فهناك زيادة حادة في إمكانات الغشاء. يطلق الفيزيائيون على هذه التعليقات الإيجابية. ولكن ، بدءًا من بعض القيمة المحتملة أعلى من إمكانية فتح قنوات الصوديوم ، يتم أيضًا فتح قنوات البوتاسيوم ، بسبب بدء تدفق أيونات البوتاسيوم إلى الخارج ، مما يقلل من إمكانات الغشاء وبالتالي إعادته إلى قيمة التوازن. إذا كانت الإثارة الأولية أقل من عتبة فتح قناة الصوديوم ، فإن العصبون سيعود إلى حالة توازنه. ومن المثير للاهتمام أن اتساع النبضة المتولدة يعتمد بشكل ضعيف على سعة التيار المثير: إما أن يكون هناك نبضة أو لا توجد ، فالقانون هو "كل شيء أو لا شيء".
بالمناسبة ، كان مبدأ "كل شيء أو لا شيء" هو الذي ألهم ماكولوتش وبيتس لإنشاء نماذج من الشبكات العصبية الاصطناعية. لكن مجال الشبكات العصبية الاصطناعية يتطور بطريقته الخاصة ، وهدفه الرئيسي هو الحل الأمثل للمشاكل العملية ، بغض النظر عن كيفية ارتباط ذلك بعمليات معالجة المعلومات في الدماغ الحي. في حين أن الشبكات العصبية المرتفعة هي نموذج لكيفية عمل الدماغ الحقيقي. يمكنك تجميع شبكة سبايك للتعرف على الصور المرئية ، ولكن الشبكات العصبية الكلاسيكية مناسبة بشكل أفضل للاستخدام العملي ، فهي أبسط وأسرع على الكمبيوتر ، وقد تم اختراع العديد من الخوارزميات لتتعلم من أجل مهام عملية محددة.
يوضح الشكل 3 مبدأ "الكل أو لا شيء" بوضوح. يوجد أدناه تيار الإدخال الموجه إلى الجانب الداخلي من غشاء العصبون ، وفي الأعلى يوجد فرق الجهد بين الجانبين الداخلي والخارجي للغشاء. لذلك ، وفقًا للمفهوم السائد حاليًا في الشبكات العصبية الحية ، يتم تشفير المعلومات في وقت حدوث النبضات ، أو ، كما يقول الفيزيائيون ، عن طريق تعديل الطور. 
أرز. 3 - توليد النبضات العصبية. يوجد أدناه التيار الموفر داخل الخلية في pkA ، وفي الجزء العلوي توجد إمكانات الغشاء بالسيارات
من الممكن إثارة خلية عصبية ، على سبيل المثال ، عن طريق إدخال قطب كهربائي دقيق فيها وتطبيق تيار داخل الخلية العصبية ، ولكن في الدماغ الحي ، تحدث الإثارة عادة من خلال عمل متشابك. كما ذكرنا سابقًا ، تتصل الخلايا العصبية ببعضها البعض باستخدام المشابك العصبية ، والتي تتشكل عند نقاط التلامس بين محور عصبون واحد مع تشعبات أخرى. تسمى الخلية العصبية التي تأتي منها الإشارة قبل المشبكي ، وتسمى الخلية التي تنتقل إليها الإشارة بعد المشبكي. عندما يحدث نبضة على خلية عصبية ما قبل المشبكية ، فإنها تطلق نواقل عصبية في الشق المشبكي ، والتي تفتح قنوات الصوديوم على العصبون ما بعد المشبكي ، ثم تحدث سلسلة الأحداث الموصوفة أعلاه ، مما يؤدي إلى الإثارة. بالإضافة إلى الإثارة ، يمكن للخلايا العصبية أيضًا أن تمنع بعضها البعض. إذا كانت الخلايا العصبية قبل المشبكية مثبطة ، فإنها ستطلق ناقل عصبي مثبط في الشق المشبكي الذي يفتح قنوات الكلوريد ، وبما أن هناك المزيد من الكلور في الخارج ، يتدفق الكلور داخل الخلية العصبية ، مما يسبب شحنة سالبة على الجانب الداخلي من الغشاء إلى زيادة (لا تنس أن أيونات الكلوريد على عكس الصوديوم والبوتاسيوم مشحونة سلبًا) ، مما يدفع الخلايا العصبية إلى حالة أكثر خمولًا. في هذه الحالة ، يكون إثارة العصبون أكثر صعوبة.
نموذج رياضي للخلايا العصبية
على أساس الآليات الديناميكية لعملية الخلايا العصبية الموصوفة أعلاه ، يمكن تجميع نموذجها الرياضي. في الوقت الحالي ، تم إنشاء العديد من النماذج البسيطة نسبيًا ، مثل Inregrate و Fire ، حيث يتم تمثيل الخلايا العصبية كمكثف ومقاوم ، بالإضافة إلى نماذج أكثر تعقيدًا ومعقولة بيولوجيًا ، مثل نموذج Hodgkin-Huxley ، وهو أكثر تعقيدًا من الناحية الحسابية ومن حيث تحليل ديناميكياتها ، لكنها تصف ديناميكيات غشاء الخلايا العصبية بشكل أكثر دقة. في هذه المقالة ، سوف نستخدم نموذج Izhikevich ، وهو حل وسط بين التعقيد الحسابي والمعقولية الفيزيائية الحيوية. على الرغم من بساطته الحسابية ، يمكن لهذا النموذج إعادة إنتاج عدد كبير من الظواهر التي تحدث في الخلايا العصبية الحقيقية. يتم إعطاء نموذج Izhikevich كنظام من المعادلات التفاضلية (الشكل 4).
أرز. 4 - نموذج Izhikevich
أين أ ، ب ، ج ، د ، ك ، سممعلمات الخلايا العصبية المختلفة. Vmهو فرق الجهد بين داخل وخارج الغشاء ، و أمهو متغير مساعد. أناهو التيار الخارجي المباشر المطبق. في هذا النموذج ، لوحظت هذه الخصائص المميزة للخلايا العصبية على النحو التالي: توليد ارتفاع استجابة لنبضة تيار خارجي واحد وتوليد سلسلة من التموج بتردد معين عند تطبيق تيار خارجي ثابت على الخلايا العصبية. إيسين- مجموع التيارات المشبكية من جميع الخلايا العصبية التي ترتبط بها هذه الخلايا العصبية.
إذا تم إنشاء ارتفاع على العصبون قبل المشبكي ، تحدث قفزة في التيار المتشابك على العصبون ما بعد المشبكي ، والذي يتحلل بشكل أسي مع وقت مميز.
دعنا ننتقل إلى الترميز
لذلك ، ننتقل إلى الأكثر إثارة للاهتمام. حان الوقت لترميز قطعة افتراضية من النسيج العصبي على الكمبيوتر. للقيام بذلك ، سنحل عدديًا نظامًا من المعادلات التفاضلية التي تحدد ديناميكيات إمكانات الغشاء في الخلية العصبية. سنستخدم طريقة أويلر للتكامل. سنقوم بالبرمجة بلغة C ++ ، ونرسم باستخدام البرامج النصية المكتوبة بلغة Python باستخدام مكتبة Matplolib ، ولكن أولئك الذين ليس لديهم Python يمكنهم الرسم باستخدام Excel.نحن بحاجة إلى مصفوفات ثنائية الأبعاد Vms ، Umsأبعاد Tsim * Nneurلتخزين إمكانات الغشاء والمتغيرات المساعدة لكل خلية عصبية ، في كل لحظة من الزمن ، تسيمهو وقت المحاكاة في التهم ، و نينورعدد الخلايا العصبية في الشبكة.
سيتم تخزين العلاقات في شكل صفيفتين المسبقو post_conأبعاد نكون، حيث المؤشرات هي عدد الاتصالات ، والقيم هي مؤشرات الخلايا العصبية قبل المشبكية وما بعد المشبكية. نكون- عدد التوصيلات.
نحتاج أيضًا إلى مصفوفة لتمثيل متغير يعدل تيار ما بعد المشبكي المتحلل الأسي لكل مشبك ، لذلك نقوم بإنشاء مصفوفة ذأبعاد نكون * تسيم.
تعويم Const h = .5f ؛ // خطوة وقت التكامل في ms const int Tsim = 1000 / .5f ؛ // وقت المحاكاة في عينات منفصلة const int Nexc = 100 ؛ // عدد الخلايا العصبية الاستثارة const int Ninh = 25 ؛ // عدد الخلايا العصبية المثبطة const int Nneur = Nexc + Ninh ؛ const int Ncon = Nneur * Nneur * 0.1f ؛ // عدد الاتصالات ، 0.1 هو احتمال الاتصال بين 2 من الخلايا العصبية العشوائية تطفو Vms ؛ // إمكانات الغشاء تطفو Ums ؛ // المتغيرات المساعدة لنموذج Izhikevich الطفو Iex ؛ // التيار المباشر الخارجي المطبق على تعويم الخلايا العصبية Isyn ؛ // تيار متشابك لكل pre_conns الخلايا العصبية int ؛ // مؤشرات الخلايا العصبية قبل المشبكية int post_conns ؛ // مؤشرات الخلايا العصبية ما بعد المشبكية تطفو الأوزان ؛ // ربط أوزان عائمة ذ ؛ // متغير تعديل متشابك الحالي اعتمادًا على المسامير على تعويم ما قبل المشابك psc_excxpire_time = 4.0f ؛ // وقت الاضمحلال المميز لتيار ما بعد المشبكي ، ms تعويم minWeight = 50.0f ؛ // أوزان ، تعويم البعد pkA maxWeight = 100.0f ؛ // تعويم معلمات الخلايا العصبية Iex_max = 40.0f ؛ // الحد الأقصى الحالي المطبق على الخلايا العصبية هو 50 pA تعويم a = 0.02f ؛ تعويم ب = 0.5f ؛ تعويم ج = -40.0f ؛ // قيمة إمكانات الغشاء التي يتم إعادة ضبطها بعد تعويم السنبلة d = 100.0f ؛ تعويم k = 0.5f ؛ تعويم Vr = -60.0f ؛ تعويم Vt = -45.0f ؛ تعويم Vpeak = 35.0f ؛ // القيمة القصوى لإمكانات الغشاء ، حيث يتم إعادة التعيين إلى القيمة مع تعويم V0 = -60.0f ؛ // القيمة الأولية لتعويم الغشاء المحتمل U0 = 0.0f ؛ // القيمة الأولية لتعويم المتغير الإضافي Cm = 50.0f ؛ // السعة الكهربائية لعصبون ، بعد PCF
كما ذكرنا سابقًا ، يتم ترميز المعلومات في وقت حدوث النبضات ، لذلك نقوم بإنشاء مصفوفات لتخزين أوقات حدوثها ومؤشرات الخلايا العصبية التي نشأت فيها. ثم يمكن كتابتها في ملف لغرض التصور.
تعويم spike_times ؛ // الأوقات التي تحدث فيها المسامير int spike_neurons ؛ // مؤشرات الخلايا العصبية التي تحدث عليها النتوءات int spike_num = 0 ؛ // رقم السنبلة
نحن نبعثر الاتصالات بشكل عشوائي ونضع الأوزان.
init_connections () باطلة (لـ (int con_idx = 0 ؛ con_idx< Ncon;){
// случайно выбираем постсипантические и пресинаптические нейроны
pre_conns = rand() % Nneur;
post_conns = rand() % Nneur;
weights = (rand() % ((int)(maxWeight - minWeight)*10))/10.0f + minWeight;
if (pre_conns >= Nexc) (// إذا كانت الخلايا العصبية قبل المشبكية مثبطة ، فإن وزن الاتصال ناقص أوزان الإشارة = -أوزان ؛) con_idx ++ ؛ ))
تحديد الظروف الأولية للخلايا العصبية والتخصيص العشوائي للتيار الخارجي التطبيقي. تلك الخلايا العصبية التي يتجاوز فيها التيار الخارجي عتبة توليد الارتفاع ستولد طفرات بتردد ثابت.
init_neurons () باطلة (لـ (int neur_idx = 0 ؛ neur_idx< Nneur; neur_idx++){
// случайно разбрасываем приложенные токи
Iex = (rand() % (int) (Iex_max*10))/10.0f;
Isyn = 0.0f;
Vms = V0;
Ums = U0;
}
}
الجزء الرئيسي من البرنامج مع دمج نموذج Izhikevich.
Float izhik_Vm (int neuron ، int time) (عودة (k * (Vms - Vr) * (Vms - Vt) - Ums + Iex + Isyn) / Cm ؛) تعويم izhik_Um (int neuron ، int time) (إرجاع a * ( ب * (Vms - Vr) - Ums) ؛) int main () (init_connections () ؛ init_neurons () ؛ تعويم expire_coeff = exp (-h / psc_excxpire_time) ؛ // لتيار الانحلال الأسي لـ (int t = 1 ؛ t< Tsim; t++){
// проходим по всем нейронам
for (int neur = 0; neur < Nneur; neur++){
Vms[t] = Vms + h*izhik_Vm(neur, t-1);
Ums[t] = Ums + h*izhik_Um(neur, t-1);
Isyn = 0.0f;
if (Vms >Vpeak) (Vms [t] = c؛ Ums [t] = Ums + d؛ spike_times = t * h؛ spike_neurons = neur؛ spike_num ++؛)) // التكرار خلال جميع الوصلات لـ (int con = 0؛ con< Ncon; con++){
y[t] = y*expire_coeff;
if (Vms] >Vpeak) (y [t] = 1.0f ؛) Isyn] + = y [t] * أوزان ؛ ) save2file () ؛ العودة 0 ؛ )
يمكن تنزيل النص الكامل للرمز
أحد هذه الأجهزة (كما هو موضح في الصورة أدناه) يحفز مناطق الدماغ الموجودة خلف الجبهة. هم مسؤولون عن الاهتمام.
في ظل ظروف المختبر ، لا يستمر هذا التحفيز أكثر من 20 دقيقة في المرة الواحدة. علاوة على ذلك ، يُسمح فقط للأشخاص الذين اجتازوا سابقًا فحصًا طبيًا صارمًا بالمشاركة في التجربة.
في النهاية ، تخضع أدمغة الأشخاص الخاضعين للاختبار لجهاز يقول العلماء إنه يمكن أن يؤدي إلى نتائج غير متوقعة. على سبيل المثال ، قد لا يساعد التأثير على أجزاء أخرى من الدماغ أو التغيير في قطبية الأقطاب الكهربائية في الشخص ، بل على العكس من ذلك ، قد يؤذي الشخص.
قد تؤذي نفسك. يحذر علماء في جامعة أكسفورد من أهمية معرفة كيفية استخدام هذه الطريقة بشكل صحيح واختيار الوقت المناسب وقوة التيار.
يتفق معهم زملاؤهم من جامعة سوانسي. وفقا لهم ، يمكن أن تسبب محفزات الدماغ الكهربائية تشنجات وتقلبات مزاجية. تشمل المجموعة عالية الخطورة الأشخاص الذين تقل أعمارهم عن 20 عامًا - وهي الفترة الأكثر إثمارًا لنمو الدماغ.
ولكن الأهم من ذلك كله ، أن العلماء قلقون من حقيقة أن العديد من الأطفال الموهوبين تقنيًا يقومون بتجميع هذه الأدوات بأيديهم. في منتدى Reddit.com ، يمكنك العثور على منشورات تشكو من "فروة الرأس المحترقة" و "نوبات الغضب" بعد تحفيز الدماغ باستخدام علاج TDCS. 
يمكن أن يحدث هذا عند تجاوز الجرعة الموصوفة. على عكس المرضى ، فإن الناس العاديين أقل وعياً بالمخاطر المحتملة ، كما يقول الباحث نيك ديفيز من جامعة سوانسي.
التسويق يسبق العلم
دعا علماء أكسفورد إلى مزيد من التحكم في محفزات الدماغ الكهربائية. تصنف بعض الشركات هذه الأدوات على أنها ألعاب ، على الرغم من أنها منتجات طبية تخضع للتسجيل والتحكم المناسبين.
لا يرغب العلماء في حظر أو تقييد الوصول إلى أجهزة التعزيز المعرفي. إنهم يريدون أن يعرف المستخدمون المخاطر التي سيتعين عليهم تحملها في السعي وراء المكافآت المحتملة.
مصدر قلق آخر هو أن التكنولوجيا ليست جاهزة بعد للاستخدام التجاري. وفقًا لعالم الأعصاب ستيفن نوفيل من جامعة ييل ، غالبًا ما تأخذ الشركات تقنيات غير مختبرة من المختبر وتحاول طرحها في السوق ، واصفة إياها بأنها "مثيرة".
يجب تنظيم أي جهاز ذي وظائف طبية وفقًا لذلك. يقول نوفيلا: "التنظيم هو الشيء الوحيد الذي يحفزنا على إنفاق المال والوقت على البحث".
وفقًا للعلماء ، سيزداد الاهتمام بالتكنولوجيا فقط. ولكن حتى يتم إجراء المزيد من الأبحاث ، يوصون باستخدام محفزات الدماغ الكهربائية بحذر.
مصدرها BBC.com
المادة الخاصة بالمسابقة "bio / mol / text": تتطلب العمليات الخلوية التي تضمن تبادل المعلومات بين الخلايا العصبية الكثير من الطاقة. ساهم الاستهلاك العالي للطاقة في مسار التطور في اختيار أكثر الآليات كفاءة لتشفير ونقل المعلومات. في هذه المقالة ، ستتعرف على النهج النظري لدراسة طاقة الدماغ ، ودورها في أبحاث علم الأمراض ، وحول الخلايا العصبية الأكثر تقدمًا ، ولماذا يكون من المفيد أحيانًا عدم "إطلاق" نقاط الاشتباك العصبي ، وكذلك كيفية اختيارها فقط المعلومات التي تحتاجها الخلايا العصبية.
الراعي العام للمسابقة هو الشركة: أكبر مورد للمعدات والكواشف والمواد الاستهلاكية للأبحاث البيولوجية والإنتاج.

الراعي لجائزة الجمهور وشريك ترشيح "الطب الحيوي اليوم وغدا" شركة "Invitro".

"Book" الراعي للمسابقة - "Alpina non-fiction"
أصل النهج
منذ منتصف القرن العشرين ، من المعروف أن الدماغ يستهلك جزءًا كبيرًا من موارد الطاقة للكائن الحي بأكمله: ربع الجلوكوز و من كل الأكسجين في حالة الرئيسيات الأعلى. ألهم هذا ويليام ليفي وروبرت باكستر من معهد ماساتشوستس للتكنولوجيا (الولايات المتحدة الأمريكية) لإجراء تحليل نظري لكفاءة استخدام الطاقة في ترميز المعلومات في الشبكات العصبية البيولوجية (الشكل 1). تستند الدراسة على الفرضية التالية. نظرًا لأن استهلاك الطاقة في الدماغ مرتفع ، فمن المفيد أن يكون لديه مثل هذه الخلايا العصبية التي تعمل بكفاءة أكبر - فهي تنقل المعلومات المفيدة فقط وتنفق أقل قدر من الطاقة.
تبين أن هذا الافتراض صحيح: في نموذج بسيط للشبكة العصبية ، أعاد المؤلفون إنتاج القيم المقاسة تجريبياً لبعض المعلمات. على وجه الخصوص ، يختلف التردد الأمثل لتوليد النبضات المحسوب بواسطتهم من 6 إلى 43 نبضة / ثانية - تقريبًا نفس التردد في الخلايا العصبية لقاعدة الحُصين. يمكن تقسيمها إلى مجموعتين وفقًا لتردد النبض: بطيء (~ 10 نبضات / ثانية) وسريع (~ 40 نبضة / ثانية). في الوقت نفسه ، يفوق عدد المجموعة الأولى المجموعة الثانية بشكل ملحوظ. لوحظت صورة مماثلة في القشرة الدماغية: هناك عدة مرات أكثر من الخلايا العصبية الهرمية البطيئة (~ 4-9 نبضات / ثانية) من الخلايا العصبية الداخلية المثبطة السريعة (> 100 نبضة / ثانية). لذا ، على ما يبدو ، فإن الدماغ "يفضل" استخدام عدد أقل من الخلايا العصبية السريعة والمستهلكة للطاقة حتى لا تستهلك كل الموارد.

الشكل 1. يتم عرض اثنين من الخلايا العصبية.في واحد منهم ليلكيبروتين سينابتوفيسين قبل المشبكي ملطخ. خلية عصبية أخرى ملونة بالكامل بروتين الفلوريسنت الأخضر. نقاط ضوئية صغيرة- اتصالات متشابكة بين الخلايا العصبية. في الملحق ، يتم عرض "بقعة واحدة" أقرب.
يتم استدعاء مجموعات من الخلايا العصبية المرتبطة ببعضها البعض بواسطة المشابك الشبكات العصبيةو. على سبيل المثال ، في القشرة الدماغية ، تشكل الخلايا العصبية الهرمية والخلايا العصبية الداخلية شبكات واسعة. يحدد عمل "الحفلة الموسيقية" المنسق جيدًا لهذه الخلايا قدراتنا المعرفية وغيرها من القدرات العليا. شبكات مماثلة ، فقط من أنواع أخرى من الخلايا العصبية ، موزعة في جميع أنحاء الدماغ ، مترابطة بطريقة معينة وتنظم عمل العضو بأكمله.
ما هي interneurons؟
تنقسم الخلايا العصبية للجهاز العصبي المركزي إلى تفعيل (شكل تفعيل المشابك) و مثبط (شكل المشابك المثبطة). يتم تمثيل هذه الأخيرة إلى حد كبير أعصاب بينية ، أو الخلايا العصبية الوسيطة. في القشرة الدماغية والحصين ، هم مسؤولون عن تكوين إيقاعات جاما في الدماغ ، والتي تضمن العمل المنسق والمتزامن للخلايا العصبية الأخرى. هذا مهم للغاية للوظائف الحركية ، وإدراك المعلومات الحسية ، وتكوين الذاكرة.
إيجاد الأفضل
في الواقع ، نحن نتحدث عن مشكلة تحسين: إيجاد الحد الأقصى لوظيفة ما وتحديد المعلمات التي يتم تحقيقها في ظلها. في حالتنا ، الوظيفة هي نسبة كمية المعلومات المفيدة إلى تكاليف الطاقة. يمكن حساب كمية المعلومات المفيدة تقريبًا باستخدام صيغة شانون ، المستخدمة على نطاق واسع في نظرية المعلومات. هناك طريقتان لحساب تكاليف الطاقة وكلاهما يعطي نتائج معقولة. أحدها - "طريقة العد الأيوني" - يعتمد على حساب عدد أيونات الصوديوم التي دخلت داخل الخلية العصبية أثناء حدث إشارة معين (PD أو PSP ، انظر الشريط الجانبي " ما هي إمكانية العمل") متبوعًا بالتحويل إلى عدد الجزيئات أدينوسين ثلاثي الفوسفات (ATP) ، "عملة" الطاقة الرئيسية للخلايا. الثاني يعتمد على وصف التيارات الأيونية عبر الغشاء وفقًا لقوانين الإلكترونيات ويسمح لك بحساب قوة الدائرة الكهربائية المكافئة للخلايا العصبية ، والتي يتم تحويلها بعد ذلك إلى تكاليف ATP.
يجب بعد ذلك مقارنة قيم المعلمات "المثلى" مع تلك التي تم قياسها تجريبيًا وتحديد مدى اختلافها. ستشير الصورة العامة للاختلافات إلى الدرجة تهيئةمن خلية عصبية معينة ككل: ما مدى واقعية قيم المعلمات ، المقاسة تجريبياً ، مع القيم المحسوبة. كلما كانت الاختلافات أضعف ، كلما اقتربت الخلايا العصبية من المستوى الأمثل ، وكلما كانت تعمل بفعالية وبشكل أمثل. من ناحية أخرى ، ستظهر مقارنة معلمات محددة في السعة المحددة التي تكون هذه الخلية العصبية قريبة من "المثالية".
علاوة على ذلك ، في سياق كفاءة الطاقة للخلايا العصبية ، يتم النظر في عمليتين يعتمد عليهما تشفير المعلومات ونقلها في الدماغ. هذا هو الدافع العصبي ، أو جهد الفعل ، الذي يمكن أن تكون المعلومات من خلاله أرسلت"المرسل إليه" على مسافة معينة (من ميكرومتر إلى متر ونصف) والإرسال المتشابك الكامن وراء انتقالإشارة من خلية عصبية إلى أخرى.
إمكانات العمل
إمكانات العمل (PD) هي إشارة ترسلها الخلايا العصبية لبعضها البعض. PD مختلفة: سريعة وبطيئة ، صغيرة وكبيرة. غالبًا ما يتم تنظيمها في تسلسلات طويلة (مثل الأحرف في الكلمات) ، أو في "حزم" قصيرة عالية التردد (الشكل 2).

الشكل 2. تولد أنواع مختلفة من الخلايا العصبية إشارات مختلفة. في المركز- المقطع الطولي من دماغ الثدييات. تُظهر الأشكال الداخلية أنواعًا مختلفة من الإشارات المسجلة بواسطة طرق الفيزيولوجيا الكهربية ،. أ - القشرية ( القشرة الدماغية) يمكن أن تنقل الخلايا العصبية الهرمية كإشارات منخفضة التردد ( إطلاق نار منتظم) ، وإشارات انفجار أو انفجارات قصيرة ( إطلاق النار). ب - لخلايا بركنجي في المخيخ ( المخيخ) يتميز فقط بنشاط رشقات بتردد عالٍ جدًا. في - ترحيل الخلايا العصبية في المهاد ( ثالاموس) نمطين من النشاط: انفجار ومنشط ( إطلاق منشط). جي - الخلايا العصبية في الجزء الأوسط من المقود ( MHb, حبال وسطي) من المهاد تولد إشارات منشط ذات تردد منخفض.
ما هي إمكانية العمل؟
- الغشاء والأيونات.يحافظ الغشاء البلازمي للخلايا العصبية على توزيع غير متساوٍ للمواد بين الخلية والبيئة خارج الخلية (الشكل 3). ب). من بين هذه المواد هناك أيضًا أيونات صغيرة ، منها K + و Na + مهمة لوصف PD.
يوجد عدد قليل من أيونات Na + داخل الخلية ، ولكن يوجد الكثير بالخارج. لهذا السبب ، يسعون باستمرار للوصول إلى القفص. على العكس من ذلك ، هناك العديد من أيونات K + داخل الخلية ، وهم يسعون جاهدين للخروج منها. لا تستطيع الأيونات القيام بذلك من تلقاء نفسها ، لأن الغشاء غير منفذ لها. لمرور الأيونات عبر الغشاء ، من الضروري فتح بروتينات خاصة - القنوات الأيونيةأغشية. - القنوات الأيونية.تنوع القنوات ضخم. ينفتح بعضها استجابةً لتغير في إمكانات الغشاء ، والبعض الآخر - عندما يرتبط رابط (ناقل عصبي في المشبك ، على سبيل المثال) ، والبعض الآخر - نتيجة للتغيرات الميكانيكية في الغشاء ، إلخ. يتمثل فتح القناة في تغيير هيكلها ، ونتيجة لذلك يمكن للأيونات أن تمر عبرها. تمر بعض القنوات بنوع معين فقط من الأيونات ، بينما تتميز القنوات الأخرى بالموصلية المختلطة.
تلعب القنوات التي "تشعر" بإمكانية الغشاء دورًا رئيسيًا في إنشاء AP - المعتمد المحتملالقنوات الأيونية. تفتح استجابة للتغيرات في إمكانات الغشاء. من بينها ، نحن مهتمون بقنوات الصوديوم المعتمدة على الجهد (قنوات الصوديوم) ، والتي تسمح بمرور أيونات الصوديوم فقط ، وقنوات البوتاسيوم المعتمدة على الجهد (قنوات K) ، والتي تسمح بمرور أيونات K + فقط. - التيار الأيوني و PD.أساس PD هو التيار الأيوني - حركة الأيونات عبر القنوات الأيونية للغشاء. نظرًا لأن الأيونات مشحونة ، فإن تيارها يؤدي إلى تغيير في إجمالي الشحنة داخل وخارج الخلية العصبية ، مما يستلزم على الفور تغييرًا في إمكانات الغشاء.
يحدث توليد AP ، كقاعدة عامة ، في الجزء الأولي من المحور العصبي - في ذلك الجزء منه المجاور لجسم الخلية العصبية ،. هناك العديد من قنوات الصوديوم المركزة هنا. إذا تم فتحهما ، فسوف يندفع تيار قوي من أيونات الصوديوم إلى المحور العصبي ، و نزع الاستقطابالأغشية - انخفاض في إمكانات الغشاء في القيمة المطلقة (الشكل 3 في). بعد ذلك ، عليك العودة إلى قيمتها الأصلية - عودة الاستقطاب. أيونات K + مسؤولة عن هذا. عندما تفتح قنوات K (قبل وقت قصير من الحد الأقصى لـ AP) ، ستبدأ أيونات K + في مغادرة الخلية وإعادة استقطاب الغشاء.
يعتبر نزع الاستقطاب وعودة الاستقطاب مرحلتين رئيسيتين من PD. بالإضافة إلى ذلك ، هناك العديد من المميزات الأخرى ، والتي ، بسبب عدم الضرورة ، لا يتم النظر فيها هنا. يمكن العثور على وصف تفصيلي لتوليد PD في ،. يوجد وصف موجز لـ PD أيضًا في المقالات حول "Biomolecule" ،. - الجزء المحوري الأولي وبدء AP.ما الذي يؤدي إلى فتح قنوات Na في المقطع الأولي للمحور؟ مرة أخرى ، التغيير في إمكانات الغشاء ، "يأتي" على طول التشعبات من الخلايا العصبية (الشكل 3 أ). هو - هي - إمكانات ما بعد المشبكي (PSP) الناتجة عن انتقال متشابك. تم شرح هذه العملية بمزيد من التفصيل في النص الرئيسي.
- إجراء PD.لن تكون قنوات Na القريبة غير مبالية بـ AP في الجزء الأولي من المحور العصبي. سيفتحون أيضًا استجابة لهذا التغيير في إمكانات الغشاء ، والذي سيؤدي أيضًا إلى إطلاق AP. هذا الأخير ، بدوره ، سوف يتسبب في "رد فعل" مشابه في الجزء التالي من المحور العصبي ، بعيدًا عن جسم العصبون ، وهكذا. بهذه الطريقة يحدث ذلك إجراء PD على طول المحور العصبي. في النهاية سوف تصل إلى نهاياتها قبل المشبكية ( سهام قرمزيةفي التين. 3 أ) حيث يمكن أن تؤدي إلى انتقال متشابك.
- استهلاك الطاقة لتوليد AP أقل من عمل المشابك.كم عدد جزيئات ثلاثي فوسفات الأدينوزين (ATP) ، "العملة" الرئيسية للطاقة ، التي يتكلفها PD؟ وفقًا لأحد التقديرات ، بالنسبة للخلايا العصبية الهرمية في القشرة الدماغية للجرذان ، فإن استهلاك الطاقة لتوليد 4 نقاط طاقة في الثانية يبلغ حوالي من إجمالي استهلاك الطاقة للخلايا العصبية. إذا أخذنا في الاعتبار عمليات التشوير الأخرى ، على وجه الخصوص ، الإرسال المتشابك ، ستكون النسبة ⅘. بالنسبة للقشرة المخيخية ، المسؤولة عن الوظائف الحركية ، فإن الوضع مشابه: استهلاك الطاقة لتوليد إشارة خرج هو 15٪ من الكل ، ونصفها تقريبًا لمعالجة معلومات الإدخال. لذلك ، PD ليست العملية الأكثر استهلاكًا للطاقة. في بعض الأحيان ، يتطلب عمل المشبك مزيدًا من الطاقة. ومع ذلك ، هذا لا يعني أن عملية توليد PD لا تظهر ميزات كفاءة الطاقة.

الشكل 3. الخلايا العصبية والقنوات الأيونية وإمكانات العمل. أ - إعادة بناء خلية الشمعدانات في القشرة الدماغية للجرذ. أزرقملطخة التشعبات وجسم الخلايا العصبية (بقعة زرقاء في المركز) ، أحمر- محور عصبي (في العديد من أنواع الخلايا العصبية ، يكون المحور العصبي أكثر تشعبًا من التشعبات ،). الخضرو سهام قرمزيةتشير إلى اتجاه تدفق المعلومات: تستقبلها التشعبات وجسم الخلية العصبية ، ويرسلها المحور العصبي إلى الخلايا العصبية الأخرى. ب - يحتوي غشاء الخلية العصبية ، مثل أي خلية أخرى ، على قنوات أيونية. أكواب خضراء- أيونات الصوديوم ، أزرق- K + أيونات. في - التغييرات في إمكانات الغشاء أثناء توليد جهد فعل (AP) بواسطة عصبون بوركينجي. المنطقة الخضراء: قنوات Na مفتوحة ، تدخل أيونات Na + إلى الخلايا العصبية ، ويحدث نزع الاستقطاب. المنطقة الزرقاء:قنوات K مفتوحة ، مخارج K + ، يحدث عودة الاستقطاب. يتوافق تداخل المنطقتين الخضراء والزرقاء مع الفترة التي يدخل فيها Na + ويخرج K + في وقت واحد.
PD هو تغيير قوي نسبيًا في السعة يشبه القفزة في إمكانات الغشاء.
أظهر تحليل لأنواع مختلفة من الخلايا العصبية (الشكل 4) أن الخلايا العصبية اللافقارية ليست ذات كفاءة عالية في استخدام الطاقة ، وأن بعض الخلايا العصبية للفقاريات تكاد تكون مثالية. وفقًا لنتائج هذه الدراسة ، تبين أن الخلايا العصبية الحُصَينية المشاركة في تكوين الذاكرة والعواطف ، بالإضافة إلى الخلايا العصبية المهادية القشرية ، التي تحمل التدفق الرئيسي للمعلومات الحسية من المهاد إلى القشرة الدماغية ، هي أكبر قدر من الطاقة فعالة.

الشكل 4. الخلايا العصبية المختلفة فعالة بطرق مختلفة.يوضح الشكل مقارنة بين استهلاك الطاقة لأنواع مختلفة من الخلايا العصبية. يتم حساب استهلاك الطاقة في النماذج كما هو الحال مع القيم الأولية (الحقيقية) للمعلمات ( أعمدة سوداء) ، ومع أفضلها ، حيث تؤدي الخلايا العصبية وظيفتها من ناحية ، ومن ناحية أخرى ، فإنها تنفق الحد الأدنى من الطاقة ( أشرطة رمادية). تبين أن نوعين من الخلايا العصبية للفقاريات هما الأكثر فاعلية من تلك المعروضة: الخلايا العصبية الداخلية الحُصَينية ( حصين الفئران الداخلية, RHI) والخلايا العصبية المهادية ( خلية التتابع المهادية القشرية الماوس, نظام MTCR) ، نظرًا لأن استهلاك الطاقة في النموذج الأصلي بالنسبة لهم هو الأقرب إلى استهلاك الطاقة للنموذج الأمثل. في المقابل ، الخلايا العصبية اللافقارية أقل كفاءة. عنوان تفسيري: SA (محوار الحبار) - محوار الحبار العملاق ؛ كاليفورنيا (محوار السلطعون) - محوار السلطعون. MFS (الماوس بسرعة سبايك interneuron القشرية) - الفأر الداخلي القشري السريع ؛ BK (جسم نحل فطر عسل خلية كينيون) هي خلية كينيون للنحلة على شكل فطر.
لماذا هم أكثر كفاءة؟ لأن لديهم القليل من التداخل بين التيارات Na و K. أثناء توليد PD ، هناك دائمًا فترة من الوقت تكون فيها هذه التيارات موجودة في وقت واحد (الشكل 3 في). في هذه الحالة ، لا يوجد عمليًا أي نقل شحنة ، ويكون التغيير في إمكانات الغشاء ضئيلًا. لكن على أي حال ، على المرء أن "يدفع" مقابل هذه التيارات ، على الرغم من "عدم جدواها" خلال هذه الفترة. لذلك ، تحدد مدته مقدار موارد الطاقة المهدرة. كلما كان ذلك أقصر ، زادت كفاءة استخدام الطاقة. أطول ، أقل فعالية. فقط في النوعين المذكورين أعلاه من الخلايا العصبية ، بفضل القنوات الأيونية السريعة ، تكون هذه الفترة قصيرة جدًا ، وتكون PDs هي الأكثر فاعلية.
بالمناسبة ، الخلايا العصبية الداخلية أكثر نشاطًا من معظم الخلايا العصبية الأخرى في الدماغ. في الوقت نفسه ، فهي مهمة للغاية للعمل المنسق والمتزامن للخلايا العصبية ، والتي تشكل معها شبكات محلية صغيرة. من المحتمل أن تكون الكفاءة العالية للطاقة في الخلايا العصبية الداخلية نوعًا من التكيف مع نشاطها العالي ودورها في تنسيق عمل الخلايا العصبية الأخرى.
تشابك عصبى
يحدث انتقال الإشارات من خلية عصبية إلى أخرى في اتصال خاص بين الخلايا العصبية ، في تشابك عصبى . سوف ننظر فقط المشابك الكيميائية (هل هناك المزيد الكهرباء) ، لأنها شائعة جدًا في الجهاز العصبي وهي مهمة لتنظيم التمثيل الغذائي الخلوي ، وتوصيل المغذيات.
في نهاية ما قبل المشبكي للمحور العصبي ، يتسبب AP في إطلاق ناقل عصبي في البيئة خارج الخلية - إلى الخلايا العصبية المستقبلة. هذا الأخير يتطلع فقط إلى هذا: في الغشاء التغصني ، تربط المستقبلات - القنوات الأيونية من نوع معين - الناقل العصبي ، وتفتح وتسمح للأيونات المختلفة بالمرور. ينتج عن هذا توليد صغير إمكانات ما بعد المشبكي(PSP) على غشاء التغصنات. إنه يشبه AP ، ولكنه أصغر بكثير في السعة ويحدث بسبب فتح قنوات أخرى. العديد من هذه الـ PSPs الصغيرة ، كل واحدة من المشبك الخاص بها ، "تتدفق" على طول الغشاء التغصني إلى جسم العصبون ( سهام خضراءفي التين. 3 أ) وتصل إلى الجزء الأولي من المحور العصبي ، حيث تتسبب في فتح قنوات Na و "استفزازها" لتوليد AP.
تسمى هذه المشابك مثير : تساهم في تنشيط الخلايا العصبية وتوليد AP. هناك أيضا مثبط المشابك. على العكس من ذلك ، فهي تساهم في تثبيط ومنع توليد AP. غالبًا ما يكون هناك كلا المشابك العصبية على نفس العصبون. علاقة معينة بين التثبيط والإثارة مهمة لسير العمل الطبيعي للدماغ ، وتشكيل إيقاعات الدماغ التي تصاحب الوظائف الإدراكية العليا.
من الغريب أن إطلاق ناقل عصبي في المشبك قد لا يحدث على الإطلاق - هذه عملية احتمالية. توفر الخلايا العصبية الطاقة بهذه الطريقة: يحدد الإرسال المتشابك بالفعل حوالي نصف إجمالي استهلاك الطاقة للخلايا العصبية. إذا اشتعلت المشابك دائمًا ، فستذهب كل الطاقة لجعلها تعمل ، ولن يتبقى أي موارد لعمليات أخرى. علاوة على ذلك ، فإن الاحتمال المنخفض (20-40٪) لإطلاق الناقل العصبي هو الذي يتوافق مع أعلى كفاءة للطاقة للمشابك. نسبة كمية المعلومات المفيدة إلى الطاقة المنفقة في هذه الحالة هي الحد الأقصى. لذلك ، اتضح أن "الفشل" يلعب دورًا مهمًا في عمل نقاط الاشتباك العصبي ، وبالتالي الدماغ بأكمله. ولا داعي للقلق بشأن إرسال الإشارات مع المشابك "غير العاملة" في بعض الأحيان ، نظرًا لوجود الكثير من نقاط الاشتباك العصبي بين الخلايا العصبية ، وستعمل واحدة منها على الأقل.
ميزة أخرى للإرسال المتشابك هي تقسيم تدفق المعلومات العامة إلى مكونات منفصلة وفقًا لتردد تعديل الإشارة الواردة (تقريبًا ، تردد نقاط الوصول الواردة). ويرجع ذلك إلى مزيج من مستقبلات مختلفة على غشاء ما بعد المشبكي. يتم تنشيط بعض المستقبلات بسرعة كبيرة: على سبيل المثال ، مستقبلات AMPA (AMPA يأتي من α- أ مينو -3 هيدروكسي -5. م إيثيل 4 إيزوكسازول ص روبيونيك أ البحث الجنائي). إذا كانت هذه المستقبلات فقط موجودة على الخلايا العصبية بعد المشبكية ، فيمكنها أن تدرك بوضوح إشارة عالية التردد (مثل ، على سبيل المثال ، في الشكل 2). في). أوضح مثال على ذلك هو الخلايا العصبية للجهاز السمعي التي تشارك في تحديد موقع مصدر الصوت والتعرف بدقة على الأصوات القصيرة مثل النقرات ، والتي يتم تمثيلها على نطاق واسع في الكلام. مستقبلات NMDA (NMDA - من ن -م إيثيل- د -أ سبارتاتي) أبطأ. أنها تسمح للخلايا العصبية باختيار إشارات التردد المنخفض (الشكل 2 جي) ، بالإضافة إلى إدراك السلسلة عالية التردد لـ AP كشيء موحد - ما يسمى بتكامل الإشارات المتشابكة. هناك أيضًا مستقبلات استقلابية أبطأ ، والتي عند ربط ناقل عصبي ، ترسل إشارة إلى سلسلة من "الرسل الثاني" داخل الخلايا لضبط مجموعة متنوعة من العمليات الخلوية. على سبيل المثال ، تنتشر المستقبلات المرتبطة ببروتين G على نطاق واسع. اعتمادًا على النوع ، فهي ، على سبيل المثال ، تنظم عدد القنوات في الغشاء أو تعدل عملها بشكل مباشر.
تسمح مجموعات مختلفة من مستقبلات AMPA السريعة ، ومستقبلات NMDA الأبطأ ، والمستقبلات الأيضية للخلايا العصبية باختيار واستخدام المعلومات الأكثر فائدة لها ، وهو أمر مهم لعملها. ويتم التخلص من المعلومات "غير المجدية" ، ولا "تدركها" الخلايا العصبية. في هذه الحالة ، لا يتعين عليك إنفاق الطاقة على معالجة المعلومات غير الضرورية. هذا جانب آخر لتحسين النقل التشابكي بين الخلايا العصبية.
ماذا بعد؟
يتم أيضًا دراسة كفاءة الطاقة لخلايا الدماغ فيما يتعلق بمورفولوجيتها. تظهر الأبحاث أن التفرع الشجيري والمحاور العصبية ليس فوضويًا كما أنه يوفر الطاقة. على سبيل المثال ، تتفرع المحاور بطريقة تجعل الطول الإجمالي للمسار الذي يمر من خلاله نقطة الوصول هو الأصغر. في هذه الحالة ، يكون استهلاك الطاقة لإجراء AP على طول المحور العصبي ضئيلاً.
يتم تحقيق انخفاض في استهلاك الطاقة للخلايا العصبية أيضًا مع نسبة معينة من المشابك المثبطة والمثيرة. يرتبط هذا ارتباطًا مباشرًا ، على سبيل المثال ، بـ إقفار(حالة مرضية ناتجة عن ضعف تدفق الدم في الأوعية الدموية) في الدماغ. في هذا المرض ، على الأرجح ، تكون الخلايا العصبية الأكثر نشاطًا في التمثيل الغذائي هي أول من يفشل. في القشرة ، يتم تمثيلهم عن طريق الخلايا العصبية الداخلية المثبطة التي تشكل المشابك المثبطة على العديد من الخلايا العصبية الهرمية الأخرى. نتيجة لوفاة interneurons ، ينخفض تثبيط هرمي. نتيجة لذلك ، يزداد المستوى العام لنشاط الأخير (يتم تنشيط المشابك في كثير من الأحيان ، ويتم إنشاء نقاط الوصول في كثير من الأحيان). يتبع ذلك على الفور زيادة في استهلاك الطاقة ، والتي في ظل ظروف نقص التروية يمكن أن تؤدي إلى موت الخلايا العصبية.
عند دراسة الأمراض ، يتم الانتباه أيضًا إلى الانتقال المتشابك باعتباره العملية الأكثر استهلاكًا للطاقة. على سبيل المثال ، في أمراض باركنسون وهنتنغتون والزهايمر ، هناك خلل أو انتقال إلى مشابك الميتوكوندريا ، والتي تلعب دورًا رئيسيًا في تخليق ATP. في حالة مرض باركنسون ، قد يكون هذا بسبب اضطراب وموت الخلايا العصبية المستهلكة للطاقة بشكل كبير من المادة السوداء ، وهو أمر مهم لتنظيم الوظائف الحركية وتوتر العضلات. في مرض هنتنغتون ، يعطل بروتين هنتنغتين الطافر آليات توصيل الميتوكوندريا الجديدة إلى نقاط الاشتباك العصبي ، مما يؤدي إلى "تجويع الطاقة" لهذه الأخيرة ، وزيادة ضعف الخلايا العصبية وتنشيط مفرط. كل هذا يمكن أن يسبب مزيدًا من الاضطراب في عمل الخلايا العصبية ، يليه ضمور في المخطط والقشرة الدماغية. في مرض الزهايمر ، يحدث اضطراب في الميتوكوندريا (بالتوازي مع انخفاض عدد المشابك) بسبب ترسب لويحات الأميلويد. يؤدي عمل الأخير على الميتوكوندريا إلى الإجهاد التأكسدي ، وكذلك إلى موت الخلايا المبرمج - موت الخلايا العصبية.
مرة أخرى عن كل شيء
في نهاية القرن العشرين ، وُلد نهج لدراسة الدماغ ، حيث يتم النظر في خاصيتين مهمتين في وقت واحد: مقدار الخلايا العصبية (أو الشبكة العصبية ، أو المشابك) يشفر وينقل المعلومات المفيدة ومقدار الطاقة فيها يقضي، . نسبتهم هي نوع من المعايير لكفاءة الطاقة للخلايا العصبية والشبكات العصبية والمشابك.
أعطى استخدام هذا المعيار في علم الأعصاب الحسابي زيادة كبيرة في المعرفة فيما يتعلق بدور بعض الظواهر والعمليات. على وجه الخصوص ، انخفاض احتمال إطلاق الناقل العصبي في المشبك ، توازن معين بين تثبيط الخلايا العصبية والإثارة ، إطلاق نوع معين فقط من المعلومات الواردة بسبب مجموعة معينة من المستقبلات - كل هذا يساهم في توفير موارد طاقة قيمة.
علاوة على ذلك ، فإن مجرد تحديد استهلاك الطاقة لعمليات الإشارات (على سبيل المثال ، توليد ، توصيل AP ، انتقال متشابك) يجعل من الممكن معرفة أي منها سيعاني أولاً وقبل كل شيء في انتهاك مرضي لإيصال المغذيات ،. نظرًا لأن المشابك تتطلب قدرًا كبيرًا من الطاقة للعمل ، فهي أول من يفشل في أمراض مثل نقص التروية وأمراض الزهايمر وهنتنغتون. وبالمثل ، فإن تحديد استهلاك الطاقة لأنواع مختلفة من الخلايا العصبية يساعد في معرفة أي منها سيموت في وقت أبكر من الأنواع الأخرى في حالة الإصابة بمرض. على سبيل المثال ، مع نفس نقص التروية ، ستفشل الخلايا العصبية الداخلية في القشرة أولاً. هذه الخلايا العصبية نفسها ، بسبب عملية التمثيل الغذائي المكثف ، هي أكثر الخلايا عرضة للتقدم في العمر ، ومرض الزهايمر والفصام.
شكرًا
أنا ممتن بصدق لوالدي أولغا ناتاليفيتش وألكساندر جوكوف ، والأخوات ليوبا وألينا ، ومشرفي أليكسي برازي ، وأصدقائي الرائعين في المختبر إيفيلينا نيكلسبارج وأولغا سلاتينسكايا على دعمهم وإلهامهم ، والتعليقات القيمة التي تم الإدلاء بها أثناء قراءة المقال. كما أنني ممتن جدًا لـ Anna Petrenko ، محررة المقالة ، و Anton Chugunov ، رئيس تحرير Biomolecule ، للملاحظات والاقتراحات والتعليقات.
المؤلفات
- دماغ شره
- سيمور س كيتي. (1957). الأيض العام للدماغ في فيفو. التمثيل الغذائي للجهاز العصبي. 221-237;
- سوكولوف ، إم ريفيتش ، سي كينيدي ، إم إتش ديس روزيرس ، سي إس باتلاك ، إت. آل (1977). طريقة DEOXYGLUCOSE لقياس استخدام الجلوكوز الدماغي المحلي: النظرية والإجراء والقيم الطبيعية في فئران ألبينو الواعية والممكنة. ي نيوروتشيم. 28 , 897-916;
- Magistretti P.J. (2008). استقلاب طاقة الدماغ. في علم الأعصاب الأساسي // Ed. Squire L.R.، Berg D.، Bloom F.E.، du Lac S.، Ghosh A.، Spitzer N. San Diego: Academic Press، 2008. P. 271–297؛
- بيير ج. ماجستريتي ، إيغور ألامان. (2015). منظور خلوي على استقلاب طاقة الدماغ والتصوير الوظيفي. عصبون. 86 , 883-901;
- وليام ب ليفي ، روبرت أ. باكستر. (1996). الرموز العصبية الموفرة للطاقة. الحساب العصبي. 8 , 531-543;
- شارب بي. وجرين سي (1994). الارتباطات المكانية لأنماط إطلاق الخلايا المفردة في المنطقة الفرعية للفأر المتحرك بحرية. J. نيوروسسي. 14 , 2339–2356;
- H. Hu، J. Gan، P. Jonas. (2014). تسريع سريع ، بارفالبيومين + عصبونات داخلية جابايرجيك: من التصميم الخلوي إلى وظيفة الدوائر الدقيقة. علوم. 345 , 1255263-1255263;
- أوليفر كان ، إسميني إي باباجورجيو ، أندرياس دراجون. (2014). تعتبر الخلايا العصبية الداخلية عالية الطاقة عنصرًا مركزيًا في معالجة المعلومات في الشبكات القشرية. متعب تدفق الدم J-Cereb. 34 , 1270-1282;
- ديفيد أتويل ، سيمون ب. لافلين. (2001). ميزانية الطاقة للإشارة في المادة الرمادية للدماغ. متعب تدفق الدم J-Cereb. 21 , 1133-1145;
- هنري ماركرام ، ماريا توليدو-رودريغيز ، يون وانغ ، أنيرود جوبتا ، جلعاد سيلبربرغ ، كايزي وو. (2004).