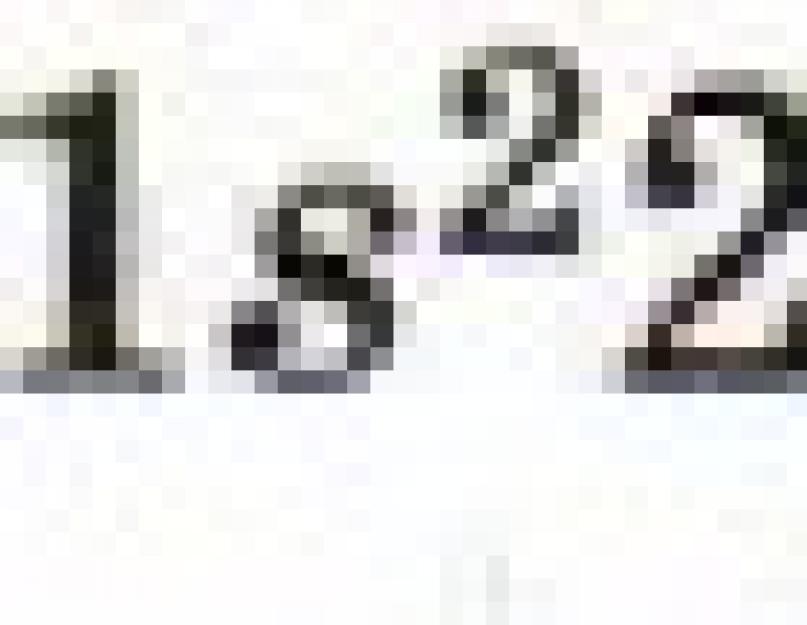إن معرفة الحالات المحتملة للإلكترون في الذرة ، وقاعدة كليشكوفسكي ، ومبدأ باولي ، وقاعدة هوند تجعل من الممكن النظر في التكوين الإلكتروني للذرة. لهذا ، يتم استخدام الصيغ الإلكترونية.
تشير الصيغة الإلكترونية إلى حالة الإلكترون في الذرة ، مما يشير إلى الرقم الكمي الرئيسي الذي يميز حالته برقم ، ورقم الكم المداري بحرف. رقم يشير إلى عدد الإلكترونات في حالة معينة مكتوب على يمين الجزء العلوي من الحرف مشيرًا إلى شكل سحابة الإلكترون.
بالنسبة لذرة الهيدروجين (n \ u003d 1، l \ u003d 0، m \ u003d 0) ، ستكون الصيغة الإلكترونية: 1s 1. كلا إلكترونين عنصر الهليوم التالي لهما نفس قيم n و l و m ويختلفان فقط في السبين. الصيغة الإلكترونية لذرة الهيليوم هي ls 2. الغلاف الإلكتروني لذرة الهليوم كامل ومستقر للغاية. الهيليوم غاز نبيل.
بالنسبة لعناصر الفترة الثانية (n = 2 ، l = 0 أو l = 1) ، يتم ملء حالة 2s أولاً ، ثم المستوى الفرعي p لمستوى الطاقة الثاني.
الصيغة الإلكترونية لذرة الليثيوم هي: ls 2 2s 1. يكون الإلكترون 2s 1 أقل ارتباطًا بالنواة الذرية (الشكل 6) ، لذلك يمكن لذرة الليثيوم التخلي عنه بسهولة (كما تتذكر بوضوح ، تسمى هذه العملية الأكسدة) ، وتتحول إلى Li + أيون.
أرز. 6.
المقاطع العرضية من 1s و 2 s الإلكترون بواسطة طائرة تمر عبر النواة
في ذرة البريليوم ، يحتل الإلكترون الرابع أيضًا الحالة الثانية: ls 2 2s 2. يمكن فصل الإلكترونين الخارجيين لذرة البريليوم بسهولة - في هذه الحالة ، يتأكسد Be إلى الكاتيون Be 2+.
تحتوي ذرة البورون على إلكترون في الحالة 2p: ls 2 2s 2 2p 1. بعد ذلك ، عند ذرات الكربون والنيتروجين والأكسجين والفلور (وفقًا لقاعدة Hund) ، يتم ملء المستوى الفرعي 2p ، والذي ينتهي عند نيون الغاز النبيل: ls 2 2s 2 2p 6.
إذا أردنا التأكيد على أن الإلكترونات في مستوى فرعي معين تشغل الخلايا الكمية واحدة تلو الأخرى ، في الصيغة الإلكترونية ، يصاحب تعيين المستوى الفرعي الفهرس. على سبيل المثال ، الصيغة الإلكترونية لذرة الكربون
![]()
بالنسبة لعناصر الفترة الثالثة ، يتم ملء الحالة 3s (n = 3 ، l = 0) والمستوى الفرعي 3p (n = 3 ، l - 1) ، على التوالي. يظل المستوى الفرعي ثلاثي الأبعاد (ن = 3 ، ل = 2) مجانيًا:
في بعض الأحيان ، في الرسوم البيانية التي تصور توزيع الإلكترونات في الذرات ، يُشار فقط إلى عدد الإلكترونات في كل مستوى طاقة ، أي يكتبون الصيغ الإلكترونية المختصرة لذرات العناصر الكيميائية ، على عكس الصيغ الإلكترونية الكاملة المذكورة أعلاه ، فمثلا:
بالنسبة للعناصر ذات الفترات الكبيرة (الرابعة والخامسة) ، وفقًا لقاعدة كليشكوفسكي ، يشغل أول إلكترونين من طبقة الإلكترون الخارجية حالات 4s (n = 4 ، l = 0) و 5 s (n = 5 ، l = 0 ) على التوالي. 0):
بدءًا من العنصر الثالث لكل فترة كبيرة ، تدخل الإلكترونات العشرة التالية المستويات الفرعية السابقة ثلاثية الأبعاد و 4 د ، على التوالي (لعناصر المجموعات الفرعية الجانبية):
كقاعدة عامة ، عند ملء المستوى الفرعي d السابق ، سيبدأ المستوى الفرعي p الخارجي (4p- و 5p على التوالي) في ملء:
بالنسبة لعناصر الفترات الكبيرة - السادس والسابع غير المكتمل - تمتلئ مستويات الطاقة والمستويات الفرعية بالإلكترونات ، كقاعدة عامة ، على النحو التالي: أول إلكترونين يدخلان المستوى الفرعي s الخارجي ، على سبيل المثال:
الإلكترون التالي (لـ La و Ac) - إلى المستوى الفرعي d السابق:
ثم تدخل الأربعة عشر إلكترونًا التالية مستوى الطاقة الثالث من الخارج إلى المستويين الفرعيين 4f و 5f ، على التوالي ، بالنسبة إلى اللانثانيدات والأكتينيدات:
ثم يبدأ مستوى الطاقة الخارجية الثاني (المستوى الفرعي d) بالتراكم مرة أخرى لعناصر المجموعات الفرعية الجانبية:
فقط بعد امتلاء المستوى الفرعي d بالكامل بعشرة إلكترونات ، سيتم ملء المستوى الفرعي p الخارجي مرة أخرى:
في الختام ، سننظر مرة أخرى في طرق مختلفة لعرض التكوينات الإلكترونية لذرات العناصر وفقًا لفترات جدول D. I. Mendeleev.
ضع في اعتبارك عناصر الفترة الأولى - الهيدروجين والهيليوم.

تظهر الصيغ الإلكترونية للذرات توزيع الإلكترونات على مستويات الطاقة والمستويات الفرعية.
تُظهر الصيغ الإلكترونية الرسومية للذرات توزيع الإلكترونات ليس فقط في المستويات والمستويات الفرعية ، ولكن أيضًا في الخلايا الكمومية (المدارات الذرية).

في ذرة الهليوم ، تكتمل الطبقة الأولى من الإلكترون - تحتوي على إلكترونين.
الهيدروجين والهيليوم عنصران s ؛ المستوى الفرعي ls من هذه الذرات مملوء بالإلكترونات.
بالنسبة لجميع عناصر الفترة الثانية ، تمتلئ طبقة الإلكترون الأولى ، وتملأ الإلكترونات الحالتين 2s و 2p وفقًا لمبدأ أقل طاقة (أول S- ، ثم p) وقواعد Pauli و Hund ( الجدول 2).
في ذرة النيون ، اكتملت طبقة الإلكترون الثانية - تحتوي على 8 إلكترونات.
الجدول 2
هيكل قذائف الإلكترون لذرات عناصر الفترة الثانية


ليثيوم لي ، بيريليوم بي - عناصر s.
البورون B ، الكربون C ، النيتروجين N ، الأكسجين O ، الفلور F ، النيون ني هي عناصر p ، المستوى الفرعي p لهذه الذرات مملوء بالإلكترونات.
بالنسبة لذرات عناصر الفترة الثالثة ، اكتملت الطبقتان الإلكترونيتان الأولى والثانية ؛ لذلك ، يتم ملء طبقة الإلكترون الثالثة ، حيث يمكن للإلكترونات أن تشغل الحالات 3s و 3p و 3d (الجدول 3).
الجدول 3
هيكل قذائف الإلكترون لذرات عناصر الفترة الثالثة

في ذرة المغنيسيوم ، اكتمل المستوى الفرعي 3s. الصوديوم والمغنيسيوم ملغ عناصر s.
بالنسبة للألمنيوم والعناصر التي تليها ، فإن المستوى الفرعي 3p مملوء بالإلكترونات.
يوجد 8 إلكترونات في الطبقة الخارجية (طبقة الإلكترون الثالثة) في ذرة الأرجون. كطبقة خارجية ، فهو مكتمل ، ولكن كما تعلم بالفعل ، يمكن أن يكون هناك 18 إلكترونًا في طبقة الإلكترون الثالثة ، مما يعني أن عناصر الفترة الثالثة لها حالة ثلاثية الأبعاد فارغة.
جميع العناصر من الألومنيوم Al إلى الأرجون Ar هي عناصر p.
تشكل العناصر s- و p- المجموعات الفرعية الرئيسية في النظام الدوري.
تحتوي ذرات عناصر الفترة الرابعة - البوتاسيوم والكالسيوم - على مستوى طاقة رابع ، ويتم ملء المستوى الفرعي 48 (الجدول 4) ، نظرًا لأنه ، وفقًا لقاعدة كليشكوفسكي ، يحتوي على طاقة أقل من المستوى الفرعي ثلاثي الأبعاد.
الجدول 4
هيكل قذائف الإلكترون لذرات عناصر الفترة الرابعة


لتبسيط المعادلات الإلكترونية الرسومية لذرات عناصر الفترة الرابعة:
البوتاسيوم K والكالسيوم الكالسيوم عناصر s مدرجة في المجموعات الفرعية الرئيسية. في الذرات من scandium Sc إلى Zinc Zn ، يمتلئ المستوى الفرعي ثلاثي الأبعاد بالإلكترونات. هذه عناصر ثلاثية الأبعاد. يتم تضمينها في المجموعات الفرعية الثانوية ، ولديها طبقة إلكترون خارجية سابقة مملوءة ، ويشار إليها كعناصر انتقالية.
انتبه إلى بنية غلاف الإلكترون لذرات الكروم والنحاس. في نفوسهم ، يحدث "فشل" لإلكترون واحد من المستوى 4s- إلى المستوى الفرعي ثلاثي الأبعاد ، وهو ما يفسره استقرار الطاقة الأكبر للتكوينات الإلكترونية الناتجة 3d 5 و 3 d 10:

في ذرة الزنك ، اكتمل مستوى الطاقة الثالث ، وتم ملء جميع المستويات الفرعية به - 3s و 3 p و 3 d ، في المجموع لديهم 18 إلكترونًا.
في العناصر التالية للزنك ، يستمر مستوى الطاقة الرابع ، المستوى الفرعي 4p ، بالملء.
العناصر من الجاليوم Ga إلى الكريبتون Kr هي عناصر p.
الطبقة الخارجية (الرابعة) من ذرة الكريبتون Kr مكتملة وتحتوي على 8 إلكترونات. لكن فقط في الطبقة الرابعة من الإلكترون ، كما تعلم ، يمكن أن يكون هناك 32 إلكترونًا ؛ ولا تزال الدولتان 4d و 4 f من ذرة الكريبتون غير مشغولة.
بالنسبة لعناصر الفترة الخامسة ، وفقًا لقاعدة كليشكوفسكي ، يتم ملء المستويات الفرعية بالترتيب التالي: 5s 4d ⇒ 5p. وهناك أيضًا استثناءات مرتبطة "بفشل" الإلكترونات في 41 Nb و 42 Mo و 44 Ru و 45 Rh و 46 Pd و 47 Ag.
في الفترتين السادسة والسابعة ، تظهر عناصر f ، أي العناصر التي يتم فيها ملء المستويات الفرعية 4f و 5 f لمستوى الطاقة الثالث بالخارج ، على التوالي.
تسمى العناصر 4f اللانثانيدات.
تسمى العناصر 5f الأكتينيدات.
ترتيب ملء المستويات الفرعية الإلكترونية في ذرات عناصر الفترة السادسة: 55 Cs و 56 Ba - bs-element ؛ 57 La ... 6 s 2 5d 1 - 5d عنصر ؛ 58 سي - 71 لو - 4 عناصر ؛ 72 Hf - 80 Hg - 5d عنصرًا ؛ 81 TL - 86 Rn - BR العناصر. ولكن حتى هنا توجد عناصر يتم فيها "انتهاك" ترتيب ملء المستويات الفرعية للطاقة ، والتي ترتبط ، على سبيل المثال ، باستقرار أكبر للطاقة بمقدار النصف والمستويات الفرعية f المملوءة بالكامل ، أي nf 7 و nf 14.
اعتمادًا على المستوى الفرعي للذرة المملوء بالإلكترونات أخيرًا ، يتم تقسيم جميع العناصر ، كما فهمت بالفعل ، إلى أربع مجموعات أو كتل إلكترونية (الشكل 7):

أرز. 7.
تقسيم النظام الدوري (الجدول) إلى كتل من العناصر
- عناصر ق. يمتلئ المستوى الفرعي s للمستوى الخارجي للذرة بالإلكترونات ؛ تتضمن عناصر s الهيدروجين والهيليوم وعناصر المجموعات الفرعية الرئيسية للمجموعتين الأولى والثانية ؛
- عناصر ف. يمتلئ المستوى الفرعي p من المستوى الخارجي للذرة بالإلكترونات ؛ تتضمن عناصر p عناصر المجموعات الفرعية الرئيسية للمجموعات III-VIII ؛
- عناصر د. يمتلئ المستوى الفرعي d للمستوى السابق للخارج للذرة بالإلكترونات ؛ تتضمن عناصر d عناصر مجموعات فرعية ثانوية من المجموعات من الأول إلى الثامن ، أي عناصر العقود المتداخلة للفترات الكبيرة الواقعة بين العناصر s و p. وتسمى أيضًا عناصر الانتقال ؛
- عناصر و المستوى الفرعي f للمستوى الخارجي الثالث للذرة مملوء بالإلكترونات ؛ وتشمل هذه اللانثانيدات والأكتينيدات.
أسئلة ومهام للفقرة 3
- قم بعمل مخططات للهيكل الإلكتروني والصيغ الإلكترونية والصيغ الإلكترونية الرسومية لذرات العناصر الكيميائية التالية:
- أ) الكالسيوم
ب) الحديد.
ج) الزركونيوم.
د) النيوبيوم.
ه) الهافنيوم.
هـ) الذهب. - اكتب الصيغة الإلكترونية للعنصر # 110 باستخدام رمز الغاز النبيل المقابل.
- ما هو "تراجع" الإلكترون؟ أعط أمثلة للعناصر التي لوحظت فيها هذه الظاهرة ، اكتب صيغها الإلكترونية.
- كيف يتم تحديد انتماء عنصر كيميائي لعائلة إلكترونية معينة؟
- قارن بين الصيغ الإلكترونية والرسومات الإلكترونية لذرة الكبريت. ما هي المعلومات الإضافية التي تحتويها الصيغة الأخيرة؟
>> الكيمياء: التكوينات الإلكترونية لذرات العناصر الكيميائية
أثبت الفيزيائي السويسري دبليو باولي في عام 1925 أنه في ذرة في مدار واحد لا يمكن أن يكون هناك أكثر من إلكترونين لهما دوران متقابل (مضاد للتوازي) (مترجم من اللغة الإنجليزية "مغزل") ، أي أن يكون لهما خصائص يمكن أن تكون مشروطة يمثل نفسه على أنه دوران للإلكترون حول محوره التخيلي: في اتجاه عقارب الساعة أو عكس اتجاه عقارب الساعة. هذا المبدأ يسمى مبدأ باولي.
إذا كان هناك إلكترون واحد في المدار ، فإنه يسمى غير مزدوج ، إذا كان هناك إلكترونان ، فهذه إلكترونات مقترنة ، أي إلكترونات ذات لفات معاكسة.
يوضح الشكل 5 مخططًا لتقسيم مستويات الطاقة إلى مستويات فرعية.
المدار s ، كما تعلم بالفعل ، كروي. يقع إلكترون ذرة الهيدروجين (s = 1) على هذا المدار وغير مزاوج. لذلك ، ستتم كتابة صيغته الإلكترونية أو تكوينه الإلكتروني على النحو التالي: 1s 1. في الصيغ الإلكترونية ، يُشار إلى رقم مستوى الطاقة بالرقم الموجود أمام الحرف (1 ...) ، ويُشار إلى المستوى الفرعي (النوع المداري) بالحرف اللاتيني ، والرقم المكتوب في أعلى يمين الحرف حرف (كأسس) يوضح عدد الإلكترونات في المستوى الفرعي.
بالنسبة إلى ذرة الهيليوم ، يمتلك He ، إلكترونين مقترنين في نفس المدار s ، هذه الصيغة هي: 1s 2.
الغلاف الإلكتروني لذرة الهليوم كامل ومستقر للغاية. الهيليوم غاز نبيل.
يحتوي مستوى الطاقة الثاني (ن = 2) على أربعة مدارات: واحدة ثانية وثلاثة ع. تتمتع الإلكترونات المدارية من المستوى الثاني (2s-orbitals) بطاقة أعلى ، لأنها على مسافة أكبر من النواة من الإلكترونات المدارية 1s (ن = 2).
بشكل عام ، لكل قيمة n ، يوجد مدار s واحد ، ولكن مع كمية مقابلة من طاقة الإلكترون فيه ، وبالتالي ، بقطر مناظر ، ينمو مع زيادة قيمة n.
p-Orbital له شكل دمبل أو حجم ثمانية. تقع جميع المدارات الثلاثة في الذرة بشكل عمودي على طول الإحداثيات المكانية المرسومة عبر نواة الذرة. يجب التأكيد مرة أخرى على أن كل مستوى طاقة (طبقة إلكترونية) ، بدءًا من n = 2 ، له ثلاثة مدارات p. مع زيادة قيمة n ، تحتل الإلكترونات مدارات p تقع على مسافات كبيرة من النواة وتوجه على طول محاور x و y و z.
بالنسبة لعناصر الفترة الثانية (n = 2) ، يتم ملء أول مدار β ، ثم ثلاثة مدارات p. الصيغة الإلكترونية 1 لتر: 1 ثانية 2 2 ثانية 1. يكون الإلكترون مرتبطًا بنواة الذرة بشكل أضعف ، لذلك يمكن لذرة الليثيوم التخلص منه بسهولة (كما تتذكر بوضوح ، تسمى هذه العملية الأكسدة) ، وتتحول إلى أيون Li +.
في ذرة البريليوم Be 0 ، يقع الإلكترون الرابع أيضًا في مدار 2s: 1s 2 2s 2. يمكن فصل الإلكترونين الخارجيين من ذرة البريليوم بسهولة - يتأكسد Be 0 إلى الكاتيون Be 2+.
في ذرة البورون ، يحتل الإلكترون الخامس مدارًا 2p: 1s 2 2s 2 2p 1. علاوة على ذلك ، تمتلئ الذرات C و N و O و E بمدارات 2p ، والتي تنتهي بغاز النيون النبيل: 1s 2 2s 2 2p 6.
بالنسبة لعناصر الفترة الثالثة ، يتم ملء المدارات Sv و Sp ، على التوالي. تظل خمسة مدارات d من المستوى الثالث مجانية:
11 Na 1s 2 2s 2 Sv1 ؛ 17C11v22822r63r5 ؛ 18Ar P ^ Yor ^ 3p6.
في بعض الأحيان ، في الرسوم البيانية التي تصور توزيع الإلكترونات في الذرات ، يشار فقط إلى عدد الإلكترونات في كل مستوى طاقة ، أي أنهم يكتبون الصيغ الإلكترونية المختصرة لذرات العناصر الكيميائية ، على عكس الصيغ الإلكترونية الكاملة المذكورة أعلاه.
بالنسبة للعناصر ذات الفترات الكبيرة (الرابعة والخامسة) ، يشغل الإلكترونان الأولان المداري الرابع والخامس ، على التوالي: 19 ك 2 ، 8 ، 8 ، 1 ؛ 38 Sr 2 ، 8 ، 18 ، 8 ، 2. بدءًا من العنصر الثالث في كل فترة كبيرة ، ستنتقل الإلكترونات العشرة التالية إلى المدارات السابقة ثلاثية الأبعاد و 4 د ، على التوالي (لعناصر المجموعات الفرعية الثانوية): 23 V 2 ، 8 ، 11 ، 2 ؛ 26 ط 2 ، 8 ، 14 ، 2 ؛ 40 Zr 2، 8، 18، 10، 2 ؛ 43 Tr 2 ، 8 ، 18 ، 13 ، 2. كقاعدة عامة ، عند ملء المستوى الفرعي d السابق ، سيبدأ المستوى الفرعي p الخارجي (4p- و 5p على التوالي) في الملء.
بالنسبة لعناصر الفترات الكبيرة - السادس والسابع غير المكتمل - تمتلئ المستويات الإلكترونية والمستويات الفرعية بالإلكترونات ، كقاعدة عامة ، على النحو التالي: أول إلكترونين سينتقلان إلى المستوى الفرعي β الخارجي: 56 Ba 2 ، 8 ، 18 ، 18 ، 8 ، 2 ؛ 87 غرام 2 ، 8 ، 18 ، 32 ، 18 ، 8 ، 1 ؛ الإلكترون التالي (لـ Na و Ac) إلى السابق (المستوى الفرعي p: 57 La 2 و 8 و 18 و 18 و 9 و 2 و 89 Ac 2 و 8 و 18 و 32 و 18 و 9 و 2.
ثم ستنتقل الإلكترونات الـ 14 التالية إلى مستوى الطاقة الثالث من الخارج في المدارات 4f و 5 f ، على التوالي ، من أجل اللانثانيدات والأكتينيدات.
ثم يبدأ مستوى الطاقة الخارجية الثاني (المستوى الفرعي d) بالتراكم مرة أخرى: لعناصر المجموعات الفرعية الثانوية: 73 Ta 2، 8.18، 32.11، 2 ؛ 104 Rf 2 ، 8.18 ، 32 ، 32.10 ، 2 ، - وأخيراً ، فقط بعد الملء الكامل بعشرة إلكترونات من المستوى الحالي ، سيتم ملء المستوى الفرعي p الخارجي مرة أخرى:
86 يو 2 ، 8 ، 18 ، 32 ، 18 ، 8.
في كثير من الأحيان ، يتم تصوير بنية غلاف الإلكترون للذرات باستخدام الطاقة أو الخلايا الكمومية - يكتبون ما يسمى بالصيغ الإلكترونية الرسومية. بالنسبة لهذا السجل ، يتم استخدام الترميز التالي: يتم الإشارة إلى كل خلية كمية بواسطة خلية تتوافق مع مدار واحد ؛ يُشار إلى كل إلكترون بسهم يتوافق مع اتجاه الدوران. عند كتابة معادلة إلكترونية رسومية ، يجب تذكر قاعدتين: مبدأ باولي ، الذي وفقًا له لا يمكن أن يكون هناك أكثر من إلكترونين في الخلية (المدارات ، ولكن مع دوران مضاد للتوازي) ، وقاعدة F.Hund ، وفقًا للإلكترونات تحتل الخلايا الحرة (المدارات) ، وتقع فيها أولاً واحدة تلو الأخرى وفي نفس الوقت لها نفس قيمة الدوران ، وعندها فقط تتزاوج ، لكن الدورات في هذه الحالة ، وفقًا لمبدأ باولي ، ستكون بالفعل موجهة بشكل معاكس.
في الختام ، دعونا ننظر مرة أخرى في رسم خرائط التكوينات الإلكترونية لذرات العناصر على مدى فترات نظام D. I. Mendeleev. توضح مخططات التركيب الإلكتروني للذرات توزيع الإلكترونات على الطبقات الإلكترونية (مستويات الطاقة). 
في ذرة الهليوم ، تكتمل الطبقة الأولى من الإلكترون - تحتوي على إلكترونين.
الهيدروجين والهيليوم عنصران s ؛ هذه الذرات لها مدار s مملوء بالإلكترونات.
عناصر الفترة الثانية
بالنسبة لجميع عناصر الفترة الثانية ، تمتلئ طبقة الإلكترون الأولى وتملأ الإلكترونات المدارات الإلكترونية و p للطبقة الإلكترونية الثانية وفقًا لمبدأ أقل طاقة (أول s- ثم p) والقواعد باولي وهوند (الجدول 2).
في ذرة النيون ، اكتملت طبقة الإلكترون الثانية - تحتوي على 8 إلكترونات.
الجدول 2 هيكل غلاف الإلكترون لذرات عناصر الفترة الثانية
نهاية الجدول. 2 
لي ، كن - في العناصر.
B ، C ، N ، O ، F ، Ne - p-element ، تمتلئ هذه الذرات بالإلكترونات p-orbitals.
عناصر الفترة الثالثة
بالنسبة لذرات عناصر الفترة الثالثة ، اكتملت الطبقتان الإلكترونيتان الأولى والثانية ؛ لذلك ، يتم ملء طبقة الإلكترون الثالثة ، حيث يمكن للإلكترونات أن تشغل المستويات الفرعية 3s و 3 p و 3 d (الجدول 3).
الجدول 3 هيكل غلاف الإلكترون لذرات عناصر الفترة الثالثة

يكتمل مدار 3 إلكترون في ذرة المغنيسيوم. عناصر Na و Mg-s. 
يوجد 8 إلكترونات في الطبقة الخارجية (طبقة الإلكترون الثالثة) في ذرة الأرجون. كطبقة خارجية ، فهي مكتملة ، ولكن في المجموع ، في طبقة الإلكترون الثالثة ، كما تعلم بالفعل ، يمكن أن يكون هناك 18 إلكترونًا ، مما يعني أن عناصر الفترة الثالثة لها مدارات ثلاثية الأبعاد شاغرة.
جميع العناصر من Al إلى Ag هي عناصر p. تشكل العناصر s- و p- المجموعات الفرعية الرئيسية في النظام الدوري.
تظهر طبقة إلكترون رابعة عند ذرات البوتاسيوم والكالسيوم ، ويمتلئ المستوى الفرعي 4 (الجدول 4) ، نظرًا لأنه يحتوي على طاقة أقل من المستوى الفرعي ثلاثي الأبعاد. لتبسيط الصيغ الإلكترونية الرسومية لذرات عناصر الفترة الرابعة: 1) نشير إلى الصيغة الإلكترونية الرسومية الشرطية للأرجون على النحو التالي:
ع ؛
2) لن نصور المستويات الثانوية التي لم يتم ملؤها لهذه الذرات.
الجدول 4 هيكل غلاف الإلكترون لذرات عناصر الفترة الرابعة


K ، Ca - عناصر s المدرجة في المجموعات الفرعية الرئيسية. بالنسبة للذرات من Sc إلى Zn ، فإن المستوى الفرعي ثلاثي الأبعاد مملوء بالإلكترونات. هذه عناصر ثلاثية الأبعاد. يتم تضمينها في المجموعات الفرعية الثانوية ، ولديها طبقة إلكترون خارجية سابقة مملوءة ، ويشار إليها كعناصر انتقالية.
انتبه إلى بنية غلاف الإلكترون لذرات الكروم والنحاس. في نفوسهم ، يحدث "فشل" لإلكترون واحد من المستوى الفرعي 4n- إلى المستوى الفرعي ثلاثي الأبعاد ، وهو ما يفسره استقرار الطاقة الأكبر للتكوينات الإلكترونية الناتجة 3d 5 و 3 d 10: 
في ذرة الزنك ، اكتملت طبقة الإلكترون الثالثة - تمتلئ جميع المستويات الفرعية 3s و 3 p و 3 d ، في المجموع هناك 18 إلكترونًا عليها.
في العناصر التالية للزنك ، يستمر ملء طبقة الإلكترون الرابعة ، المستوى الفرعي 4p: العناصر من Ga إلى Kr هي عناصر p. 
اكتملت الطبقة الخارجية (الرابعة) من ذرة الكريبتون وتحتوي على 8 إلكترونات. لكن فقط في الطبقة الرابعة من الإلكترون ، كما تعلم ، يمكن أن يكون هناك 32 إلكترونًا ؛ لا تزال المستويات الفرعية 4d و 4 f من ذرة الكريبتون شاغرة.
تملأ عناصر الفترة الخامسة المستويات الفرعية بالترتيب التالي: 5s-> 4d -> 5p. وهناك أيضًا استثناءات مرتبطة بـ "فشل" الإلكترونات ، في 41 Nb ، 42 MO ، إلخ.
في الفترتين السادسة والسابعة ، تظهر العناصر ، أي العناصر التي يتم فيها ملء المستويات الفرعية 4f و 5 f للطبقة الإلكترونية الخارجية الثالثة ، على التوالي.
تسمى العناصر 4f اللانثانيدات.
تسمى العناصر 5f الأكتينيدات.
ترتيب ملء المستويات الفرعية الإلكترونية في ذرات عناصر الفترة السادسة: 55 Сs و 56 а - 6-element ؛
57 La ... 6 s 2 5d 1 - 5d عنصر ؛ 58 سي - 71 لو - 4 عناصر ؛ 72 Hf - 80 Hg - 5d عنصرًا ؛ 81 TL- 86 Rn - 6p- العناصر. ولكن حتى هنا توجد عناصر يتم فيها "انتهاك" ترتيب ملء المدارات الإلكترونية ، والتي ترتبط ، على سبيل المثال ، باستقرار أكبر للطاقة بمقدار النصف ومعبأ بالكامل من المستويات الفرعية f ، أي nf 7 و nf 14.
اعتمادًا على المستوى الفرعي للذرة المملوء بالإلكترونات أخيرًا ، يتم تقسيم جميع العناصر ، كما فهمت بالفعل ، إلى أربع مجموعات أو كتل إلكترونية (الشكل 7).
1) عناصر ق ؛ المستوى الفرعي β للمستوى الخارجي للذرة مملوء بالإلكترونات ؛ تتضمن عناصر s الهيدروجين والهيليوم وعناصر المجموعات الفرعية الرئيسية للمجموعتين الأولى والثانية ؛
2) عناصر ف ؛ يمتلئ المستوى الفرعي p من المستوى الخارجي للذرة بالإلكترونات ؛ تتضمن عناصر p عناصر المجموعات الفرعية الرئيسية للمجموعات III-VIII ؛
3) د العناصر ؛ يمتلئ المستوى الفرعي d للمستوى السابق للخارج للذرة بالإلكترونات ؛ تتضمن عناصر d عناصر مجموعات فرعية ثانوية من المجموعات من الأول إلى الثامن ، أي عناصر العقود المتداخلة للفترات الكبيرة الواقعة بين العناصر s و p. وتسمى أيضًا عناصر الانتقال ؛
4) عناصر f ، المستوى الفرعي f للمستوى الخارجي الثالث للذرة مملوء بالإلكترونات ؛ وتشمل هذه اللانثانيدات والأكتينيدات.
1. ماذا سيحدث إذا لم يتم احترام مبدأ باولي؟
2. ماذا سيحدث إذا لم يتم احترام حكم هوند؟
3. عمل مخططات للهيكل الإلكتروني والصيغ الإلكترونية والصيغ الإلكترونية الرسومية لذرات العناصر الكيميائية التالية: Ca، Fe، Zr، Sn، Nb، Hf، Ra.
4. اكتب الصيغة الإلكترونية للعنصر # 110 باستخدام رمز الغاز النبيل المقابل.
محتوى الدرس ملخص الدرسدعم إطار عرض الدرس بأساليب متسارعة تقنيات تفاعلية يمارس مهام وتمارين امتحان ذاتي ورش عمل ، تدريبات ، حالات ، أسئلة ، واجبات منزلية ، أسئلة مناقشة أسئلة بلاغية من الطلاب الرسوم التوضيحية مقاطع الصوت والفيديو والوسائط المتعددةصور ، صور رسومات ، جداول ، مخططات فكاهة ، نوادر ، نكت ، أمثال كاريكاتورية ، أقوال ، ألغاز كلمات متقاطعة ، اقتباسات الإضافات الملخصاترقائق المقالات لأوراق الغش الفضولي والكتب المدرسية الأساسية والإضافية معجم مصطلحات أخرى تحسين الكتب المدرسية والدروستصحيح الأخطاء في الكتاب المدرسيتحديث جزء في الكتاب المدرسي من عناصر الابتكار في الدرس واستبدال المعرفة القديمة بأخرى جديدة فقط للمعلمين دروس مثاليةخطة التقويم للسنة التوصيات المنهجية لبرنامج المناقشة دروس متكاملةأثبت الفيزيائي السويسري دبليو باولي في عام 1925 أنه في ذرة في مدار واحد لا يمكن أن يكون هناك أكثر من إلكترونين لهما دوران متقابل (مضاد للتوازي) (مترجم من اللغة الإنجليزية "مغزل") ، أي أن يكون لهما خصائص يمكن أن تكون مشروطة يمثل نفسه على أنه دوران للإلكترون حول محوره التخيلي: في اتجاه عقارب الساعة أو عكس اتجاه عقارب الساعة. هذا المبدأ يسمى مبدأ باولي.
إذا كان هناك إلكترون واحد في المدار ، فإنه يسمى غير مزدوج ، إذا كان هناك إلكترونان ، فهذه إلكترونات مقترنة ، أي إلكترونات ذات لفات معاكسة.
يوضح الشكل 5 مخططًا لتقسيم مستويات الطاقة إلى مستويات فرعية.
المدار S ، كما تعلم بالفعل ، كروي. يقع إلكترون ذرة الهيدروجين (s = 1) في هذا المدار وغير مزاوج. لذلك ، ستتم كتابة صيغته الإلكترونية أو تكوينه الإلكتروني على النحو التالي: 1s 1. في الصيغ الإلكترونية ، يُشار إلى رقم مستوى الطاقة بالرقم الموجود أمام الحرف (1 ...) ، ويُشار إلى المستوى الفرعي (النوع المداري) بالحرف اللاتيني ، والرقم المكتوب في أعلى يمين الحرف حرف (كأسس) يوضح عدد الإلكترونات في المستوى الفرعي.
بالنسبة إلى ذرة الهيليوم ، يمتلك He ، إلكترونين مقترنين في نفس المدار s ، هذه الصيغة هي: 1s 2.
الغلاف الإلكتروني لذرة الهليوم كامل ومستقر للغاية. الهيليوم غاز نبيل.
يحتوي مستوى الطاقة الثاني (ن = 2) على أربعة مدارات: واحدة ثانية وثلاثة ع. تتمتع الإلكترونات المدارية من المستوى الثاني (2s-orbitals) بطاقة أعلى ، لأنها على مسافة أكبر من النواة من الإلكترونات المدارية 1s (ن = 2).
بشكل عام ، لكل قيمة n ، يوجد مدار s واحد ، ولكن مع كمية مقابلة من طاقة الإلكترون فيه ، وبالتالي ، بقطر مناظر ، ينمو مع زيادة قيمة n.
المدار R على شكل دمبل أو شكل ثمانية. تقع جميع المدارات الثلاثة في الذرة بشكل عمودي على طول الإحداثيات المكانية المرسومة عبر نواة الذرة. يجب التأكيد مرة أخرى على أن كل مستوى طاقة (طبقة إلكترونية) ، بدءًا من n = 2 ، له ثلاثة مدارات p. مع زيادة قيمة n ، تحتل الإلكترونات مدارات p تقع على مسافات كبيرة من النواة وتوجه على طول محاور x و y و z.
بالنسبة لعناصر الفترة الثانية (n = 2) ، يتم ملء أول مدار β ، ثم ثلاثة مدارات p. الصيغة الإلكترونية 1 لتر: 1 ثانية 2 2 ثانية 1. يكون الإلكترون مرتبطًا بنواة الذرة بشكل أضعف ، لذلك يمكن لذرة الليثيوم التخلص منه بسهولة (كما تتذكر بوضوح ، تسمى هذه العملية الأكسدة) ، وتتحول إلى أيون Li +.
في ذرة البريليوم Be 0 ، يقع الإلكترون الرابع أيضًا في مدار 2s: 1s 2 2s 2. يمكن فصل الإلكترونين الخارجيين من ذرة البريليوم بسهولة - يتأكسد Be 0 إلى الكاتيون Be 2+.
في ذرة البورون ، يحتل الإلكترون الخامس مدارًا 2p: 1s 2 2s 2 2p 1. علاوة على ذلك ، تمتلئ الذرات C و N و O و E بمدارات 2p ، والتي تنتهي بغاز النيون النبيل: 1s 2 2s 2 2p 6.
بالنسبة لعناصر الفترة الثالثة ، يتم ملء المدارات Sv و Sp ، على التوالي. تظل خمسة مدارات d من المستوى الثالث مجانية:
في بعض الأحيان ، في الرسوم البيانية التي تصور توزيع الإلكترونات في الذرات ، يشار فقط إلى عدد الإلكترونات في كل مستوى طاقة ، أي أنهم يكتبون الصيغ الإلكترونية المختصرة لذرات العناصر الكيميائية ، على عكس الصيغ الإلكترونية الكاملة المذكورة أعلاه.
بالنسبة للعناصر ذات الفترات الكبيرة (الرابعة والخامسة) ، يشغل الإلكترونان الأولان المداري الرابع والخامس ، على التوالي: 19 ك 2 ، 8 ، 8 ، 1 ؛ 38 Sr 2 ، 8 ، 18 ، 8 ، 2. بدءًا من العنصر الثالث في كل فترة كبيرة ، ستنتقل الإلكترونات العشرة التالية إلى المدارات السابقة ثلاثية الأبعاد و 4 د ، على التوالي (لعناصر المجموعات الفرعية الثانوية): 23 V 2 ، 8 ، 11 ، 2 ؛ 26 ط 2 ، 8 ، 14 ، 2 ؛ 40 Zr 2، 8، 18، 10، 2 ؛ 43 Tr 2 ، 8 ، 18 ، 13 ، 2. كقاعدة عامة ، عند ملء المستوى الفرعي d السابق ، سيبدأ المستوى الفرعي p الخارجي (4p- و 5p على التوالي) في الملء.
بالنسبة لعناصر الفترات الكبيرة - السادس والسابع غير المكتمل - تمتلئ المستويات الإلكترونية والمستويات الفرعية بالإلكترونات ، كقاعدة عامة ، على النحو التالي: أول إلكترونين سينتقلان إلى المستوى الفرعي β الخارجي: 56 Ba 2 ، 8 ، 18 ، 18 ، 8 ، 2 ؛ 87 غرام 2 ، 8 ، 18 ، 32 ، 18 ، 8 ، 1 ؛ الإلكترون التالي (لـ Na و Ac) إلى السابق (المستوى الفرعي p: 57 La 2 و 8 و 18 و 18 و 9 و 2 و 89 Ac 2 و 8 و 18 و 32 و 18 و 9 و 2.
ثم ستنتقل الإلكترونات الـ 14 التالية إلى مستوى الطاقة الثالث من الخارج في المدارات 4f و 5 f ، على التوالي ، من أجل اللانثانيدات والأكتينيدات.
ثم يبدأ مستوى الطاقة الخارجية الثاني (المستوى الفرعي d) بالتراكم مرة أخرى: لعناصر المجموعات الفرعية الثانوية: 73 Ta 2، 8.18، 32.11، 2 ؛ 104 Rf 2 ، 8.18 ، 32 ، 32.10 ، 2 - وأخيراً ، فقط بعد ملء المستوى الحالي بالكامل بعشرة إلكترونات ، سيتم ملء المستوى الفرعي p الخارجي مرة أخرى:
86 يو 2 ، 8 ، 18 ، 32 ، 18 ، 8.
في كثير من الأحيان ، يتم تصوير بنية غلاف الإلكترون للذرات باستخدام الطاقة أو الخلايا الكمومية - يكتبون ما يسمى بالصيغ الإلكترونية الرسومية. بالنسبة لهذا السجل ، يتم استخدام الترميز التالي: يتم الإشارة إلى كل خلية كمية بواسطة خلية تتوافق مع مدار واحد ؛ يُشار إلى كل إلكترون بسهم يتوافق مع اتجاه الدوران. عند كتابة معادلة إلكترونية رسومية ، يجب تذكر قاعدتين: مبدأ باولي ، الذي وفقًا له لا يمكن أن يكون هناك أكثر من إلكترونين في الخلية (المدارات ، ولكن مع دوران مضاد للتوازي) ، وقاعدة F.Hund ، وفقًا للإلكترونات تحتل الخلايا الحرة (المدارات) ، وتقع فيها أولاً واحدة تلو الأخرى وفي نفس الوقت لها نفس قيمة الدوران ، وعندها فقط تتزاوج ، لكن الدورات في هذه الحالة ، وفقًا لمبدأ باولي ، ستكون بالفعل موجهة بشكل معاكس.
في الختام ، دعونا نفكر مرة أخرى في رسم خرائط التكوينات الإلكترونية لذرات العناصر على مدى فترات نظام D.I Mendeleev. توضح مخططات التركيب الإلكتروني للذرات توزيع الإلكترونات على الطبقات الإلكترونية (مستويات الطاقة). 
في ذرة الهليوم ، تكتمل الطبقة الأولى من الإلكترون - تحتوي على إلكترونين.
الهيدروجين والهيليوم عنصران s ؛ هذه الذرات لها مدار s مملوء بالإلكترونات.
عناصر الفترة الثانية
بالنسبة لجميع عناصر الفترة الثانية ، تمتلئ طبقة الإلكترون الأولى وتملأ الإلكترونات المدارات الإلكترونية و p للطبقة الإلكترونية الثانية وفقًا لمبدأ أقل طاقة (أول s- ثم p) والقواعد باولي وهوند (الجدول 2).
في ذرة النيون ، اكتملت طبقة الإلكترون الثانية - تحتوي على 8 إلكترونات.
الجدول 2 هيكل غلاف الإلكترون لذرات عناصر الفترة الثانية
نهاية الجدول. 2 
لي ، كن β-العناصر.
B ، C ، N ، O ، F ، Ne هي عناصر p ؛ هذه الذرات لها مدارات p مملوءة بالإلكترونات.
عناصر الفترة الثالثة
بالنسبة لذرات عناصر الفترة الثالثة ، اكتملت الطبقتان الإلكترونيتان الأولى والثانية ؛ لذلك ، يتم ملء طبقة الإلكترون الثالثة ، حيث يمكن للإلكترونات أن تشغل المستويات الفرعية 3s و 3 p و 3 d (الجدول 3).
الجدول 3 هيكل غلاف الإلكترون لذرات عناصر الفترة الثالثة

يكتمل مدار 3 إلكترون في ذرة المغنيسيوم. Na و Mg هما عنصران s. 
يوجد 8 إلكترونات في الطبقة الخارجية (طبقة الإلكترون الثالثة) في ذرة الأرجون. كطبقة خارجية ، فهي مكتملة ، ولكن في المجموع ، في طبقة الإلكترون الثالثة ، كما تعلم بالفعل ، يمكن أن يكون هناك 18 إلكترونًا ، مما يعني أن عناصر الفترة الثالثة لها مدارات ثلاثية الأبعاد شاغرة.
جميع العناصر من Al إلى Ar هي عناصر p. تشكل العناصر s- و p- المجموعات الفرعية الرئيسية في النظام الدوري.
تظهر طبقة إلكترون رابعة عند ذرات البوتاسيوم والكالسيوم ، ويمتلئ المستوى الفرعي 4 (الجدول 4) ، نظرًا لأنه يحتوي على طاقة أقل من المستوى الفرعي ثلاثي الأبعاد. لتبسيط الصيغ الإلكترونية الرسومية لذرات عناصر الفترة الرابعة: 1) نشير إلى الصيغة الإلكترونية الرسومية الشرطية للأرجون على النحو التالي:
ع ؛
2) لن نصور المستويات الثانوية التي لم يتم ملؤها لهذه الذرات.
الجدول 4 هيكل غلاف الإلكترون لذرات عناصر الفترة الرابعة


K ، Ca - عناصر s المدرجة في المجموعات الفرعية الرئيسية. بالنسبة للذرات من Sc إلى Zn ، فإن المستوى الفرعي ثلاثي الأبعاد مملوء بالإلكترونات. هذه عناصر ثلاثية الأبعاد. يتم تضمينها في المجموعات الفرعية الثانوية ، ولديها طبقة إلكترون خارجية سابقة مملوءة ، ويشار إليها كعناصر انتقالية.
انتبه إلى بنية غلاف الإلكترون لذرات الكروم والنحاس. في نفوسهم ، يحدث "فشل" لإلكترون واحد من المستوى الفرعي 4n- إلى المستوى الفرعي ثلاثي الأبعاد ، وهو ما يفسره استقرار الطاقة الأكبر للتكوينات الإلكترونية الناتجة 3d 5 و 3 d 10: 
في ذرة الزنك ، تكتمل طبقة الإلكترون الثالثة - تمتلئ جميع المستويات الفرعية 3s و 3 p و 3 d ، في المجموع هناك 18 إلكترونًا عليها.
في العناصر التالية للزنك ، يستمر ملء طبقة الإلكترون الرابعة ، المستوى الفرعي 4p: العناصر من Ga إلى Kr هي عناصر p. 
اكتملت الطبقة الخارجية (الرابعة) من ذرة الكريبتون وتحتوي على 8 إلكترونات. لكن فقط في الطبقة الرابعة من الإلكترون ، كما تعلم ، يمكن أن يكون هناك 32 إلكترونًا ؛ لا تزال المستويات الفرعية 4d و 4 f من ذرة الكريبتون شاغرة.
تملأ عناصر الفترة الخامسة المستويات الفرعية بالترتيب التالي: 5s-> 4d -> 5p. وهناك أيضًا استثناءات مرتبطة بـ "فشل" الإلكترونات ، في 41 Nb ، 42 MO ، إلخ.
في الفترتين السادسة والسابعة ، تظهر العناصر ، أي العناصر التي يتم فيها ملء المستويات الفرعية 4f و 5 f للطبقة الإلكترونية الخارجية الثالثة ، على التوالي.
تسمى العناصر 4f اللانثانيدات.
تسمى العناصر 5f الأكتينيدات.
ترتيب ملء المستويات الفرعية الإلكترونية في ذرات عناصر الفترة السادسة: 55 Сs و 56 а - 6-element ؛
57 La ... 6 s 2 5d 1 - 5d عنصر ؛ 58 سي - 71 لو - 4 عناصر ؛ 72 Hf - 80 Hg - 5d عنصرًا ؛ 81 TL - 86 Rn - 6p عناصر. ولكن حتى هنا توجد عناصر يتم فيها "انتهاك" ترتيب ملء المدارات الإلكترونية ، والتي ترتبط ، على سبيل المثال ، باستقرار أكبر للطاقة بمقدار النصف ومعبأ بالكامل من المستويات الفرعية f ، أي nf 7 و nf 14.
اعتمادًا على المستوى الفرعي للذرة المملوء بالإلكترونات أخيرًا ، يتم تقسيم جميع العناصر ، كما فهمت بالفعل ، إلى أربع مجموعات أو كتل إلكترونية (الشكل 7).
1) عناصر ق ؛ المستوى الفرعي β للمستوى الخارجي للذرة مملوء بالإلكترونات ؛ تتضمن عناصر s الهيدروجين والهيليوم وعناصر المجموعات الفرعية الرئيسية للمجموعتين الأولى والثانية ؛
2) عناصر ف ؛ يمتلئ المستوى الفرعي p من المستوى الخارجي للذرة بالإلكترونات ؛ تتضمن عناصر p عناصر المجموعات الفرعية الرئيسية للمجموعات III-VIII ؛
3) د العناصر ؛ يمتلئ المستوى الفرعي d للمستوى السابق للخارج للذرة بالإلكترونات ؛ تتضمن عناصر d عناصر مجموعات فرعية ثانوية من المجموعات I-VIII ، أي عناصر عقود مقسمة لفترات كبيرة تقع بين عناصر s و p. وتسمى أيضًا عناصر الانتقال ؛
4) عناصر f ، المستوى الفرعي f للمستوى الخارجي الثالث للذرة مملوء بالإلكترونات ؛ وتشمل هذه اللانثانيدات والأكتينيدات.
1. ماذا سيحدث إذا لم يتم احترام مبدأ باولي؟
2. ماذا سيحدث إذا لم يتم احترام حكم هوند؟
3. عمل مخططات للهيكل الإلكتروني والصيغ الإلكترونية والصيغ الإلكترونية الرسومية لذرات العناصر الكيميائية التالية: Ca، Fe، Zr، Sn، Nb، Hf، Ra.
4. اكتب الصيغة الإلكترونية للعنصر # 110 باستخدام رمز الغاز النبيل المقابل.
5. ما هو "فشل" الإلكترون؟ أعط أمثلة للعناصر التي لوحظت فيها هذه الظاهرة ، اكتب صيغها الإلكترونية.
6. كيف يتم تحديد انتماء عنصر كيميائي لعائلة إلكترونية واحدة أو أخرى؟
7. قارن بين الصيغ الإلكترونية والرسومات الإلكترونية لذرة الكبريت. ما هي المعلومات الإضافية التي تحتويها الصيغة الأخيرة؟
6.6. ملامح التركيب الإلكتروني لذرات الكروم والنحاس وبعض العناصر الأخرى
إذا نظرت بعناية في الملحق 4 ، فمن المحتمل أنك لاحظت أنه بالنسبة لذرات بعض العناصر ، فإن تسلسل ملء المدارات بالإلكترونات منتهك. أحيانًا تسمى هذه الانتهاكات "استثناءات" ، لكن الأمر ليس كذلك - لا استثناءات لقوانين الطبيعة!
العنصر الأول مع هذا الانتهاك هو الكروم. دعونا نفكر بمزيد من التفصيل في هيكلها الإلكتروني (الشكل 6.16 أ). تحتوي ذرة الكروم على 4 س-المستوى الفرعي ليس اثنين ، كما يتوقع المرء ، ولكنه إلكترون واحد فقط. لكن ل 3 د- المستوى الفرعي خمسة إلكترونات ، ولكن هذا المستوى الفرعي يتم ملؤه بعد 4 س-المستوى الفرعي (انظر الشكل 6.4). لفهم سبب حدوث ذلك ، دعنا ننظر إلى ماهية السحب الإلكترونية 3 دالمستوى الفرعي لهذه الذرة.
كل من الخمسة 3 د- السحاب في هذه الحالة يتكون من إلكترون واحد. كما تعلمون بالفعل من الفقرة 4 من هذا الفصل ، فإن السحابة الإلكترونية الشائعة لهذه الإلكترونات الخمسة كروية ، أو ، كما يقولون ، متناظرة كرويًا. حسب طبيعة توزيع كثافة الإلكترون في اتجاهات مختلفة ، فهو مشابه لـ 1 س-EO. تبين أن طاقة المستوى الفرعي الذي تشكل إلكتروناته مثل هذه السحابة أقل مما كانت عليه في حالة السحابة الأقل تناسقًا. في هذه الحالة ، طاقة المدارات 3 د- المستوى الفرعي يساوي الطاقة 4 سمداري. عندما ينكسر التناظر ، على سبيل المثال ، عندما يظهر الإلكترون السادس ، تكون طاقة المدارات 3 د- يصبح المستوى الثانوي مرة أخرى أكثر من طاقة 4 سمداري. لذلك ، تحتوي ذرة المنغنيز مرة أخرى على إلكترون ثانٍ لـ 4 س-آو.
التناظر الكروي له سحابة مشتركة من أي مستوى فرعي مملوء بالإلكترونات نصفًا وكاملًا. إن انخفاض الطاقة في هذه الحالات له طبيعة عامة ولا يعتمد على ما إذا كان أي مستوى فرعي نصف أو مملوء بالكامل بالإلكترونات. وإذا كان الأمر كذلك ، فعلينا أن نبحث عن الانتهاك التالي في الذرة ، في غلاف الإلكترون الذي "يأتي" التاسع منه أخيرًا د-إلكترون. في الواقع ، تحتوي ذرة النحاس على 3 د- المستوى الفرعي 10 إلكترونات ، و 4 س- يوجد مستوى فرعي واحد فقط (الشكل 6.16 ب).
إن انخفاض طاقة مدارات مستوى فرعي كامل أو نصف ممتلئ هو سبب عدد من الظواهر الكيميائية المهمة ، والتي سوف تتعرف على بعضها.
6.7 الإلكترونات الخارجية والتكافؤ والمدارات والمستويات الفرعية
في الكيمياء ، لا يتم دراسة خصائص الذرات المعزولة ، كقاعدة عامة ، لأن جميع الذرات تقريبًا ، كونها جزءًا من مواد مختلفة ، تشكل روابط كيميائية. تتشكل الروابط الكيميائية أثناء تفاعل الأصداف الإلكترونية للذرات. بالنسبة لجميع الذرات (باستثناء الهيدروجين) ، لا تشارك جميع الإلكترونات في تكوين روابط كيميائية: بالنسبة للبورون ، ثلاثة من خمسة إلكترونات للكربون ، وأربعة من ستة ، وعلى سبيل المثال ، للباريوم ، اثنان من أصل خمسين- ستة. تسمى هذه الإلكترونات "النشطة" إلكترونات التكافؤ.
في بعض الأحيان يتم الخلط بين إلكترونات التكافؤ خارجيالإلكترونات ، لكنهما ليسا نفس الشيء.
السحب الإلكترونية للإلكترونات الخارجية لها أقصى نصف قطر (والقيمة القصوى لعدد الكم الرئيسي).

إن الإلكترونات الخارجية هي التي تشارك في تكوين الروابط في المقام الأول ، وذلك فقط لأنه عندما تقترب الذرات من بعضها البعض ، تتلامس الغيوم الإلكترونية التي تشكلها هذه الإلكترونات أولاً وقبل كل شيء. ولكن إلى جانبهم ، يمكن أيضًا أن يشارك جزء من الإلكترونات في تكوين رابطة. قبل الخارجية(قبل الأخيرة) ، ولكن فقط إذا كانت لديهم طاقة لا تختلف كثيرًا عن طاقة الإلكترونات الخارجية. كل من هذه الإلكترونات وغيرها من الإلكترونات للذرة تكافؤ. (في اللانثانيدات والأكتينيدات ، حتى بعض الإلكترونات "السابقة الخارجية" هي تكافؤ)
طاقة إلكترونات التكافؤ أكبر بكثير من طاقة إلكترونات الذرة الأخرى ، وتختلف إلكترونات التكافؤ في الطاقة عن بعضها البعض بشكل أقل.
تكون الإلكترونات الخارجية دائمًا متكافئة فقط إذا كان بإمكان الذرة تكوين روابط كيميائية على الإطلاق. لذلك ، كلا إلكترونين ذرة الهليوم هما خارجيان ، لكن لا يمكن تسميتهما التكافؤ ، لأن ذرة الهيليوم لا تشكل أي روابط كيميائية على الإطلاق.
تحتل إلكترونات التكافؤ مدارات التكافؤ، والذي بدوره شكل المستويات الفرعية التكافؤ.

كمثال ، ضع في اعتبارك ذرة حديد ، يظهر التكوين الإلكتروني لها في الشكل. 6.17. من إلكترونات ذرة الحديد ، العدد الكمي الأساسي الأقصى ( ن= 4) فقط اثنين 4 س-إلكترون. لذلك ، هم الإلكترونات الخارجية لهذه الذرة. المدارات الخارجية لذرة الحديد كلها مدارات بها ن= 4 ، والمستويات الفرعية الخارجية هي جميع المستويات الفرعية التي شكلتها هذه المدارات ، أي 4 س-,
4ص-, 4د- و 4 F-EEPU.
الإلكترونات الخارجية هي دائمًا تكافؤ ، لذلك ، 4 س- إلكترونات ذرة الحديد هي إلكترونات تكافؤ. وإذا كان الأمر كذلك ، فعندئذٍ 3 د- الإلكترونات ذات الطاقة الأعلى قليلاً ستكون أيضًا تكافؤًا. في المستوى الخارجي لذرة الحديد ، بالإضافة إلى 4 المعبأة س-AO لا يزال هناك مجاني 4 ص-, 4د- و 4 F-آو. جميعها خارجية ، لكن 4 منها فقط تكافؤ ص-AO ، لأن طاقة المدارات المتبقية أعلى بكثير ، وظهور الإلكترونات في هذه المدارات لا يفيد ذرة الحديد.
إذن ، ذرة الحديد
المستوى الإلكتروني الخارجي - الرابع ،
المستويات الفرعية الخارجية - 4 س-, 4ص-, 4د- و 4 F-EEPU ،
المدارات الخارجية - 4 س-, 4ص-, 4د- و 4 F-أو ،
الإلكترونات الخارجية - اثنان 4 س-إلكترون (4 س 2),
الطبقة الخارجية للإلكترون هي الرابعة ،
سحابة إلكترونية خارجية - 4 س-EO
مستويات التكافؤ الفرعية - 4 س-, 4ص- و 3 د-EEPU ،
مدارات التكافؤ - 4 س-, 4ص- و 3 د-أو ،
إلكترونات التكافؤ - اثنان 4 س-إلكترون (4 س 2) وستة 3 د-الإلكترونات (3 د 6).
يمكن ملء المستويات الفرعية من التكافؤ جزئيًا أو كليًا بالإلكترونات ، أو يمكن أن تظل حرة على الإطلاق. مع زيادة شحنة النواة ، تنخفض قيم الطاقة لجميع المستويات الفرعية ، ولكن بسبب تفاعل الإلكترونات مع بعضها البعض ، تتناقص طاقة المستويات الفرعية المختلفة مع "سرعة" مختلفة. طاقة ممتلئة بالكامل د- و F- تنخفض المستويات الفرعية كثيرًا لدرجة أنها لم تعد تكافؤًا.
كمثال ، تأمل ذرات التيتانيوم والزرنيخ (الشكل 6.18).

في حالة ذرة التيتانيوم 3 د-EEPU مملوءة جزئيًا بالإلكترونات ، وطاقتها أكبر من طاقة 4 س-EEPU و 3 د-الإلكترونات هي التكافؤ. في ذرة الزرنيخ 3 د- تمتلئ وحدة المعالجة الإلكترونية بالكامل بالإلكترونات ، وطاقتها أقل بكثير من الطاقة 4 س-EEPU ، وبالتالي 3 د-الإلكترونات ليست تكافؤ.
في هذه الأمثلة ، قمنا بتحليلها التكوين الإلكتروني التكافؤذرات التيتانيوم والزرنيخ.
يتم وصف التكوين الإلكتروني التكافؤ للذرة على أنه صيغة التكافؤ الإلكترونية، أو في النموذج مخطط الطاقة للمستويات الفرعية التكافؤ.
VALENCE ELECTRONES، EXTERNAL ELECTRONES، VALENCE EPU، VALENCE AO، VALENCE ELECTRON CONFIGURATION OF THE ATOM، VALENCE ELECTRON FORMULA، VALENCE SUBLEVEL DIAGRAM.
1. في مخططات الطاقة التي قمت بتجميعها وفي الصيغ الإلكترونية الكاملة للذرات Na و Mg و Al و Si و P و S و Cl و Ar ، تشير إلى الإلكترونات الخارجية وإلكترونات التكافؤ. اكتب معادلات التكافؤ الإلكترونية لهذه الذرات. في مخططات الطاقة ، قم بتمييز الأجزاء المقابلة لمخططات الطاقة لمستويات التكافؤ الفرعية.
2. ما هو مشترك بين التكوينات الإلكترونية للذرات أ) Li و Na و B و Al و O و S و Ne و Ar ؛ ب) الزنك والمغنيسيوم والسكريات والألمنيوم والكروم والزنك والتي تي والسيليكون ؛ ج) H و He و Li و O و K و Kr و Sc و Ga. ما هي اختلافاتهم
3. كم عدد المستويات الفرعية للتكافؤ في غلاف الإلكترون لذرة كل عنصر من العناصر: أ) الهيدروجين والهيليوم والليثيوم ، ب) النيتروجين والصوديوم والكبريت ، ج) البوتاسيوم والكوبالت والجرمانيوم
4. كم عدد مدارات التكافؤ المملوءة بالكامل عند ذرة أ) البورون ، ب) الفلور ، ج) الصوديوم؟
5. كم عدد المدارات التي تحتوي على إلكترون غير مزاوج تحتوي ذرة على أ) البورون ، ب) الفلور ، ج) الحديد
6. كم عدد المدارات الخارجية الحرة التي تمتلكها ذرة المنغنيز؟ كم عدد التكافؤات المجانية؟
7. في الدرس التالي ، قم بإعداد شريط من الورق بعرض 20 مم ، وقسمه إلى خلايا (20 × 20 مم) ، وقم بتطبيق سلسلة طبيعية من العناصر على هذا الشريط (من الهيدروجين إلى الميتريوم).
8. في كل خلية ، ضع رمز العنصر ورقمه التسلسلي وصيغة التكافؤ الإلكترونية ، كما هو موضح في الشكل. 6.19 (استخدم الملحق 4).

6.8 تنظيم الذرات وفقًا لهيكل غلافها الإلكتروني
يعتمد تنظيم العناصر الكيميائية على التسلسل الطبيعي للعناصر
و مبدأ تشابه قذائف الإلكترونذراتهم.
أنت تعرف بالفعل النطاق الطبيعي للعناصر الكيميائية. الآن دعنا نتعرف على مبدأ تشابه قذائف الإلكترون.
بالنظر إلى صيغ التكافؤ الإلكترونية للذرات في NRE ، من السهل العثور على أنها تختلف فقط في قيم عدد الكم الرئيسي لبعض الذرات. على سبيل المثال ، 1 س 1 للهيدروجين ، 2 س 1 لليثيوم ، 3 س 1 للصوديوم ، إلخ. أو 2 س 2 2ص 5 للفلور ، 3 س 2 3ص 5 للكلور ، 4 س 2 4ص 5 للبروم ، إلخ. وهذا يعني أن المناطق الخارجية لسحب إلكترونات التكافؤ لهذه الذرات متشابهة جدًا في الشكل وتختلف فقط في الحجم (وبالطبع ، في كثافة الإلكترون). وإذا كان الأمر كذلك ، فيمكن استدعاء السحب الإلكترونية لهذه الذرات وتكوينات التكافؤ المقابلة لها مماثل. بالنسبة لذرات العناصر المختلفة ذات التكوينات الإلكترونية المتشابهة ، يمكننا الكتابة الصيغ الإلكترونية التكافؤ المشترك: نانوثانية 1 في الحالة الأولى و نانوثانية 2 np 5 في الثانية. بالانتقال على طول السلسلة الطبيعية للعناصر ، يمكن للمرء أن يجد مجموعات أخرى من الذرات ذات تكوينات تكافؤ مماثلة.
في هذا الطريق، في السلسلة الطبيعية للعناصر ، تحدث بانتظام ذرات ذات تكوينات إلكترونية متكافئة مماثلة.
هذا هو مبدأ تشابه أغلفة الإلكترون.
دعونا نحاول الكشف عن شكل هذا الانتظام. للقيام بذلك ، سوف نستخدم السلسلة الطبيعية للعناصر التي قمت بإنشائها.

تبدأ NRE بالهيدروجين ، الذي تكون صيغته الإلكترونية التكافؤ 1 سواحد . بحثًا عن تكوينات تكافؤ مماثلة ، قمنا بقص السلسلة الطبيعية للعناصر أمام العناصر باستخدام صيغة إلكترونية مشتركة للتكافؤ نانوثانية 1 (أي قبل الليثيوم ، قبل الصوديوم ، إلخ). لقد تلقينا ما يسمى ب "فترات" من العناصر. دعنا نضيف "الفترات" الناتجة بحيث تصبح صفوف جدول (انظر الشكل 6.20). نتيجة لذلك ، لن يكون لهذه التكوينات الإلكترونية سوى ذرات أول عمودين من الجدول.
دعنا نحاول تحقيق تشابه في التكوينات الإلكترونية التكافؤ في أعمدة أخرى من الجدول. للقيام بذلك ، قمنا بقص العناصر بالأرقام 58-71 و 90-103 من الفترتين السادسة والسابعة (لديهم 4 F- و 5 F-المستويات الفرعية) وضعها تحت الطاولة. سيتم إزاحة رموز العناصر المتبقية أفقيًا كما هو موضح في الشكل. بعد ذلك ، سيكون لذرات العناصر الموجودة في نفس العمود من الجدول تكوينات تكافؤ مماثلة ، والتي يمكن التعبير عنها في الصيغ الإلكترونية العامة للتكافؤ: نانوثانية 1 , نانوثانية 2 , نانوثانية 2 (ن–1)د 1 , نانوثانية 2 (ن–1)د 2 وهكذا دواليك حتى نانوثانية 2 np 6. يتم شرح جميع الانحرافات عن معادلات التكافؤ العامة بنفس الأسباب كما في حالة الكروم والنحاس (انظر الفقرة 6.6).
كما ترون ، باستخدام NRE وتطبيق مبدأ تشابه أغلفة الإلكترون ، تمكنا من تنظيم العناصر الكيميائية. يسمى هذا النظام من العناصر الكيميائية طبيعي، لأنها تستند فقط إلى قوانين الطبيعة. الجدول الذي تلقيناه (الشكل 6.21) هو أحد طرق تصوير النظام الطبيعي للعناصر بيانياً ويسمى جدول زمني طويل للعناصر الكيميائية.

مبدأ تشابه الأصداف الإلكترونية ، النظام الطبيعي للعناصر الكيميائية (النظام "الدوري") ، جدول العناصر الكيميائية.
6.9 جدول زمني طويل للعناصر الكيميائية
دعنا نتعرف بمزيد من التفصيل على هيكل الجدول الطويل للعناصر الكيميائية.
تسمى صفوف هذا الجدول ، كما تعلم بالفعل ، "فترات" من العناصر. تم ترقيم الفترات بالأرقام العربية من 1 إلى 7. لا يوجد سوى عنصرين في الفترة الأولى. يتم استدعاء الفترتين الثانية والثالثة ، التي تحتوي كل منها على ثمانية عناصر قصيرةفترات. يتم استدعاء الفترتين الرابعة والخامسة ، التي تحتوي كل منها على 18 عنصرًا طويلفترات. تسمى الفترتان السادسة والسابعة ، التي تحتوي كل منها على 32 عنصرًا طويل جدافترات.
تسمى أعمدة هذا الجدول مجموعاتعناصر. يشار إلى أرقام المجموعة بأرقام رومانية بأحرف لاتينية A أو B.
عناصر بعض المجموعات لها أسماء (مجموعة) مشتركة خاصة بها: عناصر مجموعة IA (Li، Na، K، Rb، Cs، Fr) - العناصر القلوية(أو العناصر المعدنية القلوية) ؛ عناصر المجموعة IIA (Ca ، Sr ، Ba ، Ra) - عناصر الأرض القلوية(أو العناصر المعدنية الأرضية القلوية) (تشير أسماء "الفلزات القلوية" وفلزات الأرض القلوية "إلى مواد بسيطة تكونت من العناصر المقابلة ولا يجب استخدامها كأسماء لمجموعات العناصر) ؛ عناصر المجموعة VIA (O ، S ، Se ، Te ، Po) - الكالكوجينات، عناصر المجموعة VIIA (F، Cl، Br، I، At) - الهالوجينات، عناصر المجموعة VIIIA (He ، Ne ، Ar ، Kr ، Xe ، Rn) - عناصر الغازات النبيلة(الاسم التقليدي "الغازات النبيلة" ينطبق أيضًا على المواد البسيطة)
العناصر الموضوعة عادة في الجزء السفلي من الجدول مع الأرقام التسلسلية 58-71 (Ce - Lu) تسمى اللانثانيدات("اللانثانم التالي") ، والعناصر ذات الأرقام التسلسلية 90-103 (Th - Lr) - الأكتينيدات("الأكتينيوم التالي"). يوجد متغير من جدول الفترة الطويلة ، حيث لا يتم قطع اللانثانيدات والأكتينيدات من NRE ، ولكنها تبقى في أماكنها لفترات طويلة جدًا. هذا الجدول يسمى في بعض الأحيان فترة طويلة اضافية.
جدول الفترة الطويلة مقسم إلى أربعة الكتلة(أو أقسام).
ق كتلةيتضمن عناصر من مجموعات IA و IIA مع الصيغ الإلكترونية المشتركة التكافؤ نانوثانية 1 و نانوثانية 2
(عناصر ق).
ف بلوكيتضمن عناصر من المجموعة IIIA إلى VIIIA مع الصيغ الإلكترونية المشتركة للتكافؤ من نانوثانية 2 np 1 ل نانوثانية 2 np 6 (ف العناصر).
د بلوكيتضمن عناصر من مجموعة IIIB إلى IIB مع صيغ إلكترونية مشتركة للتكافؤ من نانوثانية 2 (ن–1)د 1 ل نانوثانية 2 (ن–1)د 10 (د-العناصر).
و - بلوكيشمل اللانثانيدات والأكتينيدات ( و العناصر).

عناصر س- و ص- تشكل الكتل المجموعات A والعناصر د-الكتلة- مجموعة ب من نظام العناصر الكيميائية. الجميع F-العناصر مدرجة رسميًا في المجموعة IIIB.
عناصر الفترة الأولى - الهيدروجين والهيليوم - هي س-العناصر ويمكن وضعها في مجموعات IA و IIA. ولكن غالبًا ما يتم وضع الهيليوم في المجموعة VIIIA كعنصر تنتهي به الفترة ، والذي يتوافق تمامًا مع خصائصه (الهيليوم ، مثل جميع المواد البسيطة الأخرى التي تشكلها عناصر هذه المجموعة ، غاز نبيل). غالبًا ما يتم وضع الهيدروجين في المجموعة VIIA ، نظرًا لأن خصائصه أقرب بكثير إلى الهالوجينات منها إلى العناصر القلوية.
تبدأ كل فترة من فترات النظام بعنصر له تكوين تكافؤ للذرات نانوثانية 1 ، نظرًا لأنه من هذه الذرات يبدأ تكوين طبقة الإلكترون التالية ، وينتهي بعنصر بتكوين التكافؤ للذرات نانوثانية 2 np 6 (باستثناء الفترة الأولى). هذا يجعل من السهل تحديد مجموعات المستويات الفرعية في مخطط الطاقة المملوء بالإلكترونات في ذرات كل فترة (الشكل 6.22). قم بهذا العمل مع جميع المستويات الفرعية الموضحة في النسخة التي أنشأتها من الشكل 6.4. المستويات الفرعية الموضحة في الشكل 6.22 (باستثناء المستويات المعبأة بالكامل د- و F-المستويات الفرعية) هي التكافؤ لذرات جميع عناصر فترة معينة.
الظهور في فترات س-, ص-, د- أو F- العناصر تتوافق تمامًا مع تسلسل التعبئة س-, ص-, د- أو F- المستويات الفرعية للإلكترونات. تسمح هذه الميزة لنظام العناصر ، بمعرفة الفترة والمجموعة ، التي تتضمن عنصرًا معينًا ، بكتابة صيغة التكافؤ الإلكترونية على الفور.
جدول الفترات الطويلة للعناصر الكيميائية ، والكتل ، والفترات ، والمجموعات ، والعناصر القلوية ، وعناصر الأرض القلوية ، والكالوجينات ، والهالوجين ، وعناصر الغازات النبيلة ، واللانثينيدات ، والأكتينيدات.
اكتب الصيغ الإلكترونية العامة للتكافؤ لذرات العناصر أ) مجموعات IVA و IVB ، ب) مجموعات IIIA و VIIB؟
2. ما هو الشائع بين التكوينات الإلكترونية لذرات العناصر A و B؟ كيف يختلفون؟
3. كم عدد مجموعات العناصر المدرجة في أ) س- بلوك ، ب) ص- بلوك ، ج) د-الكتلة؟
4. تابع الشكل 30 في اتجاه زيادة طاقة المستويات الفرعية وحدد مجموعات المستويات الفرعية المملوءة بالإلكترونات في الفترات الرابعة والخامسة والسادسة.
5. اكتب مستويات التكافؤ الفرعية للذرات أ) الكالسيوم ، ب) الفوسفور ، ج) التيتانيوم ، د) الكلور ، هـ) الصوديوم. 6. قم بصياغة كيفية اختلاف العناصر s و p و d عن بعضها البعض.
7. اشرح سبب انتماء الذرة إلى أي عنصر يتحدد بعدد البروتونات في النواة وليس بواسطة كتلة هذه الذرة.
8. بالنسبة لذرات الليثيوم والألمنيوم والسترونشيوم والسيلينيوم والحديد والرصاص ، اصنع التكافؤ والصيغ الإلكترونية الكاملة والمختصرة وارسم مخططات الطاقة للمستويات الفرعية التكافؤ. 9. الذرات التي تتوافق عناصرها مع الصيغ الإلكترونية التالية التكافؤ: 3 س 1 , 4س 1 3د 1 ، 2 ثانية 2 2 ص 6 , 5س 2 5ص 2 , 5س 2 4د 2 ?
6.10. أنواع الصيغ الإلكترونية للذرة. خوارزمية تجميعها
لأغراض مختلفة ، نحتاج إلى معرفة التكوين الكامل أو التكوين التكافؤ للذرة. يمكن تمثيل كل من هذه التكوينات الإلكترونية بواسطة صيغة ومخطط للطاقة. هذا هو، التكوين الإلكتروني الكامل للذرةأعربت الصيغة الإلكترونية الكاملة للذرة، أو رسم تخطيطي للطاقة الكاملة للذرة. بدوره ، تكوين إلكترون التكافؤ للذرةأعربت التكافؤ(أو كما يطلق عليه غالبًا ، " قصيرة ") الصيغة الإلكترونية للذرة، أو رسم تخطيطي لمستويات التكافؤ الفرعية للذرة(الشكل 6.23).

في السابق ، صنعنا صيغًا إلكترونية للذرات باستخدام الأرقام الترتيبية للعناصر. في الوقت نفسه ، حددنا تسلسل ملء المستويات الفرعية بالإلكترونات وفقًا لمخطط الطاقة: 1 س, 2س,
2ص, 3س, 3ص, 4س, 3د, 4ص, 5س, 4د, 5ص,
6س, 4F, 5د, 6ص, 7سوهلم جرا. وفقط من خلال كتابة الصيغة الإلكترونية الكاملة ، يمكننا أيضًا كتابة صيغة التكافؤ.
من الأنسب كتابة معادلة التكافؤ الإلكترونية للذرة ، والتي تُستخدم غالبًا ، بناءً على موضع العنصر في نظام العناصر الكيميائية ، وفقًا لإحداثيات مجموعة الفترة.
دعونا نفكر بالتفصيل في كيفية عمل ذلك للعناصر س-, ص- و د- كتل.
للعناصر ستتكون الصيغة الإلكترونية من كتلة التكافؤ للذرة من ثلاثة رموز. بشكل عام ، يمكن كتابتها على النحو التالي:
في المقام الأول (بدلاً من خلية كبيرة) هو رقم الفترة (يساوي العدد الكمي الرئيسي لها س-الإلكترون) ، وفي الثالث (في مرتفع) - عدد المجموعة (يساوي عدد إلكترونات التكافؤ). بأخذ ذرة المغنيسيوم كمثال (الفترة الثالثة ، المجموعة IIA) ، نحصل على:
للعناصر ص- تتكون الصيغة الإلكترونية من كتلة التكافؤ للذرة من ستة رموز:
![]()
هنا ، بدلاً من الخلايا الكبيرة ، يتم وضع رقم الفترة أيضًا (يساوي العدد الكمي الرئيسي لهذه الخلايا س- و ص-electrons) ، واتضح أن رقم المجموعة (يساوي عدد إلكترونات التكافؤ) يساوي مجموع الأحرف المرتفعة. بالنسبة لذرة الأكسجين (الفترة الثانية ، مجموعة VIA) نحصل على:
2س 2 2ص 4 .
صيغة التكافؤ الإلكترونية لمعظم العناصر ديمكن كتابة الكتلة على النحو التالي:
كما في الحالات السابقة ، هنا بدلاً من الخلية الأولى ، يتم وضع رقم الفترة (يساوي العدد الكمي الرئيسي لهذه سالإلكترونات). تبين أن الرقم الموجود في الخلية الثانية أقل بمقدار واحد ، نظرًا لأن العدد الكمي الرئيسي لهؤلاء د-الإلكترونات. رقم المجموعة هنا يساوي أيضًا مجموع المؤشرات. مثال على ذلك هو صيغة التكافؤ الإلكترونية من التيتانيوم (الفترة الرابعة ، مجموعة IVB): 4 س 2 3د 2 .
رقم المجموعة يساوي مجموع المؤشرات وعناصر مجموعة VIB ، لكنهم ، كما تتذكر ، في التكافؤ س-المستوى الفرعي يحتوي على إلكترون واحد فقط ، والصيغة الإلكترونية العامة للتكافؤ نانوثانية 1 (ن–1)د 5. لذلك ، فإن صيغة التكافؤ الإلكترونية ، على سبيل المثال ، الموليبدينوم (الفترة الخامسة) هي 5 س 1 4د 5 .
من السهل أيضًا تكوين معادلة التكافؤ الإلكترونية لأي عنصر من عناصر مجموعة IB ، على سبيل المثال ، الذهب (الفترة السادسة)> -> 6 س 1 5د 10 ، ولكن في هذه الحالة عليك أن تتذكر ذلك د- تظل إلكترونات ذرات عناصر هذه المجموعة متكافئة ، ويمكن لبعضها أن يشارك في تكوين روابط كيميائية.
الصيغة الإلكترونية العامة للتكافؤ لذرات عناصر المجموعة IIB هي - نانوثانية 2 (ن – 1)دعشرة. لذلك ، فإن صيغة التكافؤ الإلكترونية ، على سبيل المثال ، لذرة الزنك هي 4 س 2 3د 10 .
الصيغ الإلكترونية التكافؤ لعناصر الثالوث الأول (Fe ، Co و Ni) تخضع أيضًا للقواعد العامة. الحديد ، أحد عناصر المجموعة VIIIB ، له صيغة إلكترونية تكافؤ 4 س 2 3د 6. ذرة الكوبالت لها واحدة د-إلكترون أكثر (4 س 2 3د 7) ، بينما تحتوي ذرة النيكل على اثنين (4 س 2 3د 8).
باستخدام هذه القواعد فقط لكتابة صيغ التكافؤ الإلكترونية ، من المستحيل تكوين الصيغ الإلكترونية لذرات البعض د-العناصر (Nb ، Ru ، Rh ، Pd ، Ir ، Pt) ، نظرًا للميل إلى قذائف الإلكترون شديدة التناظر ، فإن ملء المستويات الفرعية التكافؤ بالإلكترونات له بعض الميزات الإضافية.
بمعرفة صيغة التكافؤ الإلكترونية ، يمكن للمرء أيضًا كتابة الصيغة الإلكترونية الكاملة للذرة (انظر أدناه).
في كثير من الأحيان ، بدلاً من الصيغ الإلكترونية الكاملة المرهقة ، يكتبون الصيغ الإلكترونية المختصرةذرات. لتجميعها في الصيغة الإلكترونية ، يتم اختيار جميع إلكترونات الذرة باستثناء إلكترونات التكافؤ ، ووضع رموزها بين قوسين مربعين وجزء من الصيغة الإلكترونية يتوافق مع الصيغة الإلكترونية لذرة العنصر الأخير من العنصر السابق. يتم استبدال النقطة (العنصر الذي يشكل الغاز النبيل) برمز هذه الذرة.
أمثلة على الصيغ الإلكترونية من أنواع مختلفة موضحة في الجدول 14.
الجدول 14 أمثلة على الصيغ الإلكترونية للذرات
الصيغ الإلكترونية |
|||
مختصر |
التكافؤ |
||
1س 2 2س 2 2ص 3 |
2س 2 2ص 3 |
2س 2 2ص 3 |
|
1س 2 2س 2 2ص 6 3س 2 3ص 5 |
3س 2 3ص 5 |
3س 2 3ص 5 |
|
1س 2 2س 2 2ص 6 3س 2 3ص 6 4س 2 3د 5 |
4س 2 3د 5 |
4س 2 3د 5 |
|
1س 2 2س 2 2ص 6 3س 2 3ص 6 3د 10 4س 2 4ص 3 |
4س 2 4ص 3 |
4س 2 4ص 3 |
|
1س 2 2س 2 2ص 6 3س 2 3ص 6 3د 10 4س 2 4ص 6 |
4س 2 4ص 6 |
4س 2 4ص 6 |
|
خوارزمية لتجميع الصيغ الإلكترونية للذرات (على سبيل المثال من ذرة اليود)
№ |
عملية |
نتيجة |
|
حدد إحداثيات الذرة في جدول العناصر. |
الفترة 5 ، المجموعة VIIA |
||
اكتب صيغة التكافؤ الإلكترونية. |
5س 2 5ص 5 |
||
أضف رموز الإلكترونات الداخلية بالترتيب الذي تملأ به المستويات الفرعية. |
1س 2 2س 2 2ص 6 3س 2 3ص 6 4س 2 3د 10 4ص 6 5س 2 4د 10 5ص 5 |
||
مع مراعاة انخفاض الطاقة المملوءة بالكامل د- و F- المستويات الفرعية ، اكتب الصيغة الإلكترونية الكاملة. |
|
||
قم بتسمية إلكترونات التكافؤ. |
1س 2 2س 2 2ص 6 3س 2 3ص 6 3د 10 4س 2 4ص 6 4د 10 5س 2 5ص 5 |
||
حدد التكوين الإلكتروني لذرة الغازات النبيلة السابقة. |
|||
اكتب الصيغة الإلكترونية المختصرة ، واجمعها بين قوسين معقوفين غير التكافؤالإلكترونات. |
5س 2 5ص 5 |
ملحوظات
1. بالنسبة لعناصر الفترتين الثانية والثالثة ، تؤدي العملية الثالثة (بدون الرابعة) على الفور إلى صيغة إلكترونية كاملة.
2. (ن – 1)د 10- تبقى الإلكترونات متكافئة عند ذرات عناصر مجموعة IB.
الصيغة الإلكترونية الكاملة ، الصيغة الإلكترونية VALENCE ، الصيغة الإلكترونية المختصرة ، الخوارزمية لتكوين الصيغة الإلكترونية للذرات.
1. يؤلف معادلة التكافؤ الإلكترونية لذرة العنصر أ) الفترة الثانية من المجموعة أ الثالثة ، ب) الفترة الثالثة من المجموعة أ الثانية ، ج) الفترة الرابعة من المجموعة أ الرابعة.
2. عمل صيغ إلكترونية مختصرة من ذرات المغنيسيوم والفوسفور والبوتاسيوم والحديد والبرومين والأرجون.
6.11. جدول الفترة القصيرة للعناصر الكيميائية
على مدى أكثر من 100 عام مرت منذ اكتشاف النظام الطبيعي للعناصر ، تم اقتراح عدة مئات من أكثر الجداول تنوعًا والتي تعكس هذا النظام بيانياً. من بين هؤلاء ، بالإضافة إلى جدول الفترة الطويلة ، ما يسمى بجدول الفترة القصيرة لعناصر D. I. Mendeleev هو الأكثر استخدامًا على نطاق واسع. يتم الحصول على جدول فترة قصيرة من فترة طويلة إذا تم قطع الفترات الرابعة والخامسة والسادسة والسابعة أمام عناصر مجموعة IB ، وتم فصلها عن بعضها وإضافة الصفوف الناتجة بنفس الطريقة التي أضفناها الفترات السابقة. تظهر النتيجة في الشكل 6.24.

يتم وضع اللانثانيدات والأكتينيدات أيضًا تحت الجدول الرئيسي هنا.
في مجموعاتيحتوي هذا الجدول على العناصر التي تحتوي ذراتها نفس عدد إلكترونات التكافؤبغض النظر عن المدارات التي توجد فيها هذه الإلكترونات. لذا فإن عناصر الكلور (عنصر نموذجي يتكون من مادة غير فلزية ؛ 3 س 2 3ص 5) والمنغنيز (عنصر تشكيل المعادن ؛ 4 س 2 3د 5) ، لا تمتلك تشابه قذائف الإلكترون ، تقع هنا في نفس المجموعة السابعة. الحاجة إلى التمييز بين هذه العناصر تجعل من الضروري التفرد في مجموعات مجموعات فرعية: رئيسي- نظائرها من المجموعات A لجدول الفترة الطويلة و آثار جانبيةهي نظائرها من المجموعات B. في الشكل 34 ، تم إزاحة رموز عناصر المجموعات الفرعية الرئيسية إلى اليسار ، ورموز عناصر المجموعات الفرعية الثانوية إلى اليمين.
صحيح أن مثل هذا الترتيب للعناصر في الجدول له مزايا أيضًا ، لأن عدد إلكترونات التكافؤ هو الذي يحدد بشكل أساسي قدرات التكافؤ للذرة.
يعكس جدول الفترة الطويلة قوانين التركيب الإلكتروني للذرات ، والتشابه وأنماط التغيرات في خواص المواد والمركبات البسيطة حسب مجموعات العناصر ، والتغير المنتظم في عدد من الكميات الفيزيائية التي تميز الذرات والمواد والمركبات البسيطة. في جميع أنحاء نظام العناصر ، وأكثر من ذلك بكثير. جدول الفترة القصيرة أقل ملاءمة في هذا الصدد.
جدول الفترات القصيرة ، المجموعات الفرعية الرئيسية ، المجموعات الثانوية الثانوية.
1. قم بتحويل جدول الفترة الطويلة الذي قمت بإنشائه من سلسلة العناصر الطبيعية إلى جدول قصير المدة. قم بإجراء التحويل العكسي.
2. هل من الممكن عمل صيغة الكترونية تكافؤ عامة لذرات عناصر مجموعة واحدة لجدول فترة قصيرة؟ لماذا ا؟
6.12. أحجام الذرة. نصف قطر المداري
.الذرة ليس لها حدود واضحة. ما هو حجم الذرة المعزولة؟ نواة الذرة محاطة بغلاف إلكتروني ، وتتكون القشرة من غيوم إلكترونية. يتميز حجم EO بنصف قطر صس. جميع السحب في الطبقة الخارجية لها نفس نصف القطر تقريبًا. لذلك ، يمكن تمييز حجم الذرة بهذا نصف القطر. يدعي نصف القطر المداري للذرة(ص 0).
ترد قيم نصف القطر المداري للذرات في الملحق 5.
يعتمد نصف قطر EO على شحنة النواة وعلى مدار الإلكترون الذي يشكل هذه السحابة. وبالتالي ، فإن نصف القطر المداري للذرة يعتمد أيضًا على هذه الخصائص نفسها.
ضع في اعتبارك الغلاف الإلكتروني لذرات الهيدروجين والهيليوم. تقع الإلكترونات في ذرة الهيدروجين وفي ذرة الهيليوم على 1 س-آو ، وسحبها سيكون لها نفس الحجم إذا كانت شحنات نوى هذه الذرات متماثلة. لكن شحنة نواة ذرة الهيليوم هي ضعف شحنة نواة ذرة الهيدروجين. وفقًا لقانون كولوم ، فإن قوة الجذب المؤثرة على كل من إلكترونات ذرة الهيليوم هي ضعف قوة جذب الإلكترون لنواة ذرة الهيدروجين. لذلك ، يجب أن يكون نصف قطر ذرة الهيليوم أصغر بكثير من نصف قطر ذرة الهيدروجين. وهناك: ص 0 (ذكر) / ص 0 (ح) = 0.291 هـ / 0.529 هـ 0.55.
تحتوي ذرة الليثيوم على إلكترون خارجي عند 2 س-AO ، أي يشكل سحابة من الطبقة الثانية. بطبيعة الحال ، يجب أن يكون نصف قطرها أكبر. حقًا: ص 0 (لي) = 1.586 ج.
تحتوي ذرات العناصر المتبقية من الفترة الثانية على إلكترونات خارجية (و 2 س، و 2 ص) في نفس طبقة الإلكترون الثانية ، وتزداد شحنة نواة هذه الذرات مع زيادة الرقم التسلسلي. تنجذب الإلكترونات بقوة أكبر إلى النواة ، وبطبيعة الحال ، ينخفض نصف قطر الذرات. يمكننا تكرار هذه الحجج لذرات عناصر الفترات الأخرى ، ولكن مع توضيح واحد: يتناقص نصف قطر المدار بشكل رتيب فقط عندما يتم ملء كل مستوى من المستويات الفرعية.
لكن إذا تجاهلنا التفاصيل ، فإن الطبيعة العامة للتغيير في حجم الذرات في نظام من العناصر تكون على النحو التالي: مع زيادة الرقم التسلسلي في فترة ما ، ينخفض نصف القطر المداري للذرات ، وفي مجموعة يزدادون. أكبر ذرة هي ذرة السيزيوم ، وأصغر ذرة هيليوم ، ولكن من ذرات العناصر التي تشكل مركبات كيميائية (الهيليوم والنيون لا يشكلونها) ، وأصغر ذرة الفلور.
معظم ذرات العناصر التي تقف في الصف الطبيعي بعد اللانثانيدات لها أنصاف أقطار مدارية أصغر إلى حد ما مما قد يتوقعه المرء ، بناءً على القوانين العامة. هذا يرجع إلى حقيقة أن 14 لانثانيدًا تقع بين اللانثانم والهافنيوم في نظام العناصر ، وبالتالي فإن الشحنة النووية لذرة الهافنيوم هي 14 هأكثر من اللانثانم. لذلك ، تنجذب الإلكترونات الخارجية لهذه الذرات إلى النواة بقوة أكبر مما تنجذب في غياب اللانثانيدات (يُطلق على هذا التأثير غالبًا "انكماش اللانثانيد").
يرجى ملاحظة أنه عند الانتقال من ذرات عناصر المجموعة VIIIA إلى ذرات عناصر المجموعة IA ، يزداد نصف القطر المداري بشكل مفاجئ. وبالتالي ، تبين أن اختيارنا للعناصر الأولى لكل فترة (انظر الفقرة 7) كان صحيحًا.
الشعاع المداري للذرة ، تغيره في نظام العناصر.
1. وفقًا للبيانات الواردة في التذييل 5 ، ارسم على ورقة الرسم البياني اعتماد نصف القطر المداري للذرة على الرقم التسلسلي للعنصر للعناصر ذات ضمن 1 إلى 40. طول المحور الأفقي 200 مم ، وطول المحور الرأسي 100 مم.
2. كيف يمكنك تمييز ظهور الخط المكسور الناتج؟
6.13. طاقة تأين الذرة
إذا أعطيت إلكترونًا في ذرة طاقة إضافية (ستتعلم كيفية القيام بذلك من دورة فيزياء) ، فيمكن للإلكترون أن ينتقل إلى AO آخر ، أي أن الذرة ستنتهي في حالة حماس. هذه الحالة غير مستقرة ، وسيعود الإلكترون على الفور تقريبًا إلى حالته الأصلية ، وسيتم إطلاق الطاقة الزائدة. ولكن إذا كانت الطاقة الممنوحة للإلكترون كبيرة بما يكفي ، فيمكن للإلكترون أن ينفصل تمامًا عن الذرة ، بينما تتفكك الذرة مؤينأي أنه يتحول إلى أيون موجب الشحنة ( الكاتيون). الطاقة اللازمة للقيام بذلك تسمى طاقة التأين للذرة(هو).
من الصعب إلى حد ما تمزيق إلكترون من ذرة واحدة وقياس الطاقة اللازمة لذلك ، لذلك يتم تحديدها واستخدامها عمليًا طاقة التأين المولي(ه وم).
تُظهر طاقة التأين المولي أصغر طاقة مطلوبة لفصل مول واحد من الإلكترونات من مول واحد من الذرات (إلكترون واحد من كل ذرة). تُقاس هذه القيمة عادةً بالكيلوجول لكل مول. وترد قيم طاقة التأين المولي للإلكترون الأول لمعظم العناصر في الملحق 6.
كيف تعتمد طاقة التأين للذرة على موضع العنصر في نظام العناصر ، أي كيف تتغير في المجموعة والفترة؟
من الناحية الفيزيائية ، فإن طاقة التأين تساوي العمل الذي يجب إنفاقه للتغلب على قوة جذب إلكترون إلى ذرة عند نقل إلكترون من ذرة إلى مسافة لا نهائية منها.
أين فهي شحنة الإلكترون ، سهي شحنة الكاتيون المتبقية بعد إزالة الإلكترون ، و صس هو نصف القطر المداري للذرة.
و ف، و سهي قيم ثابتة ، ويمكن استنتاج أن عمل فصل الإلكترون لكنومعها طاقة التأين هوتتناسب عكسيا مع نصف قطر مدار الذرة.
بعد تحليل قيم نصف القطر المداري لذرات العناصر المختلفة والقيم المقابلة لطاقة التأين الواردة في الملحقين 5 و 6 ، يمكنك أن ترى أن الاعتماد بين هذه القيم قريب من التناسب ، ولكن إلى حد ما مختلف عنه. السبب في أن استنتاجنا لا يتفق جيدًا مع البيانات التجريبية هو أننا استخدمنا نموذجًا تقريبيًا للغاية لا يأخذ في الاعتبار العديد من العوامل المهمة. لكن حتى هذا النموذج التقريبي سمح لنا باستخلاص النتيجة الصحيحة التي مفادها أنه مع زيادة نصف القطر المداري ، تنخفض طاقة التأين للذرة ، وعلى العكس من ذلك ، مع انخفاض نصف القطر ، تزداد.
نظرًا لأن نصف القطر المداري للذرات يتناقص في فترة مع زيادة الرقم التسلسلي ، تزداد طاقة التأين. في المجموعة ، مع زيادة العدد الذري ، يزداد نصف قطر المدار للذرات ، كقاعدة عامة ، وتقل طاقة التأين. أعلى طاقة تأين مولارية توجد في أصغر الذرات ، ذرات الهيليوم (2372 كيلوجول / مول) ، والذرات القادرة على تكوين روابط كيميائية ، في ذرات الفلور (1681 كيلوجول / مول). أصغر ذرات السيزيوم أكبر (376 كيلوجول / مول). في نظام العناصر ، يمكن إظهار اتجاه زيادة طاقة التأين بشكل تخطيطي على النحو التالي: 
في الكيمياء ، من المهم أن تميز طاقة التأين ميل الذرة للتبرع بإلكتروناتها: فكلما زادت طاقة التأين ، قل ميل الذرة للتبرع بالإلكترونات ، والعكس صحيح.
الحالة المثارة ، التأين ، الموجبة الموجبة ، طاقة التأين ، طاقة التأين المولي ، التغير في طاقة التأين في نظام من العناصر.
1. باستخدام البيانات الواردة في الملحق 6 ، حدد مقدار الطاقة التي تحتاج إلى إنفاقها لتمزيق إلكترون واحد من جميع ذرات الصوديوم بكتلة إجمالية قدرها 1 جم.
2. باستخدام البيانات الواردة في الملحق 6 ، حدد عدد المرات التي يجب إنفاقها من الطاقة الإضافية لفصل إلكترون واحد من جميع ذرات الصوديوم بكتلة 3 جم عن كل ذرات البوتاسيوم من نفس الكتلة. لماذا تختلف هذه النسبة عن نسبة طاقات التأين المولي لنفس الذرات؟
3. وفقًا للبيانات الواردة في التذييل 6 ، ارسم اعتماد طاقة التأين المولي على الرقم التسلسلي للعناصر ذات ضمن 1 إلى 40. أبعاد الرسم البياني هي نفسها كما في مهمة الفقرة السابقة. تحقق مما إذا كان هذا الرسم البياني يطابق اختيار "فترات" نظام العناصر.
6.14. طاقة تقارب الإلكترون
.ثاني أهم خصائص الطاقة في الذرة هي طاقة تقارب الإلكترون(همع).
في الممارسة العملية ، كما في حالة طاقة التأين ، عادةً ما يتم استخدام الكمية المولية المقابلة - طاقة تقارب الإلكترون المولي().
تُظهر طاقة تقارب الإلكترون المولي ما هي الطاقة المنبعثة عند إضافة مول واحد من الإلكترونات إلى مول واحد من الذرات المحايدة (إلكترون واحد لكل ذرة). مثل طاقة التأين المولية ، تُقاس هذه الكمية أيضًا بالكيلوجول لكل مول.
للوهلة الأولى ، قد يبدو أنه لا ينبغي إطلاق الطاقة في هذه الحالة ، لأن الذرة عبارة عن جسيم محايد ، ولا توجد قوى جذب إلكتروستاتيكية بين ذرة محايدة وإلكترون سالب الشحنة. على العكس من ذلك ، عند الاقتراب من الذرة ، يبدو أن الإلكترون يجب أن يتنافر بنفس الإلكترونات سالبة الشحنة التي تشكل غلاف الإلكترون. في الواقع، وهذا ليس صحيحا. تذكر إذا سبق لك التعامل مع الكلور الذري. بالطبع لا. بعد كل شيء ، يوجد فقط في درجات حرارة عالية جدًا. حتى الكلور الجزيئي الأكثر استقرارًا لا يوجد عمليًا في الطبيعة - إذا لزم الأمر ، يجب الحصول عليه باستخدام التفاعلات الكيميائية. وعليك أن تتعامل مع كلوريد الصوديوم (الملح الشائع) طوال الوقت. بعد كل شيء ، يستهلك الشخص ملح الطعام كل يوم. وهو شائع جدًا في الطبيعة. ولكن بعد كل شيء ، يحتوي ملح الطعام على أيونات الكلوريد ، أي ذرات الكلور التي تعلق إلكترونًا "إضافيًا" لكل منها. أحد أسباب انتشار أيونات الكلوريد هو أن ذرات الكلور تميل إلى ربط الإلكترونات ، أي عندما تتشكل أيونات الكلوريد من ذرات الكلور والإلكترونات ، يتم إطلاق الطاقة.
إن أحد أسباب إطلاق الطاقة معروف لك بالفعل - فهو مرتبط بزيادة في تناظر غلاف الإلكترون لذرة الكلور أثناء الانتقال إلى شحنة مفردة أنيون. في نفس الوقت ، كما تتذكر ، الطاقة 3 ص- انخفاض المستوى الفرعي. هناك أسباب أخرى أكثر تعقيدًا.
نظرًا لحقيقة أن عدة عوامل تؤثر على قيمة طاقة تقارب الإلكترون ، فإن طبيعة التغيير في هذه القيمة في نظام من العناصر أكثر تعقيدًا من طبيعة التغيير في طاقة التأين. يمكنك التحقق من ذلك من خلال تحليل الجدول الوارد في الملحق 7. ولكن نظرًا لأن قيمة هذه الكمية يتم تحديدها بشكل أساسي من خلال نفس التفاعل الكهروستاتيكي مثل قيم طاقة التأين ، فإن تغييرها في نظام العناصر (على الأقل في A- المجموعات) بشكل عام يشبه التغيير في طاقة التأين ، أي تقل طاقة تقارب الإلكترون في مجموعة ، وفي فترة تزداد. الحد الأقصى هو عند ذرات الفلور (328 كيلوجول / مول) والكلور (349 كيلوجول / مول). تشبه طبيعة التغيير في طاقة تقارب الإلكترون في نظام من العناصر طبيعة التغيير في طاقة التأين ، أي يمكن إظهار اتجاه الزيادة في طاقة تقارب الإلكترون بشكل تخطيطي على النحو التالي:
2. على نفس المقياس على طول المحور الأفقي كما في المهام السابقة ، ارسم اعتماد الطاقة المولية لتقارب الإلكترون على الرقم التسلسلي لذرات العناصر ذات ضمن 1 إلى 40 باستخدام التطبيق 7.
3. ما المعنى المادي لطاقات تقارب الإلكترون السلبية؟
4. لماذا ، من بين جميع ذرات عناصر الفترة الثانية ، فقط البريليوم والنيتروجين والنيون لها قيم سلبية للطاقة المولية لتقارب الإلكترون؟
6.15. ميل الذرات للتبرع بالالكترونات واكتسابها
أنت تعلم بالفعل أن ميل الذرة للتبرع بإلكتروناتها الخاصة وقبول الإلكترونات الأجنبية يعتمد على خصائص طاقتها (طاقة التأين وطاقة تقارب الإلكترون). ما هي الذرات الأكثر ميلًا للتبرع بإلكتروناتها ، وأي الذرات تميل أكثر لقبول الغرباء؟
للإجابة على هذا السؤال ، دعونا نلخص في الجدول 15 كل ما نعرفه عن التغيير في هذه الميول في نظام العناصر.
الجدول 15
التكوين الإلكترونيةالذرة هي تمثيل عددي لمداراتها الإلكترونية. مدارات الإلكترون هي مناطق ذات أشكال مختلفة تقع حول النواة الذرية ، حيث من المحتمل رياضيًا العثور على إلكترون. يساعد التكوين الإلكتروني في إخبار القارئ بسرعة وسهولة عن عدد مدارات الإلكترون في الذرة ، وكذلك تحديد عدد الإلكترونات في كل مدار. بعد قراءة هذا المقال ، ستتقن طريقة تجميع التكوينات الإلكترونية.
خطوات
توزيع الإلكترونات باستخدام النظام الدوري لـ D. I. Mendeleev
- على سبيل المثال ، ذرة الصوديوم بشحنة -1 سيكون لها إلكترون إضافي بالإضافة الىإلى العدد الذري الأساسي الخاص بها وهو 11. وبعبارة أخرى ، سيكون للذرة 12 إلكترونًا في المجموع.
- إذا كنا نتحدث عن ذرة صوديوم بشحنة +1 ، فيجب طرح إلكترون واحد من العدد الذري الأساسي 11. إذن سيكون للذرة 10 إلكترونات.
-
احفظ قائمة المدارات الأساسية.مع زيادة عدد الإلكترونات في الذرة ، فإنها تملأ المستويات الفرعية المختلفة لقشرة الإلكترون للذرة وفقًا لتسلسل معين. يحتوي كل مستوى فرعي من غلاف الإلكترون ، عند ملئه ، على عدد زوجي من الإلكترونات. هناك المستويات الفرعية التالية:
افهم سجل التكوين الإلكتروني.تتم كتابة التكوينات الإلكترونية لتعكس بوضوح عدد الإلكترونات في كل مدار. تتم كتابة المدارات بالتسلسل ، مع كتابة عدد الذرات في كل مدار على شكل حرف مرتفع على يمين الاسم المداري. التكوين الإلكتروني المكتمل له شكل سلسلة من التعيينات ذات المستوى الفرعي والنصوص المرتفعة.
- هنا ، على سبيل المثال ، هو أبسط تكوين إلكتروني: 1s 2 2s 2 2p 6.يوضح هذا التكوين أن هناك إلكترونين في المستوى الفرعي 1s ، وإلكترونين في المستوى الفرعي 2s ، وستة إلكترونات في المستوى الفرعي 2p. مجموع 2 + 2 + 6 = 10 إلكترونات. هذا هو التكوين الإلكتروني لذرة النيون المحايدة (العدد الذري للنيون هو 10).
-
تذكر ترتيب المدارات.ضع في اعتبارك أن مدارات الإلكترون مرقمة بترتيب تصاعدي لرقم غلاف الإلكترون ، ولكنها مرتبة بترتيب تصاعدي للطاقة. على سبيل المثال ، يمتلك المدار 4s 2 طاقة أقل (أو قدرة أقل على الحركة) من 3d 10 المملوء أو المملوء جزئيًا ، لذلك تتم كتابة مدار 4s أولاً. بمجرد معرفة ترتيب المدارات ، يمكنك بسهولة ملئها وفقًا لعدد الإلكترونات في الذرة. الترتيب الذي تملأ به المدارات هو كما يلي: 1s ، 2s ، 2p ، 3s ، 3p ، 4s ، 3d ، 4p ، 5s ، 4d ، 5p ، 6s ، 4f ، 5d ، 6p ، 7s ، 5f ، 6d ، 7p.
- سيكون التكوين الإلكتروني للذرة التي تملأ فيها جميع المدارات بالشكل التالي: 10 7p 6
- لاحظ أن الترميز أعلاه ، عند ملء جميع المدارات ، هو التكوين الإلكتروني للعنصر Uuo (ununoctium) 118 ، أعلى ذرة مرقمة في الجدول الدوري. لذلك ، يحتوي هذا التكوين الإلكتروني على جميع المستويات الفرعية الإلكترونية المعروفة حاليًا لذرة مشحونة بشكل محايد.
-
املأ المدارات حسب عدد الإلكترونات في ذرتك.على سبيل المثال ، إذا أردنا تدوين التكوين الإلكتروني لذرة الكالسيوم المحايدة ، يجب أن نبدأ بالبحث عن عددها الذري في الجدول الدوري. عددها الذري هو 20 ، لذلك سنكتب تكوين ذرة تحتوي على 20 إلكترونًا وفقًا للترتيب أعلاه.
- املأ المدارات بالترتيب أعلاه حتى تصل إلى الإلكترون العشرين. سيحتوي المدار الأول 1s على إلكترونين ، وسيحتوي المدار 2s أيضًا على إلكترونين ، وسيحتوي المدار 2p على ستة ، وسيحتوي المدار 3s على اثنين ، وسيحتوي المدار 3p على 6 ، وسيكون للمدار 4s 2 (2 + 2 + 6 +2 +6 + 2 = 20.) بمعنى آخر ، التكوين الإلكتروني للكالسيوم له الشكل: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2.
- لاحظ أن المدارات في ترتيب تصاعدي للطاقة. على سبيل المثال ، عندما تكون مستعدًا للانتقال إلى مستوى الطاقة الرابع ، اكتب أولاً مدار 4 ثوانٍ و ومن بعدثلاثي الأبعاد. بعد مستوى الطاقة الرابع ، تنتقل إلى المستوى الخامس ، حيث يتم تكرار نفس الترتيب. يحدث هذا فقط بعد مستوى الطاقة الثالث.
-
استخدم الجدول الدوري كإشارة بصرية.ربما لاحظت بالفعل أن شكل الجدول الدوري يتوافق مع ترتيب المستويات الفرعية الإلكترونية في التكوينات الإلكترونية. على سبيل المثال ، الذرات الموجودة في العمود الثاني من اليسار تنتهي دائمًا بـ "s 2" ، بينما الذرات الموجودة على الحافة اليمنى للقسم الأوسط الرفيع تنتهي دائمًا بـ "d 10" ، وهكذا. استخدم الجدول الدوري كدليل مرئي لكتابة التكوينات - حيث يتوافق الترتيب الذي تضيف به إلى المدارات مع موقعك في الجدول. انظر أدناه:
- على وجه الخصوص ، يحتوي العمودان الموجودان في أقصى اليسار على ذرات تنتهي تكويناتها الإلكترونية في مدارات s ، وتحتوي الكتلة اليمنى من الجدول على ذرات تنتهي تكويناتها في مدارات p ، وفي الجزء السفلي من الذرات تنتهي في مدارات f.
- على سبيل المثال ، عند تدوين التكوين الإلكتروني للكلور ، فكر على هذا النحو: "هذه الذرة تقع في الصف الثالث (أو" الفترة ") من الجدول الدوري. وهي أيضًا تقع في المجموعة الخامسة من الكتلة المدارية p من الجدول الدوري .. لذلك سينتهي تكوينه الإلكتروني بـ .. 3 ص 5
- لاحظ أن العناصر الموجودة في المنطقتين المداريتين d و f من الجدول لها مستويات طاقة لا تتوافق مع الفترة التي توجد فيها. على سبيل المثال ، يتوافق الصف الأول من كتلة العناصر ذات المدارات d مع المدارات ثلاثية الأبعاد ، على الرغم من أنها تقع في الفترة الرابعة ، والصف الأول من العناصر ذات المدارات f يتوافق مع المدار 4f ، على الرغم من حقيقة أنه يقع في الفترة السادسة.
-
تعلم الاختصارات لكتابة التكوينات الإلكترونية الطويلة.تسمى الذرات الموجودة على الجانب الأيمن من الجدول الدوري غازات نبيلة.هذه العناصر مستقرة كيميائيا جدا. لتقصير عملية كتابة تكوينات إلكترونية طويلة ، اكتب ببساطة بين قوسين مربعين الرمز الكيميائي لأقرب غاز نبيل بإلكترونات أقل من ذرتك ، ثم استمر في كتابة التكوين الإلكتروني للمستويات المدارية اللاحقة. انظر أدناه:
- لفهم هذا المفهوم ، سيكون من المفيد كتابة مثال على التكوين. لنكتب تكوين الزنك (العدد الذري 30) باستخدام اختصار الغازات النبيلة. يبدو تكوين الزنك الكامل كما يلي: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10. ومع ذلك ، نرى أن 1s 2 2s 2 2p 6 3s 2 3p 6 هو التكوين الإلكتروني للأرجون ، وهو غاز نبيل. ما عليك سوى استبدال جزء التكوين الإلكتروني للزنك بالرمز الكيميائي للأرجون بين قوسين مربعين (.)
- إذن ، التكوين الإلكتروني للزنك ، المكتوب بصيغة مختصرة ، هو: 4s 2 3d 10.
- لاحظ أنه إذا كنت تكتب التكوين الإلكتروني لغاز نبيل ، مثل الأرجون ، فلا يمكنك الكتابة! يجب على المرء استخدام اختصار الغاز النبيل أمام هذا العنصر ؛ للأرجون سيكون نيون ().
استخدام الجدول الدوري أدوما
-
إتقان الجدول الدوري أدوما.لا تتطلب طريقة تسجيل التكوين الإلكتروني هذه حفظًا ، ولكنها تتطلب جدولًا دوريًا معدلًا ، لأنه في الجدول الدوري التقليدي ، بدءًا من الفترة الرابعة ، لا يتوافق رقم الفترة مع غلاف الإلكترون. ابحث عن الجدول الدوري أدوما ، وهو نوع خاص من الجدول الدوري صممه العالم فاليري زيمرمان. من السهل العثور عليه ببحث قصير على الإنترنت.
- في الجدول الدوري أدوما ، تمثل الصفوف الأفقية مجموعات من العناصر مثل الهالوجينات والغازات النبيلة والمعادن القلوية والمعادن الأرضية القلوية ، إلخ. تتوافق الأعمدة الرأسية مع المستويات الإلكترونية ، وما يسمى بـ "الشلالات" (خطوط قطرية تربط الكتل s و p و d و f) تتوافق مع فترات.
- يتم نقل الهيليوم إلى الهيدروجين ، حيث يتميز كلا العنصرين بمدار 1 ثانية. تظهر كتل الفترة (s و p و d و f) على الجانب الأيمن وترد أرقام المستوى في الأسفل. يتم تمثيل العناصر في مربعات مرقمة من 1 إلى 120. هذه الأرقام هي الأرقام الذرية المعتادة ، والتي تمثل العدد الإجمالي للإلكترونات في الذرة المحايدة.
-
ابحث عن ذرتك في طاولة أدوما.لتدوين التكوين الإلكتروني لعنصر ما ، ابحث عن رمزه في الجدول الدوري لـ ADOMAH واشطب جميع العناصر ذات العدد الذري الأعلى. على سبيل المثال ، إذا كنت بحاجة إلى كتابة التكوين الإلكتروني للإربيوم (68) ، فاشطب جميع العناصر من 69 إلى 120.
- انتبه للأرقام من 1 إلى 8 في قاعدة الجدول. هذه هي أرقام المستوى الإلكتروني أو أرقام الأعمدة. تجاهل الأعمدة التي تحتوي على عناصر مشطوبة فقط. بالنسبة للإربيوم ، تبقى الأعمدة ذات الأرقام 1،2،3،4،5 و 6.
-
عد المستويات الفرعية المدارية حتى العنصر الخاص بك.بالنظر إلى رموز الكتلة الموضحة على يمين الجدول (s و p و d و f) وأرقام الأعمدة الموضحة في الأسفل ، تجاهل الخطوط القطرية بين الكتل وقم بتقسيم الأعمدة إلى أعمدة بلوك ، وقم بإدراجها في طلب من أسفل إلى أعلى. ومرة أخرى ، تجاهل الكتل التي يتم فيها شطب جميع العناصر. اكتب كتل الأعمدة بدءًا من رقم العمود متبوعًا برمز الكتلة ، على النحو التالي: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (للإربيوم).
- يرجى ملاحظة: التكوين الإلكتروني أعلاه مكتوب بترتيب تصاعدي لرقم المستوى الفرعي الإلكتروني. يمكن أيضًا كتابتها بالترتيب الذي تملأ به المدارات. للقيام بذلك ، اتبع التسلسلات من أسفل إلى أعلى ، وليس الأعمدة ، عند كتابة كتل الأعمدة: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12.
-
عد الإلكترونات لكل مستوى فرعي إلكتروني.قم بحساب العناصر الموجودة في كل كتلة عمود والتي لم يتم شطبها عن طريق ربط إلكترون واحد من كل عنصر ، واكتب رقمها بجوار رمز الكتلة لكل كتلة عمود كما يلي: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s 2. في مثالنا ، هذا هو التكوين الإلكتروني للإربيوم.
-
احذر من التكوينات الإلكترونية غير الصحيحة.هناك ثمانية عشر استثناءً نموذجيًا يتعلق بالتكوينات الإلكترونية للذرات في أدنى حالة طاقة ، وتسمى أيضًا حالة الطاقة الأرضية. إنهم لا يخضعون للقاعدة العامة إلا في آخر موقعين أو ثلاثة مواقع تشغلها الإلكترونات. في هذه الحالة ، يفترض التكوين الإلكتروني الفعلي أن الإلكترونات في حالة طاقة أقل مقارنة بالتكوين القياسي للذرة. تشمل ذرات الاستثناء:
- سجل تجاري(... ، 3d5 ، 4s1) ؛ النحاس(... ، 3d10 ، 4s1) ؛ ملحوظة(...، 4d4، 5s1) ؛ مو(...، 4d5، 5s1) ؛ رو(...، 4d7، 5s1) ؛ Rh(...، 4d8، 5s1) ؛ PD(...، 4d10، 5s0) ؛ اي جي(...، 4d10، 5s1) ؛ لا(...، 5d1، 6s2) ؛ م(...، 4f1، 5d1، 6s2) ؛ Gd(...، 4f7، 5d1، 6s2) ؛ Au(...، 5d10، 6s1) ؛ تيار متردد(...، 6d1، 7s2) ؛ العاشر(...، 6d2، 7s2) ؛ بنسلفانيا(...، 5f2، 6d1، 7s2) ؛ يو(...، 5f3، 6d1، 7s2) ؛ Np(... ، 5f4 ، 6d1 ، 7s2) و سم(... ، 5f7 ، 6d1 ، 7s2).
- للعثور على العدد الذري للذرة عند كتابتها في شكل إلكتروني ، ما عليك سوى جمع جميع الأرقام التي تلي الأحرف (s و p و d و f). هذا يعمل فقط مع الذرات المحايدة ، إذا كنت تتعامل مع أيون ، فلن ينجح شيء - سيكون عليك إضافة أو طرح عدد الإلكترونات الزائدة أو المفقودة.
- الرقم الذي يلي الحرف مرتفع ، لا تخطئ في عنصر التحكم.
- لا يوجد مستوى فرعي "استقرار نصف مملوء". هذا تبسيط. أي استقرار يتعلق بالمستويات الفرعية "نصف الممتلئة" يرجع إلى حقيقة أن كل مدار يشغله إلكترون واحد ، لذلك يتم تقليل التنافر بين الإلكترونات.
- تميل كل ذرة إلى حالة مستقرة ، وتملأ التكوينات الأكثر استقرارًا المستويات الفرعية s و p (s2 و p6). تحتوي الغازات النبيلة على هذا التكوين ، لذلك نادرًا ما تتفاعل وتكون موجودة على اليمين في الجدول الدوري. لذلك ، إذا انتهى التكوين في 3p 4 ، فإنه يحتاج إلى إلكترونين للوصول إلى حالة مستقرة (يتطلب الأمر مزيدًا من الطاقة لفقد ستة ، بما في ذلك إلكترونات المستوى s ، لذلك من السهل فقدان أربعة). وإذا انتهى التكوين بـ 4d 3 ، فإنه يحتاج إلى فقد ثلاثة إلكترونات للوصول إلى حالة مستقرة. بالإضافة إلى ذلك ، فإن المستويات الفرعية نصف الممتلئة (s1 ، p3 ، d5 ..) أكثر استقرارًا من p4 أو p2 على سبيل المثال ؛ ومع ذلك ، سيكون s2 و p6 أكثر استقرارًا.
- عندما تتعامل مع أيون ، فهذا يعني أن عدد البروتونات لا يساوي عدد الإلكترونات. ستظهر شحنة الذرة في هذه الحالة في أعلى يمين (عادةً) الرمز الكيميائي. لذلك ، ذرة الأنتيمون بشحنة +2 لها التكوين الإلكتروني 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1. لاحظ أن 5p 3 قد تغيرت إلى 5p 1. كن حذرًا عندما ينتهي تكوين الذرة المحايدة عند مستويات ثانوية بخلاف s و p.عندما تأخذ الإلكترونات ، يمكنك فقط أن تأخذها من مدارات التكافؤ (مداري s و p). لذلك ، إذا انتهى التكوين بـ 4s 2 3d 7 وحصلت الذرة على +2 شحنة ، فإن التكوين سينتهي بـ 4s 0 3d 7. يرجى ملاحظة أن 3d 7 ليسالتغييرات ، بدلاً من ذلك تُفقد إلكترونات المدار s.
- هناك ظروف يُجبر فيها الإلكترون على "الانتقال إلى مستوى طاقة أعلى". عندما يفتقر المستوى الثانوي إلى إلكترون واحد ليكون نصفه أو ممتلئًا ، خذ إلكترونًا واحدًا من أقرب مستوى فرعي s أو p وانقله إلى المستوى الثانوي الذي يحتاج إلى إلكترون.
- هناك خياران لكتابة التكوين الإلكتروني. يمكن كتابتها بترتيب تصاعدي لأرقام مستويات الطاقة أو بالترتيب الذي تمتلئ به مدارات الإلكترون ، كما هو موضح أعلاه بالنسبة للإربيوم.
- يمكنك أيضًا كتابة التكوين الإلكتروني لعنصر من خلال كتابة تكوين التكافؤ فقط ، وهو المستوى الفرعي s و p الأخير. وبالتالي ، سيكون تكوين التكافؤ للأنتيمون 5s 2 5p 3.
- الأيونات ليست هي نفسها. الأمر أكثر صعوبة معهم. تخطي مستويين واتبع نفس النمط اعتمادًا على المكان الذي بدأت منه ومدى ارتفاع عدد الإلكترونات.
أوجد العدد الذري لذرتك.كل ذرة لها عدد معين من الإلكترونات المرتبطة بها. ابحث عن رمز الذرة في الجدول الدوري. العدد الذري هو عدد صحيح موجب يبدأ من 1 (للهيدروجين) ويزداد بمقدار واحد لكل ذرة لاحقة. العدد الذري هو عدد البروتونات في الذرة ، وبالتالي فهو أيضًا عدد الإلكترونات في الذرة بدون شحنة.
حدد شحنة الذرة.سيكون للذرات المحايدة نفس عدد الإلكترونات كما هو موضح في الجدول الدوري. ومع ذلك ، فإن الذرات المشحونة ستحتوي على إلكترونات أكثر أو أقل ، اعتمادًا على حجم شحنتها. إذا كنت تعمل مع ذرة مشحونة ، أضف أو اطرح إلكترونات على النحو التالي: أضف إلكترونًا واحدًا لكل شحنة سالبة واطرح واحدًا مقابل كل شحنة موجبة.