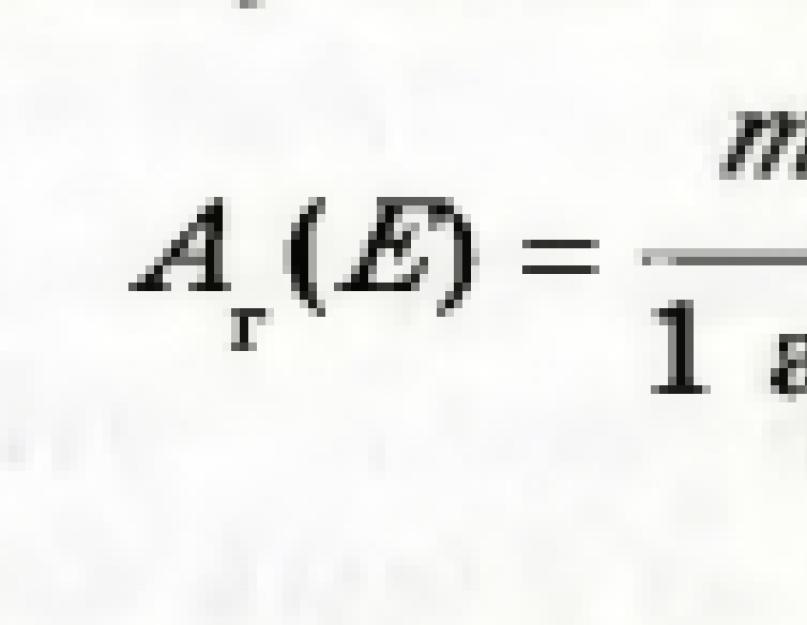>> كتلة الذرة. الكتلة الذرية النسبية
كتلة الذرة. الكتلة الذرية النسبية
ستساعدك مادة الفقرة في معرفة:
> ما هو الفرق بين كتلة الذرة والنسب الكتلة الذرية ;
> لماذا من الملائم استخدام الكتل الذرية النسبية ؛
> أين تجد قيمة الكتلة الذرية النسبية للعنصر.
إنه ممتع
كتلة الإلكترون حوالي 9 10-28 جم.
كتلة الذرة.
من الخصائص المهمة للذرة كتلتها. تتركز كل كتلة الذرة تقريبًا في النواة. تحتوي الإلكترونات على كتلة صغيرة يتم إهمالها عادةً.
مقارنة بـ 1/12 - كتلة ذرة الكربون (وهي أثقل بمقدار 12 مرة من ذرة الهيدروجين). كانت تسمى هذه الكتلة الصغيرة وحدة الكتلة الذرية (والمختصرة كـ a. e. m.):
1 أ. إم \ u003d 1/12 م أ (ج) \ u003d 1/12 1.994 10 -23 جم \ u003d 1.662 10-24 جم.
تتطابق كتلة ذرة الهيدروجين تقريبًا مع وحدة الكتلة الذرية: m · a (H) ~ 1a. ه.م.م. كتلة ذرة أورانوس أكبر منها في
هذا هو
م أ (يو) ~ 238 أ. تأكل.
العدد الذي تم الحصول عليه بقسمة كتلة ذرة عنصر على وحدة الكتلة الذرية يسمى الكتلة الذرية النسبية للعنصر. يتم الإشارة إلى هذه القيمة بواسطة A r (E):

الفهرس بالقرب من الحرف A - الحرف الأول في الكلمة اللاتينية relativus - نسبي.
توضح الكتلة الذرية النسبية لعنصر عدد مرات كتلة الذرة عنصرأكثر من 1/12 من كتلة ذرة كربون.
م أ (ح) = 1.673 10 -2 4 جم
م أ (ح) = 1 أ. تأكل.
أ ص (ح) = 1
الكتلة الذرية النسبية للعنصر ليس لها بعد.
تم تجميع الجدول الأول للكتل الذرية النسبية منذ ما يقرب من 200 عام من قبل العالم الإنجليزي ج. دالتون.
بناءً على المادة المقدمة ، يمكن استخلاص الاستنتاجات التالية:
الكتل الذرية النسبية تتناسب مع كتل الذرات.
نسب كتل الذرات هي نفسها تلك الخاصة بالكتل الذرية النسبية.
يتم كتابة قيم الكتل الذرية النسبية للعناصر الكيميائية النظام الدوري .
جون دالتون (1766-1844)

اللغة الإنجليزية المتميزة فيزيائيوكيميائي. عضو الجمعية الملكية بلندن (أكاديمية العلوم الإنجليزية). كان أول من طرح فرضية حول الكتل والأحجام المختلفة للذرات ، وحدد الكتل الذرية النسبية للعديد من العناصر وقام بتجميع الجدول الأول لقيمها (1803). اقترح رموز العناصر وتسميات المركبات الكيميائية.
بعد أن أجرى أكثر من 200000 ملاحظة للأرصاد الجوية ، وبعد أن درس تكوين وخصائص الهواء ، اكتشف قوانين الضغوط الجزئية (الجزئية) غازات(1801) ، التمدد الحراري للغازات (1802) ، ذوبان الغازات في السوائل (1803).

أرز. 35. خلية عنصر أورانوس
لقد تم تحديدها بدقة عالية جدًا ؛ الأرقام المقابلة تتكون في الغالب من خمسة وستة أرقام (الشكل 35).
في الحسابات الكيميائية التقليدية ، عادةً ما يتم تقريب قيم الكتل الذرية النسبية إلى أعداد صحيحة. لذلك ، للهيدروجين وأورانوس
Ar (H) = 1.0079 ~ 1 ؛
أ ص (يو) = 238.029 ~ 238.
يتم تقريب قيمة الكتلة الذرية النسبية للكلور فقط لأعشار:
أ ص (كل) = 35.453 ~ 35.5.
اكتشف في النظام الدوري قيم الكتل الذرية النسبية لليثيوم والكربون والأكسجين والنيون وقم بتقريبها إلى أعداد صحيحة.
كم مرة تكون كتلة ذرات الكربون والأكسجين والنيون والمغنيسيوم أكبر من كتلة ذرة الهيليوم؟ للحسابات ، استخدم الكتل الذرية النسبية المقربة.
ملاحظة: العناصر مرتبة في الجدول الدوري بترتيب تصاعدي للكتل الذرية.
الاستنتاجات
الذرات لها كتلة صغيرة للغاية.
لتسهيل العمليات الحسابية ، يتم استخدام الكتل النسبية للذرات.
الكتلة الذرية النسبية للعنصر هي نسبة كتلة ذرة العنصر إلى كتلة ذرة الكربون.
يشار إلى قيم الكتل الذرية النسبية في النظام الدوري للعناصر الكيميائية.
?
48. ما هو الفرق بين مفهومي "الكتلة الذرية" والكتلة الذرية النسبية "؟
49. ما هي وحدة الكتلة الذرية؟
50. ماذا تعني المدخلات A r و A r؟
51. أي ذرة أخف - كربون أم تيتانيوم؟ كم مرة؟
52. ما له كتلة كبيرة: ذرة فلور أو ذرتان من الليثيوم. ذرتان مغنيسيوم أم ثلاث ذرات كبريت؟
53. أوجد في النظام الدوري ثلاثة أو أربعة أزواج من العناصر ، نسبة كتل الذرات منها هي: أ) 1: 2 ؛ ب) 1: 3.
54. احسب الكتلة الذرية النسبية للهيليوم إذا كانت كتلة ذرة هذا العنصر هي 6.647 - 10 -24 جم.
55. احسب كتلة ذرة البريليوم.
P. Popel P.، Kriklya L. S.، Chemistry: Pdruch. لمدة 7 خلايا. zahalnosvit. نافش. زقل. - ك .: مركز المعارض "الأكاديمية" 2008. - 136 ص: il.
محتوى الدرس ملخص الدرس ودعم إطار عرض الدرس التقنيات التفاعلية تسريع طرق التدريس يمارس الاختبارات القصيرة واختبار المهام عبر الإنترنت وورش عمل التمارين المنزلية وأسئلة التدريب للمناقشات الصفية الرسوم التوضيحية مواد الفيديو والصوت صور ، صور رسوم بيانية ، جداول ، مخططات كاريكاتورية ، أمثال ، أقوال ، كلمات متقاطعة ، حكايات ، نكت ، اقتباسات الإضافات ملخصات أوراق الغش للمقالات الفضولية (MAN) الأدبيات الرئيسية ومسرد المصطلحات الإضافية تحسين الكتب المدرسية والدروس تصحيح الأخطاء في الكتاب المدرسي واستبدال المعرفة القديمة بأخرى جديدة فقط للمعلمين خطط التقويم برامج التدريب التوصيات المنهجيةموسوعي يوتيوب
1 / 3
✪ الكيمياء | الكتلة الذرية النسبية
✪ الكتلة الذرية النسبية. الكتلة الجزيئية.
✪ 15. الكتلة الذرية
ترجمات
معلومات عامة
إحدى الخصائص الأساسية للذرة هي كتلتها. الكتلة المطلقة للذرة هي كمية صغيرة للغاية. وبالتالي ، فإن كتلة ذرة الهيدروجين تبلغ حوالي 1.67 × 10 × 24 جم. لذلك ، في الكيمياء (للأغراض العملية) يكون استخدام القيمة [الشرطية] النسبية هو السائد والأكثر ملاءمة ، والتي تسمى الكتلة الذرية النسبيةأو ببساطة الكتلة الذريةوالذي يوضح عدد المرات التي تكون فيها كتلة ذرة عنصر معين أكبر من كتلة ذرة عنصر آخر ، باعتبارها وحدة كتلة.
كوحدة لقياس الكتل الذرية والجزيئية ، 1 ⁄ 12 جزء من كتلة ذرة متعادلة من نظير الكربون الأكثر شيوعًا 12 درجة مئوية. تسمى هذه الوحدة غير النظامية لقياس الكتلة وحدة كتلة ذرية (أ. تأكل.) أو دالتون (نعم).
يسمى الفرق بين الكتلة الذرية للنظير وعدد كتلته الكتلة الزائدة (عادة ما يتم التعبير عنها في MeV). يمكن أن تكون إيجابية وسلبية ؛ سبب حدوثه هو الاعتماد غير الخطي لطاقة الارتباط للنواة على عدد البروتونات والنيوترونات ، وكذلك الاختلاف في كتل البروتون والنيوترون.
يكون اعتماد الكتلة الذرية للنظير على رقم الكتلة كما يلي: الكتلة الزائدة موجبة للهيدروجين -1 ، مع زيادة عدد الكتلة تنخفض وتصبح سالبة حتى يتم الوصول إلى الحد الأدنى للحديد -56 ، ثم تبدأ في تنمو وتزيد إلى قيم موجبة للنويدات الثقيلة. يتوافق هذا مع حقيقة أن انشطار النوى الأثقل من الحديد يطلق طاقة ، بينما يتطلب انشطار النوى الضوئية طاقة. على العكس من ذلك ، فإن اندماج نوى أخف من الحديد يطلق طاقة ، بينما يتطلب اندماج العناصر الأثقل من الحديد طاقة إضافية.
قصة
عند حساب الكتل الذرية ، في البداية (منذ بداية القرن التاسع عشر ، بناءً على اقتراح ج. دالتون ؛ انظر نظرية دالتون الذرية) ، تم أخذ كتلة ذرة الهيدروجين باعتبارها أخف عنصر كتلة وحدة [نسبيًا] و ، فيما يتعلق به ، تم حساب كتل ذرات العناصر الأخرى. ولكن نظرًا لأن الكتل الذرية لمعظم العناصر يتم تحديدها بناءً على تكوين مركبات الأكسجين الخاصة بها ، فقد تم إجراء الحسابات في الواقع (بحكم الواقع) فيما يتعلق بالكتلة الذرية للأكسجين ، والتي كان يُفترض أنها 16 ؛ تم اعتبار النسبة بين الكتل الذرية للأكسجين والهيدروجين مساوية لـ 16: 1. بعد ذلك ، أظهرت القياسات الأكثر دقة أن هذه النسبة تساوي 15.874: 1 أو ، وهي نفسها ، 16: 1.0079 ، اعتمادًا على أي ذرة - أكسجين أو الهيدروجين - تشير إلى قيمة عدد صحيح. التغيير في الكتلة الذرية للأكسجين يستلزم تغيير في الكتل الذرية لمعظم العناصر. لذلك ، تقرر ترك الكتلة الذرية 16 للأكسجين ، بأخذ الكتلة الذرية للهيدروجين لتكون 1.0079.
وهكذا ، تم أخذ وحدة الكتلة الذرية 1 ⁄ 16 يسمى جزء من كتلة ذرة الأكسجين وحدة الأكسجين. وجد لاحقًا أن الأكسجين الطبيعي عبارة عن مزيج من النظائر ، بحيث تحدد وحدة كتلة الأكسجين متوسط قيمة كتلة ذرات نظائر الأكسجين الطبيعي (الأكسجين -16 ، والأكسجين -17 والأكسجين -18) ، والتي تحولت إلى تكون غير مستقرة بسبب الاختلافات الطبيعية في التركيب النظائري للأكسجين. بالنسبة للفيزياء الذرية ، تبين أن هذه الوحدة غير مقبولة ، وفي هذا الفرع من العلم ، تم أخذ وحدة الكتلة الذرية 1 ⁄ 16 جزء من كتلة ذرة الأكسجين 16 O. ونتيجة لذلك ، تم تشكيل مقياسين للكتل الذرية - كيميائي وفيزيائي. تسبب وجود مقياسين للكتل الذرية في إزعاج كبير. تبين أن قيم العديد من الثوابت المحسوبة على المقاييس الفيزيائية والكيميائية مختلفة. أدى هذا الموقف غير المقبول إلى إدخال مقياس الكربون للكتل الذرية بدلاً من مقياس الأكسجين.
تم تبني مقياس موحد للكتل الذرية النسبية ووحدة جديدة للكتلة الذرية من قبل المؤتمر الدولي للفيزيائيين (1960) وتوحيدها من قبل المؤتمر الدولي للكيميائيين (1961 ؛ 100 عام بعد المؤتمر الدولي الأول للكيميائيين) ، بدلاً من وحدتا الأكسجين السابقتان للكتلة الذرية - الفيزيائية والكيميائية. الأكسجين المواد الكيميائيةالوحدة تساوي 0.999957 من وحدة الكربون الجديدة للكتلة الذرية. في المقياس الحديث ، تكون الكتل الذرية النسبية للأكسجين والهيدروجين ، على التوالي ، 15.9994: 1.0079 ... نظرًا لأن الوحدة الجديدة للكتلة الذرية مرتبطة بنظير معين ، وليس بمتوسط قيمة الكتلة الذرية لمادة كيميائية العنصر ، الاختلافات النظيرية الطبيعية لا تؤثر على استنساخ هذه الوحدة.
من مواد الدرس ، ستتعلم أن ذرات بعض العناصر الكيميائية تختلف عن ذرات العناصر الكيميائية الأخرى في الكتلة. سيخبرك المعلم كيف قام الكيميائيون بقياس كتلة الذرات ، وهي صغيرة جدًا بحيث لا يمكنك رؤيتها بالمجهر الإلكتروني.
الموضوع: الأفكار الكيميائية الأولية
درس: الكتلة الذرية النسبية للعناصر الكيميائية
في بداية القرن التاسع عشر (بعد 150 عامًا من عمل روبرت بويل) ، اقترح العالم الإنجليزي جون دالتون طريقة لتحديد كتلة ذرات العناصر الكيميائية. دعونا نفكر في جوهر هذه الطريقة.
اقترح دالتون نموذجًا يحتوي بموجبه جزيء مادة معقدة على ذرة واحدة فقط من عناصر كيميائية مختلفة. على سبيل المثال ، اعتقد أن جزيء الماء يتكون من ذرة هيدروجين واحدة وذرة أكسجين واحدة. يتضمن تكوين المواد البسيطة وفقًا لدالتون أيضًا ذرة واحدة فقط من عنصر كيميائي. أولئك. يجب أن يتكون جزيء الأكسجين من ذرة أكسجين واحدة.
وبعد ذلك ، من خلال معرفة الكسور الكتلية للعناصر في مادة ما ، من السهل تحديد عدد المرات التي تختلف فيها كتلة ذرة عنصر ما عن كتلة ذرة عنصر آخر. وهكذا ، اعتقد دالتون أن الجزء الكتلي لعنصر ما في مادة ما يتم تحديده من خلال كتلة ذرته.
من المعروف أن الجزء الكتلي للمغنيسيوم في أكسيد المغنيسيوم هو 60٪ ، والجزء الكتلي للأكسجين 40٪. باتباع مسار منطق دالتون ، يمكننا القول أن كتلة ذرة المغنيسيوم أكبر بمقدار 1.5 مرة من كتلة ذرة الأكسجين (60/40 = 1.5):
لاحظ العالم أن كتلة ذرة الهيدروجين هي الأصغر ، لأن. لا توجد مادة معقدة يكون فيها الكسر الكتلي للهيدروجين أكبر من الكسر الكتلي لعنصر آخر. لذلك ، اقترح مقارنة كتل ذرات العناصر بكتلة ذرة الهيدروجين. وبهذه الطريقة قام بحساب القيم الأولى للكتل الذرية النسبية (بالنسبة إلى ذرة الهيدروجين) للعناصر الكيميائية.
تم أخذ الكتلة الذرية للهيدروجين كوحدة. وتبين أن قيمة الكتلة النسبية للكبريت هي 17. لكن جميع القيم التي تم الحصول عليها إما تقريبية أو غير صحيحة ، لأن. كانت تقنية التجربة في ذلك الوقت بعيدة عن الكمال ، وكان تركيب دالتون على تكوين المادة غير صحيح.
في 1807 - 1817. أجرى الكيميائي السويدي يونس جاكوب برزيليوس قدرًا كبيرًا من الأبحاث لتحسين الكتل الذرية النسبية للعناصر. تمكن من الحصول على نتائج قريبة من النتائج الحديثة.
بعد وقت طويل من عمل برزيليوس ، بدأت مقارنة كتل ذرات العناصر الكيميائية بـ 1/12 من كتلة ذرة الكربون (الشكل 2).

أرز. 1. نموذج لحساب الكتلة الذرية النسبية لعنصر كيميائي
توضح الكتلة الذرية النسبية لعنصر كيميائي عدد المرات التي تكون فيها كتلة ذرة عنصر كيميائي أكبر من 1/12 من كتلة ذرة كربون.
يُشار إلى الكتلة الذرية النسبية A r ، ولا تحتوي على وحدات قياس ، حيث تُظهر نسبة كتل الذرات.
على سبيل المثال: أ ص (ق) = 32 ، أي ذرة الكبريت أثقل 32 مرة من 1/12 من كتلة ذرة الكربون.
الكتلة المطلقة من 1/12 من ذرة الكربون هي وحدة مرجعية ، يتم حساب قيمتها بدقة عالية وهي 1.66 * 10 -24 جم أو 1.66 * 10 -27 كجم. هذه الكتلة المرجعية تسمى وحدة كتلة ذرية (أ. م).
لا يلزم حفظ قيم الكتل الذرية النسبية للعناصر الكيميائية ، حيث يتم تقديمها في أي كتاب مدرسي أو كتاب مرجعي عن الكيمياء ، وكذلك في الجدول الدوري لـ D.I. مندليف.
عند حساب قيم الكتل الذرية النسبية ، من المعتاد التقريب إلى الأعداد الصحيحة.
الاستثناء هو الكتلة الذرية النسبية للكلور - بالنسبة للكلور ، يتم استخدام القيمة 35.5.
1. مجموعة من المهام والتمارين في الكيمياء: الصف الثامن: إلى الكتاب المدرسي من قبل P.A. Orzhekovsky وآخرون. "الكيمياء ، الصف الثامن" / P.A. Orzhekovsky، N.A. تيتوف ، ف. هيجل. - M: AST: Astrel ، 2006.
2. Ushakova O.V. كتاب الكيمياء: الصف الثامن: إلى الكتاب المدرسي بقلم أ. Orzhekovsky وآخرون "الكيمياء. الصف 8 "/ O.V. أوشاكوفا ، بي. بيسبالوف ، ب. أورزيكوفسكي. تحت. إد. الأستاذ. ب. Orzhekovsky - M.: AST: Astrel: Profizdat، 2006. (ص 24-25)
3. الكيمياء: الصف الثامن: كتاب مدرسي. للعامة المؤسسات / P.A. Orzhekovsky ، L.M. ميشرياكوفا ، إل. بونتاك. M: AST: Astrel، 2005. (§10)
4. الكيمياء: inorg. الكيمياء: كتاب مدرسي. لمدة 8 خلايا. جنرال لواء المؤسسات / G.E. رودزيتس ، فوجيو فيلدمان. - م: التعليم ، JSC "الكتب المدرسية في موسكو" ، 2009. (§§8 ، 9)
5. موسوعة للأطفال. المجلد 17. الكيمياء / الفصل. حرره V.A. فولودين ، الرائد. علمي إد. أنا لينسون. - م: أفانتا + ، 2003.
موارد ويب إضافية
1. مجموعة واحدة من المصادر التعليمية الرقمية ().
2. النسخة الإلكترونية لمجلة "الكيمياء والحياة" ().
الواجب المنزلي
ص 24-25 أرقام 1-7من كتاب المصنف في الكيمياء: الصف الثامن: إلى الكتاب المدرسي بقلم أ. Orzhekovsky وآخرون "الكيمياء. الصف 8 "/ O.V. أوشاكوفا ، بي. بيسبالوف ، ب. أورزيكوفسكي. تحت. إد. الأستاذ. ب. Orzhekovsky - M: AST: Astrel: Profizdat ، 2006.
الكتلة الذرية، الكتلة الذرية النسبية(الاسم القديم - الوزن الذري) - قيمة كتلة الذرة ، معبراً عنها بوحدات الكتلة الذرية. في الوقت الحالي ، يُفترض أن وحدة الكتلة الذرية تساوي 1/12 من كتلة الذرة المحايدة لنظير الكربون الأكثر شيوعًا 12 درجة مئوية ، وبالتالي فإن الكتلة الذرية لهذا النظير هي بالضبط 12 ، بالنسبة لأي نظير آخر ، الكتلة الذرية ليس عددًا صحيحًا ، على الرغم من أنه قريب من العدد الكتلي لهذا النظير (أي العدد الإجمالي للنكليونات - البروتونات والنيوترونات - في نواته). يسمى الفرق بين الكتلة الذرية للنظير وعدد كتلته الكتلة الزائدة (عادة ما يتم التعبير عنها في MeV). يمكن أن تكون إيجابية وسلبية ؛ سبب حدوثه هو الاعتماد غير الخطي لطاقة الارتباط للنواة على عدد البروتونات والنيوترونات ، وكذلك الاختلاف في كتل البروتون والنيوترون.
يكون اعتماد الكتلة الذرية على رقم الكتلة كما يلي: الكتلة الزائدة موجبة للهيدروجين -1 ، مع زيادة عدد الكتلة تنخفض وتصبح سالبة حتى يتم الوصول إلى الحد الأدنى للحديد -56 ، ثم تبدأ في النمو والزيادة لقيم موجبة للنويدات الثقيلة. يتوافق هذا مع حقيقة أن انشطار النوى الأثقل من الحديد يطلق طاقة ، بينما يتطلب انشطار النوى الضوئية طاقة. على العكس من ذلك ، فإن اندماج نوى أخف من الحديد يطلق طاقة ، بينما يتطلب اندماج العناصر الأثقل من الحديد طاقة إضافية.
الكتلة الذرية لعنصر كيميائي (أيضًا "متوسط الكتلة الذرية" ، "الكتلة الذرية القياسية") هي المتوسط المرجح للكتلة الذرية لجميع النظائر المستقرة لعنصر كيميائي معين ، مع الأخذ في الاعتبار وفرتها الطبيعية في قشرة الأرض والغلاف الجوي. يتم تقديم هذه الكتلة الذرية في الجدول الدوري ، ويتم استخدامها في الحسابات المتكافئة. تختلف الكتلة الذرية لعنصر بنسبة نظيرية مضطربة (على سبيل المثال ، مخصب في بعض النظائر) عن الكتلة القياسية.
الوزن الجزيئي للمركب الكيميائي هو مجموع الكتل الذرية للعناصر المكونة له ، مضروبًا في معاملات العناصر المتكافئة وفقًا للصيغة الكيميائية للمركب. بالمعنى الدقيق للكلمة ، تكون كتلة الجزيء أقل من كتلة الذرات المكونة له بقيمة مساوية لطاقة الارتباط للجزيء. ومع ذلك ، فإن هذا العيب الكتلي أصغر بمقدار 9-10 مرات من كتلة الجزيء ويمكن إهماله.
يتم اختيار تعريف الخلد (ورقم Avogadro) بحيث تكون كتلة مول واحد من مادة (الكتلة المولية) ، معبرًا عنها بالجرام ، مساوية عدديًا للكتلة الذرية (أو الجزيئية) لتلك المادة. على سبيل المثال ، الكتلة الذرية للحديد هي 55.847. لذلك ، يحتوي مول واحد من ذرات الحديد (أي عددها يساوي رقم أفوجادرو ، 6.022 1023) على 55.847 جرامًا.
يتم إجراء المقارنة المباشرة وقياس كتل الذرات والجزيئات باستخدام طرق قياس الطيف الكتلي.
قصة
حتى الستينيات من القرن الماضي ، تم تحديد الكتلة الذرية بحيث يكون لنظير الأكسجين -16 كتلة ذرية تبلغ 16 (مقياس الأكسجين). ومع ذلك ، فإن نسبة الأكسجين -17 إلى الأكسجين -18 في الأكسجين الطبيعي ، والتي تم استخدامها أيضًا في حسابات الكتلة الذرية ، نتج عنها جدولين مختلفين من الكتل الذرية. استخدم الكيميائيون مقياسًا يعتمد على حقيقة أن الخليط الطبيعي من نظائر الأكسجين يجب أن يكون له كتلة ذرية تساوي 16 ، بينما خصص الفيزيائيون نفس العدد وهو 16 للكتلة الذرية للنظير الأكثر شيوعًا للأكسجين (يحتوي على ثمانية بروتونات وثمانية نيوترونات) .
ويكيبيديا
تعريف
حديدهو العنصر السادس والعشرون من الجدول الدوري. التسمية - Fe من اللاتينية "ferrum". تقع في الفترة الرابعة مجموعة VIIIB. يشير إلى المعادن. الشحنة النووية 26.
الحديد هو أكثر المعادن شيوعًا في العالم بعد الألمنيوم: فهو يشكل 4٪ (كتلة) من قشرة الأرض. يوجد الحديد على شكل مركبات مختلفة: أكاسيد ، كبريتيدات ، سيليكات. يوجد الحديد في الحالة الحرة فقط في النيازك.
أهم خامات الحديد تشمل خام الحديد المغناطيسي Fe 3 O 4 ، خام الحديد الأحمر Fe 2 O 3 ، خام الحديد البني 2Fe 2 O 3 × 3H 2 O وخام الحديد الصافي FeCO 3.
الحديد معدن فضي مطيل (الشكل 1). يفسح المجال بشكل جيد للتزوير والدرفلة وأنواع أخرى من الآلات. تعتمد الخواص الميكانيكية للحديد بشدة على نقاوته - على محتوى حتى كميات صغيرة جدًا من العناصر الأخرى الموجودة فيه.
أرز. 1. الحديد. مظهر.
الوزن الذري والجزيئي للحديد
الوزن الجزيئي النسبي للمادة(M r) هو رقم يوضح عدد المرات التي تكون فيها كتلة جزيء معين أكبر من 1/12 من كتلة ذرة كربون ، و الكتلة الذرية النسبية للعنصر(أ ص) - كم مرة يكون متوسط كتلة ذرات عنصر كيميائي أكبر من 1/12 من كتلة ذرة كربون.
نظرًا لأن الحديد في الحالة الحرة يوجد في شكل جزيئات حديد أحادية الذرة ، فإن قيم كتلته الذرية والجزيئية هي نفسها. إنها تساوي 55.847.
التآصل والتعديلات المتآصلة للحديد
يشكل الحديد تعديلين بلوريين: α-iron و-iron. أولهما له شعرية مكعبة محورها الجسم ، والثانية - مكعبة محورها الوجه. α-Iron مستقر ديناميكيًا في نطاقين من درجات الحرارة: أقل من 912 درجة مئوية ومن 1394 درجة مئوية إلى درجة الانصهار. درجة انصهار الحديد هي 1539 ± 5 درجة مئوية. بين 912 درجة مئوية و 1394 درجة مئوية ، يكون الحديد γ مستقرًا.
ترجع نطاقات درجة حرارة ثبات الحديد ألفا وبيتا إلى طبيعة التغيير في طاقة جيبس لكلا التعديلين مع تغير في درجة الحرارة. عند درجات حرارة أقل من 912 درجة مئوية وأعلى من 1394 درجة مئوية ، تكون طاقة جيبس من حديد ألفا أقل من طاقة جيبس للحديد بيتا ، وفي النطاق 912 - 1394 درجة مئوية - أكثر.
نظائر الحديد
من المعروف أن الحديد يمكن أن يحدث في الطبيعة على شكل أربعة نظائر مستقرة 54Fe و 56Fe و 57Fe و 57Fe. أعداد كتلتها 54 و 56 و 57 و 58 على التوالي. تحتوي نواة ذرة نظير الحديد 54 Fe على ستة وعشرين بروتونًا وثمانية وعشرين نيوترونًا ، وتختلف النظائر المتبقية عنها في عدد النيوترونات فقط.
هناك نظائر اصطناعية للحديد بأعداد كتلتها من 45 إلى 72 ، بالإضافة إلى 6 حالات إيزومرية من النوى. أكثر النظائر عمرا بين النظائر المذكورة أعلاه هو 60 Fe مع نصف عمر 2.6 مليون سنة.
أيونات الحديد
الصيغة الإلكترونية لتوزيع إلكترونات الحديد على المدارات هي كما يلي:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2.
نتيجة للتفاعل الكيميائي ، يتخلى الحديد عن إلكترونات التكافؤ ، أي هو المتبرع بهم ، ويتحول إلى أيون موجب الشحنة:
Fe 0 -2e → Fe 2+ ؛
Fe 0 -3e → Fe 3+.
جزيء وذرة الحديد
في الحالة الحرة ، يوجد الحديد على شكل جزيئات حديد أحادية الذرة. فيما يلي بعض الخصائص التي تميز ذرة وجزيء الحديد:
سبائك الحديد
حتى القرن التاسع عشر ، كانت سبائك الحديد معروفة بشكل أساسي بخلائطها مع الكربون ، والتي سميت باسم الفولاذ والحديد الزهر. ومع ذلك ، في المستقبل ، تم إنشاء سبائك جديدة قائمة على الحديد تحتوي على الكروم والنيكل وعناصر أخرى. في الوقت الحاضر ، تنقسم سبائك الحديد إلى فولاذ كربوني ، وحديد مصبوب ، وسبائك فولاذية ، وفولاذ بخصائص خاصة.
في التكنولوجيا ، تسمى سبائك الحديد عادة المعادن الحديدية ، ويسمى إنتاجها المعادن الحديدية.
أمثلة على حل المشكلات
| ممارسه الرياضه | التركيب الأولي للمادة هو كما يلي: الكسر الكتلي لعنصر الحديد 0.7241 (أو 72.41٪) ، والجزء الكتلي للأكسجين هو 0.2759 (أو 27.59٪). اشتق الصيغة الكيميائية. |
| المحلول | يتم حساب الكسر الكتلي للعنصر X في جزيء تركيبة HX بالصيغة التالية: ω (X) = n × Ar (X) / M (HX) × 100٪. دعونا نشير إلى عدد ذرات الحديد في الجزيء كـ "x" ، وعدد ذرات الأكسجين كـ "y". دعونا نجد الكتل الذرية النسبية المقابلة لعناصر الحديد والأكسجين (سيتم تقريب قيم الكتل الذرية النسبية المأخوذة من الجدول الدوري لـ DI Mendeleev إلى أعداد صحيحة). Ar (Fe) = 56 ؛ Ar (O) = 16. نقسم النسبة المئوية للعناصر على الكتل الذرية النسبية المقابلة. وهكذا نجد العلاقة بين عدد الذرات في جزيء المركب: x: y = ω (Fe) / Ar (Fe): ω (O) / Ar (O) ؛ س: ص = 72.41 / 56: 27.59 / 16 ؛ س: ص = 1.29: 1.84. لنأخذ أصغر رقم كواحد (أي نقسم جميع الأرقام على أصغر رقم 1.29): 1,29/1,29: 1,84/1,29; لذلك ، فإن أبسط صيغة لدمج الحديد مع الأكسجين هي Fe 2 O 3. |
| إجابه | Fe2O3 |
تعتمد الخصائص الفيزيائية للحديد على درجة نقاوته. الحديد النقي هو معدن أبيض فضي مطيل إلى حد ما. كثافة الحديد 7.87 جم / سم 3. نقطة الانصهار هي 1539 درجة مئوية ، على عكس العديد من المعادن الأخرى ، يظهر الحديد خصائص مغناطيسية.
الحديد النقي مستقر إلى حد ما في الهواء. في الممارسة العملية ، يستخدم الحديد المحتوي على الشوائب. عند تسخينه ، يكون الحديد نشطًا جدًا ضد العديد من اللافلزات. ضع في اعتبارك الخصائص الكيميائية للحديد باستخدام مثال التفاعل مع غير المعادن النموذجية: الأكسجين والكبريت.
عندما يتم حرق الحديد في الأكسجين ، يتشكل مركب من الحديد والأكسجين ، والذي يسمى مقياس الحديد. يكون التفاعل مصحوبًا بإطلاق حرارة وضوء. لنقم بمعادلة التفاعل الكيميائي:
3Fe + 2O 2 = Fe 3 O 4
عند تسخينه ، يتفاعل الحديد بعنف مع الكبريت لتكوين كبريتيد الحديد (II). يترافق التفاعل أيضًا مع إطلاق الحرارة والضوء. لنقم بمعادلة التفاعل الكيميائي:
يستخدم الحديد على نطاق واسع في الصناعة والحياة اليومية. العصر الحديدي هو حقبة في تطور البشرية ، بدأت في بداية الألفية الأولى قبل الميلاد فيما يتعلق بانتشار صهر الحديد وتصنيع الأدوات الحديدية والأسلحة العسكرية. جاء العصر الحديدي ليحل محل العصر البرونزي. ظهر الفولاذ لأول مرة في الهند في القرن العاشر قبل الميلاد ، وحديد الزهر فقط في العصور الوسطى. يستخدم الحديد النقي في صنع قلب المحولات والمغناطيسات الكهربائية ، وكذلك في إنتاج السبائك الخاصة. الأهم من ذلك كله ، يتم استخدام سبائك الحديد في الممارسة العملية: الحديد الزهر والصلب. يستخدم الحديد الزهر في إنتاج المسبوكات والفولاذ والصلب - كمواد هيكلية وأدوات مقاومة للتآكل.
تحت تأثير الأكسجين الجوي والرطوبة ، تتحول سبائك الحديد إلى صدأ. يمكن وصف منتج الصدأ بالصيغة الكيميائية Fe 2 O 3 · xH 2 O. يموت سدس الحديد المصهور من الصدأ ، وبالتالي فإن مسألة التحكم في التآكل مهمة للغاية. طرق الحماية من التآكل متنوعة للغاية. وأهمها: حماية السطح المعدني بالطلاء ، وإنشاء سبائك ذات خصائص مقاومة للتآكل ، والوسائل الكهروكيميائية ، والتغيير في تكوين الوسط. تنقسم الطلاءات الواقية إلى مجموعتين: المعدنية (طلاء الحديد بالزنك والكروم والنيكل والكوبالت والنحاس) وغير المعدنية (الورنيش والدهانات والبلاستيك والمطاط والأسمنت). مع إدخال إضافات خاصة في تكوين السبائك ، يتم الحصول على الفولاذ المقاوم للصدأ.
حديد. انتشار الحديد في الطبيعة
حديد. توزيع الحديد في الطبيعة. الدور البيولوجي للحديد
العنصر الكيميائي المهم الثاني بعد الأكسجين ، والذي سيتم دراسة خصائصه ، هو Ferum. الحديد عنصر معدني يشكل مادة بسيطة - الحديد. الحديد هو عضو في المجموعة الثامنة من المجموعة الفرعية الثانوية للجدول الدوري. وفقًا لرقم المجموعة ، يجب أن يكون الحد الأقصى لتكافؤ الحديد ثمانية ، ومع ذلك ، في المركبات ، يُظهر Ferum في كثير من الأحيان تكافؤين اثنين وثلاثة ، بالإضافة إلى المركبات المعروفة بتكافؤ الحديد بستة. الكتلة الذرية النسبية للحديد ستة وخمسون.
من حيث وفرته في تكوين قشرة الأرض ، يحتل Ferum المرتبة الثانية بين العناصر المعدنية بعد الألمنيوم. تبلغ نسبة كتلة الحديد في القشرة الأرضية خمسة بالمائة تقريبًا. في الحالة الأصلية ، يكون الحديد نادرًا جدًا ، وعادة ما يكون فقط في شكل نيازك. كان هذا هو الشكل الذي تمكن أسلافنا من التعرف على الحديد لأول مرة وتقديره باعتباره مادة جيدة جدًا لصنع الأدوات. يُعتقد أن الحديد هو المكون الرئيسي لبُلب الكرة الأرضية. غالبًا ما يوجد Ferum في الطبيعة كجزء من الخامات. أهمها: خام الحديد المغناطيسي (ماغنتيت) Fe 3 O 4 ، خام الحديد الأحمر (الهيماتيت) Fe 2 O 3 ، خام الحديد البني (ليمونيت) Fe 2 O 3 nH 2 O ، بيريت الحديد (البيريت) FeS 2 ، خام الحديد الصاري (السديريت) FeCO3 ، الحديد الجيوثيتي O (OH). تحتوي مياه الينابيع المعدنية على Fe (HCO 3) 2 وبعض أملاح الحديد الأخرى.
الحديد عنصر حيوي. في جسم الإنسان ، وكذلك في الحيوانات ، يوجد الحديد في جميع الأنسجة ، لكن الجزء الأكبر منه (حوالي ثلاثة جرامات) يتركز في كريات الدم. تحتل ذرات الحديد موقعًا مركزيًا في جزيئات الهيموجلوبين ؛ والهيموجلوبين مدين لها بلونها وقدرتها على ربط الأكسجين وتقسيمه. يشارك الحديد في عملية نقل الأكسجين من الرئتين إلى أنسجة الجسم. احتياجات الجسم اليومية من Ferum هي 15-20 مجم. يدخل كميتها الإجمالية إلى جسم الإنسان مع الأطعمة النباتية واللحوم. مع فقدان الدم ، تتجاوز الحاجة إلى Ferum الكمية التي يحصل عليها الشخص من الطعام. يمكن أن يؤدي نقص الحديد في الجسم إلى حالة تتميز بانخفاض عدد خلايا الدم الحمراء والهيموجلوبين في الدم. يجب تناول مكملات الحديد وفقًا لتعليمات الطبيب فقط.
الخواص الكيميائية للأكسجين. تفاعلات الاتصال
الخواص الكيميائية للأكسجين. تفاعلات الاتصال. مفهوم الأكاسيد والأكسدة والاحتراق. شروط بدء الاحتراق ووقفه
يتفاعل الأكسجين بقوة مع العديد من المواد عند تسخينه. إذا قمت بوضع فحم C الأحمر الساخن في وعاء به أكسجين ، فإنه يصبح أبيض ساخنًا ويحترق. لنقم بمعادلة التفاعل الكيميائي:
C + ONaHCO 2 = CONaHCO 2
يحترق الكبريت في الأكسجين بلهب أزرق لامع لتكوين مادة غازية - ثاني أكسيد الكبريت. لنقم بمعادلة التفاعل الكيميائي:
S + ONaHCO 2 = سوناهكو 2
يحترق الفوسفور P في الأكسجين بلهب ساطع لتكوين دخان أبيض كثيف ، والذي يتكون من جزيئات صلبة من أكسيد الفوسفور (V). لنقم بمعادلة التفاعل الكيميائي:
4P + 5ONaHCO 2 = 2PNaHCO 2 ONaHCO 5
تتحد معادلات تفاعلات تفاعل الأكسجين مع الفحم والكبريت والفوسفور من خلال حقيقة أن مادة واحدة تتكون من مادتين ابتدائيتين في كل حالة. تسمى هذه التفاعلات ، والتي نتيجة لها فقط مادة واحدة (منتج) من عدة مواد أولية (الكواشف) ، تفاعلات الاتصال.
نواتج تفاعل الأكسجين مع المواد المدروسة (الفحم ، الكبريت ، الفوسفور) هي أكاسيد. الأكاسيد عبارة عن مواد معقدة تحتوي على عنصرين ، أحدهما هو الأكسجين. تشكل جميع العناصر الكيميائية تقريبًا أكاسيدًا ، باستثناء بعض العناصر الخاملة: الهيليوم والنيون والأرجون والكريبتون والزينون. هناك بعض العناصر الكيميائية التي لا تتحد بشكل مباشر مع الأكسجين ، مثل Aurum.
تسمى التفاعلات الكيميائية لتفاعل المواد مع الأكسجين تفاعلات الأكسدة. يعتبر مفهوم "الأكسدة" أكثر عمومية من مفهوم "الاحتراق". الاحتراق تفاعل كيميائي يحدث فيه أكسدة المواد مصحوبة بإطلاق الحرارة والضوء. لكي يحدث الاحتراق ، فإن الشروط التالية ضرورية: ملامسة الهواء عن كثب بمادة قابلة للاشتعال والتسخين لدرجة حرارة الاشتعال. بالنسبة للمواد المختلفة ، فإن درجة حرارة الاشتعال لها قيم مختلفة. على سبيل المثال ، درجة حرارة الاشتعال لغبار الخشب هي 610 درجة مئوية ، والكبريت - 450 درجة مئوية ، والفوسفور الأبيض 45-60 درجة مئوية.من أجل منع حدوث الاحتراق ، من الضروري إثارة واحدة على الأقل من هذه الظروف. أي أنه من الضروري إزالة المادة القابلة للاحتراق ، وتبريدها تحت درجة حرارة الاشتعال ، ومنع وصول الأكسجين. ترافقنا عمليات الاحتراق في الحياة اليومية ، لذلك يجب أن يعرف كل شخص شروط بدء الاحتراق وإنهائه ، وكذلك مراعاة القواعد اللازمة للتعامل مع المواد القابلة للاشتعال.
دورة الأكسجين في الطبيعة
دورة الأكسجين في الطبيعة. استخدام الأكسجين ودوره البيولوجي
ما يقرب من ربع ذرات جميع المواد الحية يمثلها الأكسجين. نظرًا لأن العدد الإجمالي لذرات الأكسجين في الطبيعة ثابت ، مع إزالة الأكسجين من الهواء بسبب التنفس والعمليات الأخرى ، يجب أن يتم تجديده. أهم مصادر الأكسجين في الطبيعة غير الحية هي ثاني أكسيد الكربون والماء. يدخل الأكسجين إلى الغلاف الجوي بشكل أساسي نتيجة لعملية التمثيل الضوئي ، والتي تنطوي على هذا-o-two. مصدر مهم للأكسجين هو الغلاف الجوي للأرض. يتكون جزء من الأكسجين في الأجزاء العليا من الغلاف الجوي بسبب تفكك الماء تحت تأثير الإشعاع الشمسي. يتم إطلاق جزء من الأكسجين بواسطة النباتات الخضراء في عملية التمثيل الضوئي باستخدام الرماد اثنين س وهذا هو في اثنين. في المقابل ، يتشكل الغلاف الجوي it-o-two نتيجة تفاعلات الاحتراق وتنفس الحيوانات. يتم إنفاق o-two في الغلاف الجوي على تكوين الأوزون في الأجزاء العليا من الغلاف الجوي ، والتجوية المؤكسدة للصخور ، وفي عملية تنفس الحيوانات وفي تفاعلات الاحتراق. يؤدي تحويل t-two إلى tse-two إلى إطلاق الطاقة ، على التوالي ، يجب إنفاق الطاقة على تحويل هذين إلى اثنين o. هذه الطاقة هي الشمس. وبالتالي ، فإن الحياة على الأرض تعتمد على العمليات الكيميائية الدورية الممكنة بسبب دخول الطاقة الشمسية.
يرجع استخدام الأكسجين إلى خصائصه الكيميائية. يستخدم الأكسجين على نطاق واسع كعامل مؤكسد. يتم استخدامه للحام وقطع المعادن ، في الصناعة الكيميائية - للحصول على مركبات مختلفة وتكثيف بعض عمليات الإنتاج. في تكنولوجيا الفضاء ، يستخدم الأكسجين لحرق الهيدروجين وأنواع الوقود الأخرى ، في الطيران - عند الطيران على ارتفاعات عالية ، في الجراحة - لدعم المرضى الذين يعانون من ضيق التنفس.
يرجع الدور البيولوجي للأكسجين إلى قدرته على دعم التنفس. يستهلك الشخص عند التنفس لمدة دقيقة واحدة في المتوسط 0.5 dm3 من الأكسجين ، وخلال النهار - 720 dm3 ، وخلال العام - 262.8 متر مكعب من الأكسجين.
1. تفاعل التحلل الحراري لبرمنجنات البوتاسيوم. لنقم بمعادلة التفاعل الكيميائي:
يتم توزيع مادة البوتاسيوم - المنغنيز - 4 على نطاق واسع في الحياة اليومية تحت اسم "برمنجنات البوتاسيوم". يتم إظهار الأكسجين الذي تم تكوينه بواسطة شعلة مشتعلة ، والتي تومض بشكل ساطع عند فتح أنبوب مخرج الغاز بالجهاز الذي يتم فيه إجراء التفاعل ، أو عند إدخاله في وعاء به أكسجين.
2. تفاعل تحلل بيروكسيد الهيدروجين في وجود أكسيد المنغنيز (IV). لنقم بمعادلة التفاعل الكيميائي:
بيروكسيد الهيدروجين معروف أيضًا في الحياة اليومية. يمكن استخدامه لعلاج الخدوش والجروح الطفيفة (يجب أن يكون محلول الرماد اثنين أو اثنين بالوزن ثلاثة بالمائة في كل مجموعة إسعافات أولية). يتم تسريع العديد من التفاعلات الكيميائية في وجود مواد معينة. في هذه الحالة ، يتم تسريع تفاعل تحلل بيروكسيد الهيدروجين بواسطة manganese-o-two ، لكن manganese-o-two نفسه لا يستهلك ولا يعد جزءًا من نواتج التفاعل. المنغنيز- o-two هو عامل مساعد.
المحفزات هي مواد تسرع التفاعلات الكيميائية ، لكنها لا تُستهلك في حد ذاتها. لا تستخدم المحفزات على نطاق واسع في الصناعة الكيميائية فحسب ، بل تلعب أيضًا دورًا مهمًا في حياة الإنسان. المحفزات الطبيعية ، والتي تسمى الإنزيمات ، تشارك في تنظيم العمليات البيوكيميائية.
الأكسجين ، كما أشرنا سابقًا ، أثقل قليلاً من الهواء. لذلك ، يمكن جمعها عن طريق دفع الهواء إلى وعاء موضوعة مع الفتحة لأعلى.
قاموا بترميمها بالفحم في فرن (انظر) ، مرتبة في حفرة ؛ قاموا بضخه في الفرن باستخدام منفاخ ، وتم فصل المنتج - kritsa عن الخبث بالضربات وتم تشكيل منتجات مختلفة منه. مع تحسن طرق النفخ وزيادة ارتفاع الموقد ، زادت العملية وأصبح جزء منها مكربنًا ، أي تم الحصول على الحديد الزهر ؛ يعتبر هذا المنتج الهش نسبيًا منتج نفايات. ومن هنا جاء اسم الحديد الزهر ، والحديد الزهر - الحديد الزهر الإنجليزي. لاحقًا ، لوحظ أنه عند التحميل ليس الحديد ، ولكن الحديد الزهر في الفرن ، يتم أيضًا الحصول على ازدهار من الحديد منخفض الكربون ، واتضح أن هذه العملية ذات المرحلتين (انظر إعادة توزيع كريشني) أكثر ربحية من النفخ الخام. في القرنين الثاني عشر والثالث عشر. كانت طريقة الصراخ منتشرة بالفعل. في القرن الرابع عشر بدأ صهر الحديد الزهر ليس فقط كمنتج شبه نهائي لمزيد من المعالجة ، ولكن أيضًا كمواد لصب المنتجات المختلفة. كما أن إعادة بناء الموقد وتحويله إلى منجم ("دومنيتسا") ، ثم إلى فرن صهر ، يعود أيضًا إلى نفس الوقت. في منتصف القرن الثامن عشر في أوروبا ، بدأ استخدام عملية البوتقة للحصول على الفولاذ ، والتي كانت معروفة في سوريا في الفترة المبكرة من العصور الوسطى ، لكنها تحولت فيما بعد إلى طي النسيان. بهذه الطريقة ، يتم الحصول على الفولاذ عن طريق صهر الخلائط المعدنية في بوتقات صغيرة من كتلة عالية المقاومة للحرارة. في الربع الأخير من القرن الثامن عشر بدأت عملية إعادة توزيع الحديد الزهر في موقد عاكس للهب في التطور (انظر Puddling). أدت الثورة الصناعية في القرن الثامن عشر - أوائل القرن التاسع عشر ، واختراع المحرك البخاري ، وإنشاء السكك الحديدية ، والجسور الكبيرة ، والأسطول البخاري إلى حاجة هائلة إليها. ومع ذلك ، فإن جميع طرق الإنتاج الحالية لا يمكن أن تلبي احتياجات السوق. بدأ الإنتاج الضخم للصلب فقط في منتصف القرن التاسع عشر ، عندما تم تطوير عمليات Bessemer و Thomas و Open Hearth. في القرن 20th نشأت عملية صناعة الفولاذ الكهربائي وانتشرت على نطاق واسع ، مما أدى إلى إنتاج فولاذ عالي الجودة.
التوزيع في الطبيعة. من حيث المحتوى في الغلاف الصخري (4.65٪ بالوزن) ، فإنه يحتل المرتبة الثانية بين (الأول). تهاجر بقوة في قشرة الأرض ، وتشكل حوالي 300 (، إلخ). تلعب دورًا نشطًا في عمليات الصهارة والحرارة المائية والجينات الفائقة ، والتي ترتبط بتكوين أنواع مختلفة من رواسبها (انظر Zheleznye). - أعماق الأرض ، تتراكم في المراحل الأولى من الصهارة ، في الموجات فوق السطحية (9.85٪) والقاعدة (8.56٪) (في الجرانيت 2.7٪ فقط). يتراكم B في العديد من الرواسب البحرية والقارية ، مكونًا رواسب رسوبية.
فيما يلي الخصائص الفيزيائية المتعلقة بشكل أساسي بتلك التي يقل محتوى شوائبها الإجمالي عن 0.01٪ بالكتلة:
نوع من التفاعل مع ينشط HNO 3 المركز (كثافة 1.45 جم / سم 3) بسبب ظهور طبقة أكسيد واقية على سطحه ؛ أكثر تمييع HNO 3 يذوب بتكوين Fe 2+ أو Fe 3+ ، ويتعافى إلى MH 3 أو N 2 O و N 2.
الاستلام والتطبيق. يتم الحصول على النقي في كميات قليلة نسبيًا من الماء منه أو منه. يتم تطوير طريقة للحصول عليها مباشرة. يزيد تدريجياً من إنتاج نقي بدرجة كافية من خلال تركيزه المباشر من الركاز أو الفحم عند مستويات منخفضة نسبيًا.
أهم التقنيات الحديثة. في شكله النقي ، نظرًا لقيمته المنخفضة ، لا يتم استخدامه عمليًا ، على الرغم من أن منتجات الفولاذ أو الحديد الزهر في الحياة اليومية غالبًا ما تسمى "الحديد". يستخدم الجزء الأكبر في شكل مختلف تمامًا في التركيب والخصائص. تمثل ما يقرب من 95 ٪ من جميع المنتجات المعدنية. غني (أكثر من 2٪ من حيث الوزن) - الحديد الزهر ، مصهور في فرن الصهر من الحديد المخصب (انظر إنتاج الأفران العالية). يتم صهر الفولاذ بمختلف درجاته (المحتوى أقل من 2٪ بالكتلة) من الحديد الزهر في الموقد المكشوف والكهرباء والمحولات عن طريق (حرق) الزائدة وإزالة الشوائب الضارة (بشكل رئيسي S ، P ، O) وإضافة عناصر صناعة السبائك (انظر Martenovskaya ، المحول). يتم صهر الفولاذ عالي السبائك (الذي يحتوي على نسبة عالية من العناصر الأخرى) في القوس الكهربائي والحث. لإنتاج الفولاذ ولأغراض مهمة بشكل خاص ، يتم استخدام عمليات جديدة - الفراغ ، إعادة الصهر بالكهرباء ، ذوبان البلازما وشعاع الإلكترون ، إلخ. يتم تطوير طرق لصهر الفولاذ في وحدات التشغيل المستمر التي تضمن الجودة العالية والأتمتة للعملية.
على أساس ، يتم إنشاء المواد التي يمكنها تحمل تأثيرات البيئات الشديدة والمنخفضة والعالية والخطيرة ، والجهود الكبيرة المتناوبة ، والإشعاع النووي ، وما إلى ذلك. الإنتاج وهو يتزايد باستمرار. في عام 1971 ، تم صهر 89.3 مليون طن من الحديد الخام و 121 مليون طن من الفولاذ في الاتحاد السوفياتي.
ل.أ.شفارتسمان ، إل في فانيوكوفا.
تم استخدامه كمواد فنية منذ العصور القديمة في مصر (للرأس من مقبرة توت عنخ آمون بالقرب من طيبة ، منتصف القرن الرابع عشر قبل الميلاد ، متحف أشموليان ، أكسفورد) ، بلاد ما بين النهرين (تم العثور على خناجر بالقرب من كركميش ، 500 قبل الميلاد ، المتحف البريطاني ، لندن)