> كم عدد الذرات في الكون؟
اكتشف، كم عدد الذرات الموجودة في الكون: حسب الحساب ، حجم الكون المرئي ، تاريخ الميلاد والتطور بالصورة ، عدد النجوم ، الكتلة ، البحث.
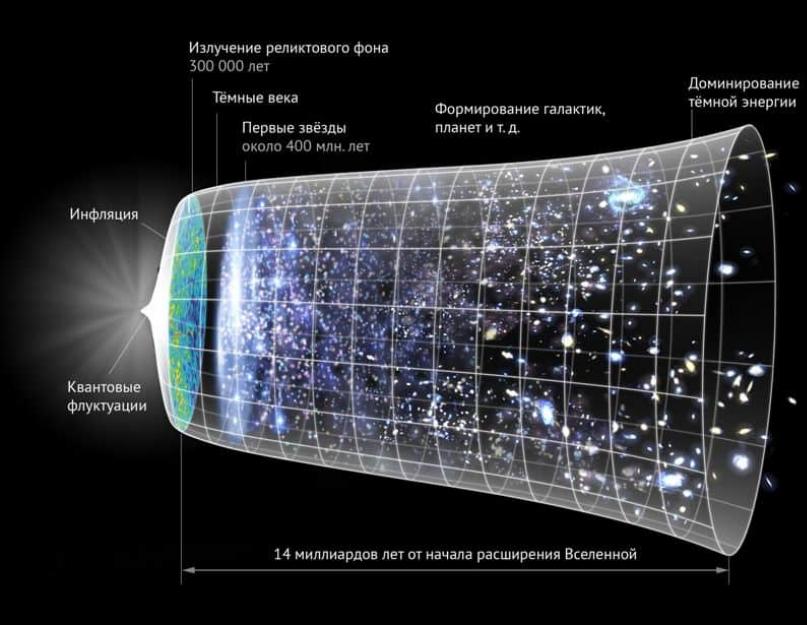
بالتأكيد ، يعلم الجميع أن الكون مكان واسع النطاق. وفقًا للتقديرات العامة ، لا تفتح أمامنا سوى 93 مليار سنة ضوئية ("الكون المرئي"). هذا رقم ضخم ، خاصة إذا كنت لا تنسى أن هذا هو الجزء المتاح فقط لأجهزتنا. وبالنظر إلى هذه الأحجام ، لن يكون من الغريب افتراض أن كمية المادة يجب أن تكون كبيرة أيضًا.
من المثير للاهتمام البدء في دراسة القضية على نطاق صغير. بعد كل شيء ، يحتوي كوننا على 120-300 سكستيليون نجمة (1.2 أو 3 × 10 23). إذا قمنا بزيادة كل شيء إلى مستوى الذرات ، فإن هذه الأرقام ستبدو ببساطة غير واردة. كم عدد الذرات الموجودة في الكون؟
وفقًا للحسابات ، اتضح أن الكون مليء بـ 10 78-10 82 ذرة. لكن حتى هذه المؤشرات لا تعكس مقدار المادة التي تحتوي عليها. سبق وذكرنا أنه يمكننا استيعاب 46 مليار سنة ضوئية في أي اتجاه ، مما يعني أننا لا نستطيع رؤية الصورة كاملة. بالإضافة إلى ذلك ، يتوسع الكون باستمرار ، مما يبعد الأشياء عنا.
منذ وقت ليس ببعيد ، توصل حاسوب عملاق ألماني إلى نتيجة حول وجود 500 مليار مجرة في مجال الرؤية. إذا لجأنا إلى المصادر المحافظة ، فسنحصل على 300 مليار. يمكن أن تحتوي مجرة واحدة على 400 مليار نجم ، لذا فإن العدد الإجمالي في الكون يمكن أن يصل إلى 1.2 × 10 23 - 100 سكستيليون.
يبلغ متوسط وزن النجمة 10 35 جرامًا. الوزن الإجمالي 10 58 جرام. تظهر الحسابات أن كل جرام يحتوي على 10 24 بروتون ، أو نفس العدد من ذرات الهيدروجين (يحتوي الهيدروجين على بروتون واحد). في المجموع ، نحصل على 10 82 هيدروجين.
نحن نأخذ الكون المرئي كأساس ، حيث يجب توزيع هذا المقدار بالتساوي (أكثر من 300 مليون سنة ضوئية). ولكن على نطاق أصغر ، ستخلق المادة مجموعات من المادة المضيئة التي نعرفها جميعًا.
للتلخيص ، تتركز معظم ذرات الكون في النجوم التي تخلق المجرات ، وتتحد في مجموعات ، والتي بدورها تشكل عناقيد فائقة وتكمل كل ذلك بتكوين السور العظيم. هذا عند التكبير. إذا ذهبت في الاتجاه المعاكس وأخذت مقاييس أصغر ، فإن المجموعات تمتلئ بالغيوم بالغبار والغاز ومواد أخرى.

تميل المادة إلى الانتشار بشكل متناحٍ. أي أن جميع المناطق السماوية متشابهة ويحتوي كل منها على نفس المقدار. الفضاء مشبع بموجة من الإشعاع الخواص القوي ، تعادل 2.725 كلفن (أعلى بقليل من الصفر المطلق).
ينص المبدأ الكوني على أن الكون متجانس. بناءً عليه ، يمكن القول إن قوانين الفيزياء ستكون صالحة بشكل متساوٍ في أي مكان في الكون ولا ينبغي انتهاكها على نطاق واسع. يتم دعم هذه الفكرة أيضًا من خلال الملاحظات التي توضح تطور بنية الكون بعد الانفجار العظيم.
اتفق الباحثون على أن معظم المادة تشكلت في لحظة الانفجار العظيم ، وأن التوسع لا يضيف مادة جديدة. كانت آليات آخر 13.7 مليار سنة هي توسع وتشتت الجماهير الرئيسية.
لكن النظرية معقدة بسبب تكافؤ كتلة وطاقة أينشتاين ، والتي تتكون من النظرية العامة للنسبية (إضافة الكتلة تزيد تدريجياً من كمية الطاقة).

ومع ذلك ، تظل كثافة الكون مستقرة. حديث يصل إلى 9.9 × 10 30 جرام لكل سم 3. تتركز هنا 68.3٪ من الطاقة المظلمة و 26.8٪ من المادة المظلمة و 4.9٪ من المادة المضيئة. اتضح أن الكثافة تساوي ذرة هيدروجين واحدة لكل 4 م 3.
لا يزال العلماء غير قادرين على فك رموز الخصائص ، لذلك من المستحيل أن نقول على وجه اليقين ما إذا كانت موزعة بالتساوي أو تشكل كتل كثيفة. لكن يُعتقد أن المادة المظلمة تبطئ من تمددها ، لكن الطاقة المظلمة تعمل على تسريع هذا التمدد.
كل هذه الأرقام ، فيما يتعلق بعدد الذرات في الكون ، هي تقدير تقريبي. لا تنس الفكرة الرئيسية: نحن نتحدث عن حسابات الكون المرئي.
السعي لتحقيق أدنى حالة طاقة هو خاصية عامة للمادة. ربما تعرف عن الانهيارات الثلجية الجبلية وانهيارات الصخور. طاقتهم كبيرة لدرجة أنها تستطيع أن تزيل الجسور والمنازل وغيرها من الهياكل الكبيرة والمتينة من على وجه الأرض. سبب هذه الظاهرة الهائلة للطبيعة هو أن كتلة الثلج أو الحجارة تميل إلى احتلال الحالة بأقل طاقة ، وأن الطاقة الكامنة للجسم المادي عند سفح الجبل أقل مما هي على المنحدر أو القمة.
تشكل الذرات روابط مع بعضها البعض لنفس السبب: الطاقة الكلية للذرات المتصلة أقل من طاقة نفس الذرات في حالة حرة. هذا ظرف سعيد للغاية بالنسبة لي ولك - بعد كل شيء ، إذا لم يكن هناك ربح في الطاقة عند دمج الذرات في جزيئات ، فلن تملأ الكون سوى ذرات العناصر ، وظهور جزيئات بسيطة ومعقدة ضرورية للوجود من المستحيل.
ومع ذلك ، لا يمكن للذرات أن ترتبط ببعضها البعض بشكل تعسفي. كل ذرة قادرة على الارتباط بعدد معين من الذرات الأخرى ، والذرات المقيدة مرتبة في الفضاء بطريقة محددة بدقة. يجب البحث عن سبب هذه القيود في خصائص غلاف الإلكترون للذرات ، أو بالأحرى في الخصائص خارجيقذائف الإلكترون التي تستخدمها الذرات للتفاعل مع بعضها البعض.
تحتوي غلاف الإلكترون الخارجي المكتمل على طاقة أقل (أي أكثر فائدة للذرة) من الطاقة غير المكتملة. وفقًا لقاعدة الثمانيات ، تحتوي القشرة المكتملة على 8 إلكترونات:

هذه هي الأصداف الإلكترونية الخارجية لذرات الغازات النبيلة ، باستثناء الهيليوم (ن = 1) ، الذي يتكون غلافه المكتمل من إلكترونين s (1s 2 ) فقط لأنص - لا يوجد مستوى فرعي في المستوى الأول.
تكون الأصداف الخارجية لجميع العناصر ، باستثناء الغازات النبيلة ، غير مكتملة وفي عملية التفاعل الكيميائي تكون مكتملة ، إن أمكن.
لكي يحدث مثل هذا "الإكمال" ، يجب على الذرات إما إعطاء الإلكترونات لبعضها البعض أو مشاركتها. هذا يفرض على الذرات أن تكون بجوار بعضها البعض ، أي أن تكون مرتبطة كيميائيا.
هناك عدة مصطلحات لأنواع الروابط الكيميائية: التساهمية ، التساهمية القطبية ، الأيونية ، المعدنية ، المتبرع المتقبل ، الهيدروجينوالبعض الآخر. ومع ذلك ، كما سنرى ، فإن جميع طرق ربط جسيمات المادة ببعضها البعض لها طبيعة مشتركة - وهذا هو توفير الإلكترونات الخاصة بهم للاستخدام الشائع (بشكل أكثر دقة - التنشئة الاجتماعيةالإلكترونات) ، والتي غالبًا ما تُستكمل بتفاعل إلكتروستاتيكي بين الشحنات المعاكسة التي تنشأ أثناء انتقالات الإلكترون. في بعض الأحيان ، يمكن أن تكون قوى الجذب بين الجسيمات الفردية كهروستاتيكية بحتة. هذا ليس فقط جاذبية بين الأيونات ، ولكن أيضًا تفاعلات متعددة بين الجزيئات.
الكيمياء هي علم المواد وتحولاتها في بعضها البعض.
المواد هي مواد نقية كيميائيا
المادة النقية كيميائيًا هي مجموعة من الجزيئات لها نفس التركيب النوعي والكمي ونفس البنية.
CH 3 -O-CH 3 -
CH 3 -CH 2-أوه
جزيء - أصغر جزيئات مادة لها كل خصائصها الكيميائية ؛ يتكون الجزيء من ذرات.
الذرة هي الجزيئات غير القابلة للتجزئة كيميائيًا والتي تشكل الجزيئات. (بالنسبة للغازات النبيلة ، الجزيء والذرة متماثلان ، He ، Ar)
الذرة عبارة عن جسيم محايد كهربائيًا يتكون من نواة موجبة الشحنة ، يتم حولها توزيع الإلكترونات سالبة الشحنة وفقًا لقوانينها المحددة بدقة. علاوة على ذلك ، فإن إجمالي شحنة الإلكترونات يساوي شحنة النواة.
تتكون نواة الذرات من بروتونات موجبة الشحنة (ع) ونيوترونات (ن) لا تحمل أي شحنة. الاسم الشائع للنيوترونات والبروتونات هو النيوكليونات. كتلة البروتونات والنيوترونات هي نفسها تقريبًا.
تحمل الإلكترونات (هـ -) شحنة سالبة تساوي شحنة البروتون. الكتلة e - حوالي 0.05٪ من كتلة البروتون والنيوترون. وهكذا ، تتركز كتلة الذرة بأكملها في نواتها.
يُطلق على الرقم p في الذرة ، الذي يساوي شحنة النواة ، الرقم التسلسلي (Z) ، نظرًا لأن الذرة محايدة كهربائيًا ، فإن الرقم e يساوي الرقم p.
العدد الكتلي (أ) للذرة هو مجموع البروتونات والنيوترونات في النواة. وفقًا لذلك ، فإن عدد النيوترونات في الذرة يساوي الفرق بين A و Z. (العدد الكتلي للذرة والرقم التسلسلي) (N = A-Z).
17 35 Cl p = 17 ، N = 18 ، Z = 17. 17p + ، 18n 0 ، 17e -.
النيوكليونات
يتم تحديد الخصائص الكيميائية للذرات من خلال تركيبتها الإلكترونية (عدد الإلكترونات) ، والتي تساوي العدد الذري (الشحنة النووية). لذلك ، فإن جميع الذرات التي لها نفس الشحنة النووية تتصرف كيميائيًا بنفس الطريقة ويتم حسابها كذرات من نفس العنصر الكيميائي.
العنصر عبارة عن مجموعة من الذرات لها نفس الشحنة النووية. (110 عنصر كيميائي).
يمكن أن تختلف الذرات ، التي لها نفس الشحنة النووية ، في عدد الكتلة ، والذي يرتبط بعدد مختلف من النيوترونات في نواتها.
تسمى الذرات التي لها نفس Z ولكن الأعداد الكتلية المختلفة نظائر.
17 35 Cl 17 37 Cl
نظائر الهيدروجين H:
التعيين: 1 1 N 1 2 D 1 3 T
الاسم: بروتيوم الديوتيريوم التريتيوم
التكوين الأساسي: 1p 1p + 1n 1p + 2n
البروتيوم والديوتيريوم مستقران
يتحلل التريتيوم (المشع) المستخدم في القنابل الهيدروجينية.
وحدة كتلة ذرية. رقم أفوجادرو. حشرة العتة.
كتل الذرات والجزيئات صغيرة جدًا (حوالي 10-28 إلى 10-24 جم) ، وللعرض العملي لهذه الكتل ، يُنصح بتقديم وحدة القياس الخاصة بك ، والتي من شأنها أن تؤدي إلى مقياس مناسب ومألوف.
نظرًا لأن كتلة الذرة تتركز في نواتها ، والتي تتكون من البروتونات والنيوترونات من نفس الكتلة تقريبًا ، فمن المنطقي أخذ كتلة نواة واحدة كوحدة كتلة من الذرات.
اتفقنا على أخذ واحد من اثني عشر من نظير الكربون ، الذي له بنية متماثلة للنواة (6p + 6n) ، كوحدة لكتلة الذرات والجزيئات. تسمى هذه الوحدة بوحدة الكتلة الذرية (amu) ، وهي تساوي عدديًا كتلة نواة واحدة. في هذا المقياس ، تكون كتل الذرات قريبة من القيم الصحيحة: He-4 ؛ آل 27 Ra-226 amu ……
احسب كتلة 1 أوقية بالجرام.
1/12 (12 ج) ![]() = \ u003d \ u003d 1.66 * 10-24 جم / a.u.m
= \ u003d \ u003d 1.66 * 10-24 جم / a.u.m
دعونا نحسب عدد amu الموجود في 1g.
ن أ = 6.02 * رقم أفوجادرو
تسمى النسبة الناتجة برقم Avogadro ، وهي توضح عدد وحدات amu الموجودة في 1g.
يتم التعبير عن الكتل الذرية الواردة في الجدول الدوري بوحدة amu
الكتلة الجزيئية هي كتلة الجزيء ، معبرًا عنها في amu ، يتم العثور عليها كمجموع كتل جميع الذرات التي تشكل هذا الجزيء.
م (1 جزيء H 2 SO 4) \ u003d 1 * 2 + 32 * 1 + 16 * 4 \ u003d 98 amu
من أجل الانتقال من amu إلى 1 g ، والذي يستخدم عمليًا في الكيمياء ، تم إدخال حساب جزئي لكمية المادة ، ويحتوي كل جزء على عدد N A للوحدات الهيكلية (الذرات ، والجزيئات ، والأيونات ، والإلكترونات). في هذه الحالة ، تكون كتلة هذا الجزء ، المسمى 1 مول ، معبرًا عنها بالجرام ، مساوية عدديًا للكتلة الذرية أو الجزيئية ، معبرًا عنها بوحدة amu.
لنجد كتلة 1 جزيء جرامي H 2 SO 4:
م (1 مول H 2 SO 4) \ u003d
98a.u.m * 1.66 ** 6.02 * =
كما ترى ، فإن الكتلة الجزيئية والكتلة المولية متساوية عدديًا.
1 مول- كمية المادة المحتوية على Avogadro عدد الوحدات الهيكلية (الذرات ، الجزيئات ، الأيونات).
الوزن الجزيئي (م)هي كتلة مول واحد من مادة معبرًا عنها بالجرام.
كمية المادة- V (مول) ؛ كتلة المادة م (ز) ؛ الكتلة المولية M (جم / مول) - مرتبطة بالنسب: V = ؛
2 س 2 س + س 2 2 س 2 س
2 مول 1 مول
2. القوانين الأساسية للكيمياء
إن قانون ثبات تكوين المادة - مادة نقية كيميائيًا ، بغض النظر عن طريقة التحضير ، لها دائمًا تركيبة نوعية وكمية ثابتة.
CH3 + 2O2 = CO2 + 2H2O
هيدروكسيد الصوديوم + حمض الهيدروكلوريك = كلوريد الصوديوم + H2O
المواد ذات التركيب الثابت تسمى daltonites. كاستثناء ، من المعروف أن المواد ذات التركيب الثابت - برتوليت (أكاسيد ، كربيدات ، نيتريد)
قانون حفظ الكتلة (Lomonosov) - تكون كتلة المواد التي دخلت في التفاعل دائمًا مساوية لكتلة نواتج التفاعل. ويترتب على ذلك أن الذرات لا تختفي أثناء التفاعل ولا تتشكل ، بل تنتقل من مادة إلى أخرى. هذا هو الأساس لاختيار المعاملات في معادلة التفاعل الكيميائي ، يجب أن يكون عدد ذرات كل عنصر في الجزأين الأيمن والأيسر من المعادلة متساويًا.
قانون المكافئ - في التفاعلات الكيميائية ، تتفاعل المواد وتتشكل بكميات مساوية لما يعادل (عدد المكافئات لمادة واحدة يتم استهلاكها ، بالضبط نفس العدد من المكافئات التي يتم استهلاكها أو يتم تكوين مادة أخرى).
المكافئ هو كمية المادة التي تضيف ، تستبدل ، تطلق مولًا واحدًا من ذرات H (أيونات) أثناء التفاعل. تسمى الكتلة المكافئة المعبر عنها بالجرام الكتلة المكافئة (E).
قوانين الغاز
قانون دالتون - الضغط الكلي لمزيج من الغازات يساوي مجموع الضغوط الجزئية لجميع مكونات خليط الغازات.
![]()
قانون أفوجادرو - تحتوي أحجام متساوية من الغازات المختلفة في نفس الظروف على عدد متساوٍ من الجزيئات.
النتيجة: مول واحد من أي غاز في الظروف العادية (t = 0 درجة أو 273K و P = 1 جو أو 101255 Pascal أو 760 mmHg. Pillar.) يحتل V = 22.4 لتر.
يسمى V الذي يحتل مولًا واحدًا من الغاز بالحجم المولي Vm.
معرفة حجم الغاز (خليط الغاز) و Vm في ظل ظروف معينة ، من السهل حساب كمية الغاز (خليط الغاز) = V / Vm.
ترتبط معادلة منديليف - كلابيرون بكمية الغاز بالظروف التي يقع فيها. pV = (م / م) * RT = * RT
عند استخدام هذه المعادلة ، يجب التعبير عن جميع الكميات الفيزيائية في SI: ضغط الغاز p (باسكال) ، حجم الغاز V (لتر) ، كتلة الغاز m (kg.) ، الكتلة المولية M (kg / mol) ، T - درجة الحرارة المطلقة (K) ، كمية نو من الغاز (مول) ، R- ثابت الغاز = 8.31 J / (mol * K).
D - الكثافة النسبية لغاز واحد بالنسبة إلى غاز آخر - تُظهر نسبة غاز M إلى غاز M ، المحدد كمعيار ، عدد المرات التي يكون فيها غاز واحد أثقل من D \ u003d M1 / M2.
طرق التعبير عن تكوين خليط من المواد.
الكسر الكتلي W- نسبة كتلة المادة إلى كتلة الخليط بأكمله W \ u003d ((m in-va) / (محلول m)) * 100٪
جزء الخلد æ - نسبة عدد in-va ، إلى العدد الإجمالي لجميع القرون. في الخليط.
توجد معظم العناصر الكيميائية في الطبيعة كمزيج من نظائر مختلفة ؛ بمعرفة التركيب النظيري لعنصر كيميائي ، معبرًا عنه في الكسور الجزيئية ، يتم حساب متوسط القيمة الموزونة للكتلة الذرية لهذا العنصر ، والتي يتم تحويلها إلى ISCE. А = Σ (æi * Аi) = æ1 * А1 + æ2 * А2 +… + æn * Аn ، حيث æi هو جزء الخلد من النظير i ، Аi هي الكتلة الذرية للنظير i.
جزء الحجم (φ) - نسبة VI إلى حجم الخليط بأكمله. φi = Vi / VΣ
معرفة التركيب الحجمي لخليط الغاز ، يتم حساب Mav لخليط الغاز. Мav = Σ (φi * Mi) = φ1 * М1 + φ2 * М2 +… + n * n
الذرة هي أصغر جسيم في مادة كيميائية قادر على الاحتفاظ بخصائصها. تأتي كلمة "atom" من الكلمة اليونانية القديمة "atomos" ، والتي تعني "غير قابل للتجزئة". اعتمادًا على عدد الجسيمات الموجودة في الذرة ، يمكنك تحديد العنصر الكيميائي.
باختصار عن هيكل الذرة
كما يمكنك سرد المعلومات الأساسية حول الجسيم بنواة واحدة ، وهي موجبة الشحنة. حول هذه النواة توجد سحابة سالبة الشحنة من الإلكترونات. كل ذرة في حالتها الطبيعية محايدة. يمكن تحديد حجم هذا الجسيم بالكامل من خلال حجم سحابة الإلكترون التي تحيط بالنواة.
النواة نفسها ، بدورها ، تتكون أيضًا من جسيمات أصغر - البروتونات والنيوترونات. البروتونات مشحونة إيجابيا. النيوترونات لا تحمل أي شحنة. ومع ذلك ، يتم دمج البروتونات والنيوترونات في فئة واحدة وتسمى نيوكليونات. إذا كانت هناك حاجة إلى معلومات أساسية حول بنية الذرة لفترة وجيزة ، فيمكن أن تقتصر هذه المعلومات على البيانات المدرجة..

أول معلومة عن الذرة
كان الإغريق يشتبه في حقيقة أن المادة يمكن أن تتكون من جزيئات صغيرة. لقد اعتقدوا أن كل ما هو موجود يتكون من ذرات. ومع ذلك ، كان هذا الرأي فلسفيًا بحتًا بطبيعته ولا يمكن تفسيره علميًا.
كان العالم الإنجليزي أول من حصل على معلومات أساسية عن بنية الذرة ، وكان هذا الباحث هو الذي تمكن من اكتشاف أن عنصرين كيميائيين يمكن أن يدخلوا في نسب مختلفة ، وكل مجموعة من هذا القبيل ستمثل مادة جديدة. على سبيل المثال ، ينتج عن ثمانية أجزاء من عنصر الأكسجين ثاني أكسيد الكربون. أربعة أجزاء من الأكسجين هي أول أكسيد الكربون.
في عام 1803 ، اكتشف دالتون ما يسمى بقانون النسب المتعددة في الكيمياء. بمساعدة القياسات غير المباشرة (نظرًا لعدم إمكانية فحص ذرة واحدة تحت المجاهر آنذاك) ، استنتج دالتون الوزن النسبي للذرات.

بحث رذرفورد
بعد قرن تقريبًا ، تم تأكيد المعلومات الأساسية حول بنية الذرات بواسطة كيميائي إنجليزي آخر - اقترح العالم نموذجًا لقشرة الإلكترون لأصغر الجسيمات.
في ذلك الوقت ، كان "النموذج الكوكبي للذرة" لروذرفورد أحد أهم الخطوات التي يمكن أن تتخذها الكيمياء. تشير المعلومات الأساسية حول بنية الذرة إلى أنها تشبه النظام الشمسي: تدور إلكترونات الجسيمات حول النواة في مدارات محددة بدقة ، تمامًا كما تفعل الكواكب.
الغلاف الإلكتروني للذرات وصيغ ذرات العناصر الكيميائية
تحتوي غلاف الإلكترون لكل ذرة على عدد من الإلكترونات تمامًا مثل عدد البروتونات في نواتها. هذا هو السبب في أن الذرة محايدة. في عام 1913 ، تلقى عالم آخر معلومات أساسية عن بنية الذرة. كانت صيغة نيلز بور مشابهة لصيغة رذرفورد. وفقًا لمفهومه ، تدور الإلكترونات أيضًا حول النواة الموجودة في المركز. أنهى بوهر نظرية رذرفورد ، وأدخل الانسجام في حقائقها.
حتى ذلك الحين ، تم وضع صيغ بعض المواد الكيميائية. على سبيل المثال ، يُشار إلى بنية ذرة النيتروجين بشكل تخطيطي على أنها 1s 2 2s 2 2p 3 ، يتم التعبير عن بنية ذرة الصوديوم بالصيغة 1s 2 2s 2 2p 6 3s 1. من خلال هذه الصيغ ، يمكنك معرفة عدد الإلكترونات التي تتحرك في كل من مدارات مادة كيميائية معينة.

نموذج شرودنغر
ومع ذلك ، فإن هذا النموذج الذري أصبح عفا عليه الزمن. أصبحت المعلومات الأساسية حول بنية الذرة ، المعروفة للعلم اليوم ، متاحة إلى حد كبير بفضل البحث الذي أجراه الفيزيائي النمساوي
اقترح نموذجًا جديدًا لهيكلها - موجة واحدة. بحلول هذا الوقت ، كان العلماء قد أثبتوا بالفعل أن الإلكترون لا يتمتع بطبيعة الجسيم فحسب ، بل يمتلك خصائص الموجة.
ومع ذلك ، فإن نموذج شرودنغر ورذرفورد يحتوي أيضًا على بعض الأحكام العامة. نظرياتهم متشابهة في أن الإلكترونات موجودة عند مستويات معينة.
تسمى هذه المستويات أيضًا بالطبقات الإلكترونية. يمكن استخدام رقم المستوى لوصف طاقة الإلكترون. كلما ارتفعت الطبقة ، زادت طاقتها. يتم عد جميع المستويات من أسفل إلى أعلى ، وبالتالي فإن رقم المستوى يتوافق مع طاقته. كل طبقة من طبقات الغلاف الإلكتروني للذرة لها مستوياتها الفرعية. في هذه الحالة ، يمكن أن يحتوي المستوى الأول على مستوى فرعي واحد ، والمستوى الثاني - اثنان ، والثالث - ثلاثة ، وما إلى ذلك (انظر الصيغ الإلكترونية أعلاه للنيتروجين والصوديوم).

حتى الجسيمات الأصغر
في الوقت الحالي ، بالطبع ، تم اكتشاف جسيمات أصغر من الإلكترون والبروتون والنيوترون. من المعروف أن البروتون يتكون من كواركات. توجد جسيمات أصغر في الكون - على سبيل المثال ، النيوترينو ، وهو أصغر بمئة مرة من الكوارك وأصغر بمليار مرة من البروتون.
النيوترينو هو جسيم صغير يصل إلى 10 سبتليون مرة أصغر من الديناصور ريكس ، على سبيل المثال. الديناصور نفسه أصغر بعدة مرات من الكون المرئي بأكمله.
معلومات أساسية عن بنية الذرة: النشاط الإشعاعي
من المعروف دائمًا أنه لا يوجد تفاعل كيميائي يمكنه تغيير عنصر إلى آخر. لكن في عملية الانبعاث الإشعاعي ، يحدث هذا تلقائيًا.
يسمى النشاط الإشعاعي قدرة نوى الذرات على التحول إلى نوى أخرى - أكثر استقرارًا. عندما يتلقى الناس معلومات أساسية حول بنية الذرات ، يمكن أن تكون النظائر ، إلى حد ما ، بمثابة تجسيد لأحلام الخيميائيين في العصور الوسطى.
أثناء تحلل النظائر ، ينبعث الإشعاع المشع. اكتشف بيكريل هذه الظاهرة لأول مرة. النوع الرئيسي للإشعاع المشع هو تسوس ألفا. يطلق جسيم ألفا. يوجد أيضًا تحلل بيتا ، حيث يتم إخراج جسيم بيتا من نواة الذرة ، على التوالي.
النظائر الطبيعية والاصطناعية
حاليًا ، هناك حوالي 40 نظيرًا طبيعيًا معروفًا. يقع معظمهم في ثلاث فئات: اليورانيوم والراديوم والثوريوم والأكتينيوم. يمكن العثور على كل هذه النظائر في الطبيعة - في الصخور والتربة والهواء. ولكن إلى جانبهم ، يُعرف أيضًا حوالي ألف نظير مشتق صناعيًا ، يتم الحصول عليها في المفاعلات النووية. تستخدم العديد من هذه النظائر في الطب ، وخاصة في التشخيص..

النسب داخل الذرة
إذا تخيلنا ذرة ، ستكون أبعادها قابلة للمقارنة مع حجم ملعب رياضي دولي ، فيمكننا بصريًا الحصول على النسب التالية. ستكون إلكترونات الذرة في مثل هذا "الملعب" أعلى المدرجات. كل واحد سيكون أصغر من رأس الدبوس. ثم يقع اللب في وسط هذا الحقل ، ولن يكون حجمه أكبر من حجم حبة البازلاء.
يسأل الناس أحيانًا كيف تبدو الذرة حقًا. في الواقع ، لا يبدو حرفياً أي شيء - ليس بسبب عدم استخدام ما يكفي من المجاهر الجيدة في العلم. أبعاد الذرة موجودة في تلك المناطق حيث مفهوم "الرؤية" ببساطة غير موجود.
الذرات صغيرة جدًا. لكن ما مدى صغر هذه الأبعاد حقًا؟ الحقيقة هي أن أصغر حبة ملح بالكاد مرئية للعين البشرية تحتوي على حوالي كوينتيليون ذرة.
إذا تخيلنا ذرة بهذا الحجم يمكن أن تلائم يد الإنسان ، فعندئذ سيكون بجانبها فيروسات بطول 300 متر. يبلغ طول البكتيريا 3 كيلومترات وسُمك شعرة الإنسان 150 كيلومترًا. في وضع الاستلقاء ، يمكنه تجاوز حدود الغلاف الجوي للأرض. وإذا كانت هذه النسب حقيقية ، فقد يصل طول شعرة الإنسان إلى القمر. هذه ذرة معقدة ومثيرة للاهتمام ، يواصل العلماء دراستها حتى يومنا هذا.
تعريف
ذرةهي أصغر جسيم كيميائي.
تنوع المركبات الكيميائية يرجع إلى مزيج مختلف من ذرات العناصر الكيميائية في الجزيئات والمواد غير الجزيئية. قدرة الذرة على الدخول في مركبات كيميائية ، يتم تحديد خصائصها الكيميائية والفيزيائية من خلال بنية الذرة. في هذا الصدد ، بالنسبة للكيمياء ، فإن التركيب الداخلي للذرة ، وقبل كل شيء ، بنية غلافها الإلكتروني لهما أهمية قصوى.
نماذج لبنية الذرة
في بداية القرن التاسع عشر ، أعاد دالتون إحياء النظرية الذرية ، معتمداً على القوانين الأساسية للكيمياء المعروفة في ذلك الوقت (ثبات التركيب ، والنسب المتعددة والمكافئات). أجريت التجارب الأولى لدراسة بنية المادة. ومع ذلك ، على الرغم من الاكتشافات التي تم إجراؤها (ذرات نفس العنصر لها نفس الخصائص ، وذرات العناصر الأخرى لها خصائص مختلفة ، تم تقديم مفهوم الكتلة الذرية) ، تم اعتبار الذرة غير قابلة للتجزئة.
بعد تلقي الدليل التجريبي (أواخر القرن التاسع عشر - أوائل القرن العشرين) على مدى تعقيد بنية الذرة (التأثير الكهروضوئي ، والكاثود والأشعة السينية ، والنشاط الإشعاعي) ، وجد أن الذرة تتكون من جسيمات سالبة وإيجابية مشحونة تتفاعل مع بعضهم البعض.
أعطت هذه الاكتشافات قوة دافعة لإنشاء النماذج الأولى لبنية الذرة. تم اقتراح أحد النماذج الأولى جيه طومسون(1904) (الشكل 1): قُدِّمت الذرة على أنها "بحر من الكهرباء الموجبة" تتأرجح فيه الإلكترونات.
بعد التجارب على جسيمات الفا عام 1911. اقترح رذرفورد ما يسمى ب نموذج كوكبيبنية الذرة (الشكل 1) ، على غرار بنية النظام الشمسي. وفقًا للنموذج الكوكبي ، يوجد في وسط الذرة نواة صغيرة جدًا بشحنة Z e ، حجمها أصغر بنحو 1،000،000 مرة من حجم الذرة نفسها. تحتوي النواة على كتلة الذرة بالكامل تقريبًا ولها شحنة موجبة. تتحرك الإلكترونات في مدارات حول النواة ، يتم تحديد عددها بواسطة شحنة النواة. يحدد المسار الخارجي للإلكترونات الأبعاد الخارجية للذرة. قطر الذرة 10-8 سم ، بينما قطر النواة أصغر بكثير -10-12 سم.
أرز. 1 نماذج لبنية الذرة حسب طومسون وراذرفورد
أظهرت التجارب على دراسة الأطياف الذرية خلل في النموذج الكوكبي لبنية الذرة ، حيث يتعارض هذا النموذج مع التركيب الخطي للأطياف الذرية. استنادًا إلى نموذج رذرفورد ونظرية أينشتاين للكميات الضوئية ونظرية الكم للإشعاع ، بلانك نيلز بور (1913)تمت صياغته المسلماتالذي يحتوي على النظرية الذرية(الشكل 2): يمكن للإلكترون أن يدور حول النواة ليس في أي منها ، ولكن فقط في بعض المدارات المحددة (ثابتة) ، يتحرك على طول مثل هذا المدار ، ولا ينبعث منه طاقة كهرومغناطيسية أو إشعاع (امتصاص أو انبعاث كمية من الكهرومغناطيسية الطاقة) يحدث أثناء انتقال الإلكترون (يشبه القفزة) من مدار إلى آخر.

أرز. 2. نموذج لبنية الذرة حسب ن. بوهر
أظهرت المادة التجريبية المتراكمة التي تميز بنية الذرة أنه لا يمكن وصف خصائص الإلكترونات ، وكذلك الكائنات الدقيقة الأخرى ، على أساس مفاهيم الميكانيكا الكلاسيكية. تخضع الجسيمات الدقيقة لقوانين ميكانيكا الكم ، والتي أصبحت أساسًا للخلق النموذج الحديث لبنية الذرة.
الأطروحات الرئيسية لميكانيكا الكم:
- تنبعث الطاقة وتمتصها الأجسام في أجزاء منفصلة - الكميات ، وبالتالي تتغير طاقة الجسيمات بشكل مفاجئ ؛
- للإلكترونات والجسيمات الدقيقة الأخرى طبيعة مزدوجة - فهي تعرض خصائص كل من الجسيمات والموجات (ثنائية موجة الجسيمات) ؛
- تنكر ميكانيكا الكم وجود مدارات معينة للجسيمات الدقيقة (بالنسبة للإلكترونات المتحركة ، من المستحيل تحديد الموضع الدقيق ، لأنها تتحرك في الفضاء بالقرب من النواة ، يمكن للمرء فقط تحديد احتمال العثور على إلكترون في أجزاء مختلفة من الفضاء).
يُطلق على المساحة القريبة من النواة ، والتي يكون فيها احتمال العثور على إلكترون مرتفعًا بدرجة كافية (90٪) المداري.
عدد الكمية. مبدأ باولي. قواعد كليشكوفسكي
يمكن وصف حالة الإلكترون في الذرة باستخدام أربعة عدد الكمية.
نهو رقم الكم الرئيسي. يميز الطاقة الكلية للإلكترون في الذرة وعدد مستوى الطاقة. تأخذ n القيم الصحيحة من 1 إلى ∞. يحتوي الإلكترون على أقل طاقة عند n = 1 ؛ مع زيادة n - الطاقة. تسمى حالة الذرة ، عندما تكون إلكتروناتها عند مستويات طاقتها بحيث تكون طاقتها الكلية في حدها الأدنى ، الحالة الأرضية. الدول ذات القيم الأعلى تسمى متحمس. يشار إلى مستويات الطاقة بالأرقام العربية وفقًا لقيمة n. يمكن ترتيب الإلكترونات في سبعة مستويات ، وبالتالي ، في الواقع ، يوجد n من 1 إلى 7. يحدد الرقم الكمي الرئيسي حجم سحابة الإلكترون ويحدد متوسط نصف قطر الإلكترون في الذرة.
لهو رقم الكم المداري. يميز احتياطي الطاقة للإلكترونات في المستوى الفرعي وشكل المدار (الجدول 1). يقبل القيم الصحيحة من 0 إلى n-1. ل يعتمد على ن. إذا كانت n = 1 ، فإن l = 0 ، مما يعني أنه في المستوى الأول يوجد مستوى فرعي أول.

أناهو رقم الكم المغناطيسي. يميز اتجاه المدار في الفضاء. يقبل القيم الصحيحة من –l إلى 0 إلى + l. وهكذا ، عندما l = 1 (p-orbital) ، m e تأخذ القيم -1 ، 0 ، 1 ، ويمكن أن يكون اتجاه المدار مختلفًا (الشكل 3).

أرز. 3. أحد الاتجاهات الممكنة في الفضاء المداري p
سهو رقم كم الدوران. يميز دوران الإلكترون حول المحور. يأخذ القيم -1/2 (↓) و +1/2 (). إلكترونان في نفس المدار لهما دوران مضاد.
يتم تحديد حالة الإلكترونات في الذرات مبدأ باولي: لا يمكن أن تحتوي الذرة على إلكترونين لهما نفس المجموعة من جميع الأرقام الكمية. يتم تحديد تسلسل ملء المدارات بالإلكترونات بواسطة قواعد كليشكوفسكي: المدارات مملوءة بالإلكترونات بترتيب تصاعدي للمجموع (n + l) لهذه المدارات ، إذا كان المجموع (n + l) هو نفسه ، فإن المدار ذو القيمة الأقل من n يُملأ أولاً.
ومع ذلك ، لا تحتوي الذرة عادةً على إلكترونات واحدة ، بل تحتوي على عدة إلكترونات ، ومن أجل مراعاة تفاعلها مع بعضها البعض ، يتم استخدام مفهوم الشحنة الفعالة للنواة - يتأثر إلكترون المستوى الخارجي بشحنة أقل من شحنة النواة ، ونتيجة لذلك تحمي الإلكترونات الداخلية الإلكترونات الخارجية.
الخصائص الرئيسية للذرة: نصف القطر الذري (التساهمي ، المعدني ، فان دير فال ، الأيوني) ، تقارب الإلكترون ، جهد التأين ، العزم المغناطيسي.
الصيغ الإلكترونية للذرات
تشكل جميع إلكترونات الذرة غلافها الإلكتروني. تم تصوير هيكل غلاف الإلكترون صيغة إلكترونية، والذي يوضح توزيع الإلكترونات على مستويات الطاقة والمستويات الفرعية. يُشار إلى عدد الإلكترونات في المستوى الفرعي برقم مكتوب في أعلى يمين الحرف الذي يشير إلى المستوى الفرعي. على سبيل المثال ، تحتوي ذرة الهيدروجين على إلكترون واحد ، والذي يقع على المستوى الفرعي s لمستوى الطاقة الأول: 1s 1. تتم كتابة الصيغة الإلكترونية للهيليوم التي تحتوي على إلكترونين على النحو التالي: 1s 2.
بالنسبة لعناصر الفترة الثانية ، تملأ الإلكترونات مستوى الطاقة الثاني ، والذي لا يمكن أن يحتوي على أكثر من 8 إلكترونات. أولاً ، تملأ الإلكترونات المستوى الفرعي s ، ثم المستوى الفرعي p. فمثلا:
5 ب 1s 2 2s 2 2p 1
علاقة التركيب الإلكتروني للذرة بموضع العنصر في النظام الدوري
يتم تحديد الصيغة الإلكترونية للعنصر من خلال موقعه في النظام الدوري لـ D.I. مندليف. لذا ، فإن عدد الفترة يتوافق مع عناصر الفترة الثانية ، وتملأ الإلكترونات مستوى الطاقة الثاني ، والذي لا يمكن أن يحتوي على أكثر من 8 إلكترونات. أولاً ، تملأ الإلكترونات عناصر الفترة الثانية ، تملأ الإلكترونات مستوى الطاقة الثاني ، والذي لا يمكن أن يحتوي على أكثر من 8 إلكترونات. أولاً ، تملأ الإلكترونات المستوى الفرعي s ، ثم المستوى الفرعي p. فمثلا:
5 ب 1s 2 2s 2 2p 1
بالنسبة لذرات بعض العناصر ، يتم ملاحظة ظاهرة "تسرب" الإلكترون من مستوى طاقة خارجي إلى المستوى قبل الأخير. يحدث انزلاق الإلكترون في ذرات النحاس والكروم والبلاديوم وبعض العناصر الأخرى. فمثلا:
24 Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
مستوى الطاقة الذي لا يمكن أن يحتوي على أكثر من 8 إلكترونات. أولاً ، تملأ الإلكترونات المستوى الفرعي s ، ثم المستوى الفرعي p. فمثلا:
5 ب 1s 2 2s 2 2p 1
رقم المجموعة لعناصر المجموعات الفرعية الرئيسية يساوي عدد الإلكترونات في مستوى الطاقة الخارجية ، وتسمى هذه الإلكترونات إلكترونات التكافؤ (تشارك في تكوين رابطة كيميائية). يمكن أن تكون إلكترونات التكافؤ لعناصر المجموعات الفرعية الجانبية إلكترونات بمستوى الطاقة الخارجي والمستوى الفرعي d للمستوى قبل الأخير. يتوافق عدد مجموعة عناصر المجموعات الفرعية الجانبية للمجموعات III-VII ، بالإضافة إلى Fe ، Ru ، Os ، مع العدد الإجمالي للإلكترونات في المستوى الفرعي s لمستوى الطاقة الخارجية والمستوى الفرعي d لـ المستوى قبل الأخير
مهام:
ارسم الصيغ الإلكترونية لذرات الفوسفور والروبيديوم والزركونيوم. قائمة إلكترونات التكافؤ.
إجابه:
15 P 1s 2 2s 2 2p 6 3s 2 3p 3 إلكترونات التكافؤ 3s 2 3p 3
37 Rb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1 إلكترونات التكافؤ 5s 1
40 Zr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 2 5s 2 إلكترونات التكافؤ 4d 2 5s 2