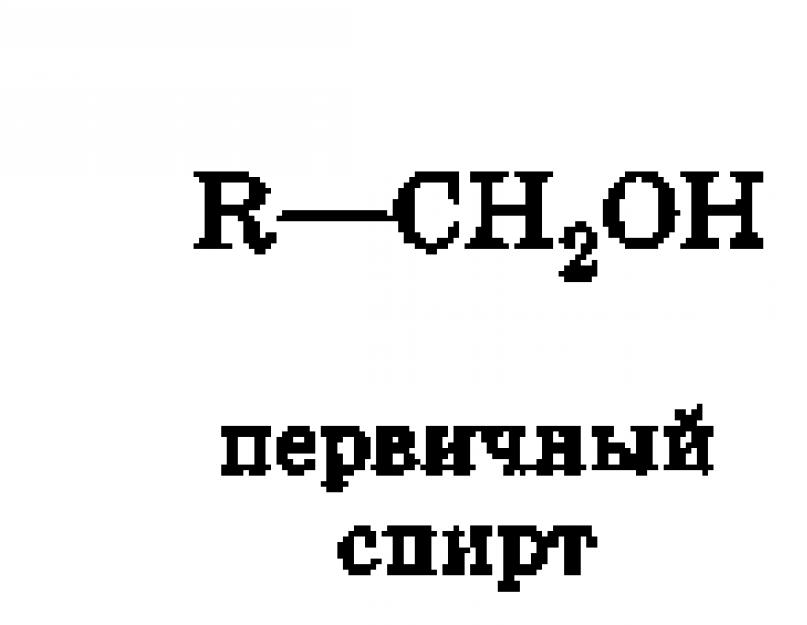تعريف
قلل من تناول الكحوليات أحادية الماءيمكن اعتبارها مشتقات الهيدروكربونات من سلسلة الميثان ، في الجزيئات التي يتم استبدال ذرة الهيدروجين بمجموعة الهيدروكسيل.
لذلك ، تتكون الكحولات أحادية الماء المشبعة من جذور هيدروكربونية ومجموعة وظيفية - OH. في أسماء الكحولات ، يتم الإشارة إلى مجموعة الهيدروكسيل بواسطة اللاحقة -ol.
الصيغة العامة للكحولات أحادية الماء المشبعة هي C n H 2 n +1 OH أو R-OH أو C n H 2 n +2 O. لا تعكس الصيغة الجزيئية للكحول بنية الجزيء ، نظرًا لأن مادتين مختلفتين تمامًا يمكن أن تتوافق مع نفس الصيغة الإجمالية ، على سبيل المثال ، الصيغة الجزيئية C 2 H 5 OH شائعة لكل من كحول الإيثيل والأسيتون (ثنائي ميثيل كيتون):
CH 3 -CH 2-OH (إيثانول) ؛
CH 3 -O-CH 3 (أسيتون).
مثل الهيدروكربونات في سلسلة الميثان ، تشكل الكحولات أحادية الماء المشبعة سلسلة متجانسة من الميثانول.
دعونا نؤلف هذه السلسلة من المتماثلات وننظر في أنماط التغيرات في الخصائص الفيزيائية لمركبات هذه السلسلة اعتمادًا على الزيادة في الجذر الهيدروكربوني (الجدول 1).
سلسلة متماثلة (غير مكتملة) من الكحولات أحادية الماء المشبعة
الجدول 1. سلسلة متجانسة (غير مكتملة) للكحولات أحادية الماء المشبعة.
تعتبر الكحولات أحادية الهيدرات المحدودة أخف من الماء ، لأن كثافتها أقل من الوحدة. الكحولات السفلية قابلة للامتزاج بالماء من جميع النواحي ، مع زيادة الجذور الهيدروكربونية تقل هذه القدرة. معظم الكحوليات قابلة للذوبان بدرجة عالية في المذيبات العضوية. تحتوي الكحولات على نقاط غليان وانصهار أعلى من الهيدروكربونات المقابلة أو مشتقات الهالوجين ، بسبب إمكانية تكوين روابط بين الجزيئات.
أهم ممثلي الكحولات أحادية الماء المشبعة هم الميثانول (CH 3 OH) والإيثانول (C 2 H 5 OH).
أمثلة على حل المشكلات
مثال 1
| ممارسه الرياضه | في اللآلئ الطبيعية ، نسب كتلة الكالسيوم والكربون والأكسجين هي 10: 3: 12. ما هي أبسط صيغة لؤلؤة؟ |
| المحلول | من أجل معرفة العلاقة بين العناصر الكيميائية في تكوين الجزيء ، من الضروري إيجاد كمية المادة الخاصة بها. من المعروف أنه للعثور على كمية المادة ، يجب استخدام الصيغة: لنجد الكتل المولية للكالسيوم والكربون والأكسجين (سيتم تقريب قيم الكتل الذرية النسبية المأخوذة من الجدول الدوري لـ DI Mendeleev إلى أعداد صحيحة). من المعروف أن M = Mr ، لذا M (Ca) = 40 جم / مول ، Ar (C) = 12 جم / مول ، M (O) = 32 جم / مول. ثم مقدار مادة هذه العناصر يساوي: n (Ca) = m (Ca) / M (Ca) ؛ ن (Ca) \ u003d 10/40 \ u003d 0.25 مول. ن (ج) = م (ج) / م (ج) ؛ ن (ج) = 3/12 = 0.25 مول. ن (س) = م (س) / م (س) ؛ ن (س) = 12/16 = 0.75 مول. أوجد النسبة المولية: n (Ca): n (C): n (O) = 0.25: 0.25: 0.75 = 1: 1: 3 ، أولئك. صيغة مركب اللؤلؤ هي CaCO 3. |
| إجابه | كربونات الكالسيوم 3 |
مثال 2
| ممارسه الرياضه | أكسيد النيتريك يحتوي على 63.2٪ أكسجين. ما هي صيغة الأكسيد |
| المحلول | يتم حساب الكسر الكتلي للعنصر X في جزيء تركيبة HX بالصيغة التالية: ω (X) = n × Ar (X) / M (HX) × 100٪. دعونا نحسب الكسر الكتلي للنيتروجين في الأكسيد: ω (N) \ u003d 100٪ - ω (O) \ u003d 100٪ - 63.2٪ \ u003d 36.8٪. دعونا نشير إلى عدد مولات العناصر التي يتكون منها المركب على أنها "x" (نيتروجين) و "y" (أكسجين). بعد ذلك ، ستبدو النسبة المولية على النحو التالي (سيتم تقريب قيم الكتل الذرية النسبية المأخوذة من الجدول الدوري لـ DI Mendeleev إلى أعداد صحيحة): x: y = ω (N) / Ar (N): ω (O) / Ar (O) ؛ س: ص = 36.8 / 14: 63.2 / 16 ؛ س: ص = 2.6: 3.95 = 1: 2. لذا فإن صيغة مركب النيتروجين والأكسجين ستكون NO 2. هذا هو أكسيد النيتريك (IV). |
| إجابه | لا 2 |
محتوى المقال
الكحول(كحول) - فئة من المركبات العضوية تحتوي على مجموعة أو أكثر من مجموعات C-OH ، في حين أن مجموعة هيدروكسيل OH مرتبطة بذرة كربون أليفاتية (المركبات التي تكون فيها ذرة الكربون في مجموعة C-OH جزءًا من النواة العطرية تسمى الفينولات)
تصنيف الكحوليات متنوع ويعتمد على سمة الهيكل التي يتم أخذها كأساس.
1. اعتمادًا على عدد مجموعات الهيدروكسيل في الجزيء ، يتم تقسيم الكحولات إلى:
أ) أحادي الذرة (يحتوي على مجموعة هيدروكسيل OH واحدة) ، على سبيل المثال ، ميثانول CH 3 OH ، إيثانول C 2 H 5 OH ، بروبانول C 3 H 7 OH
ب) متعدد الذرات (مجموعتان أو أكثر من مجموعات الهيدروكسيل) ، على سبيل المثال ، جلايكول الإيثيلين
HO-CH 2 -CH 2 -OH ، الجلسرين HO-CH 2 -CH (OH) -CH 2 -OH ، بنتاريريثريتول C (CH 2 OH) 4.
تكون المركبات التي تحتوي فيها ذرة كربون واحدة على مجموعتين من الهيدروكسيل في معظم الحالات غير مستقرة وتتحول بسهولة إلى ألدهيدات ، أثناء فصل الماء: RCH (OH) 2 ® RCH \ u003d O + H 2 O
2. وفقًا لنوع ذرة الكربون التي ترتبط بها مجموعة OH ، تنقسم الكحوليات إلى:
أ) الأساسي ، حيث يتم ربط مجموعة OH بذرة الكربون الأولية. تسمى ذرة الكربون الأولية (مظللة باللون الأحمر) ، مرتبطة بذرة كربون واحدة فقط. أمثلة على الكحولات الأولية - الإيثانول CH 3 - ج H 2-OH ، بروبانول CH 3 -CH 2 - ج H 2-أوه.
ب) ثانوي ، حيث يتم ربط مجموعة OH بذرة كربون ثانوية. ذرة الكربون الثانوية (الموضحة باللون الأزرق) مرتبطة في وقت واحد بذرتين من الكربون ، على سبيل المثال ، بروبانول ثانوي ، وبيوتانول ثانوي (الشكل 1).
أرز. واحد. هيكل الكحوليات الثانوية
ج) المستوى الثالث ، حيث يتم ربط مجموعة OH بذرة الكربون الثالثة. ترتبط ذرة الكربون الثلاثية (الموضحة باللون الأخضر) في نفس الوقت بثلاث ذرات كربون متجاورة ، على سبيل المثال ، البيوتانول العالي والبنتانول (الشكل 2).
أرز. 2. هيكل الكحوليات الثلاثية
تسمى مجموعة الكحول المرتبطة بها أيضًا الابتدائية أو الثانوية أو الثالثة ، وفقًا لنوع ذرة الكربون.
في الكحولات متعددة الهيدروكسيل التي تحتوي على مجموعتين أو أكثر من مجموعات OH ، يمكن أن تتواجد مجموعات H O الأولية والثانوية في نفس الوقت ، على سبيل المثال ، في الجلسرين أو إكسيليتول (الشكل 3).
أرز. 3. الجمع بين مجموعات OH الابتدائية والثانوية في هيكل كحول متعدد الكحوليات.
3. وفقًا لبنية المجموعات العضوية المرتبطة بمجموعة OH ، يتم تقسيم الكحوليات إلى مشبعة (ميثانول ، إيثانول ، بروبانول) ، غير مشبع ، على سبيل المثال ، كحول الأليل CH 2 \ u003d CH - CH 2 -OH ، عطري (على سبيل المثال ، كحول بنزيل C 6 H 5 CH 2 OH) يحتوي على مجموعة عطرية في المجموعة R.
الكحولات غير المشبعة ، حيث "تجاور" مجموعة OH الرابطة المزدوجة ، أي مرتبط بذرة كربون تشارك في وقت واحد في تكوين رابطة مزدوجة (على سبيل المثال ، كحول فينيل CH 2 \ u003d CH – OH) ، غير مستقر للغاية ويتشابه على الفور ( سم.ISOMERIZATION) للألدهيدات أو الكيتونات:
CH 2 \ u003d CH – OH ® CH 3 -CH \ u003d O
تسمية الكحوليات.
بالنسبة للكحوليات الشائعة ذات البنية البسيطة ، يتم استخدام تسمية مبسطة: يتم تحويل اسم المجموعة العضوية إلى صفة (باستخدام اللاحقة والنهاية " الجديد") وإضافة كلمة" كحول ":
في الحالة التي يكون فيها هيكل المجموعة العضوية أكثر تعقيدًا ، يتم استخدام القواعد المشتركة لجميع الكيمياء العضوية. تسمى الأسماء التي تم تجميعها وفقًا لهذه القواعد بأنها منهجية. وفقًا لهذه القواعد ، يتم ترقيم سلسلة الهيدروكربون من النهاية التي تكون مجموعة OH الأقرب إليها. بعد ذلك ، يتم استخدام هذا الترقيم للإشارة إلى موضع البدائل المختلفة على طول السلسلة الرئيسية ، تتم إضافة اللاحقة "ol" ورقم يشير إلى موضع مجموعة OH في نهاية الاسم (الشكل 4):
أرز. أربعة. الأسماء المنهجية للكحول. يتم تمييز المجموعات الوظيفية (OH) والمستبدلة (CH 3) ، بالإضافة إلى المؤشرات الرقمية المقابلة لها ، بألوان مختلفة.
يتم إجراء الأسماء المنهجية لأبسط الكحوليات وفقًا لنفس القواعد: الميثانول والإيثانول والبيوتانول. بالنسبة لبعض أنواع الكحوليات ، تم الحفاظ على الأسماء البسيطة (المبسطة) التي تم تطويرها تاريخيًا: كحول البروبارجيل HCє C – CH 2 –OH ، الجلسرين HO – CH 2 –CH (OH) –CH 2 –OH ، بنتاريريثريتول C (CH 2 OH) 4 ، كحول فينيثيل C 6 H 5 -CH 2 -CH 2-OH.
الخصائص الفيزيائية للكحول.
الكحولات قابلة للذوبان في معظم المذيبات العضوية ، والممثلين الثلاثة الأبسط - الميثانول والإيثانول والبروبانول ، وكذلك البوتانول العالي (H 3 C) 3 COH - قابلة للامتزاج بالماء بأي نسبة. مع زيادة عدد ذرات C في المجموعة العضوية ، يبدأ التأثير الكارثي للماء (طارد الماء) في التأثير ، وتصبح قابلية الذوبان في الماء محدودة ، وفي R تحتوي على أكثر من 9 ذرات كربون ، تختفي عمليًا.
بسبب وجود مجموعات OH ، تتشكل روابط هيدروجينية بين جزيئات الكحول.
أرز. 5. سندات الهيدروجين في الكحول(موضحة بخط منقط)
نتيجة لذلك ، تحتوي جميع الكحولات على نقطة غليان أعلى من الهيدروكربونات المقابلة ، على سبيل المثال ، T. kip. الإيثانول + 78 درجة مئوية ، و T. kip. الإيثان - 88.63 درجة مئوية ؛ T. كيب. البيوتانول والبيوتان + 117.4 درجة مئوية و -0.5 درجة مئوية على التوالي.
الخواص الكيميائية للكحول.
تتميز الكحوليات بتحولات مختلفة. تفاعلات الكحوليات لها بعض الأنماط العامة: تفاعل الكحولات أحادية الماء الأولية أعلى من الكحوليات الثانوية ، بدورها ، الكحولات الثانوية أكثر نشاطًا كيميائيًا من الكحوليات الثالثة. بالنسبة للكحولات ثنائية الهيدروجين ، في حالة وجود مجموعات OH عند ذرات الكربون المجاورة ، لوحظ زيادة في التفاعل (بالمقارنة مع الكحولات أحادية الماء) بسبب التأثير المتبادل لهذه المجموعات. بالنسبة للكحوليات ، من الممكن حدوث تفاعلات مع انقسام كل من روابط C – O و O –H.
1. تجري ردود الفعل من خلال الرابطة О.
عند التفاعل مع المعادن النشطة (Na ، K ، Mg ، Al) ، تُظهر الكحولات خصائص الأحماض الضعيفة وتشكل أملاحًا تسمى الكحولات أو الألكوكسيدات:
2CH 3 OH + 2Na® 2CH 3 موافق + H 2
الكحولات غير مستقرة كيميائيًا وتتحلل بالماء لتكوين كحول وهيدروكسيد معدني:
C 2 H 5 OK + H 2 O ® C 2 H 5 OH + KOH
يوضح هذا التفاعل أن الكحول أحماض أضعف مقارنة بالماء (حمض قوي يحل محل ضعيف) ، بالإضافة إلى ذلك ، عند التفاعل مع المحاليل القلوية ، لا تشكل الكحول الكحولات. ومع ذلك ، في الكحولات متعددة الهيدروكسيل (في حالة ارتباط مجموعات OH بذرات C المجاورة) ، تكون حموضة مجموعات الكحول أعلى بكثير ، ويمكنها تكوين كحول ليس فقط عند التفاعل مع المعادن ، ولكن أيضًا مع القلويات:
HO – CH 2 –CH 2 –OH + 2NaOH ® NaO – CH 2 –CH 2 –ONa + 2H 2 O
عندما ترتبط مجموعات H O في الكحولات المتعددة الهيدروجين بذرات C غير المجاورة ، فإن خصائص الكحوليات قريبة من monohydric ، حيث لا يظهر التأثير المتبادل لمجموعات H O.
عند التفاعل مع الأحماض المعدنية أو العضوية ، تشكل الكحولات إسترات - مركبات تحتوي على جزء R-O-A (A هو بقايا الحمض). يحدث تكوين الإسترات أيضًا أثناء تفاعل الكحولات مع أنهيدريدات وكلوريدات الحمض للأحماض الكربوكسيلية (الشكل 6).
تحت تأثير العوامل المؤكسدة (K 2 Cr 2 O 7 ، KMnO 4) ، تشكل الكحولات الأولية الألدهيدات ، بينما تشكل الكحولات الثانوية الكيتونات (الشكل 7)
أرز. 7. تكوين الألدهيد والكيتونات أثناء أكسدة الكحول
يؤدي تقليل الكحوليات إلى تكوين هيدروكربونات تحتوي على نفس عدد ذرات الكربون مثل جزيء الكحول الأولي (الشكل 8).
أرز. ثمانية. استعادة البوتانول
2. ردود الفعل التي تحدث في رابطة C – O.
في حالة وجود محفزات أو أحماض معدنية قوية ، يتم تجفيف الكحول (يتم فصل الماء) ، بينما يمكن أن يذهب التفاعل في اتجاهين:
أ) الجفاف بين الجزيئات بمشاركة جزيئين كحول ، بينما تتكسر روابط C-O في أحد الجزيئات ، مما يؤدي إلى تكوين الإيثرات - المركبات التي تحتوي على جزء R-O-R (الشكل 9 أ).
ب) أثناء الجفاف داخل الجزيئات ، تتشكل الألكينات - هيدروكربونات برابطة مزدوجة. في كثير من الأحيان ، تحدث كلتا العمليتين - تكوين الأثير والألكين - بالتوازي (الشكل 9 ب).
في حالة الكحولات الثانوية ، أثناء تكوين ألكين ، يمكن أن يكون هناك اتجاهان للتفاعل (الشكل 9 ج) ، يكون الاتجاه السائد هو الاتجاه الذي ينفصل فيه الهيدروجين عن أقل ذرة كربون مهدرجة أثناء التكثيف (مميز بعلامة رقم 3) ، أي محاط بعدد أقل من ذرات الهيدروجين (مقارنة بالذرة 1). يظهر في الشكل. يتم استخدام 10 تفاعلات لإنتاج الألكينات والإيثرات.
يحدث تكسير رابطة C-O في الكحول أيضًا عندما يتم استبدال مجموعة OH بهالوجين ، أو مجموعة أمينية (الشكل 10).
أرز. عشرة. استبدال OH-GROUP في الكحول بهالوجين أو مجموعة أمين
ردود الفعل هو مبين في الشكل. 10 تستخدم لإنتاج الهالوكربونات والأمينات.
الحصول على الكحوليات.
بعض التفاعلات الموضحة أعلاه (الشكل 6،9،10) قابلة للعكس ، وفي ظل الظروف المتغيرة ، يمكن أن تستمر في الاتجاه المعاكس ، مما يؤدي إلى إنتاج الكحوليات ، على سبيل المثال ، أثناء التحلل المائي للإسترات والهالوكربونات (الشكل. 11A و B ، على التوالي) ، وكذلك الألكينات المائية - بإضافة الماء (الشكل 11 ب).
أرز. أحد عشر. إنتاج الكحول عن طريق الماء وترطيب المركبات العضوية
يشكل تفاعل التحلل المائي للألكينات (الشكل 11 ، المخطط ب) أساس الإنتاج الصناعي للكحولات المنخفضة التي تحتوي على ما يصل إلى 4 ذرات كربون.
يتشكل الإيثانول أيضًا أثناء ما يسمى بالتخمير الكحولي للسكريات ، على سبيل المثال الجلوكوز C 6 H 12 O 6. تستمر العملية في وجود فطريات الخميرة وتؤدي إلى تكوين الإيثانول وثاني أكسيد الكربون:
C 6 H 12 O 6 ® 2C 2 H 5 OH + 2CO 2
لا يمكن للتخمير أن ينتج أكثر من 15٪ محلول مائي من الكحول ، لأن الخمائر تموت بتركيز أعلى من الكحول. يتم الحصول على محاليل الكحول ذات التركيز العالي عن طريق التقطير.
يتم إنتاج الميثانول صناعياً عن طريق اختزال أول أكسيد الكربون عند 400 درجة مئوية تحت ضغط 20-30 ميجا باسكال في وجود محفز يتكون من أكاسيد النحاس والكروم والألمنيوم:
CO + 2 H 2 ® H 3 SON
إذا تم إجراء الأكسدة بدلاً من التحلل المائي للألكينات (الشكل 11) ، يتم تكوين كحول ثنائي الهيدروجين (الشكل 12)
أرز. 12. الحصول على الكحول الرقمي
استخدام الكحوليات.
تسمح قدرة الكحوليات على المشاركة في مجموعة متنوعة من التفاعلات الكيميائية باستخدامها للحصول على جميع أنواع المركبات العضوية: الألدهيدات والكيتونات والأحماض الكربوكسيلية والإيثرات والإسترات المستخدمة كمذيبات عضوية ، في إنتاج البوليمرات والأصباغ والأدوية.
يستخدم الميثانول CH 3 OH كمذيب ، وفي إنتاج الفورمالديهايد المستخدم لإنتاج راتنجات الفينول فورمالدهايد ، تم اعتبار الميثانول مؤخرًا وقود محرك واعد. تستخدم كميات كبيرة من الميثانول في إنتاج ونقل الغاز الطبيعي. الميثانول هو المركب الأكثر سمية بين جميع أنواع الكحوليات ، والجرعة المميتة عند تناوله عن طريق الفم هي 100 مل.
الإيثانول C 2 H 5 OH هو مركب البداية لإنتاج الأسيتالديهيد ، وحمض الخليك ، وكذلك لإنتاج إسترات الأحماض الكربوكسيلية المستخدمة كمذيبات. بالإضافة إلى ذلك ، يعتبر الإيثانول المكون الرئيسي لجميع المشروبات الكحولية ، كما أنه يستخدم على نطاق واسع في الطب كمطهر.
يستخدم البوتانول كمذيب للدهون والراتنجات ، بالإضافة إلى أنه يستخدم كمواد خام لإنتاج المواد العطرية (أسيتات البوتيل ، بوتيل الساليسيلات ، إلخ). في الشامبو ، يتم استخدامه كعنصر يزيد من شفافية الحلول.
يوجد كحول البنزيل C 6 H 5 -CH 2 -OH في الحالة الحرة (وعلى شكل استرات) في الزيوت الأساسية من الياسمين والصفير. له خصائص مطهرة (مطهرة) ، ويستخدم في مستحضرات التجميل كمادة حافظة للكريمات ، والمستحضرات ، وإكسير الأسنان ، وفي صناعة العطور كمادة عطرية.
كحول الفينيثيل C 6 H 5 -CH 2 -CH 2 -OH له رائحة الورد ، ويوجد في زيت الورد ، ويستخدم في صناعة العطور.
يستخدم Ethylene glycol HOCH 2 -CH 2 OH في إنتاج البلاستيك وكمضاد للتجمد (مادة مضافة تقلل من نقطة تجمد المحاليل المائية) ، بالإضافة إلى تصنيع أحبار النسيج والطباعة.
يستخدم Diethylene glycol HOCH 2 -CH 2 OCH 2 -CH 2 OH لملء أجهزة الفرامل الهيدروليكية ، وكذلك في صناعة النسيج عند الانتهاء من الأقمشة وصبغها.
يستخدم Glycerin HOCH 2 -CH (OH) -CH 2 OH لإنتاج راتنجات بوليستر جليبتال ، بالإضافة إلى أنه أحد مكونات العديد من مستحضرات التجميل. النتروجليسرين (الشكل 6) هو المكون الرئيسي للديناميت المستخدم في التعدين وبناء السكك الحديدية كمادة متفجرة.
يستخدم Pentaerythritol (HOCH 2) 4 C لإنتاج بوليستر (راتنجات خماسية) ، كمادة مقوية للراتنجات الاصطناعية ، وملدنات لكلوريد البولي فينيل ، وأيضًا في إنتاج متفجرات رباعي النتروجين.
الكحولات المتعددة الهيدروكسيل HOCH2- (CHOH) 3-CH2OH والسوربيتول HOCH2- (CHOH) 4-CH2OH لها طعم حلو وتستخدم بدلاً من السكر في صناعة الحلويات لمرضى السكر والسمنة. تم العثور على السوربيتول في روان والكرز التوت.
ميخائيل ليفيتسكي
الكحولات هي مشتقات من الهيدروكربونات تحتوي على مجموعة أو أكثر من مجموعة هيدروكسيل الهيدروكسيل.
تصنف الكحوليات:
1. وفقًا لعدد مجموعات الهيدروكسيل الموجودة في الجزيء ، يتم تقسيم الكحولات إلى أحادي الذرة (مع هيدروكسيل واحد) ، وثنائي الذرة (مع هيدروكسيل واحد) ، وثلاثي الذرات (مع ثلاثة هيدروكسيل) ومتعدد الهيدروكسيل.
مثل الهيدروكربونات المشبعة ، تشكل الكحولات أحادية الماء سلسلة من المتماثلات يتم بناؤها بانتظام:
كما هو الحال في السلاسل المتجانسة الأخرى ، يختلف كل عضو في سلسلة الكحول في التكوين عن الأعضاء السابقين واللاحقين من خلال الاختلاف المتماثل (-CH 2 -).
2. اعتمادًا على ذرة الكربون التي يوجد بها الهيدروكسيل ، يتم تمييز الكحولات الأولية والثانوية والثالثية. تحتوي جزيئات الكحولات الأولية على مجموعة -CH 2 OH المرتبطة بجذر واحد أو بذرة هيدروجين في الميثانول (الهيدروكسيل عند ذرة الكربون الأولية). تتميز الكحولات الثانوية بمجموعة> C H OH مرتبطة بجذرين (هيدروكسيل في ذرة الكربون الثانوية). تحتوي جزيئات كحول المرحلة الثالثة على مجموعة> C-OH مرتبطة بثلاثة جذور (الهيدروكسيل في ذرة الكربون الثالثة). بدلالة الراديكالية بواسطة R ، يمكننا كتابة صيغ هذه الكحوليات بشكل عام: 
وفقًا لتسمية IUPAC ، عند إنشاء اسم كحول أحادي الهيدروجين ، تتم إضافة اللاحقة -ol إلى اسم الهيدروكربون الأصلي. إذا كانت هناك وظائف أعلى في المركب ، فسيتم الإشارة إلى مجموعة الهيدروكسيل بالبادئة hydroxy- (في الروسية ، غالبًا ما تستخدم البادئة أوكسي). باعتبارها السلسلة الرئيسية ، يتم اختيار أطول سلسلة غير متفرعة من ذرات الكربون ، والتي تتضمن ذرة كربون مرتبطة بمجموعة الهيدروكسيل ؛ إذا كان المركب غير مشبع ، فسيتم تضمين الرابطة المتعددة أيضًا في هذه السلسلة. تجدر الإشارة إلى أنه عند تحديد بداية الترقيم ، عادةً ما يكون لدالة الهيدروكسيل الأسبقية على الهالوجين والرابطة المزدوجة والألكيل ، لذلك يبدأ الترقيم من نهاية السلسلة ، التي تقع مجموعة الهيدروكسيل بالقرب منها:

يتم تسمية أبسط الكحولات وفقًا للجذور التي ترتبط بها مجموعة الهيدروكسيل: (CH 3) 2 CHOH - كحول الأيزوبروبيل ، (CH 3) 3 COH - كحول ثلاثي بوتيل.
غالبًا ما يتم استخدام التسمية المنطقية للكحول. وفقًا لهذه التسمية ، تعتبر الكحوليات من مشتقات كحول الميثيل - كاربينول:

هذا النظام مناسب في الحالات التي يكون فيها اسم الراديكالي بسيطًا وسهل الإنشاء.
2. الخصائص الفيزيائية للكحول
تحتوي الكحولات على نقاط غليان أعلى وتكون أقل تطايرًا ، ولها نقاط انصهار أعلى ، وقابلة للذوبان في الماء أكثر من الهيدروكربونات المقابلة ؛ ومع ذلك ، فإن الفرق يتناقص مع زيادة الوزن الجزيئي.
يرجع الاختلاف في الخصائص الفيزيائية إلى القطبية العالية لمجموعة الهيدروكسيل ، مما يؤدي إلى ارتباط جزيئات الكحول من خلال الترابط الهيدروجيني:

وبالتالي ، فإن نقاط الغليان الأعلى للكحول مقارنة بنقاط غليان الهيدروكربونات المقابلة ترجع إلى الحاجة إلى كسر روابط الهيدروجين أثناء انتقال الجزيئات إلى الطور الغازي ، الأمر الذي يتطلب طاقة إضافية. من ناحية أخرى ، يؤدي هذا النوع من الارتباط ، إذا جاز التعبير ، إلى زيادة الوزن الجزيئي ، مما يؤدي بطبيعة الحال إلى انخفاض التقلب.
الكحوليات ذات الوزن الجزيئي المنخفض قابلة للذوبان بدرجة عالية في الماء ، وهو أمر مفهوم نظرًا لإمكانية تكوين روابط هيدروجينية مع جزيئات الماء (يرتبط الماء نفسه بدرجة كبيرة جدًا). في كحول الميثيل ، تشكل مجموعة الهيدروكسيل نصف كتلة الجزيء تقريبًا ؛ لا عجب إذن أن الميثانول قابل للامتزاج بالماء من جميع النواحي. مع زيادة حجم سلسلة الهيدروكربونات في الكحول ، ينخفض تأثير مجموعة الهيدروكسيل على خصائص الكحول ، على التوالي ، تقل قابلية ذوبان المواد في الماء وتزداد قابليتها للذوبان في الهيدروكربونات. الخصائص الفيزيائية للكحولات أحادية الماء ذات الوزن الجزيئي العالي تشبه بالفعل تلك الخاصة بالهيدروكربونات المقابلة.

تعتبر المركبات العضوية المحتوية على الأكسجين ، أحدها كحول مختلف ، مشتقات وظيفية مهمة للهيدروكربونات. هم أحادي الذرة ، ثنائي الذرة ومتعدد الذرات. الكحولات أحادية الماء هي في الواقع مشتقات الهيدروكربونات ، في المكون الجزيئي الذي توجد فيه مجموعة هيدروكسيل واحدة (يُشار إليها بـ "-OH") مرتبطة بذرات الكربون المشبعة.
ينتشر
يتم توزيع الكحولات أحادية الماء على نطاق واسع في الطبيعة. لذلك ، يوجد كحول الميثيل بكميات صغيرة في عصير عدد من النباتات (على سبيل المثال ، عشبة الهوجويد). يوجد الكحول الإيثيلي ، باعتباره أحد منتجات التخمر الكحولي للمركبات العضوية ، في الفواكه والتوت المحمضين. تم العثور على كحول سيتيل في زيت الحوت. يشمل شمع العسل سيريل وكحولات ميريسيل. تحتوي بتلات الورد على 2-فينيل إيثانول. توجد كحول التربين في شكل مواد عطرية في العديد من الثقافات العطرية للتوابل.
تصنيف
تصنف الكحولات حسب العدد الجزيئي لمجموعات الهيدروكسيل. بادئ ذي بدء:
- كحول أحادي الهيدرات (مثل الإيثانول) ؛
- ثنائي الذرة (إيثانيديول) ؛
- متعدد الذرات (الجلسرين).
وفقًا لطبيعة الجذر الهيدروكربوني ، تنقسم الكحوليات إلى عطرية ، أليفاتية ، دورية. اعتمادًا على نوع ذرة الكربون التي لها ارتباط بمجموعة الهيدروكسيل ، تعتبر الكحوليات أولية وثانوية وثالثية. يتم التعبير عن الصيغة العامة للكحول أحادي الهيدرات كما هو مطبق على الحد من الكحولات أحادية الماء بالقيمة: C n H 2n + 2 O.

التسمية
يتكون اسم الكحول وفقًا للتسمية الوظيفية الجذرية من الاسم المرتبط بمجموعة الهيدروكسيل في الراديكالية وكلمة "كحول". وفقًا للتسمية المنهجية IUPAC ، يتكون اسم الكحول من الألكان المقابل مع إضافة النهاية "-ol". فمثلا:
- الميثانول - كحول الميثيل ؛
- ميثيل بروبانول 1-2 - أيزوبوتيل (ثلاثي بوتيل) ؛
- إيثانول - إيثيل ؛
- بوتانول 1-2 - بوتيل (سيك بوتيل) ؛
- بروبانول 1-2 - بروبيل (أيزوبروبيل).
يتم تصنيف الترقيم وفقًا لقواعد IUPAC حسب موضع مجموعة الهيدروكسيل ، ويتلقى رقمًا أقل. على سبيل المثال: pentanediol-2-4 ، 4-methylpentanol-2 ، إلخ.
ايزومرية
تحتوي الكحولات أحادية الهيدرات المحدودة على الأنواع التالية من التماكب البنيوي والمكاني. فمثلا:
- هيكل عظمي من الكربون.
- الايثرات الايزومرية.
- مناصب المجموعة الوظيفية.
يتم تمثيل التماثل المكاني للكحوليات بواسطة التماثل البصري. يمكن التماثل البصري في وجود ذرة كربون غير متماثلة (تحتوي على أربعة بدائل مختلفة) في الجزيء.

طرق الحصول على الكحوليات أحادية الماء
يمكنك الحد من الكحول أحادي الهيدرات بعدة طرق:
- التحلل المائي للهالوكانات.
- ترطيب الألكينات.
- الحد من الألدهيدات والكيتونات.
- تخليق المغنيسيوم العضوي.
يعد التحلل المائي للهالوكانات أحد أكثر الطرق المختبرية شيوعًا لتحضير الكحول. عن طريق المعالجة بالماء (كبديل - بمحلول مائي قلوي) ، يتم الحصول على الكحوليات الأولية والثانوية:
CH 3 - CH 2 -Br + NaOH → CH 3 - CH 2 - OH + NaBr.
يتم تحلل هالو ألكانات الثلاثية بسهولة أكبر ، ولكن لديها تفاعل جانبي سهل للتخلص. لذلك ، يتم الحصول على كحول الدرجة الثالثة بطرق أخرى.
يتم ترطيب الألكينات عن طريق إضافة الماء إلى الألكينات في وجود محفزات تحتوي على حمض (H 3 PO 4). تعتمد الطريقة على الإنتاج الصناعي للكحولات مثل الإيثيل والأيزوبروبيل وثالث بيوتيل.
يتم إجراء اختزال مجموعة الكربونيل باستخدام الهيدروجين في وجود محفز الهدرجة (Ni أو Pt). في هذه الحالة ، تتكون الكحولات الثانوية من الكيتونات ، وتتكون الكحولات أحادية الماء الأولية المشبعة من الألدهيدات. صيغة العملية:
CH 3 - C \ u003d O (-H) + H 2 (ethanal) → CH 3 - CH 2 - OH (إيثانول).
يتم الحصول على مركبات المغنيسيوم العضوية عن طريق إضافة هاليدات ألكيل ماغنيسيوم إلى الألدهيدات والكيتونات. يتم إجراء التفاعل في ثنائي إيثيل إيثر جاف. يشكل التحلل المائي اللاحق لمركبات المغنيسيوم العضوي كحولات أحادية الماء.
تتكون الكحولات الأولية من تفاعل Grignard فقط من الفورمالديهايد وأي هاليدات ألكيل ماغنيسيوم. تعطي الألدهيدات الأخرى كحولات ثانوية من خلال هذا التفاعل ، الكيتونات - كحول من الدرجة الثالثة.

التوليف الصناعي للميثانول
الطرق الصناعية ، كقاعدة عامة ، هي عمليات مستمرة مع إعادة تدوير متعددة لكتل كبيرة من المواد المتفاعلة ، يتم تنفيذها في الطور الغازي. الكحولات المهمة صناعيا هي الميثانول والإيثانول.
الميثانول (حجم إنتاجه هو الأكبر بين الكحوليات) حتى عام 1923 تم الحصول عليه عن طريق التقطير الجاف (التسخين بدون دخول الهواء) للخشب. اليوم يتم إنتاجه من غاز تخليق (خليط من CO و H 2). تتم العملية عند ضغط 5-10 ميجا باسكال باستخدام محفزات الأكسيد (ZnO + Cr 2 O 3 ، CuO + ZnO + Al 2 O 3 وغيرها) في نطاق درجة حرارة 250-400 درجة مئوية ، نتيجة لذلك ، تم الحصول على كحول أحادي الهيدرات مشبع. صيغة التفاعل: CO + 2H 2 → CH 3 OH.
في الثمانينيات ، عند دراسة آلية هذه العملية ، وجد أن الميثانول لا يتكون من أول أكسيد الكربون ، ولكن من ثاني أكسيد الكربون ، الناتج عن تفاعل أول أكسيد الكربون مع آثار الماء.

التوليف الصناعي للإيثانول
طريقة الإنتاج الشائعة لتخليق الإيثانول التقني هي ترطيب الإيثيلين. ستتخذ صيغة الإيثانول الكحولي أحادي الهيدرات الشكل التالي:
CH 2 \ u003d CH 2 + H 2 O → CH 3 - CH 2 OH.
تتم العملية تحت ضغط 6-7 ميجا باسكال في الطور الغازي ، ويمرر الإيثيلين وبخار الماء فوق المحفز. المحفز هو الفوسفوريك أو حمض الكبريتيك المترسب على هلام السيليكا.
يتم الحصول على كحول الإيثيل الغذائي والطب عن طريق التحلل المائي الأنزيمي للسكريات الموجودة في العنب والتوت والحبوب والبطاطس ، يليها تخمير الجلوكوز الناتج. تخمر المواد السكرية ناتج عن فطريات الخميرة التي تنتمي إلى مجموعة الإنزيمات. درجة الحرارة الأكثر ملاءمة لهذه العملية هي 25-30 درجة مئوية. في المؤسسات الصناعية ، يتم استخدام الإيثانول ، الذي يتم الحصول عليه عن طريق تخمير الكربوهيدرات المتكونة أثناء التحلل المائي للخشب والنفايات الناتجة عن إنتاج اللب والورق.

الخصائص الفيزيائية للكحولات أحادية الماء
في جزيئات الكحول توجد ذرات هيدروجين مرتبطة بعنصر كهرسلبي - أكسجين ، خالي عمليًا من الإلكترونات. بين ذرات الهيدروجين وذرات الأكسجين التي تحتوي على أزواج وحيدة من الإلكترونات ، تتشكل روابط هيدروجينية بين الجزيئات.
تعود الرابطة الهيدروجينية إلى السمات المحددة لذرة الهيدروجين:
- عندما يتم سحب إلكترونات الربط إلى ذرة أكثر كهربيًا ، تكون نواة ذرة الهيدروجين "عارية" ، ويتم تكوين بروتون غير محمي بواسطة إلكترونات أخرى. عندما تتأين أي ذرة أخرى ، تظل قشرة الإلكترون باقية ، تحجب النواة.
- تمتلك ذرة الهيدروجين حجمًا صغيرًا مقارنة بالذرات الأخرى ، ونتيجة لذلك فهي قادرة على الاختراق بعمق شديد في غلاف الإلكترون لذرة مجاورة مستقطبة سالبًا دون الارتباط بها بواسطة رابطة تساهمية.
الرابطة الهيدروجينية أضعف بحوالي 10 مرات من الرابطة التساهمية المعتادة. تتراوح طاقة رابطة الهيدروجين بين 4-60 كيلو جول / مول ، أما بالنسبة لجزيئات الكحول فتبلغ 25 كيلو جول / مول. وهو يختلف عن روابط s العادية بطول أطول (0.166 نانومتر) مقارنة بطول رابطة O-H (0.107 نانومتر).
الخواص الكيميائية
يتم تحديد التفاعلات الكيميائية للكحولات أحادية الماء من خلال وجود مجموعة الهيدروكسيل الوظيفية في جزيئاتها. تكون ذرة الأكسجين في الحالة الهجينة sp3. زاوية الرابطة قريبة من رباعي السطوح. يذهب اثنان من المدارات الهجينة sp3 لتشكيل روابط مع ذرات أخرى ، ويحتوي المديران الآخران على أزواج وحيدة من الإلكترونات. وفقًا لذلك ، تتركز الشحنة السالبة الجزئية على ذرة الأكسجين ، وتتركز الشحنات الموجبة الجزئية على ذرات الهيدروجين والكربون.
روابط C-O و C-H قطبية تساهمية (الأخير أكثر قطبية). يحدد الانقسام غير المتجانس لرابطة O-H بتكوين H + الخصائص الحمضية للكحولات أحادية الماء. يمكن مهاجمة ذرة كربون ذات شحنة موجبة جزئية بواسطة كاشف نووي.

خصائص الحمض
الكحوليات هي أحماض ضعيفة جدًا ، أضعف من الماء لكنها أقوى من الأسيتيلين. لا يغيرون لون المؤشر. تتجلى أكسدة الكحولات أحادية الماء عند التفاعل مع المعادن النشطة (الأرض القلوية والقلوية) مع إطلاق الهيدروجين وتكوين الكحولات:
2ROH + 2Na → 2RONa + H2.
الكحولات المعدنية القلوية عبارة عن مواد لها رابطة أيونية بين الأكسجين والصوديوم ؛ في محلول كحول أحادي الهيدرات ، تتفكك لتشكيل أيونات ألكوكسيد:
CH 3 ONa → CH 3 O - + Na + (أيون الميثوكسيد).
يمكن أيضًا تكوين الكحولات عن طريق تفاعل الكحول مع أميد الصوديوم:
C 2 H 5 OH + NaNH 2 → C 2 H 5 ONa + NH 3.
هل سيتفاعل الإيثانول مع القلويات؟ شبه مستحيل. الماء حمض أقوى من كحول الإيثيل ، لذلك يتم تحقيق التوازن هنا. مع زيادة طول الجذر الهيدروكربوني في جزيء الكحول ، تنخفض الخصائص الحمضية. أيضًا ، تتميز الكحولات أحادية الماء المشبعة بانخفاض الحموضة في السلسلة: الابتدائية → الثانوية → الثالثة.
تفاعل الاستبدال النووي
في الكحول ، تكون رابطة C-O مستقطبة ، وتتركز شحنة موجبة جزئية على ذرة الكربون. نتيجة لذلك ، تتعرض ذرة الكربون للهجوم بواسطة جزيئات محبة للنووية. في عملية كسر رابطة C-O ، يحل nucleophile آخر محل مجموعة الهيدروكسيل.
أحد هذه التفاعلات هو تفاعل الكحول مع هاليدات الهيدروجين أو محاليلها المركزة. معادلة التفاعل:
ج 2 H 5 OH + HBr → C 2 H 5 Br + H 2 O.
لتسهيل التخلص من مجموعة الهيدروكسيل ، يتم استخدام حمض الكبريتيك المركز كمحفز. يقوم ببروتون ذرة الأكسجين ، وبالتالي تنشيط جزيء الكحول أحادي الهيدريك.
تدخل الكحولات الأولية ، مثل الهالو ألكانات الأولية ، في تفاعلات متبادلة وفقًا لآلية SN 2. تتفاعل الكحولات أحادية الهيدرات الثانوية ، مثل هالو ألكانات الثانوية ، مع الأحماض المائية. تخضع شروط تفاعل الكحول لطبيعة المكونات المتفاعلة. تفاعل الكحوليات يتبع النمط التالي:
R 3 COH → R 2 CHOH → RCH 2 OH.
أكسدة
في ظل ظروف معتدلة (محاليل محايدة أو قلوية من برمنجنات البوتاسيوم ، خليط الكروم عند درجة حرارة 40-50 درجة مئوية) ، تتأكسد الكحولات الأولية إلى الألدهيدات ، وعند تسخينها إلى درجة حرارة أعلى ، إلى الأحماض. تخضع الكحوليات الثانوية لعملية أكسدة للكيتونات. تتأكسد الطبقات الثلاثية في وجود الحمض في ظل ظروف قاسية جدًا (على سبيل المثال ، بمزيج من الكروم عند درجة حرارة 180 درجة مئوية). يحدث تفاعل الأكسدة للكحولات الثلاثية من خلال تجفيف الكحول مع تكوين ألكين وأكسدة الأخير مع كسر الرابطة المزدوجة.
والتي تحتوي في تركيبتها على مجموعة هيدروكسيل واحدة أو أكثر. اعتمادًا على عدد مجموعات OH ، يتم تقسيمها إلى كحول أحادي الماء ، ثلاثي الهيدروجين ، إلخ. في أغلب الأحيان ، تعتبر هذه المواد المعقدة من مشتقات الهيدروكربونات ، والتي خضعت جزيئاتها لتغييرات بسبب. تم استبدال ذرة هيدروجين واحدة أو أكثر بمجموعة هيدروكسيل.
أبسط ممثلي هذه الفئة هم الكحولات أحادية الماء ، والتي تبدو الصيغة العامة لها كما يلي: R-OH أو

Cn + H 2n + 1OH.
- الكحولات التي تحتوي على ما يصل إلى 15 ذرة كربون عبارة عن سوائل ، 15 أو أكثر من المواد الصلبة.
- تعتمد القابلية للذوبان في الماء على الوزن الجزيئي ، فكلما زاد ، كلما كان الكحول يذوب في الماء أسوأ. وبالتالي ، فإن الكحوليات المنخفضة (حتى البروبانول) قابلة للامتزاج بالماء بأي نسب ، بينما الكحوليات الأعلى منها غير قابلة للذوبان عمليًا.
- تزداد نقطة الغليان أيضًا مع زيادة الكتلة الذرية ، على سبيل المثال ، t kip. CH3OH = 65 درجة مئوية ، و t bp. С2Н5ОН = 78 درجة مئوية.
- كلما زادت نقطة الغليان ، انخفض التقلب ، أي لا تتبخر المادة جيدًا.
يمكن تفسير هذه الخصائص الفيزيائية للكحولات المشبعة بمجموعة هيدروكسيل واحدة من خلال حدوث رابطة هيدروجينية بين الجزيئات بين الجزيئات الفردية للمركب نفسه أو الكحول والماء.
الكحولات أحادية الماء قادرة على الدخول في مثل هذه التفاعلات الكيميائية:

بعد النظر في الخصائص الكيميائية للكحول ، يمكننا أن نستنتج أن الكحولات أحادية الماء هي مركبات مذبذبة ، لأن. يمكن أن تتفاعل مع الفلزات القلوية ، وتظهر خصائص ضعيفة ، ومع هاليدات الهيدروجين ، وتظهر الخصائص الأساسية. تتضمن جميع التفاعلات الكيميائية كسر رابطة O-H أو C-O.
وبالتالي ، فإن الكحولات أحادية الماء المشبعة عبارة عن مركبات معقدة تحتوي على مجموعة OH واحدة لا تحتوي على تكافؤات حرة بعد تكوين رابطة C-C وتظهر خصائص ضعيفة لكل من الأحماض والقواعد. نظرًا لخصائصها الفيزيائية والكيميائية ، فهي تستخدم على نطاق واسع في التخليق العضوي ، وإنتاج المذيبات ، ومضافات الوقود ، وكذلك في صناعة الأغذية ، والطب ، ومستحضرات التجميل (الإيثانول).