مقدمة
بحلول ستينيات القرن الماضي ، جمعت الكيمياء العضوية كمية هائلة من المواد الواقعية التي تتطلب تفسيرًا. على خلفية التراكم المستمر للحقائق التجريبية ، كان عدم كفاية المفاهيم النظرية للكيمياء العضوية حادًا بشكل خاص. النظرية تخلفت عن الممارسة والتجربة. وقد انعكس هذا التأخر بشكل مؤلم في مسار البحث التجريبي في المختبرات. أجرى الكيميائيون أبحاثهم بشكل عشوائي إلى حد كبير ، وبشكل أعمى ، وغالبًا دون فهم طبيعة المواد التي يصنعونها وجوهر التفاعلات التي أدت إلى تكوينها. على سبيل المثال ، لم يكن لدى الإنجليزي في. إلى جانب ذلك ، لم يكلف نفسه على الإطلاق بمهمة تصنيع الصبغة ، لكنه حاول الحصول على الكينين. الكيمياء العضوية ، في تعبير Wöhler المناسب ، تشبه غابة كثيفة مليئة بالأشياء الرائعة ، غابة ضخمة بلا مخرج ، بلا نهاية.
تتطلب المشاكل الملحة للكيمياء العضوية حل السؤال الأساسي: هل الجزيئات عبارة عن كومة عشوائية من الذرات مرتبطة ببعضها البعض بواسطة قوى جذابة ، أو جزيئات جزيئات ذات بنية معينة يمكن إنشاؤها من خلال فحص خصائص المادة. رفضت نظرية الأنواع التي وضعها جيرارد ، والتي اعترف بها معظم الكيميائيين في ذلك الوقت مع بعض التحفظات ، حل مشكلة بنية الجزيئات بناءً على دراسة الخصائص الكيميائية. وفي الوقت نفسه ، في الكيمياء العضوية ، كانت الحقائق والتعميمات قد تراكمت بالفعل بحلول ذلك الوقت ، والتي يمكن أن تكون بمثابة أساس لحل هذه المشكلة. وهكذا ، على سبيل المثال ، أعطت نظرية الجذور الكيمياء العضوية تعميمًا بالغ الأهمية ، والذي يتكون من حقيقة أنه أثناء التفاعلات الكيميائية تمر مجموعات معينة من الذرات دون تغيير من جزيئات المواد الأولية إلى الجزيئات التي تشكلت في هذه التفاعلات. من جانبها ، ساهمت نظرية الأنواع بشكل كبير في دراسة الأجزاء الأكثر تنوعًا من الجزيئات وأسباب هذا التباين.
الفصل 1
1.1. اكتشاف تكافؤ العناصر
من خلال التحقيق في تكوين المركبات العضوية المعدنية ، وجد فرانكلاند (1853) أن كل معدن يعطي مركبات بعدد محدد بدقة من الجذور ؛ هذا الرقم هو تكافؤ المعدن. فيما يلي أبسط المركبات العضوية المعدنية من فلز واحد ، وثاني ، وثلاثة ، ورباعي التكافؤ:
بعد اكتشاف فرانكلاند ، أصبح من الواضح أن الذرات يمكن أن تتحد في جزيئات فقط في العلاقات التي تحددها تكافؤ الذرات. على وجه الخصوص ، وجد أن الكربون رباعي التكافؤ (Kekule ، Kolbe).
أدى اكتشاف التكافؤ مباشرة إلى فكرة أن الجزيئات لها بنية محددة. ومع ذلك ، ظلت الأسئلة حول طرق تحديد بنية الجزيئات ، وكذلك اعتماد خصائص مادة ما على بنية جزيئاتها ، مفتوحة.
جاء عصر جديد في الكيمياء العضوية مع ظهور نظرية التركيب الكيميائي. يعود الدور الرئيسي في إنشاء نظرية الهيكل وإثباتها وتأكيدها إلى العالم الروسي الشهير ألكسندر ميخائيلوفيتش بتليروفعلى الرغم من أنه بجانبه ، بدأ تطوير عناصر من هذه النظرية بواسطة A. Cooper (1831-1892) في إنجلترا و A. Kekule (1829-1896) في ألمانيا.
1.2. ألف تطورات كوبر
في عام 1858 ، نشر كوبر في ثلاث لغات (الإنجليزية والفرنسية والألمانية) مقالاً بعنوان "في نظرية كيميائية جديدة" ، حيث يرفض نظرية الأنواع ويعبر عن وجهة النظر التي بموجبها يمكن لجميع خصائص المواد العضوية يجب شرح ذلك إذا تم أخذ خاصيتين فقط من الذرات في الاعتبار: "التقارب الانتقائي" (ارتباط الذرات) و "درجة التقارب" (تكافؤ الذرات).
كتب كوبر: "من وجهة نظري ، هاتان الخاصيتان كافيتان لشرح كل ما يميز الكيمياء العضوية: هذا ما سأثبته أدناه ... في جزيء يتكون من ثلاث ، أربع ، خمس ذرات كربون ، إلخ. وكميات مكافئة من الهيدروجين والأكسجين وما إلى ذلك ، يمكن استبدال الأخير بعناصر أخرى ، بينما يشكل الكربون عقدة متصلة بشكل متبادل. هذا يعني انه كربون واحد مرتبط بكربون آخر. تعطي هذه الخاصية الكربون ، إذا جاز التعبير ، ملامح غريبة وتجعل من الممكن فهم الحقيقة غير المفهومة سابقًا المتمثلة في طبقات ذرات الكربون في المركبات العضوية.
بعد أن توصل كوبر إلى فكرة مهمة حول سلسلة ذرات الكربون ، أعرب أيضًا عن آرائه في الصيغ التي ، وفقًا لخطته ، يجب أن تعطي صورة عن بنية المركبات. وكمثال على معادلاته التي كانت أولى الصيغ الدستورية ، يمكن إعطاء ما يلي:

يمكن أن نرى من هذه الأمثلة أن كوبر كان قادرًا على نقل تكوين هذه المركبات بشكل مثير للدهشة ، بالإضافة إلى بعض أكثرها تعقيدًا والتي لم تتم دراستها في ذلك الوقت (أحماض الطرطريك والطرطريك).
ومع ذلك ، فقد حُرمت كل هذه الصيغ من الإثبات التجريبي. لم تثر كوبر مطلقًا مسألة إمكانية التحقق التجريبي منها. استندت صيغه ، كما يسهل رؤيتها ، إلى تفسير رسمي لمفاهيم التكافؤ وترابط الذرات ، وجزئيًا حتى على الحدس. بطبيعة الحال ، مع هذا النهج من المستحيل تجنب الأخطاء. لذلك ، على سبيل المثال ، صيغ الجلسرين وحمض الجليسريك وحمض الأكساليك التي قدمتها شركة Cooper غير صحيحة بالفعل:

وهكذا ، فإن آراء كوبر ، التي طورها في عمله الموهوب والمثير للاهتمام ، لا تتسم بطابع النظرية الصارمة.
1.3. الصيغ الدستورية في Loschmidt
آخر تم إجراء محاولة لتصوير المركبات العضوية مع الصيغ الدستورية في عام 1861 بواسطة Loschmidt . عند بناء معادلاته ، اعتبر لوسشميت الذرات أصغر جزيئات مادية تخضع لتأثير قوى الجذب والتنافر. تتوازن هذه القوى عندما تقترب الذرات من بعضها البعض ، وتبقى الذرات المختلفة بالقرب من بعضها البعض في وضع توازن معين. يشير Loschmidt بشكل تعسفي إلى مجالات عمل القوى الذرية ذات الدوائر (على سبيل المثال ، ذرات الكربون والهيدروجين - دوائر بسيطة ، أكسجين - مزدوج ، نيتروجين - ثلاثي).
كان لصيغ Loschmidt الشكل التالي:

دون محاولة تكوين أي فكرة عن الطريقة التي تترابط بها ذرات الكربون الست في جزيء البنزين ، أشار Loschmidt إلى البنزين بالرمز

على عكس Cooper ، عند اختيار الصيغ ، كان Loschmidt ، بالإضافة إلى التكافؤ ("التلوث" في تعبيره) ، يسترشد أحيانًا بالخصائص الكيميائية. ومع ذلك ، بشكل عام ، كانت طريقة اشتقاق صيغ Loschmidt مجردة ، وغالبًا ما كانت ببساطة غير معقولة. لذلك ، دون الاعتماد على البيانات الكيميائية ، حاول Loschmidt استنباط صيغ لمواد معقدة مثل النيلي وحمض البوليك ، إلخ.
وبطبيعة الحال ، تبين أن هذه الصيغ خاطئة. على الرغم من حقيقة أن العديد من صيغ المركبات العضوية التي اقترحها Loschmidt قد أثبتت نجاحها ، إلا أن عمله ظل دون أن يلاحظه أحد تقريبًا من قبل الكيميائيين في ذلك الوقت ولم يكن له أي تأثير كبير على تطوير نظرية الكيمياء العضوية.
1.4. المساهمة في إنشاء النظرية البنيوية كيكولي
قدم الكيميائي الألماني الشهير مساهمة كبيرة في إنشاء النظرية البنيوية كيكولي. لقد أسس رباعي الكربون ، وقدم نوع الميثان ، واقترح الصيغة المعروفة للبنزين ، والأهم من ذلك ، صاغ بشكل صحيح إحدى المشكلات الرئيسية للكيمياء العضوية في ذلك الوقت.
في مقال بعنوان "حول تكوين وتحولات المركبات الكيميائية وعن الطبيعة الكيميائية للكربون" في عام 1858 ، كتب كيكولي: "أعتقد أن المهمة الرئيسية للكيمياء في الوقت الحالي ليست اكتشاف المجموعات الذرية ، والتي ، نظرًا لبعض خصائصها ، يمكن اعتبارها جذورًا ، وتخصيص المركبات لأنواع معينة ، والتي لا تكاد تحمل أي معنى آخر من كعينة من الصيغ. على العكس من ذلك ، أعتقد أنه من الضروري توسيع التفكير إلى بنية الراديكاليين أنفسهم ؛ من طبيعة العناصر ، يجب استنتاج طبيعة الراديكاليين ومركباتهم. نقطة البداية لهذا ، اعتبر كيكول "أساس العنصر" (التكافؤ) ، وفيما يتعلق بالمركبات العضوية ، أولاً وقبل كل شيء ، طبيعة الكربون. أعرب كيكول أيضًا عن عدد من الأفكار الصحيحة الأخرى حول ارتباط الذرات ، معبرًا عنها في صيغ رسومية. ومع ذلك ، لم يعلق Kekule أهمية على صيغ البنية على صيغه ، فقد سعى للتعبير عن التفاعل معها فقط. لذلك كتب: "تهدف الصيغ العقلانية إلى إعطاء فكرة محددة عن الطبيعة الكيميائية للمركب ، وبالتالي ، عن تحولاته والعلاقة بينه وبين الأجسام الأخرى ... يجب أن يؤخذ في الاعتبار أن الصيغ العقلانية - هذه ليست سوى صيغ للتحولات ، وليست صيغًا دستورية ، وأنها ليست سوى وسيلة للتعبير عن تحولات الأجسام ونتائج مقارنة المواد المختلفة مع بعضها البعض ؛ أنه لا ينبغي بأي حال من الأحوال التعبير عن الدستور ، أي ترتيب الذرات في المركب المقابل.
إن إنشاء البنية الحقيقية للجزيئات يعتبر Kekule أيضًا مهمة الكيمياء ، ولكن ، في رأيه ، لا يمكن تحقيق ذلك من خلال دراسة التحولات الكيميائية ، ولكن فقط من خلال دراسة مقارنة للخصائص الفيزيائية للمركبات. وهكذا ، في هذه المسألة أيضًا ، وقف كيكولي على موقف جيرار.
مثل المنظرون الآخرون ، صور كيكولي المادة بعدة صيغ نموذجية. لذلك ، على سبيل المثال ، من أجل نقل الخصائص الكيميائية المعروفة آنذاك لحمض الأسيتيك ، اقترح Kekule تمثيله بثماني صيغ. وهكذا ، على الرغم من أن وجهات نظر Kekule كانت قريبة من وجهات النظر الهيكلية الجديدة ، على الرغم من أن Kekule قدم مساهمة كبيرة في تطوير نظرية التركيب الكيميائي ، إلا أنه لم يستطع تحرير نفسه تمامًا من أفكار نظرية النوع.
الفصل 2. نظرية التركيب الكيميائي ل A.M. Butlerov
2.1. أفكار بتليروف
عارض أ. م. بتليروف موقف نظرية الأنواع حول استحالة إنشاء بنية الجزيئات بالوسائل الكيميائية. أظهر ذلك يوجد في الجزيء تسلسل معين من الترابط الكيميائي للذرات (التركيب الكيميائي). كما أثبت بتليروف ذلك يمكن تحديد بنية الجزيء عن طريق فحص الخصائص الكيميائية للمادة ، وعلى العكس من معرفة التركيب ، يمكن توقع العديد من خصائص المركب.لم يثبت بتليروف هذا الموقف فقط بالمواد الواقعية المتاحة بالفعل ، ولكنه توقع أيضًا على أساسها إمكانية وجود مواد جديدة ، اكتشفها لاحقًا هو وكيميائيون آخرون.
صاغ الفكرة الرئيسية لنظرية A.M. Butlerov من قبله في عام 1861 في مقال "حول التركيب الكيميائي للمواد".كتب: "انطلاقا من فكرة أن كل ذرة كيميائية هي جزء من الجسم تشارك في تكوين هذا الأخير وتعمل هنا بكمية معينة من القوة الكيميائية (التقارب) التي تنتمي إليها ، أسمي التركيب الكيميائي التوزيع من تأثير هذه القوة ، والتي بسببها تتحد الذرات الكيميائية ، التي تؤثر بشكل غير مباشر أو مباشر على بعضها البعض ، في جسيم كيميائي.
أساس نظرية بتليروف هو فكرة ترتيب التفاعل الكيميائي للذرات في الجزيء . لا يتضمن هذا الترتيب للتفاعل الكيميائي أفكارًا حول آلية الترابط الكيميائي والترتيب الفيزيائي للذرات. هذه الميزة المهمة لنظرية التركيب الكيميائي تجعل من الممكن الاعتماد عليها دائمًا عند بناء نموذج فيزيائي للجزيء.
بعد أن أسس مفهوم التركيب الكيميائي ، قدم A.M. Butlerov تعريفًا جديدًا طبيعة المادة : « يتم تحديد الطبيعة الكيميائية للجسيم المعقد من خلال طبيعة المكونات الأولية وكميتها وتركيبها الكيميائي ».
وهكذا ، كان أ م بتليروف أول من أثبت ذلك كل جزيء له بنية كيميائية معينة ، أن الهيكل يحدد خصائص المادة وأنه من خلال دراسة التحولات الكيميائية للمادة ، يمكن للمرء أن يؤسس هيكلها .
2.2. الصيغ التركيبية الكيميائية
تنبع آراء أ. إم بتليروف حول أهمية الصيغ التركيبية الكيميائية من الأحكام الرئيسية لنظريته. اعتقد بتليروف أن هذه الصيغ لا ينبغي أن تكون "نموذجية" و "رجعية" ، بل دستورية. بهذا المعنى ، لكل مادة ، هناك صيغة منطقية واحدة فقط ممكنة ، على أساسها يمكن للمرء أن يحكم على الخصائص الكيميائية.
أما بالنسبة لطريقة كتابة الصيغ البنيوية ، فقد اعتبر بتلروف بحق هذه المسألة ذات الأهمية الثانوية: "تذكر أن النقطة ليست في الشكل ، بل في الجوهر ، في المفهوم ، في الفكرة ، مع الأخذ في الاعتبار أن الصيغ التي تدل على التماثل ، من الضروري منطقيًا التعبير عن الجسيم الحالي ، أي بعض العلاقات الكيميائية الموجودة فيه ، ليس من الصعب الوصول إلى استنتاج مفاده أن أي طريقة للكتابة يمكن أن تكون جيدة ، إذا كانت تعبر بشكل ملائم عن هذه العلاقات. من الطبيعي تمامًا حتى استخدام طرق مختلفة ، مع تفضيل الطريقة الأكثر تعبيرًا عن حالة معينة. على سبيل المثال ، يمكن تصوير الإيثان C2H6 بشكل غير مبالٍ تقريبًا:
ومع ذلك ، مع الفهم غير المحدد بشكل كافٍ ، يمكن أن تؤدي طريقة مختلفة في الكتابة إلى الحيرة.
2.3 قيمة نظرية التركيب الكيميائي ودورها
مع ظهور نظرية التركيب الكيميائي ، ظهرت الكيمياء العضوية من متاهة الصيغ النموذجية ؛ تم عرض مسارات لمعرفة التركيب الداخلي للجزيئات ؛ ظهر الأساس النظري لفهم العمليات الكيميائية ، للتنبؤ بطرق جديدة لتركيب المركبات العضوية. منذ لحظة نشأتها ، أتاحت نظرية التركيب الكيميائي للكيميائيين إجراء بحث تجريبي بطريقة موجهة وهادفة.
كان النجاح الملحوظ في نظرية التركيب الكيميائي هو تفسير ظاهرة التزاوج ، التي اكتُشفت في الربع الأول من القرن الماضي.
كما تعلمون ، في نهاية القرن الثامن عشر ، تم وضع قانون ثبات التركيب ، والذي بموجبه يكون لكل مادة تكوين محدد وثابت. لعدة عقود ، تم إعطاء هذا القانون أيضًا المعنى المعاكس ، أي أنه كان يُعتقد أن مادة واحدة محددة لها تركيبة محددة معينة. ظهر عدم صحة الموقف الأخير نتيجة دراسة عدد من المواد العضوية. في عام 1823 ، وجد Liebig ، بعد أن درس الملح الفضي لحمض الفلمنيك ، أن تركيبه (AgCNO) مطابق لتكوين أيزوسيانات الفضة الذي حصل عليه Wöhler في عام 1822 ، والذي يختلف اختلافًا حادًا عنه.
هذه الحقيقة الرائعة لم تبقى معزولة لفترة طويلة. سرعان ما تم اكتشاف العديد من المواد الأخرى بنفس التركيب ولكن بخصائص مختلفة. منذ عام 1830 ، بدأت تسمى الظاهرة المكتشفة بالتشابه (من اليونانية - تتكون من أجزاء متطابقة) ، والمواد التي لها نفس التركيب - أيزومرات. كانت محاولات تفسير التماكب بنظرية الراديكاليين ونظرية الأنواع أحادية الجانب (مثل هذه النظريات نفسها) ، وبالتالي لم تعط نتائج مرضية. في الواقع ، لما يقرب من أربعة عقود ، لم تجد ظاهرة التماثل التماثل تفسيراً نظرياً.
أصبح مثل هذا التفسير ممكنًا فقط بعد إنشاء نظرية التركيب الكيميائي ، والتي بموجبها يتم تحديد طبيعة المادة ليس فقط من خلال طبيعة وعدد الذرات التي يتكون منها الجزيء ، ولكن أيضًا من خلال هيكلها ، التركيب الكيميائي. من هذا ، وبوضوح لا شك فيه ، يتبع احتمال وجود مواد لها نفس التركيب والوزن الجزيئي ، ومع ذلك ، فهي مختلفة تمامًا بسبب التركيب الكيميائي غير المتكافئ. وهكذا ، كان الاختلاف في التركيب الكيميائي تفسيرًا طبيعيًا وبسيطًا لظاهرة التماكب.
2.4 اكتشاف بتليروف لظاهرة التماكب الديناميكي
تجدر الإشارة إلى أن اكتشف A.M.Butlerov وشرح لأول مرة ظاهرة التزاوج الديناميكي , تتكون من حقيقة أن اثنين أو أكثر من الأيزومرات في ظل ظروف معينة تنتقل بسهولة إلى بعضها البعض (تسمى هذه الظاهرة حاليًا باسم tautomerism).كانت مشكلة التزاوج ككل اختبارًا جادًا لنظرية بتلر وتم حلها ببراعة من خلالها.
من السمات المهمة لتعاليم A.M. Butlerov أنه لم يعتبر الجزيء بأي حال من الأحوال نوعًا من التكوين غير المتحرك الذي ترتبط فيه الذرات الفردية ببنية ميتة وبلا حياة. . في هذا الموضوع كتب:
"... في الوقت الحاضر ننظر إلى مركب كيميائي ليس كشيء ميت ولا يتحرك ؛ نحن نقبل ، على العكس من ذلك ، أنه يتمتع بحركة ثابتة متضمنة في أصغر جزيئاته ، والتي تخضع علاقاتها المتبادلة الخاصة لتغييرات مستمرة ، تلخيصًا في هذه الحالة في نتيجة متوسطة ثابتة معينة. يمكن أن يكون لدينا هنا أيضًا تغيرات ثابتة في الجسيمات الكيميائية التي تشكل كتلة المواد ، لكن كل هذا ينخفض إلى حالة متوسطة معينة للكتلة نفسها. باختصار ، بشكل عام ، أمامنا دائمًا حالة توازن متنقل معين. من وجهة النظر الديناميكية هذه حول طبيعة المركب الكيميائي والتفاعلات الكيميائية ، نشرح بوضوح هذه الظواهر التي ، من وجهة النظر السابقة ، كانت غير مفهومة تمامًا. يجدر الإشارة ، على سبيل المثال ، إلى الانفصال ، ومدى سهولة تفسير ردود الفعل الخلفية ، وما إلى ذلك. "
2.5 دفاع بتليروف عن أولوياته. دور دي مندليف
إن الأحكام الواضحة التي لا يمكن دحضها لنظرية التركيب الكيميائي التي صاغها أ. إم بتليروف في وقت قصير ضمنت الاعتراف العالمي بها. ومع ذلك ، في الوقت نفسه ، كان هناك ميل لإسكات مزايا A.M. Butlerov وتقديم Kekule و Cooper فقط كمبدعين لنظرية الهيكل.
بعد سنوات قليلة من إنشاء نظرية الهيكل ، كان على A.M.Butlerov أن يدافع عن أولويته ، لأن بعض الكيميائيين الأجانب ، الذين لم يعترفوا في البداية ولم يفهموا نظريته ، حاولوا لاحقًا أن ينسبوا شرف إنشاء الأحكام الرئيسية من هذه النظرية لأنفسهم.
تم التأكيد بوضوح على الدور الحاسم لـ A.M.Butlerov في إنشاء نظرية التركيب الكيميائي في عام 1868 من قبل العالم الروسي العظيم D. , توصية A. M. Butlerov لجامعة سانت بطرسبرغ. كتب منديليف أن بتلروف "... يسعى مجددًا ، من خلال دراسة التحولات الكيميائية ، إلى اختراق أعماق الروابط التي تربط العناصر غير المتجانسة معًا ، ويمنح كل منها قدرة فطرية للدخول في عدد معروف من المركبات ، ويصف الاختلاف في الخصائص إلى طريقة مختلفة لربط العناصر. لم يتابع أحد هذه الأفكار باستمرار كما فعل ، على الرغم من أنهم بحثوا في وقت سابق ... لتنفيذ نفس الطريقة في البحث في جميع فئات المركبات العضوية ، نشر بتلروف في عام 1864 كتابًا: "مقدمة إلى الدراسة الكاملة للكيمياء العضوية "، الذي ترجمه بتليروف إلى الألمانية العام الماضي ، بفضل قراءاته وانبهاره بالأفكار ، أسس حوله في قازان مدرسة كيميائيين يعملون في اتجاهه. تمكنت أسماء ماركوفنيكوف ومياسنيكوف وبوبوف واثنين من زايتسيف ومورجونوف وبعض الآخرين من اكتساب شهرة للعديد من الاكتشافات التي تم إجراؤها أساسًا بسبب استقلال حركة بتليروز. يمكنني أن أشهد شخصيًا أن علماء فرنسيين وألمانًا مثل Wurtz و Kolbe يعتبرون Butlerov واحدًا من أكثر العوامل المؤثرة في الاتجاه النظري في الكيمياء في عصرنا.
يعتقد A.M.Butlerov بحق أن نظرية التركيب الكيميائي سوف تتطور مع تراكم مادة واقعية جديدة. كتب: "... لا يسعني إلا أن ألاحظ أن الاستنتاجات التي يؤدي إليها مبدأ التركيب الكيميائي تبين أنها في آلاف الحالات تتفق مع الحقائق. كما هو الحال في أي نظرية ، وهنا ، بالطبع ، هناك أوجه قصور وعيوب - هناك حقائق لا تتوافق بشكل صارم مع مفهوم التركيب الكيميائي. بالطبع ، يجب على المرء أن يرغب بشكل خاص في إعادة إنتاج مثل هذه الحقائق ؛ الحقائق التي لا تفسرها النظريات الحالية هي الأكثر تكلفة للعلم ، ومن تطورها يجب أن يتوقع المرء تطورها في المستقبل القريب.
استنتاج
تم إنشاء نظرية التركيب الكيميائي بواسطة A.M. Butlerov في منتصف القرن التاسع عشر ، في وقت كانت العلاقات الاجتماعية والاقتصادية البرجوازية الجديدة تنمو في روسيا وأدى نمو القوى المنتجة إلى التطور القوي للعلوم الطبيعية. خلال هذه الفترة ، أنشأ I.M. Sechenov ثم I.P. Pavlov عقيدة مادية للنشاط العصبي العالي للإنسان والحيوان ، K A. قانون الطبيعة - القانون الدوري ، الذي عمم جميع المعارف المتعلقة بالعناصر الكيميائية التي كانت متاحة في ذلك الوقت. يفتح N.I Lobachevsky مجالًا جديدًا للرياضيات.
خلقت نظرية التركيب الكيميائي إمكانية التنظيم العلمي للمادة الواقعية للكيمياء العضوية ، وشرحت أهم انتظاماتها ، وقدمت مفتاحًا للتنبؤ بحقائق جديدة. كان الأساس العلمي لإنشاء الكيمياء العضوية الحديثة. شكلت أساس المفاهيم النظرية الحديثة للكيمياء العضوية. اليوم ، يمكن التعبير عن جوهر هذه النظرية على النحو التالي: يتم تحديد الخواص الفيزيائية والكيميائية للمركبات العضوية من خلال تكوين جزيئاتها ، وكذلك من خلال التركيب الكيميائي والمكاني والإلكتروني.
فهرس
1. أ. Artemenko "الكيمياء العضوية": كتاب مدرسي للبناء. متخصص. الجامعات. - الطبعة الرابعة ، المنقحة. وإضافية - م: المدرسة العليا. 2000. - 559 ص: مريض.
2. أ. Chichibabin "الكيمياء العضوية": كتاب مدرسي للجامعات. - ت. 1-2. إد. 3 ، ISP. وإضافية 1963. - 910 ص.
نوع الهيدروجين:
هذه الصيغ تشبه إلى حد ما الصيغ الحديثة. لكن مؤيدي نظرية الأنواع لم يروا أنها تعكس البنية الحقيقية للمواد وكتبوا العديد من الصيغ المختلفة لمركب واحد ، اعتمادًا على التفاعلات الكيميائية التي حاولوا كتابتها باستخدام هذه الصيغ. لقد اعتبروا أن بنية الجزيئات غير معروفة بشكل أساسي ، مما أضر بتطور العلم.
3. مقدمة من قبل J. Berzelius في عام 1830 لمصطلح "isomerism" لظاهرة وجود مواد من نفس التركيب مع خصائص مختلفة.
4 - النجاحات التي تحققت في تركيب المركبات العضوية ، والتي أدت إلى تبديد مبدأ الحيوية ، أي "قوة الحياة" ، التي يُزعم أن المواد العضوية تتشكل تحت تأثيرها في جسم الكائنات الحية:
في عام 1828 ، قام F. Wehler بتصنيع اليوريا من مادة غير عضوية (سيانات الأمونيوم) ؛
في عام 1842 ، تلقى الكيميائي الروسي ن. ن. زينين الأنيلين.
في عام 1845 ، صنع الكيميائي الألماني أ. كولب حمض الأسيتيك.
في عام 1854 ، قام الكيميائي الفرنسي م.
في عام 1861 ، قام A.M. Butlerov بنفسه بتصنيع مادة شبيهة بالسكر.
5. في منتصف القرن الثامن عشر. تصبح الكيمياء علمًا أكثر صرامة. نتيجة لعمل E.Frankland و A. Kekule ، تم تأسيس مفهوم تكافؤ ذرات العناصر الكيميائية. طور Kekule مفهوم رباعي الكربون. بفضل أعمال كانيزارو ، أصبحت مفاهيم الكتل الذرية والجزيئية أكثر وضوحًا ، وتم تنقيح معانيها وطرق تحديدها.
في عام 1860 ، اجتمع أكثر من 140 كيميائيًا رائدًا من دول أوروبية مختلفة لحضور مؤتمر دولي في كارلسروه. أصبح المؤتمر حدثًا مهمًا للغاية في تاريخ الكيمياء: تم تلخيص نجاحات العلم وتم إعداد الظروف لمرحلة جديدة في تطور الكيمياء العضوية - ظهور نظرية التركيب الكيميائي للمواد العضوية بواسطة A.M. Butlerov ( 1861) ، وكذلك للاكتشاف الأساسي لـ D.I Mendeleev - القانون الدوري ونظام العناصر الكيميائية (1869).
في عام 1861 ، تحدث أ. إم بتليروف في مؤتمر الأطباء وعلماء الطبيعة في مدينة شباير بتقرير "عن التركيب الكيميائي للأجسام". في ذلك ، أوجز أسس نظريته عن التركيب الكيميائي للمركبات العضوية. في ظل التركيب الكيميائي ، فهم العالم ترتيب ارتباط الذرات في الجزيئات.
الصفات الشخصية لـ A.M Butlerov
تميز A.M. Butlerov بالطبيعة الموسوعية للمعرفة الكيميائية ، والقدرة على تحليل الحقائق وتعميمها ، والتنبؤ. تنبأ بوجود أيزومر من البيوتان ، ثم حصل عليه ، وكذلك أيزومر البيوتيلين - أيزوبيوتيلين.
بتليروف ألكسندر ميخائيلوفيتش (1828-1886)
كيميائي روسي ، أكاديمي في أكاديمية سانت بطرسبرغ للعلوم (منذ عام 1874). تخرج من جامعة قازان (1849). كان يعمل هناك (منذ 1857 - أستاذ ، في 1860 و 1863 - رئيس الجامعة). مبتكر نظرية التركيب الكيميائي للمركبات العضوية التي تقوم عليها الكيمياء الحديثة. إثبات فكرة التأثير المتبادل للذرات في الجزيء. تنبأ وشرح تماثل العديد من المركبات العضوية. كتب "مقدمة إلى الدراسة الكاملة للكيمياء العضوية" (1864) - أول دليل في تاريخ العلوم يعتمد على نظرية التركيب الكيميائي. رئيس قسم الكيمياء بالجمعية الفيزيائية والكيميائية الروسية (1878-1882).
أنشأ A.M. Butlerov المدرسة الأولى للكيميائيين العضويين في روسيا ، والتي انبثقت منها علماء لامعون: في.
لا عجب أن كتب D.I Mendeleev: "أ. يُعد M. Butlerov أحد أعظم العلماء الروس ، فهو روسي من حيث تعليمه العلمي وأصالة أعماله ".
الأحكام الرئيسية لنظرية تركيب المركبات الكيميائية
تم تأكيد نظرية التركيب الكيميائي للمركبات العضوية ، التي طرحها A.M. Butlerov في النصف الثاني من القرن الماضي (1861) ، من خلال عمل العديد من العلماء ، بما في ذلك طلاب Butlerov ونفسه. اتضح أنه من الممكن على أساسها شرح العديد من الظواهر التي لم يكن لها تفسير حتى ذلك الحين: التماثل ، والتماثل ، ومظهر من مظاهر رباعي التكافؤ بواسطة ذرات الكربون في المواد العضوية. حققت النظرية أيضًا وظيفتها النذير: على أساسها ، توقع العلماء وجود مركبات لا تزال غير معروفة ووصف الخصائص واكتشفها.
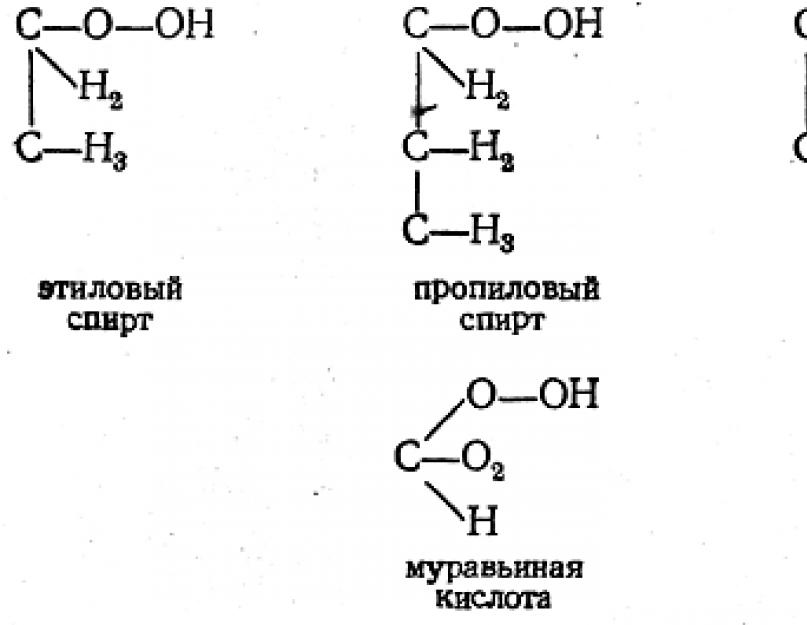
لذلك ، في 1862-1864. نظر A.M. Butlerov في تماثل كحول البروبيل ، والبيوتيل ، والأميل ، وحدد عدد الأيزومرات الممكنة واشتق الصيغ من هذه المواد. تم إثبات وجودها تجريبيًا في وقت لاحق ، وتم تصنيع بعض الأيزومرات بواسطة Butlerov نفسه.
خلال القرن العشرين. تم تطوير أحكام نظرية التركيب الكيميائي للمركبات الكيميائية على أساس الآراء الجديدة التي انتشرت في العلم: نظرية بنية الذرة ، نظرية الترابط الكيميائي ، أفكار حول آليات التفاعلات الكيميائية. في الوقت الحاضر ، هذه النظرية لها طابع عالمي ، أي أنها صالحة ليس فقط للمواد العضوية ، ولكن أيضًا للمواد غير العضوية.
المركز الأول. ترتبط الذرات في الجزيئات بترتيب معين وفقًا لتكافؤها. الكربون في جميع المركبات العضوية وغير العضوية رباعي التكافؤ.
من الواضح أن الجزء الأخير من الحكم الأول للنظرية يمكن تفسيره بسهولة من خلال حقيقة أن ذرات الكربون في المركبات في حالة الإثارة: 
أ) يمكن أن تتحد ذرات الكربون الرباعية التكافؤ مع بعضها البعض ، وتشكل سلاسل مختلفة:
متفرعة مفتوحة
- فتح غير ممنوح
- مغلق
ب) يمكن أن يكون ترتيب اتصال ذرات الكربون في الجزيئات مختلفًا ويعتمد على نوع الرابطة الكيميائية التساهمية بين ذرات الكربون - مفردة أو متعددة (مزدوجة وثلاثية).
المركز الثاني.لا تعتمد خصائص المواد على تركيبها النوعي والكمي فحسب ، بل تعتمد أيضًا على بنية جزيئاتها.
هذا الموقف يفسر ظاهرة الايزومرية. المواد التي لها نفس التركيب ، ولكن لها بنية كيميائية أو مكانية مختلفة ، وبالتالي خصائص مختلفة ، تسمى أيزومرات. الأنواع الرئيسية للتشابه:
التماثل البنيوي ، حيث تختلف المواد في ترتيب ارتباط الذرات في الجزيئات:
1) تماثل الهيكل الكربوني 
3) تماثل متماثل (interlass) 
التزاوج المكاني ، حيث تختلف جزيئات المواد ليس في ترتيب ارتباط الذرات ، ولكن في موقعها في الفضاء: cis-trans-isomerism (هندسي).
يعتبر هذا التشابه نموذجيًا للمواد التي تحتوي جزيئاتها على بنية مستوية: الألكينات ، والألكانات الحلقية ، وما إلى ذلك.
ينتمي التماثل البصري (المرآة) أيضًا إلى التماثل المكاني.
الروابط الأربعة الفردية حول ذرة الكربون ، كما تعلم بالفعل ، مرتبة بشكل رباعي السطوح. إذا تم ربط ذرة كربون بأربع ذرات أو مجموعات مختلفة ، فإن ترتيبًا مختلفًا لهذه المجموعات في الفضاء يكون ممكنًا ، أي شكلين متشابهين مكانيين.
يظهر شكلين مرآتين من ألانين الأحماض الأمينية (حمض 2-أمينوبروبانويك) في الشكل 17.
تخيل أن جزيء ألانين يوضع أمام مرآة. المجموعة -NH2 أقرب إلى المرآة ، لذلك ستكون في المقدمة في الانعكاس ، وستكون المجموعة -COOH في الخلفية ، وما إلى ذلك (انظر الصورة على اليمين). توجد ألانيا في شكلين مكانيين ، عندما يتم فرضهما ، لا يتحدان مع بعضهما البعض.
تؤكد عالمية الموقف الثاني لنظرية بنية المركبات الكيميائية وجود أيزومرات غير عضوية.
لذلك ، فإن أول توليفات المواد العضوية - تخليق اليوريا ، الذي أجراه Wehler (1828) ، أظهر أن مادة غير عضوية - سيانات الأمونيوم ومادة عضوية - اليوريا متزامنة: 
إذا استبدلت ذرة الأكسجين في اليوريا بذرة كبريت ، فستحصل على ثيوريا ، وهو متماثل إلى ثيوسيانات الأمونيوم ، وهو كاشف معروف لأيونات Fe 3+. من الواضح أن ثيوريا لا تعطي رد الفعل النوعي هذا.
المركز الثالث.تعتمد خصائص المواد على التأثير المتبادل للذرات في الجزيئات.
على سبيل المثال ، في حمض الأسيتيك ، تتفاعل واحدة فقط من ذرات الهيدروجين الأربع مع القلويات. بناءً على ذلك ، يمكن افتراض أن ذرة هيدروجين واحدة فقط مرتبطة بالأكسجين:
من ناحية أخرى ، من الصيغة البنائية لحمض الأسيتيك ، يمكن للمرء أن يستنتج أنه يحتوي على ذرة هيدروجين متحركة واحدة ، أي أنها أحادية القاعدة.
للتحقق من عالمية موقف نظرية الهيكل من اعتماد خصائص المواد على التأثير المتبادل للذرات في الجزيئات ، والذي لا يوجد فقط في المركبات العضوية ، ولكن أيضًا في المركبات غير العضوية ، نقارن خصائص ذرات الهيدروجين في مركبات الهيدروجين من غير المعادن. لها بنية جزيئية وفي ظل الظروف العادية غازات أو سوائل متطايرة. اعتمادًا على موضع غير المعدني في النظام الدوري لـ D.I Mendeleev ، يمكن تحديد نمط في التغيير في خصائص هذه المركبات: 
الميثان لا يتفاعل مع الماء. يفسر عدم وجود الخصائص الأساسية للميثان من خلال تشبع قدرات التكافؤ لذرة الكربون.
تعرض الأمونيا الخصائص الأساسية. جزيءه قادر على ربط أيون الهيدروجين بنفسه بسبب جاذبيته إلى زوج الإلكترون الوحيد من ذرة النيتروجين (آلية تكوين الرابطة المتلقية للمانح).
في الفوسفين PH3 ، يتم التعبير عن الخصائص الأساسية بشكل ضعيف ، والتي ترتبط بنصف قطر ذرة الفوسفور. إنه أكبر بكثير من نصف قطر ذرة النيتروجين ، لذا فإن ذرة الفوسفور تجذب ذرة الهيدروجين إلى نفسها بشكل أضعف.
في الفترات من اليسار إلى اليمين ، تزداد شحنات نوى الذرات ، وينخفض نصف قطر الذرات ، وتزداد قوة التنافر لذرة الهيدروجين بشحنة موجبة جزئية + G ، وبالتالي تزداد الخصائص الحمضية لمركبات الهيدروجين من غير المعادن تم تحسينها. 
في المجموعات الفرعية الرئيسية ، يزداد نصف القطر الذري للعناصر من أعلى إلى أسفل ، وتجذب الذرات غير المعدنية مع 5- ذرات الهيدروجين مع 5+ أضعف ، وتقل قوة مركبات الهيدروجين ، وتتفكك بسهولة ، وبالتالي يتم تحسين خصائصها الحمضية.
تفسر القدرة المختلفة لمركبات الهيدروجين من غير المعادن على إزالة أو إضافة كاتيونات الهيدروجين في المحاليل من خلال التأثير غير المتكافئ للذرة غير المعدنية على ذرات الهيدروجين.
يفسر التأثير المختلف للذرات في جزيئات الهيدروكسيدات المكونة من عناصر من نفس الفترة أيضًا التغيير في خواصها الحمضية القاعدية.
تنخفض الخصائص الأساسية للهيدروكسيدات ، بينما تزداد الخواص الحمضية ، حيث تزداد درجة أكسدة الذرة المركزية ، وبالتالي فإن طاقة ارتباطها بذرة الأكسجين (8) وتنافر ذرة الهيدروجين (8+) بواسطة تزداد.
هيدروكسيد الصوديوم NaOH. نظرًا لأن نصف قطر ذرة الهيدروجين صغير جدًا ، فإنه يجذب ذرة الأكسجين إلى نفسها بقوة أكبر وستكون الرابطة بين ذرات الهيدروجين والأكسجين أقوى منها بين ذرات الصوديوم والأكسجين. يعرض هيدروكسيد الألومنيوم Al (OH) 3 خصائص مذبذبة.
في حمض البيركلوريك HclO4 ، ترتبط ذرة الكلور ذات الشحنة الموجبة الكبيرة نسبيًا بقوة أكبر بذرة الأكسجين وتطرد ذرة الهيدروجين بقوة أكبر من 6+. يستمر التفكك وفقًا لنوع الحمض.
الاتجاهات الرئيسية في تطوير نظرية التركيب الكيميائي للمركبات وأهميتها
في زمن A.M. Butlerov ، كانت الصيغ التجريبية (الجزيئية) والهيكلية مستخدمة على نطاق واسع في الكيمياء العضوية. يعكس الأخير ترتيب اتصال الذرات في الجزيء وفقًا لتكافؤهم ، والذي يُشار إليه بالشرطات.
لسهولة التسجيل ، غالبًا ما يتم استخدام الصيغ الهيكلية المختصرة ، حيث يتم الإشارة فقط إلى الروابط بين ذرات الكربون أو الكربون والأكسجين بشرطة.
الصيغ الهيكلية المختصرة
بعد ذلك ، مع تطور المعرفة حول طبيعة الرابطة الكيميائية وتأثير التركيب الإلكتروني لجزيئات المواد العضوية على خواصها ، بدأوا في استخدام الصيغ الإلكترونية التي يُشار فيها تقليديًا إلى الرابطة التساهمية بنقطتين. في مثل هذه الصيغ ، غالبًا ما يظهر اتجاه إزاحة أزواج الإلكترون في الجزيء.
إن التركيب الإلكتروني للمواد هو الذي يفسر التأثيرات الميزومرية والحثية.
التأثير الاستقرائي هو إزاحة أزواج الإلكترون من روابط جاما من ذرة إلى أخرى بسبب اختلاف سلبيتها الكهربية. يشار إليه (->).
يكون تأثير الحث لذرة (أو مجموعة ذرات) سالبًا (- /) ، إذا كانت هذه الذرة تحتوي على كهرسلبية عالية (هالوجينات ، أكسجين ، نيتروجين) ، تجذب إلكترونات رابطة جاما وتكتسب شحنة سالبة جزئية. للذرة (أو مجموعة الذرات) تأثير حثي إيجابي (+ /) إذا كانت تصد إلكترونات روابط جاما. هذه الخاصية تمتلكها بعض الجذور المقيدة C2H5). تذكر قاعدة ماركوفنيكوف حول كيفية إضافة الهيدروجين وهالوجين هاليد الهيدروجين إلى الألكينات (البروبين) وستفهم أن هذه القاعدة ذات طبيعة خاصة. قارن هذين المثالين من معادلات التفاعل:
[[Theory_of_the_chemical_compounds_A._M._Butlerov |  ]]
]]
في جزيئات المواد الفردية ، يتجلى كل من التأثيرات الحثية والميزومرية في وقت واحد. في هذه الحالة ، إما أنها تعزز بعضها البعض (في الألدهيدات والأحماض الكربوكسيلية) ، أو تضعف بعضها البعض (في كلوريد الفينيل).
نتيجة التأثير المتبادل للذرات في الجزيئات هو إعادة توزيع كثافة الإلكترون.
تم التعبير عن فكرة الاتجاه المكاني للروابط الكيميائية لأول مرة من قبل الكيميائي الفرنسي J. A. Le Bel والكيميائي الهولندي J. X. Van't Hoff في عام 1874. تم تأكيد افتراضات العلماء بالكامل من خلال كيمياء الكم. تتأثر خصائص المواد بشكل كبير بالتركيب المكاني لجزيئاتها. على سبيل المثال ، قدمنا بالفعل الصيغ الخاصة بكل من cis- و trans-isomers من بيوتين -2 ، والتي تختلف في خصائصها (انظر الشكل 16).
يبلغ متوسط طاقة الرابطة التي يجب كسرها أثناء الانتقال من شكل إلى آخر حوالي 270 كيلوجول / مول ؛ ليس هناك الكثير من الطاقة في درجة حرارة الغرفة. من أجل الانتقال المتبادل لأشكال البيوتين -2 من واحد إلى آخر ، من الضروري كسر رابطة تساهمية واحدة وتشكيل أخرى بدلاً من ذلك. بمعنى آخر ، هذه العملية هي مثال على تفاعل كيميائي ، وكلا شكلي البيوتين -2 يعتبران مركبات كيميائية مختلفة.
من الواضح أنك تتذكر أن أهم مشكلة في تصنيع المطاط كانت الحصول على المطاط المجسم. كان من الضروري إنشاء بوليمر يتم فيه ترتيب الوحدات الهيكلية بترتيب صارم (المطاط الطبيعي ، على سبيل المثال ، يتكون فقط من وحدات رابطة الدول المستقلة) ، لأن هذه الخاصية المهمة للمطاط مثل مرونته تعتمد على هذا.
تميّز الكيمياء العضوية الحديثة نوعين رئيسيين من التماثل: البنيوي (التماثل المتسلسل ، تماثل موضع الروابط المتعددة ، تماثل السلاسل المتماثلة ، تماثل موضع المجموعات الوظيفية) والتزاوج الفراغي (هندسي ، أو تماثل متماثل ، بصري ، أو المرآة ، التماثل).
لذلك ، كنت قادرًا على التأكد من أن الموقف الثاني لنظرية التركيب الكيميائي ، التي صاغها بوضوح أ. إم بتليروف ، غير مكتمل. من وجهة نظر حديثة ، يتطلب هذا الحكم إضافات:
لا تعتمد خصائص المواد على تركيبها النوعي والكمي فحسب ، بل تعتمد أيضًا على:
المواد الكيميائية،
الكتروني
الهيكل المكاني.
لعب إنشاء نظرية بنية المواد دورًا مهمًا في تطوير الكيمياء العضوية. من علم وصفي في الغالب ، يتحول إلى علم توليفي إبداعي ؛ أصبح من الممكن الحكم على التأثير المتبادل للذرات في جزيئات المواد المختلفة (انظر الجدول 10). خلقت نظرية التركيب المتطلبات الأساسية لشرح والتنبؤ بأنواع مختلفة من تماثل الجزيئات العضوية ، وكذلك اتجاهات وآليات التفاعلات الكيميائية.
على أساس هذه النظرية ، يقوم الكيميائيون العضويون بإنشاء مواد لا تحل محل المواد الطبيعية فحسب ، بل تتفوق عليها بشكل كبير في خصائصها. لذلك ، فإن الأصباغ الاصطناعية أفضل بكثير وأرخص من العديد من الأصباغ الطبيعية ، على سبيل المثال ، الإيزارين والنيلي المعروفين في العصور القديمة. يتم إنتاج المطاط الصناعي بكميات كبيرة مع مجموعة متنوعة من الخصائص. يتم استخدام البلاستيك والألياف على نطاق واسع ، والمنتجات التي تستخدم في الهندسة والحياة اليومية والطب والزراعة.
يمكن مقارنة قيمة نظرية التركيب الكيميائي لـ A. M. Butlerov للكيمياء العضوية مع قيمة القانون الدوري والنظام الدوري للعناصر الكيميائية لـ D. I. Mendeleev للكيمياء غير العضوية. ليس من قبيل الصدفة أن تشترك كلتا النظريتين في الكثير من الأمور المشتركة في طرق تكوينهما ، واتجاهات التطور والأهمية العلمية العامة. ومع ذلك ، في تاريخ أي نظرية علمية أخرى رائدة (نظرية داروين ، وعلم الوراثة ، ونظرية الكم ، وما إلى ذلك) يمكن للمرء أن يجد مثل هذه المراحل المشتركة.
1. إنشاء أوجه تشابه بين النظريتين الرائدتين في الكيمياء - القانون الدوري والجدول الدوري للعناصر الكيميائية بقلم D.I Mendeleev ونظرية التركيب الكيميائي للمركبات العضوية بواسطة A. اتجاهات تطورهم ، شائعة في الأدوار التنبؤية.
2. ما هو الدور الذي لعبته نظرية تركيب المركبات الكيميائية في تشكيل القانون الدوري؟
3. ما الأمثلة من الكيمياء غير العضوية التي تؤكد عالمية كل من أحكام نظرية تركيب المركبات الكيميائية؟
4. يشير حمض الفوسفور H3PO3 إلى الأحماض ثنائية القاعدة. اقترح صيغته الهيكلية واعتبر التأثير المتبادل للذرات في جزيء هذا الحمض.
5. اكتب الأيزومرات التي لها التركيبة С3Н8O. قم بتسميتها وفقًا للتسمية المنهجية. تحديد أنواع التماثل.
6. الصيغ التالية من الهيدرات البلورية لكلوريد الكروم (III) معروفة: [Cr (H20) 6] Cl3 ؛ [Cr (H20) 5Cl] Cl2 H20 ؛ [Cr (H20) 4 * C12] Cl 2H2O. ماذا تسمي هذه الظاهرة؟
تمت صياغة الأحكام الرئيسية لنظرية التركيب الكيميائي للمركبات العضوية من قبل أستاذ جامعة قازان A.M. Butlerov في عام 1861.
- ترتبط الذرات في الجزيئات بترتيب محدد بدقة وفقًا لتكافؤ العناصر.
- لا تعتمد خصائص المواد على تركيبتها الكمية والنوعية فحسب ، بل تعتمد أيضًا على الترتيب الذي ترتبط به الذرات في الجزيئات ، أي. من التركيب الكيميائي.
- تؤثر الذرات في الجزيئات بعضها على بعض.
- يتم تحديد خصائص المواد من خلال هيكلها ، وعلى العكس من ذلك ، من خلال معرفة الهيكل ، يمكن للمرء أن يتنبأ بالخصائص.
- يمكن تحديد التركيب الكيميائي للمواد بالطرق الكيميائية.
نظرية التركيب الكيميائي لـ A.M. خضع Butlerov لعملية تطور أهمها:
- ظهور النظريات الإلكترونية في الكيمياء العضوية ، مما جعل من الممكن صياغة اعتماد السلوك الكيميائي للمواد العضوية على التركيب الإلكتروني.
- التمثيلات الكيميائية المجسمة التي تحدد العلاقة بين الخواص الكيميائية للمواد والبنية المكانية.
ميزات المركبات العضوية ، يتم تحديد تنوعها بشكل أساسي من خلال البنية الإلكترونية لذرة الكربون ، والتي تظهر في المركبات العضوية تكافؤًا يساوي أربعة ويمكن أن تكون في حالة sp 3 - و sp 2 - و sp-hybrid. لذلك ، يمكن إجراء الرابطة بين الذرات بواسطة أزواج إلكترون واحد واثنين وثلاثة أزواج ، أي تكون مفردة (σ - رابطة) ، مزدوجة (1σ - رابطة و 1π - رابطة) ، ثلاثية (1σ - رابطة و 2 - رابطة). الخاصية الاستثنائية للكربون هي القدرة على تكوين سلاسل من الذرات بأطوال مختلفة وبنى دورية.
من الموضع الثاني لنظرية البنية يتبع وجود التماثل والتشابه في المواد العضوية. سلسلة متشابهةتسمى مجموعة من المركبات العضوية التي لها بنية وخصائص متشابهة وتختلف عن بعضها البعض في التركيب بواسطة مجموعة واحدة أو أكثر - CH 2 -. يتم استدعاء ممثلي نفس السلسلة المتماثلة المتجانسات.
نظائر- المواد التي لها نفس التركيب الكمي والنوعي ، ولكنها تختلف في تركيب الجزيئات ، وبالتالي في الخصائص. هناك تماثل بنيوي ومكاني (ستيريو). النوع الأول هو
- تماثل الهيكل الكربوني (على سبيل المثال ، n- بيوتان و isobutane) ؛
- أيزومرية موضع الرابطة المتعددة في الجزيء (على سبيل المثال ، 2-ميثيل -1-بيوتين و 2-ميثيل -2-بيوتين) ؛
- تماثل موضع المجموعة الوظيفي (مثل 1-كلوروبروبان و 2-كلوروبروبان) ؛
- التزاوج بين الطبقة أو metamerism (على سبيل المثال ، butyne-1 و butadiene-1،3) ، إلخ.
في الأيزومرات المكانية ، يكون ترتيب ارتباط الذرات في الجزيئات هو نفسه ، لكن موقعها في الفضاء مختلف ، مما يسبب اختلافًا في الخصائص. المكاني هو تماثل هندسي. من الممكن ، على سبيل المثال ، في الألكينات.
أسس إنشاء نظرية التركيب الكيميائي للمركبات العضوية A.M. باتلروف هو النظرية الذرية والجزيئية (عمل من قبل أفاغادرو وس. كانيزارو). سيكون من الخطأ الافتراض أن العالم قبل إنشائه لم يكن يعرف شيئًا عن المواد العضوية ولم تُبذل أية محاولات لإثبات بنية المركبات العضوية. بحلول عام 1861 (العام الذي أنشأ فيه A.M. Butlerov نظرية التركيب الكيميائي للمركبات العضوية) ، وصل عدد المركبات العضوية المعروفة إلى مئات الآلاف ، وحدث فصل الكيمياء العضوية كعلم مستقل في وقت مبكر من عام 1807 (J. Berzelius) .
خلفية نظرية تركيب المركبات العضوية
بدأت دراسة واسعة للمركبات العضوية في القرن الثامن عشر بعمل A. Lavoisier ، الذي أظهر أن المواد التي تم الحصول عليها من الكائنات الحية تتكون من عدة عناصر - الكربون ، والهيدروجين ، والأكسجين ، والنيتروجين ، والكبريت ، والفوسفور. كان إدخال المصطلحين "راديكالي" و "إيزومريزم" ذا أهمية كبيرة ، بالإضافة إلى تكوين نظرية الراديكاليين (L. Giton de Morvo ، A. Lavoisier ، J. Liebig ، J. Dumas ، J. Berzelius) ، النجاح في تصنيع المركبات العضوية (اليوريا ، الأنيلين ، حمض الأسيتيك ، الدهون ، المواد الشبيهة بالسكر ، إلخ).
تم نشر مصطلح "التركيب الكيميائي" ، وكذلك أسس النظرية الكلاسيكية للتركيب الكيميائي ، لأول مرة بواسطة A.M. بتليروف في 19 سبتمبر 1861 في تقريره في مؤتمر علماء الطبيعة والأطباء الألمان في شباير.
الأحكام الرئيسية لنظرية هيكل المركبات العضوية A.M. بتليروف
1. ترتبط الذرات التي تشكل جزيء مادة عضوية ببعضها بترتيب معين ، ويتم إنفاق واحد أو أكثر من التكافؤ من كل ذرة على الترابط مع بعضها البعض. لا توجد تكافؤات مجانية.
أطلق بتليروف على تسلسل اتصال الذرات اسم "التركيب الكيميائي". بيانياً ، يُشار إلى الروابط بين الذرات بخط أو نقطة (الشكل 1).
أرز. 1. التركيب الكيميائي لجزيء الميثان: أ- الصيغة البنائية ، ب- الصيغة الإلكترونية
2. تعتمد خصائص المركبات العضوية على التركيب الكيميائي للجزيئات ، أي تعتمد خصائص المركبات العضوية على الترتيب الذي ترتبط به الذرات في الجزيء. من خلال دراسة الخصائص ، يمكنك تصوير المادة.
لنأخذ مثالاً: مادة لها الصيغة الإجمالية C 2 H 6 O. من المعروف أنه عندما تتفاعل هذه المادة مع الصوديوم ، يتم إطلاق الهيدروجين ، وعندما يعمل حمض عليها ، يتشكل الماء.
ج 2 H 6 O + Na = C 2 H 5 ONa + H 2
C 2 H 6 O + HCl \ u003d C 2 H 5 Cl + H 2 O
يمكن أن تتوافق هذه المادة مع صيغتين هيكليتين:
CH 3 -O-CH 3 - أسيتون (ثنائي ميثيل كيتون) و CH 3 -CH 2 -OH - كحول إيثيل (إيثانول) ،
بناءً على الخصائص الكيميائية المميزة لهذه المادة ، نستنتج أنها إيثانول.
الأيزومرات هي مواد لها نفس التركيب النوعي والكمي ، لكن لها بنية كيميائية مختلفة. هناك عدة أنواع من التماكب: الهيكلية (الخطية ، المتفرعة ، الهيكل الكربوني) ، هندسية (cis- و trans-isomerism ، مميزة للمركبات ذات الروابط المزدوجة المتعددة (الشكل 2)) ، البصري (المرآة) ، المجسم (المكاني ، خاصية المواد التي يمكن أن تتواجد في الفضاء بطرق مختلفة (الشكل 3)).

أرز. 2. مثال على التماثل الهندسي
3. تتأثر الخصائص الكيميائية للمركبات العضوية أيضًا بالذرات الأخرى الموجودة في الجزيء. تسمى هذه المجموعات من الذرات المجموعات الوظيفية ، لأن وجودها في جزيء مادة ما يمنحها خصائص كيميائية خاصة. على سبيل المثال: -OH (مجموعة هيدروكسو) ، -SH (مجموعة ثيو) ، -CO (مجموعة كاربونيل) ، -COOH (مجموعة الكربوكسيل). علاوة على ذلك ، تعتمد الخواص الكيميائية للمادة العضوية بدرجة أقل على الهيكل العظمي الهيدروكربوني منها على المجموعة الوظيفية. هي المجموعات الوظيفية التي توفر مجموعة متنوعة من المركبات العضوية ، والتي يتم تصنيفها على أساسها (كحول ، ألدهيدات ، أحماض كربوكسيلية ، إلخ. تشتمل المجموعات الوظيفية أحيانًا على روابط كربون-كربون (مضاعف مزدوج وثلاثي). إذا كان هناك العديد منها متطابقة المجموعات الوظيفية ، ثم يطلق عليها متجانسة الوظائف (CH 2 (OH) -CH (OH) -CH 2 (OH) - الجلسرين) ، إذا كانت متعددة ، ولكنها مختلفة - متعددة الوظائف (NH 2 -CH (R) -COOH - الأحماض الأمينية) .

تين. 3. مثال على الأيزومر الفراغي: أ - هكسان حلقي ، شكل "كرسي" ، ب - هكسان حلقي ، شكل "حمام"
4. يكون تكافؤ الكربون في المركبات العضوية دائمًا أربعة.
ظهر الأول في بداية القرن التاسع عشر. نظرية الراديكاليين (J. Gay-Lussac، F. Wehler، J. Liebig). كانت تسمى الجذور مجموعات من الذرات التي تمر دون تغيير أثناء التفاعلات الكيميائية من مركب إلى آخر. تم الحفاظ على مفهوم المتطرفين هذا ، ولكن تبين أن معظم الأحكام الأخرى لنظرية الراديكاليين غير صحيحة.
وفقًا لنظرية الأنواع (C. Gerard) ، يمكن تقسيم جميع المواد العضوية إلى أنواع تتوافق مع بعض المواد غير العضوية. على سبيل المثال ، تم اعتبار كحول R-OH وإيثرات R-O-R كممثلين لنوع الماء H-OH ، حيث يتم استبدال ذرات الهيدروجين بالجذور. خلقت نظرية الأنواع تصنيفًا للمواد العضوية ، يتم تطبيق بعض مبادئه حاليًا.
تم إنشاء النظرية الحديثة لهيكل المركبات العضوية من قبل العالم الروسي البارز أ.م. بتليروف.
1. يتم ترتيب الذرات في الجزيء في تسلسل معين وفقًا للتكافؤ. تكافؤ ذرة الكربون في المركبات العضوية هو أربعة.
2. لا تعتمد خصائص المواد على الذرات والكميات التي تشكل جزءًا من الجزيء فحسب ، بل تعتمد أيضًا على ترتيب ترابطها.
3. تؤثر الذرات أو مجموعات الذرات التي يتكون منها الجزيء بشكل متبادل على بعضها البعض ، والذي يعتمد عليه النشاط الكيميائي وتفاعل الجزيئات.
4. تسمح لك دراسة خصائص المواد بتحديد تركيبها الكيميائي.
التأثير المتبادل للذرات المجاورة في الجزيئات هو أهم خاصية للمركبات العضوية. ينتقل هذا التأثير إما من خلال سلسلة من الروابط الفردية أو من خلال سلسلة من الروابط الفردية والمزدوجة (المتناوبة).
تصنيف المركبات العضويةيعتمد على تحليل جانبين من بنية الجزيئات - هيكل الهيكل الكربوني ووجود المجموعات الوظيفية.