Svako ko je išao u školu sjeća se da je jedan od obaveznih predmeta za učenje bila hemija. Moglo bi joj se svidjeti, ili joj se ne sviđa - nije bitno. I vjerovatno je da je mnogo znanja iz ove discipline već zaboravljeno i ne primjenjuje se u životu. Međutim, tabela hemijski elementi Svi se vjerovatno sjećaju D. I. Mendeljejeva. Za mnoge je to ostala raznobojna tablica, u kojoj su u svaki kvadrat upisana određena slova koja označavaju nazive kemijskih elemenata. Ali ovdje nećemo govoriti o hemiji kao takvoj, i opisivati stotine kemijskih reakcija i procesa, već ćemo govoriti o tome kako se pojavio periodni sistem općenito - ova priča će biti od interesa za svaku osobu, pa i za sve one koji žele zanimljive i korisne informacije.
Malo pozadine
Davne 1668. godine, izvanredni irski hemičar, fizičar i teolog Robert Boyle objavio je knjigu u kojoj su razobličeni mnogi mitovi o alhemiji iu kojoj je govorio o potrebi traženja nerazgradivih hemijskih elemenata. Naučnik je dao i njihovu listu, koja se sastoji od samo 15 elemenata, ali je dozvolio ideju da može biti više elemenata. To je postalo Polazna tačka ne samo u potrazi za novim elementima, već i u njihovoj sistematizaciji.
Stotinu godina kasnije, francuski hemičar Antoine Lavoisier sastavio je nova lista, koji je već uključivao 35 elemenata. Kasnije je utvrđeno da su njih 23 nerazgradiva. Ali potragu za novim elementima nastavili su naučnici širom svijeta. I vodeća uloga poznati ruski hemičar Dmitrij Ivanovič Mendeljejev igrao je u ovom procesu - on je prvi iznio hipotezu da bi mogla postojati veza između atomske mase elemenata i njihove lokacije u sistemu.
Zahvaljujući mukotrpnom radu i poređenju hemijskih elemenata, Mendeljejev je uspeo da otkrije vezu između elemenata u kojoj oni mogu biti jedno, a njihova svojstva nisu nešto što se podrazumeva, već su fenomen koji se periodično ponavlja. Kao rezultat toga, u februaru 1869. Mendeljejev je formulisao prvi periodični zakon, a već u martu je svoj izvještaj „Odnos svojstava sa atomskom težinom elemenata“ podnio Ruskom hemijskom društvu istoričar hemije N. A. Menshutkin. Zatim je iste godine objavljena Mendeljejevljeva publikacija u časopisu Zeitschrift fur Chemie u Njemačkoj, a 1871. nova obimna publikacija naučnika posvećena njegovom otkriću objavljena je u drugom njemačkom časopisu Annalen der Chemie.
Kreiranje periodnog sistema

Glavnu ideju do 1869. već je formirao Mendeljejev, i to prilično kratko vrijeme, ali dugo nije mogao da to uredi u nekakav uređen sistem koji jasno prikazuje šta je šta. U jednom od razgovora sa kolegom A. A. Inostrancevom, čak je rekao da mu je sve već proradilo u glavi, ali nije mogao sve da iznese na sto. Nakon toga, prema Mendeljejevljevim biografima, počeo je mukotrpan rad nad njegovim stolom, koji je trajao tri dana bez pauze za spavanje. Razvrstani su se razni načini organizovanja elemenata u tabeli, a posao je bio komplikovan činjenicom da u to vreme nauka još nije znala za sve hemijske elemente. Ali, uprkos tome, tabela je ipak kreirana, a elementi sistematizovani.
Legenda o snu Mendeljejeva
Mnogi su čuli priču da je D. I. Mendeljejev sanjao svoj stol. Ovu verziju je aktivno distribuirao gore spomenuti kolega Mendeljejeva A. A. Inostrantsev kao smijesna prica kojim je zabavljao svoje učenike. Rekao je da je Dmitrij Ivanovič otišao u krevet i u snu je jasno vidio svoj stol, u kojem su svi hemijski elementi raspoređeni u pravom redoslijedu. Nakon toga, studenti su se čak našalili da je na isti način otkrivena i votka od 40°. Ali još su postojali stvarni preduslovi za priču o spavanju: kao što je već pomenuto, Mendeljejev je radio za stolom bez sna i odmora, a Inostrancev ga je jednom zatekao umornog i iscrpljenog. Popodne je Mendeljejev odlučio da napravi pauzu, a nešto kasnije se naglo probudio, odmah uzeo komad papira i na njemu prikazao gotov sto. Ali sam naučnik je opovrgao cijelu ovu priču snom, rekavši: "Razmišljam o tome možda dvadeset godina, a vi mislite: sjedio sam i odjednom je... spremno." Dakle, legenda o snu može biti vrlo privlačna, ali stvaranje stola bilo je moguće samo napornim radom.

Dalji rad
U periodu od 1869. do 1871. Mendeljejev je razvio ideje periodičnosti, kojima je naučna zajednica bila sklona. I jedan od prekretnice Ovaj proces je bio shvatanje da bilo koji element u sistemu treba da se zasniva na ukupnosti njegovih svojstava u poređenju sa svojstvima drugih elemenata. Na osnovu toga, a i na osnovu rezultata istraživanja promjene oksida koji stvaraju staklo, kemičar je uspio izmijeniti vrijednosti atomskih masa nekih elemenata, među kojima su uran, indijum, berilijum i drugi.
Naravno, Mendeljejev je želio što prije popuniti prazne ćelije koje su ostale u tabeli, a 1870. je predvidio da će uskoro biti otkriveni nauci nepoznati hemijski elementi, čije atomske mase i svojstva može izračunati. Prvi od njih bili su galijum (otkriven 1875.), skandij (otkriven 1879.) i germanijum (otkriven 1885.). Tada su se predviđanja nastavila ostvarivati i otkriveno je još osam novih elemenata, uključujući: polonijum (1898), renijum (1925), tehnecijum (1937), francijum (1939) i astatin (1942-1943). Inače, 1900. godine D. I. Mendeleev i škotski hemičar William Ramsay došli su do zaključka da elemente nulte grupe također treba uključiti u tabelu - do 1962. zvali su se inertni, a poslije - plemeniti plinovi.
Organizacija periodnog sistema
Hemijski elementi u tabeli D. I. Mendeljejeva raspoređeni su u redove, u skladu sa povećanjem njihove mase, a dužina redova je odabrana tako da elementi u njima imaju slična svojstva. Na primjer, plemeniti gasovi kao što su radon, ksenon, kripton, argon, neon i helijum ne reaguju lako sa drugim elementima, a takođe imaju nisku hemijsku aktivnost, zbog čega se nalaze u krajnjem desnom stubu. I elementi lijevog stupca (kalijum, natrijum, litijum, itd.) savršeno reaguju sa ostalim elementima, a same reakcije su eksplozivne. Pojednostavljeno rečeno, unutar svake kolone elementi imaju slična svojstva, koja se razlikuju od kolone do kolone. Svi elementi do br. 92 nalaze se u prirodi, a sa brojem 93. počinju umjetni elementi koji se mogu stvoriti samo u laboratoriji.
U originalnoj verziji periodični sistem je shvaćen samo kao odraz poretka koji postoji u prirodi i nije bilo objašnjenja zašto bi sve tako trebalo da bude. I tek kada se pojavila kvantna mehanika, pravo značenje redosled elemenata u tabeli postao je jasan.
Lekcije kreativnog procesa
Govoreći o tome koje se pouke kreativnog procesa mogu izvući iz čitave istorije stvaranja periodnog sistema D. I. Mendeljejeva, kao primjer se mogu navesti ideje engleskog istraživača na polju kreativnog mišljenja Grahama Wallacea i francuskog naučnika Henri Poincaré. Hajdemo ih ukratko.
Prema Poincaréu (1908) i Grahamu Wallaceu (1926), postoje četiri glavne faze u kreativnom razmišljanju:
- Trening- faza formulisanja glavnog zadatka i prvi pokušaji njegovog rješavanja;
- Inkubacija- faza tokom koje dolazi do privremenog odvlačenja pažnje od procesa, ali se rad na pronalaženju rješenja problema odvija na podsvjesnom nivou;
- uvid- faza u kojoj intuitivno rešenje. Štaviše, ovo rešenje se može naći u situaciji koja apsolutno nije relevantna za zadatak;
- Ispitivanje- faza testiranja i implementacije rješenja, u kojoj se vrši verifikacija ovog rješenja i njegov mogući dalji razvoj.
Kao što vidimo, u procesu kreiranja svoje tabele, Mendeljejev je intuitivno pratio ove četiri faze. Koliko je to efektivno može se suditi po rezultatima, tj. jer je tabela kreirana. A s obzirom na to da je njegovo stvaranje bio veliki iskorak ne samo za hemijsku nauku, već i za čitavo čovečanstvo, navedene četiri faze mogu se primeniti kako na realizaciju malih projekata, tako i na realizaciju globalnih planova. Glavna stvar koju treba zapamtiti je da se ni jedno otkriće, niti jedno rješenje problema ne može pronaći samo po sebi, ma koliko željeli da ih vidimo u snu i koliko god spavali. Da biste uspjeli, bilo da se radi o izradi tabele hemijskih elemenata ili izradi novog marketinškog plana, potrebno je posjedovati određena znanja i vještine, kao i vješto koristiti svoj potencijal i vrijedno raditi.
Želimo vam uspjeh u vašim nastojanjima i uspješnu implementaciju Conceived!
Hemijski element je skupni pojam koji opisuje skup atoma jednostavna supstanca, odnosno onu koja se ne može podijeliti na jednostavnije (prema strukturi njihovih molekula) komponente. Zamislite da dobijete komad čistog gvožđa sa zahtevom da ga podelite na hipotetičke sastojke koristeći bilo koji uređaj ili metod koji su ikada izmislili hemičari. Međutim, ne možete ništa, pegla se nikada neće podeliti na nešto jednostavnije. Jednostavna supstanca - gvožđe - odgovara hemijskom elementu Fe.
Teorijska definicija
Eksperimentalna činjenica koja je gore navedena može se objasniti sljedećom definicijom: kemijski element je apstraktna kolekcija atoma (ne molekula!) odgovarajuće jednostavne supstance, odnosno atoma istog tipa. Kada bi postojao način da se pogleda svaki od pojedinačnih atoma u komadu čistog željeza koji je gore spomenut, onda bi svi bili isti - atomi željeza. Za razliku od ovoga, hemijsko jedinjenje, na primjer, željezni oksid, uvijek sadrži najmanje dva različite vrste atomi: atomi željeza i atomi kisika.
Uslovi koje treba da znate
Atomska masa: masa protona, neutrona i elektrona koji čine atom hemijskog elementa.
atomski broj: broj protona u jezgru atoma elementa.
hemijski simbol: slovo ili par latinična slova A koji predstavlja simbol za ovaj element.
Hemijsko jedinjenje: supstanca koja se sastoji od dva ili više hemijskih elemenata kombinovanih jedan sa drugim u određenom omjeru.
Metal: Element koji gubi elektrone u hemijskim reakcijama sa drugim elementima.
Metalloid: Element koji ponekad reaguje kao metal, a ponekad kao nemetal.
Nemetalni: element koji teži da dobije elektrone hemijske reakcije sa ostalim elementima.
Periodični sistem hemijskih elemenata: sistem za klasifikaciju hemijskih elemenata prema njihovim atomskim brojevima.
sintetički element: onaj koji se dobija veštački u laboratoriji, a obično se ne javlja u prirodi.

Prirodni i sintetički elementi
Devedeset i dva hemijska elementa se prirodno javljaju na Zemlji. Ostatak je dobijen veštački u laboratorijama. Sintetički hemijski element je obično proizvod nuklearnih reakcija u akceleratorima čestica (uređajima koji se koriste za povećanje brzine subatomskih čestica kao što su elektroni i protoni) ili nuklearnih reaktora(uređaji koji se koriste za kontrolu energije oslobođene u nuklearnim reakcijama). Prvi sintetizovani element sa atomskim brojem 43 bio je tehnecijum, koji su 1937. otkrili italijanski fizičari C. Perrier i E. Segre. Osim tehnecijuma i prometijuma, svi sintetički elementi imaju jezgra veće od onih u uranijuma. Posljednji sintetički element koji je nazvan je livermorijum (116), a prije toga bio je flerovijum (114).

Dvadeset uobičajenih i važnih elemenata
| Ime | Simbol | Procenat svih atoma * | Svojstva hemijskih elemenata (u normalnim sobnim uslovima) |
|||
| U Univerzumu | U zemljinoj kori | U morskoj vodi | U ljudskom tijelu |
|||
| Aluminijum | Al | - | 6,3 | - | - | Lagan, srebrni metal |
| Kalcijum | Ca | - | 2,1 | - | 0,02 | Uključeno u prirodne minerale, školjke, kosti |
| Karbon | OD | - | - | - | 10,7 | Osnova svih živih organizama |
| Hlor | Cl | - | - | 0,3 | - | otrovni gas |
| Bakar | Cu | - | - | - | - | Samo crveni metal |
| Zlato | Au | - | - | - | - | Samo žuti metal |
| Helijum | On | 7,1 | - | - | - | Veoma lagan plin |
| Vodonik | H | 92,8 | 2,9 | 66,2 | 60,6 | Najlakši od svih elemenata; gas |
| Jod | I | - | - | - | - | Nemetalni; koristi se kao antiseptik |
| Iron | Fe | - | 2,1 | - | - | Magnetski metal; koristi se za proizvodnju željeza i čelika |
| Olovo | Pb | - | - | - | - | Mek, teški metal |
| Magnezijum | mg | - | 2,0 | - | - | Veoma lagan metal |
| Merkur | hg | - | - | - | - | Tečni metal; jedan od dva tečna elementa |
| Nikl | Ni | - | - | - | - | Metal otporan na koroziju; koristi se u kovanicama |
| Nitrogen | N | - | - | - | 2,4 | Gas, glavna komponenta vazduha |
| Kiseonik | O | - | 60,1 | 33,1 | 25,7 | Plin, drugi važan vazdušna komponenta |
| Fosfor | R | - | - | - | 0,1 | Nemetalni; važno za biljke |
| Kalijum | To | - | 1.1 | - | - | Metal; važno za biljke; obično se naziva "potaša" |
* Ako vrijednost nije navedena, tada je element manji od 0,1 posto.
Veliki prasak kao osnovni uzrok nastanka materije
Koji je hemijski element bio prvi u svemiru? Naučnici vjeruju da odgovor na ovo pitanje leži u zvijezdama i procesima u kojima se zvijezde formiraju. Vjeruje se da je svemir nastao u nekom trenutku između 12 i 15 milijardi godina. Do ovog trenutka ništa što postoji, osim energije, nije začeto. Ali dogodilo se nešto što je ovu energiju pretvorilo u ogromnu eksploziju (tzv. Veliki prasak). U narednim sekundama poslije veliki prasak materija je počela da se formira.
Prvi najjednostavniji oblici materije koji su se pojavili bili su protoni i elektroni. Neki od njih su kombinovani u atome vodika. Potonji se sastoji od jednog protona i jednog elektrona; to je najjednostavniji atom koji može postojati.

Polako, tokom dugog vremenskog perioda, atomi vodonika počeli su da se skupljaju u određenim delovima svemira, formirajući guste oblake. Vodik u ovim oblacima je gravitacionim silama povučen u kompaktne formacije. Na kraju su ovi oblaci vodonika postali dovoljno gusti da formiraju zvijezde.
Zvijezde kao hemijski reaktori novih elemenata
Zvijezda je jednostavno masa materije koja stvara energiju nuklearnih reakcija. Najčešća od ovih reakcija je kombinacija četiri atoma vodika kako bi se formirao jedan atom helija. Čim su se zvijezde počele formirati, helijum je postao drugi element koji se pojavio u svemiru.
Kako zvijezde stare, prelaze s nuklearnih reakcija vodika i helija na druge vrste. U njima atomi helija formiraju atome ugljika. Kasniji atomi ugljika formiraju kisik, neon, natrij i magnezij. Još kasnije, neon i kiseonik se kombinuju i formiraju magnezijum. Kako se ove reakcije nastavljaju, formira se sve više i više hemijskih elemenata.
Prvi sistemi hemijskih elemenata
Prije više od 200 godina, hemičari su počeli tražiti načine da ih klasificiraju. Sredinom devetnaestog veka bilo je poznato oko 50 hemijskih elemenata. Jedno od pitanja koje su hemičari nastojali riješiti. svodi se na sljedeće: da li je kemijski element supstanca potpuno drugačija od bilo kojeg drugog elementa? Ili su neki elementi na neki način povezani s drugima? Da li postoji a common law to ih ujedinjuje?
Hemičari su predložili razni sistemi hemijski elementi. Tako je, na primjer, engleski hemičar William Prout 1815. godine sugerirao da su atomske mase svih elemenata višekratne mase atoma vodika, ako uzmemo da je jednaka jedinici, odnosno da moraju biti cijeli brojevi. U to vrijeme, J. Dalton je već izračunao atomske mase mnogih elemenata u odnosu na masu vodonika. Međutim, ako je to otprilike slučaj za ugljik, dušik, kisik, onda se klor s masom od 35,5 nije uklapao u ovu shemu.
Njemački hemičar Johann Wolfgang Dobereiner (1780-1849) pokazao je 1829. da se tri elementa iz takozvane halogene grupe (hlor, brom i jod) mogu klasificirati prema njihovim relativnim atomskim masama. Ispostavilo se da je atomska težina broma (79,9) skoro tačno prosek atomskih težina hlora (35,5) i joda (127), odnosno 35,5 + 127 ÷ 2 = 81,25 (blizu 79,9). Ovo je bio prvi pristup konstrukciji jedne od grupa hemijskih elemenata. Doberiner je otkrio još dvije takve trijade elemenata, ali nije uspio formulirati opći periodični zakon.
Kako se pojavio periodni sistem hemijskih elemenata?
Većina ranih šema klasifikacije nije bila baš uspješna. Zatim, oko 1869. godine, gotovo isto otkriće dva hemičara su napravila gotovo u isto vrijeme. Ruski hemičar Dmitrij Mendeljejev (1834-1907) i nemački hemičar Julius Lothar Mejer (1830-1895) predložili su organizacione elemente koji imaju slične fizičke i Hemijska svojstva, u uređeni sistem grupa, serija i perioda. Istovremeno, Mendeljejev i Mejer su istakli da se svojstva hemijskih elemenata periodično ponavljaju u zavisnosti od njihove atomske težine.
Danas se Mendeljejev općenito smatra otkrićem periodični zakon jer je napravio jedan korak koji Meyer nije. Kada su svi elementi bili smješteni u periodnom sistemu, pojavile su se neke praznine u njemu. Mendeljejev je predvidio da su to lokacije za elemente koji još nisu otkriveni.
Međutim, otišao je i dalje. Mendeljejev je predvidio svojstva ovih još neotkrivenih elemenata. Znao je gdje se nalaze u periodnom sistemu, tako da je mogao predvidjeti njihova svojstva. Zanimljivo je da su svaki hemijski element koji je Mendeljejev predvideo, budući galijum, skandij i germanijum, otkriveni manje od deset godina nakon što je objavio svoj periodični zakon.
Kratki oblik periodnog sistema
Bilo je pokušaja da se izračuna koliko su varijanti grafičkog prikaza periodnog sistema predložili različiti naučnici. Ispostavilo se da ih je više od 500. Štaviše, 80% ukupan broj opcije su tabele, a ostalo je geometrijske figure, matematičke krive, itd. Kao rezultat praktična upotreba pronađene četiri vrste stolova: kratki, poludugi, dugi i merdevinasti (piramidalni). Potonje je predložio veliki fizičar N. Bohr.
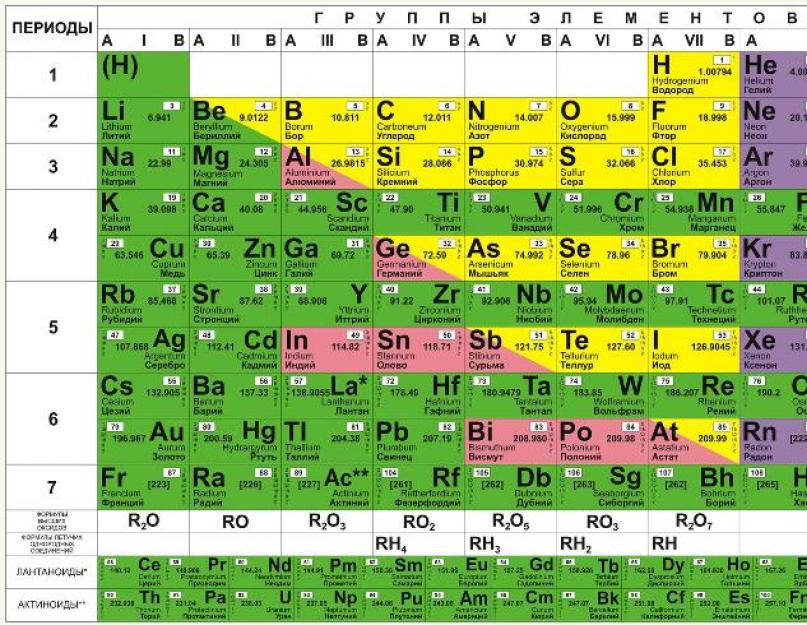
Slika ispod prikazuje kratku formu.

U njemu su hemijski elementi raspoređeni uzlaznim redoslijedom njihovih atomskih brojeva slijeva nadesno i odozgo prema dolje. Dakle, prvi hemijski element periodnog sistema, vodonik, ima atomski broj 1 jer jezgra atoma vodonika sadrže jedan i samo jedan proton. Slično, kisik ima atomski broj 8, budući da jezgra svih atoma kisika sadrže 8 protona (vidi sliku ispod).

Glavni strukturni fragmenti periodnog sistema su periodi i grupe elemenata. U šest perioda sve ćelije su popunjene, sedmi još nije završen (elementi 113, 115, 117 i 118, iako su sintetizovani u laboratorijama, još uvek nisu zvanično registrovani i nemaju nazive).
Grupe su podijeljene na glavne (A) i sekundarne (B) podgrupe. Elementi prva tri perioda, koji sadrže po jednu liniju serije, uključeni su isključivo u A-podgrupe. Preostala četiri perioda uključuju po dva reda.
Hemijski elementi u istoj grupi imaju slična hemijska svojstva. Dakle, prvu grupu čine alkalni metali, drugu - zemnoalkalni. Elementi u istom periodu imaju svojstva koja se polako mijenjaju iz alkalnog metala u plemeniti plin. Slika ispod pokazuje kako se jedno od svojstava - atomski radijus - mijenja za pojedinačni elementi u tabeli.
Dugoročni oblik periodnog sistema
Prikazan je na donjoj slici i podijeljen je u dva smjera, redovima i kolonama. Postoji sedam redova perioda, kao u kratkom obliku, i 18 kolona, koje se nazivaju grupe ili porodice. Naime, povećanje broja grupa sa 8 u kratkoj formi na 18 u dugoj se dobija stavljanjem svih elemenata u periode počevši od 4., ne u dva, već u jedan red.
Dva različiti sistemi numerisanje se koristi za grupe, kao što je prikazano na vrhu tabele. Rimski numerički sistem (IA, IIA, IIB, IVB, itd.) tradicionalno je popularan u SAD. Drugi sistem (1, 2, 3, 4, itd.) se tradicionalno koristi u Evropi i pre nekoliko godina je preporučen za upotrebu u SAD.

Izgled periodnih tablica na gornjim slikama je malo pogrešan, kao i kod svake takve objavljene tablice. Razlog za to je da bi dvije grupe elemenata prikazane na dnu tabela zapravo trebale biti smještene unutar njih. Lantanidi, na primjer, pripadaju periodu 6 između barija (56) i hafnija (72). Osim toga, aktinidi pripadaju periodu 7 između radijuma (88) i rutherfordijuma (104). Kada bi se zalijepili u sto, bio bi preširok da stane na komad papira ili zidnu kartu. Stoga je uobičajeno postaviti ove elemente na dno tabele.
Periodični sistem je jedan od najvećim otkrićimačovječanstvo, što je omogućilo usmjeravanje znanja o svijetu oko nas i otkrivanje novih hemijskih elemenata. Neophodan je i školarcima, kao i svima koji se zanimaju za hemiju. Osim toga, ova shema je nezamjenjiva u drugim područjima nauke.
Ovaj dijagram sadrži sve poznato čoveku elemenata, a oni su grupisani prema atomska masa i serijski broj
. Ove karakteristike utiču na svojstva elemenata. Ukupno, u kratkoj verziji tabele postoji 8 grupa, elementi uključeni u jednu grupu imaju vrlo slična svojstva. Prva grupa sadrži vodonik, litijum, kalijum, bakar, latinski izgovor na ruskom što je cuprum. A takođe i argentum - srebro, cezijum, zlato - aurum i francijum. Druga grupa sadrži berilijum, magnezijum, kalcijum, cink, zatim stroncijum, kadmijum, barijum, a grupa se završava živom i radijumom.
U treću grupu spadaju bor, aluminijum, skandij, galijum, zatim itrijum, indijum, lantan, a grupa se završava sa talijem i aktinijumom. Četvrta grupa počinje ugljikom, silicijumom, titanijumom, nastavlja se sa germanijumom, cirkonijumom, kositrom, a završava se sa hafnijem, olovom i ruterfordijumom. U petoj grupi nalaze se elementi kao što su azot, fosfor, vanadijum, arsen, niobijum, antimon koji se nalaze ispod, zatim dolazi bizmut tantal i upotpunjuje dubnijsku grupu. Šesti počinje kiseonikom, zatim sumporom, hromom, selenom, zatim molibdenom, telurom, pa volframom, polonijumom i siborgijumom.
U sedmoj grupi, prvi element je fluor, zatim hlor, mangan, brom, tehnecijum, zatim jod, zatim renijum, astat i borij. Poslednja grupa je najbrojniji. Uključuje gasove kao što su helijum, neon, argon, kripton, ksenon i radon. U ovu grupu spadaju i metali gvožđe, kobalt, nikl, rodijum, paladijum, rutenijum, osmijum, iridijum, platina. Slijede hanijum i meitnerijum. Zasebno smješteni elementi koji formiraju serija aktinida i serija lantanida. Imaju slična svojstva kao lantan i aktinijum.

Ova shema uključuje sve vrste elemenata, koji su podijeljeni u 2 velike grupe – metala i nemetala vlasništvo različita svojstva. Kako odrediti pripada li element određenoj grupi, pomoći će uvjetna linija, koja se mora povući od bora do astatina. Treba imati na umu da se takva linija može samo povući puna verzija stolovi. Svi elementi koji se nalaze iznad ove linije i nalaze se u glavnim podgrupama smatraju se nemetalima. A koji su niži, u glavnim podgrupama - metali. Takođe, metali su supstance koje se nalaze u bočne podgrupe. Postoje posebne slike i fotografije na kojima se možete detaljno upoznati sa položajem ovih elemenata. Vrijedi napomenuti da oni elementi koji se nalaze na ovoj liniji pokazuju ista svojstva i metala i nemetala.
Posebnu listu čine i amfoterni elementi, koji imaju dvostruka svojstva i mogu formirati 2 vrste jedinjenja kao rezultat reakcija. Istovremeno se podjednako manifestuju i osnovni i kiselinska svojstva. Prevladavanje određenih svojstava zavisi od uslova reakcije i supstanci sa kojima amfoterni element reaguje.

Treba napomenuti da je ova shema u tradicionalnoj izvedbi dobre kvalitete boja. Gde različite boje radi lakše orijentacije su označene glavne i sekundarne podgrupe. I elementi se grupišu ovisno o sličnosti njihovih svojstava.
Međutim, trenutno je, uz shemu boja, crno-bijeli periodni sustav Mendeljejeva vrlo čest. Ovaj obrazac se koristi za crno-bijelu štampu. Unatoč prividnoj složenosti, rad s njim je jednako zgodan, s obzirom na neke nijanse. Dakle, u ovom slučaju moguće je razlikovati glavnu podgrupu od sekundarne po razlikama u nijansama koje su jasno vidljive. Osim toga, u verziji u boji označeni su elementi s prisustvom elektrona na različitim slojevima različite boje.
Vrijedi napomenuti da u jednobojnom dizajnu nije teško kretati se shemom. Za to će biti dovoljne informacije navedene u svakoj pojedinačnoj ćeliji elementa.

Ispit je danas glavna vrsta testa na kraju škole, što znači da se za njega treba pripremiti Posebna pažnja. Stoga, prilikom odabira završni ispit iz hemije, morate obratiti pažnju na materijale koji mogu pomoći u njegovoj isporuci. Studentima je po pravilu dozvoljeno da tokom ispita koriste neke tablice, a posebno periodni sistem dobra kvaliteta. Stoga, da bi donio samo koristi u testovima, pažnju treba unaprijed obratiti na njegovu strukturu i proučavanje svojstava elemenata, kao i njihov redoslijed. Takođe morate naučiti koristite crno-bijelu verziju tabele tako da se ne suočite sa poteškoćama na ispitu.

Pored glavne tabele koja karakteriše svojstva elemenata i njihovu zavisnost od atomske mase, postoje i druge šeme koje mogu pomoći u proučavanju hemije. Na primjer, postoje tablice rastvorljivosti i elektronegativnosti supstanci. Prvi može odrediti koliko je određeno jedinjenje rastvorljivo u vodi na običnoj temperaturi. U ovom slučaju, anioni se nalaze horizontalno - negativno nabijeni ioni, a kationi, odnosno pozitivno nabijeni ioni, smješteni su okomito. Saznati stepen rastvorljivosti jednog ili drugog jedinjenja, potrebno je pronaći njegove komponente u tabeli. A na mjestu njihovog raskrsnice bit će potrebna oznaka.
Ako je slovo "p", tada je supstanca potpuno rastvorljiva u vodi normalnim uslovima. U prisustvu slova "m" - tvar je slabo rastvorljiva, a u prisustvu slova "n" - gotovo se ne otapa. Ako postoji znak „+“, jedinjenje ne stvara talog i reaguje sa rastvaračem bez ostatka. Ako je prisutan znak "-", to znači da takva supstanca ne postoji. Ponekad možete vidjeti i znak “?” u tabeli, što znači da stepen rastvorljivosti ovog jedinjenja nije pouzdan. Elektronegativnost elemenata može varirati od 1 do 8, postoji i posebna tabela za određivanje ovog parametra.
 Još jedna korisna tablica je serija metalnih aktivnosti. Svi metali se nalaze u njemu povećanjem stepena elektrohemijskog potencijala. Niz stresnih metala počinje litijumom, a završava se zlatom. Vjeruje se da što je metal više lijevo u ovom redu, to je aktivniji u kemijskim reakcijama. Na ovaj način, većina aktivni metal
Litijum se smatra alkalnim metalom. Vodonik je takođe prisutan na kraju liste elemenata. Vjeruje se da su metali koji se nalaze nakon njega praktički neaktivni. Među njima su elementi kao što su bakar, živa, srebro, platina i zlato.
Još jedna korisna tablica je serija metalnih aktivnosti. Svi metali se nalaze u njemu povećanjem stepena elektrohemijskog potencijala. Niz stresnih metala počinje litijumom, a završava se zlatom. Vjeruje se da što je metal više lijevo u ovom redu, to je aktivniji u kemijskim reakcijama. Na ovaj način, većina aktivni metal
Litijum se smatra alkalnim metalom. Vodonik je takođe prisutan na kraju liste elemenata. Vjeruje se da su metali koji se nalaze nakon njega praktički neaktivni. Među njima su elementi kao što su bakar, živa, srebro, platina i zlato.
Slike periodnog sistema u dobrom kvalitetu
Ova šema je jedno od najvećih dostignuća u oblasti hemije. Gde Postoji mnogo vrsta ove tablice.- kratka verzija, duga, kao i ekstra duga. Najčešća je kratka tabela, a uobičajena je i duga verzija šeme. Vrijedi napomenuti da IUPAC trenutno ne preporučuje kratku verziju sheme za upotrebu.
Total was razvijeno je više od stotinu tipova tablica, koji se razlikuju po prezentaciji, obliku i grafičkom prikazu. Koriste se u raznim oblastima nauke, ili se uopšte ne koriste. Trenutno, istraživači nastavljaju da razvijaju nove konfiguracije kola. Kao glavna opcija koristi se kratki ili dugi strujni krug odličnog kvaliteta.
Poznavajući formulaciju periodičnog zakona i koristeći periodični sistem elemenata D. I. Mendeljejeva, može se okarakterisati bilo koji hemijski element i njegova jedinjenja. Pogodno je sabrati takvu karakteristiku hemijskog elementa prema planu.
I. Simbol hemijskog elementa i njegovo ime.
II. Položaj hemijskog elementa u periodični sistem elementi D.I. Mendeljejev:
- serijski broj;
- broj perioda;
- broj grupe;
- podgrupa (glavna ili sekundarna).
III. Struktura atoma hemijskog elementa:
- naboj jezgra atoma;
- relativno atomska masa hemijski element;
- broj protona;
- broj elektrona;
- broj neutrona;
- broj elektronskih nivoa u atomu.
IV. Elektronske i elektronsko-grafske formule atoma, njegovih valentnih elektrona.
V. Vrsta hemijskog elementa (metalni ili nemetalni, s-, p-, d- ili f-element).
VI. Formule višeg oksida i hidroksida nekog hemijskog elementa, karakteristike njihovih svojstava (bazične, kisele ili amfoterne).
VII. Poređenje metalnih ili nemetalnih svojstava hemijskog elementa sa svojstvima susjednih elemenata po periodu i podgrupi.
VIII. Maksimalno i minimalno oksidaciono stanje atoma.
Na primjer, dajmo karakteristiku hemijskog elementa sa serijskim brojem 15 i njegovih spojeva prema položaju u periodičnom sistemu elemenata D. I. Mendeljejeva i strukturi atoma.
I. U tabeli D. I. Mendeljejeva nalazimo ćeliju sa brojem hemijskog elementa, zapisati njegov simbol i ime.
Hemijski element broj 15 je fosfor. Njegov simbol je R.
II. Okarakterizirajmo položaj elementa u tabeli D. I. Mendeljejeva (broj perioda, grupa, tip podgrupe).
Fosfor je u glavnoj podgrupi grupe V, u 3. periodu.
III. Dajemo opšti opis sastava atoma hemijskog elementa (nuklearni naboj, atomska masa, broj protona, neutrona, elektrona i elektronski nivoi).
Nuklearni naboj atoma fosfora je +15. Relativna atomska masa fosfora je 31. Jezgro atoma sadrži 15 protona i 16 neutrona (31 - 15 = 16). Atom fosfora ima tri energetska nivoa sa 15 elektrona.
IV. Sastavljamo elektronske i elektronsko-grafske formule atoma, označavamo njegove valentne elektrone.
Elektronska formula atoma fosfora je: 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 .
Elektronografska formula vanjskog nivoa atoma fosfora: na trećem energetskom nivou nalaze se dva elektrona na 3s podnivou (dvije strelice suprotnog smjera su upisane u jednoj ćeliji), tri elektrona su na tri p- podnivo (po jedan u svakoj od tri ćelije ispisane su strelice koje pokazuju u istom smjeru).
Valentni elektroni su elektroni spoljašnjeg nivoa, tj. 3s2 3p3 elektrona.
V. Odredite vrstu hemijskog elementa (metalni ili nemetalni, s-, p-, d- ili f-element).
Fosfor je nemetal. Budući da je posljednji podnivo u atomu fosfora, koji je ispunjen elektronima, p-podnivo, fosfor pripada porodici p-elemenata.
VI. Izrađujemo formule za viši oksid i hidroksid fosfora i karakteriziramo njihova svojstva (bazna, kisela ili amfoterna).
Najveći fosfor oksid P 2 O 5 pokazuje svojstva kiselog oksida. Hidroksid koji odgovara višem oksidu, H 3 PO 4 , pokazuje svojstva kiseline. Ova svojstva potvrđujemo jednadžbama tipova hemijskih reakcija:
P 2 O 5 + 3 Na 2 O \u003d 2Na 3 PO 4
H 3 PO 4 + 3NaOH \u003d Na 3 PO 4 + 3H 2 O
VII. Uporedimo nemetalna svojstva fosfora sa svojstvima susjednih elemenata po periodu i podgrupi.
Susjed fosfora u podgrupi je dušik. Susjedi fosfora u tom periodu su silicijum i sumpor. Nemetalna svojstva atoma hemijskih elemenata glavnih podgrupa sa povećanjem serijskog broja rastu u periodima i opadaju u grupama. Stoga su nemetalne osobine fosfora izraženije od onih silicijuma i manje od onih azota i sumpora.
VIII. Odredite maksimalno i minimalno stanje oksidacije atoma fosfora.
Maksimum pozitivan stepen oksidacija za hemijske elemente glavnih podgrupa jednaka je broju grupe. Fosfor je u glavnoj podgrupi pete grupe, pa je maksimalno oksidaciono stanje fosfora +5.
Minimalno oksidaciono stanje za nemetale u većini slučajeva je jednako razlici između broja grupe i broja osam. Dakle, minimalno oksidaciono stanje fosfora je -3.
PERIODIČNA TABLICA MENDELEEVA
Konstrukcija Mendeljejevljevog periodnog sistema hemijskih elemenata odgovara karakterističnim periodima teorije brojeva i ortogonalnih baza. Dopunjavanjem Hadamardovih matrica matricama parnog i neparnog reda stvara se strukturna osnova ugniježđenih matričnih elemenata: matrice prvog (Odin), drugog (Euler), trećeg (Mersenne), četvrtog (Hadamard) i petog (Fermat) reda.
Lako je vidjeti da su redovi veličine 4 k Hadamardove matrice odgovaraju inertnim elementima sa atomskom masom koja je višestruka od četiri: helijum 4, neon 20, argon 40 (39.948) itd., ali i temelji života i digitalne tehnologije: ugljenik 12, kiseonik 16, silicijum 28 , germanijum 72.
Čini se da sa Mersenovim matricama reda 4 k-1, naprotiv, sve je aktivno, otrovno, destruktivno i korozivno povezano. Ali to su i radioaktivni elementi - izvori energije, i olovo 207 (krajnji proizvod, otrovne soli). Fluor je, naravno, 19. Redovi Mersenne matrice odgovaraju nizu radioaktivnih elemenata koji se zove aktinijumski niz: uranijum 235, plutonijum 239 (izotop koji je moćniji izvor atomske energije od uranijuma) itd. to je isto alkalni metali litijum 7, natrijum 23 i kalijum 39.

Galijum - atomska težina 68
Narudžbe 4 k–2 Eulerove matrice (dvostruki Mersenne) odgovara dušiku 14 (atmosferska baza). Kuhinjska so formirana je od dva "mersenne" atoma natrijuma 23 i hlora 35, zajedno ova kombinacija je tipična, samo za Eulerove matrice. Masivniji hlor s težinom od 35,4 malo je manji od Adamardove dimenzije od 36. Kristali obične soli: kocka (! tj. krotki karakter, Hadamars) i oktaedar (prkosniji, ovo je nesumnjivo Euler).
AT atomska fizika prelaz gvožđe 56 - nikl 59, ovo je granica između elemenata koji daju energiju tokom sinteze većeg jezgra ( H-bomba) i raspadanje (uranijum). Red 58 je poznat po tome što za njega ne postoje samo analozi Adamardovih matrica u obliku Belevichovih matrica sa nulama na dijagonali, za njega nema ni mnogo ponderisanih matrica - najbliža ortogonalna W(58,53) ima 5 nula u svakoj koloni i redu (duboka praznina).
U nizu koji odgovara Fermaovim matricama i njihovim supstitucijama redova 4 k+1, kosta 257 fermija voljom sudbine.Ne mozes nista reci tacan pogodak. Evo zlata 197. Bakar 64 (63.547) i srebro 108 (107.868), simboli elektronike, očigledno ne dostižu zlato i odgovaraju skromnijim Adamardovim matricama. Bakar, čija je atomska težina nedaleko od 63, hemijski je aktivan – poznati su njegovi zeleni oksidi.

Kristali bora pod velikim uvećanjem
OD zlatni omjer bor je povezan - atomska masa među svim ostalim elementima je najbliža 10 (tačnije, 10,8, blizina atomske težine neparnim brojevima također utječe). Bor je prilično složen element. Bohr igra zbunjujuću ulogu u istoriji samog života. Okvirna struktura u njegovim strukturama je mnogo složenija nego u dijamantu. Jedinstvena vrsta hemijske veze koja omogućava boru da apsorbuje bilo koju nečistoću je vrlo slabo shvaćena, iako istraživanja povezana s njom veliki broj naučnici su već dobili Nobelove nagrade. Oblik kristala bora je ikosaedar, pet trouglova čine vrh.
Platinum Mystery. Peti element su, bez sumnje, plemeniti metali poput zlata. Ovjes preko Adamardove dimenzije 4 k, za 1 veliku.

Stabilni izotop uranijum 238
Podsjetimo, međutim, da su Fermatovi brojevi rijetki (najbliži je 257). Kristali prirodnog zlata imaju oblik blizak kocki, ali pentagram također blista. Njegov najbliži susjed, platina, plemeniti metal, udaljena je manje od 4 puta manje atomske težine od zlata 197. Platina ima atomsku težinu ne 193, već nešto povećanu, 194 (red Ojlerovih matrica). Sitnica, ali je dovodi u tabor još nekoliko agresivnijih elemenata. Vrijedi zapamtiti, zbog svoje inertnosti (otapa se, možda, u aqua regia), platina se koristi kao aktivni katalizator hemijski procesi.
Spužvasta platina pali vodonik na sobnoj temperaturi. Priroda platine nije nimalo mirna, iridijum 192 se ponaša tiše (mješavina izotopa 191 i 193). Više je nalik bakru, ali sa težinom i karakterom zlata.
Između neona 20 i natrijuma 23 ne postoji element sa atomskom težinom od 22. Naravno, atomske težine su integralna karakteristika. Ali među izotopima, zauzvrat, postoji i čudna korelacija svojstava sa svojstvima brojeva i odgovarajućih matrica ortogonalnih baza. As nuklearno gorivo najveća primena ima izotop uranijum 235 (Mersenneov matrični red), u kojem je moguća samoodrživa nuklearna lančana reakcija. U prirodi se ovaj element javlja u stabilnom obliku uranijuma 238 (red Ojlerovih matrica). Ne postoji element sa atomskom težinom od 13. Što se tiče haosa, ograničen broj stabilnih elemenata periodnog sistema i teškoća pronalaženja matrica visokog nivoa zbog barijere koja se vidi u matricama trinaestog reda su u korelaciji.

Izotopi hemijskih elemenata, ostrvo stabilnosti