एल्डिहाइड और उनके रासायनिक गुण
एल्डिहाइड वे कार्बनिक पदार्थ होते हैं जिनके अणुओं में एक कार्बोनिल समूह होता है जो कम से कम एक हाइड्रोजन परमाणु और एक हाइड्रोकार्बन रेडिकल से बंधा होता है।
एल्डिहाइड के रासायनिक गुण कार्बोनिल समूह की उपस्थिति से उनके अणु में पूर्व निर्धारित होते हैं। इस संबंध में, कार्बोनिल समूह के अणु में अतिरिक्त प्रतिक्रियाएं देखी जा सकती हैं।
इसलिए, उदाहरण के लिए, यदि आप एक गर्म निकल उत्प्रेरक के ऊपर हाइड्रोजन के साथ फॉर्मलाडेहाइड वाष्प लेते हैं और पास करते हैं, तो हाइड्रोजन जोड़ा जाएगा और फॉर्मलाडेहाइड मिथाइल अल्कोहल में कम हो जाएगा। इसके अलावा, इस बंधन की ध्रुवीय प्रकृति भी एल्डिहाइड की ऐसी प्रतिक्रिया को जन्म देती है जैसे पानी में मिलाना।
और अब आइए पानी मिलाने से होने वाली प्रतिक्रियाओं की सभी विशेषताओं को देखें। यह ध्यान दिया जाना चाहिए कि कार्बोनिल समूह के कार्बन परमाणु में एक हाइड्रॉक्सिल समूह जोड़ा जाता है, जो ऑक्सीजन परमाणु के इलेक्ट्रॉन जोड़े के कारण आंशिक सकारात्मक चार्ज करता है।

इस जोड़ के साथ, निम्नलिखित प्रतिक्रियाएं विशेषता हैं:
सबसे पहले, हाइड्रोजनीकरण होता है और प्राथमिक अल्कोहल RCH2OH बनते हैं।
दूसरे, एल्कोहल मिलाए जाते हैं और हेमीएसेटल R-CH (OH) - OR बनते हैं। और हाइड्रोजन क्लोराइड एचसीएल की उपस्थिति में, जो उत्प्रेरक के रूप में कार्य करता है, और शराब की अधिकता के साथ, हम एसिटल आरसीएच (OR) 2 के गठन का निरीक्षण करते हैं;
तीसरा, सोडियम हाइड्रोसल्फाइट NaHSO3 जोड़ा जाता है और हाइड्रोसल्फाइट एल्डिहाइड के डेरिवेटिव बनते हैं। एल्डिहाइड के ऑक्सीकरण के दौरान, सिल्वर (I) ऑक्साइड के अमोनिया घोल और कॉपर (II) हाइड्रॉक्साइड के साथ बातचीत और कार्बोक्जिलिक एसिड के निर्माण जैसी विशेष प्रतिक्रियाएं देखी जा सकती हैं।
एल्डिहाइड के पोलीमराइजेशन को रैखिक और चक्रीय पोलीमराइजेशन जैसी विशेष प्रतिक्रियाओं की विशेषता है।
अगर हम एल्डिहाइड के रासायनिक गुणों के बारे में बात करते हैं, तो हमें ऑक्सीकरण प्रतिक्रिया का भी उल्लेख करना चाहिए। ऐसी प्रतिक्रियाओं में "सिल्वर मिरर" प्रतिक्रिया और ट्रैफिक लाइट प्रतिक्रिया शामिल हैं।
आप कक्षा में एक दिलचस्प प्रयोग करके "चांदी के दर्पण" की असामान्य प्रतिक्रिया देख सकते हैं। ऐसा करने के लिए, आपको एक साफ धुली हुई परखनली चाहिए, जिसमें आपको सिल्वर ऑक्साइड के अमोनिया घोल के कुछ मिलीलीटर डालना चाहिए, और फिर उसमें फॉर्मेलिन की चार या पाँच बूंदें मिलाएँ। इस प्रयोग का अगला चरण टेस्ट ट्यूब को एक गिलास गर्म पानी में रखना है और फिर आप देख सकते हैं कि टेस्ट ट्यूब की दीवारों पर एक चमकदार परत कैसे दिखाई देती है। यह परिणामी कोटिंग धात्विक चांदी का एक अवक्षेप है।

और यहाँ तथाकथित "ट्रैफिक लाइट" प्रतिक्रिया है:

एल्डिहाइड के भौतिक गुण
आइए अब एल्डिहाइड के भौतिक गुणों को देखना शुरू करते हैं। इन पदार्थों में क्या गुण हैं? यह ध्यान दिया जाना चाहिए कि कई सरल एल्डिहाइड एक रंगहीन गैस हैं, अधिक जटिल एक तरल के रूप में हैं, लेकिन उच्च एल्डिहाइड ठोस हैं। एल्डिहाइड का आणविक भार जितना अधिक होगा, क्वथनांक उतना ही अधिक होगा। इसलिए, उदाहरण के लिए, प्रोपियोनाल्डिहाइड 48.8 डिग्री पर क्वथनांक तक पहुंचता है, लेकिन प्रोपाइल अल्कोहल 97.8 0C पर उबलता है।
अगर हम एल्डिहाइड के घनत्व के बारे में बात करते हैं, तो यह एकता से कम है। उदाहरण के लिए, एसिटिक और फॉर्मिक एल्डिहाइड पानी में अच्छी तरह से घुल जाते हैं, जबकि अधिक जटिल एल्डिहाइड में घुलने की कमजोर क्षमता होती है।
एल्डिहाइड, जो निम्नतम श्रेणी से संबंधित हैं, में तेज और अप्रिय गंध होती है, जबकि पानी में ठोस और अघुलनशील, इसके विपरीत, एक सुखद पुष्प गंध की विशेषता होती है।
प्रकृति में एल्डिहाइड ढूँढना
प्रकृति में, एल्डिहाइड के विभिन्न समूहों के प्रतिनिधि हर जगह पाए जाते हैं। ये पौधों के हरे भागों में मौजूद होते हैं। यह एल्डिहाइड के सबसे सरल समूहों में से एक है, जिसमें फॉर्मिक एल्डिहाइड CH2O शामिल है।
अधिक जटिल संरचना वाले एल्डिहाइड भी हैं। इन प्रकारों में वैनिलिन या अंगूर चीनी शामिल हैं।
लेकिन चूंकि एल्डिहाइड में सभी प्रकार की अंतःक्रियाओं में आसानी से प्रवेश करने की क्षमता होती है, ऑक्सीकरण और कम करने की प्रवृत्ति होती है, इसलिए यह विश्वास के साथ कहा जा सकता है कि एल्डिहाइड विभिन्न प्रतिक्रियाओं में बहुत सक्षम हैं और इसलिए वे अपने शुद्ध रूप में अत्यंत दुर्लभ हैं। लेकिन उनके व्युत्पन्न पौधे और पशु पर्यावरण दोनों में हर जगह पाए जा सकते हैं।

एल्डिहाइड का अनुप्रयोग
एल्डिहाइड समूह कई प्राकृतिक पदार्थों में मौजूद है। कम से कम उनमें से कई के लिए उनकी विशिष्ट विशेषता गंध है। इसलिए, उदाहरण के लिए, उच्च एल्डिहाइड के प्रतिनिधियों में अलग-अलग सुगंध होती है और वे आवश्यक तेलों का हिस्सा होते हैं। खैर, जैसा कि आप पहले से ही जानते हैं, ऐसे तेल फूलों, मसालेदार और सुगंधित पौधों, फलों और फलों में मौजूद होते हैं। उन्होंने औद्योगिक वस्तुओं के निर्माण और इत्र के निर्माण में बड़े पैमाने पर उपयोग पाया है।
एलिफैटिक एल्डिहाइड CH3(CH2)7C(H)=O साइट्रस आवश्यक तेलों में पाया जा सकता है। इस तरह के एल्डिहाइड में नारंगी की गंध होती है, और खाद्य उद्योग में एक स्वाद देने वाले एजेंट के साथ-साथ सौंदर्य प्रसाधन, इत्र और घरेलू रसायनों में सुगंध के रूप में उपयोग किया जाता है।
फॉर्मिक एल्डिहाइड एक रंगहीन गैस है जिसमें तीखी, विशिष्ट गंध होती है और यह पानी में आसानी से घुलनशील होती है। फॉर्मलडिहाइड के ऐसे जलीय घोल को फॉर्मेलिन भी कहा जाता है। फॉर्मलडिहाइड बहुत विषैला होता है, लेकिन दवा में इसका उपयोग पतला रूप में कीटाणुनाशक के रूप में किया जाता है। इसका उपयोग उपकरणों को कीटाणुरहित करने के लिए किया जाता है, और इसके कमजोर घोल का उपयोग त्वचा को भारी पसीने से धोने के लिए किया जाता है।
इसके अलावा, फॉर्मलाडेहाइड का उपयोग चमड़े की कमाना में किया जाता है, क्योंकि इसमें चमड़े में मौजूद प्रोटीन पदार्थों के साथ संयोजन करने की क्षमता होती है।
कृषि में, फॉर्मलाडेहाइड ने बुवाई से पहले अनाज के प्रसंस्करण में खुद को साबित कर दिया है। इसका उपयोग प्लास्टिक के उत्पादन के लिए किया जाता है, जो प्रौद्योगिकी और घरेलू जरूरतों के लिए बहुत जरूरी है।
एसिटिक एल्डिहाइड एक रंगहीन तरल है जिसमें सड़े हुए सेब की गंध होती है और यह पानी में आसानी से घुलनशील होता है। इसका उपयोग एसिटिक एसिड और अन्य पदार्थों के उत्पादन के लिए किया जाता है। लेकिन चूंकि यह एक विषैला पदार्थ है, इसलिए यह शरीर में विषाक्तता या आंखों और श्वसन तंत्र के श्लेष्मा झिल्ली की सूजन का कारण बन सकता है।
जैविक दवाएं
हम रासायनिक वर्गीकरण के अनुसार समूहों में विभाजित दवाओं का अध्ययन करते हैं। इस वर्गीकरण का लाभ एक समूह बनाने वाली दवाओं को प्राप्त करने के तरीकों के विकास में सामान्य पैटर्न की पहचान और अध्ययन करने की क्षमता है, पदार्थों के भौतिक और रासायनिक गुणों के आधार पर दवा विश्लेषण के तरीके, रासायनिक संरचना के बीच संबंध स्थापित करना और औषधीय क्रिया।
सभी दवाओं को अकार्बनिक और जैविक में विभाजित किया गया है। अकार्बनिक, बदले में, पीएस में तत्वों की स्थिति के अनुसार वर्गीकृत होते हैं। और कार्बनिक लोगों को स्निग्ध, एलिसिक्लिक, सुगंधित और हेट्रोसायक्लिक श्रृंखला के डेरिवेटिव में विभाजित किया जाता है, जिनमें से प्रत्येक को वर्गों में विभाजित किया जाता है: हाइड्रोकार्बन, हाइड्रोकार्बन के हलोजन डेरिवेटिव, अल्कोहल, एल्डिहाइड, कीटोन, एसिड, ईथर, सरल और जटिल, आदि।
एचपी के रूप में एलिफैटिक यौगिक।
एल्डिहाइड और उनके डेरिवेटिव की तैयारी। कार्बोहाइड्रेट
एल्डीहाइड
यौगिकों के इस समूह में एल्डिहाइड समूह, या उनके कार्यात्मक डेरिवेटिव युक्त कार्बनिक औषधीय पदार्थ शामिल हैं।
सामान्य सूत्र:
औषधीय गुण
एक कार्बनिक यौगिक की संरचना में एक एल्डिहाइड समूह का परिचय इसे एक मादक और एंटीसेप्टिक प्रभाव देता है। इसमें ऐल्डिहाइड की क्रिया ऐल्कोहॉल की क्रिया के समान होती है। लेकिन अल्कोहल के विपरीत, एल्डिहाइड समूह यौगिक की विषाक्तता को बढ़ाता है।
औषधीय क्रिया पर संरचना को प्रभावित करने वाले कारक :
अल्काइल रेडिकल के बढ़ाव से गतिविधि बढ़ जाती है, लेकिन साथ ही विषाक्तता बढ़ जाती है;
एक असंतृप्त बंधन और हैलोजन की शुरूआत का एक ही प्रभाव होता है;
एल्डिहाइड के हाइड्रेटेड रूप के गठन से विषाक्तता में कमी आती है। लेकिन एक स्थिर हाइड्रेटेड रूप बनाने की क्षमता केवल एल्डिहाइड के क्लोरीन डेरिवेटिव में प्रकट होती है। तो, फॉर्मलाडेहाइड एक प्रोटोप्लाज्मिक जहर है, इसका उपयोग कीटाणुशोधन के लिए किया जाता है, एसिटालडिहाइड और क्लोरल का उपयोग उनकी उच्च विषाक्तता के कारण दवा में नहीं किया जाता है, और क्लोरल हाइड्रेट एक कृत्रिम निद्रावस्था, शामक के रूप में उपयोग की जाने वाली दवा है।
मादक (औषधीय) क्रिया और विषाक्तता की ताकत फॉर्मलाडेहाइड से एसीटैल्डिहाइड और क्लोरल तक बढ़ गई। एक हाइड्रेटेड फॉर्म (क्लोरल हाइड्रेट) का गठन औषधीय प्रभाव को बनाए रखते हुए, विषाक्तता को नाटकीय रूप से कम कर सकता है।
शारीरिक स्थिति सेएल्डिहाइड हो सकते हैं गैसीय (कम आणविक भार), तरल पदार्थ और ठोस. कम आणविक भार में एक तेज अप्रिय गंध, उच्च आणविक भार - एक सुखद पुष्प होता है।
रासायनिक गुण
रासायनिक शब्दों में, ये अत्यधिक प्रतिक्रियाशील पदार्थ हैं, उनके अणु में कार्बोनिल समूह की उपस्थिति के कारण।
एल्डिहाइड की उच्च प्रतिक्रियाशीलता द्वारा समझाया गया है:
ए) एक ध्रुवीकृत दोहरे बंधन की उपस्थिति
b) कार्बोनिल का द्विध्रुव आघूर्ण
c) कार्बोनिल के कार्बन परमाणु पर आंशिक धनात्मक आवेश की उपस्थिति
σ -
σ + एच
दो कार्बन के बीच दोहरे बंधन के विपरीत, C और O के बीच का दोहरा बंधन दृढ़ता से ध्रुवीकृत होता है, क्योंकि ऑक्सीजन में कार्बन की तुलना में बहुत अधिक विद्युतीयता होती है, और बंधन का इलेक्ट्रॉन घनत्व ऑक्सीजन की ओर स्थानांतरित हो जाता है। इस तरह का एक उच्च ध्रुवीकरण कार्बोनिल समूह कार्बन के इलेक्ट्रोफिलिक गुणों और न्यूक्लियोफिलिक यौगिकों के साथ प्रतिक्रिया करने की क्षमता (न्यूक्लियोफिलिक जोड़ प्रतिक्रियाओं में प्रवेश करने के लिए) निर्धारित करता है। समूह के ऑक्सीजन में न्यूक्लियोफिलिक गुण होते हैं।
ऑक्सीकरण और न्यूक्लियोफिलिक जोड़ प्रतिक्रियाएं विशेषता हैं
I. ऑक्सीकरण प्रतिक्रियाएं।
एल्डीहाइडसरलता ऑक्सीकृत होते हैं. ऐल्डिहाइडों का अम्लों में ऑक्सीकरणप्रभाव में होता है कितने मज़बूतऔर कमजोर ऑक्सीकरण एजेंट .
कई धातुएँ - चाँदी, पारा, बिस्मथ, तांबा - अपने लवण के घोल से कम हो जाती हैं, खासकर क्षार की उपस्थिति में। यह एल्डिहाइड को ऑक्सीकरण में सक्षम अन्य कार्बनिक यौगिकों से अलग करता है - अल्कोहल, असंतृप्त यौगिक, जिसके ऑक्सीकरण के लिए मजबूत ऑक्सीकरण एजेंटों की आवश्यकता होती है। इसलिए, क्षारीय माध्यम में पारा, तांबा, चांदी के जटिल धनायनों के साथ एल्डिहाइड की ऑक्सीकरण प्रतिक्रियाओं का उपयोग एल्डिहाइड की प्रामाणिकता को साबित करने के लिए किया जा सकता है।
मैं। 1 .प्रतिक्रियासिल्वर नाइट्रेट के अमोनिया विलयन के साथ (सिल्वर मिरर रिएक्शन) FS द्वारा एल्डिहाइड समूह वाले पदार्थों को प्रमाणित करने के लिए अनुशंसित किया जाता है। यह एल्डिहाइड के एसिड में ऑक्सीकरण और Ag + से Ag↓ में कमी पर आधारित है।
AgNO 3 + 2NH 4 OH → NO 3 + 2H 2 O
एनएसओएन+ 2एनओ 3 + एच 2 ओ → हकूनह 4 + 2Ag↓+ 2NH 4 NO 3 + NH 3
फॉर्मेल्डिहाइड, फॉर्मिक एसिड के अमोनियम नमक के लिए ऑक्सीकृत, धातु चांदी में कम हो जाता है, जो जमा होता हैपरखनली की दीवारों पर शानदार पट्टिका "दर्पण" या ग्रे तलछट।

मैं। 2. प्रतिक्रियाफेलिंग के अभिकर्मक के साथ (तांबे का जटिल यौगिक (II) टैटरिक एसिड के पोटेशियम-सोडियम नमक के साथ)। एल्डिहाइड कॉपर (II) यौगिक को कॉपर (I) ऑक्साइड में अपचित करते हैं, एक ईंट-लाल अवक्षेप बनता है।उपयोग से पहले तैयार)।
फेलिंग अभिकर्मक 1 - CuSO 4 विलयन
फेलिंग का अभिकर्मक 2 - टार्टरिक एसिड के पोटेशियम-सोडियम नमक का एक क्षारीय घोल
1:1 फेलिंग अभिकर्मकों को मिलाते समय 1 और 2 एक नीला तांबे का जटिल यौगिक बनता है (द्वितीय) टैटरिक एसिड के पोटेशियम-सोडियम नमक के साथ:

नीला धुंधला
जब एल्डिहाइड मिलाया जाता है और गर्म किया जाता है, तो अभिकर्मक का नीला रंग गायब हो जाता है, एक मध्यवर्ती उत्पाद बनता है - कॉपर (I) हाइड्रॉक्साइड का एक पीला अवक्षेप, जो तुरंत कॉपर (I) ऑक्साइड और पानी के लाल अवक्षेप में विघटित हो जाता है।
2केएनए+ आर- सीओएच+2NaOH+ 2KOH→ आर- कूना+4KNaC4H4O6 + 2 CuOH ↓ +H2O
2 CuOH ↓ →घन 2 हे ↓ + H2O
पीला अवक्षेप ईंट लाल अवक्षेप

पाठ्यपुस्तकों की एक अलग सामान्य प्रतिक्रिया योजना होती है
मैं। 3. प्रतिक्रियानेस्लर के अभिकर्मक के साथ (टेट्राआयोडोमेरक्यूरेट (II) पोटैशियम का क्षारीय घोल)। फॉर्मलडिहाइड पारा आयन को धात्विक पारा में कम कर देता है - एक गहरे भूरे रंग का अवक्षेप।
R-COH + K 2 +3KOH → R-COOK + 4KI + एचजी↓ + 2H2O
वैसे भी एल्डिहाइड क्या हैं? इस प्रश्न का उत्तर उतना सरल नहीं है जितना पहली नज़र में लग सकता है। इस बारे में एक अनुभवी इत्र प्रेमी से पूछें - सबसे अधिक संभावना है कि वह आपको सिंथेटिक सामग्री के बारे में एक अवर्णनीय गंध के बारे में बताएगा जिसने सुगंध को इतना असामान्य, अमूर्त और अभिनव बना दिया।
एक रसायनज्ञ या यहां तक कि एक सामान्य ग्यारहवें ग्रेडर जो नियमित रूप से रसायन विज्ञान की कक्षाओं में भाग लेते हैं, वे भी ज्यादा नहीं सोचेंगे और कहेंगे कि एल्डिहाइड कार्बनिक यौगिकों का एक वर्ग है जिसमें एक समूह होता है। -चो, जिसे एल्डिहाइड समूह कहा जाता है। सभी एल्डिहाइड में सामान्य रासायनिक गुण होते हैं, जैसे कि संबंधित एसिड बनाने के लिए आसानी से ऑक्सीकृत हो जाना। यह चांदी के दर्पण की प्रतिक्रिया का आधार है - याद रखें जब परखनली को गर्म किया जाता है और कांच की सतह पर एक चमकदार धातु की परत दिखाई देती है। जर्मन रसायनज्ञ यूस्टेस वॉन लिबिग द्वारा गढ़ा गया शब्द "एल्डिहाइड", एक संक्षिप्त है अल्कोहल डिहाइड्रोजनटम,जिसका मतलब है " हाइड्रोजन के बिना शराब».
एल्डिहाइड के तुच्छ नामों में अक्सर* (फुटनोट देखें) या तो "एल्डिहाइड" शब्द ही मौजूद है, या प्रत्यय अल , उदाहरण के लिए, "डंपलिंग एल्डिहाइड", "ज़ाबल्डिहाइड", "पोकरगल"। वैनिलिन और हेलियोट्रोपिन जैसे पदार्थ भी रासायनिक दृष्टिकोण से एल्डिहाइड हैं। सामान्य तौर पर, परफ्यूमर के पास अपने शस्त्रागार में पूरी तरह से अलग गंध के साथ बड़ी मात्रा में एल्डिहाइड होता है: खरबूजाखरबूजे की तरह खुशबू आ रही है अडोक्सालसमुद्र और अंडे की सफेदी की महक, सिट्रोनेललाल- एक प्रकार का पौधा, लिराल- कामुदिनी ट्रिपल- हरी घास। साइक्लेमेनल्डिहाइड, सिनामाल्डिहाइड, ऐनीज़, क्यूमिक, कीनू हैं।
ठीक है, आप पूछते हैं, चैनल का इससे क्या लेना-देना है? यदि इतने सारे एल्डिहाइड हैं और वे सभी अलग-अलग गंध लेते हैं, तो यह "एल्डिहाइड नोट" क्या है, इसकी गंध कैसी होती है और चैनल नंबर 5 में कौन से विशिष्ट एल्डिहाइड शामिल हैं? खर्म्स के "पुश्किन के जीवन के उपाख्यानों" को याद करें: "पुश्किन को ज़ुकोवस्की से प्यार हो गया और उन्होंने उसे दोस्ताना तरीके से ज़ुकोव कहना शुरू कर दिया"? जिसे परफ्यूमर्स अक्सर मैत्रीपूर्ण तरीके से केवल एल्डिहाइड कहते हैं, वास्तव में, एक उप-प्रजाति और एक विशेष मामला: संतृप्त स्निग्ध या तथाकथित फैटी एल्डिहाइड। उनका नाम आमतौर पर अणु में कार्बन परमाणुओं की संख्या के आधार पर रखा जाता है। "एल्डिहाइड सी-7" पर, या हेप्टानल, - सात कार्बन परमाणु, "एल्डिहाइड सी-10" में, डीन का, जैसा कि आप अनुमान लगा सकते हैं, दस।
चैनल नंबर 5 में एल्डिहाइड का मिश्रण होता है " सी-11 अण्डाकार"या "एस-110"(अंडेनाल) , "सी-11 अण्डाकार"(10-अनैतिक) और एस 12(डोडेकैनाल)। यह ध्यान देने योग्य है कि एल्डिहाइड इस पौराणिक सुगंध की उपस्थिति से बहुत पहले इत्र की संरचना में दिखाई देते थे [ चैनल नंबर 5 1921 में जारी किया गया था]. परफ्यूमरी के कई इतिहासकार इस बात से सहमत हैं कि एल्डिहाइड का उपयोग पहली बार 1905 के इसके पुन: जारी करने के लिए किया गया था, जिसे परफ्यूमर पियरे आर्मिगेंट द्वारा बनाया गया था। मॉस्को फैक्ट्री अल्फोंस रैलेट एंड कंपनी द्वारा (1912) और बाउक्वेट डी कैथरीन (1913) दोनों में एल्डिहाइड हैं, चैनल नंबर 5 की तरह, परफ्यूमर अर्नेस्ट बो (वैसे, एक देशी मस्कोवाइट) द्वारा बनाया गया है। लेकिन यह चैनल था जो निस्संदेह सभी समय और लोगों की मुख्य एल्डिहाइड सुगंध बन गया, जिसने बड़ी संख्या में नकल और प्रतियों को जन्म दिया।

फैटी एल्डिहाइड एक विशिष्ट मोमी गंध से एकजुट होते हैं, एक बुझी हुई मोमबत्ती की गंध के समान (वास्तव में, यह मोमबत्ती की गंध फैटी एल्डिहाइड, पैराफिन के अधूरे दहन के उत्पादों के कारण होती है)। फैटी एल्डिहाइड की गंध बहुत तीव्र और तेज होती है, 1% या उससे कम पतला होने पर यह सुखद हो जाती है। डिकानल (C-10) की गंध में उत्साह का संकेत होता है, एल्डिहाइड C-12 की गंध में लिली और वायलेट की बारीकियां होती हैं। सरल एल्डिहाइड, फॉर्मलाडेहाइड और एसीटैल्डिहाइड में, गंध बेहद तेज और अप्रिय होती है (फिर भी, एसिटालडिहाइड का उपयोग फ्लेवरिस्ट द्वारा किया जाता है और कुछ स्वाद योजक में शामिल होता है), हेक्सानल (सी -6 एल्डिहाइड) में कोई पहले से ही अपेक्षाकृत सुखद हरे रंग को अलग कर सकता है। और सेब पहलू। फैटी एल्डिहाइड, जिसमें श्रृंखला में 15 या अधिक कार्बन परमाणु होते हैं, पहले से ही लगभग गंधहीन होते हैं।
फैटी एल्डिहाइड की गंध में एक और आम संपत्ति है - एक निश्चित "साबुनपन"। एल्डिहाइड लंबे समय से साबुन की सुगंध के लिए सक्रिय रूप से उनकी कम लागत, गंध की तीव्रता और अप्रिय साबुन आधार गंध को अच्छी तरह से मुखौटा करने की क्षमता के कारण सक्रिय रूप से उपयोग किया जाता है। अक्सर एल्डिहाइड की गंध अमूर्त सफाई या ताजे लोहे के कपड़े धोने की भावना से जुड़ी होती है।

विशेष ध्यान देने योग्य एक और महत्वपूर्ण बात यह है कि एल्डिहाइड कुछ कृत्रिम नहीं है, मानव श्रम का परिणाम है। उनमें से कई व्यापक रूप से प्रकृति में पाए जाते हैं। Decanal, उदाहरण के लिए, खट्टे फलों के आवश्यक तेलों (नारंगी में 4% तक!), शंकुधारी और कई फूलों के पौधों में पाया जाता है, और धनिया के आवश्यक तेल में इसकी बहुत अधिक मात्रा होती है। असंतृप्त स्निग्ध एल्डिहाइड भी प्रकृति में सर्वव्यापी हैं, उनके पास और भी अधिक तीव्र गंध है, उदाहरण के लिए, (ई) -2-डिसेनल सीताफल की विशिष्ट गंध के लिए जिम्मेदार है, यह वास्तव में अक्सर बेडबग्स के "रासायनिक हथियारों" में मौजूद होता है, और एपॉक्सी व्युत्पन्न, ट्रांस -4, 5-एपॉक्सी- (ई) -2-डिसेनल, रक्त की विशिष्ट गंध का कारण बनता है, जो इसे एक स्पष्ट धातु पहलू देता है। इस पदार्थ की गंध से ही शिकारी अपने शिकार का पता लगाते हैं।
पहली पुष्प-एल्डिहाइड सुगंध की सफलता के मद्देनजर, रसायनज्ञों ने समान घ्राण गुणों वाली नई सामग्रियों को संश्लेषित करने के लिए अथक प्रयास किया। 1905 में, फ्रांसीसी ई.ई. ब्लेज़ और एल. हुइलन (बुल.सोक.चिम.फ्र. 1905, 33, 928) ने गामा-अंडेकैलैक्टोन को संश्लेषित किया, थोड़ी देर बाद, 1908 में, दो रूसी रसायनज्ञों ए.ए. ज़ुकोव और पी.आई. शेस्ताकोव (ZhRHO 40, 830, 1908)। इस यौगिक में एक दिलचस्प सुगंध थी, जो धूप में गर्म पके आड़ू की गंध की याद दिलाती है - फल, मोमी और कुछ हद तक नारियल-मलाईदार।
निर्माताओं ने इस पदार्थ को "एल्डिहाइड सी -14" नाम से बेचने का फैसला किया ताकि एक तरफ नए "एल्डिहाइड्स विद नंबर्स" के लिए परफ्यूमर्स की प्यास को संतुष्ट किया जा सके, और दूसरी तरफ प्रतियोगियों को गुमराह करने के लिए, क्योंकि वास्तव में, एक से रासायनिक दृष्टिकोण से, यह एक एल्डिहाइड नहीं था। , लेकिन एक लैक्टोन (एक चक्रीय एस्टर), और इस यौगिक के अणु में परमाणु 14 नहीं, बल्कि 11 हैं। एक मजाक के रूप में, "शतरंज में नहीं, बल्कि वरीयता में , मैं जीता नहीं, लेकिन हार गया। ”

तथाकथित "एल्डिहाइड सी -14" ने 1919 में बड़ी सफलता के साथ गुरलेन मित्सुको में अपनी शुरुआत की, और थोड़ी देर बाद, नई समान सामग्री दिखाई दी: "एल्डिहाइड सी -16 (स्ट्रॉबेरी)", "एल्डिहाइड सी -18 (नारियल) "," एल्डिहाइड सी -20 (क्रिमसन)" और कुछ अन्य। तो यह पता चला है कि, एक ओर, लगभग हर तीसरा सुगंधित पदार्थ एक एल्डिहाइड है, और दूसरी ओर, कुछ सबसे महत्वपूर्ण एल्डिहाइड बिल्कुल भी एल्डिहाइड नहीं हैं।
* केमिस्ट कई तरह के नामों का इस्तेमाल करते हैं। पहला प्रकार व्यवस्थित, या नामकरण है। नामकरण नाम एक प्रकार का सिफर है, एक एल्गोरिथम, जिसकी बदौलत किसी पदार्थ की संरचना को फिर से बनाना संभव है, यानी यह समझना कि अणु के अंदर कौन से परमाणु और कैसे जुड़े हुए हैं। प्रत्येक नाम एक संरचना से मेल खाता है और इसके विपरीत - प्रत्येक पदार्थ के लिए केवल एक नामकरण नाम होता है। एल्डिहाइड, नामकरण के अनुसार, प्रत्यय "अल" होना चाहिए। ऐसे नामों का एकमात्र, लेकिन बहुत महत्वपूर्ण नुकसान उनकी भारीपन है। उदाहरण के लिए, पिछली बार चर्चा की गई आईएसओ ई सुपर, नामकरण नियमों के अनुसार, "1-(1,2,3,4,5,6,7,8-ऑक्टाहाइड्रो-2,3,8,8,) कहा जाना चाहिए। -टेट्रामेथाइल-2-नेफ्थिल) एथेनोन-1"। यह कल्पना करना कठिन है कि यदि रसायनज्ञ केवल नामकरण नामों का उपयोग करते हैं तो प्रयोगशालाओं का रोजमर्रा का जीवन क्या बदल जाता है ("वसीली, कृपया उस फ्लास्क को सिस-3-डाइमिथाइलमेथॉक्सी के साथ पास करें ...")।
इस कारण से, तुच्छ नामों का अधिक बार उपयोग किया जाता है। एक तुच्छ नाम है, जैसा कि यह था, एक उपनाम, एक पदार्थ का उपनाम। यह हमें संरचना और संरचना के बारे में कुछ नहीं बताता है, लेकिन यह छोटा और यादगार है। वैनिलिन, डाइक्लोरवोस, प्रोमेडोल, पैराबेन - ये सभी तुच्छ नाम हैं। अलग-अलग कंपनियां एक ही कंपाउंड को अलग-अलग नामों से जारी कर सकती हैं, आमतौर पर ऐसे नामों को ट्रेडमार्क कहा जाता है। 2एसिटाइलऑक्सीबेंज़ोइक एसिड एक नामकरण नाम है, एसिटाइलसैलिसिलिक एसिड एक तुच्छ नाम है, और एस्पिरिन एक ब्रांड नाम है। सिंथेटिक सुगंध के निर्माता अपनी सामग्री को उज्ज्वल, मधुर नाम देना पसंद करते हैं। अक्सर एल्डिहाइड (रासायनिक दृष्टिकोण से) को अंत में प्रत्यय "अल" के साथ नामित किया जाता है। लेकिन एल्डिहाइड के लिए परफ्यूमर्स के प्यार को जानते हुए, कभी-कभी "अल" के नाम उन पदार्थों को दिए जाते हैं जो कुछ पूरी तरह से अलग होते हैं। उदाहरण के लिए, क्लोनल, आईएफएफ का एक उत्पाद, वास्तव में एक नाइट्राइल है, और मिस्टिकल, गिवाउडान से एक कैप्टिव सामग्री, एक कार्बोक्जिलिक एसिड है। अनिवार्य रूप से "एल्डिहाइड सी -14" के समान ही चाल।
ऑक्सीजन युक्त यौगिक
कार्बोनिल यौगिक
एल्डीहाइड और
कार्बनिक यौगिक जिनके अणुओं में एक कार्बोनिल समूह होता हैकार्बोनिल यौगिक कहलाते हैं। कार्बोनिल समूह से जुड़े पदार्थों की प्रकृति के आधार पर, कार्बोनिल यौगिकों को एल्डिहाइड, कीटोन, कार्बोक्जिलिक एसिड और उनके कार्यात्मक डेरिवेटिव में विभाजित किया जाता है।
एल्डीहाइड
एल्डिहाइड कार्बनिक यौगिक होते हैं जिनमें एक कार्बोनिल समूह होता है जिसमें एक कार्बन परमाणु एक रेडिकल और एक हाइड्रोजन परमाणु से बंधा होता है, अर्थात एल्डिहाइड का सामान्य सूत्र. एक अपवाद फॉर्मिक एल्डिहाइड है।जिसमें, जैसा देखा जा सकता है,आर= एच.
संवयविता
एल्डीहाइड्स को हाइड्रोकार्बन रेडिकल के आइसोमेरिज्म की विशेषता होती है, जिसमें एक सामान्य (अनब्रांच्ड) चेन और एक शाखित, साथ ही केटोन्स के साथ इंटरक्लास आइसोमेरिज्म दोनों हो सकते हैं।उदाहरण के लिए ,
|
हे |
हे |
हे |
|
|
ब्यूटिरिक एल्डिहाइड |
आइसोब्यूट्रिक |
मिथाइल एथिल कीटोन या |
|
रसीद
1.
एल्डिहाइड प्राप्त करने के लिए सबसे अधिक इस्तेमाल की जाने वाली विधियाँ प्राथमिक अल्कोहल का ऑक्सीकरण और उत्प्रेरक डिहाइड्रोजनीकरण हैं।
एक) प्राथमिक अल्कोहल का ऑक्सीकरण।
जैसा कि देखा जा सकता है, अम्ल आगे ऑक्सीकरण पर बनते हैं। अल्कोहल के रासायनिक गुणों पर विचार करते समय ये प्रतिक्रियाएं पहले ही दी जा चुकी थीं।
बी) प्राथमिक अल्कोहल का निर्जलीकरण। अल्कोहल वाष्प को 200-300 . तक गर्म करने पर प्रतिक्रिया की जाती है° एक उत्प्रेरक के साथ, जो तांबा, निकल, कोबाल्ट आदि का उपयोग करता है।
2. तांबे और पैलेडियम लवण की उपस्थिति में वायुमंडलीय ऑक्सीजन के साथ एथिलीन के ऑक्सीकरण द्वारा एसीटैल्डिहाइड के उत्पादन के लिए एक विधि विकसित की गई है।
3. एसिटिक एल्डिहाइड कुचेरोव प्रतिक्रिया के अनुसार एसिटिलीन के जलयोजन द्वारा प्राप्त किया जाता है।
|
हे |
||
|
एचसी सीएच + एच 2 ओ –– एचजीएसओ 4 ® –– ® सीएच 3 –सी |
||
|
|
मैं |
एसिटिलेनिक हाइड्रोकार्बन के रासायनिक गुणों का अध्ययन करते समय कुचेरोव प्रतिक्रिया पर पहले ही विस्तार से विचार किया जा चुका है।
4. एल्डिहाइड हाइड्रोकार्बन के डाइहैलोजन डेरिवेटिव के हाइड्रोलिसिस द्वारा प्राप्त किए जाते हैं, लेकिन केवल वे जिनमें दोनों हैलोजन परमाणु टर्मिनल कार्बन परमाणुओं में से एक पर स्थित होते हैं।
|
सीएच 3-सीएच 2 - |
2H 2 O ® + 2 HCl |
|||
|
1,1-डाइक्लोरोप्रोपेन |
1,1-प्रोपेनेडियोल |
|||
एक क्षारीय या अम्लीय माध्यम में एक डाइहैलोकाइल पर पानी की क्रिया के तहत, इसके हाइड्रोलिसिस की प्रतिक्रिया एक कार्बन परमाणु पर दो हाइड्रॉक्सिल समूहों वाले डायहाइड्रिक अल्कोहल के गठन के चरण से गुजरती है।
ऐसी ऐल्कोहॉल, निर्माण के समय अपनी अस्थिरता के कारण जल खो देती हैं और ऐल्डिहाइड बनाती हैं।
भौतिक गुण
सबसे सरल एल्डिहाइडचींटी-संबंधी - बहुत तीखी गंध वाली गैस। अन्य निचले एल्डिहाइड तरल पदार्थ होते हैं जो पानी में आसानी से घुलनशील होते हैं। एल्डीहाइड्स में दम घुटने वाली गंध होती है, जो बार-बार कमजोर पड़ने पर सुखद हो जाती है, फलों की गंध की याद दिलाती है। एल्डिहाइड समान कार्बन परमाणुओं वाले अल्कोहल की तुलना में कम तापमान पर उबालते हैं। यहसी एल्डिहाइड में हाइड्रोजन बंध की अनुपस्थिति के कारण। इसी समय, एल्डिहाइड का क्वथनांक आणविक भार में संबंधित हाइड्रोकार्बन की तुलना में अधिक होता है, जो एल्डिहाइड की उच्च ध्रुवता से जुड़ा होता है।
कुछ एल्डिहाइड के भौतिक गुण तालिका में प्रस्तुत किए गए हैं।
मेज . कुछ एल्डिहाइड के भौतिक गुण
|
नाम |
सूत्र |
टी ° उबल रहा है, |
टी ° वर्ग, |
डी4 20 |
|
चींटी-संबंधी |
हे |
92,0 |
21,0 |
0,815 |
|
खट्टा |
हे |
123,5 |
21,0 |
0,780 |
|
propionic |
हे |
102,0 |
48,8 |
0,807 |
|
तेल |
हे |
99,0 |
75,7 |
0,817 |
|
आइसोब्यूट्रिक |
हे |
65,9 |
64,0 |
0,794 |
रासायनिक गुण
एल्डिहाइड उच्च प्रतिक्रियाशीलता की विशेषता है। उनकी अधिकांश प्रतिक्रियाएं कार्बोनिल समूह की उपस्थिति के कारण होती हैं। कार्बोनिल समूह में कार्बन परमाणु अवस्था में है SP2- संकरण और रूप तीनएस - कनेक्शन (उनमें से एक कनेक्शन हैसी-ओ ), जो एक ही तल में 120 . के कोण पर स्थित हैंएक दूसरे के लिए °।

कार्बोनिल समूह की संरचना की योजना
कार्बोनिल समूह का दोहरा बंधन भौतिक प्रकृति में कार्बन परमाणुओं के बीच दोहरे बंधन के समान है, अर्थात यह संयोजनएस- और पी - बांड, जिनमें से अंतिम कार्बन और ऑक्सीजन परमाणुओं के पी-इलेक्ट्रॉनों द्वारा बनता है। कार्बन परमाणु की तुलना में ऑक्सीजन परमाणु की अधिक विद्युत ऋणात्मकता के कारण, बंधसी = ओ इलेक्ट्रॉन घनत्व शिफ्ट के कारण दृढ़ता से ध्रुवीकृतपी - ऑक्सीजन परमाणु से बंध जाता है, जिसके परिणामस्वरूप आंशिक ऋणात्मक (डी-) , और कार्बन परमाणु पर - आंशिक धनात्मक (घ + ) प्रभार: .
ध्रुवीकरण के कारण, कार्बोनिल समूह के कार्बन परमाणु में इलेक्ट्रोफिलिक गुण होते हैं और यह न्यूक्लियोफिलिक अभिकर्मकों के साथ प्रतिक्रिया करने में सक्षम होता है। एल्डिहाइड की सबसे महत्वपूर्ण प्रतिक्रियाएं कार्बोनिल समूह के दोहरे बंधन पर न्यूक्लियोफिलिक जोड़ प्रतिक्रियाएं हैं।
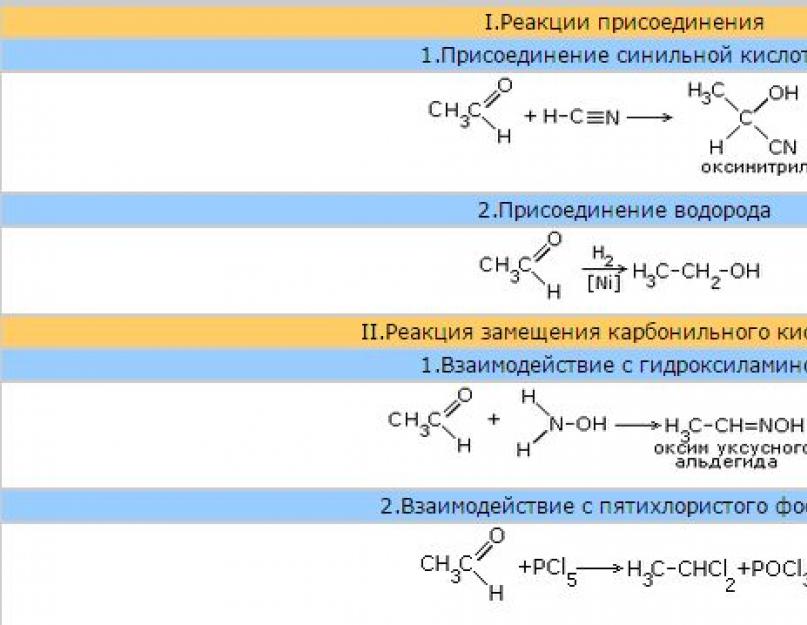
1. एल्डिहाइड की विशिष्ट न्यूक्लियोफिलिक जोड़ प्रतिक्रियाओं में से एकहै हाइड्रोसायनिक (हाइड्रोसायनिक) एसिड के अलावागठन के लिए अग्रणीए - ऑक्सीनिट्राइल्स।
इस प्रतिक्रिया का उपयोग कार्बन श्रृंखला का विस्तार करने और उत्पादन करने के लिए किया जाता हैए - हाइड्रॉक्सी एसिड।
2.
सोडियम हाइड्रोसल्फाइट का जोड़क्रिस्टलीय पदार्थ देता है जिसे आमतौर पर एल्डिहाइड के हाइड्रोसल्फाइट डेरिवेटिव के रूप में जाना जाता है।
उल्लिखित डेरिवेटिव किसी भी वातावरण में आसानी से हाइड्रोलाइज्ड हो जाते हैं, जिससे मूल कार्बोनिल यौगिक बन जाता है। इसलिए, जब सोडा के घोल के साथ गर्म किया जाता है, तो एसीटैल्डिहाइड का हाइड्रोसल्फाइट व्युत्पन्न, एसिटालडिहाइड स्वयं बनता है।
इस गुण का उपयोग एल्डिहाइड को शुद्ध करने और उन्हें मिश्रण से अलग करने के लिए किया जाता है।
3.
अल्कोहल का जोड़एल्डिहाइड के कारण हेमिसिटल्स - यौगिकों का निर्माण होता है,जिसमें कार्बन परमाणु हाइड्रॉक्सिल (-OH) और एल्कोक्सी (-O .) दोनों से आबंधित रहता हैआर ) समूह।
जब एक अम्लीय माध्यम में हेमिसिटल्स को अल्कोहल की अधिकता के साथ व्यवहार किया जाता है, तो एसिटल बनते हैं - ऐसे यौगिक जिनमें कार्बन परमाणु दो अल्कोक्सी समूहों से बंधे होते हैं (प्रतिक्रिया अल्कोहल से ईथर के संश्लेषण के समान होती है)।
ईथर के विपरीत, अल्कोहल और एल्डिहाइड बनाने के लिए एसिड द्वारा एसिटल को हाइड्रोलाइज किया जाता है।
4. हाइड्रोजन का जोड़एल्डिहाइड को उत्प्रेरक की उपस्थिति में किया जाता है (नी, सह, पीडी आदि) और प्राथमिक अल्कोहल के गठन की ओर जाता है।
कम करने वाले एजेंट के रूप में लिथियम एल्यूमीनियम हाइड्राइड का तेजी से उपयोग किया जा रहा है। LiAlH 4 और सोडियम बोरोहाइड्राइडएनएबीएच4.
कार्बोनिल समूह में अतिरिक्त प्रतिक्रियाओं के अलावा, एल्डिहाइड को ऑक्सीकरण प्रतिक्रियाओं की भी विशेषता है।
5. ऑक्सीकरण . ऐल्डिहाइड आसानी से ऑक्सीकृत होकर संगत कार्बोक्जिलिक अम्ल बनाते हैं।
एक) सिल्वर ऑक्साइड का अमोनिया विलयन[एजी (एनएच 3) 2] ओह जब एल्डिहाइड के साथ गर्म किया जाता है, तो यह मुक्त धातु चांदी के निर्माण के साथ एल्डिहाइड को एक एसिड (इसके अमोनियम नमक के रूप में) में ऑक्सीकरण करता है। घटी हुई चांदी को रासायनिक बर्तन की दीवारों पर एक पतली परत में जमा किया जाता है जिसमें प्रतिक्रिया होती है, और एक चांदी का दर्पण प्राप्त होता है। यह प्रतिक्रिया, जिसे इसलिए "चांदी का दर्पण" कहा जाता है, एल्डिहाइड के लिए गुणात्मक प्रतिक्रिया के रूप में कार्य करता है।
बी) एक अन्य विशिष्ट प्रतिक्रिया कॉपर हाइड्रॉक्साइड के साथ एल्डिहाइड का ऑक्सीकरण है (द्वितीय)।
जब नीले कॉपर हाइड्रॉक्साइड को गर्म किया जाता है (द्वितीय एसिटालडिहाइड के घोल के साथ, कॉपर ऑक्साइड का एक लाल अवक्षेप (मैं ) इस मामले में, एसिटालडिहाइड को एसिटिक एसिड में ऑक्सीकृत किया जाता है, और +2 के ऑक्सीकरण राज्य के साथ तांबे को +1 के ऑक्सीकरण राज्य के साथ तांबे में कम कर दिया जाता है। एल्डिहाइड के बीच फॉर्मिक एल्डिहाइड (फॉर्मेल्डिहाइड) एक विशेष स्थान रखता है। फॉर्मिक एल्डिहाइड रेडिकल की अनुपस्थिति के कारण, इसमें कुछ विशिष्ट गुण होते हैं। उदाहरण के लिए, फॉर्मलाडेहाइड का ऑक्सीकरण कार्बन डाइऑक्साइड में किया जाता हैसीओ 2 .
फॉर्मलडिहाइड आसानी से चक्रीय और रैखिक बहुलक बनाने के लिए बहुलक करता है। तो, एक अम्लीय वातावरण में, यह एक चक्रीय ट्रिमर बनाता है - ट्राइऑक्साइमिथिलीन।
उत्प्रेरक की उपस्थिति में शुष्क गैसीय फॉर्मलाडेहाइड उच्च आणविक भार पॉलीफॉर्मलडिहाइड बनाता है। फॉर्मलाडेहाइड का पोलीमराइज़ेशन एल्केन्स के पोलीमराइज़ेशन जैसा दिखता है।
|
ओ–– कैट® |
एच |
एच |
|
…–एच 2 सी–ओ (एच 2 सी–ओ) एन एच 2 सी–ओ–… |
जलीय घोल में, फॉर्मलाडेहाइड एक बहुलक बनाता है जिसे पैराफॉर्म कहा जाता है।
एन सीएच 2 \u003d ओ + एच 2 ओ® एचओसीएच 2 (ओसीएच 2) एन-2 ओसीएच 2 ओएच
(पैराफॉर्म)
विशेष रूप से व्यावहारिक महत्व फिनोल-फॉर्मेल्डिहाइड रेजिन बनाने के लिए फिनोल के साथ फॉर्मलाडेहाइड की पॉलीकोंडेशन प्रतिक्रिया है। फिनोल और फॉर्मलाडेहाइड के मिश्रण पर क्षारीय या अम्लीय उत्प्रेरक की क्रिया के तहत, ऑर्थो और पैरा स्थितियों में संघनन होता है।
फॉर्मलडिहाइड के साथ फिनोल के संघनन के कारण अणु की वृद्धि सामान्य तापमान पर एक रैखिक दिशा में होती है।
|
|
CH2OH |
||||
आदि।
कुल मिलाकर, फॉर्मलाडेहाइड के साथ फिनोल की पॉलीकोंडेशन प्रतिक्रिया को निम्नानुसार दर्शाया जा सकता है:
|
ओ+(एन+1) |
उत्प्रेरक |
|
NH2O |
||||
|
–––––––– ® |
फिनोल-फॉर्मेल्डिहाइड रेजिन पहले औद्योगिक सिंथेटिक रेजिन हैं, "बैकेलाइट" नाम से उनका उत्पादन पहली बार 1909 में शुरू हुआ था। फिनोल-फॉर्मेल्डिहाइड रेजिन का उपयोग विभिन्न प्लास्टिक के उत्पादन में किया जाता है। विभिन्न भरावों के संयोजन में, ऐसे प्लास्टिक को फेनोलिक्स कहा जाता है। इसके अलावा, फिनोल-फॉर्मेल्डिहाइड रेजिन का उपयोग विभिन्न चिपकने वाले और वार्निश, थर्मल इन्सुलेशन सामग्री, लकड़ी के प्लास्टिक, मोल्ड आदि के निर्माण में किया जाता है।
आवेदन पत्र
फॉर्मलाडेहाइड के उपयोग के बारे में पहले ही बहुत कुछ कहा जा चुका है। इसके अलावा, इसका उपयोग यूरिया के साथ बातचीत करके कार्बामाइड रेजिन प्राप्त करने के लिए किया जाता है, जिसके आधार पर प्लास्टिक का उत्पादन किया जाता है, जो इलेक्ट्रिकल इंजीनियरिंग की जरूरतों के लिए आवश्यक है। फॉर्मलाडेहाइड (फॉर्मेलिन) के घोल का उपयोग चमड़ा उद्योग में चमड़े को कम करने के लिए, अनाज और सब्जी की दुकानों को कीटाणुरहित करने के लिए, ग्रीनहाउस, ग्रीनहाउस में, बुवाई से पहले बीजों की ड्रेसिंग के लिए, शारीरिक तैयारी के भंडारण के लिए और कुछ दवाओं के उत्पादन में भी किया जाता है।
एसिटिक एल्डिहाइड एक औद्योगिक पैमाने पर एसिटिक एसिड, एसिटिक एनहाइड्राइड, एथिल अल्कोहल, एथिल एसीटेट और अन्य मूल्यवान उत्पादों के उत्पादन के लिए फीडस्टॉक है, और अमाइन और फिनोल के साथ संघनित होने पर विभिन्न सिंथेटिक रेजिन।
केटोन्स
केटोन्स ऐसे यौगिक होते हैं जिनमें कार्बोनिल समूह दो हाइड्रोकार्बन रेडिकल्स से बंधा होता है। कीटोन्स का सामान्य सूत्र, जहां R के साथ मेल खा सकता हैआर"।
संवयविता
केटोन्स को हाइड्रोकार्बन रेडिकल्स के आइसोमेरिज्म, कार्बोनिल ग्रुप की स्थिति के आइसोमेरिज्म और एल्डिहाइड के साथ इंटरक्लास आइसोमेरिज्म की विशेषता है।
रसीद
एल्डिहाइड के लिए पहले दी गई लगभग सभी तैयारी विधियाँ (देखें "") भी कीटोन्स पर लागू होती हैं।
1. द्वितीयक ऐल्कोहॉलों का ऑक्सीकरण.
2. माध्यमिक अल्कोहल का निर्जलीकरण.
3. एसिटिलीन समरूपों का जलयोजन (कुचेरोव प्रतिक्रिया).
4. डाइहैलोजेनेटेड हाइड्रोकार्बन का हाइड्रोलिसिसश्रृंखला में मध्य कार्बन परमाणुओं में से एक में दोनों हलोजन परमाणु होते हैं।
|
सीएच 3 - |
क्लोरीन |
||
|
सीएच 3 - |
हे |
5.
गर्म होने पर कार्बोक्जिलिक एसिड के कैल्शियम लवणों के पाइरोलिसिस द्वारा केटोन्स भी प्राप्त किए जाते हैं।हे
द्वितीय
सीएच 3-सी
मैं
हे
भौतिक गुण
लोअर केटोन्स तरल पदार्थ होते हैं जो पानी में आसानी से घुलनशील होते हैं। सामान्य तौर पर, कीटोन्स में एक सुखद गंध होती है, जो फूलों की गंध की याद दिलाती है। एल्डिहाइड की तरह, कीटोन संबंधित अल्कोहल की तुलना में कम तापमान पर उबलता है, लेकिन हाइड्रोकार्बन से अधिक होता है। कुछ कीटोन्स के भौतिक गुण तालिका में प्रस्तुत किए गए हैं।
मेज। कुछ कीटोन्स के भौतिक गुण
|
नाम |
सूत्र |
टी ° वर्ग, |
टी ° उबल रहा है, |
डी4 20 |
|
एसीटोन (डाइमिथाइल कीटोन) 42,0 |
102,7 |
0,816 |
रासायनिक गुण
एल्डिहाइड की तरह, कीटोन अत्यधिक प्रतिक्रियाशील होते हैं। एल्डिहाइड और कीटोन्स की रासायनिक गतिविधि जितनी अधिक होती है, कार्बोनिल समूह के कार्बन परमाणु पर धनात्मक आवेश उतना ही अधिक होता है। रेडिकल जो इस धनात्मक आवेश को बढ़ाते हैं, एल्डिहाइड और कीटोन्स की प्रतिक्रियाशीलता में तेजी से वृद्धि करते हैं, जबकि धनात्मक आवेश को कम करने वाले मूलक विपरीत प्रभाव डालते हैं। कीटोन्स में, दो एल्काइल समूह इलेक्ट्रॉन-दान कर रहे हैं, जिससे यह स्पष्ट होता है कि एल्डिहाइड की तुलना में केटोन्स न्यूक्लियोफिलिक जोड़ प्रतिक्रियाओं में कम सक्रिय क्यों हैं।
एल्डिहाइड के लिए इस प्रकार की प्रतिक्रियाओं के उदाहरणों पर पहले विस्तार से विचार किया गया था (देखें ""), इसलिए, केटोन्स के कार्बोनिल समूह में न्यूक्लियोफिलिक जोड़ प्रतिक्रियाओं के कुछ उदाहरण देते हुए, हम केवल एल्डिहाइड से उनके रासायनिक गुणों में अंतर पर ध्यान देंगे।
1. हाइड्रोसायनिक एसिड का परिग्रहण.
|
आर |
ओह |
यह ध्यान दिया जाना चाहिए कि केवल मिथाइल केटोन्स सोडियम हाइड्रोसल्फाइट के साथ प्रतिक्रिया करते हैं, यानी समूह वाले केटोन्ससीएच3.
3.
एल्डिहाइड की तुलना में, कीटोन अल्कोहल के साथ प्रतिक्रिया नहीं करते हैं।
4. हाइड्रोजन का जोड़. कीटोन्स में हाइड्रोजन मिलाने से द्वितीयक ऐल्कोहॉल का निर्माण होता है।
5. एल्डिहाइड की तुलना में केटोन्स को ऑक्सीकरण करना अधिक कठिन होता है। वायु ऑक्सीजन और कमजोर ऑक्सीकरण एजेंट कीटोन्स का ऑक्सीकरण नहीं करते हैं। केटोन्स "सिल्वर मिरर" प्रतिक्रिया नहीं देते हैं और कॉपर हाइड्रॉक्साइड के साथ प्रतिक्रिया नहीं करते हैं (द्वितीय ) कठोर परिस्थितियों में मजबूत ऑक्सीकरण एजेंटों की कार्रवाई के तहत, कीटोन अणु की कार्बन श्रृंखला कार्बोनिल समूह के पास नष्ट हो जाती है और एसिड (कभी-कभी कीटोन, मूल कीटोन की संरचना के आधार पर) कार्बन परमाणुओं की एक छोटी संख्या के साथ बनते हैं।
|
|
|
|
आवेदन पत्र
कीटोन्स के सबसे सरल प्रतिनिधि एसीटोन का व्यापक औद्योगिक अनुप्रयोग है। एसीटोन एक मूल्यवान विलायक है जिसका उपयोग पेंट और वार्निश उद्योग में, रेयान, फिल्म और धुआं रहित पाउडर के उत्पादन में किया जाता है। यह मेथैक्रेलिक एसिड, मिथाइल मेथैक्रिलेट (अटूट कार्बनिक ग्लास का उत्पादन), मिथाइल आइसोबुटिल कीटोन, आदि के उत्पादन में फीडस्टॉक के रूप में भी कार्य करता है।
खंड का अंत
एल्डिहाइड और कीटोन्स की संरचना

एल्डीहाइड- कार्बनिक पदार्थ जिनके अणु होते हैं कार्बोनिल समूह:

एक हाइड्रोजन परमाणु और एक हाइड्रोकार्बन रेडिकल से बंधा हुआ। एल्डिहाइड का सामान्य सूत्र है:

सबसे सरल एल्डिहाइड में, एक अन्य हाइड्रोजन परमाणु द्वारा हाइड्रोकार्बन रेडिकल की भूमिका निभाई जाती है:
 formaldehyde
formaldehyde हाइड्रोजन परमाणु से जुड़े कार्बोनिल समूह को अक्सर कहा जाता है एल्डिहाइड:

केटोन्स अणुओं में कार्बनिक पदार्थ होते हैं जिनके कार्बोनिल समूह दो हाइड्रोकार्बन रेडिकल से बंधे होते हैं। जाहिर है, कीटोन्स का सामान्य सूत्र है:

कीटोन्स के कार्बोनिल समूह को कहा जाता है कीटो समूह.
सरलतम कीटोन, एसीटोन में, कार्बोनिल समूह दो मिथाइल रेडिकल से बंधा होता है:

एल्डिहाइड और कीटोन्स का नामकरण और समावयवता
एल्डिहाइड समूह से जुड़े हाइड्रोकार्बन रेडिकल की संरचना के आधार पर, वहाँ हैं संतृप्त, असंतृप्त, सुगंधित, हेट्रोसायक्लिक और अन्य एल्डिहाइड:
IUPAC नामकरण के अनुसार, संतृप्त एल्डिहाइड के नाम एक अल्केन के नाम से बनते हैं, जिसमें प्रत्यय का उपयोग करके अणु से कार्बन परमाणुओं की समान संख्या होती है। अल. उदाहरण के लिए:
नंबरिंगमुख्य श्रृंखला के कार्बन परमाणु एल्डिहाइड समूह के कार्बन परमाणु से शुरू होते हैं। इसलिए, एल्डिहाइड समूह हमेशा पहले कार्बन परमाणु पर स्थित होता है, और इसकी स्थिति को इंगित करना आवश्यक नहीं है।
व्यवस्थित नामकरण के साथ, व्यापक रूप से उपयोग किए जाने वाले एल्डिहाइड के तुच्छ नामों का भी उपयोग किया जाता है। ये नाम आमतौर पर एल्डिहाइड से संबंधित कार्बोक्जिलिक एसिड के नामों से प्राप्त होते हैं।
शीर्षक के लिए कीटोन्सव्यवस्थित नामकरण के अनुसार, कीटो समूह को प्रत्यय द्वारा निरूपित किया जाता है -वहऔर एक संख्या जो कार्बोनिल समूह के कार्बन परमाणु की संख्या को इंगित करती है (संख्या कीटो समूह के निकटतम श्रृंखला के अंत से शुरू होनी चाहिए)।
उदाहरण के लिए:
के लिये एल्डीहाइडकेवल एक प्रकार की संरचनात्मक समावयवता विशेषता है - कार्बन कंकाल का समावयवता, जो Butanal के साथ संभव है, और for कीटोन्स- भी कार्बोनिल स्थिति समरूपता. इसके अलावा, उन्हें भी विशेषता है इंटरक्लास आइसोमेरिज्म(प्रोपेनल और प्रोपेनोन)।
एल्डिहाइड और कीटोन्स के भौतिक गुण

एक एल्डिहाइड या कीटोन अणु में, कार्बन परमाणु की तुलना में ऑक्सीजन परमाणु की अधिक विद्युत ऋणात्मकता के कारण, बंधन C=O अत्यधिक ध्रुवीकृत हैऑक्सीजन के लिए π-बंधन के इलेक्ट्रॉन घनत्व के बदलाव के कारण:

एल्डिहाइड और कीटोन्स ऑक्सीजन परमाणु पर अधिक इलेक्ट्रॉन घनत्व वाले ध्रुवीय पदार्थ. एल्डिहाइड और कीटोन्स (फॉर्मेल्डिहाइड, एसीटैल्डिहाइड, एसीटोन) की श्रृंखला के निचले सदस्य पानी में असीम रूप से घुलनशील होते हैं। इनका क्वथनांक संगत ऐल्कोहॉलों के क्वथनांक से कम होता है। यह इस तथ्य के कारण है कि एल्डिहाइड और कीटोन के अणुओं में, अल्कोहल के विपरीत, कोई मोबाइल हाइड्रोजन परमाणु नहीं होते हैं और वे हाइड्रोजन बांड के कारण सहयोगी नहीं बनते हैं।
निचले एल्डिहाइड में तीखी गंध होती है; श्रृंखला में चार से छह कार्बन परमाणुओं वाले एल्डिहाइड में एक अप्रिय गंध होता है; उच्च एल्डिहाइड और कीटोन में फूलों की गंध होती है और इनका उपयोग इत्र में किया जाता है।
एक अणु में एक एल्डिहाइड समूह की उपस्थिति एल्डिहाइड के विशिष्ट गुणों को निर्धारित करती है।
वसूली प्रतिक्रियाएं।
1. हाइड्रोजन का जोड़एल्डिहाइड अणु कार्बोनिल समूह में दोहरे बंधन में होते हैं:

एल्डिहाइड के हाइड्रोजनीकरण के उत्पाद प्राथमिक अल्कोहल हैं, कीटोन द्वितीयक अल्कोहल हैं।
इसलिए, जब एसिटालडिहाइड को निकल उत्प्रेरक पर हाइड्रोजनीकृत किया जाता है, तो एथिल अल्कोहल बनता है, और जब एसीटोन हाइड्रोजनीकृत होता है, तो प्रोपेनॉल -2 बनता है।

2. एल्डिहाइड का हाइड्रोजनीकरण- कमी प्रतिक्रिया, जिसमें कार्बोनिल समूह में शामिल कार्बन परमाणु के ऑक्सीकरण की डिग्री घट जाती है।
ऑक्सीकरण प्रतिक्रियाएं।
एल्डिहाइड को न केवल कम किया जा सकता है, बल्कि ऑक्सीकरण भी किया जा सकता है। ऑक्सीकरण होने पर, एल्डिहाइड कार्बोक्जिलिक एसिड बनाते हैं। योजनाबद्ध रूप से, इस प्रक्रिया को निम्नानुसार दर्शाया जा सकता है:

1. वायुमंडलीय ऑक्सीजन द्वारा ऑक्सीकरण।उदाहरण के लिए, प्रोपियोनिक एसिड प्रोपियोनाल्डिहाइड (प्रोपेनल) से बनता है:

2. कमजोर ऑक्सीकरण एजेंटों के साथ ऑक्सीकरण(सिल्वर ऑक्साइड का अमोनिया विलयन)। सरलीकृत रूप में, इस प्रक्रिया को प्रतिक्रिया समीकरण द्वारा व्यक्त किया जा सकता है:

उदाहरण के लिए:

अधिक सटीक रूप से, यह प्रक्रिया समीकरणों द्वारा परिलक्षित होती है:

यदि पोत की सतह जिसमें प्रतिक्रिया की जाती है, पहले घटी हुई थी, तो प्रतिक्रिया के दौरान बनने वाली चांदी इसे एक पतली फिल्म के साथ कवर करती है। इसलिए, इस प्रतिक्रिया को "सिल्वर मिरर" प्रतिक्रिया कहा जाता है। यह व्यापक रूप से दर्पण बनाने, चांदी की सजावट और क्रिसमस की सजावट के लिए उपयोग किया जाता है।
3. ताजा अवक्षेपित कॉपर (II) हाइड्रॉक्साइड के साथ ऑक्सीकरण।एल्डिहाइड का ऑक्सीकरण, Cu 2+ Cu + तक कम हो जाता है। प्रतिक्रिया के दौरान बनने वाला कॉपर (I) हाइड्रॉक्साइड CuOH तुरंत लाल कॉपर (I) ऑक्साइड और पानी में विघटित हो जाता है।

यह प्रतिक्रिया, प्रतिक्रिया की तरह चांदी का दर्पण”, एल्डिहाइड का पता लगाने के लिए प्रयोग किया जाता है।
कीटोन्स या तो वायुमंडलीय ऑक्सीजन द्वारा या सिल्वर ऑक्साइड के अमोनिया घोल के रूप में ऐसे कमजोर ऑक्सीकरण एजेंट द्वारा ऑक्सीकृत नहीं होते हैं।
एल्डिहाइड और एसिड के रासायनिक गुण - सार


एल्डिहाइड के व्यक्तिगत प्रतिनिधि और उनका अर्थ
formaldehyde(मेथेनल, फॉर्मिक एल्डिहाइड एचसीएचओ) - तीखी गंध वाली रंगहीन गैस और -21 डिग्री सेल्सियस का क्वथनांक, हम पानी में आसानी से घुल जाएंगे। फॉर्मलडिहाइड जहरीला होता है! पानी में फॉर्मलाडेहाइड (40%) के घोल को फॉर्मेलिन कहा जाता है और इसका उपयोग फॉर्मलाडेहाइड और एसिटिक कीटाणुशोधन के लिए किया जाता है। कृषि में, फॉर्मेलिन का उपयोग बीज ड्रेसिंग के लिए, चमड़ा उद्योग में - चमड़े के प्रसंस्करण के लिए किया जाता है। फॉर्मलडिहाइड बनाने के लिए प्रयोग किया जाता है यूरोट्रोपिन- औषधीय पदार्थ। कभी-कभी ब्रिकेट के रूप में संपीड़ित, यूरोट्रोपिन का उपयोग ईंधन (सूखी शराब) के रूप में किया जाता है। फिनोल-फॉर्मेल्डिहाइड रेजिन और कुछ अन्य पदार्थों के उत्पादन में बड़ी मात्रा में फॉर्मलाडेहाइड की खपत होती है।
एसिटिक एल्डिहाइड(एथेनल, एसीटैल्डिहाइड सीएच 3 सीएचओ) - एक तेज, अप्रिय गंध वाला तरल और 21 डिग्री सेल्सियस का क्वथनांक, हम पानी में अच्छी तरह से घुल जाएंगे। एसिटिक एसिड और कई अन्य पदार्थ औद्योगिक पैमाने पर एसीटैल्डिहाइड से प्राप्त होते हैं, इसका उपयोग विभिन्न प्लास्टिक और एसीटेट फाइबर के उत्पादन के लिए किया जाता है। एसिटिक एल्डिहाइड जहरीला होता है!

परमाणुओं का समूह -

बुलाया कार्बोक्सिल समूह, या कार्बोक्सिल।
अणु में एक कार्बोक्सिल समूह वाले कार्बनिक अम्ल हैं अकेले आधार का.
इन अम्लों का सामान्य सूत्र RCOOH है, उदाहरण के लिए:

दो कार्बोक्सिल समूहों वाले कार्बोक्जिलिक अम्ल कहलाते हैं द्विक्षारकीय. इनमें शामिल हैं, उदाहरण के लिए, ऑक्सालिक और स्यूसिनिक एसिड:

वे भी हैं बहुक्षारकीकार्बोक्जिलिक एसिड जिसमें दो से अधिक कार्बोक्सिल समूह होते हैं। इनमें शामिल हैं, उदाहरण के लिए, ट्राइबेसिक साइट्रिक एसिड:

हाइड्रोकार्बन रेडिकल की प्रकृति के आधार पर, कार्बोक्जिलिक एसिड को विभाजित किया जाता है सीमांत, असंतृप्त, सुगंधित.
सीमित, या संतृप्त, कार्बोक्जिलिक एसिड हैं, उदाहरण के लिए, प्रोपेनोइक (प्रोपियोनिक) एसिड:

या पहले से ही हमें succinic acid से परिचित है।
जाहिर है, संतृप्त कार्बोक्जिलिक एसिड में हाइड्रोकार्बन रेडिकल में -बॉन्ड नहीं होते हैं।
असंतृप्त कार्बोक्जिलिक एसिड के अणुओं में, कार्बोक्सिल समूह एक असंतृप्त, असंतृप्त हाइड्रोकार्बन रेडिकल से जुड़ा होता है, उदाहरण के लिए, ऐक्रेलिक (प्रोपेन) अणुओं में
सीएच 2 \u003d सीएच-कूह
या ओलिक
सीएच 3 -(सीएच 2) 7-सीएच \u003d सीएच-(सीएच 2) 7-कूह
और अन्य एसिड।
जैसा कि बेंजोइक एसिड के सूत्र से देखा जा सकता है, यह है खुशबूदार, क्योंकि इसके अणु में एक सुगन्धित (बेंजीन) वलय होता है:


एक कार्बोक्जिलिक एसिड का नाम संबंधित एल्केन (अणु में कार्बन परमाणुओं की समान संख्या के साथ एक अल्केन) के नाम से प्रत्यय के अतिरिक्त के साथ बनता है -ओवी— , समापन -और मैंऔर शब्द अम्ल. कार्बन परमाणुओं की संख्या एक कार्बोक्सिल समूह से शुरू होता है. उदाहरण के लिए:

नाम में उपसर्गों द्वारा कार्बोक्सिल समूहों की संख्या को दर्शाया गया है दी-, त्रि-, टेट्रा-:
कई एसिड ऐतिहासिक रूप से विकसित, या तुच्छ, नाम भी रखते हैं।
मोनोबैसिक कार्बोक्जिलिक एसिड को सीमित करने की संरचना सामान्य सूत्र द्वारा व्यक्त की जाएगी सी एन एच 2एन ओ 2, या सी एन एच 2एन+1 सीओओएच, या RCOOH.
कार्बोक्जिलिक एसिड के भौतिक गुण
कम एसिड, यानी, अपेक्षाकृत छोटे आणविक भार वाले एसिड, जिसमें एक अणु में चार कार्बन परमाणु होते हैं, एक विशिष्ट तीखी गंध वाले तरल पदार्थ होते हैं (उदाहरण के लिए, एसिटिक एसिड की गंध)। 4 से 9 कार्बन परमाणुओं वाले एसिड एक अप्रिय गंध के साथ चिपचिपा तैलीय तरल पदार्थ होते हैं; एक अणु में 9 से अधिक कार्बन परमाणु होते हैं - ठोस जो पानी में नहीं घुलते हैं। मोनोबैसिक कार्बोक्जिलिक एसिड को सीमित करने के क्वथनांक अणु में कार्बन परमाणुओं की संख्या में वृद्धि के साथ बढ़ते हैं और, परिणामस्वरूप, सापेक्ष आणविक भार में वृद्धि के साथ। तो, फॉर्मिक एसिड का क्वथनांक 100.8 डिग्री सेल्सियस, एसिटिक एसिड - 118 डिग्री सेल्सियस, प्रोपियोनिक एसिड - 141 डिग्री सेल्सियस है।
सामान्य परिस्थितियों में सबसे सरल कार्बोक्जिलिक एसिड, फॉर्मिक HCOOH, जिसमें एक छोटा सापेक्ष आणविक भार (M r (HCOOH) = 46) होता है, एक तरल होता है जिसका क्वथनांक 100.8 ° C होता है। उसी समय, ब्यूटेन (M r (C 4 H 10) \u003d 58) समान परिस्थितियों में गैसीय होता है और इसका क्वथनांक -0.5 ° C होता है। क्वथनांक और सापेक्ष आणविक भार के बीच इस विसंगति को समझाया गया है कार्बोक्जिलिक एसिड के डिमर का गठनजिसमें दो अम्ल अणु दो से बंधे होते हैं हाइड्रोजन बांड:

कार्बोक्जिलिक एसिड अणुओं की संरचना पर विचार करने पर हाइड्रोजन बांड की घटना स्पष्ट हो जाती है।
संतृप्त मोनोबैसिक कार्बोक्जिलिक एसिड के अणुओं में परमाणुओं का एक ध्रुवीय समूह होता है - कार्बाक्सिल

और व्यावहारिक रूप से गैर-ध्रुवीय हाइड्रोकार्बन रेडिकल. कार्बोक्सिल समूह पानी के अणुओं की ओर आकर्षित होता है, जिससे उनके साथ हाइड्रोजन बंध बनते हैं:

फॉर्मिक और एसिटिक एसिड पानी में असीम रूप से घुलनशील होते हैं। जाहिर है, हाइड्रोकार्बन रेडिकल में परमाणुओं की संख्या में वृद्धि के साथ, कार्बोक्जिलिक एसिड की घुलनशीलता कम हो जाती है।
कार्बोक्जिलिक एसिड के रासायनिक गुण
एसिड के वर्ग (कार्बनिक और अकार्बनिक दोनों) के सामान्य गुण हाइड्रोजन और ऑक्सीजन परमाणुओं के बीच एक मजबूत ध्रुवीय बंधन वाले हाइड्रॉक्सिल समूह के अणुओं में उपस्थिति के कारण होते हैं। आइए हम पानी में घुलनशील कार्बनिक अम्लों के उदाहरण का उपयोग करके इन गुणों पर विचार करें।
1. पृथक्करणएसिड अवशेषों के हाइड्रोजन केशन और आयनों के निर्माण के साथ:
अधिक सटीक रूप से, इस प्रक्रिया को एक समीकरण द्वारा वर्णित किया गया है जो इसमें पानी के अणुओं की भागीदारी को ध्यान में रखता है:
कार्बोक्जिलिक एसिड के पृथक्करण का संतुलन बाईं ओर स्थानांतरित हो गया है; उनमें से अधिकांश कमजोर इलेक्ट्रोलाइट्स हैं। हालांकि, उदाहरण के लिए, एसिटिक और फॉर्मिक एसिड का खट्टा स्वाद हाइड्रोजन केशन और अम्लीय अवशेषों के आयनों में पृथक्करण के कारण होता है।
जाहिर है, कार्बोक्जिलिक एसिड के अणुओं में "अम्लीय" हाइड्रोजन, यानी कार्बोक्सिल समूह के हाइड्रोजन की उपस्थिति भी अन्य विशिष्ट गुणों को निर्धारित करती है।
2. धातुओं के साथ बातचीतहाइड्रोजन तक वोल्टेज की विद्युत रासायनिक श्रृंखला में खड़े होना:
तो, आयरन एसिटिक एसिड से हाइड्रोजन को कम करता है:
3. बुनियादी आक्साइड के साथ बातचीतनमक और पानी के निर्माण के साथ:
4. धातु हाइड्रोक्साइड के साथ बातचीतनमक और पानी के गठन के साथ (बेअसर प्रतिक्रिया):
5. कमजोर अम्लों के लवणों के साथ परस्पर क्रियाबाद के गठन के साथ। इस प्रकार, एसिटिक एसिड सोडियम स्टीयरेट से स्टीयरिक एसिड और पोटेशियम कार्बोनेट से कार्बोनिक एसिड को विस्थापित करता है:

6. अल्कोहल के साथ कार्बोक्जिलिक एसिड की बातचीतएस्टर के गठन के साथ - एस्टरीफिकेशन प्रतिक्रिया (कार्बोक्जिलिक एसिड की विशेषता वाली सबसे महत्वपूर्ण प्रतिक्रियाओं में से एक):
अल्कोहल के साथ कार्बोक्जिलिक एसिड की बातचीत हाइड्रोजन केशन द्वारा उत्प्रेरित होती है।
एस्टरीफिकेशन प्रतिक्रिया प्रतिवर्ती है। डीवाटरिंग एजेंटों की उपस्थिति में और जब एस्टर को प्रतिक्रिया मिश्रण से हटा दिया जाता है, तो संतुलन एस्टर गठन की ओर बढ़ जाता है।
रिवर्स एस्टरीफिकेशन रिएक्शन में, जिसे एस्टर हाइड्रोलिसिस (पानी के साथ एस्टर की प्रतिक्रिया) कहा जाता है, एक एसिड और एक अल्कोहल बनता है:

जाहिर है, पॉलीहाइड्रिक अल्कोहल, उदाहरण के लिए, ग्लिसरॉल, कार्बोक्जिलिक एसिड के साथ भी प्रतिक्रिया कर सकता है, अर्थात, एस्टरीफिकेशन प्रतिक्रिया में प्रवेश करता है:

सभी कार्बोक्जिलिक एसिड (फॉर्मिक को छोड़कर), एक कार्बोक्सिल समूह के साथ, उनके अणुओं में हाइड्रोकार्बन अवशेष होते हैं। बेशक, यह एसिड के गुणों को प्रभावित नहीं कर सकता है, जो हाइड्रोकार्बन अवशेषों की प्रकृति से निर्धारित होते हैं।
7. एकाधिक बंधन जोड़ प्रतिक्रियाएं- असंतृप्त कार्बोक्जिलिक एसिड उनमें प्रवेश करते हैं। उदाहरण के लिए, हाइड्रोजन जोड़ प्रतिक्रिया हाइड्रोजनीकरण है। मूलांक में एक n-आबंध वाले अम्ल के लिए, समीकरण को सामान्य रूप में लिखा जा सकता है:
तो, जब ओलिक एसिड हाइड्रोजनीकृत होता है, तो संतृप्त स्टीयरिक एसिड बनता है:
असंतृप्त कार्बोक्जिलिक एसिड, अन्य असंतृप्त यौगिकों की तरह, हैलोजन को दोहरे बंधन में जोड़ते हैं। उदाहरण के लिए, ऐक्रेलिक एसिड ब्रोमीन पानी को रंगहीन कर देता है:

8. प्रतिस्थापन प्रतिक्रियाएं (हैलोजन के साथ)- संतृप्त कार्बोक्जिलिक एसिड उनमें प्रवेश करने में सक्षम हैं। उदाहरण के लिए, क्लोरीन के साथ एसिटिक एसिड की प्रतिक्रिया करके, एसिड के विभिन्न क्लोरीन डेरिवेटिव प्राप्त किए जा सकते हैं:

कार्बोक्जिलिक एसिड के रासायनिक गुण - संग्रह



कार्बोक्जिलिक एसिड के व्यक्तिगत प्रतिनिधि और उनका महत्व
फॉर्मिक (मीथेन) एसिड HCOOH- तीखी गंध वाला तरल और 100.8 ° C का क्वथनांक, पानी में अत्यधिक घुलनशील।
फॉर्मिक एसिड जहरीला होता है और त्वचा के संपर्क में आने पर जल जाता है! चींटियों द्वारा स्रावित चुभने वाले द्रव में यह अम्ल होता है।
फॉर्मिक एसिड में एक कीटाणुनाशक गुण होता है और इसलिए यह भोजन, चमड़ा और दवा उद्योग और दवा में अपना आवेदन पाता है। इसका उपयोग कपड़ा और कागज की रंगाई में किया जाता है।
एसिटिक (एथेनोइक) अम्ल CH3 COOH- एक रंगहीन तरल जिसमें एक विशिष्ट तीखी गंध होती है, किसी भी अनुपात में पानी के साथ गलत। एसिटिक एसिड के जलीय घोल सिरका (3-5% घोल) और सिरका एसेंस (70-80% घोल) के नाम से बिक्री पर जाते हैं और खाद्य उद्योग में व्यापक रूप से उपयोग किए जाते हैं। एसिटिक एसिड कई कार्बनिक पदार्थों के लिए एक अच्छा विलायक है और इसलिए इसका उपयोग रंगाई, चमड़ा उद्योग और पेंट और वार्निश उद्योग में किया जाता है। इसके अलावा, एसिटिक एसिड कई तकनीकी रूप से महत्वपूर्ण कार्बनिक यौगिकों के उत्पादन के लिए एक कच्चा माल है: उदाहरण के लिए, इसका उपयोग खरपतवारों को नियंत्रित करने के लिए उपयोग किए जाने वाले पदार्थों को प्राप्त करने के लिए किया जाता है - शाकनाशी। एसिटिक एसिड वाइन सिरका का मुख्य घटक है, जिसकी विशेषता गंध इसके कारण होती है। यह इथेनॉल के ऑक्सीकरण का एक उत्पाद है और इससे बनता है जब शराब को हवा में संग्रहीत किया जाता है।
उच्चतम सीमित मोनोबैसिक एसिड के सबसे महत्वपूर्ण प्रतिनिधि हैं पामिटिक सी 15 एच 31 सीओओएच और स्टीयरिक सी 17 एच 35 सीओओएच एसिड. निचले अम्लों के विपरीत, ये पदार्थ ठोस होते हैं, पानी में खराब घुलनशील होते हैं।
हालांकि, उनके लवण - स्टीयरेट और पामिटेट - अत्यधिक घुलनशील होते हैं और एक डिटर्जेंट प्रभाव डालते हैं, यही वजह है कि उन्हें साबुन भी कहा जाता है। स्पष्ट है कि इन पदार्थों का उत्पादन बड़े पैमाने पर होता है।
असंतृप्त उच्च कार्बोक्जिलिक एसिड में से सबसे महत्वपूर्ण है तेज़ाब तैलसी 17 एच 33 सीओओएच, या सीएच 3 - (सीएच 2) 7 - सीएच \u003d सीएच - (सीएच 2) 7 सीओओएच। यह बिना स्वाद या गंध के तेल जैसा तरल है। इसके लवण प्रौद्योगिकी में व्यापक रूप से उपयोग किए जाते हैं।
डिबासिक कार्बोक्जिलिक एसिड का सबसे सरल प्रतिनिधि है ऑक्सालिक (एथेनेडियोइक) एसिड HOOC-COOH, जिसके लवण कई पौधों में पाए जाते हैं, जैसे सॉरेल और ऑक्सालिस। ऑक्सालिक एसिड एक रंगहीन क्रिस्टलीय पदार्थ है, जो पानी में अत्यधिक घुलनशील है। इसका उपयोग धातुओं की पॉलिशिंग, लकड़ी के काम और चमड़े के उद्योगों में किया जाता है।
परीक्षा उत्तीर्ण करने के लिए संदर्भ सामग्री:
आवर्त सारणी
घुलनशीलता तालिका