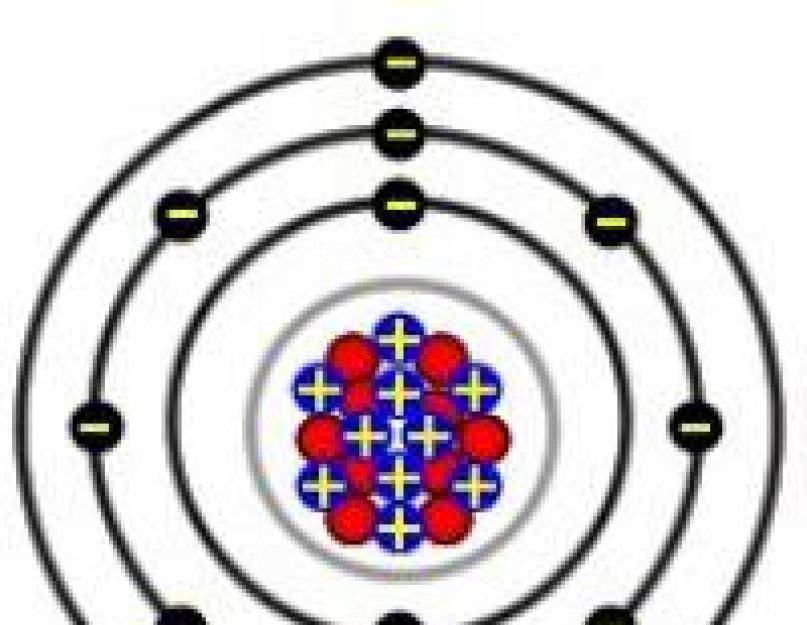
Ličio junginių savybės, palyginti su kitų šarminių metalų junginiais.
Šarminių metalų hidridai, oksidai, peroksidai, hidroksidai: cheminis ryšys junginiuose, paruošimas ir savybės.
Natrio, natrio hidroksido ir natrio karbonato gavimas pramonėje.
Sąveika su šarminiais tirpalais: a) amfoteriniai metalai; b) nemetalai; c) rūgščių oksidai; d) amfoteriniai oksidai.
I periodinės elementų sistemos IA pogrupio metalai I. I. Mendelejevas Li, Na, K, Rb, Cs ir Fr vadinami šarminiais.
Šarminiai, šarminių žemių metalai, Be ir Mg yra vieni labiausiai elektroteigiamų elementų. Junginiuose su kitais elementais IA pogrupio metalams būdinga +1, o PA pogrupio metalams +2. Didėjant elektronų sluoksnių skaičiui ir didėjant spinduliams, atomų jonizacijos energija mažėja. Dėl to pogrupių elementų cheminis aktyvumas didėja augant jų serijiniam numeriui. Jiems būdingas fotoelektrinis efektas siejamas su maža jonizacijos energija, taip pat jų dažymu dujinio degiklio liepsnos druskomis.Dėl lengvo išorinių elektronų sugrįžimo šarminiai ir šarminiai žemės metalai sudaro junginius, daugiausia turinčius joninį ryšį.
Šarminiai ir šarminių žemių metalai pasižymi dideliu kiekiu
cheminis aktyvumas. Kaitinant vandenilyje, jie susidaro
hidridai yra į druskas panašūs junginiai, turintys vandenilio
kaip neigiamo krūvio jonas. Oras šarminis
metalai greitai oksiduojasi, formuojasi, priklausomai nuo jų aktyvumo
oksidai, peroksidai, superoksidai arba ozonidai.
Tuo pačiu metu Ci, Na ir K "užsidega ore arba tik sauso deguonies atmosferoje
kaitinant a, Rb ir Cs savaime užsiliepsnoja nekaitinant.
Būdingas tik M 2 O sudėties oksido susidarymas degimo metu
dėl ličio. Natris sudaro peroksidą, kurio sudėtis yra M 2 O 2, kalis, rubidis
ir cezio superoksido sudėtis MO 2 .
Šarminiai metalai intensyviai reaguoja su vandeniu, išstumdami iš jo vandenilį ir sudarydami atitinkamus hidroksidus. Šių metalų sąveikos su vandeniu aktyvumas didėja didėjant elemento atominiam skaičiui. Taigi, - litis reaguoja su vandeniu netirpdamas, natris - tirpsta, kalis - savaime užsiliepsnoja, rubidžio ir cezio sąveika vyksta dar intensyviau. Šarminiai metalai intensyviai reaguoja su halogenais, o kaitinant – su siera.
Šarminių metalų hidroksidai – junginiai, kuriuose vyrauja
bet joninis. Vandeniniuose tirpaluose jie visiškai atsiskiria
Būdingas jungties pobūdis taip pat paaiškina jų aukštą šiluminę temperatūrą
stabilumas: jie neatskiria vandens, net kai kaitinami iki virimo temperatūros (virš 1300 ° C) Išimtis yra ličio hidroksidas, kuris kaitinant suyra dalydamasis vandeniu. Ličio elgsena ir kitais atžvilgiais skiriasi nuo kitų šarminių metalų. Tai paaiškinama nepilna elektronine analogija su kitais grupės elementais.
Iš šarminių metalų tik ličio, su santykinai mažas Kaitinamas, jis sąveikauja su azotu, anglimi ir siliciu, sudarydamas atitinkamai Li 3 N nitridą, Li 2 C 2 karbidą ir Li 6 Si 2 silicidą. Esant drėgmei, nitridų susidarymas vyksta jau kambario temperatūroje.
Skirtingai nuo šarminių metalų, kurių beveik visos druskos gerai tirpsta vandenyje, litis sudaro blogai tirpų fluoridą LiF karbonatą Li 2 CO 3 ir fosfatą Li 3 PO 4 .
Kalcis, stroncis ir baris deguonies ir vandens atžvilgiu elgiasi kaip šarminiai metalai. Jie skaido vandenį išskirdami vandenilį ir susidaro hidroksidai M(OH) 2 . Sąveikaujant su deguonimi jie sudaro oksidus (CaO) ir peroksidus (SrO 2, BaO 2), kurie reaguoja su vandeniu kaip panašūs šarminių metalų junginiai.
Magnis taip pat labai skiriasi nuo šarminių žemių metalų. Pavyzdžiui, dėl mažo hidroksido tirpumo jis nesąveikauja su šaltu vandeniu. Kaitinant, procesas palengvėja.
Apskritai PA pogrupio metalai yra chemiškai aktyvūs: kaitinami jie sąveikauja su halogenais ir siera, sudarydami atitinkamas druskas, o jungiasi su molekuliniu azotu.
Šarminių žemių metalų druskos, kaip ir šarminių metalų druskos, yra sudarytos iš jonų. Šių metalų druskos nuspalvina degiklio liepsną. in būdingų spalvų, tai nepastebėta Be ir Mg junginiams.
Skirtingai nuo šarminių metalų druskų, daugelis PA pogrupio metalų druskų yra mažai tirpios, ypač fluoridai (išskyrus BeF 2). sulfatai (išskyrus BeSO 4 ir MgSO 4), karbonatai. Iš vandeninių tirpalų Be 2+ nusėda kintamos sudėties bazinių karbonatų pavidalu, Mg 2+ - 4MgCO 3 -Mg (OH) 2 -5H 2 O ir Ca 2+, Sr 2 + ir Ba 2 pavidalu. + nuosėdos vidutinių karbonatų pavidalu MCO3.
BET) Be+2NaOH= Na2BeO2+H2
Al+NaOH+H2O=NaAlO2+H2
B) Nemetalai, išskyrus halogenus, nereaguoja su šarmų tirpalais.
Cl2+NaOH=NaClO3+NaCl+H2O
AT) rūgštiniai oksidai ištirpsta tik šarmuose, sudarydami druską ir vandenį
SO3+2NaOH=Na2So4+H2o
G) Amf me reaguoja su stipriais šarmais, taip parodydamas jų rūgštines savybes, pavyzdžiui:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O Amfoteriniai oksidai su šarmais gali reaguoti dviem būdais: tirpale ir lydaloje.
Kai tirpalas reaguoja su šarmu, susidaro įprasta vidutinė druska (kaip parodyta aukščiau pateiktame pavyzdyje).
Tirpale reaguojant su šarmu susidaro kompleksinė druska.
Al 2 O 3 + 2NaOH + 3H 2 O → 2Na (šiuo atveju susidaro natrio tetrahidroksoaliuminatas)
Šarminiai metalai yra bendras cheminių elementų periodinės lentelės 1-osios grupės elementų pavadinimas. Jo sudėtis yra ličio (Li), natrio (Na), kalio (K), rubidžio (Rb), cezio (Cs), francio (Fr) ir hipotetinio elemento ununenio (Uue). Grupės pavadinimas kilęs iš tirpių natrio ir kalio hidroksidų, turinčių šarmų reakciją ir skonį, pavadinimo. Apsvarstykite bendruosius elementų atomų struktūros ypatumus, savybes, paprastų medžiagų gamybą ir naudojimą.
Pasenusi ir nauja grupių numeracija
Pagal pasenusią numeravimo sistemą šarminiai metalai, užimantys kairiausią vertikalią periodinės lentelės stulpelį, priklauso I-A grupei. 1989 m. Tarptautinė chemijos sąjunga (IUPAC) kaip pagrindinę pasiūlė kitą variantą (ilgą laikotarpį). Šarminiai metalai pagal naują klasifikaciją ir ištisinę numeraciją priklauso 1 grupei. Šį rinkinį atidaro 2-ojo laikotarpio atstovas litis, o užbaigia 7-ojo laikotarpio radioaktyvusis elementas francis. Visi I grupės metalai išoriniame atomų apvalkale turi vieną s-elektroną, kurio lengvai atsisako (atkuria).
Šarminių metalų atomų sandara
1-osios grupės elementams būdingas antras energijos lygis, pakartojantis ankstesnių inertinių dujų struktūrą. Ličio priešpaskutiniame sluoksnyje yra 2 elektronai, likusieji turi po 8 elektronus. Cheminėse reakcijose atomai lengvai atiduoda išorinį s-elektroną, įgydami energetiškai palankią tauriųjų dujų konfigūraciją. 1-osios grupės elementai turi mažas jonizacijos energijos ir elektronegatyvumo (EO) vertes. Jie lengvai formuoja vieno krūvio teigiamus jonus. Pereinant nuo ličio prie francio, didėja protonų ir elektronų skaičius, atomo spindulys. Rubidis, cezis ir francis dovanoja išorinį elektroną lengviau nei elementai, esantys prieš juos grupėje. Vadinasi, grupėje iš viršaus į apačią atkuriamoji galia didėja.

Lengvas šarminių metalų oksidiškumas lemia tai, kad 1-osios grupės elementai gamtoje egzistuoja vienkartinio krūvio katijonų junginių pavidalu. Natrio kiekis žemės plutoje - 2,0%, kalio - 1,1%. Kitų elementų jame yra nedideliais kiekiais, pavyzdžiui, francio atsargos - 340 g Natrio chloridas ištirpsta jūros vandenyje, druskingų ežerų ir estuarijų sūryme, formuoja uolienų ar paprastosios druskos nuosėdas. Kartu su halitu atsiranda silvinito NaCl. KCl ir silvinas KCl. Lauko špatą sudaro kalio aliumosilikatas K 2 . Natrio karbonatas yra ištirpęs daugelio ežerų vandenyje, o elemento sulfato atsargos telkiasi Kaspijos jūros (Kara-Bogaz-Gol) vandenyse. Čilėje yra natrio nitrato nuosėdų (Čilės salietros). Gamtoje esančių ličio junginių yra ribotas skaičius. Rubidis ir cezis randami kaip priemaišos I grupės elementų junginiuose, o francis – urano rūdų sudėtyje.
Šarminių metalų atradimo seka
Britų chemikas ir fizikas G. Davy 1807 metais atliko šarminių lydalų elektrolizę, pirmą kartą gaudamas natrio ir kalio laisvą formą. 1817 metais švedų mokslininkas Johannas Arfvedsonas mineraluose atrado elementą ličio, o 1825 metais G. Davy išskyrė gryną metalą. Pirmą kartą rubidį 1861 m. atrado R. Bunsenas ir G. Kirchhoffas. Vokiečių mokslininkai išanalizavo aliuminio silikatų sudėtį ir spektre gavo raudoną liniją, atitinkančią naują elementą. 1939 m. Paryžiaus radioaktyvumo instituto darbuotoja Marguerite Pere nustatė francio izotopo egzistavimą. Ji taip pat pavadino elementą savo tėvynės garbei. Ununennium (eca-francium) yra laikinasis naujo tipo atomo, kurio atominis numeris 119, pavadinimas. Cheminis simbolis Uue naudojamas laikinai. Tyrėjai nuo 1985 m. bando susintetinti naują elementą, kuris bus pirmasis 8 periode, septintas 1 grupėje.
Fizikinės šarminių metalų savybės

Beveik visi šarminiai metalai yra sidabriškai balti ir šviežiai supjaustyti turi metalinį blizgesį (cezis yra aukso geltonumo). Ore blizgesys blėsta, atsiranda pilka plėvelė, ant ličio – žalsvai juoda. Šis metalas yra didžiausio kietumo tarp savo kaimynų grupėje, tačiau yra prastesnis už talką – minkštiausią mineralą, atveriantį Moso skalę. Natris ir kalis lengvai sulenkiami, juos galima pjaustyti. Rubidis, cezis ir francis gryna forma sudaro pastos masę. Šarminių metalų lydymasis vyksta palyginti žemoje temperatūroje. Ličio atveju jis pasiekia 180,54 °C. Natris lydosi 97,86°C, kalis – 63,51°C, rubidis – 39,32°C, cezis – 28,44°C. Šarminių metalų tankis yra mažesnis nei su jais susijusių medžiagų. Litis plūduriuoja žibale, pakyla į vandens paviršių, jame taip pat plūduriuoja kalis ir natris.
Kristalinė būsena
Šarminių metalų kristalizacija vyksta kubinėje singonijoje (centrinėje kūno dalyje). Jo sudėtyje esantys atomai turi laidumo juostą, iki kurios laisvųjų lygių gali praeiti elektronai. Būtent šios aktyvios dalelės atlieka ypatingą cheminį ryšį – metalinį. Energijos lygių struktūros bendrumas ir kristalų gardelių prigimtis paaiškina I grupės elementų panašumą. Pereinant nuo ličio prie cezio, didėja elementų atomų masės, todėl reguliariai didėja tankis, taip pat keičiasi kitos savybės.
Cheminės šarminių metalų savybės
Vienintelis išorinis elektronas šarminių metalų atomuose yra silpnai traukiamas į branduolį, todėl jiems būdinga maža jonizacijos energija, neigiamas arba artimas nuliui elektronų afinitetas. 1-osios grupės elementai, turintys redukcinį aktyvumą, praktiškai nepajėgūs oksiduotis. Grupėje iš viršaus į apačią padidėja aktyvumas cheminėse reakcijose:

Šarminių metalų gamyba ir naudojimas
1 grupei priklausantys metalai gaminami pramonėje elektrolizės būdu jų halogenidų ir kitų natūralių junginių lydiniams. Skaidant elektros srove, teigiami jonai ant katodo įgyja elektronus ir redukuojami į laisvą metalą. Anijonas oksiduojamas priešingame elektrode.

Hidroksido lydalų elektrolizės metu prie anodo oksiduojasi OH dalelės, išsiskiria deguonis ir gaunamas vanduo. Kitas būdas yra šarminių metalų terminis redukavimas iš jų druskų lydalo su kalciu. Praktinę reikšmę turi paprastos 1 grupės elementų medžiagos ir junginiai. Litis naudojamas kaip žaliava branduolinės energetikos inžinerijoje ir naudojamas raketų technologijoje. Metalurgijoje jis naudojamas vandenilio, azoto, deguonies ir sieros likučiams pašalinti. Hidroksido papildas elektrolitas šarminėse baterijose.

Natris yra būtinas branduolinei energijai, metalurgijai ir organinei sintezei. Cezis ir rubidis naudojami saulės elementų gamyboje. Plačiai naudojami šarminių metalų hidroksidai ir druskos, ypač chloridai, nitratai, sulfatai, karbonatai. Katijonai pasižymi biologiniu aktyvumu, natrio ir kalio jonai ypač svarbūs žmogaus organizmui.
„Litis yra lengviausias metalas; jo savitasis svoris yra 0,59, todėl jis plūduriuoja net ant alyvos; tirpsta apie 185°, bet neišgaruoja karštyje. Spalva primena natrį ir, kaip ir natris, turi geltoną atspalvį.
D. I. Mendelejevas. Chemijos pagrindai.
Kai 1817 m. 25 metų švedų chemikas Johanas Augustas Arfvedsonas (1792-1841) iš mineralinio petalito (tai buvo ličio hidroksidas) išskyrė naują „iki šiol nežinomos prigimties degųjį šarmą“, jo mokytojas, garsus švedų chemikas Jensas. Jakobas Berzelius (1779-1848) pasiūlė jį vadinti lition, iš graikų kalbos. litosas – akmuo.

Šis šarmas, priešingai nei jau žinomas natris ir kalis, pirmą kartą buvo atrastas akmenų „karalystėje“. 1818 metais anglų chemikas Humphrey Davy (1778-1829) iš ličio gavo naują metalą, kurį pavadino ličiu. Ta pati graikiška šaknis yra žodžiuose „litosfera“, „litografija“ (įspaudas iš akmens formos) ir kt.
Litis yra lengviausias iš kietųjų medžiagų: jo tankis yra tik 0,53 g/cm3 (pusė vandens). Litis gaunamas elektrolizės būdu iš ličio chlorido lydalo. Reta metalinio ličio savybė yra reakcija su azotu normaliomis sąlygomis, kad susidarytų ličio nitridas.
Litis vis dažniau naudojamas ličio jonų akumuliatorių gamyboje. Dėl to 2012 metais pasaulyje buvo pagaminta 37 tūkstančiai tonų ličio – penkis kartus daugiau nei 2005 metais.
Ličio junginiai naudojami stiklo ir keramikos pramonėje. Ličio hidroksidas yra anglies dioksido pertekliaus sugėriklis erdvėlaivių ir povandeninių laivų salonuose. Ličio karbonatas naudojamas psichiatrijoje tam tikriems sutrikimams gydyti. Vidutiniame žmoguje ličio yra mažiau nei 1 mg.
Natrio
 „Metalinio natrio gamyba yra vienas iš svarbiausių chemijos atradimų ne tik dėl to, kad taip išsiplėtė ir tapo teisingesnė paprastų kūnų samprata, bet ypač dėl to, kad natrio cheminės savybės matomos, o kitose gerai žinomose – tik silpnai išreikštos. metalai“.
„Metalinio natrio gamyba yra vienas iš svarbiausių chemijos atradimų ne tik dėl to, kad taip išsiplėtė ir tapo teisingesnė paprastų kūnų samprata, bet ypač dėl to, kad natrio cheminės savybės matomos, o kitose gerai žinomose – tik silpnai išreikštos. metalai“.
D. I. Mendelejevas. Chemijos pagrindai.
Rusiškas pavadinimas „natris“ (jis yra ir švedų bei vokiečių kalbomis) kilęs iš žodžio „natron“: taip senovės egiptiečiai vadino sausą soda, kuri buvo naudojama mumifikacijos procese. XVIII amžiuje pavadinimas „natronas“ buvo priskirtas „mineraliniam šarmui“ – kaustinei sodai. Dabar natrio kalkės vadinamos kaustinės sodos ir kalcio oksido mišiniu (angliškai soda lime), o angliškai - natriu (ir daugeliu kitų kalbų - natrio). Žodis „soda“ kilęs iš lotyniško augalo pavadinimo „hodgepodge“ (sodanas). Tai pakrantės jūrinis augalas, kurio pelenai senovėje buvo naudojami stiklo gamybai. Šiuose pelenuose yra natrio karbonato, kuris vadinamas soda. Ir dabar soda yra svarbiausias mokesčio komponentas gaminant daugumą stiklo, įskaitant langų stiklą.
 Halitas yra pagrindinis natrio mineralas
Halitas yra pagrindinis natrio mineralas Pirmasis žmogus, pamatęs, kaip atrodo metalinis natris, buvo G. Davy, kuris elektrolizės būdu išskyrė naująjį metalą. Jis pasiūlė ir naujojo elemento pavadinimą – natris.
Natris yra labai aktyvus metalas, greitai oksiduojasi ore, pasidengdamas stora reakcijos produktų pluta su deguonimi ir vandens garais. Yra žinoma paskaitų patirtis: jei mažas natrio gabalėlis bus įmestas į vandenį, jis pradės su juo reaguoti, išskirdamas vandenilį. Reakcijoje išsiskiria daug šilumos, dėl kurios natris ištirpsta, o jo rutulys bėga paviršiumi. Vanduo atvėsina natrį ir neleidžia vandeniliui pliūpti, tačiau jei natrio gabalėlis didelis, galimas gaisras ir net sprogimas.
Natrio metalas plačiai naudojamas įvairiose sintezėse kaip reduktorius, taip pat kaip nevandeninių skysčių sausiklis. Jo yra didelės talpos natrio-sieros akumuliatoriuose. Žemai tirpstantis natrio ir kalio lydinys, skystas kambario temperatūroje, veikia kaip aušinimo skystis, pašalinantis šiluminės energijos perteklių iš branduolinių reaktorių. Visi žino geltoną liepsnos spalvą esant natriui: taip nuspalvinama dujinio degiklio liepsna, jei į ją patenka mažiausias sūrios sriubos lašelis. Natrio garai geltonai šviečia ekonomiškose dujų išlydžio lempose, kurios apšviečia gatves.
Daugelį amžių druska buvo vienintelis būdas išsaugoti maistą. Be valgomosios druskos būtų neįmanomos ilgos kelionės jūra, ekspedicijos aplink pasaulį ir dideli geografiniai atradimai. Rusijos istorija žino didžiulį sukilimą, vadinamą druskos riaušėmis, prasidėjusiu 1648 m. ir apėmusiu visą šalį. Viena iš sukilimo priežasčių – padidintas mokestis druskai.
Kadaise per metus buvo pagaminama šimtai tūkstančių tonų natrio: iš jo buvo gaminamas tetraetilšvinas, didinantis benzino oktaninį skaičių. Daugelyje šalių uždraudus benziną su švinu sumažėjo natrio gamyba. Dabar pasaulyje per metus pagaminama apie 100 tūkst. tonų natrio.
Mineralinis halitas (natrio chloridas) sudaro didžiulius akmens druskos telkinius. Tik Rusijoje jos atsargos siekia dešimtis milijardų tonų. Halite paprastai yra iki 8% kitų druskų, daugiausia magnio ir kalcio. Kasmet išgaunama daugiau nei 280 milijonų tonų natrio chlorido, tai yra viena didžiausių produkcijos. Kadaise Čilėje natrio nitratas buvo iškasamas dideliais kiekiais, todėl ir kilo jo pavadinimas – Čilės nitratas.
Taip pat naudojamos ir kitos natrio druskos, kurių šiuo metu žinoma daug. Vienas žinomiausių yra natrio sulfatas. Jei šioje druskoje yra vandens, ji vadinama Glauberio druska. Didžiuliai jo kiekiai susidaro garuojant vandeniui Kaspijos jūros Kara-Bogaz-Gol įlankoje (Turkmėnistanas), taip pat kai kuriuose druskinguose ežeruose. Šiuo metu natrio sulfato tirpalai naudojami kaip šilumos akumuliatorius saulės energiją kaupiančiuose įrenginiuose, stiklo, popieriaus, audinių gamyboje.
 Druska
Druska Natris yra gyvybiškai svarbus elementas. Natrio jonai daugiausia randami tarpląsteliniame skystyje ir dalyvauja raumenų susitraukimų mechanizme (natrio trūkumas sukelia traukulius), palaikant vandens ir druskos pusiausvyrą (natrio jonai sulaiko vandenį organizme) ir rūgščių ir šarmų pusiausvyrą (palaiko pastovi kraujo pH vertė). Iš natrio chlorido skrandyje susidaro druskos rūgštis, be kurios neįmanoma virškinti maisto. Vidutinio žmogaus organizme natrio yra apie 100 g.Natris į organizmą patenka daugiausia valgomosios druskos pavidalu, jo paros dozė – 3-6 g.Vienkartinė didesnė nei 30 g dozė yra pavojinga gyvybei.
Kalis
 Arabų kalba al-qili yra pelenai, taip pat kažkas kalcinuoto. Jie taip pat pradėjo vadinti produktą, gautą iš augalų pelenų, t.y. kalio karbonatu. Saulėgrąžų pelenuose kalio yra daugiau nei 30 proc. Be arabiško straipsnio šis žodis rusiškai pavirto į „kalis“. Be rusų ir lotynų (kalium), šis terminas buvo išsaugotas daugelyje Europos kalbų: vokiečių, olandų, danų, norvegų, švedų (su lotyniška galūne -um), graikų (κάλιο), taip pat daugelyje Europos kalbų. Slavų kalbos: serbų (kalyum ), makedonų (kalium), slovėnų (kalij).
Arabų kalba al-qili yra pelenai, taip pat kažkas kalcinuoto. Jie taip pat pradėjo vadinti produktą, gautą iš augalų pelenų, t.y. kalio karbonatu. Saulėgrąžų pelenuose kalio yra daugiau nei 30 proc. Be arabiško straipsnio šis žodis rusiškai pavirto į „kalis“. Be rusų ir lotynų (kalium), šis terminas buvo išsaugotas daugelyje Europos kalbų: vokiečių, olandų, danų, norvegų, švedų (su lotyniška galūne -um), graikų (κάλιο), taip pat daugelyje Europos kalbų. Slavų kalbos: serbų (kalyum ), makedonų (kalium), slovėnų (kalij).
Kalis yra vienas gausiausiai žemės plutoje esančių elementų. Pagrindiniai jo mineralai yra silvinas (kalio chloridas), silvinitas (mišrus kalio ir natrio chloridas) ir karnalitas (mišrus kalio ir magnio chloridas). Silvinas, taip pat kalio nitratas (kalis, tai taip pat yra Indijos nitratas) naudojami dideliais kiekiais kaip kalio trąšos. Kalis kartu su azotu ir fosforu yra vienas iš trijų svarbiausių augalų mitybos elementų.
 Silvinas yra vienas iš pagrindinių kalio mineralų (kartu su silvinitu ir karnalitu).
Silvinas yra vienas iš pagrindinių kalio mineralų (kartu su silvinitu ir karnalitu). Angliškas elemento pavadinimas (kalis), kaip ir rusiškas kalio karbonato (kalio) pavadinimas, yra pasiskolintas iš germanų grupės kalbų; anglų, vokiečių ir olandų kalbomis ash yra ash, pot yra puodas, t.y. potash yra „pelenai iš puodo“. Anksčiau kalio karbonatas buvo gautas išgarinus pelenų ekstraktą cisternose; buvo naudojamas muilui gaminti. Kalio muilas, skirtingai nei natrio muilas, yra skystas. Iš arabiško pelenų pavadinimo kilo šarmo pavadinimas daugelyje Europos kalbų: anglų. ir golis. šarmas, vokiškas Šarminė, prancūziška ir italas. šarmai ir kt. Ta pati šaknis yra žodyje „alkaloidai“, t. y. „kaip šarmai“).
Kalis buvo pirmasis elementas, kurį atrado G. Davy (jis taip pat pirmą kartą gavo ličio, bario, kalcio, stroncio, magnio ir boro). Davy elektrolizavo šlapią kalio hidroksido gabalėlį. Tuo pačiu metu, pasak Davy, „ant jo paviršiaus atsirado maži rutuliukai su stipriu metaliniu blizgesiu, išoriškai nesiskiriantys nuo gyvsidabrio. Kai kurie iš jų iškart po susiformavimo perdegė sprogimu ir pasirodę ryškia liepsna, o kiti neperdegė, o tik pritemo, o jų paviršius buvo padengtas balta plėvele. Kalis yra labai aktyvus metalas. Jo mažas gabalėlis, įneštas į vandenį, sprogsta.
Kalis yra svarbus bioelementas, žmogaus organizme yra nuo 160 iki 250 g kalio, daugiau nei natrio. Kalio jonai dalyvauja perduodant nervinius impulsus. Vaisiuose ir daržovėse yra daug kalio.
Kalio hidroksidas naudojamas muilui gaminti. Jis tarnauja kaip elektrolitas šarminėse baterijose - geležies-nikelio, nikelio-metalo hidrido. Anksčiau kalio nitratas (kalio nitratas) buvo vartojamas dideliais kiekiais juodųjų miltelių gamybai; dabar naudojama kaip trąša.
Natūraliame kalyje yra 0,0117% ilgalaikio radionuklido 40K, kurio pusinės eliminacijos laikas yra 1,26 milijardo metų. Tai paaiškina faktą, kad kalis-40 „išliko“ iki mūsų laikų nuo jo sintezės momento branduolinėse reakcijose žvaigždėse. Tačiau nuo Žemės susiformavimo prieš 4,5 milijardo metų 40K kiekis planetoje sumažėjo 12,5 karto dėl jo irimo! 70 kg sveriančiame žmogaus kūne yra maždaug 20 mg 40K arba 3 x 1020 atomų, iš kurių daugiau nei 5000 atomų skyla kas sekundę! Gali būti, kad toks „vidinis“ švitinimas (sustiprintas anglies-14 irimo) buvo viena iš mutacijų priežasčių vykstant laukinės gamtos evoliucijai. Pasaulyje kalio metalo gamyba nedidelė: apie 200 tonų per metus.
rubidis ir cezis
Rubidis ir cezis yra pirmieji cheminiai elementai, atrasti naudojant spektrinę analizę. Šį metodą sukūrė vokiečių mokslininkai ir draugai – fizikas Gustavas Robertas Kirchhoffas (1824-1887) ir chemikas Robertas Wilhelmas Bunsenas (1811-1899), dirbę Heidelbergo universitete. Šiuo itin jautriu metodu jie išanalizavo visas sutiktas medžiagas, tikėdamiesi rasti ką nors naujo. Ir 1860-ųjų pradžioje. atrado du naujus elementus. Taip atsitiko, kai jie išanalizavo sausas liekanas, gautas išgarinant vandenį iš Bad Diurkheimo kurorto, esančio 30 km nuo Heidelbergo, mineralinių šaltinių. Šios medžiagos spektre, be jiems jau žinomų natrio, kalio ir ličio linijų, Kirchhoffas ir Bunsenas pastebėjo dvi silpnas mėlynas linijas. Jie suprato, kad šios linijos priklauso nežinomam cheminiam elementui, kurio vandenyje yra labai mažais kiekiais. Pagal spektro linijų šviesą naujas elementas
Tęsdami tyrimus, Kirchhoffas ir Bunsenas iš Saksonijos jiems atsiųstame aliumosilikato minerale lepido (ličio žėručio) aptiko dar vieną elementą, kurio spektre išsiskyrė tamsiai raudonos linijos. Jis buvo vadinamas rubidiumu: iš lat. rubidas - raudonas. Tas pats elementas buvo rastas mineraliniame vandenyje, iš kurio chemikui Bunsenui pavyko jį išskirti. Verta paminėti, kad norint gauti kelis gramus rubidžio druskos, reikėjo apdoroti 44 tonas mineralinio vandens ir per 180 kg lepidolito.
 Cezio kristalus galima laikyti sandarioje ampulėje.
Cezio kristalus galima laikyti sandarioje ampulėje. Ir kaip XIX amžiaus pabaigoje, ne mažiau titaniškame radžio druskos išskyrimo darbe Marie Curie „kompasas“ buvo radioaktyvumas, panašus „kompasas“ Kirchhoffui ir Bunsenui buvo spektroskopas.
Rubidis ir cezis yra tipiški šarminiai metalai. Tai buvo patvirtinta, kai chemikas Bunsenas, redukuodamas rubidžio druską, gavo šį elementą metalo pavidalu. Aktyvesnį cezią gryna forma gavo tik 1881 metais švedų chemikas Carlas Theodoras Setterbergas (1853-1941), elektrolizuodamas išlydytą cezio cianidą. Cezis yra vienas iš labiausiai tirpstančių metalų. Gryna forma yra auksinės spalvos. Tačiau gryno cezio gauti nėra lengva: ore jis akimirksniu užsidega savaime. Grynas rubidis tirpsta tik 39,3 °C temperatūroje, cezis – 10 laipsnių žemesnėje temperatūroje, o labai karštą vasaros dieną šių metalų mėginiai ampulėse tampa skysti.
Pasaulyje metalinio rubidžio gamyba yra nedidelė – apie 3 tonas per metus. Rubidis-87 naudojamas medicinoje: jo atomus sugeria kraujo ląstelės, o jais išspinduliuojant greituosius elektronus, specialios aparatūros pagalba kraujagyslėse matomos „butrosios vietos“. Rubidis naudojamas saulės elementuose.
 Gustavas Kirchhoffas (kairėje) ir Robertas Bunsenas atrado rubidį naudodami spektroskopą. Lepidolito spektre jie rado tamsiai raudonas linijas ir suteikė pavadinimą naujam elementui – rubidžiui.
Gustavas Kirchhoffas (kairėje) ir Robertas Bunsenas atrado rubidį naudodami spektroskopą. Lepidolito spektre jie rado tamsiai raudonas linijas ir suteikė pavadinimą naujam elementui – rubidžiui. Vidutinio amžiaus žmogaus organizme rubidžio yra maždaug 0,7 g, o cezio – tik 0,04 mg.
Elektroniniai perėjimai cezio atomuose naudojami itin tiksliuose „atominiuose laikrodžiuose“. Visame pasaulyje dabar yra daugiau nei 70 tokių tiksliausių laikrodžių – laiko etalonų: paklaida yra mažesnė nei sekundė per 100 milijonų metų. Cezio laikrodis turi laiko vienetą – sekundę.
Raketai pagreitinti, naudojant elektrinį reaktyvinį variklį, buvo pasiūlyta panaudoti cezio jonus. Jame jonai pagreitinami stipriame elektrostatiniame lauke ir išstumiami per antgalį.
Mažos traukos elektriniai raketų varikliai gali veikti ilgą laiką ir skristi dideliais atstumais.
Prancūzija
 Šį elementą (pagal radioaktyvumą) 1939 m. atrado Paryžiaus Radžio instituto darbuotoja Marguerite Perey (1909-1975) ir pavadino jį savo tėvynės garbei 1946 m.
Šį elementą (pagal radioaktyvumą) 1939 m. atrado Paryžiaus Radžio instituto darbuotoja Marguerite Perey (1909-1975) ir pavadino jį savo tėvynės garbei 1946 m.
Francis yra cezio kaimynas periodinėje elementų lentelėje. D. I. Mendelejevas tuomet dar neatrastą elementą pavadino ekaceziu. Šis paskutinis ir sunkiausias šarminis metalas stulbinamai skiriasi nuo visų kitų savo grupės. Pirma, niekas niekada nematė ir nepamatys net mažiausio Prancūzijos gabalėlio. Antra, francis neturi tokių fizinių savybių kaip tankis, lydymosi temperatūra ir virimo temperatūra. Taigi terminą „sunkiausias metalas“ galima priskirti tik jo atomams, bet ne paprastai medžiagai. Ir viskas dėl to, kad francis yra dirbtinai gautas labai radioaktyvus elementas, jo ilgiausiai gyvenančio izotopo 223 Fr pusinės eliminacijos laikas yra tik 22 minutės. O norint ištirti medžiagos fizines savybes, reikia ją turėti bent mažiausio gabalėlio pavidalu. Tačiau Prancūzijai tai neįmanoma.
 Marguerite Perey yra pirmoji moteris, išrinkta (1962 m.) į Prancūzijos mokslų akademiją.
Marguerite Perey yra pirmoji moteris, išrinkta (1962 m.) į Prancūzijos mokslų akademiją. Francis gaunamas dirbtiniu būdu. Ir kai jis susilieja, jo atomai greitai skyla. Be to, kuo daugiau sukaupta atomų, tuo daugiau jų suyra per laiko vienetą. Taigi, norint tiesiog išlaikyti pastovų francio atomų skaičių, jie turi būti sintetinami ne mažesniu nei jų skilimo greičiu. Dubnoje vykdant francio sintezę uraną apšvitinant galingu protonų pluoštu, kas sekundę buvo pagaminama apie milijonas šio elemento atomų. Esant tokiam sintezės greičiui, mėginio skilimo greitis tampa lygus jo susidarymo greičiui, kai jo atomų skaičius lygus dviem milijardams. Tai visiškai nereikšmingas medžiagos kiekis, jis net nematomas pro mikroskopą.
Be to, šie atomai nėra surinkti į metalo gabalą, o yra paskirstyti urano taikinio paviršiuje. Tad nenuostabu, kad visame pasaulyje bet kuriuo momentu radioaktyviosiose uolienose pavieniui bus išsklaidyta ne daugiau kaip dvi ar trys dešimtys gramų francio.

Chemija tiria metalų ir nemetalų savybes. Ar žinojote, kad yra šarminių ir nešarminių metalų? Ir mes ne tik žinome, bet ir pateiksime sėkmingo pasiruošimo chemijos dalykui sąrašą. Taigi, šarminių metalų sąrašas jau pateiktas Mendelejevo periodinėje lentelėje. Ten visi pirmosios grupės pagrindinio pogrupio metalai yra šarminiai.
Tai yra litis, kalis, natris, cezis, rubidis ir francis. Tik šie metalai vadinami šarminiais. Ir jie taip vadinami, nes jei jie sąveikauja su vandeniu, tada susidaro šarmai.
Yra ir kita metalo rūšis – tai šarminės žemės. Jei norite tik šarminių metalų sąrašo, tada yra tik 6 metalai. Jei visi metalai, kurių hidroksidai turi šarminių savybių, pateks dar keturi elementai – kalcis, stroncis, baris ir radis.
Sunku gamtoje rasti visus šarminius metalus grynu pavidalu – juk jie lengvai patenka į junginius. Visų pirma, šie metalai randami šių junginių pavidalu.
Šarminių metalų savybės
Šarminiai metalai yra puikūs šilumos laidininkai ir yra geri elektros laidininkai.
Šarminiai metalai turi žemą lydymosi temperatūrą
Metalų tankis didėja didėjant skaičiui, tačiau juos lengviau išlydyti, jei metalai yra grupės apačioje.
Šarminių metalų gavimas
Paprastai šarminiai metalai gaunami elektrolizės būdu, tačiau du šarminių žemių metalai – stroncis ir baris – gaunami naudojant aliuminoterminį metodą.
Cheminės savybės
Kaip minėjome, šie metalai yra labai aktyvūs, jie taip pat yra puikios reduktorius. Jie randami junginių pavidalu, kuriuose joninė jungtis bus pagrindinė.
Paprastai jie visada sudaro stabilius junginius. Pagrindinės šarminių metalų reakcijos ir papildomos savybės pateiktos lentelėje:
Taigi dabar, naudodamiesi sąrašu ir lentele, taip pat periodine Mendelejevo sistema, galite daug pasakyti apie šarminius metalus.
Galite pamatyti, kaip atrodo šarminiai metalai. Taip pat yra sąrašas ir nurodytos jungčių reakcijos su vandeniu, siera, rūgštimis, druskomis ir halogenais.
Šarminiai metalai yra neorganinių medžiagų grupė, paprasti periodinės lentelės elementai. Visi jie turi panašią atominę struktūrą ir atitinkamai panašias savybes. Į grupę įeina kalis, natris, litis, cezis, rubidis, francis ir teoriškai aprašytas, bet dar nesusintetintas elementas ununenas. Pirmosios penkios medžiagos egzistuoja gamtoje, francis yra dirbtinai sukurtas radioaktyvus elementas. Šarminiai metalai gavo savo pavadinimą dėl gebėjimo sudaryti šarmus reaguodami su vandeniu.
Visi grupės elementai yra chemiškai aktyvūs, todėl Žemėje jų randama tik įvairių mineralų sudėtyje, pavyzdžiui, uolienos, kalio, paprastosios druskos, borakso, lauko špato, jūros vandens, požeminių sūrymų, Čilės salietros. Francis dažnai lydi urano rūdas; rubidis ir cezis yra mineralai su natriu ir kaliu.
Savybės
Visi grupės atstovai yra minkštieji metalai, juos galima pjaustyti peiliu, lenkti rankomis. Išoriškai – blizgus, baltas (išskyrus cezį). Cezis suteikia auksinį blizgesį. Šviesa: natris ir kalis yra lengvesni už vandenį, litis plūduriuoja net žibale. Klasikiniai metalai, pasižymintys geru elektros ir šilumos laidumu. Jie dega, suteikia liepsnai būdingą spalvą, kuri yra vienas iš analitinių būdų nustatyti metalo rūšį. Lydomasis, „ugniai atspariausias“ yra litis (+180,5 ° C). Cezis tirpsta tiesiai rankose +28,4 °C temperatūroje.
 Aktyvumas grupėje didėja didėjant atominei masei: Li →Cs. Jie turi redukuojančių savybių, įskaitant reakciją su vandeniliu. Rodyti valentiškumą -1. Smarkiai reaguoti su vandeniu (viskas, išskyrus litį – sprogsta); su rūgštimis ir deguonimi. Sąveika su nemetalais, alkoholiais, vandeniniu amoniaku ir jo dariniais, karboksirūgštimis ir daugeliu metalų.
Aktyvumas grupėje didėja didėjant atominei masei: Li →Cs. Jie turi redukuojančių savybių, įskaitant reakciją su vandeniliu. Rodyti valentiškumą -1. Smarkiai reaguoti su vandeniu (viskas, išskyrus litį – sprogsta); su rūgštimis ir deguonimi. Sąveika su nemetalais, alkoholiais, vandeniniu amoniaku ir jo dariniais, karboksirūgštimis ir daugeliu metalų.
Kalis ir natris yra biogeniniai elementai, dalyvaujantys žmogaus organizmo vandens-druskos ir rūgščių-šarmų balanse, būtini normaliai kraujotakai ir daugelio fermentų veiklai. Kalis yra svarbus augalams.
Mūsų kūne taip pat yra rubidžio. Jo rasta kraujyje, kauluose, smegenyse, plaučiuose. Pasižymi priešuždegiminiu, antialerginiu poveikiu, lėtina nervų sistemos reakcijas, stiprina imuninę sistemą, teigiamai veikia kraujo sudėtį.
Atsargumo priemonės
Šarminiai metalai yra labai pavojingi, gali užsidegti ir sprogti tiesiog nuo sąlyčio su vandeniu ar oru. Daugelis reakcijų vyksta audringai, todėl dirbti su jomis leidžiama tik atidžiai instruktavus, laikantis visų atsargumo priemonių, su apsaugine kauke ir akiniais.
Kalio, natrio ir ličio tirpalai vandenyje yra stiprūs šarmai (kalio, natrio, ličio hidroksidai); Sąlytis su oda sukelia gilius, skausmingus nudegimus. Sąlytis su šarmais, net ir mažomis koncentracijomis, patenka į akis, gali sukelti aklumą. Reakcijos su rūgštimis, amoniaku, alkoholiais vyksta, kai išsiskiria degus ir sprogus vandenilis.
Šarminiai metalai laikomi po žibalo arba vazelino sluoksniu sandariuose induose. Manipuliacijos grynais reagentais atliekamos argono atmosferoje.
Eksperimentų su šarminiais metalais likučius reikia šalinti atsargiai. Visus metalo likučius pirmiausia reikia neutralizuoti.
Taikymas