Įvadas
Iki praėjusio amžiaus šeštojo dešimtmečio organinė chemija sukaupė didžiulį kiekį faktinės medžiagos, kurią reikėjo paaiškinti. Nuolat kaupiant eksperimentinius faktus, organinės chemijos teorinių sampratų nepakankamumas ypač išryškėjo. Teorija atsiliko nuo praktikos ir eksperimento. Šis atsilikimas skaudžiai atsispindėjo atliekant eksperimentinius tyrimus laboratorijose; chemikai savo tyrimus atliko daugiausia atsitiktinai, aklai, dažnai nesuprasdami sintezuojamų medžiagų prigimties ir reakcijų, dėl kurių jos susidarė, esmės. Pavyzdžiui, anglas V. Perkinas vyresnysis, 1856 m. susintetinęs dažiklį mauveine oksiduodamas nešvarų anilą, visiškai neįsivaizdavo savo atrastos reakcijos mechanizmo; be to, jis visai nekėlė uždavinio sintetinti dažus, o bandė gauti chininą. Organinė chemija, taikliai Wöhlerio išraiška, priminė tankų mišką, pilną nuostabių dalykų, didžiulį tankmę be išėjimo ir pabaigos.
Aktualios organinės chemijos problemos reikalavo išspręsti pagrindinį klausimą: ar molekulės yra atsitiktinė atomų krūva, kurią kartu laiko patrauklios jėgos, ar molekulės yra tam tikros struktūros dalelės, kurias galima nustatyti tiriant medžiagos savybes. Gerard'o tipų teorija, kurią su tam tikromis išlygomis pripažino dauguma to meto chemikų, atsisakė spręsti molekulių sandaros problemą, pagrįstą cheminių savybių tyrimu. Tuo tarpu organinėje chemijoje tuo metu jau buvo susikaupę faktų ir apibendrinimų, kurie galėjo būti pagrindu sprendžiant šį klausimą. Taigi, pavyzdžiui, radikalų teorija organinei chemijai suteikė itin svarbų apibendrinimą, kuris susideda iš to, kad cheminių reakcijų metu tam tikros atomų grupės nepakitusios pereina iš pradinių medžiagų molekulių į šiose reakcijose susidariusias molekules. Savo ruožtu tipų teorija labai prisidėjo tiriant pačias kintamiausias molekulių dalis ir šio kintamumo priežastis.
1 skyrius
1.1. Elementų valentingumo atradimas
Tyrinėdamas organometalinių junginių sudėtį, Franklandas (1853) nustatė, kad kiekvienas metalas duoda junginių su griežtai apibrėžtu radikalų skaičiumi; šis skaičius yra metalo valentingumas. Žemiau pateikiami paprasčiausi metalo organiniai junginiai iš vieno, dviejų, trijų ir keturiavalenčių metalų:
Po Franklando atradimo tapo aišku, kad atomai gali jungtis į molekules tik santykiuose, kuriuos lemia atomų valentingumas. Visų pirma buvo nustatyta, kad anglis yra keturvalentė (Kekule, Kolbe).
Valentiškumo atradimas tiesiogiai paskatino idėją, kad molekulės turi apibrėžtą struktūrą. Tačiau klausimai apie molekulių struktūros nustatymo būdus, taip pat medžiagos savybių priklausomybę nuo jos molekulių struktūros liko atviri.
Nauja era organinėje chemijoje atėjo atsiradus cheminės struktūros teorijai. Pagrindinis vaidmuo kuriant, pagrindžiant ir patvirtinant struktūros teoriją priklauso garsiam rusų mokslininkui Aleksandrui Michailovičiui Butlerovui., nors be jo, šios teorijos elementus pradėjo plėtoti A. Cooperis (1831-1892) Anglijoje ir A. Kekule (1829-1896) Vokietijoje.
1.2. A. Cooperio raidos
1858 m. Cooperis trimis kalbomis (anglų, prancūzų ir vokiečių) paskelbė straipsnį „Apie naują cheminę teoriją“, kuriame atmeta tipų teoriją ir išreiškia požiūrį, pagal kurį gali būti visos organinių medžiagų savybės. paaiškinama, jei atsižvelgiama tik į dvi atomų savybes: "selektyvus giminingumas" (atomų ryšys) ir "afiniteto laipsnis" (atomų valentingumas).
Cooperis rašė: „Mano požiūriu, šių dviejų savybių pakanka paaiškinti viską, kas būdinga organinei chemijai: štai ką aš įrodysiu toliau... Molekulėje, susidedančioje iš trijų, keturių, penkių ir tt anglies atomų. ir lygiaverčiai vandenilio, deguonies ir kt. kiekiai, pastarieji gali būti pakeisti kitais elementais, o anglis sudaro tarpusavyje sujungtą mazgą. Tai reiškia kad viena anglis yra sujungta su kita anglimi. Ši savybė suteikia anglies, galima sakyti, savotišką fizionomiją ir leidžia suprasti iki tol nesuvokiamą anglies atomų sluoksniavimosi organiniuose junginiuose faktą.
Taip priėjęs prie svarbios idėjos apie anglies atomų grandinę, Cooperis toliau išreiškia savo nuomonę formulėmis, kurios pagal jo planą turėtų pateikti junginių struktūros vaizdą. Kaip jo formulių, kurios buvo pirmosios konstitucinės formulės, pavyzdį galima pateikti:

Iš šių pavyzdžių matyti, kad Cooperis sugebėjo stebėtinai teisingai perteikti šių junginių sudėtį, taip pat kai kuriuos sudėtingesnius ir tuo metu mažai tyrinėtus (vyno ir vyno rūgštis).
Tačiau visoms šioms formulėms buvo atimtas eksperimentinis pagrindimas. Cooperis visai nekėlė klausimo dėl jų eksperimentinio patikrinimo galimybės. Jo formulės, kaip nesunku suprasti, buvo pagrįstos formalia valentingumo ir atomų jungimosi sąvokų interpretacija ir iš dalies netgi intuicija. Natūralu, kad naudojant šį metodą klaidų išvengti neįmanoma. Taigi, pavyzdžiui, Cooperio pateiktos glicerolio, glicerino rūgšties ir oksalo rūgšties formulės jau yra neteisingos:

Taigi Cooperio pažiūros, kurias jis išplėtojo savo talentingame, įdomiame darbe, neturi griežtos teorijos pobūdžio.
1.3. Loschmidto konstitucines formules
Kita 1861 m. Loschmidtas bandė pavaizduoti organinius junginius konstitucinėmis formulėmis. . Kurdamas savo formules, Loschmidtas laikė atomus mažiausiomis materialiomis dalelėmis, kurias veikia traukos ir atstūmimo jėgos. Šios jėgos yra subalansuotos, kai atomai artėja vienas prie kito, o įvairūs atomai laikomi šalia vienas kito tam tikroje pusiausvyros padėtyje. Loschmidtas savavališkai pažymėjo atominių jėgų veikimo sferas apskritimais (pavyzdžiui, anglies ir vandenilio atomai – paprasti apskritimai, deguonis – dvigubai, azoto – trigubai).
Loschmidto formulės buvo tokios formos:

Nesistengdamas susidaryti jokios idėjos apie šešių anglies atomų ryšį benzeno molekulėje, Loschmidtas benzeną pažymėjo simboliu

Skirtingai nei Cooperis, rinkdamasis formules, Loschmidtas, be valentingumo (jo išraiška „pollentiškumas“), kartais vadovavosi ir cheminėmis savybėmis. Tačiau apskritai Loschmidto formulių išvedimo metodas buvo abstraktus ir dažnai tiesiog nepagrįstas. Taigi, nesiremdamas cheminiais duomenimis, Loschmidtas bandė išvesti tokių sudėtingų medžiagų, kaip indigo, šlapimo rūgštis ir kt., formules.
Natūralu, kad šios formulės buvo klaidingos. Nepaisant to, kad daugelis Loschmidto pasiūlytų organinių junginių formulių pasirodė sėkmingos, jo darbas liko beveik nepastebėtas to meto chemikų ir neturėjo didelės įtakos organinės chemijos teorijos raidai.
1.4. Prisidėjo prie struktūrinės teorijos kūrimo Kekulė
Didelį indėlį kuriant struktūrinę teoriją įnešė garsus vokiečių chemikas Kekulė. Jis nustatė anglies tetravalentiškumą, įvedė metano rūšį, pasiūlė gerai žinomą benzeno formulę, o svarbiausia – teisingai suformulavo vieną pagrindinių to meto organinės chemijos problemų.
Straipsnyje „Apie cheminių junginių susidarymą ir virsmą bei apie anglies cheminę prigimtį“ Kekulė 1858 m.: „Manau, kad šiuo metu pagrindinis chemijos uždavinys yra ne atominių grupių, kurios dėl kai kurių savo savybių gali būti laikomos radikalais, atradimas ir junginių priskyrimas tam tikriems tipams, kurie vargu ar turi kitą reikšmę. nei kaip pavyzdines formules. Atvirkščiai, aš manau, kad apmąstymą būtina išplėsti į pačių radikalų struktūrą; iš elementų prigimties reikia spręsti ir radikalų, ir jų junginių prigimtį. Atspirties tašku Kekulė laikė „elemento pagrindą“ (valentingumą), o organinių junginių atžvilgiu – visų pirma anglies prigimtį. Kekulė išsakė ir nemažai kitų teisingų minčių apie atomų ryšį, išreikšdama tai grafinėmis formulėmis. Tačiau Kekulė savo formulėms nesureikšmino struktūros formulių, jomis siekė išreikšti tik reaktyvumą. Taigi, jis rašė: „Racionaliomis formulėmis siekiama pateikti aiškų supratimą apie junginio cheminę prigimtį, taigi ir apie jo metamorfozes bei jo santykį su kitais kūnais... Tuo pačiu, natūralu, reikia turėti omenyje, kad racionalios formulės - tai tik transformacijų formulės, o ne konstitucinės formulės, kad jos yra tik kūnų metamorfozių ir įvairių substancijų palyginimo tarpusavyje rezultatų išraiškos priemonė; kad jokiu būdu jie neturėtų išreikšti konstitucijos, t. y. atomų išsidėstymo atitinkamame junginyje.
Nustatyti tikrąją molekulių struktūrą Kekulė laikė ir chemijos uždaviniu, tačiau, jo nuomone, tai galima pasiekti ne tiriant chemines transformacijas, o tik lyginamuoju junginių fizikinių savybių tyrimu. Taigi ir šiuo klausimu Kekulė stovėjo Gérardo pozicijoje.
Kaip ir kiti tipo teoretikai, Kekulė materiją vaizdavo keliomis tipinėmis formulėmis. Taigi, pavyzdžiui, norėdamas perteikti tuomet žinomas acto rūgšties chemines savybes, Kekulė pasiūlė ją pavaizduoti aštuoniomis formulėmis. Taigi, nors Kekulės pažiūros buvo artimos naujoms struktūrinėms pažiūroms, nors Kekulė įnešė svarų indėlį į cheminės sandaros teorijos raidą, jis negalėjo visiškai išsivaduoti nuo tipo teorijos idėjų.
2 skyrius. A.M.Butlerovo cheminės struktūros teorija
2.1. Butlerovo idėjos
A. M. Butlerovas priešinosi tipų teorijos pozicijai apie molekulių struktūros cheminėmis priemonėmis negalimumą nustatyti; jis tai parodė molekulėje yra tam tikra atomų cheminio ryšio seka (cheminė struktūra). Butlerovas tai dar labiau įrodė molekulės sandarą galima nustatyti tiriant chemines medžiagos savybes, ir atvirkščiai, žinant struktūrą, galima numatyti daugybę junginio savybių. Butlerovas ne tik pagrindė šią poziciją jau turima faktine medžiaga, bet ir numatė naujų medžiagų, kurias vėliau atrado jis ir kiti chemikai, egzistavimo galimybę.
Pagrindinę A. M. Butlerovo teorijos idėją jis suformulavo 1861 m. straipsnyje „Apie cheminę medžiagų struktūrą“. Jis rašė: „Remdamasis mintimi, kad kiekvienas cheminis atomas, kuris yra kūno dalis, dalyvauja formuojant pastarąjį ir čia veikia su tam tikra jam priklausančia chemine jėga (afinitetu), cheminę struktūrą vadinu pasiskirstymu. šios jėgos veikimo, dėl kurios cheminiai atomai, netiesiogiai arba tiesiogiai veikiantys vienas kitą, susijungia į cheminę dalelę.
Butlerovo teorijos pagrindas yra idėja apie atomų cheminės sąveikos tvarką molekulėje. . Ši cheminės sąveikos tvarka neapima idėjų apie cheminio ryšio mechanizmą ir fizinį atomų išsidėstymą. Ši svarbi cheminės sandaros teorijos ypatybė leidžia visada ja remtis kuriant fizinį molekulės modelį.
Sukūręs cheminės struktūros sampratą, A. M. Butlerovas pateikia naują apibrėžimą materijos prigimtis : « kompleksinės dalelės cheminę prigimtį lemia elementariųjų sudedamųjų dalių pobūdis, jų kiekis ir cheminė struktūra ».
Taigi A. M. Butlerovas pirmasis tai nustatė kiekviena molekulė turi tam tikrą cheminę struktūrą, kad struktūra lemia medžiagos savybes ir kad tiriant cheminius medžiagos virsmus galima nustatyti jos struktūrą .
2.2. Cheminės struktūrinės formulės
A. M. Butlerovo požiūriai į cheminių struktūrinių formulių reikšmę išplaukia iš pagrindinių jo teorijos nuostatų. Butlerovas manė, kad šios formulės turi būti ne „tipinės“, „reakcinės“, o konstitucinės. Šia prasme kiekvienai medžiagai galima tik viena racionali formulė, pagal kurią galima spręsti apie chemines savybes.
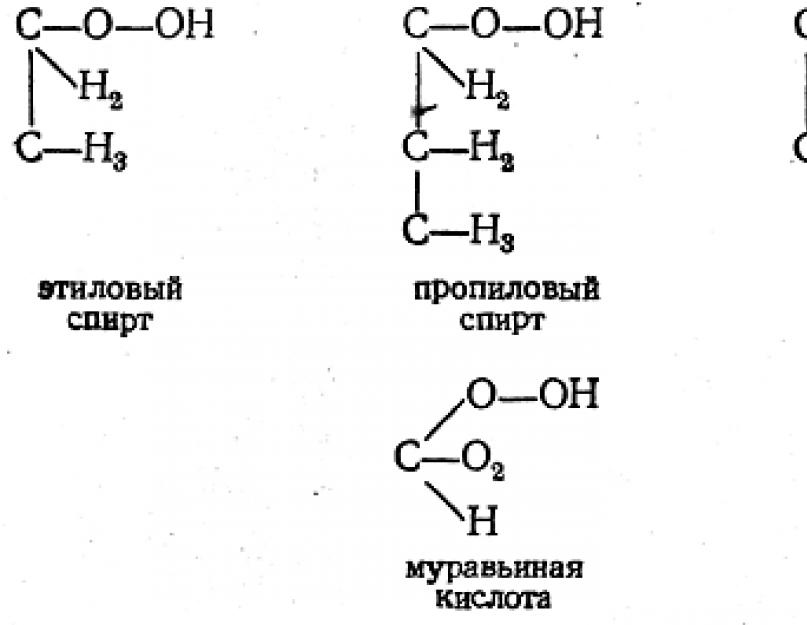
Kalbant apie struktūrinių formulių rašymo metodą, Butlerovas teisingai laikė šį klausimą antraeiliu: „Atmindamas, kad esmė yra ne formoje, o iš esmės, sąvokoje, idėjoje, ir atsižvelgiant į tai, kad formulės, žyminčios izomerizmą , logiškai būtina išreikšti esamąją dalelę, t.y., tam tikrus joje egzistuojančius cheminius ryšius, nesunku prieiti prie išvados, kad bet koks rašymo būdas gali būti geras, jei tik jis patogiai išreiškia šiuos ryšius. Gana natūralu netgi naudoti skirtingus būdus, pirmenybę teikiant tam, kuris konkrečiu atveju yra išraiškingesnis. Pavyzdžiui, etanas C2H6 gali būti pavaizduotas beveik abejingai:
Tačiau esant nepakankamai apibrėžtam supratimui, kitoks rašymo būdas gali sukelti sumišimą.
2.3. Cheminės struktūros teorijos vertė, jos vaidmuo
Atsiradus cheminės struktūros teorijai, iš tipiškų formulių labirinto iškilo organinė chemija; buvo parodyti keliai į vidinės molekulių sandaros pažinimą; atsirado teorinis pagrindas suprasti cheminius procesus, numatyti naujus organinių junginių sintezės būdus. Cheminės struktūros teorija nuo pat savo atsiradimo momento leido chemikams kryptingai, kryptingai atlikti eksperimentinius tyrimus.
Nepaprasta sėkmė cheminės struktūros teorijoje buvo izomerijos reiškinio paaiškinimas, aptiktas praėjusio amžiaus pirmajame ketvirtyje.
Kaip žinote, XVIII amžiaus pabaigoje buvo nustatytas kompozicijos pastovumo dėsnis, pagal kurį kiekviena duota medžiaga turi apibrėžtą, pastovią sudėtį. Keletą dešimtmečių šiam įstatymui buvo suteikta ir priešinga reikšmė, tai yra, buvo manoma, kad tik viena konkreti medžiaga turi tam tikrą apibrėžtą sudėtį. Pastarosios pozicijos neteisingumas buvo parodytas ištyrus daugybę organinių medžiagų. 1823 m. Liebigas, ištyręs fulmino rūgšties sidabro druską, nustatė, kad jos sudėtis (AgCNO) yra identiška 1822 m. Wöhlerio gautai sidabro izocianato sudėčiai, kuri smarkiai skiriasi nuo jos.
Šis nuostabus faktas ilgai neliko izoliuotas; Netrukus buvo atrasta daug kitų medžiagų, kurių sudėtis tokia pati, bet skirtingos savybės. Nuo 1830 m. atrastas reiškinys pradėtas vadinti izomerizmu (iš graikų – sudarytas iš identiškų dalių), o medžiagos, kurių sudėtis tokia pati – izomerai. Bandymai aiškinti izomerizmą radikalų teorija ir tipų teorija buvo vienpusiški (kaip ir pačios šios teorijos), todėl nedavė patenkinamų rezultatų. Tiesą sakant, beveik keturis dešimtmečius izomerijos reiškinys nerado teorinio paaiškinimo.
Toks paaiškinimas tapo įmanomas tik sukūrus cheminės struktūros teoriją, pagal kurią medžiagos prigimtį lemia ne tik molekulę sudarančių atomų prigimtis ir skaičius, bet ir jos struktūra, cheminė struktūra. Iš to neabejotinai akivaizdžiai išplaukia galimybė egzistuoti medžiagų, turinčių vienodą sudėtį ir molekulinę masę, tačiau vis dėlto visiškai skirtingų dėl nevienodos cheminės struktūros. Taigi cheminės struktūros skirtumas buvo natūralus ir paprastas izomerijos reiškinio paaiškinimas.
2.4. Butlerovo dinaminės izomerijos fenomeno atradimas
Reikėtų pažymėti, kad A. M. Butlerovas atrado ir pirmą kartą taip pat paaiškino dinaminės izomerijos reiškinį , susidedantis iš to, kad du ar daugiau izomerų tam tikromis sąlygomis lengvai pereina vienas į kitą (šis reiškinys šiuo metu vadinamas tautomerija). Izomerijos problema kaip visuma buvo rimtas Butlerio teorijos išbandymas ir buvo puikiai išspręstas.
Svarbus A. M. Butlerovo mokymų bruožas yra tai, kad jis jokiu būdu nelaikė molekulės kažkokiu nepajudinamu dariniu, kuriame atskiri atomai yra sujungti į negyvą, negyvą struktūrą. . Šia tema jis rašė:
„... šiuo metu į cheminį junginį žiūrime ne kaip į kažką negyvą, nejudantį; mes sutinkame, priešingai, kad jis yra aprūpintas nuolatiniu judėjimu, esančiu jos mažiausiose dalelėse, kurių konkretūs tarpusavio santykiai nuolat keičiasi, šiuo atveju sumuojant į tam tikrą pastovų vidutinį rezultatą. Čia taip pat galime turėti nuolatinius cheminių dalelių, sudarančių medžiagų masę, pokyčius, tačiau visa tai sumažinama iki tam tikros vidutinės pačios masės būsenos. Žodžiu, apskritai mes visada turime tam tikros judrios pusiausvyros būseną. Šiuo dinaminiu požiūriu į cheminio junginio prigimtį ir chemines reakcijas mes aiškiai paaiškiname tokius reiškinius, kurie ankstesniu požiūriu buvo visiškai nesuprantami. Verta atkreipti dėmesį, pavyzdžiui, į disociaciją, kaip lengvai dabar paaiškiname atgalines reakcijas ir pan.
2.5. Butlerovas gynė savo prioritetus. D.I. Mendelejevo vaidmuo
A. M. Butlerovo per trumpą laiką suformuluotos aiškios, nepaneigiamos cheminės sandaros teorijos nuostatos užtikrino jos visuotinį pripažinimą. Tačiau tuo pat metu buvo tendencija nuslėpti A. M. Butlerovo nuopelnus ir pateikti tik Kekulę ir Cooperį kaip struktūros teorijos kūrėjus.
Praėjus keleriems metams po struktūros teorijos sukūrimo, A. M. Butlerovas turėjo apginti savo prioritetą, nes kai kurie užsienio chemikai, kurie iš pradžių nepripažino ir net nesuprato jo teorijos, vėliau bandė priskirti pagrindinių nuostatų kūrimo garbę. šios teorijos sau.
Lemiamas A. M. Butlerovo vaidmuo kuriant cheminės struktūros teoriją buvo aiškiai pabrėžtas didysis rusų mokslininkas D. I. Mendelejevas 1868 m. , rekomenduodamas A. M. Butlerovą Sankt Peterburgo universitetui. Mendelejevas rašė, kad Butlerovas „... vėl siekia, tirdamas chemines transformacijas, prasiskverbti į pačias gelmes jungčių, laikančių nevienalyčius elementus kartu, suteikia kiekvienam iš jų įgimtą gebėjimą įsilieti į žinomą skaičių junginių ir priskiria savybių skirtumas su kitokiu elementų sujungimo būdu . Niekas taip nuosekliai nesiekė šių minčių, kaip jis, nors jie nagrinėjo anksčiau... Norėdamas taip pat peržiūrėti visas organinių junginių klases, Butlerovas 1864 m. išleido knygą „Įvadas į išsamų organinės chemijos tyrimą“. “, praėjusiais metais į vokiečių kalbą išverstas Butlerovas, savo skaitymu ir susižavėjimu idėjomis, jis Kazanėje suformavo aplink save jo vadovaujamą chemikų mokyklą. Markovnikovo, Myasnikovo, Popovo, dviejų Zaicevų, Morgunovo ir kai kurių kitų vardai sugebėjo išgarsėti dėl daugelio atradimų, padarytų daugiausia dėl Butlerozo judėjimo nepriklausomybės. Asmeniškai galiu paliudyti, kad tokie prancūzų ir vokiečių mokslininkai kaip Wurtzas ir Kolbe Butlerovą laiko vienu įtakingiausių mūsų laikų teorinės chemijos krypties judėjimo.
A. M. Butlerovas teisingai manė, kad cheminės struktūros teorija vystysis kaupiant naują faktinę medžiagą. Jis rašė: „... Negaliu nepastebėti, kad išvados, į kurias veda cheminės sandaros principas, tūkstančiais atvejų sutampa su faktais. Kaip ir bet kurioje teorijoje, ir čia, žinoma, yra trūkumų, netobulumų – yra faktų, kurie griežtai neatitinka cheminės sandaros sampratos. Žinoma, ypač reikėtų norėti tokių faktų atgaminimo; faktai, kurie nepaaiškinami esamomis teorijomis, yra brangiausi mokslui, o iš jų raidos daugiausia reikėtų tikėtis jo raidos artimiausioje ateityje.
Išvada
Cheminės sandaros teoriją A. M. Butlerovas sukūrė XIX amžiaus viduryje, tuo metu, kai Rusijoje kūrėsi nauji buržuaziniai socialiniai-ekonominiai santykiai, o gamybinių jėgų augimas lėmė galingą gamtos mokslo raidą. Per šį laikotarpį I. M. Sechenovas, o paskui I. P. Pavlovas sukūrė materialistinę doktriną apie aukštesnį žmogaus ir gyvūnų nervinį aktyvumą, K. A. Timiriazevas ir kiek vėliau I. V. Mičurinas padėjo pamatus naujam biologijos raidos etapui, D. I. Mendelejevas atranda svarbiausią. gamtos dėsnis – periodinis dėsnis, apibendrinantis visas tuo metu turimas žinias apie cheminius elementus. N. I. Lobačevskis atveria naują matematikos sritį.
Cheminės sandaros teorija sukūrė galimybę moksliškai susisteminti organinės chemijos faktinę medžiagą, paaiškino svarbiausius jos dėsningumus ir suteikė raktą naujų faktų prognozavimui. Tai buvo mokslinis pagrindas šiuolaikinei organinei chemijai sukurti. Tai sudarė šiuolaikinių teorinių organinės chemijos sampratų pagrindą. Šiandien šios teorijos esmę galima išreikšti taip: organinių junginių fizines ir chemines savybes lemia jų molekulių sudėtis, taip pat cheminė, erdvinė ir elektroninė struktūra.
Bibliografija
1. A.I. Artemenko „Organinė chemija“: statybos vadovėlis. specialistas. universitetai. – 4-asis leidimas, pataisytas. ir papildomas - M .: Aukštoji mokykla; 2000. - 559 p.: iliustr.
2. A.E. Čičibabinas „Organinė chemija“: vadovėlis universitetams. - T. 1-2. Red. 3, isp. ir papildomas 1963. - 910 p.
Vandenilio tipas:
Tokios formulės yra šiek tiek panašios į šiuolaikines. Tačiau tipų teorijos šalininkai nemanė, kad jie atspindi tikrąją medžiagų struktūrą ir vienam junginiui parašė daug skirtingų formulių, priklausomai nuo cheminių reakcijų, kurias bandė parašyti naudodami šias formules. Jie manė, kad molekulių sandara yra iš esmės nežinoma, o tai kenkė mokslo raidai.
3. J. Berzelius 1830 m. įvedė terminą „izomerija“, reiškiantį tos pačios sudėties, skirtingų savybių turinčių medžiagų egzistavimo reiškinį.
4. Organinių junginių sintezės sėkmė, dėl kurios buvo išsklaidyta vitalizmo doktrina, tai yra „gyvybės jėga“, kurios įtakoje gyvų būtybių organizme tariamai susidaro organinės medžiagos:
1828 metais F. Wehleris iš neorganinės medžiagos (amonio cianato) susintetino karbamidą;
1842 metais rusų chemikas N. N. Zininas gavo anilino;
1845 metais vokiečių chemikas A. Kolbe susintetino acto rūgštį;
1854 m. prancūzų chemikas M. Berthelot susintetino riebalus ir galiausiai
1861 metais A. M. Butlerovas pats susintetino į cukrų panašią medžiagą.
5. XVIII amžiaus viduryje. chemija tampa griežtesniu mokslu. E. Franklando ir A. Kekulės darbo rezultatas – buvo nustatyta cheminių elementų atomų valentingumo samprata. Kekulė sukūrė anglies tetravalencijos koncepciją. Cannizzaro darbų dėka aiškėjo atominės ir molekulinės masės sąvokos, išgrynintos jų reikšmės ir nustatymo metodai.
1860 m. daugiau nei 140 pirmaujančių chemikų iš įvairių Europos šalių susirinko į tarptautinį kongresą Karlsrūhėje. Kongresas tapo labai svarbiu įvykiu chemijos istorijoje: buvo apibendrinti mokslo laimėjimai ir sudarytos sąlygos naujam organinės chemijos raidos etapui – A. M. Butlerovo organinių medžiagų cheminės sandaros teorijos atsiradimui. 1861 m.), taip pat už esminį D. I. Mendelejevo atradimą – Periodinį dėsnį ir cheminių elementų sistemą (1869).
1861 metais A. M. Butlerovas kalbėjo Spejerio miesto gydytojų ir gamtininkų suvažiavime su pranešimu „Apie cheminę kūnų sandarą“. Jame jis išdėstė savo teorijos apie organinių junginių cheminę struktūrą pagrindus. Pagal cheminę struktūrą mokslininkas suprato atomų jungimosi tvarką molekulėse.
Asmeninės A. M. Butlerovo savybės
A. M. Butlerovas išsiskyrė chemijos žinių enciklopediškumu, gebėjimu analizuoti ir apibendrinti faktus, numatyti. Jis numatė butano izomero egzistavimą ir tada jį gavo, taip pat butileno izomerą - izobutileną.
Butlerovas Aleksandras Michailovičius (1828-1886)
Rusų chemikas, Sankt Peterburgo mokslų akademijos akademikas (nuo 1874). Baigė Kazanės universitetą (1849). Ten dirbo (nuo 1857 m. – profesorius, 1860 ir 1863 m. – rektorius). Organinių junginių cheminės struktūros teorijos, kuria grindžiama šiuolaikinė chemija, kūrėjas. Pagrindė idėją apie abipusę atomų įtaką molekulėje. Jis numatė ir paaiškino daugelio organinių junginių izomerizmą. Parašė „Įvadas į visapusį organinės chemijos tyrimą“ (1864 m.) – pirmąjį mokslo istorijoje vadovą, paremtą cheminės struktūros teorija. Rusijos fizikos ir chemijos draugijos Chemijos katedros pirmininkas (1878-1882).
A. M. Butlerovas sukūrė pirmąją organinių chemikų mokyklą Rusijoje, iš kurios iškilo genialūs mokslininkai: V. V. Markovnikovas, D. P. Konovalovas, A. E. Favorskis ir kt.
Nenuostabu, kad D. I. Mendelejevas rašė: „A. M. Butlerovas yra vienas didžiausių Rusijos mokslininkų, jis yra rusas tiek savo moksliniu išsilavinimu, tiek darbų originalumu.
Pagrindinės cheminių junginių sandaros teorijos nuostatos
Praėjusio amžiaus antroje pusėje (1861 m.) A. M. Butlerovo iškelta organinių junginių cheminės sandaros teorija buvo patvirtinta daugelio mokslininkų, tarp jų ir Butlerovo mokinių bei jo paties, darbais. Paaiškėjo, kad remiantis juo galima paaiškinti daugybę reiškinių, kurie iki tol neturėjo aiškinimo: izomerija, homologija, tetravalencijos pasireiškimas anglies atomais organinėse medžiagose. Teorija atliko ir savo prognostinę funkciją: jos pagrindu mokslininkai numatė dar nežinomų junginių egzistavimą, aprašė savybes ir jas atrado.
Taigi, 1862–1864 m. A. M. Butlerovas nagrinėjo propilo, butilo ir amilo alkoholių izomerizmą, nustatė galimų izomerų skaičių ir išvedė šių medžiagų formules. Vėliau jų egzistavimas buvo įrodytas eksperimentiškai, o kai kuriuos izomerus susintetino pats Butlerovas.
Per XX a. cheminių junginių cheminės sandaros teorijos nuostatos buvo kuriamos remiantis naujomis moksle išplitusiomis pažiūromis: atomo sandaros teorija, cheminio ryšio teorija, idėjomis apie cheminių reakcijų mechanizmus. Šiuo metu ši teorija turi universalų pobūdį, tai yra, galioja ne tik organinėms, bet ir neorganinėms medžiagoms.
Pirmoji pozicija. Atomai molekulėse yra sujungti tam tikra tvarka pagal jų valentingumą. Visuose organiniuose ir daugumoje neorganinių junginių anglis yra keturvalentė.
Akivaizdu, kad paskutinė pirmosios teorijos nuostatos dalis gali būti lengvai paaiškinama tuo, kad anglies atomai junginiuose yra sužadintos būsenos: 
a) keturvalenčiai anglies atomai gali jungtis vienas su kitu, sudarydami įvairias grandines:
atviras šakotas
- atviras nešakotas
- uždaryta
b) anglies atomų jungimosi tvarka molekulėse gali būti skirtinga ir priklauso nuo kovalentinio cheminio ryšio tarp anglies atomų tipo – viengubo ar daugybinio (dvigubo ir trigubo).
Antra pozicija. Medžiagų savybės priklauso ne tik nuo jų kokybinės ir kiekybinės sudėties, bet ir nuo jų molekulių struktūros.
Ši pozicija paaiškina izomerijos reiškinį. Medžiagos, kurių sudėtis yra tokia pati, bet skiriasi chemine ar erdvine struktūra ir dėl to skirtingomis savybėmis, vadinamos izomerai. Pagrindinės izomerijos rūšys:
Struktūrinė izomerija, kurioje medžiagos skiriasi atomų jungimosi tvarka molekulėse:
1) anglies skeleto izomerija 
3) homologinių eilučių (tarpklasių) izomerija 
Erdvinė izomerija, kurioje medžiagų molekulės skiriasi ne atomų jungimosi tvarka, o padėtimi erdvėje: cis-trans-izomerija (geometrinė).
Ši izomerija būdinga medžiagoms, kurių molekulės yra plokščios struktūros: alkenams, cikloalkanams ir kt.
Optinė (veidrodinė) izomerija taip pat priklauso erdvinei izomerijai.
Keturios pavienės jungtys aplink anglies atomą, kaip jau žinote, yra išdėstytos tetraedriškai. Jei anglies atomas yra prijungtas prie keturių skirtingų atomų ar grupių, tada galimas skirtingas šių grupių išsidėstymas erdvėje, tai yra dvi erdvinės izomerinės formos.
17 paveiksle parodytos dvi veidrodinės aminorūgšties alanino (2-aminopropano rūgšties) formos.
Įsivaizduokite, kad prieš veidrodį yra alanino molekulė. Grupė -NH2 yra arčiau veidrodžio, todėl atspindyje ji bus priekyje, o -COOH grupė bus fone ir pan. (žr. paveikslėlį dešinėje). Alanija egzistuoja dviem erdvinėmis formomis, kurios, sudėjus viena su kita, nesusijungia.
Antrosios cheminių junginių sandaros teorijos pozicijos universalumas patvirtina neorganinių izomerų egzistavimą.
Taigi, pirmoji organinių medžiagų sintezė - karbamido sintezė, kurią atliko Wehleris (1828), parodė, kad neorganinė medžiaga - amonio cianatas ir organinė medžiaga - karbamidas yra izomerinės: 
Jei deguonies atomą karbamide pakeisite sieros atomu, gausite tiokarbamidą, kuris yra izomerinis amonio tiocianatui, gerai žinomam Fe 3+ jonų reagentui. Akivaizdu, kad tiokarbamidas nesuteikia šios kokybinės reakcijos.
Trečia pozicija. Medžiagų savybės priklauso nuo atomų tarpusavio įtakos molekulėse.
Pavyzdžiui, acto rūgštyje tik vienas iš keturių vandenilio atomų reaguoja su šarmu. Remiantis tuo, galima daryti prielaidą, kad tik vienas vandenilio atomas yra prijungtas prie deguonies:
Kita vertus, iš acto rūgšties struktūrinės formulės galima daryti išvadą, kad joje yra vienas judrus vandenilio atomas, tai yra, ji yra vienbazė.
Norėdami patikrinti sandaros teorijos pozicijos universalumą dėl medžiagų savybių priklausomybės nuo molekulių atomų tarpusavio įtakos, kuri egzistuoja ne tik organiniuose, bet ir neorganiniuose junginiuose, lyginame vandenilio atomų savybes. nemetalų vandenilio junginiai. Jie turi molekulinę struktūrą ir normaliomis sąlygomis yra dujos arba lakūs skysčiai. Atsižvelgiant į nemetalo padėtį D. I. Mendelejevo periodinėje sistemoje, galima nustatyti tokių junginių savybių pasikeitimo modelį: 
Metanas nesąveikauja su vandeniu. Pagrindinių metano savybių trūkumas paaiškinamas anglies atomo valentingumo galimybių prisotinimu.
Amoniakas pasižymi pagrindinėmis savybėmis. Jo molekulė gali prijungti prie savęs vandenilio joną dėl savo traukos prie vienišos azoto atomo elektronų poros (donoro-akceptoriaus ryšio formavimo mechanizmas).
Fosfine PH3 pagrindinės savybės yra silpnai išreikštos, o tai susiję su fosforo atomo spinduliu. Jis yra daug didesnis už azoto atomo spindulį, todėl fosforo atomas silpniau traukia vandenilio atomą prie savęs.
Laikotarpiais iš kairės į dešinę didėja atomų branduolių krūviai, mažėja atomų spinduliai, didėja vandenilio atomo su daliniu teigiamu krūviu G + atstūmimo jėga, taigi ir nemetalų vandenilio junginių rūgštinės savybės. yra sustiprinti. 
Pagrindiniuose pogrupiuose elementų atominiai spinduliai didėja iš viršaus į apačią, nemetalų atomai su 5- traukia vandenilio atomus, kurių 5+ silpnesni, vandenilio junginių stiprumas mažėja, jie lengvai disocijuojasi, todėl sustiprėja jų rūgštinės savybės.
Skirtingas nemetalų vandenilio junginių gebėjimas pašalinti arba pridėti vandenilio katijonų tirpaluose paaiškinamas nevienodu nemetalų atomo poveikiu vandenilio atomams.
Skirtinga atomų įtaka to paties laikotarpio elementų suformuotose hidroksidų molekulėse paaiškina ir jų rūgščių-šarmų savybių pasikeitimą.
Didėjant centrinio atomo oksidacijos laipsniui, pagrindinės hidroksidų savybės mažėja, o rūgščių didėja, todėl jo ryšio su deguonies atomu energija (8-) ir vandenilio atomo atstūmimas (8+) jis didėja.
Natrio hidroksidas NaOH. Kadangi vandenilio atomo spindulys yra labai mažas, jis stipriau pritraukia deguonies atomą prie savęs ir ryšys tarp vandenilio ir deguonies atomų bus stipresnis nei tarp natrio ir deguonies atomų. Aliuminio hidroksidas Al(OH)3 pasižymi amfoterinėmis savybėmis.
Perchloro rūgštyje HclO 4 santykinai didelį teigiamą krūvį turintis chloro atomas yra stipriau prijungtas prie deguonies atomo ir stipriau atstumia vandenilio atomą 6+. Disociacija vyksta pagal rūgšties tipą.
Pagrindinės cheminių junginių sandaros teorijos raidos kryptys ir jos reikšmė
A. M. Butlerovo laikais organinėje chemijoje buvo plačiai naudojamos empirinės (molekulinės) ir struktūrinės formulės. Pastarieji atspindi atomų jungimosi tvarką molekulėje pagal jų valentingumą, kuris žymimas brūkšneliais.
Kad būtų lengviau įrašyti, dažnai naudojamos sutrumpintos struktūrinės formulės, kuriose brūkšneliais nurodomi tik ryšiai tarp anglies arba anglies ir deguonies atomų.
Sutrumpintos struktūrinės formulės
Tada, tobulėjant žinioms apie cheminio ryšio prigimtį ir organinių medžiagų molekulių elektroninės struktūros įtaką jų savybėms, jie pradėjo naudoti elektronines formules, kuriose kovalentinis ryšys sutartinai žymimas dviem taškais. Tokiose formulėse dažnai rodoma elektronų porų poslinkio molekulėje kryptis.
Būtent elektroninė medžiagų struktūra paaiškina mezomerinį ir indukcinį poveikį.
Indukcinis efektas yra gama ryšių elektronų porų poslinkis iš vieno atomo į kitą dėl jų skirtingo elektronegatyvumo. Žymima (->).
Atomo (ar atomų grupės) indukcinis poveikis yra neigiamas (-/), jei šis atomas turi didelį elektronegatyvumą (halogenai, deguonis, azotas), pritraukia gama ryšio elektronus ir įgyja dalinį neigiamą krūvį. Atomas (ar atomų grupė) turi teigiamą indukcinį poveikį (+/), jei atstumia gama ryšių elektronus. Šią savybę turi kai kurie ribojantys radikalai C2H5). Prisiminkite Markovnikovo taisyklę, kaip į alkenus (propeną) pridedamas vandenilis ir vandenilio halogeno halogenas, ir jūs suprasite, kad ši taisyklė yra ypatingo pobūdžio. Palyginkite šiuos du reakcijų lygčių pavyzdžius:
[[Teorija_cheminių_junginių_A._M._Butlerovas|  ]]
]]
Atskirų medžiagų molekulėse vienu metu pasireiškia ir indukcinis, ir mezomerinis poveikis. Šiuo atveju jie arba sustiprina vienas kitą (aldehiduose, karboksirūgštyse), arba susilpnina (vinilchloride).
Atomų tarpusavio įtakos molekulėse rezultatas yra elektronų tankio persiskirstymas.
Cheminių ryšių erdvinės krypties idėją pirmą kartą išreiškė prancūzų chemikas J. A. Le Bel ir olandų chemikas J. X. Van't Hoffas 1874 m. Mokslininkų prielaidas visiškai patvirtino kvantinė chemija. Medžiagų savybėms didelę įtaką daro jų molekulių erdvinė struktūra. Pavyzdžiui, jau pateikėme buteno-2 cis- ir trans-izomerų formules, kurios skiriasi savo savybėmis (žr. 16 pav.).
Vidutinė ryšio energija, kuri turi nutrūkti pereinant iš vienos formos į kitą, yra maždaug 270 kJ / mol; kambario temperatūroje energijos nėra tiek daug. Abipusiam buteno-2 formų perėjimui iš vienos į kitą reikia nutraukti vieną kovalentinį ryšį ir vietoj jo sudaryti kitą. Kitaip tariant, šis procesas yra cheminės reakcijos pavyzdys, o abi buteno-2 formos yra skirtingi cheminiai junginiai.
Akivaizdu, kad prisimenate, kad svarbiausia gumos sintezės problema buvo stereotaisyklinės gumos gavimas. Reikėjo sukurti polimerą, kuriame struktūriniai mazgai būtų išdėstyti griežta tvarka (pavyzdžiui, natūrali guma susideda tik iš cis-vienetų), nes nuo to priklauso tokia svarbi gumos savybė kaip jos elastingumas.
Šiuolaikinėje organinėje chemijoje išskiriami du pagrindiniai izomerijos tipai: struktūrinė (grandinė izomerija, daugialypių jungčių padėties izomerija, homologinių eilučių izomerija, funkcinių grupių padėties izomerija) ir stereoizomerija (geometrinė, arba cis-trans-izomerija, optinė, arba veidrodis, izomerija).
Taigi, jūs galėjote įsitikinti, kad antroji cheminės struktūros teorijos pozicija, aiškiai suformuluota A. M. Butlerovo, buvo neišsami. Šiuolaikiniu požiūriu ši nuostata reikalauja papildymų:
medžiagų savybės priklauso ne tik nuo jų kokybinės ir kiekybinės sudėties, bet ir nuo jų:
Cheminis,
elektroninis,
Erdvinė struktūra.
Medžiagų sandaros teorijos sukūrimas vaidino svarbų vaidmenį plėtojant organinę chemiją. Iš vyraujančio aprašomojo mokslo jis virsta kūrybišku, sintetinu mokslu, atsirado galimybė spręsti apie atomų tarpusavio įtaką įvairių medžiagų molekulėse (žr. 10 lentelę). Struktūros teorija sudarė prielaidas paaiškinti ir numatyti įvairius organinių molekulių izomerijos tipus, cheminių reakcijų kryptis ir mechanizmus.
Remdamiesi šia teorija, organiniai chemikai kuria medžiagas, kurios ne tik pakeičia natūralias, bet ir gerokai pranoksta jas savo savybėmis. Taigi, sintetiniai dažai yra daug geresni ir pigesni nei daugelis natūralių, pavyzdžiui, senovėje žinomi alizarinas ir indigo. Sintetiniai kaučiukai gaminami dideliais kiekiais, pasižymintys įvairiausiomis savybėmis. Plačiai naudojami plastikai ir pluoštai, kurių gaminiai naudojami inžinerijoje, kasdieniame gyvenime, medicinoje, žemės ūkyje.
A. M. Butlerovo cheminės struktūros teorijos vertę organinei chemijai galima palyginti su periodinio dėsnio ir D. I. Mendelejevo cheminių elementų periodinės sistemos verte neorganinei chemijai. Ne veltui abi teorijos turi tiek daug bendro savo formavimosi būdais, raidos kryptimis ir bendra moksline reikšme. Tačiau bet kurios kitos pirmaujančios mokslo teorijos istorijoje (Ch. Darvino teorija, genetika, kvantinė teorija ir kt.) galima rasti tokių bendrų etapų.
1. Nustatykite paraleles tarp dviejų pagrindinių chemijos teorijų – periodinio dėsnio ir periodinės cheminių elementų lentelės (D. I. Mendelejevo) ir A. M. Butlerovo organinių junginių cheminės struktūros teorijos, remiantis šiais pagrindais: bendras prielaidomis, bendras jų raidos kryptys, paplitusios prognostiniuose vaidmenyse.
2. Kokį vaidmenį formuojant periodiniam dėsniui suvaidino cheminių junginių sandaros teorija?
3. Kokie neorganinės chemijos pavyzdžiai patvirtina kiekvienos cheminių junginių sandaros teorijos nuostatos universalumą?
4. Fosforo rūgštis H3PO3 reiškia dvibazes rūgštis. Pasiūlykite jo struktūrinę formulę ir apsvarstykite abipusę atomų įtaką šios rūgšties molekulėje.
5. Parašykite izomerus, kurių sudėtis С3Н8O. Pavadinkite juos pagal sisteminę nomenklatūrą. Nustatykite izomerijos tipus.
6. Yra žinomos šios chromo(III) chlorido kristalinių hidratų formulės: [Cr(H20)6]Cl3; [Cr(H20)5Cl]Cl2H20; [Cr(H20)4 * C12]Cl 2H2O. Kaip pavadintumėte šį reiškinį?
Pagrindines organinių junginių cheminės sandaros teorijos nuostatas suformulavo Kazanės universiteto profesorius A. M. Butlerovas 1861 m.
- Atomai molekulėse yra sujungti griežtai nustatyta tvarka, atsižvelgiant į elementų valentiškumą.
- Medžiagų savybės priklauso ne tik nuo jų kiekybinės ir kokybinės sudėties, bet ir nuo molekulėse esančių atomų susijungimo tvarkos, t.y. nuo cheminės struktūros.
- Atomai molekulėse veikia vienas kitą.
- Medžiagų savybes lemia jų struktūra, o, atvirkščiai, žinant struktūrą, galima numatyti savybes.
- Medžiagų cheminę struktūrą galima nustatyti cheminiais metodais.
A.M. cheminės struktūros teorija. Butlerovas patyrė evoliuciją, kurios svarbiausios kryptys yra:
- Elektroninių teorijų atsiradimas organinėje chemijoje, kurios leido suformuluoti organinių medžiagų cheminio elgesio priklausomybę nuo elektroninės struktūros.
- Stereocheminiai vaizdiniai, nulėmę ryšį tarp cheminių medžiagų savybių ir erdvinės struktūros.
Organinių junginių ypatybes, jų įvairovę pirmiausia lemia anglies atomo elektroninė struktūra, kuri organiniuose junginiuose turi keturių valentingumą ir gali būti sp 3 -, sp 2 - ir sp-hibridinės būsenos. Todėl ryšį tarp atomų gali atlikti viena, dvi ir trys elektronų poros, t.y. būti viengubai (σ – ryšys), dvigubai (1σ – ryšys ir 1π – ryšys), trigubas (1σ – ryšys ir 2 π – ryšys). Išskirtinė anglies savybė – gebėjimas formuoti įvairaus ilgio ir ciklinės struktūros atomų grandines.
Iš antrosios struktūros teorijos pozicijos seka homologijos ir izomerijos buvimas organinėse medžiagose. Homologinė serija vadinamas organinių junginių rinkiniu, kurie turi panašią struktūrą ir savybes ir skiriasi viena nuo kitos viena ar keliomis grupėmis -CH 2 -. Tos pačios homologinės serijos atstovai vadinami homologai.
Izomerai- medžiagos, kurių kiekybinė ir kokybinė sudėtis yra tokia pati, tačiau skiriasi molekulių struktūra, taigi ir savybėmis. Yra struktūrinė ir erdvinė (stereo) izomerija. Pirmasis tipas yra
- anglies karkaso izomerija (pavyzdžiui, n-butanas ir izobutanas);
- daugialypės jungties padėties molekulėje izomerija (pavyzdžiui, 2-metil-1-butenas ir 2-metil-2-butenas);
- funkcinės grupės padėties izomerija (pvz., 1-chlorpropanas ir 2-chlorpropanas);
- tarpklasinė izomerija arba metamerizmas (pavyzdžiui, butinas-1 ir butadienas-1,3) ir kt.
Erdviniuose izomeruose atomų ryšių tvarka molekulėse yra vienoda, tačiau skiriasi jų vieta erdvėje, todėl skiriasi savybės. Erdvinė yra geometrinė izomerija. Tai įmanoma, pavyzdžiui, alkenuose.
Organinių junginių cheminės struktūros teorijos sukūrimo pagrindas A.M. Butlerovas buvo atomų ir molekulių teorija (A. Avagadro ir S. Cannizzaro darbai). Būtų klaidinga manyti, kad iki susikūrimo pasaulis nieko nežinojo apie organines medžiagas ir nebuvo bandoma pagrįsti organinių junginių sandaros. Iki 1861 m. (A. M. Butlerovas sukūrė organinių junginių cheminės struktūros teoriją) žinomų organinių junginių skaičius siekė šimtus tūkstančių, o organinės chemijos, kaip savarankiško mokslo, atskyrimas įvyko jau 1807 m. (J. Berzelius) .
Organinių junginių sandaros teorijos pagrindai
Platus organinių junginių tyrimas prasidėjo XVIII amžiuje A. Lavoisier darbais, kurie parodė, kad iš gyvų organizmų gaunamos medžiagos susideda iš kelių elementų – anglies, vandenilio, deguonies, azoto, sieros ir fosforo. Didelę reikšmę turėjo terminų „radikalas“ ir „izomerizmas“ įvedimas, radikalų teorijos formavimas (L. Giton de Morvo, A. Lavoisier, J. Liebig, J. Dumas, J. Berzelius) , sėkmė organinių junginių (karbamido, anilino, acto rūgšties, riebalų, į cukrų panašių medžiagų ir kt.) sintezėje.
Terminą „cheminė struktūra“, kaip ir klasikinės cheminės struktūros teorijos pagrindus, pirmą kartą paskelbė A.M. Butlerovas 1861 m. rugsėjo 19 d. savo pranešime Vokietijos gamtininkų ir gydytojų kongrese Speyeryje.
Pagrindinės organinių junginių sandaros teorijos nuostatos A.M. Butlerovas
1. Atomai, sudarantys organinės medžiagos molekulę, yra tarpusavyje sujungti tam tikra tvarka, o vienas ar keli valentai iš kiekvieno atomo išleidžiami ryšiams vienas su kitu. Laisvų valentų nėra.
Butlerovas pavadino atomų sujungimo seką „chemine struktūra“. Grafiškai ryšiai tarp atomų žymimi linija arba tašku (1 pav.).
Ryžiai. 1. Cheminė metano molekulės struktūra: A - struktūrinė formulė, B - elektroninė formulė
2. Organinių junginių savybės priklauso nuo molekulių cheminės sandaros, t.y. organinių junginių savybės priklauso nuo atomų susijungimo molekulėje tvarkos. Išstudijavę savybes, galite pavaizduoti medžiagą.
Apsvarstykite pavyzdį: medžiagos bendroji formulė C 2 H 6 O. Yra žinoma, kad šiai medžiagai sąveikaujant su natriu išsiskiria vandenilis, o veikiant rūgščiai susidaro vanduo.
C 2 H 6 O + Na = C 2 H 5 ONa + H 2
C 2 H 6 O + HCl \u003d C 2 H 5 Cl + H 2 O
Ši medžiaga gali atitikti dvi struktūrines formules:
CH 3 -O-CH 3 - acetonas (dimetilketonas) ir CH 3 -CH 2 -OH - etilo alkoholis (etanolis),
remiantis šiai medžiagai būdingomis cheminėmis savybėmis, darome išvadą, kad tai yra etanolis.
Izomerai yra medžiagos, kurių kokybinė ir kiekybinė sudėtis yra tokia pati, bet skirtinga cheminė struktūra. Yra keli izomerijos tipai: struktūrinė (linijinė, šakota, anglies karkasas), geometrinė (cis- ir trans-izomerija, būdinga junginiams su daugybine dviguba jungtimi (2 pav.)), optinė (veidrodinė), stereo (erdvinė, būdingas medžiagoms , galinčios įvairiai išsidėstyti erdvėje (3 pav.)).

Ryžiai. 2. Geometrinės izomerijos pavyzdys
3. Organinių junginių cheminėms savybėms įtakos turi ir kiti molekulėje esantys atomai. Tokios atomų grupės vadinamos funkcinėmis grupėmis dėl to, kad jų buvimas medžiagos molekulėje suteikia jai ypatingų cheminių savybių. Pavyzdžiui: -OH (hidrokso grupė), -SH (tio grupė), -CO (karbonilo grupė), -COOH (karboksilo grupė). Be to, organinių medžiagų cheminės savybės mažiau priklauso nuo angliavandenilių skeleto nei nuo funkcinės grupės. Būtent funkcinės grupės suteikia organinių junginių įvairovę, dėl kurios jie klasifikuojami (alkoholiai, aldehidai, karboksirūgštys ir kt. Funkcinės grupės kartais apima anglies-anglies ryšius (daugkartinis dvigubas ir trigubas). Jei yra keli vienodi funkcinės grupės, tai vadinama homopolifunkcine (CH 2 (OH) -CH (OH) -CH 2 (OH) - glicerolis), jei kelios, bet skirtingos - heteropolifunkcinės (NH 2 -CH (R) -COOH - aminorūgštys) .

3 pav. Stereoizomerijos pavyzdys: a – cikloheksanas, „kėdės“ forma, b – cikloheksanas, „vonios“ forma
4. Organinių junginių anglies valentingumas visada yra keturi.
Pirmasis pasirodė XIX amžiaus pradžioje. radikalų teorija (J. Gay-Lussac, F. Wehler, J. Liebig). Radikalais buvo vadinamos atomų grupės, kurios cheminių reakcijų metu iš vieno junginio į kitą pereina nepakitusios. Ši radikalų samprata buvo išsaugota, tačiau dauguma kitų radikalų teorijos nuostatų pasirodė neteisingos.
Pagal tipų teoriją (C. Gerard) visas organines medžiagas galima suskirstyti į tipus, atitinkančius tam tikras neorganines medžiagas. Pavyzdžiui, R-OH alkoholiai ir R-O-R eteriai buvo laikomi H-OH vandens, kuriame vandenilio atomai pakeisti radikalais, atstovais. Tipų teorija sukūrė organinių medžiagų klasifikaciją, kurios kai kurie principai taikomi šiuo metu.
Šiuolaikinę organinių junginių struktūros teoriją sukūrė iškilus rusų mokslininkas A.M. Butlerovas.
1. Atomai molekulėje išsidėstę tam tikra seka pagal jų valentingumą. Anglies atomo valentingumas organiniuose junginiuose yra keturi.
2. Medžiagų savybės priklauso ne tik nuo to, kurie atomai ir kokiais kiekiais yra molekulės dalis, bet ir nuo to, kokia tvarka jie yra tarpusavyje susiję.
3. Molekulę sudarantys atomai arba atomų grupės tarpusavyje veikia vienas kitą, nuo to priklauso molekulių cheminis aktyvumas ir reaktyvumas.
4. Medžiagų savybių tyrimas leidžia nustatyti jų cheminę struktūrą.
Tarpinė gretimų atomų įtaka molekulėse yra svarbiausia organinių junginių savybė. Ši įtaka perduodama arba per viengubų jungčių grandinę, arba per konjuguotų (kintamų) viengubų ir dvigubų jungčių grandinę.
Organinių junginių klasifikacija yra pagrįsta dviejų molekulių struktūros aspektų – anglies skeleto struktūros ir funkcinių grupių buvimo – analize.