Elektronų pasiskirstymas tarp įvairių AO vadinamas elektroninė atomo konfigūracija. Atitinka elektroninė konfigūracija su mažiausia energija pagrindinė būsena atomas, nurodo likusios konfigūracijos susijaudinusios būsenos.
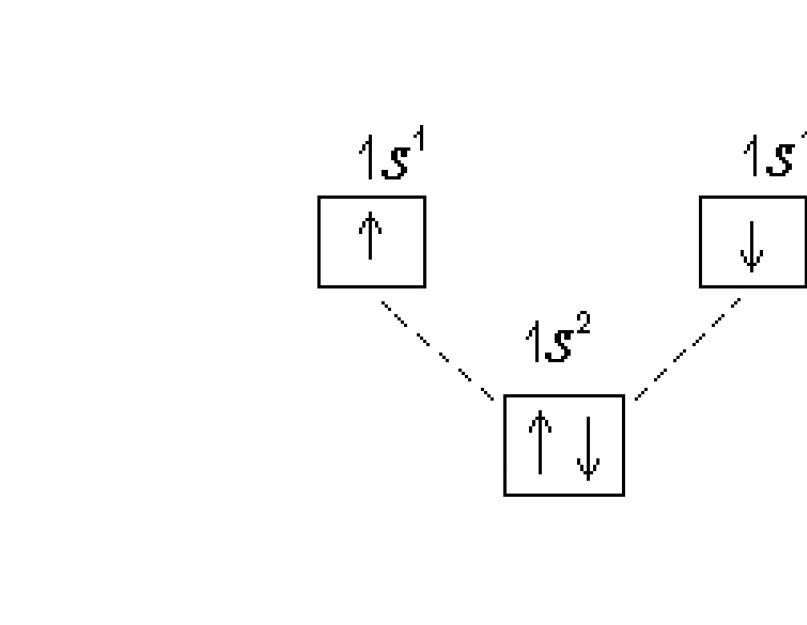
Elektroninė atomo konfigūracija vaizduojama dviem būdais – elektroninių formulių ir elektronų difrakcijos diagramų pavidalu. Rašant elektronines formules, naudojami pagrindiniai ir orbitiniai kvantiniai skaičiai. Polygis žymimas pagrindiniu kvantiniu skaičiumi (skaičiumi) ir orbitiniu kvantiniu skaičiumi (atitinkančia raide). Elektronų skaičius polygyje apibūdina viršutinį indeksą. Pavyzdžiui, vandenilio atomo pagrindinės būsenos elektroninė formulė yra tokia: 1 s 1 .
Elektroninių lygių struktūrą galima išsamiau apibūdinti naudojant elektronų difrakcijos diagramas, kur pasiskirstymas po lygius pavaizduotas kvantinių ląstelių pavidalu. Šiuo atveju orbita paprastai vaizduojama kaip kvadratas, šalia kurio pritvirtintas polygio žymėjimas. Kiekviename lygyje esantys po lygiai turėtų būti šiek tiek nukrypę nuo aukščio, nes jų energija šiek tiek skiriasi. Elektronai žymimi rodyklėmis arba ↓ priklausomai nuo sukinio kvantinio skaičiaus ženklo. Vandenilio atomo elektronų difrakcijos diagrama:
Daugiaelektroninių atomų elektroninių konfigūracijų sudarymo principas yra pridėti protonų ir elektronų prie vandenilio atomo. Elektronų pasiskirstymas energijos lygiuose ir polygiuose paklūsta anksčiau svarstytoms taisyklėms: mažiausios energijos principui, Pauli principui ir Hundo taisyklei.
Atsižvelgiant į atomų elektroninių konfigūracijų struktūrą, visus žinomus elementus pagal paskutinio užpildyto polygio orbitinio kvantinio skaičiaus reikšmę galima suskirstyti į keturias grupes: s- elementai, p- elementai, d- elementai, f- elementai.
Helio atome He (Z=2) antrasis elektronas užima 1 s-orbitalė, jos elektroninė formulė: 1 s 2. Elektronografinė diagrama:

Helis baigia pirmąjį trumpiausią periodinės elementų lentelės periodą. Pažymima elektroninė helio konfigūracija.
Antrasis periodas atveria ličio Li (Z=3), jo elektroninę formulę:  Elektronografinė diagrama:
Elektronografinė diagrama:

Toliau pateikiamos supaprastintos elektronų difrakcijos diagramos elementų, kurių to paties energijos lygio orbitos yra viename aukštyje, atomų. Vidiniai, visiškai užpildyti polygiai nerodomi.
Po ličio seka berilis Be (Z = 4), kuriame papildomas elektronas užpildo 2 s- orbitinė. Elektroninė formulė Be: 2 s 2

Pradinėje būsenoje kitas boro elektronas B (z=5) užima 2 R-orbita, V:1 s 2 2s 2 2p vienas; jo elektronų difrakcijos modelis:

Šie penki elementai turi elektronines konfigūracijas:
C (Z=6): 2 s 2 2p 2N (Z=7): 2 s 2 2p 3

O (Z=8): 2 s 2 2p 4 F (Z=9): 2 s 2 2p 5

Ne (Z=10): 2 s 2 2p 6

Pateiktos elektroninės konfigūracijos nustatomos pagal Hundo taisyklę.
Pirmasis ir antrasis neono energijos lygiai yra visiškai užpildyti. Pažymime jo elektroninę konfigūraciją ir toliau naudosime elektroninių elementų atomų formulių įrašo trumpumui.
Natrio Na (Z=11) ir Mg (Z=12) atidaro trečiąjį periodą. Išoriniai elektronai užima 3 s-orbita:
Na (Z=11): 3 s 1

Mg (Z=12): 3 s 2

Tada, pradedant nuo aliuminio (Z=13), 3 R- žemesnio lygio. Trečiasis laikotarpis baigiasi argonu Ar (Z=18):
Al (Z=13): 3 s 2 3p 1

Ar (Z=18): 3 s 2 3p 6

Trečiojo laikotarpio elementai skiriasi nuo antrojo laikotarpio elementų tuo, kad jie turi laisvą 3 d-orbitalės, galinčios dalyvauti formuojant cheminį ryšį. Tai paaiškina elementų rodomas valentingumo būsenas.
Ketvirtajame periode pagal taisyklę ( n+l), kalio K (Z=19) ir kalcio Ca (Z=20) elektronai užima 4 s- žemesnio lygio, o ne 3 d. Pradedant skandiumu Sc (Z=21) ir baigiant cinku Zn (Z=30), 3 d- polygis:
Elektroninės formulės d-elementai gali būti pavaizduoti jonine forma: polygiai yra išvardyti didėjimo tvarka pagal pagrindinį kvantinį skaičių ir konstanta n– orbitinio kvantinio skaičiaus didėjimo tvarka. Pavyzdžiui, Zn toks įrašas atrodytų taip:  Abu šie įrašai yra lygiaverčiai, tačiau anksčiau pateikta cinko formulė teisingai atspindi polygių užpildymo tvarką.
Abu šie įrašai yra lygiaverčiai, tačiau anksčiau pateikta cinko formulė teisingai atspindi polygių užpildymo tvarką.
3 eilutė d- chromo Cr (Z=24) elementai nukrypsta nuo taisyklės ( n+l). Pagal šią taisyklę Cr konfigūracija turėtų atrodyti taip:  Nustatyta, kad tikroji jo konfigūracija yra
Nustatyta, kad tikroji jo konfigūracija yra  Kartais šis efektas vadinamas elektrono „gedimu“. Panašus poveikis paaiškinamas perpus padidėjusiu stabilumu ( p
3 ,
d
5 ,
f
7) ir visiškai ( p
6 ,
d
10 ,
f
14) baigti polygiai.
Kartais šis efektas vadinamas elektrono „gedimu“. Panašus poveikis paaiškinamas perpus padidėjusiu stabilumu ( p
3 ,
d
5 ,
f
7) ir visiškai ( p
6 ,
d
10 ,
f
14) baigti polygiai.
Nukrypimai nuo taisyklės ( n+l) pastebimi ir kituose elementuose (2 lentelė). Taip yra dėl to, kad didėjant pagrindiniam kvantiniam skaičiui, mažėja skirtumai tarp sublygių energijų.
Toliau reikia užpildyti 4 p-polygis (Ga - Kr). Ketvirtajame periode yra tik 18 elementų. Panašiai užpildykite 5 s-, 4d- ir 5 p- 18 penktojo laikotarpio elementų polygiai. Atkreipkite dėmesį, kad energija 5 s- ir 4 d-polygiai yra labai arti, o elektronas su 5 s- žemesnis lygis gali lengvai pereiti į 4 d- žemesnio lygio. 5 dieną s-polygis Nb, Mo, Tc, Ru, Rh, Ag turi tik vieną elektroną. Pagrindinės būklės 5 s- polygis Pd neužpildytas. Pastebimas dviejų elektronų „nusileidimas“.
2 lentelė
Išimtys iš ( n+l) – pirmųjų 86 elementų taisyklės
|
Elektroninė konfigūracija |
||
|
pagal taisyklę ( n+l) |
faktinis |
|
|
4s 2 3d 4 4s 2 3d 9 5s 2 4d 3 5s 2 4d 4 5s 2 4d 5 5s 2 4d 6 5s 2 4d 7 5s 2 4d 8 5s 2 4d 9 6s 2 4f 1 5d 0 6s 2 4f 2 5d 0 6s 2 4f 8 5d 0 6s 2 4f 14 5d 7 6s 2 4f 14 5d 8 6s 2 4f 14 5d 9 |
4s 1 3d 5 4s 1 3d 10 5s 1 4d 4 5s 1 4d 5 5s 1 4d 6 5s 1 4d 7 5s 1 4d 8 5s 0 4d 10 5s 1 4d 10 6s 2 4f 0 5d 1 6s 2 4f 1 5d 1 6s 2 4f 7 5d 1 6s 0 4f 14 5d 9 6s 1 4f 14 5d 9 6s 1 4f 14 5d 10 |
|
Šeštajame periode po 6 užpildymo s- cezio Cs (Z=55) ir bario Ba (Z=56) polygis kitas elektronas, pagal taisyklę ( n+l), turėtų užtrukti 4 f- žemesnio lygio. Tačiau lantane La (Z=57) elektronas patenka į 5 d- žemesnio lygio. Pusiau užpildytas (4 f 7) 4f-polygis padidino stabilumą, todėl gadolinio Gd (Z=64), po europio Eu (Z=63), 4 f-polygis išlaiko ankstesnį elektronų skaičių (7), o naujas elektronas pasiekia 5 d- žemesnio lygio, pažeidžiant taisyklę ( n+l). Terbio Tb (Z=65) kitas elektronas užima 4 f-polygis ir vyksta elektronų perėjimas iš 5 d- polygis (4 konfigūracija f 9 6s 2). Užpildymas 4 f-polygis baigiasi iterbiu Yb (Z=70). Kitas liutecio atomo elektronas Lu užima 5 d- žemesnio lygio. Jo elektroninė konfigūracija skiriasi nuo lantano atomo tik tuo, kad yra visiškai užpildyta 4 f- žemesnio lygio.
Šiuo metu periodinėje elementų sistemoje D.I. Mendelejevo, esant skandiumui Sc ir itriui Y, liutecis (o ne lantanas) kartais yra pirmasis d-elementas ir visi 14 priešais esančių elementų, įskaitant lantaną, įtraukiant jį į specialią grupę lantanidai už periodinės elementų lentelės.
Elementų chemines savybes daugiausia lemia išorinių elektroninių nivelyrų struktūra. Elektronų skaičiaus pokytis trečioje išorėje 4 f- polygis mažai veikia elementų chemines savybes. Taigi visi 4 f elementai yra panašūs savo savybėmis. Tada šeštajame periode užpildoma 5 d-polygis (Hf - Hg) ir 6 p-polygis (Tl - Rn).
Septintame laikotarpyje 7 s-polygis užpildomas franciui Fr (Z=87) ir radžiui Ra (Z=88). Actinium nukrypsta nuo taisyklės ( n+l), o kitas elektronas užpildo 6 d- žemesnio lygio, o ne 5 f. Po to seka elementų grupė (Th - Nr) su užpildu 5 f-polygiai, kurie sudaro šeimą aktinidai. Atkreipkite dėmesį, kad 6 d- ir 5 f- sublygiai turi tokią artimą energiją, kad elektroninė aktinidų atomų konfigūracija dažnai nepaklūsta taisyklei ( n+l). Tačiau šiuo atveju tiksli konfigūracijos reikšmė yra 5 f t 5d m ne taip svarbu, nes jis gana silpnai veikia elemento chemines savybes.
Lawrencium Lr (Z=103) turi naują elektroną ties 6 d- žemesnio lygio. Šis elementas kartais dedamas į periodinę lentelę po liuteciu. Septintasis laikotarpis nebaigtas. 104–109 elementai yra nestabilūs, o jų savybės mažai žinomos. Taigi, didėjant branduolio krūviui, periodiškai kartojasi panašios išorinių lygių elektroninės struktūros. Šiuo atžvilgiu taip pat reikėtų tikėtis periodiškų įvairių elementų savybių pokyčių.
Periodinis cheminių elementų atomų savybių pokytis
Elementų atomų cheminės savybės pasireiškia jų sąveikos metu. Atomų išorinių energijos lygių konfigūracijų tipai lemia pagrindinius jų cheminio elgesio bruožus.
Kiekvieno elemento atomo savybės, lemiančios jo elgesį cheminėse reakcijose, yra jonizacijos energija, elektronų giminingumas, elektronegatyvumas.
Jonizacijos energija yra energija, reikalinga elektronui atskirti ir pašalinti nuo atomo. Kuo mažesnė jonizacijos energija, tuo didesnė atomo redukcinė galia. Todėl jonizacijos energija yra atomo redukcinio gebėjimo matas.
Jonizacijos energija, reikalinga pirmajam elektronui atsiskirti, vadinama pirmąja jonizacijos energija I 1 . Energija, reikalinga antrajam elektronui atsiskirti, vadinama antrąja jonizacijos energija I 2 ir tt Šiuo atveju vyksta tokia nelygybė
aš 1< I 2 < I 3 .
Elektrono atsiskyrimas ir pašalinimas nuo neutralaus atomo vyksta lengviau nei nuo įkrauto jono.
Didžiausia jonizacijos energijos vertė atitinka tauriąsias dujas. Šarminiai metalai turi mažiausią jonizacijos energijos vertę.
Per vieną laikotarpį jonizacijos energija kinta nemonotoniškai. Iš pradžių jis mažėja pereinant nuo s elementų prie pirmųjų p elementų. Tada vėlesniuose p elementuose jis didėja.
Vienoje grupėje, padidėjus elemento eilės skaičiui, jonizacijos energija mažėja, o tai atsiranda dėl to, kad padidėja atstumas tarp išorinio lygio ir branduolio.
Elektronų giminingumas yra energija (žymima E), kuri išsiskiria, kai elektronas yra prijungtas prie atomo. Kai atomas priima elektroną, jis tampa neigiamo krūvio jonu. Elektronų afinitetas tam tikru laikotarpiu didėja, o grupėje, kaip taisyklė, mažėja.
Halogenai turi didžiausią elektronų afinitetą. Prijungę trūkstamą elektroną, kad užbaigtų apvalkalą, jie įgyja užbaigtą tauriųjų dujų atomo konfigūraciją.
Elektronegatyvumas yra jonizacijos energijos ir elektronų afiniteto suma
Elektronegatyvumas didėja su periodu ir mažėja su pogrupiu.
Atomai ir jonai neturi griežtai apibrėžtų ribų dėl elektrono banginės prigimties. Todėl atomų ir jonų spinduliai nustatomi sąlyginai.
Didžiausias atomų spindulio padidėjimas pastebimas mažų periodų elementuose, kuriuose užpildomas tik išorinis energijos lygis, būdingas s- ir p-elementams. D- ir f-elementams stebimas sklandesnis spindulio padidėjimas didėjant branduolio krūviui.
Pogrupyje atomo spindulys didėja, kai didėja energijos lygių skaičius.
Pirmųjų keturių periodų elementų atomų elektronų apvalkalų sandara: $s-$, $p-$ ir $d-$elementai. Elektroninė atomo konfigūracija. Atomų antžeminės ir sužadintos būsenos
Atomo sąvoka atsirado senovės pasaulyje, kad būtų apibūdintos medžiagos dalelės. Graikų kalba atomas reiškia „nedalomas“.
Elektronai
Airių fizikas Stoney, remdamasis eksperimentais, padarė išvadą, kad elektrą perneša mažiausios dalelės, esančios visų cheminių elementų atomuose. Už $ 1891 $ Stoney pasiūlė pavadinti šias daleles elektronų, kuris graikų kalba reiškia „gintaras“.
Praėjus keleriems metams po to, kai elektronas gavo pavadinimą, anglų fizikas Josephas Thomsonas ir prancūzų fizikas Jeanas Perrinas įrodė, kad elektronai turi neigiamą krūvį. Tai mažiausias neigiamas krūvis, kuris chemijoje laikomas vienetu $(–1)$. Tomsonui netgi pavyko nustatyti elektrono greitį (jis lygus šviesos greičiui – 300 000$ km/s) ir elektrono masę (1836$ kartų mažesnė už vandenilio atomo masę).
Thomsonas ir Perrinas sujungė srovės šaltinio polius dviem metalinėmis plokštėmis – katodu ir anodu, sulituotomis į stiklinį vamzdelį, iš kurio buvo pašalintas oras. Kai ant elektrodų plokštelių buvo įjungta apie 10 tūkstančių voltų įtampa, vamzdyje blykstelėjo šviesos išlydis, o dalelės iš katodo (neigiamo poliaus) nuskriejo į anodą (teigiamą polių), kurį mokslininkai pirmą kartą pavadino. katodiniai spinduliai, o tada išsiaiškino, kad tai elektronų srautas. Elektronai, patekę į specialias medžiagas, tepamas, pavyzdžiui, į televizoriaus ekraną, sukelia švytėjimą.
Buvo padaryta išvada: elektronai pabėga iš medžiagos, iš kurios pagamintas katodas, atomų.
Laisvuosius elektronus ar jų srautą galima gauti ir kitais būdais, pavyzdžiui, kaitinant metalinę vielą arba apšviečiant metalus, kuriuos sudaro periodinės lentelės I grupės pagrindinio pogrupio elementai (pavyzdžiui, cezis).
Elektronų būsena atome
Elektrono būsena atome suprantama kaip informacijos apie energijos specifinis elektronas erdvė kurioje jis yra. Jau žinome, kad elektronas atome neturi judėjimo trajektorijos, t.y. galima kalbėti tik apie tikimybės suradę jį erdvėje aplink branduolį. Jis gali būti bet kurioje šios erdvės dalyje, supančioje branduolį, o įvairių jo padėčių visuma yra laikoma elektronų debesimi, turinčiu tam tikrą neigiamo krūvio tankį. Vaizdžiai tai galima įsivaizduoti taip: jei būtų įmanoma nufotografuoti elektrono padėtį atome šimtosiomis ar milijoninėmis sekundės dalimis, kaip fotoapdailoje, tai elektronas tokiose nuotraukose būtų vaizduojamas kaip taškas. Perdengus daugybę tokių nuotraukų, būtų gautas didžiausio tankio elektronų debesies vaizdas ten, kur yra daugiausia šių taškų.
Paveiksle pavaizduotas tokio elektrono tankio „pjūvis“ per branduolį einančioje vandenilio atome, o sferą riboja punktyrinė linija, kurios viduje tikimybė rasti elektroną yra $90%$. Arčiausiai branduolio esantis kontūras apima erdvės sritį, kurioje tikimybė rasti elektroną yra $10%$, tikimybė rasti elektroną antrojo kontūro viduje nuo branduolio yra $20%$, trečiojo viduje - $≈30 %$ ir kt. Elektrono būsenoje yra tam tikras neapibrėžtumas. Šiai ypatingai būsenai apibūdinti vokiečių fizikas W. Heisenbergas pristatė sąvoką neapibrėžtumo principas, t.y. parodė, kad neįmanoma vienu metu ir tiksliai nustatyti elektrono energijos ir vietos. Kuo tiksliau nustatoma elektrono energija, tuo neapibrėžtesnė jo padėtis, ir atvirkščiai, nustačius padėtį, elektrono energijos nustatyti neįmanoma. Elektronų aptikimo tikimybės sritis neturi aiškių ribų. Tačiau galima išskirti erdvę, kurioje elektrono radimo tikimybė yra didžiausia.
Erdvė aplink atomo branduolį, kurioje greičiausiai randamas elektronas, vadinama orbitale.

Jame yra maždaug $90%$ elektronų debesies, o tai reiškia, kad apie 90%$ laiko elektronas būna šioje erdvės dalyje. Pagal formą išskiriami $4$ šiuo metu žinomų orbitalių tipų, kurie žymimi lotyniškomis raidėmis $s, p, d$ ir $f$. Kai kurių elektroninių orbitų formų grafinis vaizdas parodytas paveikslėlyje.

Svarbiausia elektrono judėjimo tam tikroje orbitoje charakteristika yra jo ryšio su branduoliu energija. Elektronai, turintys panašias energijos vertes, sudaro vieną elektroninis sluoksnis, arba energijos lygis. Energijos lygiai sunumeruoti pradedant nuo branduolio: $1, 2, 3, 4, 5, 6 $ ir $ 7 $.
Sveikasis skaičius $n$, nurodantis energijos lygio skaičių, vadinamas pagrindiniu kvantiniu skaičiumi.
Jis apibūdina elektronų, užimančių tam tikrą energijos lygį, energiją. Pirmojo energijos lygio elektronai, esantys arčiausiai branduolio, turi mažiausią energiją. Palyginti su pirmojo lygio elektronais, kitų lygių elektronai pasižymi dideliu energijos kiekiu. Vadinasi, išorinio lygio elektronai yra mažiausiai stipriai surišti su atomo branduoliu.
Energijos lygių (elektroninių sluoksnių) skaičius atome lygus periodo skaičiui D. I. Mendelejevo sistemoje, kuriam priklauso cheminis elementas: pirmojo periodo elementų atomai turi vieną energijos lygį; antrasis laikotarpis - du; septintas laikotarpis - septyni.
Didžiausias elektronų skaičius energijos lygyje nustatomas pagal formulę:
kur $N$ yra didžiausias elektronų skaičius; $n$ yra lygio skaičius arba pagrindinis kvantinis skaičius. Vadinasi: pirmame arčiausiai branduolio esančiame energijos lygyje gali būti ne daugiau kaip du elektronai; antroje - ne daugiau kaip 8 USD; trečią - ne daugiau kaip 18 USD; ketvirtą - ne daugiau kaip 32 USD. O kaip, savo ruožtu, yra išdėstyti energijos lygiai (elektroniniai sluoksniai)?
Pradedant nuo antrojo energijos lygio $(n = 2)$, kiekvienas lygis yra suskirstytas į polygius (posluoksnius), kurie vienas nuo kito šiek tiek skiriasi susiejimo energija su branduoliu.
Polygių skaičius yra lygus pagrindinio kvantinio skaičiaus reikšmei: pirmasis energijos lygis turi vieną polygį; antrasis - du; trečias - trys; ketvirtas yra keturi. Polygius savo ruožtu sudaro orbitos.
Kiekviena $n$ reikšmė atitinka orbitų skaičių, lygų $n^2$. Pagal lentelėje pateiktus duomenis galima atsekti ryšį tarp pagrindinio kvantinio skaičiaus $n$ ir polygių skaičiaus, orbitų tipo ir skaičiaus bei didžiausio elektronų skaičiaus polygyje ir lygyje.
Pagrindinis kvantinis skaičius, orbitalių tipai ir skaičius, maksimalus elektronų skaičius polygiuose ir lygiuose.
| Energijos lygis $(n)$ | Polygių skaičius lygus $n$ | Orbitinis tipas | Orbitų skaičius | Maksimalus elektronų skaičius | ||
| žemesniame lygyje | lygiu, lygiu $n^2$ | žemesniame lygyje | lygiu, lygiu $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| 3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| 4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ | ||||
Įprasta sublygius žymėti lotyniškomis raidėmis, taip pat orbitalių, iš kurių jie susideda, formą: $s, p, d, f$. Taigi:
- $s$-polygis – pirmasis kiekvieno energijos lygio polygis, esantis arčiausiai atomo branduolio, susideda iš vienos $s$-orbitalės;
- $p$-sublygis – kiekvieno antrasis polygis, išskyrus pirmąjį, energijos lygį, susideda iš trijų $p$-orbitalių;
- $d$-sublygis – kiekvieno trečias polygis, pradedant nuo trečiojo energijos lygio, susideda iš penkių $d$-orbitalių;
- Kiekvieno iš jų $f$-polygis, pradedant nuo ketvirtojo energijos lygio, susideda iš septynių $f$-orbitalių.
atomo branduolys
Tačiau ne tik elektronai yra atomų dalis. Fizikas Henri Becquerel išsiaiškino, kad natūralus mineralas, kurio sudėtyje yra urano druskos, taip pat skleidžia nežinomą spinduliuotę, apšviesdamas nuo šviesos uždarytas fotografines juostas. Šis reiškinys buvo vadinamas radioaktyvumas.
Yra trys radioaktyviųjų spindulių tipai:
- $α$-spinduliai, susidedantys iš $α$-dalelių, kurių krūvis $2$ kartus didesnis už elektrono krūvį, bet turi teigiamą ženklą, o masė $4$ kartus didesnė už vandenilio atomo masę;
- $β$-spinduliai yra elektronų srautas;
- $γ$ spinduliai yra nereikšmingos masės elektromagnetinės bangos, kurios neturi elektros krūvio.
Vadinasi, atomas turi sudėtingą struktūrą – jį sudaro teigiamai įkrautas branduolys ir elektronai.
Kaip išdėstytas atomas?
1910 m. Kembridže, netoli Londono, Ernestas Rutherfordas su savo mokiniais ir kolegomis tyrė $ α $ dalelių sklaidą, praeinančius per ploną aukso foliją ir krentančių ant ekrano. Alfa dalelės dažniausiai nukrypdavo nuo pradinės krypties tik vienu laipsniu, o tai patvirtindavo, atrodytų, aukso atomų savybių vienodumą ir vienodumą. Ir staiga tyrėjai pastebėjo, kad kai kurios $α$ dalelės staigiai pakeitė savo kelio kryptį, tarsi įbėgdamos į kokią nors kliūtį.
Padėjęs ekraną prieš foliją, Rutherfordas sugebėjo aptikti net tuos retus atvejus, kai $α$ dalelės, atsispindėjusios nuo aukso atomų, skrisdavo priešinga kryptimi.
Skaičiavimai parodė, kad stebimi reiškiniai gali įvykti, jei visa atomo masė ir visas jo teigiamas krūvis būtų sutelkti į mažytį centrinį branduolį. Branduolio spindulys, kaip paaiškėjo, yra 100 000 kartų mažesnis už viso atomo, tos srities, kurioje yra elektronų, turinčių neigiamą krūvį, spindulį. Jei pritaikysime vaizdinį palyginimą, tai visą atomo tūrį galima prilyginti Lužnikų stadionui, o branduolį – futbolo kamuoliui, esančiam aikštės centre.
Bet kurio cheminio elemento atomas yra panašus į mažą saulės sistemą. Todėl toks Rutherfordo pasiūlytas atomo modelis vadinamas planetiniu.
Protonai ir neutronai
Pasirodo, mažytis atomo branduolys, kuriame sutelkta visa atomo masė, susideda iš dviejų tipų dalelių – protonų ir neutronų.
Protonai kurių krūvis lygus elektronų krūviui, bet priešingas ženklu $(+1)$, o masė lygi vandenilio atomo masei (chemijoje ji priimta kaip vienetas). Protonai žymimi $↙(1)↖(1)p$ (arba $р+$). Neutronai neneša krūvio, jie yra neutralūs ir turi masę, lygią protono masei, t.y. 1 USD. Neutronai žymimi $↙(0)↖(1)n$ (arba $n^0$).
Protonai ir neutronai vadinami bendrai nukleonai(iš lat. branduolys- branduolys).
Protonų ir neutronų skaičiaus atome suma vadinama masės skaičius. Pavyzdžiui, aliuminio atomo masės skaičius:

Kadangi elektrono masė, kuri yra nereikšminga, gali būti nepaisoma, akivaizdu, kad visa atomo masė yra sutelkta branduolyje. Elektronai žymimi taip: $e↖(-)$.
Kadangi atomas yra elektriškai neutralus, tai taip pat akivaizdu kad protonų ir elektronų skaičius atome yra vienodas. Jis lygus cheminio elemento atominiam skaičiui priskirtas jai periodinėje lentelėje. Pavyzdžiui, geležies atomo branduolyje yra $ 26 $ protonų, o $ 26 $ elektronai sukasi aplink branduolį. O kaip nustatyti neutronų skaičių?
Kaip žinote, atomo masė yra protonų ir neutronų masės suma. Žinant elemento $(Z)$ eilinį skaičių, t.y. protonų skaičių ir masės skaičių $(A)$, lygų protonų ir neutronų skaičių sumai, neutronų skaičių $(N)$ galite rasti naudodami formulę:
Pavyzdžiui, neutronų skaičius geležies atome yra:
$56 – 26 = 30$.
Lentelėje pateikiamos pagrindinės elementariųjų dalelių charakteristikos.
Pagrindinės elementariųjų dalelių charakteristikos.
izotopų
To paties elemento atomų atmainos, turinčios tą patį branduolio krūvį, bet skirtingą masės skaičių, vadinamos izotopais.
Žodis izotopas susideda iš dviejų graikiškų žodžių: isos- tas pats ir topos- vieta, reiškia "užimti vieną vietą" (ląstelę) Periodinėje elementų sistemoje.
Gamtoje randami cheminiai elementai yra izotopų mišinys. Taigi anglis turi tris izotopus, kurių masė yra 12, 13, 14 $; deguonis - trys izotopai, kurių masė yra 16, 17, 18 USD ir kt.
Paprastai periodinėje sistemoje nurodoma santykinė cheminio elemento atominė masė yra natūralaus tam tikro elemento izotopų mišinio atominių masių vidutinė vertė, atsižvelgiant į jų santykinį gausumą gamtoje, todėl atominės masės gana dažnai būna trupmeninės. Pavyzdžiui, natūralūs chloro atomai yra dviejų izotopų mišinys – $35$ (gamtoje yra $75%$) ir $37$ (yra $25%$); todėl santykinė chloro atominė masė yra 35,5 USD. Chloro izotopai parašyti taip:
$↖(35)↙(17)(Cl)$ ir $↖(37)↙(17)(Cl)$
Chloro izotopų cheminės savybės yra visiškai tokios pačios kaip daugumos cheminių elementų, tokių kaip kalis, argonas, izotopų:
$↖(39)↙(19)(K)$ ir $↖(40)↙(19)(K)$, $↖(39)↙(18)(Ar)$ ir $↖(40)↙(18) )(Ar)$
Tačiau vandenilio izotopai labai skiriasi savo savybėmis, nes jų santykinė atominė masė smarkiai padidėja. jiems net buvo suteikti atskiri pavadinimai ir cheminiai ženklai: protium - $↖(1)↙(1)(H)$; deuteris – $↖(2)↙(1)(H)$ arba $↖(2)↙(1)(D)$; tritis – $↖(3)↙(1)(H)$ arba $↖(3)↙(1)(T)$.

Dabar galima pateikti šiuolaikišką, griežtesnį ir moksliškesnį cheminio elemento apibrėžimą.
Cheminis elementas yra atomų, turinčių tą patį branduolinį krūvį, rinkinys.
Pirmųjų keturių periodų elementų atomų elektronų apvalkalų sandara
Apsvarstykite elementų atomų elektroninių konfigūracijų atvaizdavimą pagal D. I. Mendelejevo sistemos periodus.
Pirmojo laikotarpio elementai.
Atomų elektroninės sandaros schemos rodo elektronų pasiskirstymą elektroniniuose sluoksniuose (energijos lygius).

Elektroninės atomų formulės parodo elektronų pasiskirstymą energijos lygiuose ir polygiuose.
Grafinės elektroninės atomų formulės parodo elektronų pasiskirstymą ne tik lygiuose ir polygiuose, bet ir orbitose.

Helio atome pirmasis elektronų sluoksnis yra baigtas – jame yra $2 $ elektronų.
Vandenilis ir helis yra $s$-elementai, šių atomų $s$-orbitalės užpildytos elektronais.
Antrojo laikotarpio elementai.
Visiems antrojo periodo elementams pirmasis elektronų sluoksnis užpildomas, o elektronai užpildo antrojo elektronų sluoksnio $s-$ ir $p$ orbitales pagal mažiausios energijos principą (pirma $s$, paskui $ p$) ir Pauli ir Hundo taisyklės.
Neoniniame atome antrasis elektronų sluoksnis yra baigtas – jame yra $8 $ elektronų.
Trečiojo laikotarpio elementai.
Trečiojo periodo elementų atomams užbaigiamas pirmasis ir antrasis elektronų sluoksniai, taigi užpildomas trečiasis elektronų sluoksnis, kuriame elektronai gali užimti 3s-, 3p- ir 3d-sublygius.
Trečiojo periodo elementų atomų elektronų apvalkalų sandara.
Magnio atome užbaigiama 3,5 USD vertės elektronų orbitalė. $Na$ ir $Mg$ yra $s$ elementai.
Aliuminio ir vėlesnių elementų $3d$ polygis užpildytas elektronais.
| $↙(18)(Ar)$ Argonas |  |
$1s^2(2)s^2(2)p^6(3)s^2(3)p^6$ |  |
Argono atomo išoriniame sluoksnyje (trečiame elektronų sluoksnyje) yra 8 USD elektronų. Kadangi išorinis sluoksnis baigtas, bet iš viso trečiame elektronų sluoksnyje, kaip jau žinote, gali būti 18 elektronų, vadinasi, trečiojo periodo elementuose liko neužpildytos $3d$-orbitalės.
Visi elementai nuo $Al$ iki $Ar$ – $p$ - elementai.
$s-$ ir $r$ - elementai forma pagrindiniai pogrupiai Periodinėje sistemoje.
Ketvirtojo laikotarpio elementai.
Kalio ir kalcio atomai turi ketvirtąjį elektronų sluoksnį, užpildytas $4s$ polygis, nes jis turi mažiau energijos nei $3d$ polygis. Supaprastinti ketvirtojo periodo elementų atomų grafines elektronines formules:
- sąlyginai žymime grafinę elektroninę argono formulę taip: $Ar$;
- mes nevaizduosime polygių, kurie nėra užpildyti šiems atomams.
$K, Ca$ - $s$ - elementai,įtraukti į pagrindinius pogrupius. Atomams nuo $Sc$ iki $Zn$ 3d polygis užpildytas elektronais. Tai $3d$ elementai. Jie yra įtraukti į šoniniai pogrupiai, užpildytas jų išankstinis išorinis elektronų sluoksnis, jie vadinami pereinamieji elementai.
Atkreipkite dėmesį į chromo ir vario atomų elektronų apvalkalų struktūrą. Juose įvyksta vieno elektrono „gedimas“ iš $4s-$ į $3d$ polygį, o tai paaiškinama didesniu gautų $3d^5$ ir $3d^(10)$ elektroninių konfigūracijų energetiniu stabilumu:
$↙(24)(Cr)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(4) 4s^(2)…$ 
$↙(29)(Cu)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(9)4s^(2)…$ 
| Elemento simbolis, serijos numeris, pavadinimas | Elektroninės struktūros diagrama | Elektroninė formulė | Grafinė elektroninė formulė |
| $↙(19)(K)$ Kalis |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1$ | |
| $↙(20)(C)$ Kalcis |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2$ | |
| $↙(21)(Sc)$ Skandis |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^1$ arba $1s^2(2)s^2(2)p ^6(3)p^6(3)d^1(4)s^1$ |  |
| $↙(22)(Ti)$ Titanas |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^2$ arba $1s^2(2)s^2(2)p ^6(3)p^6(3)d^2(4)s^2$ |  |
| $↙(23)(V)$ Vanadis |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^3$ arba $1s^2(2)s^2(2)p ^6(3)p^6(3)d^3(4)s^2$ |  |
| $↙(24)(Cr)$ Chrome |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^5$ arba $1s^2(2)s^2(2)p ^6(3)p^6(3)d^5(4)s^1$ |  |
| $↙(29)(Сu)$ Chromas |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^(10)$ arba $1s^2(2)s^2(2) )p^6(3)p^6(3)d^(10)(4)s^1$ |  |
| $↙(30)(Zn)$ Cinkas |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)$ arba $1s^2(2)s^2(2) )p^6(3)p^6(3)d^(10)(4)s^2$ |  |
| $↙(31)(Ga)$ Galis |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^(1)$ arba $1s^2(2) s^2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^(1)$ |  |
| $↙(36)(Kr)$ Kriptonas |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^6$ arba $1s^2(2)s^ 2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^6$ |  |
Cinko atome baigtas trečiasis elektronų sluoksnis - jame užpildyti visi $3s, 3p$ ir $3d$ polygiai, iš viso ant jų yra $18$ elektronų.
Elementuose po cinko toliau pildomas ketvirtasis elektronų sluoksnis, $4p$ polygis. Elementai nuo $Ga$ iki $Kr$ – $r$ - elementai.
Išorinis (ketvirtas) kriptono atomo sluoksnis yra baigtas, jame yra 8 USD elektronų. Bet tik ketvirtame elektronų sluoksnyje, kaip žinote, elektronų gali būti $32$; kriptono atomas vis dar turi neužpildytus $4d-$ ir $4f$-po lygius.
Penktojo laikotarpio elementai užpildo polygius tokia tvarka: $5s → 4d → 5р$. Taip pat yra išimčių, susijusių su elektronų „gedimu“ $↙(41)Nb$, $↙(42)Mo$, $↙(44)Ru$, $↙(45)Rh$, $↙( 46) Pd$, $↙(47)Ag$. $f$ pasirodo šeštajame ir septintame laikotarpiais - elementai, t.y. elementai, kurių atitinkamai užpildomi trečiojo išorinio elektroninio sluoksnio $4f-$ ir $5f$-polygiai.
$4f$ - elementai paskambino lantanidai.
$5f$ - elementai paskambino aktinidai.
Šeštojo periodo elementų atomų elektroninių polygių užpildymo tvarka: $↙(55)Cs$ ir $↙(56)Ba$ - $6s$-elementai; $↙(57)La ... 6s^(2)5d^(1)$ - $5d$-elementas; $↙(58)Ce$ – $↙(71)Lu – 4f$-elementai; $↙(72)Hf$ – $↙(80)Hg - 5d$-elementai; $↙(81)Т1$ – $↙(86)Rn – 6d$-elementai. Bet ir čia yra elementų, kuriuose pažeidžiama elektronų orbitalių užpildymo tvarka, kas, pavyzdžiui, siejama su didesniu energijos stabilumu pusės ir visiškai užpildytų $f$-polygių, t.y. $nf^7$ ir $nf^(14)$.
Priklausomai nuo to, kuris atomo polygis užpildytas elektronais, visi elementai, kaip jau supratote, yra suskirstyti į keturias elektronines šeimas arba blokus:
- $s$ -elementai; atomo išorinio lygio $s$-polygis užpildytas elektronais; $s$-elementai apima vandenilį, helią ir pagrindinių I ir II grupių pogrupių elementus;
- $r$ -elementai; atomo išorinio lygio $p$-polygis užpildytas elektronais; $p$-elementai apima III–VIII grupių pagrindinių pogrupių elementus;
- $d$ -elementai; atomo priešišorinio lygio $d$-polygis užpildytas elektronais; $d$-elementai apima I–VIII grupių antrinių pogrupių elementus, t.y. tarp $s-$ ir $p-$ elementų išsidėsčiusių didelių laikotarpių dešimtmečių elementai. Jie taip pat vadinami perėjimo elementai;
- $f$ -elementai;$f-$trečiojo lygio atomo polygis išorėje užpildytas elektronais; tai lantanidai ir aktinidai.

Elektroninė atomo konfigūracija. Atomų antžeminės ir sužadintos būsenos
Šveicarų fizikas W. Pauli 1925 USD tai nustatė Atomas vienoje orbitoje gali turėti daugiausiai du elektronus. turintys priešingus (antilygiagrečius) sukinius (iš anglų kalbos išvertus verpstę), t.y. turintys tokias savybes, kurias sąlygiškai galima įsivaizduoti kaip elektrono sukimąsi aplink savo įsivaizduojamą ašį pagal laikrodžio rodyklę arba prieš laikrodžio rodyklę. Šis principas vadinamas Pauli principas.
Jei orbitoje yra vienas elektronas, tada jis vadinamas nesuporuotas, jei du, tai tai suporuoti elektronai, t.y. elektronai su priešingais sukiniais.
Paveiksle parodyta energijos lygių padalijimo į polygius schema.

$s-$ Orbitinė, kaip jau žinote, yra sferinės formos. Vandenilio atomo elektronas $(n = 1)$ yra šioje orbitoje ir yra nesuporuotas. Pagal tai jo elektroninė formulė, arba elektroninė konfigūracija, parašyta taip: $1s^1$. Elektroninėse formulėse energijos lygio skaičius nurodomas skaičiumi prieš raidę $ (1 ...) $, lotyniška raidė žymi polygį (orbitos tipą), o skaičius, parašytas dešinėje raidė (kaip eksponentė) rodo elektronų skaičių polygyje.
Helio atomui He, kuris turi du suporuotus elektronus toje pačioje $s-$orbitalėje, ši formulė yra: $1s^2$. Helio atomo elektroninis apvalkalas yra pilnas ir labai stabilus. Helis yra tauriosios dujos. Antrasis energijos lygis $(n = 2)$ turi keturias orbitales, vieną $s$ ir tris $p$. Antrojo lygio $s$-orbitos elektronai ($2s$-orbitos) turi didesnę energiją, nes yra didesniu atstumu nuo branduolio nei $1s$-orbitos $(n = 2)$ elektronai. Apskritai kiekvienai $n$ reikšmei yra viena $s-$orbitalė, bet ant jos yra atitinkamas elektronų energijos kiekis, todėl atitinkamo skersmens, didėjančio kaip $n$.$s- reikšmė. $Orbital padidinimas, kaip jau žinote, yra sferinės formos. Vandenilio atomo elektronas $(n = 1)$ yra šioje orbitoje ir yra nesuporuotas. Todėl jo elektroninė formulė arba elektroninė konfigūracija parašyta taip: $1s^1$. Elektroninėse formulėse energijos lygio skaičius nurodomas skaičiumi prieš raidę $ (1 ...) $, lotyniška raidė žymi polygį (orbitos tipą), o skaičius, parašytas dešinėje raidė (kaip eksponentė) rodo elektronų skaičių polygyje.
Helio atomui $He$, kuris turi du suporuotus elektronus toje pačioje $s-$orbitalėje, ši formulė yra: $1s^2$. Helio atomo elektroninis apvalkalas yra pilnas ir labai stabilus. Helis yra tauriosios dujos. Antrasis energijos lygis $(n = 2)$ turi keturias orbitales, vieną $s$ ir tris $p$. Antrojo lygio $s-$orbitalių ($2s$-orbitalių) elektronai turi didesnę energiją, nes yra didesniu atstumu nuo branduolio nei $1s$-orbitos $(n = 2)$ elektronai. Paprastai kiekvienai $n$ reikšmei yra viena $s-$orbitalė, tačiau ant jos yra atitinkamas elektronų energijos kiekis, todėl su atitinkamu skersmeniu, didėjant $n$ reikšmei. 
$r-$ Orbitinė Jis turi hantelio arba aštuonių tūrio formą. Visos trys $p$-orbitalės yra atome viena kitai statmenai išilgai erdvinių koordinačių, nubrėžtų per atomo branduolį. Dar kartą reikia pabrėžti, kad kiekvienas energijos lygis (elektroninis sluoksnis), pradedant nuo $n=2$, turi tris $p$-orbitales. Didėjant $n$ reikšmei, elektronai užima $p$-orbitales, esančias dideliais atstumais nuo branduolio ir nukreiptas išilgai $x, y, z$ ašių.
Antrojo periodo $(n = 2)$ elementams pirmiausia užpildoma viena $s$-orbitalė, o po to trys $p$-orbitalės; elektroninė formulė $Li: 1s^(2)2s^(1)$. $2s^1$ elektronas yra silpniau surištas su atomo branduoliu, todėl ličio atomas gali lengvai jį atiduoti (kaip tikriausiai prisimenate, šis procesas vadinamas oksidacija), virsdamas ličio jonu $Li^+$.
Berilio atome Be ketvirtasis elektronas taip pat patalpintas į $2s$ orbitą: $1s^(2)2s^(2)$. Du išoriniai berilio atomo elektronai lengvai atsiskiria – $B^0$ oksiduojasi į $Be^(2+)$ katijoną.
Penktasis boro atomo elektronas užima $2p$-orbitalę: $1s^(2)2s^(2)2p^(1)$. Toliau užpildomos $2p$-orbitalės iš $C, N, O, F$ atomų, kurios baigiasi neoninėmis tauriosiomis dujomis: $1s^(2)2s^(2)2p^(6)$.
Trečiojo periodo elementams užpildomos atitinkamai $3s-$ ir $3p$-orbitos. Penkios trečiojo lygio $d$ orbitos lieka laisvos:
$↙(11)Na 1s^(2)2s^(2)2p^(6)3s^(1)$,
$↙(17)Cl 1s^(2)2s^(2)2p^(6)3s^(2)3p^(5)$,
$↙(18)Ar 1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)$.
Kartais diagramose, vaizduojančiose elektronų pasiskirstymą atomuose, nurodomas tik elektronų skaičius kiekviename energijos lygyje, t.y. Parašykite sutrumpintas elektronines cheminių elementų atomų formules, priešingai nei aukščiau pateiktos visos elektroninės formulės, pavyzdžiui:
$↙(11)Na 2, 8, 1;$ $↙(17)Cl 2, 8, 7;$ $↙(18)Ar 2, 8, 8$.
Didelio periodo elementų (ketvirto ir penkto) atveju pirmieji du elektronai atitinkamai užima $4s-$ ir $5s$-orbitales: $↙(19)K 2, 8, 8, 1;$ $↙(38)Sr 2 , 8, 18, 8, 2 USD. Pradedant nuo kiekvieno didelio periodo trečiojo elemento, kiti dešimt elektronų pateks į ankstesnes $3d-$ ir $4d-$ orbitales atitinkamai (antrinių pogrupių elementams): $↙(23)V 2, 8, 11 , 2;$ $↙( 26)Fr 2, 8, 14, 2;$ $↙(40)Zr 2, 8, 18, 10, 2;$ $↙(43)Tc 2, 8, 18, 13, 2 USD. Paprastai užpildžius ankstesnį $d$-polygį, pradedamas pildyti išorinis (atitinkamai $4p-$ ir $5p-$) $p-$polygis: $↙(33)Kaip 2, 8, 18, 5;$ $ ↙(52)Te 2, 8, 18, 18, 6$.
Didelio periodo elementams – šeštam ir nepilnam septintam – elektroniniai lygiai ir polygiai užpildomi elektronais, kaip taisyklė: pirmieji du elektronai patenka į išorinį $s-$polygį: $↙(56)Ba 2, 8 , 18, 18, 8, 2;$ $↙(87)N 2, 8, 18, 32, 18, 8, 1 $; kitas elektronas ($La$ ir $Ca$) į ankstesnį $d$ polygį: $↙(57)La 2, 8, 18, 18, 9, 2$ ir $↙(89)Ac 2, 8, 18, 32, 18, 9, 2 USD.
Tada kiti $14$ elektronai pateks į trečiąjį energijos lygį iš išorės, atitinkamai į $4f$ ir $5f$ lantonidų ir aktinidų orbitas: $↙(64)Gd 2, 8, 18, 25, 9, 2 ;$ ↙(92 )U 2, 8, 18, 32, 21, 9, 2 $.
Tada antrasis energijos lygis iš išorės ($d$-polygis) vėl pradės kauptis šoninių pogrupių elementams: $↙(73)Ta 2, 8, 18, 32, 11, 2;$ $↙( 104) Rf 2, 8, 18, 32, 32, 10, 2 USD. Ir galiausiai, tik po to, kai $d$-polygis bus visiškai užpildytas dešimčia elektronų, $p$-lygis vėl bus užpildytas: $↙(86)Rn 2, 8, 18, 32, 18, 8$.
Labai dažnai atomų elektronų apvalkalų sandara vaizduojama naudojant energijos ar kvantines ląsteles – jose užrašomos vadinamosios. grafinės elektroninės formulės. Šiam įrašui naudojama tokia žyma: kiekviena kvantinė ląstelė žymima ląstele, atitinkančia vieną orbitą; kiekvienas elektronas pažymėtas sukimosi kryptį atitinkančia rodykle. Rašant grafinę elektroninę formulę, reikia atsiminti dvi taisykles: Pauli principas, pagal kurią ląstelė (orbitalė) gali turėti ne daugiau kaip du elektronus, bet su antilygiagrečiais sukiniais, ir F. Hundo taisyklė, pagal kurią elektronai laisvąsias ląsteles užima pirmiausia po vieną ir tuo pačiu turi tą pačią sukimosi reikšmę, o tik po to poruojasi, tačiau sukimai tokiu atveju pagal Pauli principą jau bus priešingos krypties.
1 užduotis. Parašykite šių elementų elektronines konfigūracijas: N, Si, F e, Kr , Te, W .
Sprendimas. Atominių orbitų energija didėja tokia tvarka:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
Ant kiekvieno s apvalkalo (vienos orbitalės) gali būti ne daugiau kaip du elektronai, ant p apvalkalo (trys orbitalės) - ne daugiau kaip šeši, ant d apvalkalo (penkios orbitalės) - ne daugiau kaip 10 ir ant f apvalkalas (septynios orbitos) - ne daugiau kaip 14.
Esant pagrindinei atomo būsenai, elektronai užima mažiausią energiją turinčias orbitas. Elektronų skaičius lygus branduolio krūviui (visas atomas yra neutralus) ir elemento atominiam skaičiui. Pavyzdžiui, azoto atomas turi 7 elektronus, iš kurių du yra 1s orbitose, du yra 2s orbitalėse, o likę trys elektronai yra 2p orbitose. Azoto atomo elektroninė konfigūracija:
7 N: 1s 2 2s 2 2p 3. Kitų elementų elektroninės konfigūracijos:
14 Si: 1s 2 2s 2 2p 6 3s 2 3p 2,
26 F e : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6,
36 K r: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6,
52 Tie : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 4,
74 Tie : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 3p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4.
2 užduotis. Kokios inertinės dujos ir kokių elementų jonai turi tokią pačią elektroninę konfigūraciją kaip dalelė, susidaranti pašalinus visus valentinius elektronus iš kalcio atomo?
Sprendimas. Kalcio atomo elektroninis apvalkalas turi tokią struktūrą: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . Pašalinus du valentinius elektronus, susidaro Ca 2+ jonas, kurio konfigūracija yra 1s 2 2s 2 2p 6 3s 2 3p 6 . Atomas turi tą pačią elektroninę konfigūraciją Ar ir jonai S 2-, Cl -, K +, Sc 3+ ir kt.
3 užduotis. Ar Al 3+ jono elektronai gali būti šiose orbitose: a) 2p; b) 1r; c) 3d?
Sprendimas. Aliuminio atomo elektroninė konfigūracija: 1s 2 2s 2 2p 6 3s 2 3p 1 . Al 3+ jonas susidaro pašalinus tris valentinius elektronus iš aliuminio atomo ir turi elektroninę konfigūraciją 1s 2 2s 2 2p 6 .
a) elektronai jau yra 2p orbitoje;
b) pagal apribojimus, taikomus kvantiniam skaičiui l (l = 0, 1, ... n -1), kai n = 1, galima tik reikšmė l = 0, todėl 1p orbitalė neegzistuoja ;
c) elektronai gali būti 3d orbitoje, jei jonas yra sužadintas.
4 užduotis. Parašykite elektroninę neono atomo konfigūraciją pirmojoje sužadintoje būsenoje.
Sprendimas. Neono atomo elektroninė konfigūracija pagrindinėje būsenoje yra 1s 2 2s 2 2p 6 . Pirmoji sužadinta būsena gaunama vienam elektronui pereinant iš aukščiausios užimtos orbitos (2p) į žemiausią laisvąją orbitą (3s). Pirmosios sužadintos būsenos neono atomo elektroninė konfigūracija yra 1s 2 2s 2 2p 5 3s 1 .
5 užduotis. Kokia yra 12 C ir 13 C , 14 N ir 15 N izotopų branduolių sudėtis?
Sprendimas. Protonų skaičius branduolyje yra lygus elemento atominiam skaičiui ir yra vienodas visiems šio elemento izotopams. Neutronų skaičius yra lygus masės skaičiui (nurodytas elemento numerio viršuje, kairėje), atėmus protonų skaičių. Skirtingi to paties elemento izotopai turi skirtingą neutronų skaičių.
Šių branduolių sudėtis:
12C: 6p + 6n; 13C: 6p + 7n; 14 N: 7p + 7n; 15N: 7p + 8n.
Elektroninė konfigūracija- elektronų išdėstymo įvairiuose cheminio elemento ar molekulės atomo elektronų apvalkaluose formulė.
Elektroninė konfigūracija paprastai rašoma atomams jų pagrindinėje būsenoje. Norint nustatyti elektroninę elemento konfigūraciją, taikomos šios taisyklės:
- Užpildymo principas. Pagal užpildymo principą elektronai, esantys atomo pagrindinėje būsenoje, užpildo orbitas didėjančių orbitos energijos lygių seka. Mažiausios energijos orbitos visada užpildomos pirmiausia.
- Pauli išskyrimo principas. Pagal šį principą bet kurioje orbitoje gali būti ne daugiau kaip du elektronai, o tada tik tuo atveju, jei jie turi priešingus sukinius (nevienodus sukinių skaičius).
- Hundo taisyklė. Pagal šią taisyklę vieno posluoksnio orbitalių užpildymas prasideda pavieniais elektronais su lygiagrečiais (to paties ženklo) sukiniais, ir tik po to, kai pavieniai elektronai užima visas orbitales, galutinis orbitalių užpildymas elektronų poromis su priešingais sukiniais. gali atsirasti.
Kvantinės mechanikos požiūriu elektroninė konfigūracija yra pilnas vieno elektrono bangos funkcijų sąrašas, iš kurio pakankamai tiksliai galima sudaryti visą atomo banginę funkciją (apytiksliai savaime nuoseklus laukas).
Paprastai tariant, atomą, kaip sudėtinę sistemą, galima visiškai apibūdinti tik visa bangos funkcija. Tačiau toks apibūdinimas praktiškai neįmanomas atomams, sudėtingesniems už vandenilio atomą, paprasčiausią iš visų cheminių elementų atomų. Patogus apytikslis aprašymas yra savarankiško lauko metodas. Šis metodas pristato kiekvieno elektrono banginės funkcijos sampratą. Visos sistemos banginė funkcija parašyta kaip tinkamai simetrizuota vieno elektrono bangų funkcijų sandauga. Skaičiuojant kiekvieno elektrono banginę funkciją, į visų kitų elektronų lauką atsižvelgiama kaip į išorinį potencialą, kuris savo ruožtu priklauso nuo šių kitų elektronų banginių funkcijų.
Taikant savaime nuoseklaus lauko metodą, gaunama sudėtinga netiesinių integralinių diferencialinių lygčių sistema, kurią vis dar sunku išspręsti. Tačiau savaime nuoseklios lauko lygtys turi pradinės problemos sukimosi simetriją (tai yra, jos yra sferiškai simetriškos). Tai leidžia visiškai klasifikuoti vieno elektrono bangų funkcijas, kurios sudaro visą atomo bangos funkciją.
Pirmiausia, kaip ir bet kuriame centralizuotai simetriniame potenciale, bangos funkcija savaime nuosekliame lauke gali būti apibūdinta viso kampinio momento kvantiniu skaičiumi. l (\displaystyle l) o kampinio momento projekcijos į kurią nors ašį kvantinis skaičius m (\displaystyle m). Banginės funkcijos su skirtingomis reikšmėmis m (\displaystyle m) atitinka tą patį energijos lygį, t.y., yra išsigimę. Be to, vienas energijos lygis atitinka būsenas su skirtingomis elektronų sukimosi projekcijomis bet kurioje ašyje. Iš viso tam tikram energijos lygiui 2 (2 l + 1) (\displaystyle 2 (2l+1)) bangų funkcijos. Be to, tam tikrai kampinio momento vertei energijos lygiai gali būti pernumeruoti. Pagal analogiją su vandenilio atomu, įprasta numeruoti tam tikro energijos lygius l (\displaystyle l) pradedant nuo n = l + 1 (\displaystyle n=l+1). Visas vieno elektrono banginių funkcijų kvantinių skaičių, iš kurių galima sudaryti atomo banginę funkciją, sąrašas vadinamas elektronine konfigūracija. Kadangi viskas yra išsigimusi kvantiniu skaičiumi m (\displaystyle m) o sukinyje su duomenimis pakanka nurodyti bendrą elektronų skaičių būsenoje n (\displaystyle n), l (\displaystyle l).
Enciklopedinis „YouTube“.
-
1 / 5
Dėl istorinių priežasčių elektroninės konfigūracijos formulėje kvantinis skaičius l (\displaystyle l) parašyta lotyniškomis raidėmis. Būsena su žymima raide s (\displaystyle s), p (\displaystyle p): l = 1 (\displaystyle l = 1), d (\displaystyle d): l = 2 (\displaystyle l = 2), f (\displaystyle f): l = 3 (\displaystyle l = 3), g (\displaystyle g): l = 4 (\displaystyle l = 4) ir taip toliau abėcėlės tvarka. Kairėje nuo numerio l (\displaystyle l) parašyti skaičių n (\displaystyle n), ir numerio viršuje l (\displaystyle l) yra elektronų skaičius duomenų būsenoje n (\displaystyle n) ir l (\displaystyle l). Pavyzdžiui 2 s 2 (\displaystyle 2s^(2)) atitinka du elektronus būsenoje su n = 2 (\displaystyle n = 2), l = 0 (\displaystyle l = 0). Dėl praktinio patogumo (žr. Klečkovskio taisyklę) pilnoje elektroninės konfigūracijos formulėje terminai rašomi kvantinio skaičiaus didėjimo tvarka n (\displaystyle n), o tada kvantinis skaičius l (\displaystyle l), pavyzdžiui 1 sek. 2 s. 2 2 p 6 3 s 2 3 p 3 (\displaystyle 1s^(2)2s^(2)2p^(6)3s^(2)3p^(3)). Kadangi toks žymėjimas yra šiek tiek perteklinis, kartais formulė sumažinama iki 1 s 2 2 s 2 p 6 3 s 2 p 3 (\displaystyle 1s^(2)2s^(2)p^(6)3s^(2)p^(3)), ty praleisti skaičių n (\displaystyle n) kur galima atspėti iš termino tvarkos taisyklė.
Periodinis dėsnis ir atomo sandara
Visi asmenys, dalyvaujantys atomo struktūroje bet kuriuose savo tyrimuose, remiasi įrankiais, kuriuos jiems suteikia periodinis įstatymas, kurį atrado chemikas D. I. Mendelejevas; tik suprasdami šį dėsnį, fizikai ir matematikai naudoja savo „kalbą“ aiškindami jo parodytas priklausomybes (nors J. W. Gibbsas yra žinomas dėl gana ironiško aforizmo šia tema), tačiau tuo pat metu yra izoliuotas nuo chemikų, studijuojančių. materija, turėdami visą savo aparato tobulumą, privalumus ir universalumą, nei fizikai, nei matematikai, žinoma, negali kurti savo tyrimų.
Šių disciplinų atstovų sąveika stebima ir toliau plėtojant temą. Antrinio periodiškumo atradimas E. V. Birono (1915) suteikė dar vieną aspektą, leidžiantį suprasti klausimus, susijusius su elektronų apvalkalų sandaros dėsningumais. S. A. Šukarevas, E. V. Birono mokinys ir
Elektroninė atomo konfigūracija yra rodo energijos pasiskirstymą ē. lygiai ir polygiai.
1s 1 ←skaičius ē su nurodyta debesies forma
↖ elektronų debesies forma
energijos lygis
Grafinės elektroninės formulės (atomo elektroninės struktūros vaizdai) -
rodo energijos pasiskirstymą ē. lygiai, polygiai ir orbitos.
I laikotarpis:+1 N
Kur - ē, ↓ - ē su antilygiagrečiais sukimais, orbita.
Rašant grafinę elektroninę formulę, reikėtų prisiminti Pauli taisyklę ir Hundo taisyklė „Jei viename polygyje yra kelios laisvos orbitalės, tada kiekviena ē dedama į atskirą orbitalę ir tik nesant laisvų orbitalių sujungiama į poras.
(Darbas su elektroninėmis ir grafinėmis elektroninėmis formulėmis).
Pavyzdžiui, H+11s1; Jis +2 1s 2 ; Li +3 1s 2 2s 1; Na +11 1s 2 2s 2 2p 6 3s 1; Ar +18 1s 2 2s 2 2p 6 3s 2 3p 6;
I laikotarpis: vandenilis ir helis – s-elementai, jų s-orbitalė užpildyta elektronais.
II laikotarpis: Li ir Be yra s elementai
B, C, N, O, F, Ne – p-elementai
Priklausomai nuo to, kuris atomo polygis yra užpildytas elektronais, visi elementai skirstomi į 4 elektronines šeimas arba blokus:
1) s-elementai – jie turi atomo išorinio sluoksnio ē-mi s polygį; tai vandenilis, helis ir e-you gl.p / gr. I ir II grupės.
2) p-elementai - jie užpildo išorinio atomo lygio elektronų pasaulio polygį; tai apima gl.p / gr elementus. III - VIII grupės.
3) d elementai - juose atomo priešišorinio lygio d-polygis užpildytas elektronais; tai apima e-you poboch.p / gr. . I-VIII grupės, t.y. el-you plug-in dešimtmečius didelių laikotarpių, esančių tarp s ir p elementų, jie taip pat vadinami pereinamaisiais elementais.
4) f-elementai- išorėje esančio atomo trečiojo lygio f polygis užpildytas elektronais; tai lantanidai (4f elementai) ir aktinidai (5f elementai).
Vario ir chromo atomai turi „nesėkmė“ ē nuo 4s- iki 3d polygio, o tai paaiškinama didesniu gautų elektroninių konfigūracijų 3d 5 ir 3d 10 energijos stabilumu:
29 Cu 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Eksperimentiškai įrodyta, kad atomų būsenos, kuriose p-, d-, f-orbitalės yra pusiau užpildytos (p 3 , d 5 , f 7 ), visiškai (p 6 , d 10 , f 14 ) arba laisvos. , padidino stabilumą. Tai paaiškina elektronų perėjimus – „nusileidimus“ tarp glaudžiai išdėstytų orbitų. Tie patys nukrypimai pastebimi chromo - molibdeno analoge, taip pat vario pogrupio elementuose - sidabre ir aukse. Unikalus šiuo požiūriu yra paladis, kurio atomas iš viso neturi 5s elektronų ir turi pėdsaką. Konfigūracija: 46 Pd 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10.
Klausimai savikontrolei
1. Kas yra elektronų debesis?
2. Kuo skiriasi 1s-orbitalė ir 2s-orbitalė?
3. Koks yra pagrindinis kvantinis skaičius? Kaip tai susiję su laikotarpio skaičiumi?
4. Kas yra polygis ir kaip ši sąvoka susijusi su laikotarpio numeriu?
5. Sudaryti PSCE laikotarpio 4-6 elementų atomų elektronines konfigūracijas.
6. Sudarykite magnio ir neono atomų elektroninę konfigūraciją.
7. Nustatykite, kuris atomas priklauso elektroninei konfigūracijai 1S 2 2S 2 2p 6 3S 1, 1S 2 2S 2 2p 6 3S 2, 1S 2 2S 2 2p 4, 1S 2 2S 1
PAMOKOS PLANAS Nr.7
Drausmė: Chemija.
Tema:
Pamokos tikslas: Ištirti joninių ir kovalentinių ryšių susidarymo mechanizmus, nagrinėti jonines, atomines ir molekulines kristalines gardeles.
Planuojami rezultatai
Tema: pagrindinių cheminių sąvokų turėjimas: cheminis ryšys, jonai, kristalinės gardelės, užtikrintas cheminės terminijos ir simbolių vartojimas; gebėjimo pateikti kiekybinius įverčius ir atlikti skaičiavimus pagal chemines formules ir lygtis formavimas;
Metasubject:įvairių rūšių pažintinės veiklos ir pagrindinių intelektinių operacijų panaudojimas: cheminių elementų atomų elektroninių konfigūracijų sudarymas.
Asmeninis: gebėjimas panaudoti šiuolaikinio chemijos mokslo ir chemijos technologijų pasiekimus savo intelektualiniam tobulėjimui didinti pasirinktoje profesinėje veikloje;
Laiko norma: 2 valandos
Klasės tipas: Paskaita.
Pamokos planas:
1. Katijonai, jų susidarymas iš atomų oksidacijos proceso metu. Anijonai, jų susidarymas iš atomų redukcijos proceso metu. Joninis ryšys, kaip ryšys tarp katijonų ir anijonų dėl elektrostatinės traukos.
2. Jonų klasifikacija: pagal sudėtį, krūvio ženklą, hidrato apvalkalo buvimą.
3. Joninės kristalinės gardelės. Medžiagų, turinčių joninio tipo kristalinę gardelę, savybės.
4. Kovalentinio ryšio (mainos ir donoro-akceptoriaus) susidarymo mechanizmas.
5. Elektronegatyvumas. Kovalentiniai poliniai ir nepoliniai ryšiai. Kovalentinio ryšio dauginys.
6. Molekulinės ir atominės kristalinės gardelės. Medžiagų, turinčių molekulines ir atomines kristalines gardeles, savybės.
Įranga: DIMendelejevo kristalinių gardelių modeliai, vadovėlis, periodinė cheminių elementų sistema.
Literatūra:
1. Chemijos 11 klasė: vadovėlis. bendrajam lavinimui organizacijos G.E. Rudzitis, F.G. Feldmanas. - M.: Švietimas, 2014. -208 p.: Ill..
2. Chemija techninio profilio profesijoms ir specialybėms: vadovėlis studentams. vidutinės institucijos. prof. išsilavinimas / O.S.Gabrielyan, I.G. Ostroumovas. - 5 leidimas, ištrintas. - M .: Leidybos centras "Akademija", 2017. - 272 psl., su spalva. nesveikas.
Lektorius: Tubaltseva Yu.N.
7 tema. Joninė ir kovalentinė cheminė jungtis.
1) Katijonai, jų susidarymas iš atomų oksidacijos proceso metu. Anijonai, jų susidarymas iš atomų redukcijos proceso metu. Joninis ryšys, kaip ryšys tarp katijonų ir anijonų dėl elektrostatinės traukos.
2) Jonų klasifikacija: pagal sudėtį, krūvio ženklą, hidratuoto apvalkalo buvimą.
3) Joninės kristalinės gardelės. Medžiagų, turinčių joninio tipo kristalinę gardelę, savybės.
4) Kovalentinio ryšio susidarymo mechanizmas (mainai ir donoras-akceptorius).
5) Elektronegatyvumas. Kovalentiniai poliniai ir nepoliniai ryšiai. Kovalentinio ryšio dauginys.
6) Molekulinės ir atominės kristalinės gardelės. Medžiagų, turinčių molekulines ir atomines kristalines gardeles, savybės.
Katijonai, jų susidarymas iš atomų oksidacijos proceso metu. Anijonai, jų susidarymas iš atomų redukcijos proceso metu. Joninis ryšys, kaip ryšys tarp katijonų ir anijonų dėl elektrostatinės traukos.
Cheminis ryšys yra atomų sąveika, kuri lemia cheminės dalelės ar kristalo kaip visumos stabilumą. Cheminis ryšys susidaro dėl elektrostatinės sąveikos tarp įkrautų dalelių: katijonų ir anijonų, branduolių ir elektronų. Kai atomai artėja vienas prie kito, tarp vieno atomo branduolio ir kito elektronų pradeda veikti patrauklios jėgos, taip pat atstumiančios jėgos tarp branduolių ir tarp elektronų. Tam tikru atstumu šios jėgos subalansuoja viena kitą ir susidaro stabili cheminė dalelė.
Susidarius cheminiam ryšiui, junginyje gali įvykti reikšmingas atomų elektronų tankio perskirstymas, palyginti su laisvaisiais atomais. Ribiniu atveju tai veda prie įkrautų dalelių – jonų (iš graikų kalbos „jonas“ – einantis) susidarymo.
Jonų sąveika:
Jei atomas netenka vieno ar daugiau elektronų, tada jis virsta teigiamu jonu – katijonu (išvertus iš graikų kalbos – „leidžiasi žemyn). Taip susidaro vandenilio katijonai H +, ličio Li +, baris Ba 2+ Įsigyja elektronus , atomai virsta neigiamais jonais - anijonais (iš graikiško "anijono" - kylantis aukštyn) Anijonų pavyzdžiai yra fluoro jonas F - , sulfido jonas S 2 - .
Katijonai ir anijonai gali pritraukti vienas kitą. Tokiu atveju susidaro cheminis ryšys, susidaro cheminiai junginiai. Šio tipo cheminis ryšys vadinamas joniniu ryšiu:
Joninė jungtis, kaip taisyklė, atsiranda tarp tipiškų metalų ir tipiškų nemetalų atomų. Būdinga metalo atomų savybė yra ta, kad jie lengvai atiduoda savo valentinius elektronus, o nemetalų atomai gali lengvai juos prijungti.
Apsvarstykite joninės jungties atsiradimą, pavyzdžiui, tarp natrio atomų ir chloro atomų natrio chloride NaCl.
Elektronui atsiskyrus nuo natrio atomo susidaro teigiamai įkrautas jonas – natrio katijonas Na +.
Pridėjus elektroną prie chloro atomo, susidaro neigiamai įkrautas jonas – chloro anijonas Cl-.
Tarp susidariusių Na + ir Cl - jonų, turinčių priešingą krūvį, atsiranda elektrostatinė trauka, dėl kurios susidaro junginys - natrio chloridas su jonine chemine jungtimi.
Joninis ryšys - Tai cheminis ryšys, atsirandantis dėl priešingai įkrautų jonų elektrostatinės sąveikos.
Taigi, joninės jungties susidarymo procesas sumažinamas iki elektronų perėjimo iš natrio atomų į chloro atomus, susidarant priešingai įkrautiems jonams su pilnomis išorinių sluoksnių elektroninėmis konfigūracijomis.
1. Metalų atomai, atsisakę išorinių elektronų, virsta teigiamais jonais:
kur n yra elektronų skaičius išoriniame atomo sluoksnyje, atitinkantis cheminio elemento grupės numerį.
2. Nemetalų atomai, priimantys elektronus, kurių trūksta iki išorinio elektronų sluoksnio užbaigimo, paverčiami neigiamais jonais:

3. Tarp priešingai įkrautų jonų atsiranda ryšys, kuris vadinamas joninės.

2. Jonų klasifikacija: pagal sudėtį, krūvio ženklą, hidrato apvalkalo buvimą.
Jonų klasifikacija:
1. Pagal krūvio ženklą: katijonai (teigiami, K+, Ca2+, H+) ir anijonai (neigiami, S2-, Cl-, I-).
2. Pagal sudėtį: sudėtingas ( , ) ir paprastas (Na +, F-)©2015-2019 svetainė
Visos teisės priklauso jų autoriams. Ši svetainė nepretenduoja į autorystę, tačiau suteikia galimybę nemokamai naudotis.
Puslapio sukūrimo data: 2017-12-12