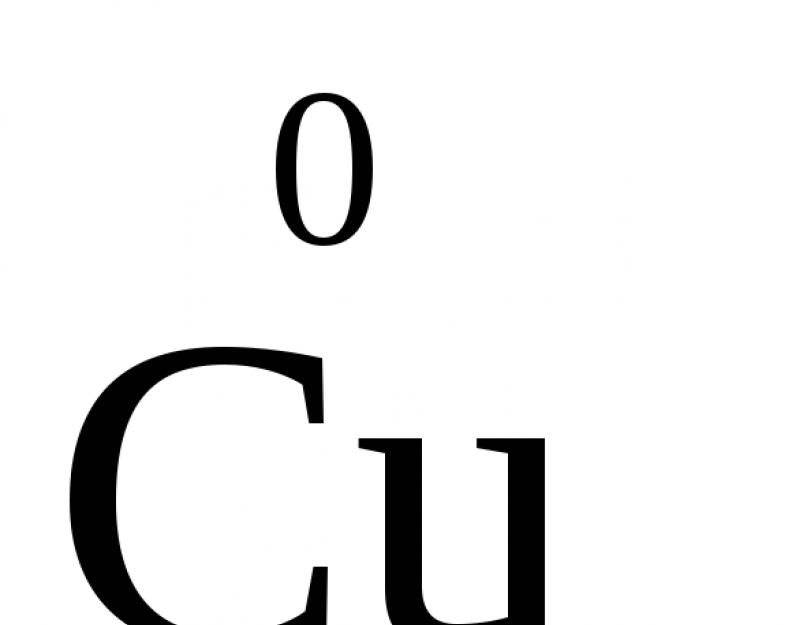Norint apibūdinti dalelių redokso gebėjimą, svarbi oksidacijos laipsnio sąvoka. OKSIDACIJOS LAIPSNIS – tai krūvis, kurį turėtų molekulės ar jono atomas, jei visi jo ryšiai su kitais atomais būtų nutrūkę, o bendros elektronų poros susijungtų su daugiau elektronneigiamų elementų.
Skirtingai nuo faktinių jonų krūvių, oksidacijos būsena rodo tik sąlyginį atomo krūvį molekulėje. Jis gali būti neigiamas, teigiamas arba nulis. Pavyzdžiui, paprastų medžiagų atomų oksidacijos būsena yra „0“ (,  ,
, ,
, ). IN cheminiai junginiai atomai gali turėti pastovus laipsnis oksidacinis arba kintamasis. Periodinės lentelės grupių pagrindinių pogrupių I, II ir III metalų cheminiuose junginiuose oksidacijos būsena paprastai yra pastovi ir lygi atitinkamai Me +1, Me +2 ir Me +3 (Li + , Ca +2, Al +3). Fluoro atomas visada turi -1. Chloro kiekis junginiuose su metalais visada yra -1. Daugumoje junginių deguonies oksidacijos būsena yra -2 (išskyrus peroksidus, kur jo oksidacijos laipsnis yra -1), ir vandenilio +1 (išskyrus metalų hidridus, kurių oksidacijos laipsnis yra -1).
). IN cheminiai junginiai atomai gali turėti pastovus laipsnis oksidacinis arba kintamasis. Periodinės lentelės grupių pagrindinių pogrupių I, II ir III metalų cheminiuose junginiuose oksidacijos būsena paprastai yra pastovi ir lygi atitinkamai Me +1, Me +2 ir Me +3 (Li + , Ca +2, Al +3). Fluoro atomas visada turi -1. Chloro kiekis junginiuose su metalais visada yra -1. Daugumoje junginių deguonies oksidacijos būsena yra -2 (išskyrus peroksidus, kur jo oksidacijos laipsnis yra -1), ir vandenilio +1 (išskyrus metalų hidridus, kurių oksidacijos laipsnis yra -1).
Neutralioje molekulėje visų atomų oksidacijos būsenų algebrinė suma lygi nuliui, o jone – jono krūvis. Šis ryšys leidžia apskaičiuoti sudėtingų junginių atomų oksidacijos būsenas.
Sieros rūgšties molekulėje H 2 SO 4 vandenilio atomo oksidacijos būsena yra +1, o deguonies atomo - -2. Kadangi yra du vandenilio atomai ir keturi deguonies atomai, turime du „+“ ir aštuonis „-“. Neutralumas yra šešių „+“ ženklų atstumu. Šis skaičius yra sieros oksidacijos būsena -  . Kalio dichromato K 2 Cr 2 O 7 molekulė susideda iš dviejų kalio atomų, dviejų chromo atomų ir septynių deguonies atomų. Kalio oksidacijos būsena visada yra +1, o deguonies - -2. Tai reiškia, kad turime du „+“ ir keturiolika „-“. Likusius dvylika „+“ sudaro du chromo atomai, kurių kiekvieno oksidacijos laipsnis yra +6 (
. Kalio dichromato K 2 Cr 2 O 7 molekulė susideda iš dviejų kalio atomų, dviejų chromo atomų ir septynių deguonies atomų. Kalio oksidacijos būsena visada yra +1, o deguonies - -2. Tai reiškia, kad turime du „+“ ir keturiolika „-“. Likusius dvylika „+“ sudaro du chromo atomai, kurių kiekvieno oksidacijos laipsnis yra +6 (  ).
).
Tipiški oksidatoriai ir reduktoriai
Iš redukcijos ir oksidacijos procesų apibrėžimo matyti, kad iš esmės kaip oksidatoriai gali veikti paprastos ir sudėtingos medžiagos, turinčios atomų, kurių oksidacijos būsena nėra žemiausia ir todėl gali sumažinti savo oksidacijos būseną. Panašiai kaip redukuojančios medžiagos gali veikti paprastos ir sudėtingos medžiagos, turinčios atomų, kurių oksidacijos būsena nėra didžiausia ir todėl gali padidinti jų oksidacijos būseną.
Galingiausi oksidatoriai yra:
1) paprastos medžiagos, sudarytos iš atomų, turinčių didelį elektronegatyvumą, t.y. tipiniai nemetalai, esantys pagrindiniuose šeštos ir septintos periodinės lentelės pogrupiuose: F, O, Cl, S (atitinkamai F 2, O 2, Cl 2, S);
2) medžiagos, turinčios aukštesniųjų ir tarpinių elementų
teigiamos oksidacijos būsenos, įskaitant jonų pavidalą, tiek paprastus, elementinius (Fe 3+), tiek deguonies turinčius oksoanijonus (permanganato jonai - MnO 4 -);
3) peroksido junginiai.
Konkrečios medžiagos, praktiškai naudojamos kaip oksidatoriai, yra deguonis ir ozonas, chloras, bromas, permanganatai, dichromatai, chloro oksirūgštys ir jų druskos (pvz.,  ,
, ,
, ), Azoto rūgštis (
), Azoto rūgštis (  ), koncentruota sieros rūgštis (
), koncentruota sieros rūgštis (  ), mangano dioksidas (
), mangano dioksidas (  ), vandenilio peroksidas ir metalų peroksidai (
), vandenilio peroksidas ir metalų peroksidai (  ,
, ).
).
Tarp galingiausių redukuojančių medžiagų yra:
1) paprastos medžiagos, kurių atomai turi mažą elektronegatyvumą („aktyvieji metalai“);
2) žemos oksidacijos būsenos metalų katijonai (Fe 2+);
3) paprastieji elementarieji anijonai, pavyzdžiui, sulfido jonas S 2-;
4) deguonies turintys anijonai (oksoanijonai), atitinkantys žemiausią teigiamą elemento (nitrito) oksidacijos būseną  , sulfitas
, sulfitas  ).
).
Specifinės medžiagos, praktiškai naudojamos kaip reduktorius, yra, pavyzdžiui, šarminiai ir šarminių žemių metalai, sulfidai, sulfitai, vandenilio halogenidai (išskyrus HF), organinės medžiagos – alkoholiai, aldehidai, formaldehidas, gliukozė, oksalo rūgštis, taip pat vandenilis, anglis. , anglies monoksidas (  ) ir aliuminio esant aukštai temperatūrai.
) ir aliuminio esant aukštai temperatūrai.
Iš esmės, jei medžiagoje yra tarpinės oksidacijos būsenos elementas, šios medžiagos gali turėti ir oksiduojančių, ir redukuojančių savybių. Viskas priklauso nuo
„partneris“ reakcijoje: su pakankamai stipriu oksidatoriumi gali reaguoti kaip reduktorius, o su pakankamai stipriu reduktoriumi - kaip oksidatorius. Pavyzdžiui, nitrito jonas NO 2 - rūgščioje aplinkoje veikia kaip oksidatorius I - jono atžvilgiu:
2 +
2
+
2 + 4HCl→
+ 4HCl→  +
2
+
2 + 4KCl + 2H2O
+ 4KCl + 2H2O
ir kaip reduktorius permanganato jonų MnO 4 atžvilgiu -
5 +
2
+
2 + 3H 2 SO 4 → 2
+ 3H 2 SO 4 → 2  +
5
+
5 +K2SO4 + 3H2O
+K2SO4 + 3H2O
Mokykloje chemija vis dar užima vieno iš sunkiausių dalykų vietą, kuri dėl to, kad slepia daugybę sunkumų, sukelia mokiniams (dažniausiai 8–9 klasių laikotarpiu) daugiau neapykantos ir abejingumo studijoms, nei domėjimosi. Visa tai mažina žinių šia tema kokybę ir kiekybę, nors daugelis sričių vis dar reikalauja šios srities specialistų. taip, sunkių akimirkų o kartais chemijoje yra net daugiau nesuprantamų taisyklių nei atrodo. Vienas iš daugelio studentų nerimą keliančių klausimų – kas yra oksidacijos skaičius ir kaip nustatyti elementų oksidacijos skaičių.
Svarbi taisyklė – išdėstymo taisyklė, algoritmai
Čia daug kalbama apie junginius, tokius kaip oksidai. Pirmiausia kiekvienas studentas turi išmokti oksidų nustatymas- tai sudėtingi dviejų elementų junginiai, juose yra deguonies. Oksidai klasifikuojami kaip dvejetainiai junginiai, nes deguonis pagal algoritmą yra antras. Nustatant rodiklį svarbu žinoti išdėstymo taisykles ir apskaičiuoti algoritmą.
Rūgščių oksidų algoritmai
Oksidacijos būsenos - Tai skaitinės elementų valentingumo išraiškos. Pavyzdžiui, rūgščių oksidai susidaro pagal tam tikrą algoritmą: pirmiausia atsiranda nemetalai arba metalai (jų valentingumas paprastai yra nuo 4 iki 7), o tada ateina deguonis, kaip ir turi būti, antra eilės tvarka, jo valentingumas lygus du. Tai galima lengvai nustatyti naudojant periodinę lentelę cheminiai elementai Mendelejevas. Taip pat svarbu žinoti, kad elementų oksidacijos būsena yra rodiklis, rodantis arba teigiamas arba neigiamas skaičius .
Algoritmo pradžioje metalas, kaip taisyklė, yra nemetalas, o jo oksidacijos būsena yra teigiama. Nemetalinio deguonies oksido junginiuose vertė yra stabili -2. Norint nustatyti visų reikšmių išdėstymo teisingumą, reikia padauginti visus turimus skaičius iš vieno konkretaus elemento indeksų, jei sandauga, atsižvelgiant į visus minusus ir pliusus, yra lygi 0, tada išdėstymas yra patikimas.
Išdėstymas rūgštyse, kuriose yra deguonies
 Rūgštys yra sudėtingos medžiagos, jie yra susiję su tam tikra rūgštine liekana ir turi vieną ar daugiau vandenilio atomų. Čia norint apskaičiuoti laipsnį, reikalingi matematikos įgūdžiai, nes skaičiavimui reikalingi rodikliai yra skaitmeniniai. Vandeniliui ar protonui jis visada yra tas pats – +1. Neigiamas deguonies jonas turi neigiamą oksidacijos būseną -2.
Rūgštys yra sudėtingos medžiagos, jie yra susiję su tam tikra rūgštine liekana ir turi vieną ar daugiau vandenilio atomų. Čia norint apskaičiuoti laipsnį, reikalingi matematikos įgūdžiai, nes skaičiavimui reikalingi rodikliai yra skaitmeniniai. Vandeniliui ar protonui jis visada yra tas pats – +1. Neigiamas deguonies jonas turi neigiamą oksidacijos būseną -2.
Atlikę visus šiuos veiksmus, galite nustatyti centrinio formulės elemento oksidacijos būseną. Jo apskaičiavimo išraiška yra lygties formos formulė. Pavyzdžiui, sieros rūgšties lygtis bus nežinoma.
Pagrindiniai OVR terminai
ORR yra redukcijos-oksidacijos reakcijos.
- Bet kurio atomo oksidacijos būsena apibūdina šio atomo gebėjimą prijungti arba atiduoti jonų (ar atomų) elektronus kitiems atomams;
- Visuotinai pripažįstama, kad oksidatoriai yra įkrauti atomai arba neįkrauti jonai;
- Reduktorius šiuo atveju bus įkrauti jonai arba, priešingai, neįkrauti atomai, kurie cheminės sąveikos procese praranda savo elektronus;
- Oksidacija apima elektronų praradimą.
Kaip priskirti oksidacijos numerius druskose
 Druskos susideda iš vieno metalo ir vienos ar kelių rūgščių liekanų. Nustatymo procedūra yra tokia pati kaip ir rūgščių, kurių sudėtyje yra rūgščių.
Druskos susideda iš vieno metalo ir vienos ar kelių rūgščių liekanų. Nustatymo procedūra yra tokia pati kaip ir rūgščių, kurių sudėtyje yra rūgščių.
Metalas, kuris tiesiogiai sudaro druską, yra pagrindiniame pogrupyje, jo laipsnis bus lygus jo grupės skaičiui, tai yra, jis visada išliks stabilus, teigiamas rodiklis.
Kaip pavyzdį galime apsvarstyti oksidacijos būsenų išsidėstymą natrio nitrate. Druska susidaro atitinkamai naudojant pagrindinio 1 grupės pogrupio elementą, oksidacijos būsena bus teigiama ir lygi vienetui. Nitratuose deguonis turi vieną reikšmę – -2. Norint gauti skaitinę reikšmę, pirmiausia sudaroma lygtis su vienu nežinomuoju, atsižvelgiant į visus reikšmių privalumus ir trūkumus: +1+X-6=0. Išsprendę lygtį, galite prieiti prie to, kad skaitinis rodiklis yra teigiamas ir lygus + 5. Tai yra azoto rodiklis. Svarbus raktas oksidacijos būsenai apskaičiuoti yra lentelė.
Išdėstymo taisyklė baziniuose oksiduose
- Tipinių metalų oksidai bet kuriuose junginiuose turi stabilų oksidacijos indeksą, jis visada yra ne didesnis kaip +1, o kitais atvejais +2;
- Skaitmeninis metalo indikatorius apskaičiuojamas naudojant periodinę lentelę. Jei elementas yra pagrindiniame 1 grupės pogrupyje, tada jo reikšmė bus +1;
- Oksidų reikšmė, atsižvelgiant į jų indeksus, po padauginimo turi būti sumuojama ir lygi nuliui, nes juose esanti molekulė yra neutrali, dalelė be krūvio;
- 2 grupės pagrindinio pogrupio metalai taip pat turi stabilų teigiamą rodiklį, kuris yra lygus +2.
Oksidacijos laipsnis yra sutartinė vertė, naudojama redokso reakcijoms registruoti. Oksidacijos laipsniui nustatyti naudojama cheminių elementų oksidacijos lentelė.
Reikšmė
Pagrindinių cheminių elementų oksidacijos būsena yra pagrįsta jų elektronegatyvumu. Reikšmė lygi elektronų, išstumtų junginiuose, skaičiui.
Oksidacijos būsena laikoma teigiama, jei elektronai yra išstumti iš atomo, t.y. elementas duoda elektronus junginyje ir yra reduktorius. Šie elementai apima metalus, jų oksidacijos būsena visada yra teigiama.
Kai elektronas pasislenka link atomo, reikšmė laikoma neigiama, o elementas laikomas oksiduojančiu agentu. Atomas priima elektronus tol, kol baigsis išorinis energijos lygis. Dauguma nemetalų yra oksidatoriai.
Paprastos medžiagos, kurios nereaguoja, visada turi nulinę oksidacijos būseną.

Ryžiai. 1. Oksidacijos būsenų lentelė.
Junginyje nemetalinis atomas, turintis mažesnį elektronegatyvumą, turi teigiamą oksidacijos būseną.
Apibrėžimas
Naudodami periodinę lentelę galite nustatyti maksimalią ir mažiausią oksidacijos būsenas (kiek elektronų gali duoti ir priimti atomas).
Didžiausias laipsnis yra lygus grupės, kurioje yra elementas, skaičiui arba valentinių elektronų skaičiui. Mažiausia vertė nustatoma pagal formulę:
Nr (grupės) – 8.

Ryžiai. 2. Periodinė lentelė.
Anglis yra ketvirtoje grupėje, todėl jos didžiausia oksidacijos laipsnis yra +4, o žemiausia - -4. Maksimalus sieros oksidacijos laipsnis yra +6, minimalus -2. Dauguma nemetalų visada turi kintamą – teigiamą ir neigiamą – oksidacijos būseną. Išimtis yra fluoras. Jo oksidacijos laipsnis visada yra -1.
Reikia atsiminti, kad ši taisyklė netaikoma atitinkamai I ir II grupių šarminiams ir šarminių žemių metalams. Šie metalai turi pastovią teigiamą oksidacijos būseną – ličio Li +1, natrio Na +1, kalio K +1, berilio Be +2, magnio Mg +2, kalcio Ca +2, stroncio Sr +2, bario Ba +2. Gali būti kitų metalų įvairaus laipsnio oksidacija. Išimtis yra aliuminis. Nepaisant to, kad jis priklauso III grupei, jo oksidacijos laipsnis visada yra +3.

Ryžiai. 3. Šarminiai ir šarminių žemių metalai.
Iš VIII grupės tik rutenis ir osmis gali turėti aukščiausią oksidacijos laipsnį +8. I grupės aukso ir vario oksidacijos būsenos yra atitinkamai +3 ir +2.
Įrašas
Norėdami teisingai įrašyti oksidacijos būseną, turėtumėte atsiminti keletą taisyklių:
- inertinės dujos nereaguoja, todėl jų oksidacijos būsena visada lygi nuliui;
- junginiuose kintamoji oksidacijos būsena priklauso nuo kintamo valentingumo ir sąveikos su kitais elementais;
- vandenilis junginiuose su metalais turi neigiamą oksidacijos laipsnį - Ca +2 H 2 -1, Na +1 H -1;
- deguonies oksidacijos laipsnis visada yra -2, išskyrus deguonies fluoridą ir peroksidą - O +2 F 2 −1, H 2 +1 O 2 −1.
Ko mes išmokome?
Oksidacijos būsena yra sąlyginė vertė, rodanti, kiek elektronų elemento atomas junginyje priėmė arba atsisakė. Reikšmė priklauso nuo valentinių elektronų skaičiaus. Metalai junginiuose visada turi teigiamą oksidacijos būseną, t.y. yra reduktorius. Šarminių ir šarminių žemės metalų oksidacijos būsena visada yra tokia pati. Nemetalai, išskyrus fluorą, gali įgyti teigiamą ir neigiamą oksidacijos būseną.
Oksidacijos būsena. Elemento atomo oksidacijos laipsnio nustatymas pagal cheminė formulė jungtys. Junginio formulės sudarymas remiantis žinomomis elementų atomų oksidacijos būsenomis
Elemento oksidacijos būsena yra sąlyginis medžiagos atomo krūvis, apskaičiuotas darant prielaidą, kad jis susideda iš jonų. Norėdami nustatyti elementų oksidacijos būseną, turite atsiminti tam tikras taisykles:
1. Oksidacijos būsena gali būti teigiama, neigiama arba nulinė. Jis yra paskirtas Arabiškas skaitmuo su pliuso arba minuso ženklu virš elemento simbolio.
2. Nustatydami oksidacijos būsenas, vadovaujamės medžiagos elektronegatyvumu: visų junginio atomų oksidacijos būsenų suma lygi nuliui.
3. Jeigu junginį sudaro vieno elemento atomai (paprastoje medžiagoje), tai šių atomų oksidacijos laipsnis lygus nuliui.
4. Kai kurių cheminių elementų atomams paprastai priskiriamos plieno oksidacijos būsenos. Pavyzdžiui, fluoro oksidacijos laipsnis junginiuose visada yra -1; ličio, natrio, kalio, rubidžio ir cezio +1; magnio, kalcio, stroncio, bario ir cinko +2, aliuminio +3.
5. Daugumos junginių vandenilio oksidacijos laipsnis yra +1, o tik junginiuose su kai kuriais metalais lygi -1 (KH, BaH2).
6. Daugumos junginių deguonies oksidacijos laipsnis yra -2, ir tik kai kuriuose junginiuose jai priskiriama -1 (H2O2, Na2O2 arba +2 (OF2)).
7. Daugelio cheminių elementų atomai turi kintamą oksidacijos būseną.
8. Metalo atomo oksidacijos laipsnis junginiuose yra teigiamas ir skaičiais lygus jo valentiškumui.
9. Didžiausia teigiama elemento oksidacijos būsena paprastai yra lygi grupės, kurioje elementas randamas, skaičiui periodinėje lentelėje.
10. Minimali metalų oksidacijos būsena lygi nuliui. Daugeliu atvejų nemetalų neigiama oksidacijos būsena yra lygi skirtumui tarp grupės skaičiaus ir skaičiaus aštuoni.
11. Atomo oksidacijos būsena sudaro paprastą joną (susideda iš vieno atomo) ir yra lygi šio jono krūviui.
Remdamiesi aukščiau pateiktomis taisyklėmis, nustatysime cheminių elementų oksidacijos būsenas H2SO4 sudėtyje. Tai junginys, susidedantis iš trijų cheminių elementų – vandenilio H, sieros S ir deguonies O. Atkreipkite dėmesį į tų elementų, kuriems jos yra pastovios, oksidacijos būsenas. Mūsų atveju tai yra vandenilis H ir deguonis O.
Nustatykime nežinomą sieros oksidacijos laipsnį. Tegul sieros oksidacijos būsena šiame junginyje yra x.
Sukurkime lygtis, padaugindami kiekvieno elemento indeksą iš oksidacijos laipsnio ir išgautą kiekį prilygindami nuliui: 2 (+1) + x + 4 (-2) = 0
2 + X – 8 = 0
x = +8 – 2 = +6
Todėl sieros oksidacijos skaičius yra plius šeši.
Toliau pateiktame pavyzdyje išsiaiškinsime, kaip sukurti junginio su žinomomis elementų atomų oksidacijos būsenomis formulę. Sukurkime geležies (III) oksido formulę. Žodis „oksidas“ reiškia, kad geležies simbolio dešinėje turite parašyti deguonies simbolį: FeO.
Pažymėkime cheminių elementų oksidacijos būsenas virš jų simbolių. Geležies oksidacijos laipsnis nurodytas pavadinime skliausteliuose (III), todėl lygi +3, deguonies oksidacijos laipsnis oksiduose yra -2.
Raskime skaičių 3 ir 2 mažiausią bendrą kartotinį, tai yra 6. Skaičius 6 padaliname iš 3, gauname skaičių 2 – tai geležies indeksas. Padalinkite skaičių 6 iš 2, gausime skaičių 3 - tai yra deguonies indeksas.
Toliau pateiktame pavyzdyje išsiaiškinsime, kaip sukurti junginio formulę su žinomomis elementų atomų ir jonų krūvių oksidacijos būsenomis. Sukurkime kalcio ortofosfato formulę. Žodis „ortofosfatas“ reiškia, kad dešinėje nuo kalcio simbolio turite parašyti rūgštinę ortofosfato rūgšties likutį: CaPO4.
Atkreipkite dėmesį į kalcio oksidacijos būseną (keturi taisyklė) ir rūgšties liekanos krūvį (pagal tirpumo lentelę).
Raskime mažiausią bendrą skaičių 2 ir 3 kartotinį, tai yra 6. Padalinkite skaičių 6 iš 2, gausime skaičių 3 – tai yra kalcio indeksas. Padalinkite skaičių 6 iš 3, gausime skaičių 2 - tai yra rūgšties likučio indeksas.
Elementų būklei junginiuose apibūdinti buvo įvesta oksidacijos būsenos sąvoka.
APIBRĖŽIMAS
Elektronų, išstumtų iš tam tikro elemento atomo arba į tam tikro elemento atomą junginyje, skaičius vadinamas oksidacijos būsena.
Teigiama oksidacijos būsena rodo elektronų, išstumtų iš tam tikro atomo, skaičių, o neigiama oksidacijos būsena rodo elektronų, pasislinkusių link tam tikro atomo, skaičių.
Iš šio apibrėžimo matyti, kad junginiuose su nepolinėmis jungtimis elementų oksidacijos būsena yra lygi nuliui. Tokių junginių pavyzdžiai yra molekulės, susidedančios iš identiškų atomų (N 2, H 2, Cl 2).
Metalų oksidacijos būsena elementinėje būsenoje yra lygi nuliui, nes elektronų tankio pasiskirstymas juose yra vienodas.
Paprastuose joniniuose junginiuose juos sudarančių elementų oksidacijos būsena yra lygi elektros krūviui, nes formuojantis šiems junginiams praktiškai visiškas perėjimas elektronai iš vieno atomo į kitą: Na +1 I -1, Mg +2 Cl -1 2, Al +3 F -1 3, Zr +4 Br -1 4.
Nustatant elementų oksidacijos laipsnį junginiuose su poliniais kovalentiniais ryšiais, lyginamos jų elektronegatyvumo reikšmės. Kadangi susidarant cheminiam ryšiui elektronai pasislenka į daugiau elektronneigiamų elementų atomus, pastarieji junginiuose turi neigiamą oksidacijos būseną.
Aukščiausia oksidacijos būsena
Elementams, esantiems jų junginiuose įvairių laipsnių Oksidacija, egzistuoja aukštesnės (maksimaliai teigiamos) ir žemesnės (minimalios neigiamos) oksidacijos būsenos sąvokos. Didžiausia cheminio elemento oksidacijos laipsnis paprastai sutampa su grupės numeriu in Periodinė elementų lentelė D. I. Mendelejevas. Išimtys yra fluoras (oksidacijos laipsnis yra -1, o elementas yra VIIA grupėje), deguonis (oksidacijos laipsnis yra +2, o elementas yra VIA grupėje), helis, neonas, argonas (oksidacijos laipsnis yra 0 ir elementai yra VIII grupėje), taip pat kobalto ir nikelio pogrupio elementai (oksidacijos laipsnis yra +2, o elementai yra VIII grupėje), kurių didžiausia oksidacijos laipsnis išreiškiamas skaičiumi, kurio reikšmė yra mažesnis nei grupės, kuriai jie priklauso, skaičius. Priešingai, vario pogrupio elementų oksidacijos laipsnis yra didesnis nei vienas, nors jie priklauso I grupei (maksimali teigiama vario ir sidabro oksidacijos būsena yra +2, aukso +3).
Problemų sprendimo pavyzdžiai
1 PAVYZDYS
- Vandenilio sulfide sieros oksidacijos būsena yra (-2), o in paprastas dalykas– pilka – 0:
Sieros oksidacijos laipsnio pokytis: -2 → 0, t.y. šeštas atsakymas.
- Paprastoje medžiagoje - sieroje - sieros oksidacijos laipsnis yra 0, o SO 3 - (+6):
Sieros oksidacijos laipsnio pokytis: 0 → +6, t.y. ketvirtas atsakymo variantas.
- Sieros rūgštyje sieros oksidacijos laipsnis yra (+4), o paprastoje medžiagoje - sieros - 0:
1×2 +x+ 3×(-2) =0;
Sieros oksidacijos laipsnio pokytis: +4 → 0, t.y. trečias atsakymo variantas.
2 PAVYZDYS
| Pratimas | Azoto valentingumas III ir oksidacijos laipsnis (-3) junginyje: a) N 2 H 4; b) NH3; c) NH4Cl; d) N 2 O 5 |
| Sprendimas | Siekdami pateikti teisingą atsakymą į pateiktą klausimą, pakaitomis nustatysime siūlomų junginių azoto valentingumą ir oksidacijos laipsnį. a) vandenilio valentingumas visada lygus I. Iš viso vandenilio valentingumo vienetai lygus 4 (1×4 = 4). Gautą reikšmę padalinkime iš azoto atomų skaičiaus molekulėje: 4/2 = 2, todėl azoto valentingumas yra II. Šis atsakymo variantas neteisingas. b) vandenilio valentingumas visada lygus I. Bendras vandenilio valentingumo vienetų skaičius lygus 3 (1 × 3 = 3). Gautą reikšmę padalinkime iš azoto atomų skaičiaus molekulėje: 3/1 = 2, todėl azoto valentingumas yra III. Azoto oksidacijos laipsnis amoniake yra (-3): Tai teisingas atsakymas. |
| Atsakymas | b variantas |