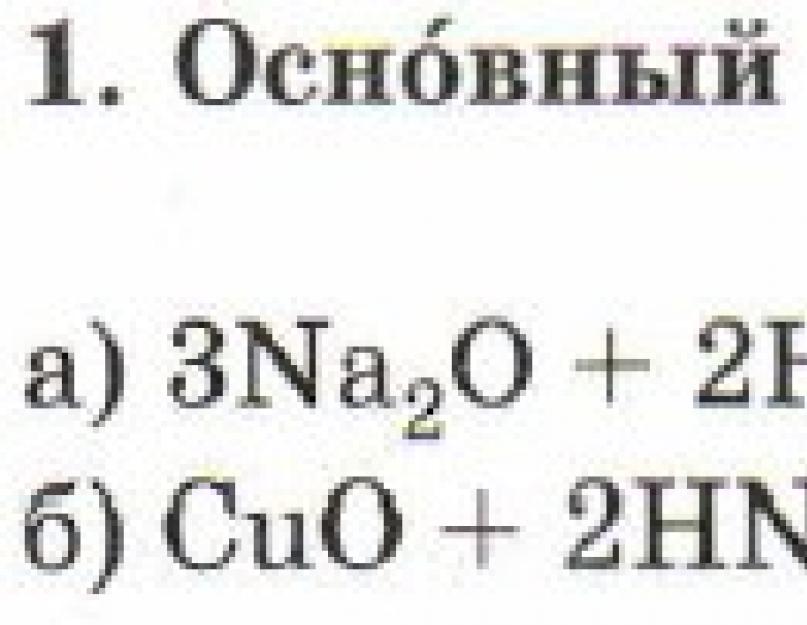Oksidas- dvejetainis cheminio elemento junginys su deguonimi –2 oksidacijos būsenoje, kuriame pats deguonis yra prijungtas tik prie mažiau elektroneigiamo elemento
Oksidų nomenklatūra
Oksidų pavadinimai konstruojami taip: pirmiausia ištariamas žodis „oksidas“, o paskui vadinamas jį sudarantis elementas. Jei elementas turi kintamąjį valentingumą, tada pavadinimo pabaigoje jis nurodomas romėnišku skaitmeniu skliausteliuose:
Na I 2 O - natrio oksidas; Ca II O - kalcio oksidas;
S IV O 2 - sieros oksidas (IV); S VI O 3 - sieros oksidas (VI).
Oksidų klasifikacija
Pagal savo chemines savybes oksidai skirstomi į dvi grupes:
1. Nesudarantis druskos (abejingas)– nesudaro druskų, pvz.: NO, CO, H2O;
2.Druskos formavimas, kurios savo ruožtu skirstomos į:
– pagrindinis
- tai tipinių metalų oksidai, kurių oksidacijos laipsnis yra +1, +2 (pagrindinių pogrupių I ir II grupės, išskyrus berilį) ir minimalios oksidacijos būsenos metalų oksidai, jei metalas turi kintamą oksidacijos laipsnį (CrO, MnO);
– rūgštus
- tai tipiškų nemetalų (CO 2, SO 3, N 2 O 5) oksidai ir metalai, kurių maksimali oksidacijos būsena yra lygi grupės skaičiui D.I.Mendelejevo PSE (CrO 3, Mn 2 O 7);
– amfoteriniai oksidai
(turintys ir bazines, ir rūgštines savybes, priklausomai nuo reakcijos sąlygų) yra metalų oksidai BeO, Al 2 O 3, ZnO ir antrinių pogrupių metalai, esantys tarpinėje oksidacijos būsenoje (Cr 2 O 3, MnO 2).
Pagrindiniai oksidai
Pagrindinis paskambino oksidai, kurios sąveikaudamos su rūgštimis arba rūgščių oksidais sudaro druskas.Baziniai oksidai atitinka bazes.
Pavyzdžiui , kalcio oksidas CaO atitinka kalcio hidroksidą Ca (OH) 2, kadmio oksidą CdO – kadmio hidroksidą Cd (OH) 2.
Bazinių oksidų cheminės savybės
1. Baziniai oksidai sąveikauja su vandeniu, sudarydami bazes.
Reakcijos sąlyga: Turi susidaryti tirpios bazės!
Na 2 O + H 2 O → 2NaOH
CaO + H 2 O → Ca (OH) 2
Al 2 O 3 + H 2 O → reakcija nevyksta, nes turi susidaryti Al(OH) 3, kuris yra netirpus.
2. Sąveika su rūgštimis, kad susidarytų druska ir vanduo:
CaO + H 2 SO 4 → CaSO 4 + H 2 O.
3. Sąveika su rūgščių oksidais, kad susidarytų druska:
CaO + SiO 2 → CaSiO 3
4. Sąveika su amfoteriniais oksidais:
СaO + Al 2 O 3 → Сa (AlO 2) 2
Rūgščių oksidai
Rūgšti paskambino oksidai, kurios sąveikaudamos su bazėmis arba baziniais oksidais sudaro druskas.Jie atitinka rūgštis.
Pavyzdžiui
, sieros oksidas (IV) atitinka sieros rūgštį H2SO3.
Rūgščių oksidų cheminės savybės
1. Sąveika su vandeniu, kad susidarytų rūgštis:Reakcijos sąlygos: turi susidaryti tirpi rūgštis.
P 2 O 5 + 3H 2 O → 2H 3 PO 4
2. Sąveika su šarmais, kad susidarytų druska ir vanduo:
Reakcijos sąlygos: tai šarmas, kuris sąveikauja su rūgšties oksidu, tai yra, tirpia baze.
SO 3 + 2NaOH → Na 2 SO 4 + H 2 O
3. Sąveika su baziniais oksidais, kad susidarytų druskos:
SO 3 + Na 2 O → Na 2 SO 4
Amfoteriniai oksidai
Oksidai, kurių hidratiniai junginiai pasižymi ir rūgščių, ir bazių savybėmis, vadinami amfoterinis.Pavyzdžiui: aliuminio oksidas Al2O3,mangano (IV) oksidas MnO2.
„Oksidų“ sąvoka apima begalę įvairių medžiagų: skystų, tokių kaip vandenilio oksidas, arba vandenį; kietas, pavyzdžiui, silicio oksidas (IV) – smėlis ir daugybė kvarco rūšių, įskaitant chalcedoną ir ametistą, kalnų krištolą ir morioną; dujiniai, pavyzdžiui, anglies oksidai (IV) ir (II) - anglies dioksidas ir anglies monoksidas.
Pagal savo chemines savybes visi oksidai skirstomi į druskas formuojančius ir nesudarančius.
Yra nedaug druskos nesudarančių oksidų. Jie apima nemetalinius elementus, pavyzdžiui: azoto oksidus (I) ir (II) - N 2 O ir NO, anglies monoksidą (II) - CO ir kai kuriuos kitus.
Druską sudarantys oksidai skirstomi į bazinius, rūgštinius ir amfoterinius oksidus. Su pastarąja susipažinsite 9 klasėje.
| Baziniai oksidai yra tie oksidai, kurie atitinka bazes. |
Pavyzdžiui,
Pagrindiniai oksidai yra metalų oksidai, turintys žemą oksidacijos laipsnį (+1 ir +2), t. y. D. I. Mendelejevo periodinės lentelės IA ir IIA grupių metalų oksidai, HgO, MnO ir kai kurie kiti. Visi baziniai oksidai yra kietos medžiagos.
Tipinės bazinių oksidų reakcijos

Laboratorinis eksperimentas Nr.27
Bazinių oksidų sąveika su rūgštimis
Į mėgintuvėlį įberkite šiek tiek (maždaug degtuko galvutės dydžio) vario oksido (II) miltelių. Atkreipkite dėmesį į jo spalvą.
Į mėgintuvėlį su vario (II) oksidu supilkite 1-2 ml sieros rūgšties tirpalo. Norėdami pagreitinti reakciją, šiek tiek pašildykite mėgintuvėlio turinį. Ką tu žiūri?
1-2 lašus gauto tirpalo stikline lazdele ar pipete užlašinkite ant stiklinės ar porcelianinės lėkštės ir išgarinkite. Kas susidaro ant stiklo plokštės?
Parašykite vario(II) oksido ir sieros rūgšties reakcijų molekulines ir jonines lygtis.


Ryžiai. 144.
Bazinio oksido sąveika su vandeniu
Ši reakcija vyksta tik tada, kai susidaro tirpi bazė - šarmas, todėl CuO + H 2 O ≠, nes Cu (OH) 2 yra netirpus.

Ryžiai. 145.
Rūgšties oksido reakcija su vandeniu Laboratorinis eksperimentas Nr.28
Bazinių oksidų sąveika su vandeniu
Į du mėgintuvėlius įpilkite 2-3 ml distiliuoto vandens. Į kiekvieną mėgintuvėlį įlašinkite 2–3 lašus fenolftaleino tirpalo.
Į pirmąjį mėgintuvėlį įpilkite šiek tiek (ne daugiau kaip pusę degtuko galvutės) kalcio oksido, o į antrąjį – vario oksido (II).
Sumaišykite mėgintuvėlių turinį. Ką tu žiūri?
Sudarykite vykdomų reakcijų molekulines ir jonines lygtis.
Suformuluokite išvadą apie bazinių oksidų sąveiką su vandeniu.
Rūgščių oksidai apima nemetalų oksidus:

taip pat metalų oksidai, turintys didelę oksidacijos laipsnį, pavyzdžiui:

Laboratorinis eksperimentas Nr.29
Rūgščių oksidų sąveika su šarmais
Į mėgintuvėlį supilkite 2 ml kalkių vandens. Apibūdinkite sprendimą.
Naudodami mėgintuvėlį su smulkiai nupieštu galu, išpūskite iškvėptą orą per kalkių vandenį mėgintuvėlyje. Ką tu žiūri?
Parašykite molekulines ir jonines reakcijos lygtis.
Kokia yra šarmo reakcijos su rūgšties oksidu esmė?

Tačiau ši reakcija įmanoma tik tuo atveju, jei rūgšties oksidas tirpsta vandenyje. Ir jei vartojate silicio oksidą (IV), reakcija praktiškai nevyks:
Laboratorinis eksperimentas Nr.30
Rūgščių oksidų sąveika su vandeniu
Į 1-ąjį mėgintuvėlį supilkite 2-3 ml distiliuoto vandens, o į antrąjį - gazuotą vandenį (anglies monoksido (IV) tirpalas vandenyje).
Į 1-ąjį mėgintuvėlį įdėkite nedidelį kiekį (ant mentelės galo) silicio oksido (IV). Į kiekvieną mėgintuvėlį įlašinkite 2–3 lašus lakmuso tirpalo. Sumaišykite mėgintuvėlių turinį. Ką tu žiūri?
Parašykite vykdomų reakcijų molekulines lygtis.
Suformuluokite išvadą apie rūgščių oksidų sąveiką su vandeniu.
Raktažodžiai ir frazės
- Oksidai yra nesudarantys druskos ir druskos.
- Oksidai yra baziniai ir rūgštūs.
- Tipinės bazinių oksidų savybės: jų sąveika su rūgštimis, rūgštiniais oksidais ir vandeniu.
- Tipinės rūgščių oksidų savybės: jų sąveika su bazėmis, baziniais oksidais ir vandeniu.
- Rūgščių ir bazinių oksidų reakcijos su vandeniu sąlygos.
Darbas kompiuteriu
- Žiūrėkite elektroninę paraišką. Išstudijuokite pamokos medžiagą ir atlikite siūlomas užduotis.
- Internete ieškokite el. pašto adresų, kurie gali būti papildomi šaltiniai, atskleidžiantys pastraipos raktinių žodžių ir frazių turinį. Pasiūlykite mokytojui savo pagalbą ruošiant naują pamoką – parašykite kitos pastraipos raktinius žodžius ir frazes.
Klausimai ir užduotys
Bazių skirstymas į grupes pagal įvairius kriterijus pateiktas 11 lentelėje.
11 lentelė
Bazinė klasifikacija
Visos bazės, išskyrus amoniako tirpalą vandenyje, yra skirtingų spalvų kietos medžiagos. Pavyzdžiui, kalcio hidroksidas Ca (OH) 2 yra baltas, vario (II) hidroksidas Cu (OH) 2 yra mėlynas, nikelio (II) hidroksidas Ni (OH) 2 yra žalias, geležies (III) hidroksidas Fe (OH) 3 yra raudona-ruda ir kt.
Vandeniniame amoniako NH 3 H 2 O tirpale, skirtingai nei kitose bazėse, yra ne metalo katijonų, o kompleksinio viengubo krūvio amonio katijono NH - 4 ir jis egzistuoja tik tirpale (šis tirpalas jums žinomas kaip amoniakas). Jis lengvai skyla į amoniaką ir vandenį:
Tačiau kad ir kokios skirtingos būtų bazės, jos visos susideda iš metalo jonų ir hidrokso grupių, kurių skaičius lygus metalo oksidacijos laipsniui.
Visos bazės, o pirmiausia šarmai (stiprūs elektrolitai), disociacijos metu sudaro OH hidroksido jonus, kurie lemia daugybę bendrų savybių: muilumą liesti, indikatorių (lakmuso, metilo apelsino ir fenolftaleino) spalvos pasikeitimą, sąveiką su kitomis medžiagomis.
Tipiškos bazinės reakcijos

Pirmoji reakcija (universali) buvo svarstoma § 38.
Laboratorinis eksperimentas Nr.23
Šarmų sąveika su rūgštimis
- Užrašykite dvi molekulinių reakcijų lygtis, kurių esmė išreiškiama šia jonine lygtimi:
H + + OH - \u003d H 2 O.
Atlikite reakcijas, kurių lygtis sudarėte. Prisiminkite, kokių medžiagų (išskyrus rūgštis ir šarmus) reikia šioms cheminėms reakcijoms stebėti.
Antroji reakcija vyksta tarp šarmų ir nemetalų oksidų, kurie atitinka rūgštis, pvz.
Atitinka
![]()
![]() ir tt
ir tt
Kai oksidai sąveikauja su bazėmis, susidaro atitinkamų rūgščių druskos ir vanduo:


Ryžiai. 141.
Šarmų sąveika su nemetalų oksidu
Laboratorinis eksperimentas Nr.24
Šarminių medžiagų sąveika su nemetalų oksidais
Pakartokite anksčiau atliktą eksperimentą. Į mėgintuvėlį supilkite 2-3 ml skaidraus kalkių vandens tirpalo.
Įdėkite sulčių šiaudelį, kuris veikia kaip dujų išleidimo vamzdis. Švelniai praleiskite iškvėptą orą per tirpalą. Ką tu žiūri?
Užrašykite reakcijos molekulines ir jonines lygtis.

Ryžiai. 142.
Šarmų sąveika su druskomis:
a - susidarius nuosėdoms; b - su dujų susidarymu
Trečioji reakcija yra tipinė jonų mainų reakcija ir vyksta tik tada, kai susidaro nuosėdos arba išsiskiria dujos, pavyzdžiui:

Laboratorinis eksperimentas Nr.25
Šarmų sąveika su druskomis
- Į tris mėgintuvėlius poromis supilkite 1-2 ml medžiagų tirpalų: 1 mėgintuvėlis - natrio hidroksidas ir amonio chloridas; 2 vamzdelis - kalio hidroksidas ir geležies sulfatas (III); 3 vamzdelis - natrio hidroksidas ir bario chloridas.
Įkaitinkite 1-ojo mėgintuvėlio turinį ir pagal kvapą atpažinkite vieną iš reakcijos produktų.
Suformuluokite išvadą apie šarmų sąveikos su druskomis galimybę.
Netirpios bazės kaitinamos skyla į metalo oksidą ir vandenį, o tai nebūdinga šarmams, pavyzdžiui:
Fe (OH) 2 \u003d FeO + H 2 O.
Laboratorinis eksperimentas Nr.26
Netirpių bazių paruošimas ir savybės
Į du mėgintuvėlius įpilkite 1 ml vario (II) sulfato arba chlorido tirpalo. Į kiekvieną mėgintuvėlį įlašinkite 3-4 lašus natrio hidroksido tirpalo. Apibūdinkite gautą vario(II) hidroksidą.
Pastaba. Palikite mėgintuvėlius su gautu vario (II) hidroksidu tolesniems eksperimentams.
Parašykite reakcijos molekulines ir jonines lygtis. Nurodykite reakcijos tipą pagal pradinių medžiagų ir reakcijos produktų skaičių ir sudėtį.
Į vieną iš mėgintuvėlių su vario (II) hidroksidu, gautu ankstesniame eksperimente, įpilkite 1-2 ml druskos rūgšties. Ką tu žiūri?
Pipete 1-2 lašus gauto tirpalo užlašinkite ant stiklinės ar porcelianinės lėkštelės ir tiglio žnyplėmis atsargiai išgarinkite. Ištirkite besiformuojančius kristalus. Atkreipkite dėmesį į jų spalvą.
Parašykite reakcijos molekulines ir jonines lygtis. Nurodykite reakcijos tipą pagal "pradinių medžiagų ir reakcijos produktų skaičių ir sudėtį", "katalizatoriaus dalyvavimą" ir "cheminės reakcijos grįžtamumą".
Vieną iš mėgintuvėlių pašildykite anksčiau gautu arba mokytojo duotu vario hidroksidu () (143 pav.). Ką tu žiūri?

Ryžiai. 143.
Vario (II) hidroksido skilimas kaitinant
Sudarykite reakcijos lygtį, nurodykite jos atsiradimo sąlygą ir reakcijos tipą pagal ženklus "pradinių medžiagų ir reakcijos produktų skaičius ir sudėtis", "šilumos išsiskyrimas arba sugertis" ir "cheminės reakcijos grįžtamumas". “.
Raktažodžiai ir frazės
- Bazinė klasifikacija.
- Tipinės bazių savybės: jų sąveika su rūgštimis, nemetalų oksidais, druskomis.
- Tipinė netirpių bazių savybė: skilimas kaitinant.
- Tipiškų bazinių reakcijų sąlygos.
Darbas kompiuteriu
- Žiūrėkite elektroninę paraišką. Išstudijuokite pamokos medžiagą ir atlikite siūlomas užduotis.
- Internete ieškokite el. pašto adresų, kurie gali būti papildomi šaltiniai, atskleidžiantys pastraipos raktinių žodžių ir frazių turinį. Pasiūlykite mokytojui savo pagalbą ruošiant naują pamoką – parašykite kitos pastraipos raktinius žodžius ir frazes.
Klausimai ir užduotys

1 bilietas.
1. Pagrindinės cheminės sąvokos (bet kurios cheminės formulės pavyzdžiu).
1. Sudėtinga medžiaga – susideda iš skirtingų cheminių elementų.
2. 5 (koeficientų) kompleksinės medžiagos molekulės.
3. Kokybinė sudėtinės medžiagos sudėtis – susideda iš vandenilio ir deguonies.
4. Kiekybinė 1 molekulės sudėtis: 2 H atomai ir vienas O atomas; 5 molekulės: 10 H atomų ir 5 O atomų.
5. Molinė masė M (H 2 O) \u003d 1 * 2 + 16 \u003d 18 g / mol
6. 5 molekulių masė m (H 2 O) \u003d 5 * 18 \u003d 90 g
7. Vandenilio masės dalis molekulėje: w = = = 0,3333 (33,33%)
2.
Deguonies pogrupio elementai - deguonis O, siera S, selenas Se, telūras Te, polonis Ro– turi bendrinį pavadinimą „chalkogenai“, reiškiantį „rūdų gimdymą“.
Atomų sandara ir savybės.
Sieros atomai, kaip ir deguonies atomai ir visi kiti D. I. Mendelejevo periodinės lentelės VI grupės pagrindinio pogrupio elementai, turi 6 elektronus išoriniame energijos lygyje, iš kurių 2 elektronai yra nesuporuoti.
Paprastos medžiagos.Deguonies alotropija – tai paprastos medžiagos deguonis O 2 ir ozonas O 3.
Sierai, kaip ir deguoniui, būdinga alotropija. Tai rombinė ir plastikinė siera.
Cheminės savybės.Siera gali būti ir oksidatorius, ir reduktorius.
1. Kalbant apie redukuojančius agentus - vandenilis, metalai, siera pasižymi oksidacinėmis savybėmis ir įgyja -2 oksidacijos laipsnį. Normaliomis sąlygomis siera reaguoja su visais šarminiais ir šarminių žemių metalais, variu, gyvsidabriu, sidabru, pavyzdžiui:
H 2 + S = H 2 S.
2. Tačiau, palyginti su deguonimi ir fluoru, siera yra reduktorius, sudarydamas junginius, kurių oksidacijos laipsnis yra +4, +6.
Siera dega melsva liepsna, sudarydama sieros oksidą (IV):
S + O 2 \u003d SO 2.
Šis junginys paprastai žinomas kaip sieros dioksidas.
3.
Ca + N 2 ®Ca 3 N 2
Cu + H 2 SO 4 (konc) ® CuSO 4 + SO 2 + H 2 O
2 bilietas.
1. D.I. atradimas. Mendelejevo periodinis dėsnis. Periodinė cheminių elementų sistema.
D. I. Mendelejevas visus cheminius elementus, žinomus iki periodinio dėsnio atradimo, išrikiavo iš eilės pagal jų atominės masės padidėjimą ir pažymėjo jame segmentus – periodus. , kurioje panašiai pasikeitė elementų ir jų suformuotų medžiagų savybės, būtent (šiuolaikiškai kalbant):
1) susilpnėjusios metalinės savybės;
2) buvo sustiprintos nemetalinės savybės;
3) elemento oksidacijos laipsnis aukštesniuose oksiduose padidėjo nuo +1 iki +7;
4) oksidai nuo bazinių iki amfoterinių buvo pakeisti rūgštiniais;
5) hidroksidai iš šarmų per amfoterinius hidroksidus buvo pakeisti vis stipresnėmis rūgštimis.
Remdamasis šiais pastebėjimais, D. I. Mendelejevas 1869 m. padarė išvadą – suformulavo periodinį įstatymą:
cheminių elementų savybės ir jų susidarymas medžiagos yra periodiškai priklausomai nuo jų atominio svorio.Šiuolaikine formuluote elementų atominės masės pakeistas branduolinis užtaisas.
2. Anglies pogrupis: anglies atomų struktūra ir savybės, paprastos medžiagos, kurias sudaro anglis, anglies cheminės savybės.
Anglies pogrupis (4 A grupė) – anglis, silicis, germanis, alavas, švinas.
Anglis C yra pirmasis D. I. Mendelejevo periodinės lentelės IV grupės pagrindinio pogrupio elementas. Jo atomuose išoriniame energijos lygyje yra 4 elektronai, todėl jie gali priimti keturis elektronus, įgydami -4 oksidacijos būseną, t. y. pasižymi oksidacinėmis savybėmis ir atiduoda savo elektronus daugiau elektronneigiamiems elementams, t. y. pasižymi redukuojančiomis savybėmis, įgydami šiuo oksidacijos laipsnis yra +4.
Anglis yra paprasta medžiaga. Anglis sudaro alotropines modifikacijas - deimantas ir grafitas. Struktūra panaši į grafitą suodžiai ir anglis. Akmens anglys dėl savo porėto paviršiaus turi savybę sugerti dujas ir ištirpusias medžiagas. Ši kai kurių medžiagų savybė vadinama adsorbcija.
Cheminės anglies savybės.
Deimantas ir grafitas susijungia su deguonimi esant labai aukštai temperatūrai. Suodžiai ir anglys daug lengviau sąveikauja su deguonimi, jame degdami. Bet bet kuriuo atveju tokios sąveikos rezultatas yra tas pats - susidaro anglies dioksidas:
C + O 2 \u003d CO 2
Kaitinant su metalais, anglis sudaro karbidus, pavyzdžiui:
4Al + 3C \u003d Al 4 C 3
3. Norėdami įrodyti, kad natrio karbonate yra karbonato jonų, naudokite būdingą reakciją.
CO 3 2- + H + (bet kuri rūgštis) ® CO 2 + H 2 O
Išsiskiria sunkios bespalvės dujos, kurios užgesina degantį degtuką.
3 bilietas.
1. Atomo sandaros teorija: planetinis atomo sandaros modelis, elektronų pasiskirstymas pagal energijos lygius pagrindinių ir antrinių pogrupių elemento pavyzdžiu.
Planetinis atomo modelis (Rutherfordo modelis)
 |
Branduolys: protonai (p +) ir neutronai (n 0).
Atomo elektroninio apvalkalo samprata (elektroniniai sluoksniai, energijos lygiai)
Elektronų apvalkale išskiriami sluoksniai, ant kurių išsidės skirtingos energijos atsargos elektronai, todėl jie dar vadinami energijos lygiai.
Šių lygių skaičius cheminio elemento atome = atitinkamas periodo skaičius D. I. Mendelejevo lentelėje:

Al atomas, 3-iojo periodo elementas, turi tris lygius. Kiekvienas lygis gali talpinti tam tikrą maksimalų elektronų skaičių: 1. 2e - , 2-asis - 8e - , ir nors maksimalus elektronų skaičius, galintis tilpti į 3 lygmenį, yra 18, šio laikotarpio elementų atomai jame, kaip ir 2-ojo periodo elementų atomai, gali būti tik 8e - .
Energijos lygiai, kuriuose yra didžiausias elektronų skaičius, vadinami baigtas. Jei juose yra mažiau elektronų, tada šie lygiai yra neišsamūs.
Šoninių pogrupių elementai išoriniame lygyje visada turi 2 elektronus (išskyrus Cr ir Cu, jie turi 1 elektroną). Galiausiai užpildomas išankstinis išorinis lygis:

2. Halogenų pogrupis: atomų struktūra ir savybės.
D. I. Mendelejevo periodinės sistemos VII grupės pagrindinio pogrupio elementai, sujungti bendru pavadinimu halogenai, fluoras F, chloras Cl, bromas Br, jodas I, astatinas At (gamtoje randamas retai) yra tipiški nemetalai. Tai suprantama, nes jų atomai turi septynis elektronus išoriniame energijos lygyje, o jam užbaigti trūksta tik vieno elektrono. Halogeno atomai, sąveikaudami su metalais, priima elektroną iš metalo atomų. Taip susidaro druskos. Taigi bendras pogrupio „halogenai“ pavadinimas, t.y. „gimdantis druskas“.
Halogenai yra labai stiprūs oksidatoriai. Fluoras cheminėse reakcijose pasižymi tik oksidacinėmis savybėmis, o junginiuose jam būdinga tik oksidacijos būsena -1. Likę halogenai taip pat gali pasižymėti redukuojančiomis savybėmis, kai sąveikauja su elektronegatyvesniais elementais – fluoru, deguonimi, azotu. Tuo pačiu metu jų oksidacijos būsenos gali būti +1, +3, +5,
7. Halogenų redukuojančios savybės didėja nuo chloro iki jodo, o tai siejama su jų atomų spindulių padidėjimu: chloro atomai yra maždaug pusantro karto mažesni nei jodo.
Halogenai yra paprastos medžiagos.Visi halogenai egzistuoja laisvoje būsenoje dviatomių molekulių pavidalu F 2, Cl 2, Br 2, I 2. Fluoras ir chloras yra dujos, bromas – skystis, jodas – kieta medžiaga. Nuo F 2 iki I 2 halogenų spalvos intensyvumas didėja. Jodo kristalai turi metalinį blizgesį.
3. Norėdami įrodyti, kad natrio sulfate yra sulfato jonų, naudokite būdingą reakciją.
SO 4 2- + Ba 2+ (tirpi bario druska) ® BaSO 4 ¯
Baltos smulkios kristalinės nuosėdos
4 bilietas.
1. Oksidacijos būsenų nustatymo taisyklės.
Elementai, kurių oksidacijos būsena yra pastovi:
1. I grupė A: Li + , Na + , K + , Rb + , Cs + .
2. II grupė A: Be +2, Mg +2, Ca +2, Zn +2, Sr +2, Cd +2, Ba +2.
3. III A grupė: Al +3
6. H +1 (MeH -1)
7. Paprastoms medžiagoms s.d. = 0.
Dėl likusių elementų d.d. apsvarstyti
H2 +1 S X O 4 - 2 : taigi siera neturi pastovaus d.d., todėl imame kaip X.
+1 *2 + X + (-2 ) * 4 = 0
Aukštasis S.O. = grupės numeris (išskyrus O, F)
Mažiausias s.d. = grupės numeris - 8 (Aš neturiu mažesnės s.d.)
2. Cheminės halogenų savybės – paprastos medžiagos.
Halogenų, kaip nemetalų, cheminis aktyvumas susilpnėja nuo fluoro iki jodo.
Kiekvienas halogenas yra stipriausias oksidatorius savo laikotarpiu. Halogenų oksidacinės savybės aiškiai matomos jiems sąveikaujant su metalais. Taip susidaro druskos. Taigi fluoras jau normaliomis sąlygomis reaguoja su dauguma metalų, o kaitinamas – su auksu, sidabru, platina, garsėjančia cheminiu pasyvumu. Aliuminis ir cinkas užsidega fluoro atmosferoje:
0 0 +2 -1
Zn + F 2 = ZnF 2 .
Likę halogenai reaguoja su metalais daugiausia kaitinant.
Apie halogenų oksidacinių savybių sumažėjimą ir redukuojamųjų savybių padidėjimą nuo fluoro iki jodo taip pat galima spręsti pagal jų gebėjimą išstumti vienas kitą iš druskų tirpalų.
Taigi, chloras išstumia bromą ir jodą iš jų druskų tirpalų, pavyzdžiui:
Cl 2 + 2NaBr \u003d 2NaCl + Br 2.
3. Sudarykite molekulines ir jonines medžiagų reakcijų lygtis: švino (II) nitrato ir kalio sulfato, geležies (III) chlorido ir sidabro nitrato.
5 bilietas.
1. Cheminių reakcijų klasifikacija pagal pradinių medžiagų ir reakcijos produktų skaičių.
2. Hidrohalogenidai ir hidrohalogeninės rūgštys bei jų druskos.
H 2 + G 2 \u003d 2NG
(G – įprastas cheminis halogenų žymėjimas).
Visi vandenilio halogenidai (jų bendroji formulė gali būti parašyti kaip NG) yra bespalvės, aštraus kvapo ir toksiškos dujos. Jie labai gerai tirpsta vandenyje ir rūko drėgname ore, nes pritraukia ore esančius vandens garus, sudarydami rūko debesį.
Vandenilio halogenidų tirpalai vandenyje yra rūgštys, tai yra HF - vandenilio fluoridas arba vandenilio fluoridas, rūgštis, HC1 - vandenilio chloridas arba druskos rūgštis, HBr - vandenilio bromido rūgštis, HI - vandenilio jodo rūgštis. Stipriausia iš vandenilio halogeninių rūgščių yra vandenilio jodo, o silpniausia – vandenilio fluorido.
Vandenilio halogeninių rūgščių druskos Halogeninės rūgštys sudaro druskas: fluoridus, chloridus, bromidus ir jodidus. Daugelio metalų chloridai, bromidai ir jodidai gerai tirpsta vandenyje.
Chlorido, bromido ir jodido jonams tirpale nustatyti ir juos atskirti naudojama reakcija su sidabro nitratu.
3. Apskaičiuokite deguonies masės dalį natrio sulfate.
| Duota: Na2SO4 | Sprendimas: W O = = |
| WO - ? % |
Atsakymas: deguonies masės dalis yra 45,1%.
6 bilietas.
1. Elektrolitai ir neelektrolitai.
Pagal elektros srovės laidumą visos medžiagos skirstomos į elektrolitus ir neelektrolitus.
Elektrolitai yra medžiagos, kurių tirpalai praleidžia elektrą. Tai rūgštys, bazės, druskos. Šios medžiagos praleidžia srovę, nes. gali disocijuoti į katijoną ir anijoną:
Rūgštys: HAn H + + An -
Bazės: MON M + + OH -
Druskos: MAn → M + + An -
Indeksas po paprasto jono arba skliausteliuose tampa koeficientu
Ca 3 (PO 4) 2 → 3Ca 2+ + 2 (PO 4) 3-
Neelektrolitams priskiriamos visos likusios – paprastos medžiagos, oksidai, beveik visos organinės medžiagos.
2.
Fizines metalų savybes lemia jų struktūra: laisvųjų elektronų buvimas kristalinėje gardelėje. Dėl laisvųjų elektronų visi metalai turi elektros laidumą, šilumos laidumą ir metalinį blizgesį.
elektro- ir šilumos laidumas. Atsitiktinai metale judantys elektronai veikiami elektros įtampos įgyja kryptingą judėjimą, dėl kurio atsiranda elektros srovė. Sidabras, varis, taip pat auksas, aliuminis ir geležis turi didžiausią elektros laidumą; mažiausias – manganas, švinas, gyvsidabris.
Dažniausiai ta pačia seka kaip ir elektros laidumas keičiasi ir metalų šilumos laidumas. Taip yra dėl didelio laisvųjų elektronų mobilumo, kurie, susidūrę su virpančiais jonais ir atomais, keičiasi su jais energija. Todėl visame metalo gabale greitai išlyginama temperatūra.
Metalinis blizgesys. Elektronai, užpildantys tarpatominę erdvę, atspindi šviesos spindulius ir nepraleidžia, kaip stiklas, todėl visi kristalinės būsenos metalai turi metalinį blizgesį.
Kitos savybės – kietumas, tankis, lydumas, plastiškumas – skiriasi.
3. Pateikite vieno iš elementų – metalų (natrio, kalcio, aliuminio ar geležies) apibūdinimą (visi pasirinktinai).
METALINIO ELEMENTO CHARAKTERISTIKOS ALUMINIO PAVYZDŽIUI
1. Padėtis periodinėje sistemoje.Aliuminis(serijos numeris 13 ) yra elementas 3 laikotarpis, pagrindinis pogrupius 3
2. Protonų skaičius atome aliuminio lygus 13 , elektronų skaičius - 13 , neutronų skaičius izotope 27 13 Al - 27-13 =14, branduolinis užtaisas +13 , elektronų pasiskirstymas lygiais 2, 8, 3 .
3. Paprasta substancija.Aliuminis- tai yra amfoterinis metalas. atomai aliuminio Rodyti atkuriamoji savybių.
4. Didesnis oksidas, jo charakteris. Aliuminis sudaro aukščiausią oksidą, kurio formulė yra Al2O3. Pagal savybes tai amfoterinis oksidas.
4. Aukštasis hidroksidas, jo prigimtis. Aliuminis sudaro aukščiausią hidroksidą, kurio formulė yra Al(OH)3. Pagal savybes amfoterinis pagrindas.
7 bilietas.
1. Stiprių ir silpnų elektrolitų samprata.
Elektrolitams priskiriamos druskos, rūgštys, bazės.
Druskos yra visi stiprūs elektrolitai, t.y. gerai praleidžia elektrą. Todėl disociacijos lygtyje tik viena rodyklė dedama skilimo į jonus kryptimi
МAn → М + + An -
Stiprios bazės yra šarmai, t.y. vandenyje tirpios bazės.
Ca (OH) 2 → Ca 2+ +2 (OH) -
Netirpūs ir mažai tirpūs yra silpni, todėl, rašydami disociacijos lygtį, jie deda grįžtamumo ženklą (be jonų yra ir molekulių)
MON M + + OH -
Stipriosios rūgštys apima HCl, HBr, HI, H 2 SO 4, HNO 3, HClO 4, HClO 3.
2. Lydiniai.
Tai būdingų savybių medžiagos, susidedančios iš dviejų ar daugiau komponentų, iš kurių bent vienas yra metalas.
Metalurgijoje geležis ir visi jos lydiniai yra klasifikuojami į vieną grupę, vadinamą juodieji metalai; kiti metalai ir jų lydiniai turi techninį pavadinimą spalvotieji metalai.
Didžioji dauguma geležies (arba geležies) lydinių turi anglies. Jie skirstomi į ketaus ir plieno.
Ketaus- geležies lydinys, kuriame yra daugiau nei 2% anglies, taip pat mangano, silicio, fosforo ir sieros. Ketus yra daug kietesnis nei geležis, paprastai jis yra labai trapus, nesuklastotas ir lūžta nuo smūgio. Šis lydinys naudojamas įvairių masyvių detalių gamybai liejant, vadinamajam ketaus, ir perdirbti į plieną - ketus.
Priklausomai nuo anglies būsenos lydinyje, išskiriamas pilkasis ir baltas ketus.
Plienas yra geležies lydinys, kuriame yra mažiau nei 2 % anglies. Plieno cheminė sudėtis skirstoma į du pagrindinius tipus: angliarūgštės ir dopingo.
Spalvotųjų metalų lydinių pavyzdžiai gali būti: nichromas, tretnik lydmetalis, win, duraliuminis.
Duraliuminis- aliuminio (95%), magnio, vario ir mangano lydinys. Labai lengvas ir stiprus lydinys. Pagal stiprumą jis prilygsta plienui, bet tris kartus lengvesnis už jį. Naudojamas orlaivių statyboje.
3. Pateikite vieno iš elementų – nemetalų (chloro, sieros, fosforo, azoto, anglies, silicio) – aprašymą (visi neprivalomi).
NEMETALINIO ELEMENTO CHARAKTERISTIKOS SIEROS PAVYZDŽIUI
1. Pozicija periodinėje lentelėjeSiera(serijos numeris 16 ) yra elementas 3 laikotarpis, pagrindinis pogrupius 6 Periodinės sistemos grupės.
2.Atomo sandara, savybės. Protonų skaičius sieros atome yra 16 , elektronų skaičius - 16 , neutronų skaičius izotope 32 16 S - 32-16 =16, branduolinis užtaisas +16 , elektronų pasiskirstymas 2, 8, 6 lygiuose.
3. Paprasta medžiaga. Siera yra nemetaliniai. Sieros atomai eksponuojami oksidacinis savybių.
3.Didesnis oksidas, jo charakteris. Siera sudaro didžiausią oksidą, kurio formulė yra SO 3. Pagal savybes tai rūgšties oksidas.
4.Didesnis hidroksidas, jo charakteris. Siera sudaro didžiausią hidroksidą, kurio formulė yra H2SO4. Pagal savybes rūgšties.
8 bilietas.
1. Oksidai: jų sudėtis, klasifikacija ir pavadinimai.
oksidai- tai yra dvejetainiai junginiai, antroje vietoje yra deguonis, kurio oksidacijos būsena yra -2.
Priklausomai nuo to, kuris elementas yra pirmasis, oksidai skirstomi į tris grupes:
1) Pagrindinis. Tai oksidai, kuriuose metalas yra pirmoje vietoje: CaO, Na 2 O.
2) rūgštis. Tai oksidai, kuriuose pirmoje vietoje yra nemetalas: P 2 O 5.
3) Amfoterinis. Tai oksidai, kuriuose amfoterinis elementas (pereinantis metalas) yra pirmame metame: Al 2 O 3, Fe 2 O 3
Baziniai oksidai atitinka bazes. Pavyzdžiui, Na 2 O – NaOH. Rūgščių oksidai atitinka rūgštis: P 2 O 5 - H 3 PO 4.
Pavadinimai susideda iš deguonies pavadinimo (lotyniškai) - oksidas ir pirmojo elemento pavadinimų, nurodančių oksidacijos laipsnį (jei kinta).
P 2 +5 O 5 fosforo (V) oksidas, Fe 2 +3 O 3 geležies (III) oksidas
2. Deguonies pogrupis: atomų struktūra ir savybės, paprastos medžiagos, sieros cheminės savybės.
Norėdami gauti atsakymą, žiūrėkite 1 bilietą, 2 klausimą.
3. Norėdami įrodyti, kad kalio chloride yra chlorido jonų, naudokite būdingą reakciją.
Cl - + Ag + (tirpsta sidabro druska) ® Ag Cl ¯
Baltos varškės nuosėdos
9 bilietas.
1. Rūgštys. Rūgščių pavadinimai ir formulės.
rūgštys yra sudėtingos neorganinės medžiagos, sudarytos iš vandenilio katijonas ir rūgšties liekanos anijonas.
Hcl – druskos rūgštis
HNO 3 – azotas
H 2 SO 4 – sieros
H 2 CO 3 - anglis
H 3 PO 4 – fosforinis
2. Lydiniai.
Norėdami gauti atsakymą, žr. 7 bilietą, 2 klausimą.
3. Pateikite vieno iš elementų – metalų (ličio, magnio, kalio ar aliuminio) apibūdinimą (visi pasirinktinai).
Norėdami gauti atsakymo pavyzdį, žr. 6 bilietą, 3 klausimą.
10 bilietas.
1. Metalų padėtis periodinėje cheminių elementų sistemoje D.I. Mendelejevas, jų atomų ir kristalų sandara.
Aš – paprastos medžiagos, kurios lengvai atiduoda elektronus. Pagrindiniams pogrupiams:

Me apima visus antrinių pogrupių elementus. Tokia Me padėtis periodinėje sistemoje yra susijusi su jų struktūra: nedidelis elektronų skaičius išoriniame lygyje (1-3), kurį pagrindiniuose pogrupiuose lemia grupės skaičius, o šoniniuose - nuolat 2 elektronai. . Antroji savybė Man yra didelis spindulys (augantis lentelėje nuo viršaus iki apačios).
Kristalinėje gardelėje Me turi laisvųjų elektronų, kurie yra atsakingi už pagrindines fizines Me savybes:

2. Pamatai TED šviesoje; jų klasifikacija ir chem. savybių.
Bazės yra elektrolitai, kurie disociacijos metu sudaro metalo katijoną ir rūgšties liekanos anijoną.
Klasifikacija:
1. Vandenyje netirpios bazės.
2. Šarminiai – tirpūs vandenyje.
Tipiškos bazinės reakcijos
1 . Bazė + rūgšties® druska + vanduo.
(mainų reakcija)
Hl + NaOH \u003d NaCl + H 2 O
H + + OH - \u003d H 2 O (neutralizacijos reakcija).
2. Bazė + rūgšties oksidas®druska + vanduo.
(mainų reakcija)
2NaOH + N 2 O 5 \u003d 2NaNO 3 + H 2 O
2OH - + N2O5 = 2NO3 - + H2O;
3 . Šarmas + druska ® nauja bazė + nauja druska.
(mainų reakcija)
2KOH + CuSO 4 = = Cu(OH) 2 ¯+ K 2 SO 4
Cu 2+ + 2OH - = = Cu (OH) 2 ¯
4. Vandenyje netirpios bazės kaitinamos skyla į metalo oksidą ir vandenį, o tai nebūdinga šarmams, pavyzdžiui:
Cu (OH) 2 ¯ \u003d CuO + H 2 O
3. Išdėstykite koeficientus reakcijos schemose elektroninio balanso metodu. Nurodykite oksidatorių ir reduktorių, oksidacijos ir redukcijos procesus.
Al + O 2 ® Al 2 O 3
HNO 3 + P® H 3 PO 4 + NO 2 + H 2 O
Ruošdamiesi egzaminui sprendimą žiūrėkite laboratorijos žurnale - praktinis darbas Nr.2.
11 bilietas.
1. Elektroninio balanso metodas.
Al 0+ O2 0 ® Al 2 +3 O 3 -2
Išrašome elementus, kurie pakeitė s.d.
Al 0 - 3e - → Al +3 4 Al 0 - reduktorius, oksidacijos procesas
O 2 0 +2 * 2e - → 2O -2 3 O 2 0 - oksidatorius, redukcijos procesas
Pastaba. Jei paprasta medžiaga turi indeksą (2), tada ji perkeliama į elektroninius svarstykles.
Reakciją išlyginame naudodami elektroninės svarstyklės koeficientus (4, 3):
4Al + 3O 2 ® 2 Al 2 O 3
2. Bendrosios cheminės metalų savybės. Elektrocheminės metalų įtampų serijos ir metalų sąveika su rūgščių ir druskų tirpalais.
Metalai yra reduktorius. Redukuojančios savybės pasireiškia reakcijose su paprastomis ir sudėtingomis medžiagomis.
I. Su paprastais – nemetalais
2Na + S = Na 2 S natrio sulfidas
II. Su kompleksu: vanduo, rūgštys, druskų tirpalai (pakeitimo reakcijos). Rašant visas šias reakcijas, būtina atsižvelgti į metalų aktyvumo eilutes (elektrochemines eilutes).
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H 2), Cu, Hg, Ag, Au.
1. Metalai, esantys į kairę nuo vandenilio įtampos serijoje, išstumia jį iš rūgščių tirpalų, o esantys dešinėje, kaip taisyklė, neišstumia vandenilio iš rūgščių tirpalų:
Zn + 2HCl \u003d ZnCl 2 + H 2.
2. Kiekvienas metalas išstumia kitus metalus iš druskos tirpalų, esančių į dešinę nuo jo tam tikroje įtampoje, o pats gali būti išstumtas metalų, esančių kairėje, pavyzdžiui:
Fe + CuSO 4 \u003d FeSO 4 + Cu,
Cu + HgCl 2 \u003d Hg + CuCl 2.
3. Nustatykite anglies monoksido (IV) masę pagal medžiagos kiekį 2 mmol.
Atsakymas: 88 mg anglies monoksido (IV).
12 bilietas.
1. Druskų hidrolizė katijonais.
МAn + HOH = MOH + HАn
druskos bazinė rūgštis
Druska hidrolizuojama, jei ją sudaro bent vienas silpnas jonas. Jei silpnas katijonas (iš silpnos bazės), tada hidrolizė vadinama katijonu.
Silpnos bazės netirpsta vandenyje.
Pavyzdžiui, FeCl3 yra druska, sudaryta iš stiprios rūgšties (HCl) ir silpnos bazės (Fe(OH) 3).
FeCl3Û Fe 3+ +3Cl -
silpnas katijonas
Fe 3+ + H + OH - Û Fe OH 2+ + H+
4. Nustatykite, kad tirpalo terpė rūgštinė
Taip yra hidrolizė katijonais.
2. Bendrosios fizinės metalų savybės.
Norėdami gauti atsakymą, žiūrėkite bilietą 6 , 2 klausimas.
3. Atlikite reakcijas, patvirtinančias, kad sieros rūgštyje yra vandenilio katijonų ir sulfatų anijonų.
H 2 SO 4 Û 2H + + SO 4 2-
H + - metiloranžinė (pasitaiko raudona) arba lakmusas (pasitaiko raudona)
SO 4 2- + Ba 2+ ® Ba SO 4 ¯ (baltos smulkios kristalinės nuosėdos)
13 bilietas.
1. Druskų hidrolizė anijonu.
Druskos hidrolizė yra tirpios druskos sąveika su vandeniu.
МAn + HOH = MOH + HАn
druskos bazinė rūgštis
Druska hidrolizuojama, jei ją sudaro bent vienas silpnas jonas. Jei silpnas anijonas (iš silpnos rūgšties), tada hidrolizė vadinama anijonu.
Stiprios rūgštys: H 2 SO 4 , HNO 3 , HClO 3 , HClO 4 , HCl, HBr, HI
Likusieji yra silpni.
Pavyzdžiui, Na 2 CO 3 - Druska sudaryta iš silpnos rūgšties ir stiprios bazės
1. Parašykite druskos disociacijos lygtį. Na 2 CO 3Û 2Na ++ CO 3 2-
silpnas anijonas
2. Pasirinkite silpną joną: katijoną arba anijoną.
3. Užfiksuokite jo sąveiką su vandeniu. CO 3 2- + H + OH - Û HCO 3 - + JIS -
4. Nustatykite tirpalo aplinką: JIS -- šarminė aplinka, H + - rūgštinė aplinka, H + nebuvimas ir OH - neutralus.
Taip yra anijonų hidrolizė.
2. Bendrosios cheminės metalų savybės.
Norėdami gauti atsakymą, žiūrėkite 11 bilietą, 2 klausimą.
3. Kiek gramų jodo ir alkoholio reikia paimti, norint paruošti 30 g 5% jodo tinktūros tirpalo?
Ruošdamiesi egzaminui sprendimą žiūrėkite laboratorijos žurnale - praktinis darbas Nr.1.
14 bilietas.
1 . Cheminių medžiagų formulių sudarymas pagal oksidacijos laipsnį.
1. Užrašykite oksidacijos būsenas:
Pirmojo elemento konstanta yra didžiausia (pagal grupės numerį) arba kintamasis (nurodytas medžiagos pavadinime)
Antrajam - mažiausias (- (8-Nr. gr.)), arba pagal tirpumo lentelę (elementų grupei);
2. Sugriauti oksidacijos būsenas skersai – gauname indeksus (jei reikia – sumažiname).
Pavyzdžiui.
1) paruoškite aliuminio oksidą: Al 2 +3 O 3 -2
2) paruoškite švino (IV) sulfidą: Pb 2 +4 S 4 -2 → PbS 2
3) padaryti kalcio sulfatą: Ca +2 SO 4 -2
2. halogenų pogrupis.
Ruošdamiesi egzaminui atsakymą žiūrėkite 3 biliete, 2 klausime.
3. Atlikti reakcijas, patvirtinančias kokybinę bario chlorido sudėtį.
BaCl 2 Û Ba 2+ + 2Cl -
Ba 2+ + SO 4 2-® Ba SO 4 ¯ (baltos smulkios kristalinės nuosėdos)
Сl - + Ag + ® Ag Сl ¯ (baltos sūrios nuosėdos)
Bilietas 15.
1. Jonų mainų reakcijos.
Norint įrašyti jonų mainų reakciją, reikia vadovautis tokiu algoritmu.
1. Parašykite molekulinės reakcijos lygtį
Fe(NO 3) 3 + 3NaOH = Fe(OH) 3 + 3NaNO 3
2. Patikrinkite reakcijos galimybę (reakcijos produktai: nuosėdos, dujos arba vanduo)
Fe(NO 3) 3 + 3NaOH = Fe(OH)3↓ + 3NaNO3
3. Užrašykite joninės reakcijos lygtį, nepamiršdami:
Paliekame molekulės pavidalu – silpnas elektrolitas (H 2 O) ir neelektrolitas, nuosėdos arba dujos;
Koeficientas prieš medžiagos formulę nurodo abu jonai!
· Daugiaatominių (sudėtinių) jonų formulės netrūksta: OH - , CO3 2- , PO4 3- ir kt.
Indeksas po paprasto jono arba skliausteliuose joninėje lygtyje pereina į prieš jį esantį koeficientą
Fe 3+ + 3(NO 3) - + 3Na + + 3OH - = Fe(OH)3↓ + 3Na + + NO 3 -
4. "Sumažinti" panašiai
Fe3++ 3NO3 - + 3Na++ 3OH - = Fe(OH)3↓ + 3Na+ + NE 3 -
5. Perrašykite redukuotą joninę lygtį
Fe 3+ + 3OH - \u003d Fe(OH)3↓
2. Bendrosios šarminių metalų charakteristikos: atomų sandara ir paprastų medžiagų fizikinės savybės.
susitarimas
Vartotojų registravimo svetainėje "KOKYBĖS ŽENKLAS" taisyklės:
Draudžiama registruoti vartotojus su tokiais slapyvardžiais kaip: 111111, 123456, ytsukenb, lox ir kt.;
Draudžiama iš naujo registruotis svetainėje (kurti pasikartojančias paskyras);
Draudžiama naudoti kitų asmenų duomenis;
Draudžiama naudoti kitų asmenų elektroninio pašto adresus;
Elgesio taisyklės svetainėje, forume ir komentaruose:
1.2. Kitų vartotojų asmens duomenų skelbimas anketoje.
1.3. Bet kokie destruktyvūs veiksmai, susiję su šiuo ištekliu (destruktyvūs scenarijai, slaptažodžio atspėjimas, apsaugos sistemos pažeidimas ir kt.).
1.4. Nepadorių žodžių ir posakių naudojimas kaip slapyvardis; posakiai, pažeidžiantys Rusijos Federacijos įstatymus, etikos ir moralės normas; žodžiai ir frazės, panašios į administracijos ir moderatorių slapyvardžius.
4. 2 kategorijos pažeidimai: baudžiamas visišku draudimu siųsti bet kokio tipo žinutes iki 7 dienų. 4.1. Informacijos, kuriai taikomas Rusijos Federacijos baudžiamasis kodeksas, Rusijos Federacijos administracinis kodeksas ir prieštarauja Rusijos Federacijos Konstitucijai, talpinimas.
4.2. Propaganda bet kokia ekstremizmo, smurto, žiaurumo, fašizmo, nacizmo, terorizmo, rasizmo forma; tarpetninės, tarpreliginės ir socialinės neapykantos kurstymas.
4.3. Nekorektiškas kūrinio aptarimas ir „KOKYBĖS ŽENKLO“ puslapiuose publikuotų tekstų ir pastabų autorių įžeidinėjimai.
4.4. Grasinimai forumo nariams.
4.5. Sąmoningai melagingos informacijos, šmeižto ir kitos informacijos, diskredituojančios tiek vartotojų, tiek kitų asmenų garbę ir orumą, pateikimas.
4.6. Pornografija avataruose, pranešimuose ir citatose, taip pat nuorodos į pornografinius vaizdus ir išteklius.
4.7. Atviras aptarimas apie administracijos ir moderatorių veiksmus.
4.8. Galiojančių taisyklių viešas aptarimas ir įvertinimas bet kokia forma.
5.1. Mat ir nešvankybės.
5.2. Provokacijos (asmeniniai išpuoliai, asmeninis diskreditavimas, neigiamos emocinės reakcijos formavimas) ir diskusijų dalyvių priekabiavimas (sistemingas provokacijų naudojimas vieno ar kelių dalyvių atžvilgiu).
5.3. Vartotojų provokavimas konfliktuoti tarpusavyje.
5.4. Šiurkštumas ir grubumas pašnekovų atžvilgiu.
5.5. Perėjimas prie individo ir asmeninių santykių išsiaiškinimas forumo temose.
5.6. Potvynis (identiški arba beprasmiai pranešimai).
5.7. Tyčinis slapyvardžių ir kitų vartotojų vardų rašymas įžeidžiančiu būdu.
5.8. Cituojamų žinučių redagavimas, jų reikšmės iškraipymas.
5.9. Asmeninio susirašinėjimo publikavimas be aiškaus pašnekovo sutikimo.
5.11. Destruktyvus trolinimas – tai tikslingas diskusijos pavertimas susirėmimu.
6.1. Per daug cituojami (per daug cituojami) pranešimai.
6.2. Naudojamas raudonas šriftas, skirtas moderatorių taisymui ir komentarams.
6.3. Moderatoriaus ar administratoriaus uždarytų temų diskusijos tęsinys.
6.4. Kurti temas, kurios neturi semantinio turinio arba yra provokuojančio turinio.
6.5. Temos ar pranešimo pavadinimo viso ar dalies sukūrimas didžiosiomis raidėmis arba užsienio kalba. Išimtis daroma nuolatinių temų pavadinimams ir moderatorių atidarytoms temoms.
6.6. Antraštės kūrimas didesniu nei įrašo šriftu ir antraštėje daugiau nei vienos paletės spalvos naudojimas.
7. Forumo taisyklių pažeidėjams taikomos sankcijos
7.1. Laikinas arba nuolatinis draudimas patekti į forumą.
7.4. Paskyros ištrynimas.
7.5. IP blokavimas.
8. Užrašai
8.1.Moderatorių ir administracijos sankcijų taikymas gali būti vykdomas be paaiškinimo.
8.2. Šios taisyklės gali keistis, apie kurias bus pranešta visiems svetainės nariams.
8.3. Vartotojams draudžiama naudoti klonus tuo laikotarpiu, kai blokuojamas pagrindinis slapyvardis. Tokiu atveju klonas užblokuojamas neribotam laikui, o pagrindinis slapyvardis gaus papildomą dieną.
8.4 Moderatorius arba administratorius gali redaguoti pranešimą su nepadoria kalba.
9. Administravimas Svetainės "ZNAK QUALITY" administracija pasilieka teisę be paaiškinimo ištrinti bet kokius pranešimus ir temas. Svetainės administracija pasilieka teisę redaguoti žinutes ir vartotojo profilį, jei juose esanti informacija tik iš dalies pažeidžia forumo taisykles. Šie įgaliojimai taikomi moderatoriams ir administratoriams. Administracija pasilieka teisę prireikus šias Taisykles keisti ar papildyti. Taisyklių nežinojimas neatleidžia vartotojo nuo atsakomybės už jų pažeidimą. Svetainės administracija negali patikrinti visos vartotojų paskelbtos informacijos. Visi pranešimai atspindi tik autoriaus nuomonę ir negali būti naudojami vertinant visų forumo dalyvių nuomones kaip visumą. Svetainės darbuotojų ir moderatorių pranešimai yra jų asmeninės nuomonės išraiška ir gali nesutapti su redaktorių ir svetainės vadovų nuomone.