Jednostavne i složene supstance. Hemijski element
O atomima i hemijskim elementima
U hemiji se, pored pojmova „atom“ i „molekula“, često koristi pojam „element“ Šta je zajedničko i po čemu se razlikuju?
Hemijski element su atomi istog tipa. Tako, na primjer, svi atomi vodika su element vodonik; svi atomi kiseonika i žive su elementi kiseonik i živa, respektivno.
Trenutno je poznato više od 107 vrsta atoma, odnosno više od 107 hemijskih elemenata. Potrebno je razlikovati pojmove „hemijski element“, „atom“ i „jednostavna supstanca“
Jednostavne i složene supstance
Prema elementarnom sastavu razlikuju jednostavne supstance koje se sastoje od atoma jednog elementa (H2, O2,Cl2, P4, Na, Cu, Au) i složene supstance koje se sastoje od atoma različitih elemenata (H2O, NH3, OF2, H2SO4 , MgCl2, K2SO4) .
Trenutno je poznato 115 hemijskih elemenata, koji čine oko 500 jednostavne supstance.
Samorodno zlato je jednostavna supstanca.
Sposobnost jednog elementa da postoji u obliku različitih jednostavnih supstanci koje se razlikuju po svojstvima naziva se alotropija. Na primjer, element kisik O ima dva alotropna oblika - diokisik O2 i ozon O3c drugačiji broj atoma u molekulima.
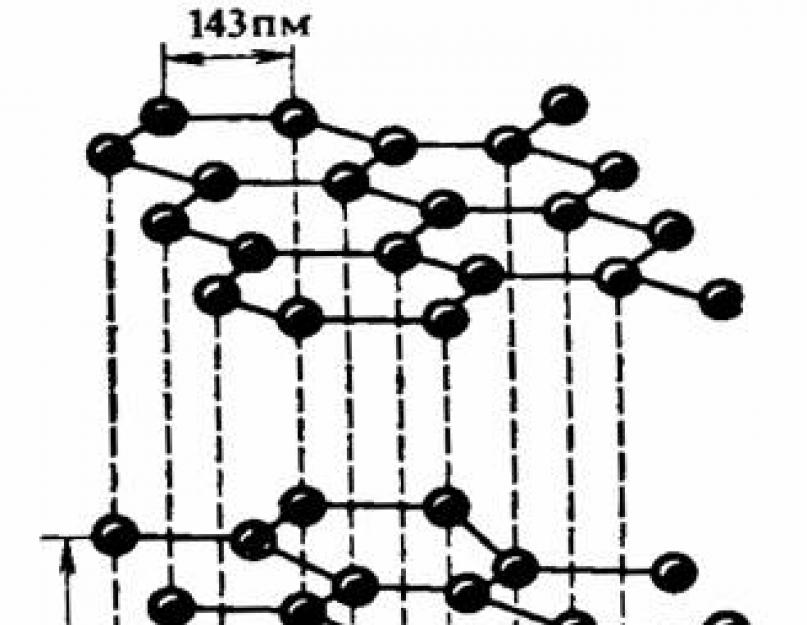
Alotropni oblici elementa ugljika C - dijamant i grafit - razlikuju se po strukturi svojih kristala. Postoje i drugi razlozi za alotropiju.
Alotropni oblici ugljika:
grafit:


dijamant:


Kompleksne supstance se često nazivaju hemijskim jedinjenjima, na primer, živin(II) oksid HgO (koji se dobija spajanjem atoma jednostavnih supstanci - žive Hg i kiseonika O2), natrijev bromid (dobija se spajanjem atoma jednostavnih supstanci - natrijuma Na i broma Br2) .
Dakle, hajde da sumiramo gore navedeno. Postoje dvije vrste molekula materije:
1. Jednostavno– molekule takvih supstanci sastoje se od atoma istog tipa. IN hemijske reakcije ne mogu se razgraditi u nekoliko jednostavnijih supstanci.
2.Kompleks- molekule takvih supstanci sastoje se od atoma različite vrste. U hemijskim reakcijama mogu se razgraditi u jednostavnije supstance.
Razlika između pojmova "hemijski element" i "jednostavna supstanca"
Koncepti "hemijskog elementa" i "jednostavne supstance" mogu se razlikovati poređenjem svojstava jednostavnih i složene supstance. Na primjer, jednostavna supstanca – kisik – je bezbojni plin neophodan za disanje i podržavanje sagorijevanja. Najmanja čestica jednostavne supstance kiseonika je molekul koji se sastoji od dva atoma. Kiseonik je takođe uključen u ugljen monoksid (ugljenmonoksid) i vodu. Međutim, voda i ugljični monoksid sadrže kemijski vezan kisik, koji nema svojstva jednostavne tvari, ne može se koristiti za disanje. Ribe, na primjer, ne udišu kemijski vezan kisik, koji je dio molekule vode, već slobodni kisik otopljen u njemu. Zato kada mi pričamo o tome o sastavu bilo kojeg kemijskog spoja, treba shvatiti da ta jedinjenja ne sadrže jednostavne tvari, već atome određene vrste, odnosno odgovarajuće elemente.
Kada se složene supstance raspadaju, atomi se mogu osloboditi u slobodnom stanju i kombinovati u jednostavne supstance. Jednostavne supstance se sastoje od atoma jednog elementa. Razlika između pojmova „hemijski element“ i „jednostavna supstanca“ potvrđuje i činjenica da isti element može formirati nekoliko jednostavnih supstanci. Na primjer, atomi elementa kisika mogu formirati dvoatomne molekule kisika i triatomske molekule ozona. Kisik i ozon su potpuno različite jednostavne tvari. Ovo objašnjava činjenicu da su poznate mnogo jednostavnije supstance od hemijskih elemenata.
Koristeći koncept "hemijskog elementa", možemo dati sljedeću definiciju jednostavnim i složenim tvarima:
Jednostavno nazivaju se supstance koje se sastoje od atoma jednog hemijskog elementa.
Kompleks nazivaju se tvari koje se sastoje od atoma različitih kemijskih elemenata.
Razlika između pojmova "mješavina" i " hemijsko jedinjenje»
Složene supstance se često nazivaju hemijskim jedinjenjima.
Pratite link i pogledajte iskustvo interakcije jednostavnih supstanci gvožđa i sumpora.
Pokušajte odgovoriti na pitanja:
1. Kako se mješavine po sastavu razlikuju od hemijskih jedinjenja?
2. Uporedite svojstva smeša i hemijskih jedinjenja?
3. Na koje načine možete razdvojiti komponente mješavine i hemijskog jedinjenja?
4. Da li je moguće suditi po spoljni znaci o formiranju mješavine i hemijskog jedinjenja?
Uporedne karakteristike smeša i hemikalija
veze
|
Pitanja za uparivanje mješavina s hemijskim jedinjenjima | Poređenje |
|
Smjese | Hemijska jedinjenja |
|
Po čemu se mješavine razlikuju po sastavu od kemijskih spojeva? | Supstance se mogu miješati u bilo kojem omjeru, tj. varijabilni sastav smeša | Sastav hemijskih jedinjenja je konstantan. |
Uporedite svojstva smeša i hemijskih jedinjenja? | Supstance u mješavinama zadržavaju svoja svojstva | Supstance koje formiraju jedinjenja ne zadržavaju svoja svojstva, jer nastaju hemijska jedinjenja sa drugim svojstvima |
Na koji način se mješavina i kemijsko jedinjenje mogu razdvojiti na sastavne komponente? | Supstance se mogu razdvojiti fizičkim sredstvima | Hemijska jedinjenja mogu se razgraditi samo hemijskim reakcijama |
Može li se po vanjskim znakovima suditi o stvaranju mješavine i kemijskog spoja? | Mehaničko miješanje nije praćeno oslobađanjem topline ili drugim znacima kemijskih reakcija | Formiranje hemijskog jedinjenja može se suditi po znacima hemijskih reakcija |
Zadaci za konsolidaciju
I. Rad sa simulatorima
Simulator br. 1
Simulator br. 2
Simulator br. 3
II. Riješite zadatak
Iz predložene liste supstanci napišite odvojeno jednostavne i složene tvari:
NaCl, H2SO4, K, S8, CO2, O3, H3PO4, N2, Fe.
Objasnite svoj izbor u svakom slučaju.
III. Odgovori na pitanja
№1
Koliko je jednostavnih supstanci zapisano u nizu formula:
H2O, N2, O3, HNO3, P2O5, S, Fe, CO2, KOH.
№2
Obje supstance su složene:
A) C (ugalj) i S (sumpor);
B) CO2 (ugljični dioksid) i H2O (voda);
B) Fe (gvožđe) i CH4 (metan);
D) H2SO4 (sumporna kiselina) i H2 (vodonik).
№3
Odaberite tačnu tvrdnju:
Jednostavne supstance se sastoje od atoma istog tipa.
A) Tačno
B) Netačno
№4
Ono što je tipično za mješavine je to
A) Imaju konstantan sastav;
B) Supstance u „mešavini“ ne zadržavaju svoja pojedinačna svojstva;
C) Supstance u “smješama” mogu se razdvojiti prema fizičkim svojstvima;
D) Supstance u „mešavinama” mogu se odvojiti hemijskom reakcijom.
№5
Za „hemijska jedinjenja” tipično je sledeće:
A) Varijabilni sastav;
B) Supstance sadržane u "hemijskom jedinjenju" mogu se odvojiti fizičkim putem;
C) Formiranje hemijskog jedinjenja može se suditi po znacima hemijskih reakcija;
D) Stalni sastav.
№6
U kom slučaju govorimo o gvožđu kao hemijskom elementu?
A) Gvožđe je metal koji privlači magnet;
B) Gvožđe je deo rđe;
C) Gvožđe se odlikuje metalnim sjajem;
D) Gvozdeni sulfid sadrži jedan atom gvožđa.
№7
U kom slučaju govorimo o kiseoniku kao jednostavnoj supstanci?
A) Kiseonik je gas koji podržava disanje i sagorevanje;
B) Ribe udišu kiseonik rastvoren u vodi;
C) Atom kiseonika je deo molekula vode;
D) Kiseonik je deo vazduha.
Svijet oko nas je materijalan. Postoje dvije vrste materije: supstancija i polje. Predmet hemije je supstanca (uključujući uticaj različitih polja na supstancu - zvučna, magnetna, elektromagnetna itd.)
Materija je sve što ima masu mirovanja (tj. karakteriše prisustvo mase kada se ne kreće). Dakle, iako je masa mirovanja jednog elektrona (masa nepomičnog elektrona) vrlo mala - oko 10 -27 g, ali čak i jedan elektron je materija.
Supstanca dolazi u tri agregatna stanja– gasoviti, tečni i čvrsti. Postoji još jedno stanje materije - plazma (na primjer, grmljavina i loptasta munja sadrže plazmu), ali u školskim predmetima kemija plazme gotovo se i ne razmatra. 
Supstance mogu biti čiste, vrlo čiste (potrebne, na primjer, za stvaranje optičkih vlakana), mogu sadržavati primjetne količine nečistoća ili mogu biti mješavine.
Sve supstance se sastoje od sitnih čestica zvanih atomi. Supstance koje se sastoje od atoma istog tipa(od atoma jednog elementa), nazivaju se jednostavnim(na primjer, ugljen, kisik, dušik, srebro, itd.). Tvari koje sadrže međusobno povezane atome različitih elemenata nazivaju se složenim.
Ako tvar (na primjer, zrak) sadrži dva ili veći broj jednostavne tvari, a njihovi atomi nisu međusobno povezani, onda se to ne naziva složenom tvari, već mješavinom jednostavnih tvari. Broj jednostavnih supstanci je relativno mali (oko pet stotina), ali je broj složenih supstanci ogroman. Do danas je poznato desetine miliona različitih složenih supstanci. 
Hemijske transformacije
Supstance su sposobne da stupaju u interakciju jedna s drugom i nastaju nove supstance. Takve transformacije se nazivaju hemijski. Na primjer, jednostavna tvar, ugljen, stupa u interakciju (kemičari kažu da reagira) s drugom jednostavnom tvari, kisikom, što rezultira stvaranjem složene tvari, ugljičnog dioksida, u kojoj su atomi ugljika i kisika međusobno povezani. Takve transformacije jedne supstance u drugu nazivaju se hemijskim. Hemijske transformacije su hemijske reakcije. Dakle, kada se šećer zagrije na zraku, složena slatka tvar - saharoza (od koje se sastoji šećer) - pretvara se u jednostavnu tvar - ugalj i složenu tvar - vodu.
Hemija proučava transformaciju jedne supstance u drugu. Zadatak hemije je da otkrije sa kojim supstancama određena supstanca može da stupi u interakciju (reaguje) pod datim uslovima i šta nastaje. Osim toga, važno je saznati pod kojim uvjetima može doći do određene transformacije i dobiti željenu supstancu.
Fizička svojstva tvari
Svaku supstancu karakterizira skup fizičkih i hemijska svojstva. Fizička svojstva su svojstva koja se mogu okarakterizirati pomoću fizičkih instrumenata. Na primjer, pomoću termometra možete odrediti tačke topljenja i ključanja vode. Fizičke metode se mogu koristiti za karakterizaciju sposobnosti tvari da provode struja, odrediti gustinu supstance, njenu tvrdoću itd. Tokom fizičkih procesa, supstance ostaju nepromijenjene u sastavu.
Fizička svojstva supstanci dijele se na prebrojiva (ona koja se pomoću određenih fizičkih instrumenata mogu okarakterizirati brojem, na primjer, označavanjem gustine, tačaka topljenja i ključanja, rastvorljivosti u vodi itd.) i bezbrojna (ona koja se ne mogu okarakterisati pomoću broj ili je veoma teško – kao što su boja, miris, ukus, itd.).
Hemijska svojstva tvari
Hemijska svojstva supstance su skup informacija o tome koje druge supstance i pod kojim uslovima određena supstanca ulazi u hemijske interakcije. Najvažniji zadatak hemija - utvrđivanje hemijskih svojstava supstanci.
Hemijske transformacije uključuju najmanje čestice tvari - atome. Prilikom hemijskih transformacija iz nekih supstanci nastaju druge supstance, a prvobitne supstance nestaju, a na njihovom mestu nastaju nove supstance (produkti reakcije). A atomi na svima hemijske transformacije su očuvane. Njihovo preuređenje se dešava tokom hemijskih transformacija, stare veze između atoma se uništavaju i nastaju nove.
Hemijski element
Broj različitih supstanci je ogroman (i svaka od njih ima svoj skup fizičkih i hemijskih svojstava). U materijalnom svijetu oko nas postoji relativno malo atoma koji se međusobno razlikuju po svojim najvažnijim karakteristikama - oko stotinu. Svaka vrsta atoma ima svoj hemijski element. Hemijski element je skup atoma sa istim ili sličnim karakteristikama. U prirodi se nalazi oko 90 različitih hemijskih elemenata. Do danas su fizičari naučili da stvaraju nove vrste atoma koji se ne nalaze na Zemlji. Takvi atomi (i, prema tome, takvi kemijski elementi) nazivaju se umjetnim (na engleskom - umjetni elementi). Do danas je sintetizirano više od dva desetina umjetno dobivenih elemenata.
Svaki element ima Latinski naziv i jednoslovni ili dvoslovni znak. U hemijskoj literaturi na ruskom jeziku ne postoje jasna pravila za izgovor simbola hemijskih elemenata. Neki to izgovaraju ovako: nazivaju element na ruskom (simboli za natrijum, magnezijum, itd.), drugi - prema latinična slova(simboli ugljika, fosfora, sumpora), treći - kako naziv elementa zvuči na latinskom (gvožđe, srebro, zlato, živa). Simbol elementa vodonik H obično izgovaramo onako kako se ovo slovo izgovara na francuskom.
Poređenje najvažnijih karakteristika hemijskih elemenata i jednostavnih supstanci dato je u tabeli ispod. Jedan element može odgovarati nekoliko jednostavnih supstanci (fenomen alotropije: ugljik, kisik, itd.), ili možda samo jedan (argon i drugi inertni plinovi).

hemija pripada prirodnim naukama. Proučava sastav, strukturu, svojstva i transformacije supstanci, kao i pojave koje prate ove transformacije.
Supstanca je jedan od glavnih oblika postojanja materije. Supstanca kao oblik materije sastoji se od pojedinačnih čestica različitog stepena složenosti i ima svoju masu, tzv.
masa mirovanja.
Jednostavne i složene supstance. Alotropija.
Sve supstance se mogu podeliti na jednostavno I kompleks .
Jednostavne supstance sastoje se od atoma jednog hemijskog elementa, kompleks - od atoma nekoliko hemijskih elemenata.
Hemijski element - ovo je određena vrsta atoma sa istim nuklearnim nabojem. dakle, atom je najmanja čestica hemijskog elementa.
Koncept jednostavna supstanca ne mogu se poistovetiti sa konceptom
hemijski element . Hemijski element karakterizira određeni pozitivni naboj atomskog jezgra, izotopski sastav i kemijska svojstva. Svojstva elementa odnose se na njegove pojedinačne atome. Jednostavnu tvar karakterizira određena gustoća, topljivost, tačke topljenja i ključanja itd. Ova svojstva se odnose na skup atoma i različita su za različite jednostavne tvari.
Jednostavna supstanca - ovo je oblik postojanja hemijskog elementa u slobodnom stanju. Mnogi hemijski elementi formiraju nekoliko jednostavnih supstanci koje se razlikuju po strukturi i svojstvima. Ovaj fenomen se zove alotropija , a formirajuće supstance su alotropske modifikacije . Dakle, element kisika formira dvije alotropske modifikacije - kisik i ozon, element ugljika - dijamant, grafit, karbin, fuleren.
Fenomen alotropije uzrokovan je iz dva razloga: različitog broja atoma u molekuli (npr. kisika O 2 i azon O 3 ) ili formiranje različitih kristalnih oblika (npr. ugljenik formira sledeće alotropske modifikacije: dijamant, grafit, karbin, fuleren), karabin je otkriven 1968. (A. Sladkov, Rusija), a fuleren je teoretski otkriven 1973. (D. Bochvar, Rusija), a 1985. godine - eksperimentalno (G. Kroto i R. Smalley, SAD).
Kompleksne supstance Oni se ne sastoje od jednostavnih supstanci, već od hemijskih elemenata. Dakle, vodonik i kisik, koji su dio vode, nalaze se u vodi ne u obliku plinovitog vodika i kisika sa svojim karakterističnim svojstvima, već u obliku elementi - vodonik i kiseonik.
Najmanja čestica tvari s molekularnom strukturom je molekul koji zadržava kemijska svojstva date tvari. Prema modernim konceptima, molekule se uglavnom sastoje od supstanci u tečnom i gasovitom stanju. Većina čvrstih materija (uglavnom neorganskih) ne sastoji se od molekula, već od drugih čestica (jona, atoma). Soli, metalni oksidi, dijamant, metali itd. nemaju molekularnu strukturu.
Relativna atomska masa
Savremene metode istraživanja omogućavaju određivanje izuzetno malih atomskih masa sa većom preciznošću. Na primjer, masa atoma vodika je 1,674 10 -27 kg, ugljenik – 1,993 10 -26 kg.
U hemiji se tradicionalno ne koriste apsolutne vrijednosti atomskih masa, već relativne. 1961. po jedinici atomska masa prihvaćeno jedinica atomske mase (skraćeno a.u.m.), što je 1/12 dio mase atoma izotopa ugljika 12 WITH.
Većina hemijskih elemenata ima atome različite mase (izotope). Zbog toga relativna atomska masa (ili samo atomska masa) A r hemijskog elementa je vrijednost jednaka odnosu prosječne mase atoma elementa i 1/12 masa atoma ugljika 12 WITH.
Atomske mase elemenata su A r, gdje je index r– početno slovo engleska riječ relativno – relativna. Postovi A r (H), A r (O) A r (C) srednja vrednost: relativna atomska masa vodonika, relativna atomska masa kiseonika, relativna atomska masa ugljenika.
Relativna atomska masa je jedna od glavnih karakteristika hemijskog elementa.
Jednostavna supstanca je oblik postojanja nekog hemijskog elementa u slobodnom obliku. Ogromna većina elemenata sadržanih u prirodni objekti, izolovani u obliku jednostavnih supstanci. Čak su i mnogi elementi sintetizirani nuklearnim reakcijama (tehnecijum, prometijum, neptunijum, plutonijum, americij, kurij, berkelijum, kalifornij) dobijeni u metalnom obliku.
Naučnici dugo vremena nije mogao napraviti jasnu razliku između elemenata i jednostavnih supstanci. Ovu razliku je prvi sa potpunom sigurnošću utvrdio D.I.Mendeljejev, koji je istakao da su "jednostavna tijela supstance koje sadrže samo jedan element...", a periodični sistem se odnosi na elemente, a ne na jednostavne supstance.
Broj jednostavnih supstanci znatno premašuje broj poznatih hemijskih elemenata (sada je poznato više od 400 jednostavnih supstanci). Mnogi elementi formiraju nekoliko jednostavnih supstanci koje se nazivaju alotropske modifikacije (vidi Alotropija). Na primjer, slobodni ugljik postoji u tri modifikacije - dijamant, grafit, karabin.
At normalnim uslovima najjednostavnije supstance - čvrste materije. Vodonik, helijum, azot, kiseonik (i njegova alotropna modifikacija - ozon), fluor, neon, hlor, argon, kripton, ksenon i radon su gasovi. A samo dva elementa - brom i živa - u normalnim uslovima postoje u obliku tečnih jednostavnih supstanci.
Podjela jednostavnih supstanci na metale i nemetale (ili metaloide) temelji se na specifičnostima njihovih fizičkih i kemijskih svojstava. Metala je mnogo više. Sa tačke gledišta elektronske konfiguracije atoma, metalni elementi uključuju sve one u čijim su atomima s-, d- ili f-podljuske ispunjene elektronima. (Jedini izuzeci su vodonik i helijum). U metale spadaju i neki p-elementi (aluminijum, galijum, indijum, kalaj, olovo, bizmut, polonijum) svi ostali p-elementi su nemetali ili pokazuju metalna svojstva u slabom stepenu (antimon, jod, astat);
Sa hemijske tačke gledišta, nemoguće je povući jasnu granicu između metala i nemetala, jer postoji nekoliko metala čija jedinjenja imaju izražena amfoterna svojstva, odnosno svojstva i metala i nemetala (vidi Amfoternost). Fizičari smatraju metale tvarima koje karakterizira dobra toplinska i električna provodljivost i karakterističan metalni sjaj (iako su takva svojstva svojstvena i nekim nemetalima). U vrlo visok krvni pritisak svi nemetali se, očigledno, mogu prevesti u metalno stanje.
Ono što se naziva fizičkim svojstvima elemenata u velikoj mjeri su svojstva odgovarajućih jednostavnih supstanci, a ta svojstva su vrlo raznolika, posebno za metale. Ako govorimo o gustini, najlakši metal je litijum (0,53 g/cm3), a najteži osmijum (22,6 g/cm3). Najlakše se topiti živa (-38,9°C), najteže se topiti volfram (3410°C).
Najniža tačka ključanja je karakteristična za živu (357,25 ° C), a najviša - za volfram (5700 ° C).
Svojstva jednostavnih supstanci zavise od serijski brojevi elementi u periodni sistem. Međutim, ova zavisnost je prilično složena i nije uvijek linearna. Na primjer, razmotrite ovisnost temperatura topljenja jednostavnih tvari o atomskom broju (nuklearni naboj Z). Element koji započinje svaki period sistema elemenata je jednostavna supstanca sa niskom tačkom topljenja (alkalni metali). Kako se Z povećava, temperatura topljenja raste, prolazi kroz jedan ili više maksimuma i dostiže minimum na kraju perioda (inertni plinovi). U malim periodima (drugi i treći) najviše tačke topljenje se dešava na ugljiku i silicijumu (elementi podgrupe IVa), u velikim (četvrti - šesti) - na hromu, molibdenu i volframu (elementi podgrupe VIb). Dakle, kriva temperature topljenja jednostavnih supstanci takođe pokazuje periodični karakter.
Dobra ilustracija periodične zavisnosti svojstava jednostavnih supstanci od atomskog broja je kriva atomskih zapremina (atomska zapremina je količnik atomske mase podeljena sa gustinom), prikazana na slici. Maksimalne vrijednosti atomske zapremine - y alkalni metali, dok se minimumi javljaju u elementima koji se nalaze u sredini perioda. Krivu atomskog volumena prvi je predložio njemački naučnik L. Meyer 1870. godine.
§ 9. Jednostavne i složene supstance
Nakon što ste savladali ovu temu, moći ćete:
Razlikovati pojmove „jednostavne supstance“ i „složene supstance“, formule jednostavnih i složenih supstanci;
Razumjeti koncept “hemijskog jedinjenja”;
Navedite primjere jednostavnih i složenih supstanci;
Opišite jednostavne i složene supstance koje su vam poznate iz svakodnevne upotrebe;
Donosite sudove o raznim supstancama.
Većina atoma hemijskih elemenata ima sposobnost da se kombinuje jedni sa drugima ili sa atomima drugih hemijskih elemenata. Kao rezultat, nastaju hemijska jedinjenja. Bez obzira na sastav njihovih strukturnih čestica, i jednostavne i složene supstance su hemijska jedinjenja, jer između njih nastaju hemijske veze.
Već ste se upoznali sa strukturom atoma hemijskih elemenata. Supstance čije su komponente atomi nazivaju se atomskim.
Međutim, među svim raznovrsnim hemijskim spojevima, postoje i molekularne supstance. Njihovi sastavni dijelovi su molekuli.
Molekule su najmanje čestice supstance koje zadržavaju svoja hemijska svojstva.
Smatra se da je molekula granica djeljivosti tvari. Ako je uništena, tada je supstanca uništena. Karakteristična karakteristika molekuli su u neprekidnom kretanju.
Zapamtite iz svog kursa prirodne istorije koji se fenomen naziva difuzija.
Svaki molekul se sastoji od određenog broja atoma jednog ili različitih kemijskih elemenata.
Zapamtite iz svog kursa prirodne istorije kako se supstance dijele prema sastavu i porijeklu.
Koje se supstance nazivaju: a) jednostavne; b) teško? Navedite nekoliko primjera jednostavnih i složenih supstanci koje najčešće koristite u svakodnevnom životu.
Jednostavne supstance su supstance koje formira jedan hemijski element.
Na primjer, jednostavne tvari vodonik, kisik, dušik nastaju u skladu s kemijskim elementima Vodik, kisik, dušik. Njihovi molekuli sadrže dva međusobno povezana atoma ovih elemenata (sl. 41 a, 6, c).
Element Kiseonik, pod određenim uslovima, formira još jednu jednostavnu supstancu - ozon, čija molekula sadrži tri atoma (Sl. 41 d).
Rice. 41. Modeli molekula jednostavnih supstanci: a - vodonika; b - kiseonik; c - ozon; g - azot
Složene supstance su supstance koje se formiraju od dva ili više hemijskih elemenata.
Kompleksne supstance uključuju; voda, šećer, sapun, kuhinjska so, kreda, metan (komponenta prirodni gas), ugljen-dioksid. Supstance koje čine ćelije živih organizama (proteini, masti i ugljikohidrati) su složene i sadrže uglavnom atome ugljika, kisika, vodika, dušika, sumpora, fosfora i imaju molekularnu strukturu.
Zapamtite kako dokazati da je voda složena tvar. Koje su metode istraživanja koristili naučnici da bi odredili sastav vode?
Slika 42 prikazuje modele molekula metana, ugljičnog dioksida i vode. Molekul metana sastoji se od jednog atoma ugljika i četiri atoma vodika, molekula ugljičnog dioksida - od jednog atoma ugljika i dva atoma kisika, molekula vode - od jednog atoma kisika i dva atoma vodika.

Rice. 42. Modeli molekula složenih supstanci: a - metana; b - ugljični dioksid; c - voda
Dakle, ovisno o svom sastavu, tvari se dijele na jednostavne i složene. Šema klasifikacije za supstance prikazana je na slici 43.

Rice. 43. Klasifikacija supstanci
Jednostavne supstance: metali i nemetali. Jednostavne supstance se dele u dve grupe. Metalni elementi formiraju metale, nemetalni elementi formiraju nemetale. Odlikuju se fizičkim svojstvima.
Prisjetite se koja su fizička svojstva tvari već upoznata. Imenujte ih.
Okrenimo se demonstracijama i pogledajmo uzorke jednostavnih supstanci metala i nemetala. Od metala, najčešći u tehnici, raznim industrijama i svakodnevnom životu su gvožđe, cink, aluminijum, bakar, srebro, zlato; Nemetali u laboratoriji uključuju sumpor, ugljenik, crveni fosfor, brom i jod.
Obratite pažnju na stanje agregacije metala i nemetala. Šta mislite zašto se brom čuva u zatvorenim ampulama?
Podjela jednostavnih tvari na metale i nemetale temelji se na njihovoj fizička svojstva(Tabela 2).
tabela 2
Fizička svojstva jednostavnih supstanci
Nemetali su tvari koje se uglavnom sastoje od molekula. Molekuli mnogih od njih su dvoatomni. Međutim, postoje i poliatomske molekule: već spomenuti ozon, kristalni sumpor - sadrži osam atoma sumpora, bijeli fosfor- četiri atoma ovog elementa. U jednostavnim supstancama koje formira element Ugljik, atomi se kombiniraju određenim redoslijedom bez formiranja molekula.
Metali se sastoje od atoma odgovarajućih elemenata. Nazivi metala često se poklapaju s imenima metalnih elemenata koji ih formiraju. Na primjer, tvari aluminija, cinka, nikla, kroma, magnezija formirane od odgovarajućih kemijskih elemenata. Međutim, supstancu bakar čine atomi elementa Cuprum, srebro - Argentum, zlato - Aurum, živa - Merkur, željezo - Gvožđe. Nazivi nemetala, elemenata i jednostavnih supstanci poklapaju se za mali broj supstanci (tabela 3).
Tabela C
Nazivi hemijskih elemenata i jednostavnih supstanci
|
Metal |
Nemetalni |
||
|
Hemijski element |
Jednostavna supstanca |
Hemijski element |
Jednostavna supstanca |
|
Aluminijum |
aluminijum |
||
|
Argentum |
|||
|
Merkur |
kiseonik |
||
Laboratorijsko iskustvo 2
Upoznavanje sa uzorcima jednostavnih i složenih supstanci
Zadatak 1. Pažljivo pogledajte supstance koje su vam date u bankama. Pročitajte oznake: H 2 O (voda), S (sumpor), P (fosfor), Mg (magnezijum), NaOH (natrijum hidroksid), C (ugljik), Fe 3 O 4 (ferum (II, III) oksid) , Fe (gvožđe), ZnO (cink oksid), CaCO 3 (kalcijum karbonat), Al (aluminijum), Zn (cink), CaO (kalcijum oksid), Na 2 CO 3 (natrijum karbonat).
Podijelite ove tvari u dvije grupe: jednostavne i složene. Jednostavna klasifikacija tvari u metale i nemetale.
Zadatak 2. Opišite: a) koliko se jednostavne i složene supstance razlikuju po sastavu; 6) koje kriterijume ste koristili za klasifikaciju?
Zadatak 3. Opišite fizička svojstva tvari na osnovu vaših zapažanja.
Nakon što završite zadatak, zapišite podatke u svoju radnu svesku u obliku tabele. Na kraju rada formulirajte zaključke.
|
supstance |
supstance |
Opis nekretnina na osnovu zapažanja |
|
|
Nemetali |
|||
Raznolikost supstanci. Raznolikost supstanci objašnjava se sposobnošću atoma elemenata da se međusobno kombinuju. U zavisnosti od toga koji atomi, u kojoj količini i kako se kombinuju, nastaju mnoge jednostavne i složene supstance (slika 44).

Rice. 44. Jednostavna supstanca sumpor (a) i složena supstanca ametist (b)
Jednostavnih supstanci je malo više od hemijskih elemenata - 400, jer, kao što već znate, isti element (kiseonik, ugljenik, fosfor, sumpor) može formirati dve ili više supstanci.
Poznate su mnogo složenije supstance (skoro 20 miliona). Ovo je voda, čija molekula uključuje vodonik i kiseonik, ugljen-dioksid - ugljenik i kiseonik, kuhinjska so - natrijum i hlor. Sastav ovih supstanci uključuje samo dva elementa - to su binarna jedinjenja. Međutim, značajan broj supstanci se sastoji od tri ili više elemenata. Dakle, glukoza sadrži tri elementa: ugljenik, vodonik i kiseonik, i soda bikarbona sadrži četiri elementa: natrijum, vodonik, ugljenik i kiseonik.
Sve se smatraju složenim organska materija. Osim toga, postoji čitava industrija za ekstrakciju sintetičkih i umjetnih spojeva, koji imaju ogromne industrijske i kućne svrhe.
Sjetite se iz svog kursa prirodne istorije koje se tvari nazivaju neorganskim i organskim. Navedite primjere neorganskih i organskih spojeva.
At normalnim uslovima(temperatura 0 °C, pritisak 101,3 kPa) supstance su u tri agregatna stanja: tečnom (voda, ulje, alkohol), čvrstom (cink, gvožđe, sumpor, fosfor, ugljenik, bakar) i gasovitom (vodonik, kiseonik, ozon, dušik, ugljični dioksid, inertni plinovi).
REZIMEMO ŠTA SMO NAUČILI
Supstance se dijele na jednostavne i složene.
Složene supstance nastaju od dva ili više hemijskih elemenata. ima ih mnogo više nego jednostavnih.
Svaku jednostavnu i složenu tvar karakteriziraju određena svojstva, odnosno znakovi po kojima se mogu identificirati njihove sličnosti i razlike.
Složene supstance su organskog i neorganskog porekla.
Raznolikost supstanci objašnjava se sposobnošću atoma elemenata da se međusobno kombinuju.
ZADACI ZA KONTROLU ZNANJA
1. Objasnite šta znače pojmovi “molekula”, “jednostavna supstanca”, “složena supstanca”, “hemijsko jedinjenje”.
2. Navedite primjere: a) jednostavne i složene supstance; b) organske i neorganske supstance.
3. Obrazložite da li su pojmovi „hemijsko jedinjenje“ i „mešavina supstanci“ identični.
4. Opišite fizička svojstva: a) šećera; b) voda; c) ulja.
5. Obrazložite zašto postoje složenije supstance od jednostavnih.
6. Izrazite vlastito mišljenje o značaju supstanci za život i zdravlje ljudi.
ZANIMLJIVO JE ZNATI
Engleski hemičar G. Davy bio je prvi koji je elektrolizom izolovao metale natrijum, kalijum, kalcijum, stroncijum, barijum i magnezijum u slobodnom stanju. Ovi radovi su postavili temelje za proizvodnju moćnih lampi za reflektore, svjetionike, itd. Nakon toga, naučnik je stvorio sigurnu rudarsku lampu, koja je korištena u cijelom svijetu sve dok nije zamijenjena lampom na baterije.
Maria Sklodowska-Curie (1867-1934) - francuska fizičarka i hemičarka, učiteljica, javna ličnost. Nauka mu duguje otkriće i proučavanje dva radioaktivna elementa - polonija i radijuma. Otkrićem elementa radijuma započela je metoda za liječenje raka kože. Za svoj rad nagrađena je dvije nagrade Nobelove nagrade, koje je donirala za izgradnju sanatorija u Zakopanima i Radiološkog instituta u Varšavi (Poljska).