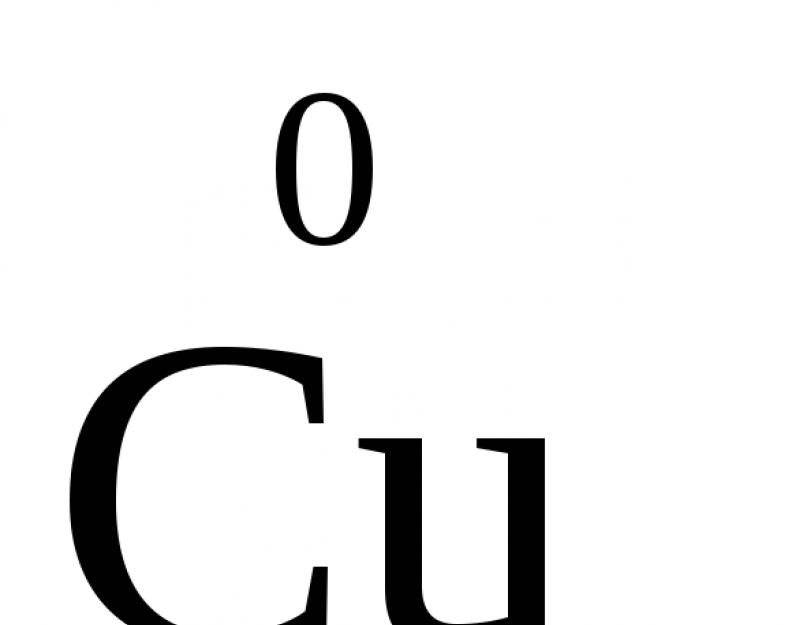A részecskék redox-képességének jellemzéséhez fontos egy olyan fogalom, mint az oxidációs fok. Az OXIDÁCIÓS ÁLLAPOT az a töltés, amely egy molekulában vagy ionban egy atomnak lehet, ha minden kötése megszakadna a többi atommal, és a közös elektronpárok több elektronegatív elemmel távoznának.
Az ionok valós töltéseitől eltérően az oxidációs állapot csak a molekulában lévő atom feltételes töltését mutatja. Lehet negatív, pozitív vagy nulla. Például egyszerű anyagokban az atomok oxidációs állapota "0" (,  ,
, ,
, ). A kémiai vegyületekben az atomok oxidációs állapota állandó vagy változó. A kémiai vegyületek periódusos rendszerének csoportjainak I., II. és III. fő alcsoportjába tartozó fémek oxidációs állapota általában állandó, és Me +1, Me +2 és Me +3 (Li +, Ca +2, Al) +3), ill. A fluoratom mindig -1. A fémekkel alkotott vegyületekben a klór mindig -1. A vegyületek túlnyomó többségében az oxigén oxidációs foka -2 (kivéve a peroxidokat, ahol az oxidációs foka -1), a hidrogén pedig +1 (kivéve a fém-hidrideket, ahol az oxidációs foka -1).
). A kémiai vegyületekben az atomok oxidációs állapota állandó vagy változó. A kémiai vegyületek periódusos rendszerének csoportjainak I., II. és III. fő alcsoportjába tartozó fémek oxidációs állapota általában állandó, és Me +1, Me +2 és Me +3 (Li +, Ca +2, Al) +3), ill. A fluoratom mindig -1. A fémekkel alkotott vegyületekben a klór mindig -1. A vegyületek túlnyomó többségében az oxigén oxidációs foka -2 (kivéve a peroxidokat, ahol az oxidációs foka -1), a hidrogén pedig +1 (kivéve a fém-hidrideket, ahol az oxidációs foka -1).
Az összes atom oxidációs állapotának algebrai összege egy semleges molekulában egyenlő nullával, ionban pedig egyenlő az ion töltésével. Ez az összefüggés lehetővé teszi az atomok oxidációs állapotának kiszámítását komplex vegyületekben.
A H 2 SO 4 kénsavmolekulában a hidrogénatom oxidációs foka +1, az oxigénatom pedig -2. Mivel két hidrogénatom és négy oxigénatom van, két "+" és nyolc "-" van. Hat "+" hiányzik a semlegességhez. Ez a szám a kén oxidációs állapota -  . A kálium-dikromát K 2 Cr 2 O 7 molekula két káliumatomból, két krómatomból és hét oxigénatomból áll. A kálium oxidációs foka +1, az oxigéné -2. Tehát van két "+" és tizennégy "-". A maradék tizenkét "+" két krómatomra esik, amelyek mindegyikének oxidációs állapota +6 (
. A kálium-dikromát K 2 Cr 2 O 7 molekula két káliumatomból, két krómatomból és hét oxigénatomból áll. A kálium oxidációs foka +1, az oxigéné -2. Tehát van két "+" és tizennégy "-". A maradék tizenkét "+" két krómatomra esik, amelyek mindegyikének oxidációs állapota +6 (  ).
).
Tipikus oxidáló és redukáló szerek
A redukciós és oxidációs folyamatok definíciójából az következik, hogy elvileg olyan egyszerű és összetett anyagok, amelyek atomokat tartalmaznak, amelyek nem a legalacsonyabb oxidációs állapotúak, ezért oxidációs állapotukat csökkenthetik, oxidálószerként működhetnek. Hasonlóképpen redukálószerként működhetnek olyan egyszerű és összetett anyagok, amelyek atomokat tartalmaznak, amelyek nem a legmagasabb oxidációs állapotban vannak, és ezért növelhetik oxidációs állapotukat.
A legerősebb oxidálószerek a következők:
1) egyszerű anyagok, amelyeket nagy elektronegativitású atomok alkotnak, pl. a periodikus rendszer hatodik és hetedik csoportjának fő alcsoportjaiban elhelyezkedő tipikus nemfémek: F, O, Cl, S (rendre F 2, O 2, Cl 2, S);
2) olyan anyagok, amelyek magasabb és köztes összetételben tartalmaznak elemeket
pozitív oxidációs állapotok, beleértve az egyszerű, elemi (Fe 3+) és oxigéntartalmú oxoanionok (permanganátion - MnO 4 -) ionok formájában;
3) peroxidvegyületek.
A gyakorlatban oxidálószerként használt speciális anyagok az oxigén és ózon, klór, bróm, permanganátok, dikromátok, klór-oxisavak és ezek sói (pl.  ,
, ,
, ), Salétromsav (
), Salétromsav (  ), tömény kénsav (
), tömény kénsav (  ), mangán-dioxid (
), mangán-dioxid (  ), hidrogén-peroxid és fém-peroxidok (
), hidrogén-peroxid és fém-peroxidok (  ,
, ).
).
A legerősebb redukálószerek a következők:
1) egyszerű anyagok, amelyek atomjainak elektronegativitása alacsony ("aktív fémek");
2) alacsony oxidációs állapotú fémkationok (Fe 2+);
3) egyszerű elemi anionok, például S 2- szulfidion;
4) oxigéntartalmú anionok (oxoanionok), amelyek megfelelnek az elem (nitrit) legalacsonyabb pozitív oxidációs állapotának  , szulfit
, szulfit  ).
).
A gyakorlatban redukálószerként használt speciális anyagok például az alkáli- és alkáliföldfémek, szulfidok, szulfitok, hidrogén-halogenidek (kivéve HF), szerves anyagok - alkoholok, aldehidek, formaldehid, glükóz, oxálsav, valamint hidrogén, szén , szénmonoxid (  ) és alumínium magas hőmérsékleten.
) és alumínium magas hőmérsékleten.
Elvileg, ha egy anyag köztes oxidációs állapotú elemet tartalmaz, akkor ezek az anyagok oxidáló és redukáló tulajdonságokat is mutathatnak. Minden attól függ
"partner" a reakcióban: kellően erős oxidálószerrel redukálószerként, kellően erős redukálószerrel oxidálószerként reagálhat. Így például a NO 2 - nitrit ion savas környezetben oxidálószerként működik az I - ionhoz képest:
2 +
2
+
2 + 4HCl→
+ 4HCl→  +
2
+
2 + 4KCl + 2H 2O
+ 4KCl + 2H 2O
és redukálószerként az MnO 4 permanganát ionhoz képest -
5 +
2
+
2 + 3H 2SO 4 → 2
+ 3H 2SO 4 → 2  +
5
+
5 + K 2 SO 4 + 3 H 2 O
+ K 2 SO 4 + 3 H 2 O
Az iskolában a kémia még mindig az egyik legnehezebb tantárgy, amely sok nehézséget rejtő okán, hogy a tanulókban (általában 8-9 osztályos időszakban) több gyűlöletet és közömbösséget ébreszt a tanulás iránt, mint érdeklődést. Mindez csökkenti a témával kapcsolatos tudás minőségét és mennyiségét, bár sok területen még mindig szükség van erre a területre. Igen, néha még nehezebb pillanatok és érthetetlenebb szabályok is vannak a kémiában, mint amilyennek látszik. A legtöbb tanulót foglalkoztató egyik kérdés az, hogy mi az oxidációs állapot, és hogyan határozható meg az elemek oxidációs állapota.
Fontos szabály az elhelyezési szabály, az algoritmusok
Sok szó esik itt olyan vegyületekről, mint az oxidok. Kezdetben minden diáknak tanulnia kell oxidok meghatározása- Két elem összetett vegyületei ezek, oxigént tartalmaznak. Az oxidokat a bináris vegyületek közé sorolják, mivel az oxigén a második helyen áll az algoritmusban. A mutató meghatározásakor fontos az elhelyezési szabályok ismerete és az algoritmus kiszámítása.
Algoritmusok savoxidokhoz
Oxidációs állapotok - ezek az elemek vegyértékének numerikus kifejezései. Például a savas oxidok egy bizonyos algoritmus szerint képződnek: először a nemfémek vagy fémek (valenciájuk általában 4-7), majd az oxigén jön, ahogy kell, második sorrendben, vegyértéke kettő. Könnyen meghatározható - Mengyelejev kémiai elemeinek periódusos rendszere szerint. Azt is fontos tudni, hogy az elemek oxidációs állapota olyan mutató, amely arra utal akár pozitív, akár negatív szám.
Az algoritmus elején általában egy nemfém, amelynek oxidációs állapota pozitív. Az oxidvegyületekben lévő nem fémes oxigénnek stabil értéke van, ami -2. Az összes érték elrendezésének helyességének meghatározásához az összes rendelkezésre álló számot meg kell szorozni egy adott elem indexeivel, ha a szorzat, figyelembe véve az összes mínuszt és pluszt, 0, akkor az elrendezés megbízható.
Oxigént tartalmazó savakban való elrendeződés
 A savak összetett anyagok, valamilyen savas maradékhoz kapcsolódnak, és egy vagy több hidrogénatomot tartalmaznak. Itt a fokozat kiszámításához matematikai ismeretekre van szükség, mivel a számításhoz szükséges mutatók digitálisak. Hidrogén vagy proton esetében mindig ugyanaz - +1. A negatív oxigénion negatív oxidációs foka -2.
A savak összetett anyagok, valamilyen savas maradékhoz kapcsolódnak, és egy vagy több hidrogénatomot tartalmaznak. Itt a fokozat kiszámításához matematikai ismeretekre van szükség, mivel a számításhoz szükséges mutatók digitálisak. Hidrogén vagy proton esetében mindig ugyanaz - +1. A negatív oxigénion negatív oxidációs foka -2.
Mindezen műveletek végrehajtása után meghatározhatja az oxidáció mértékét és a képlet központi elemét. Kiszámításának kifejezése egy képlet egyenlet formájában. Például a kénsav esetében az egyenlet egy ismeretlennel áll össze.
Az OVR alapfogalmai
Az ORR egy redukciós-oxidációs reakció.
- Bármely atom oxidációs állapota - jellemzi az atom azon képességét, hogy ionok (vagy atomok) más atomjaihoz kapcsolódjon vagy elektronokat adjon;
- Oxidálószernek szokás tekinteni a töltött atomokat vagy a töltetlen ionokat;
- A redukálószer ebben az esetben töltött ionok, vagy éppen ellenkezőleg, töltetlen atomok, amelyek elveszítik elektronjaikat a kémiai kölcsönhatás során;
- Az oxidáció az elektronok adományozása.
Hogyan rendezzük el az oxidációs állapotot a sókban
 A sók egy fémből és egy vagy több savmaradékból állnak. A meghatározási eljárás ugyanaz, mint a savtartalmú savaknál.
A sók egy fémből és egy vagy több savmaradékból állnak. A meghatározási eljárás ugyanaz, mint a savtartalmú savaknál.
A közvetlenül sót alkotó fém a fő alcsoportban található, foka megegyezik a csoport számával, vagyis mindig stabil, pozitív mutató marad.
Példaként tekintsük a nátrium-nitrát oxidációs állapotainak elrendezését. A sót az 1. csoport fő alcsoportjának elemével állítják elő, az oxidációs állapot pozitív és eggyel egyenlő. A nitrátokban az oxigén értéke azonos - -2. Ahhoz, hogy számértéket kapjunk, először egy egyenletet készítünk egy ismeretlennel, figyelembe véve az értékek összes mínuszát és pluszját: +1+X-6=0. Az egyenlet megoldásával arra a tényre juthatunk, hogy a numerikus mutató pozitív és egyenlő + 5-tel. Ez a nitrogén mutatója. Fontos kulcs az oxidáció mértékének kiszámításához - táblázat.
Elrendezési szabály bázikus oxidokban
- A tipikus fémek oxidjai bármely vegyületben stabil oxidációs indexűek, ez mindig nem haladja meg a +1-et, vagy más esetekben +2-t;
- A fém digitális indikátorát a periódusos táblázat segítségével számítják ki. Ha az elem az 1. csoport fő alcsoportjában található, akkor értéke +1 lesz;
- Az oxidok értéke, indexeiket figyelembe véve, szorzás után összegezve nullával egyenlő, mert a bennük lévő molekula semleges, töltés nélküli részecske;
- A 2. csoport fő alcsoportjának fémei is stabilan pozitív mutatót mutatnak, ami +2.
Az oxidáció mértéke egy feltételes érték, amelyet a redoxreakciók rögzítésére használnak. Az oxidáció mértékének meghatározásához a kémiai elemek oxidációs táblázatát használjuk.
Jelentése
Az alapvető kémiai elemek oxidációs állapota az elektronegativitásukon alapul. Az érték megegyezik a vegyületekben elmozdult elektronok számával.
Az oxidációs állapot akkor tekinthető pozitívnak, ha az elektronok kiszorulnak az atomból, pl. az elem elektronokat ad a vegyületben, és redukálószer. Ezen elemek közé tartoznak a fémek, oxidációs állapotuk mindig pozitív.
Amikor egy elektron elmozdul egy atom felé, az értéket negatívnak, az elemet pedig oxidálószernek tekintjük. Az atom a külső energiaszint teljessé válásáig fogad elektronokat. A legtöbb nemfém oxidálószer.
Az egyszerű anyagok, amelyek nem reagálnak, mindig nulla oxidációs állapotúak.

Rizs. 1. Oxidációs állapotok táblázata.
A vegyületben egy kisebb elektronegativitású nemfém atom pozitív oxidációs állapotú.
Meghatározás
Mengyelejev periódusos rendszere segítségével meghatározhatja a maximális és minimális oxidációs állapotot (hány elektront adhat és vehet fel egy atom).
A maximális teljesítmény egyenlő annak a csoportnak a számával, amelyben az elem található, vagy a vegyértékelektronok számával. A minimális értéket a következő képlet határozza meg:
szám (csoportok) - 8.

Rizs. 2. Periódusos rendszer.
A szén a negyedik csoportba tartozik, ezért legmagasabb oxidációs foka +4, a legalacsonyabb -4. A kén maximális oxidációs foka +6, minimuma -2. A legtöbb nemfémnek mindig változó – pozitív és negatív – oxidációs állapota van. A kivétel a fluor. Oxidációs állapota mindig -1.
Emlékeztetni kell arra, hogy ez a szabály nem vonatkozik az I. és II. csoportba tartozó alkáli- és alkáliföldfémekre. Ezek a fémek állandó pozitív oxidációs állapotúak - lítium Li +1, nátrium Na +1, kálium K +1, berillium Be +2, magnézium Mg +2, kalcium Ca +2, stroncium Sr +2, bárium Ba +2. Más fémek eltérő oxidációs állapotot mutathatnak. A kivétel az alumínium. Annak ellenére, hogy a III. csoportba tartozik, oxidációs állapota mindig +3.

Rizs. 3. Alkáli- és alkáliföldfémek.
A VIII. csoportból csak a ruténium és az ozmium mutathatja a legmagasabb +8-as oxidációs állapotot. Az arany és a réz, amelyek az I. csoportba tartoznak, +3 és +2 oxidációs állapotot mutatnak.
Felvétel
Az oxidációs állapot helyes rögzítéséhez emlékeznie kell néhány szabályra:
- az inert gázok nem reagálnak, ezért oxidációs állapotuk mindig nulla;
- vegyületekben a változó oxidációs állapot a változó vegyértéktől és más elemekkel való kölcsönhatástól függ;
- a fémekkel alkotott vegyületekben a hidrogén negatív oxidációs állapotot mutat - Ca +2 H 2 -1, Na +1 H -1;
- az oxigén oxidációs állapota mindig -2, kivéve az oxigén-fluoridot és a peroxidot - O +2 F 2 -1, H 2 +1 O 2 -1.
Mit tanultunk?
Az oxidációs állapot egy feltételes érték, amely megmutatja, hogy egy elem atomja hány elektront kapott vagy adott el egy vegyületben. Az érték a vegyértékelektronok számától függ. A vegyületekben lévő fémek mindig pozitív oxidációs állapotúak, pl. restaurátorok. Az alkáli- és alkáliföldfémeknél az oxidációs állapot mindig azonos. A nemfémek a fluor kivételével pozitív és negatív oxidációs állapotot is felvehetnek.
Az oxidáció mértéke. Egy elem atomjának oxidációs állapotának meghatározása a vegyület kémiai képletével. A vegyület képletének összeállítása az elemek atomjainak ismert oxidációs foka szerint
Egy elem oxidációs állapota egy anyagban lévő atom feltételes töltése, amelyet azzal a feltételezéssel számítunk ki, hogy az ionokból áll. Az elemek oxidációs fokának meghatározásához emlékezni kell bizonyos szabályokra:
1. Az oxidációs állapot lehet pozitív, negatív vagy nulla. Ezt egy arab szám jelöli, plusz vagy mínusz jellel az elem szimbólum felett.
2. Az oxidációs állapotok meghatározásakor az anyag elektronegativitásából indulnak ki: a vegyületben lévő összes atom oxidációs állapotának összege nulla.
3. Ha a vegyületet egy elem atomjai alkotják (egy egyszerű anyagban), akkor ezen atomok oxidációs állapota nulla.
4. Egyes kémiai elemek atomjaihoz általában oxidációs állapotot rendelnek az acélhoz. Például a vegyületekben a fluor oxidációs foka mindig -1; lítium, nátrium, kálium, rubídium és cézium +1; magnézium, kalcium, stroncium, bárium és cink +2, alumínium +3.
5. A hidrogén oxidációs állapota a legtöbb vegyületben +1, és csak egyes fémekkel rendelkező vegyületekben egyenlő -1-gyel (KH, BaH2).
6. Az oxigén oxidációs foka a legtöbb vegyületben -2, és csak néhány vegyületnél van hozzárendelve -1 oxidációs fok (H2O2, Na2O2 vagy +2 (OF2).
7. Számos kémiai elem atomja változó oxidációs állapotot mutat.
8. A vegyületekben lévő fématom oxidációs állapota pozitív, és számszerűen megegyezik a vegyértékével.
9. Egy elem maximális pozitív oxidációs állapota általában megegyezik a csoportszámmal abban a periódusos rendszerben, amelyben az elem található.
10. A fémek minimális oxidációs foka nulla. A nemfémek esetében a legtöbb esetben az alacsonyabb negatív oxidációs állapot egyenlő a csoportszám és a nyolcas szám különbségével.
11. Egy atom oxidációs állapota egy egyszerű iont képez (egy atomból áll), amely egyenlő ennek az ionnak a töltésével.
A fenti szabályokat alkalmazva meghatározzuk a H2SO4 összetételében lévő kémiai elemek oxidációs fokát. Ez egy összetett anyag, amely három kémiai elemből áll - hidrogénből, kénből és oxigénből. Esetünkben ezek a hidrogén H és az oxigén O.
Határozzuk meg a kén ismeretlen oxidációs állapotát. Legyen ebben a vegyületben a kén oxidációs állapota x.
Készítsünk egyenleteket úgy, hogy minden elem indexét megszorozzuk az oxidációs állapottal, és a kivont mennyiséget egyenlővé tesszük nullával: 2 (+1) + x + 4 (-2) = 0
2 + X - 8 = 0
x = +8 - 2 = +6
Ezért a kén oxidációs állapota plusz hat.
A következő példában nézzük meg, hogyan írhat képletet egy olyan vegyületre, amelynek az elemek atomjainak oxidációs állapota ismert. Készítsük el a ferrum(III)-oxid képletét. Az "oxid" szó azt jelenti, hogy a vas szimbólumától jobbra az oxigén szimbólumát kell írni: FeO.
Jegyezze fel a kémiai elemek oxidációs állapotát a szimbólumok felett. A vas oxidációs állapota a névben zárójelben (III) van feltüntetve, tehát +3, az oxigén oxidációs állapota oxidokban -2.
Keressük meg a 3 és 2 számok legkisebb közös többszörösét, ez a 6. Osszuk el a 6-ot 3-mal, megkapjuk a 2-es számot - ez a vas indexe. A 6-ot elosztjuk 2-vel, megkapjuk a 3-at - ez az oxigén indexe.
A következő példában nézzük meg, hogyan lehet vegyületképletet megfogalmazni az elematomok és iontöltések ismert oxidációs állapotaival. Készítsünk kalcium-ortofoszfát képletet. Az „ortofoszfát” szó azt jelenti, hogy a kalcium szimbólumtól jobbra az ortofoszfátsav savmaradékát kell írni: CaPO4.
Jegyezzük fel a kalcium oxidációs állapotát (négyes szabály) és a savmaradék töltését (az oldhatósági táblázat szerint).
Keressük meg a 2 és 3 számok legkisebb közös többszörösét, ez a 6. Osszuk el a 6-ot 2-vel, megkapjuk a 3-at - ez a kalcium indexe. A 6-os számot elosztjuk 3-mal, megkapjuk a 2-es számot - ez a savmaradék indexe.
A vegyületekben lévő elemek állapotának jellemzésére bevezettük az oxidációs fok fogalmát.
MEGHATÁROZÁS
Egy adott elem atomjáról vagy egy adott elem atomjára kiszorított elektronok számát ún. oxidációs állapot.
A pozitív oxidációs állapot az adott atomról kiszorított elektronok számát, a negatív oxidációs állapot pedig az adott atom felé elmozduló elektronok számát jelzi.
Ebből a meghatározásból az következik, hogy a nem poláris kötésekkel rendelkező vegyületekben az elemek oxidációs állapota nulla. Ilyen vegyületekre példaként szolgálhatnak az azonos atomokból álló molekulák (N 2, H 2, Cl 2).
A fémek oxidációs állapota elemi állapotban nulla, mivel az elektronsűrűség eloszlása bennük egyenletes.
Az egyszerű ionos vegyületekben az alkotóelemeik oxidációs állapota megegyezik az elektromos töltéssel, mivel ezeknek a vegyületeknek a képződése során az elektronok szinte teljes átvitele megy végbe egyik atomról a másikra: Na +1 I -1, Mg +2 Cl-12, Al+3F-13, Zr+4Br-14.
A poláris kovalens kötésekkel rendelkező vegyületek elemeinek oxidációs fokának meghatározásakor összehasonlítják elektronegativitásuk értékét. Mivel a kémiai kötés kialakulása során az elektronok több elektronegatív elem atomjaira tolódnak ki, az utóbbiak negatív oxidációs állapotúak a vegyületekben.
Legmagasabb oxidációs állapot
Azon elemek esetében, amelyek vegyületeikben eltérő oxidációs állapotot mutatnak, léteznek magasabb (maximum pozitív) és alacsonyabb (minimum negatív) oxidációs állapotok fogalmai. Egy kémiai elem legmagasabb oxidációs állapota számszerűen általában egybeesik D. I. Mengyelejev periódusos rendszerének csoportszámával. Ez alól kivétel a fluor (az oxidációs állapota -1, és az elem a VIIA csoportban található), az oxigén (az oxidációs állapot +2, és az elem a VIA csoportban található), a hélium, a neon, az argon (oxidációs állapot). 0, és az elemek a VIII. csoportban találhatók), valamint a kobalt és a nikkel alcsoport elemei (az oxidációs állapot +2, az elemek pedig a VIII. csoportban találhatók), amelyekre a legmagasabb oxidációs állapotot fejezzük ki. olyan számmal, amelynek értéke kisebb, mint annak a csoportnak a száma, amelyhez tartoznak. A réz alcsoport elemei ezzel szemben egynél magasabb oxidációs állapotúak, bár az I. csoportba tartoznak (a réz és az ezüst maximális pozitív oxidációs állapota +2, arany +3).
Példák problémamegoldásra
1. PÉLDA
- A kénhidrogénben a kén oxidációs állapota (-2), és egy egyszerű anyagban - kén - 0:
A kén oxidációs állapotának változása: -2 → 0, i.e. hatodik válasz.
- Egy egyszerű anyagban - kénben - a kén oxidációs állapota 0, SO 3 -ban pedig (+6):
A kén oxidációs állapotának változása: 0 → +6, i.e. negyedik válasz.
- A kénsavban a kén oxidációs állapota (+4), egy egyszerű anyagban - kén - 0:
1×2 +x+ 3×(-2) =0;
A kén oxidációs állapotának változása: +4 → 0, i.e. harmadik válasz.
2. PÉLDA
| Gyakorlat | A III. vegyérték és az oxidációs állapot (-3) nitrogén a vegyületben: a) N 2 H 4; b) NH3; c) NH4CI; d) N 2 O 5 |
| Megoldás | Annak érdekében, hogy a feltett kérdésre helyes választ adjunk, felváltva határozzuk meg a nitrogén vegyértékét és oxidációs állapotát a javasolt vegyületekben. a) a hidrogén vegyértéke mindig egyenlő I-vel. A hidrogén vegyértékegységeinek száma összesen 4 (1 × 4 = 4). Osszuk el a kapott értéket a molekulában lévő nitrogénatomok számával: 4/2 \u003d 2, ezért a nitrogén vegyértéke II. Ez a válasz helytelen. b) a hidrogén vegyértéke mindig egyenlő I-vel. A hidrogén vegyértékegységeinek száma összesen 3 (1 × 3 = 3). A kapott értéket elosztjuk a molekulában lévő nitrogénatomok számával: 3/1 \u003d 2, ezért a nitrogén vegyértéke III. Az ammóniában lévő nitrogén oxidációs állapota (-3): Ez a helyes válasz. |
| Válasz | (b) lehetőség |