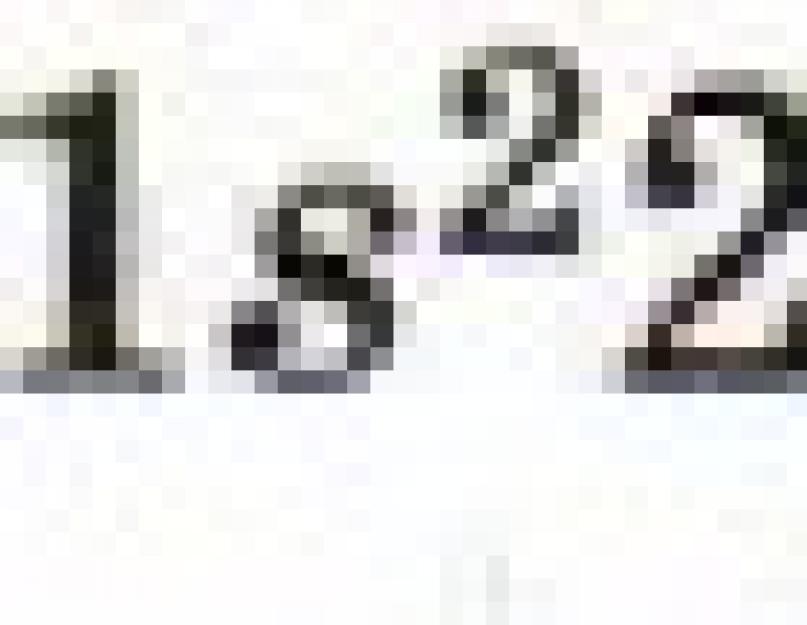Az atomban lévő elektron lehetséges állapotainak ismerete, a Klecskovszkij-szabály, a Pauli-elv és a Hund-szabály lehetővé teszi az atom elektronkonfigurációjának figyelembevételét. Ehhez elektronikus képleteket használnak.
Az elektronképlet az atomban lévő elektron állapotát jelöli, az állapotát jellemző fő kvantumszámot számmal, a pályakvantumszámot pedig betűvel jelöli. Az elektronfelhő alakját jelző betű tetejétől jobbra egy szám, amely azt jelzi, hogy hány elektron van egy adott állapotban.
Hidrogénatom esetén (n \u003d 1, l \u003d 0, m \u003d 0) az elektronikus képlet a következő lesz: 1s 1. A következő hélium He elem mindkét elektronját ugyanazok az n, l, m értékek jellemzik, és csak spinben különböznek. A hélium atom elektronképlete ls 2 . A hélium atom elektronhéja teljes és nagyon stabil. A hélium nemesgáz.
A 2. periódus elemeinél (n = 2, l = 0 vagy l = 1) először a 2s állapot töltődik ki, majd a második energiaszint p-alszintje.
A lítium atom elektronképlete: ls 2 2s 1. A 2s 1 elektron kevésbé kötődik az atommaghoz (6. ábra), így a lítium atom könnyen leadhatja (ahogy nyilván emlékszel, ezt a folyamatot oxidációnak hívják), Li + ionná alakulva.
Rizs. 6.
Az 1s és 2s elektronfelhők keresztmetszete az atommagon áthaladó sík szerint
A berillium atomban a negyedik elektron is a 2s állapotot foglalja el: ls 2 2s 2. A berillium atom két külső elektronja könnyen leválik - ebben az esetben a Be Be 2+ kationná oxidálódik.
A bóratomnak van egy elektronja 2p állapotban: ls 2 2s 2 2p 1 . Ezt követően a szén-, nitrogén-, oxigén- és fluoratomoknál (Hund-szabály szerint) a 2p alszintet töltjük fel, amely a nemesgáz neonnál ér véget: ls 2 2s 2 2p 6 .
Ha azt szeretnénk hangsúlyozni, hogy egy adott részszinten az elektronok egyenként foglalják el a kvantumcellákat, az elektronikus képletben az alszint megjelölése kíséri az indexet. Például a szénatom elektronikus képlete
![]()
A 3. periódus elemeinél a 3s-állapot (n = 3, l = 0), illetve a 3p-alszint (n = 3, l - 1) töltődik ki. A 3d-alszint (n = 3, l = 2) szabad marad:
Néha az elektronok atomokban való eloszlását ábrázoló diagramokon csak az egyes energiaszinteken lévő elektronok száma van feltüntetve, vagyis a kémiai elemek atomjainak rövidített elektronképleteit írják le, ellentétben a fent megadott teljes elektronképletekkel, például:
A nagy periódusú elemekben (4. és 5.) a Klecskovszkij-szabály szerint a külső elektronréteg első két elektronja a 4s-(n = 4, l = 0) és az 5s-állapotokat (n =) foglalja el. 5, l = 0):
Minden nagy periódus harmadik elemétől kiindulva a következő tíz elektron az előző 3d, illetve 4d alszintre lép (az oldalsó alcsoportok elemeinél):
Általános szabály, hogy az előző d-alszint kitöltésekor a külső (4p- és 5p-) p-alszint kitöltése megkezdődik:
A nagy periódusú elemek - a 6. és a nem teljes 7. - energiaszintek és alszintek általában elektronokkal vannak feltöltve: az első két elektron belép a külső s-alszintre, például:
a következő elektron (La és Ac esetén) - az előző d-alszintre:
Ezután a következő 14 elektron belép a harmadik energiaszintre kívülről a 4f- és 5f-alszintekre, a lantanidok és az aktinidák esetében:
Ekkor a második külső energiaszint (d-alszint) újra felhalmozódik az oldalsó alcsoportok elemei számára:
Csak miután a d-alszintet teljesen megtelik tíz elektronnal, a külső p-alszint újra feltöltődik:
Végezetül ismét megvizsgáljuk az elemek atomjainak elektronikus konfigurációinak megjelenítésének különböző módjait D. I. Mengyelejev táblázatának periódusai szerint.
Tekintsük az 1. periódus elemeit - hidrogént és héliumot.

Az atomok elektronikus képlete az elektronok energiaszintek és alszintek közötti eloszlását mutatja.
Az atomok grafikus elektronképlete az elektronok eloszlását nemcsak szinteken és alszinteken, hanem kvantumcellákon (atomipályákon) is bemutatja.

A hélium atomban az első elektronréteg elkészült - 2 elektronja van.
A hidrogén és a hélium s-elemek, ezeknek az atomoknak az ls-alszintjét elektronok töltik ki.
A 2. periódus minden eleménél az első elektronréteget kitöltik, és elektronok töltik ki a 2s- és 2p-állapotokat a legkisebb energia elve (először S-, majd p) és Pauli és Hund szabályai szerint. 2. táblázat).
A neonatomban elkészült a második elektronréteg - 8 elektronja van.
2. táblázat
A 2. periódusbeli elemek atomjainak elektronhéjának szerkezete


Lítium Li, berillium Be - s-elemek.
A bór B, szén C, nitrogén N, oxigén O, fluor F, neon Ne p-elemek, ezeknek az atomoknak a p-alszintjét elektronok töltik ki.
A 3. periódus elemeinek atomjainál az első és a második elektronréteg elkészül, ezért a harmadik elektronréteg kitöltődik, amelyben az elektronok elfoglalhatják a 3s, 3p és 3d állapotokat (3. táblázat).
3. táblázat
A 3. periódusbeli elemek atomjainak elektronhéjának szerkezete

A magnézium atomnál a 3-as alszint teljesül. A nátrium-nátrium és a magnézium-magnézium s-elemek.
Az alumínium és az azt követő elemek esetében a 3p alszint elektronokkal van kitöltve.
Az argonatomban a külső rétegben (a harmadik elektronrétegben) 8 elektron található. Külső rétegként teljes, de összességében a harmadik elektronrétegben, mint már tudod, 18 elektron lehet, ami azt jelenti, hogy a 3. periódus elemei üres 3d állapotúak.
Az alumínium Altól az Argon Argonig minden elem p-elem.
Az s- és p-elemek alkotják a periódusos rendszer fő alcsoportjait.
A 4. periódus elemeinek - a kálium és a kalcium - atomjainak van egy negyedik energiaszintje, a 48-as alszint ki van töltve (4. táblázat), mivel a Klecskovszkij-szabály szerint ennek kevesebb energiája van, mint a 3d-alszintnek.
4. táblázat
A 4. periódusbeli elemek atomjainak elektronhéjának szerkezete


A 4. periódus elemeinek atomjainak grafikus elektronikus képleteinek egyszerűsítésére:
A kálium-K és a kalcium-Ca a fő alcsoportokba tartozó s-elemek. A szkandium Sc-től a cink-Zn-ig terjedő atomokban a 3d alszint elektronokkal van kitöltve. Ezek 3D elemek. A másodlagos alcsoportokba tartoznak, pre-külső elektronréteggel rendelkeznek, átmeneti elemeknek nevezik őket.
Ügyeljen a króm- és rézatomok elektronhéjának szerkezetére. Ezekben egy elektron „meghibásodása” következik be a 4s-ről a 3d-alszintre, ami a kapott 3d 5 és 3d 10 elektronikus konfigurációk nagyobb energiastabilitásával magyarázható:

A cink atomban a harmadik energiaszint elkészült, benne van minden alszint - 3s, 3p és 3d, összesen 18 elektronjuk van.
A cinket követő elemekben a negyedik energiaszint, a 4p alszint töltődik tovább.
A gallium Ga-tól a Kr kriptonig terjedő elemek p-elemek.
A Kr kriptonatom külső rétege (negyedik) teljes és 8 elektronból áll. De csak a negyedik elektronrétegben, amint tudod, 32 elektron lehet; a kriptonatom 4d és 4f állapota még mindig betöltetlen.
Az 5. periódus elemeinél a Klecskovszkij-szabálynak megfelelően az alszinteket a következő sorrendben töltjük ki: 5s ⇒ 4d ⇒ 5p. És vannak kivételek is az elektronok „meghibásodásával” kapcsolatban 41 Nb, 42 Mo, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
A 6. és 7. periódusban f-elemek jelennek meg, azaz olyan elemek, amelyekben a külső harmadik energiaszint 4f-, illetve 5f-alszintje töltődik fel.
A 4f elemeket lantanidoknak nevezzük.
Az 5f-elemeket aktinidáknak nevezzük.
Elektronikus részszintek kitöltési sorrendje a 6. periódus elemeinek atomjaiban: 55 Cs és 56 Ba - bs-elemek; 57 La ...6s 2 5d 1 - 5d elem; 58 Ce - 71 Lu - 4f elemek; 72 Hf - 80 Hg - 5d elemek; 81 Tl - 86 Rn - br elemek. De még itt is vannak olyan elemek, amelyekben az energia-alszintek kitöltésének sorrendje "sérül", ami például a fél és teljesen kitöltött f-alszintek, azaz nf 7 és nf 14 nagyobb energiastabilitásával jár.
Attól függően, hogy az atom melyik alszintjét töltik meg utoljára elektronokkal, az összes elem, amint már megértette, négy elektroncsaládra vagy blokkra van osztva (7. ábra):

Rizs. 7.
A periódusos rendszer (tábla) felosztása elemblokkra
- s-elemek; az atom külső szintjének s-alszintje tele van elektronokkal; az s-elemek közé tartozik a hidrogén, a hélium és az I. és II. csoport fő alcsoportjainak elemei;
- p-elemek; az atom külső szintjének p-alszintje tele van elektronokkal; a p-elemek közé tartoznak a III-VIII csoportok fő alcsoportjainak elemei;
- d-elemek; az atom prekülső szintjének d-alszintje tele van elektronokkal; a d-elemek közé tartoznak az I-VIII csoport másodlagos alcsoportjainak elemei, vagyis az s- és p-elemek között elhelyezkedő nagy periódusok interkaláris évtizedeinek elemei. Átmeneti elemeknek is nevezik őket;
- f-elemek; az atom harmadik külső szintjének f-alszintje tele van elektronokkal; ezek közé tartoznak a lantanidok és az aktinidák.
Kérdések és feladatok a 3. §-hoz
- Készítsen diagramokat az alábbi kémiai elemek atomjainak elektronszerkezetéről, elektronképleteiről és grafikus elektronképleteiről:
- a) kalcium;
b) vas;
c) cirkónium;
d) nióbium;
e) hafnium;
e) arany. - Írja fel a 110-es elem elektronikus képletét a megfelelő nemesgáz szimbólumával!
- Mi az elektron „merülése”? Mondjon példákat azokra az elemekre, amelyekben ez a jelenség megfigyelhető, írja le elektronikus képleteiket!
- Hogyan határozható meg egy kémiai elem egy adott elektronikai családhoz való tartozása?
- Hasonlítsa össze a kénatom elektronikus és grafikus elektronképleteit! Milyen további információkat tartalmaz az utolsó képlet?
>> Kémia: Kémiai elemek atomjainak elektronikus konfigurációi
W. Pauli svájci fizikus 1925-ben megállapította, hogy egy atomban egy pályán legfeljebb két olyan elektron lehet, amelyeknek ellentétes (antiparallel) spinje van (az angol fordításban „orsó”), vagyis olyan tulajdonságokkal rendelkeznek, amelyek feltételesen úgy ábrázolható, mint egy elektron forgása képzeletbeli tengelye körül: az óramutató járásával megegyező vagy ellentétes irányba. Ezt az elvet Pauli-elvnek nevezik.
Ha egy elektron van a pályán, akkor azt párosítatlannak nevezzük, ha kettő van, akkor ezek páros elektronok, azaz ellentétes spinű elektronok.
Az 5. ábra az energiaszintek alszintekre való felosztását mutatja be.
Az s-pálya, amint azt már tudod, gömb alakú. A hidrogénatom elektronja (s = 1) ezen a pályán helyezkedik el, és nincs párosítva. Ezért az elektronikus képlete vagy elektronikus konfigurációja a következőképpen lesz írva: 1s 1. Az elektronikus képletekben az energiaszint számát a betű előtti szám jelöli (1 ...), az alszintet (pályatípust) a latin betű, és a szám, amely a jobb felső sarokban található. betű (kitevőként) mutatja az elektronok számát az alszinten.
Egy He hélium atomra, amelyen két pár elektron van ugyanazon az s-pályán, ez a képlet: 1s 2 .
A hélium atom elektronhéja teljes és nagyon stabil. A hélium nemesgáz.
A második energiaszintnek (n = 2) négy pályája van: egy s és három p. A második szintű s-pályás elektronok (2s-pályák) nagyobb energiával rendelkeznek, mivel nagyobb távolságra vannak az atommagtól, mint az 1s-pályás elektronok (n = 2).
Általánosságban elmondható, hogy minden n értékhez tartozik egy s-pálya, de ennek megfelelő mennyiségű elektronenergiája van, és ezért megfelelő átmérőjű, amely az n értékének növekedésével nő.
A p-Orbital súlyzó vagy nyolcas térfogatú. Mindhárom p-pálya az atomban egymásra merőlegesen helyezkedik el az atommagon áthúzott térbeli koordináták mentén. Ismét hangsúlyozni kell, hogy minden energiaszintnek (elektronikus rétegnek) n = 2-től kezdve három p-pályája van. Az n értékének növekedésével az elektronok az atommagtól nagy távolságra elhelyezkedő p-pályákat foglalnak el, amelyek az x, y és z tengely mentén irányulnak.
A második periódus elemeinél (n = 2) először egy β-pályát, majd három p-pályát töltünk ki. Elektronikus képlet 1l: 1s 2 2s 1. Az elektron gyengébb kötődik az atommaghoz, így a lítium atom könnyen leadhatja (ahogy nyilván emlékszel, ezt a folyamatot oxidációnak hívják), Li + ionná alakulva.
A Be 0 berillium atomban a negyedik elektron is a 2s pályán található: 1s 2 2s 2. A berillium atom két külső elektronja könnyen levál - a Be 0 Be 2+ kationná oxidálódik.
A bóratomnál az ötödik elektron 2p pályát foglal el: 1s 2 2s 2 2p 1. Továbbá a C, N, O, E atomok 2p pályákkal vannak kitöltve, ami a nemesgáz neonnal végződik: 1s 2 2s 2 2p 6.
A harmadik periódus elemeinél az Sv-, illetve az Sp-pályákat töltjük ki. A harmadik szint öt d-pályája szabadon marad:
11 Na 1s 2 2s 2 Sv1; 17C11v22822r63r5; 18Ar P^Yor^3p6.
Előfordul, hogy az elektronok atomokban való eloszlását ábrázoló diagramokon csak az egyes energiaszinteken lévő elektronok száma van feltüntetve, vagyis a kémiai elemek atomjainak rövidített elektronképleteit írják le, ellentétben a fent megadott teljes elektronképletekkel. .
A nagy periódusú elemeknél (negyedik és ötödik) az első két elektron a 4., illetve 5. pályát foglalja el: 19 K 2, 8, 8, 1; 38 Sr 2, 8, 18, 8, 2. Minden nagy periódus harmadik elemétől kiindulva a következő tíz elektron az előző 3d-, illetve 4d-pályára kerül (másodlagos alcsoportok elemei esetén): 23 V 2 , 8, 11, 2; 26 Tr 2, 8, 14, 2; 40 Zr 2, 8, 18, 10, 2; 43 Tr 2, 8, 18, 13, 2. Általános szabály, hogy az előző d-alszint kitöltésekor a külső (4p-, illetve 5p-) p-alszint kitöltése megkezdődik.
A nagy periódusú elemeknél - a hatodik és a nem teljes hetedik - az elektronikus szintek és alszintek általában elektronokkal vannak feltöltve, a következőképpen: az első két elektron a külső β-alszintre kerül: 56 Ba 2, 8, 18, 18, 8, 2; 87Gr 2, 8, 18, 32, 18, 8, 1; a következő egy elektron (Na és Ac esetén) az előzőhöz (p-alszint: 57 La 2, 8, 18, 18, 9, 2 és 89 Ac 2, 8, 18, 32, 18, 9, 2).
Ezután a következő 14 elektron kívülről a harmadik energiaszintre kerül a 4f, illetve az 5f pályán a lantanidok és az aktinidák számára.
Ezután a második külső energiaszint (d-alszint) kezd újra felépülni: a másodlagos alcsoportok elemeinél: 73 Ta 2, 8,18, 32,11, 2; 104 Rf 2, 8.18, 32, 32.10, 2, - és végül csak az aktuális szint tíz elektronjával való teljes feltöltődés után töltődik újra a külső p-alszint:
86 Rn 2, 8, 18, 32, 18, 8.
Nagyon gyakran az atomok elektronhéjának szerkezetét energia- vagy kvantumcellák segítségével ábrázolják - írják le az úgynevezett grafikus elektronikus képleteket. Ehhez a rekordhoz a következő jelölést használjuk: minden kvantumcellát egy pályának megfelelő cella jelöl; minden elektront a spin irányának megfelelő nyíl jelzi. Grafikus elektronikus képlet írásakor két szabályt kell megjegyezni: a Pauli-elvet, amely szerint egy cellában legfeljebb két elektron lehet (pályák, de antiparallel spinekkel), és F. Hund szabályát, amely szerint az elektronok szabad cellákat (pályákat) foglalnak el, ezekben helyezkednek el egyenként és ugyanakkor azonos spinértékkel rendelkeznek, és csak ezután párosulnak, de a pörgetések ebben az esetben a Pauli-elv szerint már ellentétes irányú.
Végezetül tekintsük meg még egyszer az elemek atomjainak elektronkonfigurációinak leképezését a D. I. Mengyelejev rendszer periódusaiban. Az atomok elektronszerkezetének sémái az elektronok elektronrétegek (energiaszintek) közötti eloszlását mutatják be. 
A hélium atomban az első elektronréteg elkészült - 2 elektronja van.
A hidrogén és a hélium s-elemek, ezeknek az atomoknak elektronokkal teli s-pályájuk van.
A második periódus elemei
A második periódus összes eleménél az első elektronréteget kitöltik, és az elektronok kitöltik a második elektronréteg e- és p-pályáit a legkisebb energia elve (először s-, majd p) és a szabályok szerint. Pauli és Hund (2. táblázat).
A neonatomban elkészült a második elektronréteg - 8 elektronja van.
2. táblázat A második periódus elemeinek atomjainak elektronhéjának szerkezete
A táblázat vége. 2 
Li, Be - elemekben.
B, C, N, O, F, Ne - p-elemek, ezek az atomok tele vannak elektronokkal p-pályák.
A harmadik periódus elemei
A harmadik periódus elemeinek atomjainál az első és a második elektronréteg elkészül, ezért a harmadik elektronréteg kitöltődik, amelyben az elektronok elfoglalhatják a 3s, 3p és 3d alszinteket (3. táblázat).
3. táblázat A harmadik periódus elemeinek atomjainak elektronhéjának szerkezete

A magnézium atomnál egy 3s-elektron pálya fejeződik be. Na és Mg-s elemek. 
Az argonatomban a külső rétegben (a harmadik elektronrétegben) 8 elektron található. Külső rétegként teljes, de összességében a harmadik elektronrétegben, mint már tudjátok, 18 elektron lehet, ami azt jelenti, hogy a harmadik periódus elemei kitöltetlen 3d pályákkal rendelkeznek.
Az Al-tól Ag-ig minden elem p-elem. Az s- és p-elemek alkotják a periódusos rendszer fő alcsoportjait.
A kálium és kalcium atomoknál megjelenik egy negyedik elektronréteg, és a 4s alszint kitöltődik (4. táblázat), mivel ennek energiája kisebb, mint a 3d alszint. A negyedik periódus elemeinek atomjainak grafikus elektronképleteinek egyszerűsítésére: 1) az argon feltételesen grafikus elektronképletét a következőképpen jelöljük:
Ar;
2) nem ábrázoljuk azokat az alszinteket, amelyek ezeknél az atomoknál nincsenek kitöltve.
4. táblázat A negyedik periódus elemei atomjainak elektronhéjainak szerkezete


K, Ca - a fő alcsoportokba tartozó s-elemek. Az Sc-től Zn-ig terjedő atomok esetében a 3d alszint tele van elektronokkal. Ezek 3D elemek. A másodlagos alcsoportokba tartoznak, pre-külső elektronréteggel rendelkeznek, átmeneti elemeknek nevezik őket.
Ügyeljen a króm- és rézatomok elektronhéjának szerkezetére. Ezekben egy elektron "meghibásodása" következik be a 4n-ről a 3d alszintre, ami a kapott 3d 5 és 3d 10 elektronikus konfigurációk nagyobb energiastabilitásával magyarázható: 
A cink atomban elkészül a harmadik elektronréteg - benne van az összes 3s, 3p és 3d alszint, összesen 18 elektron van rajtuk.
A cinket követő elemekben tovább töltődik a negyedik elektronréteg, a 4p részszint: A Ga-tól Kr-ig terjedő elemek p-elemek. 
A kriptonatom külső rétege (negyedik) teljes, és 8 elektronból áll. De csak a negyedik elektronrétegben, amint tudod, 32 elektron lehet; a kriptonatom 4d és 4f alszintjei még mindig kitöltetlenek.
Az ötödik periódus elemei a következő sorrendben töltik ki az alszinteket: 5s-> 4d -> 5p. És vannak kivételek is az elektronok "meghibásodásával" kapcsolatban, 41 Nb, 42 MO stb.
A hatodik és a hetedik periódusban olyan elemek jelennek meg, amelyekben a harmadik külső elektronikus réteg 4f és 5f alszintjei töltődnek fel.
A 4f elemeket lantanidoknak nevezzük.
Az 5f-elemeket aktinidáknak nevezzük.
Az elektronikus részszintek kitöltési sorrendje a hatodik periódus elemeinek atomjaiban: 55 Сs és 56 Ва - 6s-elemek;
57 La... 6s 2 5d 1 - 5d elem; 58 Ce - 71 Lu - 4f elemek; 72 Hf - 80 Hg - 5d elemek; 81 Tl- 86 Rn - 6p-elemek. De még itt is vannak olyan elemek, amelyekben az elektronikus pályák kitöltésének sorrendje „sérül”, ami például a fél és teljesen kitöltött f alszintek, azaz nf 7 és nf 14 nagyobb energiastabilitásával jár.
Attól függően, hogy az atom melyik alszintjét töltik meg utoljára elektronokkal, az összes elem, amint azt már megértette, négy elektroncsaládra vagy blokkra van osztva (7. ábra).
1) s-elemek; az atom külső szintjének β-alszintje tele van elektronokkal; az s-elemek közé tartozik a hidrogén, a hélium és az I. és II. csoport fő alcsoportjainak elemei;
2) p-elemek; az atom külső szintjének p-alszintje tele van elektronokkal; p elemek a III-VIII csoportok fő alcsoportjainak elemeit tartalmazzák;
3) d-elemek; az atom prekülső szintjének d-alszintje tele van elektronokkal; A d-elemek közé tartoznak az I-VIII csoport másodlagos alcsoportjainak elemei, vagyis az s- és p-elemek között elhelyezkedő nagy periódusok interkaláris évtizedeinek elemei. Átmeneti elemeknek is nevezik őket;
4) f-elemek, az atom harmadik külső szintjének f-alszintje tele van elektronokkal; ezek közé tartoznak a lantanidok és az aktinidák.
1. Mi történne, ha a Pauli-elvet nem tartják tiszteletben?
2. Mi történne, ha nem tartják tiszteletben Hund uralmát?
3. Készítsen diagramokat az alábbi kémiai elemek atomjainak elektronszerkezetéről, elektronképleteiről és grafikus elektronképleteiről: Ca, Fe, Zr, Sn, Nb, Hf, Ra!
4. Írja fel a 110-es elem elektronikus képletét a megfelelő nemesgáz szimbólumával!
Az óra tartalma óra összefoglalója támogatási keret óra bemutató gyorsító módszerek interaktív technológiák Gyakorlat feladatok és gyakorlatok önvizsgálat műhelyek, tréningek, esetek, küldetések házi feladat megbeszélés kérdések szónoki kérdések a tanulóktól Illusztrációk audio, videoklippek és multimédia fényképek, képek grafika, táblázatok, sémák humor, anekdoták, viccek, képregények példázatok, mondások, keresztrejtvények, idézetek Kiegészítők absztraktokat cikkek chipek érdeklődő csaló lapok tankönyvek alapvető és kiegészítő kifejezések szószedete egyéb Tankönyvek és leckék javításaa tankönyv hibáinak javítása egy töredék frissítése a tankönyvben az innováció elemei a leckében az elavult ismeretek újakkal való helyettesítése Csak tanároknak tökéletes leckék naptári terv évre a vitaprogram módszertani ajánlásai Integrált leckékW. Pauli svájci fizikus 1925-ben megállapította, hogy egy atomban egy pályán legfeljebb két olyan elektron lehet, amelyeknek ellentétes (antiparallel) spinje van (az angol fordításban „orsó”), vagyis olyan tulajdonságokkal rendelkeznek, amelyek feltételesen úgy ábrázolható, mint egy elektron forgása képzeletbeli tengelye körül: az óramutató járásával megegyező vagy ellentétes irányba. Ezt az elvet Pauli-elvnek nevezik.
Ha egy elektron van a pályán, akkor azt párosítatlannak nevezzük, ha kettő van, akkor ezek páros elektronok, azaz ellentétes spinű elektronok.
Az 5. ábra az energiaszintek alszintekre való felosztását mutatja be.
Az S-pálya, amint azt már tudod, gömb alakú. A hidrogénatom elektronja (s = 1) ezen a pályán található, és nincs párosítva. Ezért az elektronikus képlete vagy elektronikus konfigurációja a következőképpen lesz írva: 1s 1. Az elektronikus képletekben az energiaszint számát a betű előtti szám jelöli (1 ...), az alszintet (pályatípust) a latin betű, és a szám, amely a jobb felső sarokban található. betű (kitevőként) mutatja az elektronok számát az alszinten.
Egy He hélium atomra, amelyen két pár elektron van ugyanazon az s-pályán, ez a képlet: 1s 2 .
A hélium atom elektronhéja teljes és nagyon stabil. A hélium nemesgáz.
A második energiaszintnek (n = 2) négy pályája van: egy s és három p. A második szintű s-pályás elektronok (2s-pályák) nagyobb energiával rendelkeznek, mivel nagyobb távolságra vannak az atommagtól, mint az 1s-pályás elektronok (n = 2).
Általánosságban elmondható, hogy minden n értékhez tartozik egy s-pálya, de ennek megfelelő mennyiségű elektronenergiája van, és ezért megfelelő átmérőjű, amely az n értékének növekedésével nő.
Az R-pálya súlyzó vagy nyolcas formájú. Mindhárom p-pálya az atomban egymásra merőlegesen helyezkedik el az atommagon áthúzott térbeli koordináták mentén. Ismét hangsúlyozni kell, hogy minden energiaszintnek (elektronikus rétegnek) n = 2-től kezdve három p-pályája van. Az n értékének növekedésével az elektronok az atommagtól nagy távolságra elhelyezkedő p-pályákat foglalnak el, amelyek az x, y és z tengely mentén irányulnak.
A második periódus elemeinél (n = 2) először egy β-pályát, majd három p-pályát töltünk ki. Elektronikus képlet 1l: 1s 2 2s 1. Az elektron gyengébb kötődik az atommaghoz, így a lítium atom könnyen leadhatja (ahogy nyilván emlékszel, ezt a folyamatot oxidációnak hívják), Li + ionná alakulva.
A Be 0 berillium atomban a negyedik elektron is a 2s pályán található: 1s 2 2s 2. A berillium atom két külső elektronja könnyen levál - a Be 0 Be 2+ kationná oxidálódik.
A bóratomnál az ötödik elektron 2p pályát foglal el: 1s 2 2s 2 2p 1. Továbbá a C, N, O, E atomok 2p pályákkal vannak kitöltve, ami a nemesgáz neonnal végződik: 1s 2 2s 2 2p 6.
A harmadik periódus elemeinél az Sv-, illetve az Sp-pályákat töltjük ki. A harmadik szint öt d-pályája szabadon marad:
Előfordul, hogy az elektronok atomokban való eloszlását ábrázoló diagramokon csak az egyes energiaszinteken lévő elektronok száma van feltüntetve, vagyis a kémiai elemek atomjainak rövidített elektronképleteit írják le, ellentétben a fent megadott teljes elektronképletekkel. .
A nagy periódusú elemeknél (negyedik és ötödik) az első két elektron a 4., illetve 5. pályát foglalja el: 19 K 2, 8, 8, 1; 38 Sr 2, 8, 18, 8, 2. Minden nagy periódus harmadik elemétől kiindulva a következő tíz elektron az előző 3d-, illetve 4d-pályára kerül (másodlagos alcsoportok elemei esetén): 23 V 2 , 8, 11, 2; 26 Tr 2, 8, 14, 2; 40 Zr 2, 8, 18, 10, 2; 43 Tr 2, 8, 18, 13, 2. Általános szabály, hogy az előző d-alszint kitöltésekor a külső (4p-, illetve 5p-) p-alszint kitöltése megkezdődik.
A nagy periódusú elemeknél - a hatodik és a nem teljes hetedik - az elektronikus szintek és alszintek általában elektronokkal vannak feltöltve, a következőképpen: az első két elektron a külső β-alszintre kerül: 56 Ba 2, 8, 18, 18 , 8, 2; 87Gr 2, 8, 18, 32, 18, 8, 1; a következő egy elektron (Na és Ac esetén) az előzőhöz (p-alszint: 57 La 2, 8, 18, 18, 9, 2 és 89 Ac 2, 8, 18, 32, 18, 9, 2).
Ezután a következő 14 elektron kívülről a harmadik energiaszintre kerül a 4f, illetve az 5f pályán a lantanidok és az aktinidák számára.
Ezután a második külső energiaszint (d-alszint) kezd újra felépülni: a másodlagos alcsoportok elemeinél: 73 Ta 2, 8,18, 32,11, 2; 104 Rf 2, 8.18, 32, 32.10, 2 - és végül csak az aktuális szint tíz elektronnal való teljes feltöltése után töltődik újra a külső p-alszint:
86 Rn 2, 8, 18, 32, 18, 8.
Nagyon gyakran az atomok elektronhéjának szerkezetét energia- vagy kvantumcellák segítségével ábrázolják - írják le az úgynevezett grafikus elektronikus képleteket. Ehhez a rekordhoz a következő jelölést használjuk: minden kvantumcellát egy pályának megfelelő cella jelöl; minden elektront a spin irányának megfelelő nyíl jelzi. Grafikus elektronikus képlet írásakor két szabályt kell megjegyezni: a Pauli-elvet, amely szerint egy cellában legfeljebb két elektron lehet (pályák, de antiparallel spinekkel), és F. Hund szabályát, amely szerint az elektronok szabad cellákat (pályákat) foglalnak el, ezekben helyezkednek el egyenként és ugyanakkor azonos spinértékkel rendelkeznek, és csak ezután párosulnak, de a pörgetések ebben az esetben a Pauli-elv szerint már ellentétes irányú.
Végezetül tekintsük meg még egyszer az elemek atomjainak elektronkonfigurációinak leképezését a D. I. Mengyelejev rendszer periódusaiban. Az atomok elektronszerkezetének sémái az elektronok elektronrétegek (energiaszintek) közötti eloszlását mutatják be. 
A hélium atomban az első elektronréteg elkészült - 2 elektronja van.
A hidrogén és a hélium s-elemek, ezeknek az atomoknak elektronokkal teli s-pályájuk van.
A második periódus elemei
A második periódus összes eleménél az első elektronréteget kitöltik, és az elektronok kitöltik a második elektronréteg e- és p-pályáit a legkisebb energia elve (először s-, majd p) és a szabályok szerint. Pauli és Hund (2. táblázat).
A neonatomban elkészült a második elektronréteg - 8 elektronja van.
2. táblázat A második periódus elemeinek atomjainak elektronhéjának szerkezete
A táblázat vége. 2 
Li, Be β-elemek.
A B, C, N, O, F, Ne p-elemek, ezeknek az atomoknak elektronokkal teli p-pályájuk van.
A harmadik periódus elemei
A harmadik periódus elemeinek atomjainál az első és a második elektronréteg elkészül, ezért a harmadik elektronréteg kitöltődik, amelyben az elektronok elfoglalhatják a 3s, 3p és 3d alszinteket (3. táblázat).
3. táblázat A harmadik periódus elemeinek atomjainak elektronhéjának szerkezete

A magnézium atomnál egy 3s-elektron pálya fejeződik be. Na és Mg s-elemek. 
Az argonatomban a külső rétegben (a harmadik elektronrétegben) 8 elektron található. Külső rétegként teljes, de összességében a harmadik elektronrétegben, mint már tudjátok, 18 elektron lehet, ami azt jelenti, hogy a harmadik periódus elemei kitöltetlen 3d pályákkal rendelkeznek.
Al-tól Ar-ig minden elem p-elem. Az s- és p-elemek alkotják a periódusos rendszer fő alcsoportjait.
A kálium és kalcium atomoknál megjelenik egy negyedik elektronréteg, és a 4s alszint kitöltődik (4. táblázat), mivel ennek energiája kisebb, mint a 3d alszint. A negyedik periódus elemeinek atomjainak grafikus elektronképleteinek egyszerűsítésére: 1) az argon feltételesen grafikus elektronképletét a következőképpen jelöljük:
Ar;
2) nem ábrázoljuk azokat az alszinteket, amelyek ezeknél az atomoknál nincsenek kitöltve.
4. táblázat A negyedik periódus elemei atomjainak elektronhéjainak szerkezete


K, Ca - a fő alcsoportokba tartozó s-elemek. Az Sc-től Zn-ig terjedő atomok esetében a 3d alszint tele van elektronokkal. Ezek 3D elemek. A másodlagos alcsoportokba tartoznak, pre-külső elektronréteggel rendelkeznek, átmeneti elemeknek nevezik őket.
Ügyeljen a króm- és rézatomok elektronhéjának szerkezetére. Ezekben egy elektron "meghibásodása" következik be a 4n-ről a 3d alszintre, ami a kapott 3d 5 és 3d 10 elektronikus konfigurációk nagyobb energiastabilitásával magyarázható: 
A cink atomban elkészült a harmadik elektronréteg - benne van az összes 3s, 3p és 3d alszint, összesen 18 elektron van rajtuk.
A cinket követő elemekben a negyedik elektronréteg, a 4p alszint töltődik tovább: A Ga-tól Kr-ig terjedő elemek p-elemek. 
A kriptonatom külső rétege (negyedik) teljes, és 8 elektronból áll. De csak a negyedik elektronrétegben, amint tudod, 32 elektron lehet; a kriptonatom 4d és 4f alszintjei még mindig kitöltetlenek.
Az ötödik periódus elemei a következő sorrendben töltik ki az alszinteket: 5s-> 4d -> 5p. És vannak kivételek is az elektronok "meghibásodásával" kapcsolatban, 41 Nb, 42 MO stb.
A hatodik és a hetedik periódusban olyan elemek jelennek meg, amelyekben a harmadik külső elektronikus réteg 4f és 5f alszintjei töltődnek fel.
A 4f elemeket lantanidoknak nevezzük.
Az 5f-elemeket aktinidáknak nevezzük.
Az elektronikus részszintek kitöltési sorrendje a hatodik periódus elemeinek atomjaiban: 55 Сs és 56 Ва - 6s-elemek;
57 La... 6s 2 5d 1 - 5d elem; 58 Ce - 71 Lu - 4f elemek; 72 Hf - 80 Hg - 5d elemek; 81 Tl - 86 Rn - 6p elemek. De még itt is vannak olyan elemek, amelyekben az elektronikus pályák kitöltésének sorrendje „sérül”, ami például a fél és teljesen kitöltött f alszintek, azaz nf 7 és nf 14 nagyobb energiastabilitásával jár.
Attól függően, hogy az atom melyik alszintjét töltik meg utoljára elektronokkal, az összes elem, amint azt már megértette, négy elektroncsaládra vagy blokkra van osztva (7. ábra).
1) s-elemek; az atom külső szintjének β-alszintje tele van elektronokkal; az s-elemek közé tartozik a hidrogén, a hélium és az I. és II. csoport fő alcsoportjainak elemei;
2) p-elemek; az atom külső szintjének p-alszintje tele van elektronokkal; p elemek a III-VIII csoportok fő alcsoportjainak elemeit tartalmazzák;
3) d-elemek; az atom prekülső szintjének d-alszintje tele van elektronokkal; A d-elemek az I-VIII csoport másodlagos alcsoportjainak elemeit tartalmazzák, vagyis az s- és p-elemek között elhelyezkedő nagy periódusok évtizedes interkalált elemeit. Átmeneti elemeknek is nevezik őket;
4) f-elemek, az atom harmadik külső szintjének f-alszintje tele van elektronokkal; ezek közé tartoznak a lantanidok és az aktinidák.
1. Mi történne, ha a Pauli-elvet nem tartják tiszteletben?
2. Mi történne, ha nem tartják tiszteletben Hund uralmát?
3. Készítsen diagramokat az alábbi kémiai elemek atomjainak elektronszerkezetéről, elektronképleteiről és grafikus elektronképleteiről: Ca, Fe, Zr, Sn, Nb, Hf, Ra!
4. Írja fel a 110-es elem elektronikus képletét a megfelelő nemesgáz szimbólumával!
5. Mi az elektron „meghibásodása”? Mondjon példákat azokra az elemekre, amelyekben ez a jelenség megfigyelhető, írja le elektronikus képleteiket!
6. Hogyan határozható meg egy kémiai elem egyik vagy másik elektronikai családhoz való tartozása?
7. Hasonlítsa össze a kénatom elektronikus és grafikus elektronképleteit! Milyen további információkat tartalmaz az utolsó képlet?
6.6. A króm, réz és néhány más elem atomjainak elektronikus szerkezetének jellemzői
Ha figyelmesen megnézte a 4. függeléket, valószínűleg észrevette, hogy egyes elemek atomjainál megsérül a pályák elektronokkal való feltöltésének sorrendje. Néha ezeket a jogsértéseket "kivételnek" nevezik, de ez nem így van - a természet törvényei alól nincs kivétel!
Az első ilyen megsértéssel rendelkező elem a króm. Tekintsük részletesebben az elektronikus szerkezetét (6.16. ábra). a). A króm atom 4 s-alszint nem kettő, ahogy az várható, hanem csak egy elektron. De 3-ért d-alszint öt elektron, de ez az alszint 4 után töltődik be s-alszint (lásd 6.4. ábra). Hogy megértsük, miért történik ez, nézzük meg, mik az elektronfelhők 3 d ennek az atomnak a szintje.
Mind az öt 3 d-felhőket ebben az esetben egy elektron alkotja. Amint azt e fejezet 4. §-ából már tudja, ennek az öt elektronnak a közös elektronfelhője gömb alakú, vagy ahogy mondani szokás, gömbszimmetrikus. A különböző irányú elektronsűrűség-eloszlás természeténél fogva hasonló az 1-hez s-EO. Annak az alszintnek az energiája, amelynek elektronjai ilyen felhőt alkotnak, alacsonyabbnak bizonyul, mint egy kevésbé szimmetrikus felhő esetében. Ebben az esetben a 3-as pályák energiája d-alszint egyenlő a 4-es energiával s-pályák. Ha a szimmetria megtörik, például amikor megjelenik a hatodik elektron, a pályák energiája 3 d Az alszint ismét több lesz, mint az energia 4 s-pályák. Ezért a mangán atomnak ismét van egy második elektronja 4-hez s-AO.
A gömbszimmetriának van egy közös felhője bármely alszintről, amely félig és teljesen elektronokkal van tele. Az energiacsökkenés ezekben az esetekben általános jellegű, és nem függ attól, hogy valamelyik részszint félig vagy teljesen tele van-e elektronokkal. És ha igen, akkor az atomban kell keresnünk a következő sértést, amelynek elektronhéjában a kilencedik „jön” utoljára d-elektron. Valójában a rézatomnak 3 van d-alszint 10 elektron, és 4 s- csak egy alszint van (6.16. ábra b).
A teljesen vagy félig kitöltött alszint pályáinak energiájának csökkenése számos fontos kémiai jelenség oka, amelyek közül néhányat megismerhetsz.
6.7. Külső és vegyértékelektronok, pályák és alszintek
A kémiában az izolált atomok tulajdonságait általában nem tanulmányozzák, mivel szinte minden atom, amely különféle anyagok része, kémiai kötéseket képez. Az atomok elektronhéjának kölcsönhatása során kémiai kötések jönnek létre. Az összes atom esetében (a hidrogén kivételével) nem minden elektron vesz részt a kémiai kötések kialakításában: a bór esetében öt elektronból három, a szén esetében hatból négy, és például a báriumnál kettő az ötvenből. hat. Ezeket az „aktív” elektronokat nevezzük vegyérték elektronok.
Néha a vegyértékelektronokat összetévesztik külső elektronok, de ezek nem ugyanazok.
A külső elektronok elektronfelhőinek a legnagyobb sugara (és a főkvantumszám maximális értéke).

A kötések kialakításában elsősorban a külső elektronok vesznek részt, már csak azért is, mert az atomok egymáshoz közeledésekor elsősorban az ezekből az elektronokból képzett elektronfelhők érintkeznek. De velük együtt az elektronok egy része is részt vehet a kötés kialakításában. pre-külső(utolsó előtti) réteg, de csak akkor, ha energiájuk nem sokban különbözik a külső elektronok energiájától. Mind ezek, mind az atom többi elektronja vegyérték. (A lantanidokban és aktinidákban még néhány "külső előtti" elektron is vegyérték)
A vegyértékelektronok energiája sokkal nagyobb, mint az atom többi elektronjának energiája, és a vegyértékelektronok energiájában sokkal kevésbé különböznek egymástól.
A külső elektronok mindig csak akkor vegyértékek, ha az atom egyáltalán képes kémiai kötéseket kialakítani. Tehát a hélium atom mindkét elektronja külső, de nem nevezhető vegyértéknek, mivel a hélium atom egyáltalán nem képez kémiai kötéseket.
A vegyértékelektronok elfoglalják vegyértékpályák, ami viszont formál vegyérték-alszintek.

Példaként vegyünk egy vasatomot, amelynek elektronikus konfigurációja az 1. ábrán látható. 6.17. A vasatom elektronjai közül a legnagyobb főkvantumszám ( n= 4) csak kettő 4 van s-elektron. Ezért ezek ennek az atomnak a külső elektronjai. A vasatom külső pályái mind olyan pályák, amelyekkel n= 4, és a külső alszintek mindazok az alszintek, amelyeket ezek a pályák alkotnak, azaz 4 s-,
4p-, 4d- és 4 f-EPU.
A külső elektronok mindig vegyértékek, ezért 4 s-a vasatom elektronjai vegyértékelektronok. És ha igen, akkor 3 d-a valamivel nagyobb energiájú elektronok is vegyértékek lesznek. A vasatom külső szintjén a kitöltött 4 mellett s-AO még mindig van ingyenes 4 p-, 4d- és 4 f-AO. Mindegyik külső, de csak 4 vegyérték R-AO, mivel a fennmaradó pályák energiája sokkal nagyobb, és az elektronok megjelenése ezeken a pályákon nem előnyös a vasatom számára.
Tehát a vasatom
külső elektronikus szint - a negyedik,
külső alszintek - 4 s-, 4p-, 4d- és 4 f-EPU,
külső pályák - 4 s-, 4p-, 4d- és 4 f-AO,
külső elektronok - két 4 s-elektron (4 s 2),
a külső elektronréteg a negyedik,
külső elektronfelhő - 4 s-EO
vegyérték-alszintek - 4 s-, 4p- és 3 d-EPU,
vegyértékpályák - 4 s-, 4p- és 3 d-AO,
vegyértékelektronok - két 4 s-elektron (4 s 2) és hat 3 d- elektronok (3 d 6).
A vegyérték-alszintek részben vagy teljesen kitölthetők elektronokkal, vagy egyáltalán szabadok maradhatnak. Az atommag töltésének növekedésével az összes részszint energiaértéke csökken, de az elektronok egymás közötti kölcsönhatása miatt a különböző részszintek energiája különböző "sebességgel" csökken. A teljesen feltöltött energia d- és f-alszintek annyira lecsökkennek, hogy megszűnnek vegyértéknek lenni.
Példaként vegyük a titán és az arzén atomját (6.18. ábra).

A titán atom esetében 3 d-Az EPU csak részben van tele elektronokkal, és energiája nagyobb, mint a 4 energiája s-EPU és 3 d- az elektronok vegyértékek. Az arzén atomnál 3 d-Az EPU teljesen tele van elektronokkal, és energiája sokkal kisebb, mint a 4 s-EPU, és ezért 3 d-Az elektronok nem vegyértékek.
Ezekben a példákban elemeztük vegyérték elektronikus konfiguráció titán és arzén atomok.
Egy atom vegyértékelektronikus konfigurációját a következőképpen ábrázoljuk vegyérték elektronikus képlet, vagy formában vegyérték-alszintek energiadiagramja.
VALENCE ELEKTRONOK, KÜLSŐ ELEKTRONOK, VALENCE EPU, VALENCE AO, VALENCE ELECTRON AZ ATOM KONFIGURÁLÁSA, VALENCE ELEKTRON FORMULA, VALENCE ALSZINT DIAGRAM.
1. Az Ön által összeállított energiadiagramokon és a Na, Mg, Al, Si, P, S, Cl, Ar atomok teljes elektronképleteiben jelölje meg a külső és vegyértékelektronokat. Írd fel ezen atomok vegyértékelektronikai képleteit! Az energiadiagramokon jelölje ki a vegyérték-alszintek energiadiagramjainak megfelelő részeket!
2. Mi a közös az atomok elektronkonfigurációi között a) Li és Na, B és Al, O és S, Ne és Ar; b) Zn és Mg, Sc és Al, Cr és S, Ti és Si; c) H és He, Li és O, K és Kr, Sc és Ga. Mi a különbség köztük
3. Hány vegyérték részszint van az egyes elemek atomjának elektronhéjában: a) hidrogén, hélium és lítium, b) nitrogén, nátrium és kén, c) kálium, kobalt és germánium
4. Hány vegyértékpálya van teljesen kitöltve a) bór, b) fluor, c) nátrium atomján?
5. Hány párosítatlan elektronnal rendelkező pályája van egy atomnak a) bórja, b) fluorja, c) vasa
6. Hány szabad külső pályája van egy mangánatomnak? Hány szabad vegyérték?
7. A következő leckéhez készítsen elő egy 20 mm széles papírcsíkot, ossza fel cellákra (20 × 20 mm), és alkalmazzon természetes elemek sorozatát erre a csíkra (hidrogéntől a meitneriumig).
8. Minden cellába helyezze el az elem szimbólumát, sorozatszámát és a vegyérték-elektronikus képletet, ahogy az a 1. ábrán látható. 6.19 (használja a 4. mellékletet).

6.8. Az atomok rendszerezése elektronhéjaik szerkezete szerint
A kémiai elemek rendszerezése az elemek természetes sorozatán alapul
és az elektronhéjak hasonlóságának elve az atomjaikat.
Már ismeri a kémiai elemek természetes körét. Most ismerkedjünk meg az elektronhéjak hasonlóságának elvével.
Figyelembe véve az atomok vegyértékelektronikus képleteit az NRE-ben, könnyen megállapítható, hogy egyes atomok esetében csak a fő kvantumszám értékében különböznek. Például 1 s 1 a hidrogénhez, 2 s 1 a lítiumhoz, 3 s 1 a nátriumhoz stb. Vagy 2 s 2 2p 5 a fluor esetében, 3 s 2 3p 5 a klórra, 4 s 2 4p Ez azt jelenti, hogy az ilyen atomok vegyértékelektronjainak felhőinek külső tartományai alakjukban nagyon hasonlóak, és csak méretükben (és természetesen az elektronsűrűségben) különböznek egymástól. És ha igen, akkor az ilyen atomok elektronfelhőit és a hozzájuk tartozó vegyértékkonfigurációkat nevezhetjük hasonló. Különböző elemek hasonló elektronikus konfigurációjú atomjaira írhatunk közös vegyértékelektronikus képletek: ns 1 az első esetben és ns 2 np 5 a másodikban. A természetes elemsorok mentén haladva más, hasonló vegyértékkonfigurációjú atomcsoportokat találhatunk.
Ily módon az elemek természetes sorozatában rendszeresen előfordulnak hasonló vegyértékelektronikus konfigurációjú atomok.
Ez az elektronhéjak hasonlóságának elve.
Próbáljuk meg feltárni ennek a szabályszerűségnek a formáját. Ehhez az Ön által készített természetes elemsorokat fogjuk használni.

Az NRE a hidrogénnel kezdődik, amelynek vegyérték-elektronikus képlete 1 s egy . Hasonló vegyérték-konfigurációkat keresve közös vegyérték-elektronikus képlettel vágjuk az elemek elé az elemek természetes sorozatát ns 1 (vagyis a lítium előtt, a nátrium előtt stb.). Az elemek úgynevezett "periódusait" kaptuk. Adjuk össze a kapott „pontokat”, hogy táblázatsorokká váljanak (lásd 6.20. ábra). Ennek eredményeként csak a táblázat első két oszlopának atomjai lesznek ilyen elektronikus konfigurációk.
Próbáljuk meg elérni a vegyértékelektronikai konfigurációk hasonlóságát a táblázat többi oszlopában. Ehhez a 6. és 7. periódusból 58 - 71 és 90 -103 számú elemeket vágunk ki (4 f- és 5 f-alszintek), és helyezze őket az asztal alá. A fennmaradó elemek szimbólumai vízszintesen eltolódnak az ábrán látható módon. Ezt követően a táblázat ugyanazon oszlopában lévő elemek atomjai hasonló vegyértékkonfigurációval rendelkeznek, amelyet általános vegyértékelektronikai képletekkel fejezhetünk ki: ns 1 , ns 2 , ns 2 (n–1)d 1 , ns 2 (n–1)d 2 és így tovább, amíg ns 2 np 6. Az általános vegyértékképletektől való minden eltérést ugyanazok az okok magyarázzák, mint a króm és a réz esetében (lásd a 6.6. bekezdést).
Mint látható, az NRE segítségével és az elektronhéjak hasonlóságának elvét alkalmazva sikerült rendszerezni a kémiai elemeket. A kémiai elemek ilyen rendszerét ún természetes, mivel kizárólag a természet törvényein alapul. A kapott táblázat (6.21. ábra) a természetes elemrendszer grafikus ábrázolásának egyik módja, és az ún. kémiai elemek hosszú periódustáblázata.

AZ ELEKTRONIKUS HÉJOK HASONLÓSÁGÁNAK ELVE, A VEGYI ELEMEK TERMÉSZETES RENDSZERE ("PERIODIKUS" RENDSZER), KÉMIAI ELEMEK TÁBLÁZATA.
6.9. Kémiai elemek hosszú periódusos táblázata
Ismerkedjünk meg részletesebben a kémiai elemek hosszú periódusú táblázatának felépítésével.
A táblázat sorait, amint azt már tudja, az elemek "periódusainak" nevezik. A pontokat arab számokkal 1-től 7-ig számozzuk. Az első pontban csak két elem található. A második és harmadik periódus, amelyek mindegyike nyolc elemet tartalmaz, ún rövid időszakokban. A negyedik és ötödik periódus, amelyek mindegyike 18 elemet tartalmaz, ún hosszú időszakokban. Az egyenként 32 elemet tartalmazó hatodik és hetedik periódusokat hívjuk extra hosszú időszakokban.
Ennek a táblázatnak az oszlopait ún csoportok elemeket. A csoportszámokat római számok és latin A vagy B betűk jelzik.
Egyes csoportok elemeinek saját közös (csoport)nevük van: az IA csoport elemei (Li, Na, K, Rb, Cs, Fr) - lúgos elemek(vagy alkálifém elemek); IIA csoport elemei (Ca, Sr, Ba és Ra) - alkáliföldfém elemek(vagy alkáliföldfém elemek)(az "alkálifémek" és az alkáliföldfémek" elnevezések az adott elemekből képzett egyszerű anyagokra utalnak, és nem használhatók elemcsoportok megnevezéseként); VIA-elemek csoportja (O, S, Se, Te, Po) - kalkogéneket, a VIIA csoport elemei (F, Cl, Br, I, At) – halogének, a VIIIA csoport elemei (He, Ne, Ar, Kr, Xe, Rn) – nemesgáz elemek.(A hagyományos "nemesgázok" elnevezés az egyszerű anyagokra is vonatkozik)
Az általában az 58 - 71 (Ce - Lu) sorszámú táblázat alsó részében elhelyezett elemeket ún. lantanidok("lantán után"), és a 90-103 sorozatszámú elemek (Th - Lr) - aktinidák(„aktinium nyomán”). A hosszú periódusú táblázatnak létezik egy olyan változata, amelyben a lantanidok és aktinidák nem vágódnak ki az NRE-ből, hanem extra hosszú periódusokban a helyükön maradnak. Ezt a táblázatot néha úgy hívják extra hosszú időszak.
A hosszú periódusos táblázat négy részre oszlik Blokk(vagy szakaszok).
s-blokk tartalmazza az IA és IIA csoportok elemeit közös vegyértékelektronikai képletekkel ns 1 és ns 2
(s-elemek).
p-blokk magában foglalja a IIIA–VIIIA csoportba tartozó elemeket, amelyek általános vegyértékelektronikai képletei a következőktől származnak ns 2 np 1-től ns 2 np 6 (p-elemek).
d-blokk magában foglalja a IIIB-től a IIB-ig terjedő elemeket, általános vegyérték-elektronikus képletekkel ns 2 (n–1)d 1-től ns 2 (n–1)d 10 (d-elemek).
f-blokk magában foglalja a lantanidokat és az aktinidákat ( f-elemek).

Elemek s- és p-blokkok alkotnak A-csoportokat, és elemeket d-blokk - kémiai elemrendszer B-csoportja. Összes f-elemek formálisan a IIIB csoportba tartoznak.
Az első periódus elemei - hidrogén és hélium - az s-elemek, és IA és IIA csoportokba helyezhetők. De a hélium gyakrabban kerül a VIIIA csoportba, mint az az elem, amellyel az időszak véget ér, ami teljes mértékben összhangban van tulajdonságaival (a hélium, mint minden más egyszerű anyag, amelyet e csoport elemei alkotnak, nemesgáz). A hidrogént gyakran a VIIA csoportba sorolják, mivel tulajdonságai sokkal közelebb állnak a halogénekhez, mint a lúgos elemekhez.
A rendszer minden periódusa olyan elemmel kezdődik, amely atomokból álló vegyértékkonfigurációval rendelkezik ns 1 , mivel ezektől az atomoktól kezdődik a következő elektronréteg kialakulása, és az atomok vegyértékkonfigurációjú elemével ér véget. ns 2 np 6 (az első időszak kivételével). Ez megkönnyíti az energiadiagramon az egyes periódusok atomjainál elektronokkal feltöltött részszintcsoportok azonosítását (6.22. ábra). Végezze el ezt a munkát a 6.4. ábra másolatában látható összes alszinttel. A 6.22 ábrán kiemelt alszintek (kivéve a teljesen kitöltött d- és f-alszintek) egy adott periódus összes elemének atomjainak vegyértékei.
Megjelenés időszakokban s-, p-, d- vagy f-az elemek teljes mértékben összhangban vannak a kitöltés sorrendjével s-, p-, d- vagy f- az elektronok alszintjei. Az elemrendszernek ez a tulajdonsága lehetővé teszi, hogy az adott elemet magában foglaló periódus és csoport ismeretében azonnal leírjuk a vegyértékelektronikus képletét.
KÉMIAI ELEMEK, BLOKKOK, IDŐSZAKOK, CSOPORTOK, ALKULIS ELEMEK, ALUKÁLIS FÖLDELEMEK, KALKOGÉNEK, HALOGÉNEK, NEMESGÁZELEMEK, LANTHANOIDOK, AKTINOIDOK HOSSZÚ PIDÓDÚ TÁBLÁZATA.
Írja fel az a) IVA és IVB csoportok, b) IIIA és VIIB csoportok atomjainak általános vegyértékelektronikai képleteit?
2. Mi a közös az A és B csoport atomjainak elektronkonfigurációi között? Miben különböznek egymástól?
3. Hány elemcsoportot tartalmaz a) s-blokk, b) R-blokk, c) d-Blokk?
4. Folytassa a 30. ábrát az alszintek energiájának növelése irányába, és válassza ki azokat a részszintek csoportjait, amelyek a 4., 5. és 6. periódusban tele vannak elektronokkal.
5. Sorolja fel az a) kalcium, b) foszfor, c) titán, d) klór, e) nátrium atomok vegyértékrészeit! 6. Fogalmazza meg, hogyan különböznek egymástól az s-, p- és d-elemek!
7. Magyarázza meg, miért tartozik egy atom bármely elemhez, azt az atommagban lévő protonok száma határozza meg, nem pedig az atom tömege.
8. Lítium-, alumínium-, stroncium-, szelén-, vas- és ólomatomokhoz készítsen vegyértéket, töltse ki és rövidítse meg az elektronikus képleteket, és rajzolja meg a vegyérték-alszintek energiadiagramjait. 9. Az atomok, amelyek elemei megfelelnek a következő vegyértékelektronikai képleteknek: 3 s 1 , 4s 1 3d 1 , 2s 2 2 p 6 , 5s 2 5p 2 , 5s 2 4d 2 ?
6.10. Az atom elektronképleteinek típusai. Az összeállításuk algoritmusa
Különböző célokra tudnunk kell egy atom teljes vagy vegyértékkonfigurációját. Ezen elektronikus konfigurációk mindegyike egy képlettel és egy energiadiagrammal is ábrázolható. vagyis egy atom teljes elektronikus konfigurációja kifejezve az atom teljes elektronikus képlete, vagy egy atom teljes energiadiagramja. viszont egy atom vegyértékelektron konfigurációja kifejezve vegyérték(vagy ahogy gyakran nevezik, rövid") az atom elektronikus képlete, vagy egy atom vegyérték-alszintjeinek diagramja(6.23. ábra).

Korábban az elemek sorszámainak felhasználásával készítettünk atomok elektronikus képleteit. Ezzel egyidejűleg az energiadiagram alapján meghatároztuk a részszintek elektronokkal való kitöltésének sorrendjét: 1 s, 2s,
2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p,
6s, 4f, 5d, 6p, 7s stb. És csak a teljes elektronikus képlet felírásával tudtuk felírni a vegyértékképletet is.
Kényelmesebb az atom leggyakrabban használt vegyértékelektronikus képletét az elemnek a kémiai elemek rendszerében elfoglalt helyzete alapján a perióduscsoport-koordináták szerint felírni.
Nézzük meg részletesen, hogyan történik ez az elemek esetében s-, p- és d-blokkok.
Elemekhez s-blokk vegyérték elektronikus képlete egy atom három karakterből áll. Általában így írható:
Az első helyen (egy nagy cella helyén) a periódusszám áll (egyenlő ezek fő kvantumszámával s-elektronok), a harmadikon (a felső indexben) - a csoport száma (egyenlő a vegyértékelektronok számával). Példaként egy magnéziumatomot (3. periódus, IIA csoport) kapunk:
Elemekhez p-egy atom blokk vegyérték-elektronikus képlete hat karakterből áll:
![]()
Itt a nagy cellák helyére a periódusszám is kerül (ezek fő kvantumszámával egyenlő s- és p-elektronok), és a csoportszám (amely megegyezik a vegyértékelektronok számával) egyenlőnek bizonyul a felső indexek összegével. Az oxigénatomra (2. periódus, VIA csoport) kapjuk:
2s 2 2p 4 .
A legtöbb elem vegyérték-elektronikus képlete d blokkot így írhatjuk fel:
A korábbi esetekhez hasonlóan itt is az első cella helyett a periódusszám kerül (amely megegyezik ezek fő kvantumszámával s-elektronok). A második cellában lévő szám eggyel kisebbnek bizonyul, mivel ezek fő kvantumszáma d-elektronok. A csoportszám itt is egyenlő az indexek összegével. Példa erre a titán vegyértékelektronikus képlete (4. periódus, IVB csoport): 4 s 2 3d 2 .
A csoportszám megegyezik az indexek összegével és a VIB csoport elemeinek összegével, de ezek, mint emlékszel, a vegyértéken s-alszintnek csak egy elektronja van, és az általános vegyértékelektronikus képlet ns 1 (n–1)d 5. Ezért például a molibdén vegyértékelektronikus képlete (5. periódus) 5 s 1 4d 5 .
Az IB csoport bármely eleméről, például aranyról is könnyű vegyértékelektronikus képletet készíteni (6. periódus)>–>6 s 1 5d 10 , de ebben az esetben emlékeznie kell erre d- e csoport elemeinek atomjainak elektronjai továbbra is vegyértékek maradnak, és egy részük részt vehet a kémiai kötések kialakításában.
A IIB csoportba tartozó elemek atomjainak általános vegyértékelektronikai képlete: ns 2 (n – 1)d tíz . Ezért például egy cinkatom vegyértékelektronikus képlete 4 s 2 3d 10 .
Az első triád elemeinek (Fe, Co és Ni) vegyértékelektronikai képletei is betartják az általános szabályokat. A vas, a VIIIB csoport egyik eleme, vegyértékelektronikus képlete 4 s 2 3d 6. A kobalt atomnak van egy d-elektron több (4 s 2 3d 7), míg a nikkel atomnak kettő (4 s 2 3d 8).
Csak ezeket a szabályokat használva a vegyértékelektronikus képletek írásához, lehetetlen egyesek atomjainak elektronképleteit összeállítani d-elemek (Nb, Ru, Rh, Pd, Ir, Pt), hiszen bennük az erősen szimmetrikus elektronhéjakra való hajlam miatt a vegyérték-alszintek elektronokkal való kitöltése további jellemzőkkel bír.
A vegyértékelektronikus képlet ismeretében az atom teljes elektronképletét is fel lehet írni (lásd alább).
Gyakran a nehézkes teljes elektronikus képletek helyett leírnak rövidített elektronikus képletek atomok. Az elektronikus képletbe való összeállításukhoz az atom összes elektronját a vegyértékek kivételével kiválasztjuk, jeleiket szögletes zárójelbe helyezzük, és az elektronképletnek azt a részét, amely megfelel az előző utolsó eleme atomjának elektronképletének. periódus (a nemesgázt alkotó elem) helyébe ennek az atomnak a szimbóluma lép.
Különböző típusú elektronikus képletek példái a 14. táblázatban láthatók.
14. táblázat Példák az atomok elektronképleteire
Elektronikus képletek |
|||
rövidítve |
Vegyérték |
||
1s 2 2s 2 2p 3 |
2s 2 2p 3 |
2s 2 2p 3 |
|
1s 2 2s 2 2p 6 3s 2 3p 5 |
3s 2 3p 5 |
3s 2 3p 5 |
|
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 |
4s 2 3d 5 |
4s 2 3d 5 |
|
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 |
4s 2 4p 3 |
4s 2 4p 3 |
|
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 |
4s 2 4p 6 |
4s 2 4p 6 |
|
Algoritmus az atomok elektronikus képleteinek összeállítására (jódatom példáján)
№ |
Művelet |
Eredmény |
|
Határozza meg az atom koordinátáit az elemtáblázatban! |
5. időszak, VIIA csoport |
||
Írd fel az elektronikus vegyértékképletet! |
5s 2 5p 5 |
||
Adja hozzá a belső elektronok szimbólumait abban a sorrendben, ahogyan kitöltik az alszinteket. |
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 |
||
Figyelembe véve a teljesen feltöltött energia csökkenését d- és f- alszinteket, írja le a teljes elektronikus képletet. |
|
||
Jelölje meg a vegyértékelektronokat. |
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 |
||
Válassza ki az előző nemesgázatom elektronikus konfigurációját. |
|||
Írja le a rövidített elektronikus képletet, szögletes zárójelbe írva az összeset nem vegyértékű elektronok. |
5s 2 5p 5 |
Megjegyzések
1. A 2. és 3. periódus elemeinél a harmadik művelet (a negyedik nélkül) azonnal egy teljes elektronikus képlethez vezet.
2. (n – 1)d 10 - Az elektronok vegyértékben maradnak az IB csoport elemeinek atomjainál.
TELJES ELEKTRONIKUS KÉPLET, VALENCE ELEKTRONIKUS FORMULA, rövidítve ELEKTRONIKUS FORMULA, ALGORITMUS AZ ATOMOK ELEKTRONIKUS KÉPLETÉNEK ÖSSZEÁLLÍTÁSÁRA.
1. Állítsa össze az elem atomjának vegyértékelektronikus képletét a) a harmadik A csoport második periódusa, b) a második A csoport harmadik periódusa, c) a negyedik A csoport negyedik periódusa!
2. Készítsen rövidített elektronikus képleteket magnézium-, foszfor-, kálium-, vas-, bróm- és argonatomokból.
6.11. Kémiai elemek rövid időszaki táblázata
Az elemek természetes rendszerének felfedezése óta eltelt több mint 100 év során több száz legkülönfélébb táblázatot javasoltak, amelyek grafikusan tükrözik ezt a rendszert. Ezek közül a hosszú periódusú táblázat mellett a legelterjedtebben D. I. Mengyelejev elemeinek úgynevezett rövid periódusú táblázatát használják. Rövid periódusú táblázatot kapunk egy hosszú periódusú táblázatból, ha a 4., 5., 6. és 7. periódusokat az IB csoport elemei előtt kivágjuk, széthúzzuk, és az így kapott sorokat ugyanúgy hozzáadjuk. hozzáadta az előző időszakokat. Az eredmény a 6.24. ábrán látható.

A lantanidok és aktinidák itt is a főasztal alá kerülnek.
NÁL NÉL csoportok ez a táblázat olyan elemeket tartalmaz, amelyek atomjai rendelkeznek ugyanannyi vegyértékelektron nem számít, milyen pályákon vannak ezek az elektronok. Tehát a klór elemek (egy tipikus elem, amely nemfémet képez; 3 s 2 3p 5) és mangán (fémképző elem; 4 s 2 3d 5), amelyek nem rendelkeznek az elektronhéjak hasonlóságával, ugyanabba a hetedik csoportba tartoznak. Az ilyen elemek megkülönböztetésének szükségessége szükségessé teszi a csoportok elkülönítését alcsoportok: fő-- a hosszú periódusú táblázat A-csoportjainak analógjai és mellékhatások a B-csoport analógjai. A 34. ábrán a fő alcsoportok elemeinek szimbólumai balra, a másodlagos alcsoportok elemeinek szimbólumai pedig jobbra tolódnak el.
Igaz, az elemek ilyen elrendezésének a táblázatban is megvannak a maga előnyei, mert elsősorban a vegyértékelektronok száma határozza meg egy atom vegyértékképességét.
A hosszú periódusú táblázat tükrözi az atomok elektronszerkezetének törvényszerűségeit, az egyszerű anyagok és vegyületek tulajdonságainak elemcsoportonkénti hasonlóságát és változási mintázatait, az atomokat, egyszerű anyagokat és vegyületeket jellemző fizikai mennyiségek szabályos változását. az egész elemrendszerben, és még sok más. A rövid periódusos táblázat kevésbé kényelmes ebből a szempontból.
RÖVID IDŐSZAKOS TÁBLÁZAT, FŐ ALCSOPORTOK, MÁSODLAGOS ALCSOPORTOK.
1. Alakítsa át az elemek természetes sorozatából felépített hosszú periódusú táblázatot rövid periódusú táblázattá. Hajtsa végre a fordított átalakítást.
2. Készíthető-e általános vegyértékelektronikus képlet egy rövid periódusos rendszer elemeinek atomjairól? Miért?
6.12. Atomméretek. Orbitális sugarak
.Az atomnak nincsenek egyértelmű határai. Mekkora méretet tekintünk egy izolált atom méretének? Az atommagot elektronhéj veszi körül, a héj elektronfelhőkből áll. Az EO méretét egy sugár jellemzi r oo. A külső rétegben lévő összes felhő megközelítőleg azonos sugarú. Ezért egy atom mérete ezzel a sugárral jellemezhető. Ez az úgynevezett egy atom pálya sugara(r 0).
Az atomok pályasugarának értékeit az 5. függelék tartalmazza.
Az EO sugara függ az atommag töltésétől és attól, hogy a felhőt alkotó elektron melyik pályán található. Következésképpen egy atom pályasugara is ezektől a jellemzőktől függ.
Tekintsük a hidrogén- és héliumatomok elektronhéját. Mind a hidrogénatomban, mind a héliumatomban az elektronok az 1-en helyezkednek el s-AO, és a felhőik akkora méretűek lennének, ha ezeknek az atomoknak a töltései azonosak lennének. De a hélium atom magjának töltése kétszerese a hidrogénatom atommagjának töltésének. A Coulomb-törvény szerint a héliumatom egyes elektronjaira ható vonzási erő kétszerese egy elektronnak a hidrogénatom atommagjához való vonzóerejének. Ezért a hélium atom sugarának sokkal kisebbnek kell lennie, mint a hidrogénatom sugarának. És van: r 0 (Ő) / r 0 (H) = 0,291 E / 0,529 E 0,55.
A lítium atomnak van egy külső elektronja 2-nél s-AO, vagyis a második réteg felhőjét képezi. Természetesen a sugarának nagyobbnak kell lennie. Igazán: r 0 (Li) = 1,586 E.
A második periódus többi elemének atomjai külső elektronokkal rendelkeznek (és 2 sés 2 p) ugyanabba a második elektronrétegbe kerülnek, és ezen atomok magjának töltése a sorozatszám növekedésével növekszik. Az elektronok erősebben vonzódnak az atommaghoz, és természetesen az atomok sugara csökken. Megismételhetnénk ezeket az érveket más periódusok elemeinek atomjaira is, de egy pontosítással: a pályasugár csak akkor csökken monoton módon, ha az egyes részszintek kitöltődnek.
De ha figyelmen kívül hagyjuk a részleteket, akkor egy elemrendszerben az atomok méretének változásának általános jellege a következő: a sorozatszám növekedésével egy periódusban az atomok pályasugarai csökkennek, egy csoportban pedig növekednek. A legnagyobb atom a céziumatom, a legkisebb pedig a héliumatom, de a kémiai vegyületeket alkotó elemek atomjai közül (a hélium és a neon nem képezi őket) a legkisebb a fluoratom.
A lantanidok után a természetes sorozatban álló elemek legtöbb atomjának keringési sugara valamivel kisebb, mint az általános törvényszerűségek alapján elvárható. Ez annak köszönhető, hogy az elemek rendszerében a lantán és a hafnium között 14 lantanid található, és ebből következően a hafnium atom magtöltése 14 e több mint lantán. Ezért ezeknek az atomoknak a külső elektronjai erősebben vonzódnak az atommaghoz, mint lantanidok hiányában (ezt a hatást gyakran "lantanid-összehúzódásnak" nevezik).
Felhívjuk figyelmét, hogy amikor a VIIIA csoport elemeinek atomjairól az IA csoport elemeinek atomjaira váltunk, a pálya sugara hirtelen megnő. Ebből következően az egyes időszakok első elemeinek megválasztása (lásd 7. §) helyesnek bizonyult.
AZ ATOM KERESÉSI SUGÁRA, VÁLTOZÁSA AZ ELEMEK RENDSZERÉBEN.
1. Az 5. függelékben megadott adatok szerint ábrázolja milliméterpapíron az atom pályasugarának az elem sorszámától való függését olyan elemek esetén, Z 1-től 40-ig. A vízszintes tengely hossza 200 mm, a függőleges tengely hossza 100 mm.
2. Hogyan jellemezhető a keletkező szaggatott vonal megjelenése?
6.13. Egy atom ionizációs energiája
Ha egy atomban lévő elektronnak plusz energiát adsz (ezt egy fizika tanfolyamon tanulod meg), akkor az elektron egy másik AO-ba kerülhet, vagyis az atom izgatott állapot. Ez az állapot instabil, és az elektron szinte azonnal visszatér eredeti állapotába, és többletenergia szabadul fel. De ha az elektronnak adott energia elég nagy, az elektron teljesen elszakadhat az atomtól, míg az atom ionizált, azaz pozitív töltésű ionná alakul ( kation). Az ehhez szükséges energiát ún egy atom ionizációs energiája(Eés).
Elég nehéz egyetlen atomról leszakítani egy elektront és megmérni az ehhez szükséges energiát, ezért gyakorlatilag meghatározzák és használják moláris ionizációs energia(E és m).
A moláris ionizációs energia azt mutatja meg, hogy mekkora a legkisebb energia szükséges ahhoz, hogy 1 mól elektront leválasszanak 1 mól atomról (egy elektron minden atomról). Ezt az értéket általában kilojoule per mólban mérik. Az első elektron moláris ionizációs energiájának értékeit a legtöbb elemre a 6. függelék tartalmazza.
Hogyan függ egy atom ionizációs energiája az elemnek az elemrendszerben elfoglalt helyzetétől, azaz hogyan változik a csoportban és periódusban?
Fizikai értelemben az ionizációs energia egyenlő azzal a munkával, amelyet az elektron atomhoz való vonzódásának leküzdéséhez kell fordítani, amikor az elektront az atomtól végtelen távolságra mozgatják.
ahol q egy elektron töltése, K az elektron eltávolítása után megmaradó kation töltése, és r o az atom pályasugara.
És q, és K konstans értékek, és arra lehet következtetni, hogy az elektron leválásának munkája DE, és vele együtt az ionizációs energia Eés fordítottan arányosak az atom keringési sugarával.
A különböző elemek atomjainak pályasugarának értékeinek és az 5. és 6. függelékben megadott ionizációs energia megfelelő értékeinek elemzése után láthatjuk, hogy ezen értékek közötti kapcsolat közel arányos, de némileg különbözik attól. Következtetésünk nem egyezik jól a kísérleti adatokkal az az oka, hogy nagyon durva modellt alkalmaztunk, amely nem vesz figyelembe sok jelentős tényezőt. De még ez a durva modell is lehetővé tette számunkra, hogy levonjuk azt a helyes következtetést, hogy a pályasugár növekedésével az atom ionizációs energiája csökken, és fordítva, a sugár csökkenésével nő.
Mivel az atomok keringési sugara a sorozatszám növekedésével párhuzamosan csökken, az ionizációs energia növekszik. Egy csoportban az atomszám növekedésével az atomok keringési sugara általában növekszik, és az ionizációs energia csökken. A legnagyobb moláris ionizációs energia a legkisebb atomokban, a héliumatomokban (2372 kJ/mol), a kémiai kötések kialakítására képes atomok közül pedig a fluoratomokban (1681 kJ/mol). A legkisebb a legnagyobb atomokhoz, a céziumatomokhoz tartozik (376 kJ/mol). Egy elemrendszerben az ionizációs energia növekedésének iránya sematikusan a következőképpen ábrázolható: 
A kémiában fontos, hogy az ionizációs energia jellemezze az atom azon hajlamát, hogy "az elektronjait" adja: minél nagyobb az ionizációs energia, annál kevésbé hajlamos az atom elektronokat adni, és fordítva.
Gerjesztett állapot, ionizáció, kation, ionizációs energia, moláris ionizációs energia, ionizációs energia változása elemrendszerben.
1. A 6. függelékben megadott adatok alapján határozza meg, hogy mennyi energiát kell költenie egy elektron elszakításához az összes 1 g össztömegű nátriumatomról!
2. Határozza meg a 6. függelékben megadott adatok felhasználásával, hogy hányszor több energiát kell fordítani egy elektron leválasztására az összes 3 g tömegű nátriumatomról, mint az összes azonos tömegű káliumatomról! Miért tér el ez az arány ugyanazon atomok moláris ionizációs energiáinak arányától?
3. A 6. függelékben megadott adatok szerint ábrázolja a moláris ionizációs energia függését a sorozatszámtól olyan elemek esetén, amelyek Z 1-től 40-ig. A grafikon méretei megegyeznek az előző bekezdésben szereplő feladattal. Nézze meg, hogy ez a grafikon megfelel-e az elemrendszer "periódusainak" megválasztásának.
6.14. Elektronaffinitási energia
.Az atom második legfontosabb energiajellemzője az elektronaffinitási energia(E Val vel).
A gyakorlatban, mint az ionizációs energia esetében, általában a megfelelő moláris mennyiséget használják - moláris elektron affinitási energia().
A moláris elektronaffinitási energia azt mutatja meg, hogy mekkora energia szabadul fel, ha egy mól elektront adunk egy mól semleges atomhoz (egy elektron minden atomhoz). A moláris ionizációs energiához hasonlóan ezt a mennyiséget is kilojoule/mol mértékegységben mérik.
Első pillantásra úgy tűnhet, hogy ebben az esetben nem szabad energiát felszabadítani, mert az atom semleges részecske, és a semleges atom és a negatív töltésű elektron között nincs elektrosztatikus vonzási erő. Éppen ellenkezőleg, az atomhoz közeledve az elektront, úgy tűnik, ugyanazoknak a negatív töltésű elektronoknak kellene taszítaniuk, amelyek az elektronhéjat alkotják. Valójában ez nem igaz. Ne feledje, ha valaha is foglalkozott atomklórral. Természetesen nem. Végül is csak nagyon magas hőmérsékleten létezik. Még stabilabb molekuláris klór gyakorlatilag nem található meg a természetben - ha szükséges, kémiai reakciókkal kell előállítani. És állandóan a nátrium-kloriddal (konyhasóval) kell foglalkoznia. Hiszen az asztali sót az ember minden nap étellel fogyasztja. És ez meglehetősen gyakori a természetben. De végül is a konyhasó kloridionokat tartalmaz, vagyis olyan klóratomokat, amelyekhez egy-egy "extra" elektron kapcsolódik. A kloridionok ilyen elterjedésének egyik oka, hogy a klóratomok hajlamosak elektronokat kötni, vagyis amikor klóratomokból és elektronokból kloridionok képződnek, energia szabadul fel.
Az energia felszabadulásának egyik oka már ismert Ön előtt - ez a klóratom elektronhéjának szimmetriájának növekedéséhez kapcsolódik az egyszeres töltésűre való áttérés során anion. Ugyanakkor, ahogy emlékszel, az energia 3 p- alszint csökken. Vannak más összetettebb okok is.
Tekintettel arra, hogy az elektronaffinitási energia értékét számos tényező befolyásolja, egy elemrendszerben ezen érték változásának természete sokkal összetettebb, mint az ionizációs energia változásának természete. Erről meggyőződhet a 7. függelékben található táblázat elemzésével. De mivel ennek a mennyiségnek az értékét mindenekelőtt ugyanaz az elektrosztatikus kölcsönhatás határozza meg, mint az ionizációs energia értékei, akkor ennek változása a rendszerben. Az elemek (legalábbis az A-csoportokban) általánosságban az ionizációs energia változásához hasonlítanak, vagyis az elektronaffinitás energiája egy csoportban csökken, egy periódusban pedig nő. Maximum a fluor (328 kJ/mol) és a klór (349 kJ/mol) atomjainál van. Az elektronaffinitási energia változásának természete az elemek rendszerében hasonlít az ionizációs energia változásának természetére, vagyis az elektronaffinitási energia növekedésének iránya sematikusan a következőképpen ábrázolható:
2. Az előző feladatokhoz hasonló skálán a vízszintes tengely mentén ábrázolja az elektronaffinitás moláris energiájának a sorszámtól való függését olyan elemek atomjai esetén, amelyek Z 1-től 40-ig a 7-es alkalmazás használatával.
3. Mi a negatív elektronaffinitási energiák fizikai jelentése?
4. Miért a 2. periódus elemeinek összes atomja közül csak a berilliumnak, a nitrogénnek és a neonnak van negatív elektronaffinitási moláris energiája?
6.15. Az atomok tendenciája az elektronok adományozására és elnyerésére
Ön már tudja, hogy egy atom hajlama saját adományozására és idegen elektronok befogadására energiajellemzőitől (ionizációs energia és elektronaffinitási energia) függ. Mely atomok hajlamosabbak az elektronok adományozására, és melyek hajlamosabbak az idegenek befogadására?
A kérdés megválaszolásához a 15. táblázatban foglaljuk össze mindazt, amit az elemrendszerben ezen hajlamok változásáról tudunk.
15. táblázat
Elektronikus konfiguráció az atom az elektronpályáinak numerikus ábrázolása. Az elektronpályák az atommag körül elhelyezkedő, különböző alakú régiók, amelyekben matematikailag valószínű, hogy elektront találnak. Az elektronikus konfiguráció segít gyorsan és egyszerűen megmondani az olvasónak, hogy egy atom hány elektronpályája van, valamint meghatározza az egyes pályákon lévő elektronok számát. A cikk elolvasása után elsajátítja az elektronikus konfigurációk összeállításának módszerét.
Lépések
Elektronok eloszlása D. I. Mengyelejev periodikus rendszerével
- Például egy -1 töltésű nátriumatomnak lesz egy extra elektronja továbbá Más szóval, egy atomnak összesen 12 elektronja lesz.
- Ha +1 töltésű nátriumatomról beszélünk, akkor a 11-es alapatomszámból egy elektront le kell vonni. Tehát az atomnak 10 elektronja lesz.
-
Jegyezze meg a pályák alaplistáját. Az elektronok számának növekedésével egy atomban egy bizonyos sorrend szerint kitöltik az atom elektronhéjának különböző alszintjeit. Az elektronhéj minden egyes alszintje, ha meg van töltve, páros számú elektront tartalmaz. A következő alszintek vannak:
Az elektronikus konfigurációs rekord megértése. Az elektronikus konfigurációkat úgy írják le, hogy egyértelműen tükrözzék az egyes pályákon lévő elektronok számát. A pályákat szekvenciálisan írjuk, az egyes pályákon lévő atomok számát felső indexként a pálya nevétől jobbra. Az elkészült elektronikus konfiguráció alszint-megjelölések és felső indexek sorozata.
- Itt van például a legegyszerűbb elektronikus konfiguráció: 1s 2 2s 2 2p 6 . Ez a konfiguráció azt mutatja, hogy két elektron van az 1s alszinten, két elektron a 2s alszinten és hat elektron a 2p alszinten. 2 + 2 + 6 = 10 elektron összesen. Ez a semleges neonatom elektronikus konfigurációja (a neon atomszáma 10).
-
Emlékezzen a pályák sorrendjére. Ne feledje, hogy az elektronpályák számozása az elektronhéj számának növekvő sorrendjében történik, de az energia növekvő sorrendjében. Például egy feltöltött 4s 2 pálya kevesebb energiával (vagy kisebb mozgékonysággal) rendelkezik, mint egy részben feltöltött vagy feltöltött 3d 10, ezért a 4s pálya íródik először. Ha ismeri a pályák sorrendjét, könnyen kitöltheti azokat az atomban lévő elektronok számának megfelelően. A pályák feltöltésének sorrendje a következő: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Egy atom elektronikus konfigurációja, amelyben minden pálya meg van töltve, a következő formában lesz: 10 7p 6
- Megjegyzendő, hogy a fenti jelölés, amikor minden pálya megtelt, az Uuo (ununoctium) 118 elem elektronkonfigurációja, amely a periódusos rendszer legmagasabb számú atomja. Ezért ez az elektronikus konfiguráció tartalmazza a semleges töltésű atomok összes jelenleg ismert elektronikus alszintjét.
-
Töltse ki a pályákat az atomban lévő elektronok számának megfelelően. Például, ha egy semleges kalcium atom elektronkonfigurációját akarjuk felírni, akkor kezdjük azzal, hogy megkeressük a periódusos rendszerben annak rendszámát. A rendszáma 20, ezért a fenti sorrend szerint írjuk fel egy 20 elektronos atom konfigurációját.
- Töltse ki a pályákat a fenti sorrendben, amíg el nem éri a huszadik elektront. Az első 1s pályán két elektron lesz, a 2s pályán szintén kettő, a 2p pályán hat, a 3s pályán kettő, a 3p pályán 6, a 4s pályán pedig 2 (2 + 2 + 6 +2 +6 + 2 = 20 .) Más szóval, a kalcium elektronikus konfigurációja a következőképpen alakul: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2.
- Figyeljük meg, hogy a pályák energia növekvő sorrendben vannak. Például, amikor készen állsz a 4. energiaszintre lépni, akkor először írd fel a 4s pályát, és akkor 3d. A negyedik energiaszint után továbblépsz az ötödikre, ahol ugyanaz a sorrend ismétlődik. Ez csak a harmadik energiaszint után következik be.
-
Használja a periódusos táblázatot vizuális jelzésként. Valószínűleg már észrevetted, hogy a periódusos rendszer alakja megfelel az elektronikus konfigurációkban lévő elektronikus alszintek sorrendjének. Például a balról a második oszlopban lévő atomok mindig "s 2"-re végződnek, míg a vékony középső szakasz jobb szélén lévő atomok mindig "d 10"-re, és így tovább. Használja a periódusos táblázatot vizuális útmutatóként a konfigurációk írásához – mivel a pályákhoz való hozzáadás sorrendje megfelel a táblázatban elfoglalt pozíciójának. Lásd lejjebb:
- Konkrétan a bal szélső oszlop olyan atomokat tartalmaz, amelyek elektronkonfigurációja s-pályára végződik, a táblázat jobb oldali blokkja azokat az atomokat tartalmazza, amelyek konfigurációi p-pályákra, az atomok alján pedig f-pályákra végződnek.
- Például, amikor leírja a klór elektronikus konfigurációját, gondoljon így: "Ez az atom a periódusos rendszer harmadik sorában (vagy "periódusában") található. Ugyancsak a p orbitális blokk ötödik csoportjában található. Ezért az elektronikus konfigurációja a következővel végződik: ..3p 5
- Figyeljük meg, hogy a táblázat d és f orbitális tartományában lévő elemek energiaszintjei nem felelnek meg annak az időszaknak, amelyben elhelyezkednek. Például egy d-pályás elemblokk első sora a 3d pályáknak felel meg, bár a 4. periódusban található, az f-pályás elemek első sora pedig a 4f pályának felel meg, annak ellenére, hogy ez 6. periódusában található.
-
Ismerje meg a hosszú elektronikus konfigurációk írásának rövidítéseit. A periódusos rendszer jobb oldalán lévő atomokat ún nemesgázok. Ezek az elemek kémiailag nagyon stabilak. A hosszú elektronikus konfigurációk írási folyamatának lerövidítéséhez egyszerűen írja be szögletes zárójelbe a legközelebbi, az atomnál kevesebb elektront tartalmazó nemesgáz vegyjelét, majd folytassa a következő pályaszintek elektronikus konfigurációjának írását. Lásd lejjebb:
- Ennek a koncepciónak a megértéséhez hasznos lesz egy példakonfiguráció írása. Írjuk fel a cink (30-as rendszámú) konfigurációját a nemesgáz rövidítéssel. A teljes cinkkonfiguráció így néz ki: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 . Látjuk azonban, hogy az 1s 2 2s 2 2p 6 3s 2 3p 6 az argon, egy nemesgáz elektronikus konfigurációja. Egyszerűen cserélje ki a cink elektronikus konfigurációs részét az argon vegyjele szögletes zárójelben (.)
- Tehát a cink elektronikus konfigurációja, rövidített formában, a következő: 4s 2 3d 10 .
- Figyeld meg, hogy ha egy nemesgáz, mondjuk az argon elektronikus konfigurációját írod, nem írhatsz! Az elem előtt a nemesgáz rövidítését kell használni; az argonhoz neon lesz ().
ADOMAH periódusos rendszer használata
-
Sajátítsa el az ADOMAH periódusos rendszert. Az elektronikus konfiguráció rögzítésének ez a módja nem igényel memorizálást, azonban módosított periódusos rendszert igényel, mivel a hagyományos periódusos rendszerben a negyedik periódustól kezdve a periódusszám nem felel meg az elektronhéjnak. Keresse meg az ADOMAH periódusos rendszert, egy speciális típusú periódusos rendszert, amelyet Valery Zimmerman tudós tervezett. Könnyű megtalálni egy rövid internetes kereséssel.
- Az ADOMAH periódusos rendszerben a vízszintes sorok olyan elemcsoportokat jelölnek, mint a halogének, nemesgázok, alkálifémek, alkáliföldfémek stb. A függőleges oszlopok az elektronikus szinteknek, az úgynevezett "kaszkádoknak" (az s, p, d és f blokkokat összekötő átlós vonalak) pedig pontoknak.
- A héliumot hidrogénné mozgatják, mivel mindkét elemet 1s pálya jellemzi. A periódusblokkok (s,p,d és f) a jobb oldalon, a szintszámok pedig alul láthatók. Az elemek 1-től 120-ig számozott négyzetekben vannak ábrázolva. Ezek a számok a szokásos atomszámok, amelyek a semleges atomban lévő elektronok teljes számát jelentik.
-
Keresse meg atomját az ADOMAH táblázatban. Egy elem elektronikus konfigurációjának felírásához keresse meg a szimbólumát az ADOMAH periódusos rendszerben, és húzza ki az összes magasabb rendszámú elemet. Például, ha le kell írnia az erbium (68) elektronikus konfigurációját, húzza át az összes elemet 69-től 120-ig.
- Ügyeljen a táblázat alján lévő 1 és 8 közötti számokra. Ezek az elektronikus szintszámok vagy oszlopszámok. Hagyja figyelmen kívül azokat az oszlopokat, amelyek csak áthúzott elemeket tartalmaznak. Az erbium esetében az 1, 2, 3, 4, 5 és 6 számú oszlopok maradnak.
-
Számolja meg az orbitális részszinteket az elemig. A táblázat jobb oldalán látható blokkszimbólumokat (s, p, d és f) és az alul látható oszlopszámokat tekintve figyelmen kívül hagyja a blokkok közötti átlós vonalakat, és bontsa fel az oszlopokat blokk-oszlopokra, és sorolja fel őket sorrendben alulról felfelé. És ismét figyelmen kívül hagyja azokat a blokkokat, amelyekben az összes elem át van húzva. Írja fel az oszlopblokkokat az oszlopszámtól kezdve, majd a blokk szimbólummal, így: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (erbium esetén).
- Figyelem: A fenti Er elektronikus konfiguráció az elektronikus alszint számának növekvő sorrendjében van írva. A pályák feltöltésének sorrendjében is írható. Ehhez kövesse a kaszkádokat alulról felfelé, amikor oszlopblokkokat ír: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 .
-
Számolja meg az elektronokat minden egyes elektronikus részszinthez. Minden oszlopblokkban számolja meg az át nem húzott elemeket úgy, hogy minden elemből egy elektront csatol, és írja be a számukat a blokk szimbóluma mellé a következőképpen: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s 2 . Példánkban ez az erbium elektronikus konfigurációja.
-
Ügyeljen a helytelen elektronikus konfigurációkra. Tizennyolc tipikus kivétel van a legalacsonyabb energiaállapotú atomok elektronikus konfigurációjával kapcsolatban, amelyet alapenergia-állapotnak is neveznek. Nem csak az utolsó két-három elektron által elfoglalt pozícióban engedelmeskednek az általános szabálynak. Ebben az esetben a tényleges elektronikus konfiguráció azt feltételezi, hogy az elektronok az atom standard konfigurációjához képest alacsonyabb energiájú állapotban vannak. A kivételes atomok közé tartoznak:
- Kr(..., 3d5, 4s1); Cu(..., 3d10, 4s1); Nb(..., 4d4, 5s1); Mo(..., 4d5, 5s1); Ru(..., 4d7, 5s1); Rh(..., 4d8, 5s1); Pd(..., 4d10, 5s0); Ag(..., 4d10, 5s1); La(..., 5d1, 6s2); Ce(..., 4f1, 5d1, 6s2); Gd(..., 4f7, 5d1, 6s2); Au(..., 5d10, 6s1); AC(..., 6d1, 7s2); Th(..., 6d2, 7s2); Pa(..., 5f2, 6d1, 7s2); U(..., 5f3, 6d1, 7s2); Np(..., 5f4, 6d1, 7s2) és cm(..., 5f7, 6d1, 7s2).
- Az elektronikus formában írt atom rendszámának meghatározásához egyszerűen adja össze a betűket (s, p, d és f) követő összes számot. Ez csak semleges atomoknál működik, ha ionnal van dolgod, akkor nem fog működni – hozzá kell adni vagy ki kell vonnod a felesleges vagy elveszett elektronok számát.
- A betűt követő szám felső index, ne hibázz a vezérlőben.
- A "félig kitöltött" alszint stabilitása nem létezik. Ez leegyszerűsítés. Bármilyen stabilitás, amely a "félig telt" alszintekre vonatkozik, annak a ténynek köszönhető, hogy minden pályát egy elektron foglal el, így az elektronok közötti taszítás minimális.
- Mindegyik atom stabil állapotba kerül, és a legstabilabb konfigurációk s és p (s2 és p6) alszintekkel rendelkeznek. A nemesgázok ilyen konfigurációval rendelkeznek, ezért ritkán reagálnak, és a periódusos rendszer jobb oldalán helyezkednek el. Ezért, ha egy konfiguráció 3p 4 -re végződik, akkor két elektronra van szüksége a stabil állapot eléréséhez (hat elveszítéséhez több energia szükséges, beleértve az s-szintű elektronokat is, így négyet könnyebb elveszíteni). És ha a konfiguráció 4d 3 -ban végződik, akkor három elektront kell veszítenie, hogy stabil állapotot érjen el. Ezenkívül a félig kitöltött alszintek (s1, p3, d5..) stabilabbak, mint például a p4 vagy p2; az s2 és a p6 azonban még stabilabb lesz.
- Ha egy ionnal van dolgod, ez azt jelenti, hogy a protonok száma nem egyezik meg az elektronok számával. Az atom töltése ebben az esetben a kémiai szimbólum jobb felső sarkában (általában) látható. Ezért egy +2 töltésű antimon atom 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 elektronikus konfigurációjú. Vegye figyelembe, hogy az 5p 3 5p 1-re változott. Legyen óvatos, amikor egy semleges atom konfigurációja az s és p-től eltérő alszinteken végződik. Amikor elektronokat veszünk, csak vegyértékpályákról (s és p pályákról) vehetjük őket. Ezért, ha a konfiguráció 4s 2 3d 7-re végződik, és az atom +2 töltést kap, akkor a konfiguráció 4s 0 3d 7-re végződik. Felhívjuk figyelmét, hogy a 3d 7 nem megváltozik, helyette az s-pálya elektronjai vesznek el.
- Vannak olyan körülmények, amikor egy elektron kénytelen "magasabb energiaszintre mozogni". Ha egy részszinten hiányzik egy elektron ahhoz, hogy fél vagy teljes legyen, vegyen egy elektront a legközelebbi s vagy p részszintről, és mozgassa azt az elektront igénylő alszintre.
- Két lehetőség van az elektronikus konfiguráció írására. Felírhatók az energiaszintek számának növekvő sorrendjében vagy abban a sorrendben, ahogyan az elektronpályák megtelnek, amint azt fentebb az erbium esetében is bemutattuk.
- Egy elem elektronikus konfigurációját úgy is megírhatja, hogy csak a vegyértékkonfigurációt írja be, amely az utolsó s és p alszint. Így az antimon vegyértékkonfigurációja 5s 2 5p 3 lesz.
- Az ionok nem ugyanazok. Velük sokkal nehezebb. Hagyjon ki két szintet, és kövesse ugyanazt a mintát attól függően, hogy honnan indult, és milyen magas az elektronok száma.
Keresse meg atomjának rendszámát. Minden atomhoz bizonyos számú elektron kapcsolódik. Keresse meg az atom szimbólumát a periódusos rendszerben. Az atomszám egy pozitív egész szám, amely 1-től kezdődik (hidrogén esetén), és minden következő atomnál eggyel nő. Az atomszám az atomban lévő protonok száma, tehát egyben nulla töltésű atomban lévő elektronok száma is.
Határozza meg az atom töltését! A semleges atomoknak ugyanannyi elektronja lesz, mint a periódusos táblázatban. A töltött atomoknak azonban több vagy kevesebb elektronja lesz, töltésük nagyságától függően. Ha töltött atommal dolgozik, a következőképpen adja hozzá vagy vonja ki az elektronokat: adjon hozzá egy elektront minden negatív töltéshez, és vonjon ki egyet minden pozitív töltéshez.