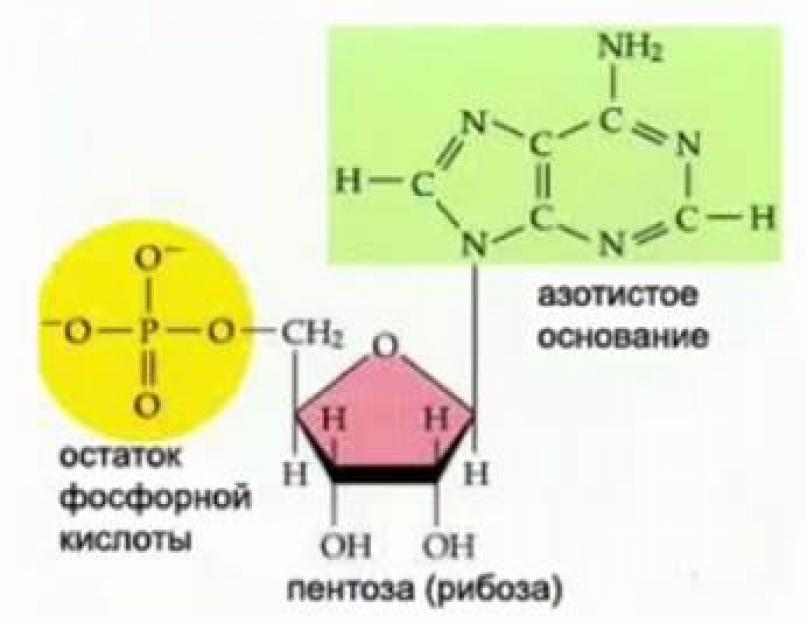
Az RNS monomerek a nukleotidok összetételében öt szénatomos cukrot (pentózt), foszforsavat (foszforsavmaradékot) és nitrogénbázist tartalmaznak (lásd 2. ábra).

Rizs. 2. Az RNS nukleotid szerkezete
Az RNS nitrogéntartalmú bázisai az uracil, citozin, adenin és guanin. Az RNS-nukleotid monoszacharidot ribóz képviseli (lásd a 2. ábrát).
Az RNS egy egyszálú molekula, sokkal kisebb, mint a DNS-molekula.
Egy RNS-molekula 75-10 000 nukleotidot tartalmaz.

Rizs. 3. RNS vírus
Sok vírus, például az influenzavírus, egyetlen nukleinsavként RNS-molekulát tartalmaz (lásd a 3. ábrát). Több az emberre patogén RNS-tartalmú vírus, mint a DNS-tartalmú. Gyermekbénulást, hepatitis A-t, akut megfázást okoznak.
Az arbovírusok ízeltlábúak által hordozott vírusok. A kullancs- és japán agyvelőgyulladás, valamint a sárgaláz kórokozói.
A reovírusok (lásd 4. ábra), az emberi légúti és bélrendszeri betegségek ritka kórokozói, különös tudományos érdeklődés tárgyává váltak, mivel genetikai anyagukat kétszálú RNS-molekula formájában mutatják be.

Rizs. 4. A reovírus szerkezete
Vannak olyan retrovírusok is, amelyek számos rákot okoznak.
A szerkezettől és az elvégzett funkciótól függően az RNS három fő típusa van: riboszómális, transzport és információs (mátrix).
1. Messenger RNS
Tanulmányok kimutatták, hogy a hírvivő RNS a sejt teljes RNS-tartalmának 3-5%-át teszi ki. Ez egy egyszálú molekula, amely a DNS-molekula egyik szálán történő transzkripció során képződik. Ennek oka az a tény, hogy a nukleáris szervezetek DNS-e a sejtmagban található, a fehérjeszintézis pedig a citoplazmában található riboszómákon történik, ezért szükség volt egy "közvetítőre". A hírvivő RNS „közvetítő” funkciót lát el, a fehérje szerkezetére vonatkozó információkat a sejtmagból, ahol a DNS található, a riboszómákba továbbítja, ahol ez az információ megvalósul (lásd 5. ábra).

Rizs. 5. Messenger RNS (mRNS)
A másolt információ mennyiségétől függően a hírvivő RNS-molekula eltérő hosszúságú lehet.
A legtöbb hírvivő RNS rövid ideig létezik a sejtben. Baktériumsejtekben az ilyen RNS-ek létezését percek határozzák meg, az emlőssejtekben (eritrocitákban) a hemoglobin (fehérje) szintézise a vörösvértestek magvesztése után több napig folytatódik.
2. Riboszomális RNS
A riboszómális RNS-ek (lásd a 6. ábrát) a sejtben jelenlévő összes riboszóma 80%-át teszik ki. Ezek az RNS-ek a sejtmagban szintetizálódnak, a sejtben pedig a citoplazmában helyezkednek el, ahol a fehérjékkel együtt riboszómákat alkotnak. A fehérjeszintézis a riboszómákon megy végbe. Itt a hírvivő RNS-ben lévő "kód" a fehérjemolekula aminosavszekvenciájává válik.

Rizs. 6. Riboszomális RNS (rRNS)
3. RNS átvitele
A transzfer RNS-ek (lásd a 7. ábrát) a DNS-en lévő sejtmagban képződnek, majd átjutnak a citoplazmába.

Rizs. 7. Transzfer RNS (tRNS)
Ezek az RNS-ek a sejt teljes RNS-tartalmának körülbelül 10%-át teszik ki. Legrövidebb, 80-100 nukleotidos molekulájuk van.
A transzfer RNS-ek egy aminosavat kötnek magukhoz, és a fehérjeszintézis helyére, a riboszómákba szállítják.
Az összes ismert transzfer RNS a nitrogéntartalmú bázisok közötti komplementer kölcsönhatás következtében egy lóherelevélre emlékeztető másodlagos szerkezetet alkot (lásd 8. ábra). A tRNS-molekulának két aktív helye van - egy triplett antikodon az egyik végén, és egy akceptor hely, amely egy aminosavat köt a másik végén.

Rizs. 8. A tRNS ("lóherelevél") szerkezete
Minden aminosav három nukleotid kombinációjának felel meg, amelyet ún hármas.

Rizs. 9. A genetikai kód táblázata
Aminosavakat kódoló hármasok kodonok DNS (lásd a 9. ábrát) - az mRNS triplettjei (kodonjai) információ formájában továbbítják. A tRNS lóherelevél tetején egy nukleotidhármas található, amely komplementer a megfelelő mRNS kodonnal (lásd 10. ábra). Ez a triplett különbözik a különböző aminosavakat hordozó tRNS-ek esetében, és pontosan azt az aminosavat kódolja, amelyet ez a tRNS hordoz. Megkapta a nevet antikodon.

Rizs. 10. tRNS
Az akceptor vég egy adott aminosav "leszállóhelye".
Így az RNS különböző típusai egyetlen funkcionális rendszert képviselnek, amelynek célja az örökletes információ fehérjeszintézis útján történő megvalósítása.
Az RNS-világ koncepciója az, hogy valaha egy RNS-molekula ellátta a DNS-molekula és a fehérjék funkcióját is.
Az élő szervezetekben szinte minden folyamat a fehérje enzimek hatására megy végbe. A fehérjék azonban nem képesek önreplikációra, és a DNS-ben tárolt információk alapján szintetizálódnak sejtekké. De a DNS megkettőződése csak a fehérjék és az RNS részvétele miatt következik be. Következésképpen egy ördögi kör alakul ki, amely miatt az élet keletkezésének elmélete keretein belül nem valószínű egy ilyen összetett rendszer spontán kialakulása.
Az 1980-as évek elején Chek és Altman (kémiai Nobel-díjas) tudósok laboratóriumában fedezték fel az RNS katalitikus képességét az USA-ban. RNS-katalizátorokat neveztek el ribozimek(Lásd 11. ábra).

Rizs. 11. A katalízis funkciót ellátó RNS ribozimomolekula szerkezete
Kiderült, hogy a riboszómák aktív központja nagy mennyiségű riboszómális RNS-t is tartalmaz. Az RNS-ek kétszálú és önreplikációra is képesek. Vagyis az RNS létezhet teljesen autonóm módon, katalizálja az anyagcsere-reakciókat, például az új ribonukleatidok szintézisét, és önreprodukálva, megőrizve a katalitikus tulajdonságait nemzedékről generációra. A véletlenszerű mutációk felhalmozódása bizonyos fehérjék szintézisét katalizáló RNS-ek kialakulásához vezetett, amelyek hatékonyabb katalizátorok, ezért ezeket a mutációkat a természetes szelekció során rögzítették. A genetikai információk speciális tárházai is megjelentek - a DNS-molekula és az RNS közvetítővé vált a DNS és a fehérjék között.
Bibliográfia
- Kamensky A.A., Kriksunov E.A., Pasechnik V.V. Általános biológia 10-11 osztály Túzok, 2005.
- Biológia. 10. fokozat. Általános biológia. Alapszint / P.V. Izhevsky, O.A. Kornilova, T.E. Loshchilin és mások - 2. kiadás, átdolgozva. - Ventana-Graf, 2010. - 224 oldal.
- Belyaev D.K. Biológia 10-11 óra. Általános biológia. Alapszintű. - 11. kiadás, sztereotípia. - M.: Oktatás, 2012. - 304 p.
- Agafonova I.B., Zakharova E.T., Sivoglazov V.I. Biológia 10-11 óra. Általános biológia. Alapszintű. - 6. kiadás, add. - Túzok, 2010. - 384 p.
- Orgchem.ru ().
- Appteka.ru ().
- Youtube.com().
Házi feladat
- 4., 5. kérdés a 12. bekezdés végén (52. o.) - Kamensky A.A., Kriksunov E.A., Pasechnik V.V. "Általános biológia", 10-11. évfolyam ()
- Hol találhatók a nukleinsavak a sejtben?
A ribonukleinsav purin és pirimidin ribonukleotidok kopolimerje, amelyek a DNS-hez hasonlóan foszfodiészter hidakkal kapcsolódnak egymáshoz (37.6. ábra). Bár ebben a két nukleinsavtípusban sok közös vonás van, számos dologban különböznek egymástól.
1. Az RNS-ben a szénhidrát, amelyhez purin- vagy pirimidinbázisok és foszfátcsoportok kapcsolódnak, ribóz, nem pedig 2-dezoxiribóz (mint a DNS-ben).
2. Az RNS pirimidin komponensei eltérnek a DNS komponenseitől. Az RNS összetétele, valamint a DNS összetétele magában foglalja az adenin, guanin és citozin nukleotidjait. Ugyanakkor az RNS (néhány speciális eset kivételével, amelyeket alább tárgyalunk) nem tartalmaz timint, helyét az RNS molekulában az uracil foglalja el.
3. Az RNS egyszálú molekula (ellentétben a DNS-sel, amelynek kétszálú szerkezete van), azonban ha az RNS-láncban komplementer szekvenciával (ellentétes polaritású) szakaszok találhatók, akkor egyetlen RNS-lánc összehajtva alakulhat ki. -úgynevezett "hajtűk", olyan szerkezetek, amelyek kétszálú jellemzőkkel rendelkeznek (37.7. ábra).

Rizs. 37.6. Ribonukleinsav (RNS) molekula fragmentuma, amelyben a purin és pirimidin bázisokat - adenint (A), uracilt (U), citozint (C) és guanint (- egy foszfodiészter váz tartja meg, amely ribozil-maradékokat köt össze N-vel glikozidkötés a megfelelő nukleinbázisokhoz Megjegyzendő, hogy az RNS-szál specifikus irányultsággal rendelkezik, amelyet az 5- és 3-terminális foszfátmaradékok jeleznek.
4. Mivel az RNS-molekula egyetlen szál, amely csak az egyik DNS-szálat komplementer, a benne lévő guanintartalom nem feltétlenül egyenlő a citozin-tartalommal, az adenin-tartalom pedig nem feltétlenül egyenlő az uracil-tartalommal.
5. Az RNS lúggal hidrolizálható mononukleotidok 2,3-ciklusos diészterévé; A 2,Y,5-triészter köztes hidrolízistermékként működik, amely a DNS lúgos hidrolízise során nem képződik, mivel az utóbbiban nincsenek 2-hidroxilcsoportok; az RNS lúgos labilitása (a DNS-hez képest) diagnosztikai és analitikai célokra egyaránt hasznos tulajdonság.
Az egyszálú RNS-ben lévő információ a polimer lánc purin- és pirimidinbázisok specifikus szekvenciája formájában valósul meg (azaz az elsődleges szerkezetben). Ez a szekvencia komplementer annak a génnek a kódoló szálával, amelyből az RNS "leolvasott". A komplementaritás miatt az RNS-molekula képes specifikusan kötődni (hibridizálódni) a kódoló szálhoz, de nem hibridizálni a nem kódoló DNS-szálhoz. Az RNS-szekvencia (a T U-val való helyettesítése kivételével) megegyezik a nem kódoló génszál szekvenciájával (37.8. ábra).
Az RNS biológiai funkciói
Az RNS számos típusa ismert. Szinte mindegyik közvetlenül részt vesz a fehérje bioszintézis folyamatában. A fehérjeszintézis templátjaként működő citoplazmatikus RNS-molekulákat hírvivő RNS-nek (mRNS) nevezik. A citoplazmatikus RNS egy másik típusa, a riboszómális RNS (rRNS) a riboszómák (a fehérjeszintézisben fontos szerepet játszó organellumok) szerkezeti komponenseinek szerepét tölti be. A transzfer RNS (tRNS) adaptermolekulák részt vesznek az mRNS információ transzlációjában (transzlációjában) a fehérjék aminosavszekvenciájába.
Az eukarióta sejtekben, köztük az emlőssejtekben termelődő elsődleges RNS-transzkriptumok jelentős része a sejtmagban lebomlik, és nem játszik semmilyen szerkezeti vagy információs szerepet a citoplazmában. A termesztett

Rizs. 37.7. A "szárral hurok" ("hajtű") típusú RNS-molekula másodlagos szerkezete, amely a komplementer nukleinbázispárok közötti hidrogénkötések intramolekuláris képződéséből adódik.
Emberi sejtekben a kis nukleáris RNS-ek egy osztályát fedezték fel, amelyek közvetlenül nem vesznek részt a fehérjeszintézisben, de hatással lehetnek az RNS-feldolgozásra és a sejt általános „architektúrájára”. Ezeknek a viszonylag kis molekuláknak a mérete változó, az utóbbiak 90-300 nukleotidot tartalmaznak (37.3. táblázat).
Az RNS egyes állati és növényi vírusok fő genetikai anyaga. Egyes RNS-vírusok soha nem mennek keresztül az RNS DNS-vé való reverz transzkripcióján. A legtöbb ismert állati vírust, például a retrovírusokat azonban RNS-genomjuk reverz transzkripciója jellemzi, amelyet az RNS-függő DNS-polimeráz (reverz transzkriptáz) irányít, hogy kettős szálú DNS-kópiát hozzon létre. Az így létrejövő kétszálú DNS-transzkriptum sok esetben beépül a genomba, és tovább biztosítja a vírusgének expresszióját, valamint a vírus RNS-genomok új másolatainak előállítását.
Az RNS szerkezeti szerveződése
Minden eukarióta és prokarióta szervezetben az RNS-molekulák három fő osztálya létezik: információs (mátrix vagy hírvivő) RNS (mRNS), transzport (tRNS) és riboszómális (rRNS). Ezen osztályok képviselői méretben, funkcióban és stabilitásban különböznek egymástól.
Az információs (mRNS) a legheterogénebb osztály méretét és stabilitását tekintve. Ennek az osztálynak minden képviselője információhordozóként szolgál a géntől a sejt fehérjeszintetizáló rendszerébe. Templátként működnek a szintetizált polipeptid számára, azaz meghatározzák a fehérje aminosavszekvenciáját (37.9. ábra).
A hírvivő RNS-ek, különösen az eukarióták, egyedi szerkezeti jellemzőkkel rendelkeznek. Az mRNS 5-végét a szomszédos 2-0-metilribonukleozid 5-hidroxilcsoportjához trifoszfát-maradékon keresztül kapcsolódó 7-metil-guanozin-trifoszfát "lezárja" (37.10. ábra). Az mRNS-molekulák gyakran tartalmaznak belső 6-metil-adenint és 2-0-metilezett ribonukleotidokat. Bár a "capping" jelentése még nem teljesen tisztázott, feltételezhető, hogy az mRNS 5-terminálisának eredő szerkezetét specifikus felismerésre használják a transzlációs rendszerben. A fehérjeszintézis az mRNS 5"-os (sapkás) végén kezdődik. A legtöbb mRNS-molekula másik vége (3-vége) egy 20-250 nukleotidból álló poliadenilát láncot tartalmaz. Ennek konkrét funkciói még nem tisztázottak véglegesen. Feltételezzük, hogy ez a szerkezet felelős az intracelluláris stabilitás fenntartásáért mRNS Egyes mRNS-ek, beleértve a hisztonokat is, nem tartalmaznak poli(A)-t. A poli(A) jelenléte az mRNS szerkezetében arra szolgál, hogy az összes RNS frakcionálásával elkülönüljön más típusú RNS-től. A szilárd hordozón, például cellulózon rögzített oligo(T) oszlopokon lévő RNS az oszloppal a poli(A)-"farok" és az immobilizált oligo (T) komplementer kölcsönhatásai miatt következik be.
Rizs. 37.8. Egy gén szekvenciája és RNS-transzkriptuma. A kódoló és nem kódoló szálak láthatók, és polaritásuk fel van tüntetve. A polaritással rendelkező RNS-transzkript komplementer a kódoló szálhoz (3-5 polaritással), és szekvenciáját tekintve azonos (kivéve a T-U szubsztitúciókat) és a nem kódoló DNS-szál polaritását.

Rizs. 37.9. DNS genetikai információ kifejeződése mRNS transzkriptum formájában és ezt követő transzlációja riboszómák részvételével egy specifikus fehérjemolekula kialakítása érdekében.
(lásd szkennelés)
Rizs. 37.10. A legtöbb eukarióta hírvivő RNS 5-terminálisán található "sapka" szerkezet, a 7-metil-guanozin-trifoszfát az mRNS 5-terminálisához kapcsolódik. amely általában 2-O-metilpurin nukleotidot tartalmaz.
Emlőssejtekben, beleértve az emberi sejteket is, a citoplazmában található érett mRNS-molekulák nem a gén átírt régiójának teljes másolatai. A transzkripció eredményeként képződő poliribonukleotid a citoplazmatikus mRNS prekurzora, a sejtmag elhagyása előtt specifikus feldolgozáson megy keresztül. Az emlőssejtek magjában található feldolgozatlan transzkripciós termékek az RNS-molekulák negyedik osztályát alkotják. Az ilyen nukleáris RNS-ek nagyon heterogének és jelentős méretűek. A heterogén nukleáris RNS molekulák molekulatömege nagyobb lehet, mint , míg az mRNS molekulatömege általában nem haladja meg a 2106-ot. A sejtmagban feldolgozódnak, és a keletkező érett mRNS-ek a citoplazmába jutnak, ahol a fehérje mátrixaként szolgálnak. bioszintézis.
A transzfer RNS (tRNS) molekulák általában körülbelül 75 nukleotidot tartalmaznak. Az ilyen molekulák molekulatömege . tRNS-ek is keletkeznek a megfelelő prekurzor molekulák specifikus feldolgozása következtében (lásd 39. fejezet). A transzport tRNS-ek mediátorként működnek az mRNS transzláció során. Minden sejtben legalább 20 típusú tRNS-molekula található. A tRNS minden típusa (néha több típusa) megfelel a fehérjeszintézishez szükséges 20 aminosav egyikének. Bár mindegyik specifikus tRNS nukleotidszekvenciájában különbözik a többitől, mindegyiknek van közös jellemzője. A szálon belüli komplementer régiók miatt minden tRNS másodlagos szerkezettel rendelkezik, amelyet "lóherelevélnek" neveznek (37.11. ábra).
Minden típusú tRNS molekulájának négy fő karja van. Az akceptor kar egy páros nukleotidokból álló „szárból” áll, és a CCA szekvenciával végződik, az adenozil-maradék Y-hidroxilcsoportján keresztül történik a kötődés az aminosav karboxilcsoportjához. A fennmaradó karok szintén komplementer bázispárokból és párosítatlan bázisok hurkából álló "szárakból" állnak (37.7. ábra). Az antikodon kar felismer egy nukleotidhármast vagy kodont (lásd a 40. fejezetet) az mRNS-ben. A D-kar a dihidrouridin jelenléte miatt kapta ezt a nevet, a -kar a T-pszeudouridin-C szekvenciájáról kapta a nevét. Az extra kar a legváltozatosabb szerkezet, és a tRNS-ek osztályozásának alapjául szolgál. Az 1. osztályú tRNS-ek (teljes számuk 75%-a) további 3-5 bázispár hosszúságú karral rendelkeznek. A 2. osztályba tartozó tRNS-molekulák extra karja 13-21 bázispár hosszú, és gyakran tartalmaz párosítatlan hurkot.

Rizs. 37.11. Az aminoacil-tRNS molekula szerkezete, amelynek 3-CCA-terminálisához aminosav kapcsolódik. Az intramolekuláris hidrogénkötések és az antikodon, a TTC és a dihidrouracil karok elhelyezkedése fel van tüntetve. (J. D. Watsontól. Molecular Biology of the Gene 3rd, ed.. Copyright 1976, 1970, 1965, W. A. Benjamin, Inc., Menlo Park Calif.)
A megfelelő karok nukleotidbázisainak komplementer kölcsönhatásának rendszere által meghatározott másodlagos szerkezet minden fajra jellemző, az akceptor kar hét bázispárt, a - kar - öt bázispárt, a D kar - három (vagy négy) bázispárt tartalmaz. bázispárok.
A tRNS-molekulák nagyon stabilak prokariótákban, és valamivel kevésbé stabilak eukariótákban. A fordított helyzet jellemző az mRNS-re, amely prokariótákban meglehetősen instabil, míg eukarióta szervezetekben jelentős stabilitású.
Riboszomális RNS. A riboszóma egy citoplazmatikus nukleoprotein szerkezet, amelyet fehérjeszintézisre terveztek egy mRNS-templátból. A riboszóma specifikus kontaktust biztosít, melynek eredményeként egy specifikus génről leolvasott nukleotid szekvencia a megfelelő fehérje aminosav szekvenciájává transzlálódik.
táblázatban. A 37.2. ábra az emlős riboszómák komponenseit mutatja 4,210 6 molekulatömeggel és ülepedési sebességgel (Swedberg-egység). Az emlősök riboszómái két nukleoprotein alegységből állnak, a nagy c
37.2. táblázat. Emlős riboszóma komponensek

molekulatömeg (60S), és kicsi, molekulatömege (40S). A 608-as alegység 58-riboszómális RNS-t (rRNS), 5,8S-pRNS-t és 28S-pRNS-t, valamint több mint 50 különböző polipeptidet tartalmaz. A kicsi, 408 alegységből egyetlen 18S-pRNS és körülbelül 30 polipeptid lánc található. Az 5S-RNS kivételével minden riboszómális RNS-nek van egy közös prekurzora, a 45S-RNS, amely a sejtmagban található (lásd a 40. fejezetet). Az 5S-RNS molekulának saját prekurzora van. A sejtmagban az erősen metilált riboszomális RNS-ek riboszomális fehérjékkel vannak csomagolva. A citoplazmában a riboszómák meglehetősen stabilak, és nagyszámú transzlációs ciklust képesek végrehajtani.
Kicsi stabil RNS. Eukarióta sejtekben nagyszámú diszkrét, erősen konzervált, kicsi és stabil RNS-molekulát találtak. A legtöbb ilyen típusú RNS a ribonukleoproteinekben található, és a sejtmagban, a citoplazmában vagy egyidejűleg mindkét kompartmentben lokalizálódik. Ezeknek a molekuláknak a mérete 90-300 nukleotid között változik, tartalmuk 100 000-1 000 000 kópia sejtenként.
A génexpresszió szabályozásában valószínűleg lényeges szerepet játszanak a kis nukleáris ribonukleinsav részecskék (amit gyakran snurp-nak neveznek - az angol kis nukleáris ribonukleinsav részecskékből). Úgy tűnik, hogy az U7 típusú nukleoprotein részecskék részt vesznek a hiszton mRNS-ek 3-terminálisának kialakításában. A részecskék valószínűleg szükségesek a poliadenilációhoz, az intron eltávolításhoz és az mRNS-feldolgozáshoz (lásd a 39. fejezetet). Tab. 37.3. összefoglalja a kis stabil RNS-ek néhány jellemzőjét.
37.3. táblázat. Az emlőssejtekben található kisméretű, stabil RNS bizonyos típusai

IRODALOM
Darnell J. et al. Molekuláris sejtbiológia, Scientific American Books, 1986.
Hunt T. DNA Makes RNA Makes Protein, Elsevier, 1983. Lewin B. Genes, 2. kiadás, Wiley, 1985.
Rich A. et al. A balkezes Z-DNS kémiája és biológiája, Annu. Fordulat. Biochem., 1984, 53, 847.
Turner P. Controlling roles for snurps, Nature 1985, 316, 105. Watson J. D. The Double Helix, Atheneum, 1968.
Watson J.D., Crick F.H.C. Nukleinsavak molekuláris szerkezete. Természet, 1953, 171, 737.
Zieve G. W. Kis stabil RNS-ek két csoportja, Cell, 1981, 25, 296.
A biológiai tudományok kandidátusa, S. GRIGOROVICH.
Története legkorábbi hajnalán, amikor az ember megszerezte az értelmet, és ezzel együtt az absztrakt gondolkodás képességét, a mindent megmagyarázó ellenállhatatlan szükség foglya lett. Miért süt a nap és a hold? Miért folynak a folyók? Milyen a világ? Természetesen az egyik legfontosabb az élők lényegének kérdése volt. Az éles különbség az élők, a növekvő és a mozdulatlan holtak között túl feltűnő volt ahhoz, hogy figyelmen kívül hagyjuk.
Az első vírus, amelyet D. Ivanovsky írt le 1892-ben, a dohánymozaikvírus. Ennek a felfedezésnek köszönhetően világossá vált, hogy vannak a sejtnél primitívebb élőlények.
Orosz mikrobiológus D. I. Ivanovsky (1864-1920), a virológia alapítója.
1924-ben A. I. Oparin (1894-1980) felvetette, hogy a fiatal Föld légkörében, amely hidrogénből, metánból, ammóniából, szén-dioxidból és vízgőzből állt, aminosavak szintetizálódhatnak, amelyek aztán spontán fehérjékké egyesülnek.
Oswald Avery amerikai biológus baktériumokkal végzett kísérletei során meggyőzően bizonyította, hogy a nukleinsavak felelősek az örökletes tulajdonságok átviteléért.
Az RNS és a DNS összehasonlító szerkezete.
A Tetrahymena legegyszerűbb szervezet ribozimének kétdimenziós térszerkezete.
A riboszóma sematikus ábrázolása, a fehérjeszintézis molekuláris gépe.
Az "evolúció in vitro" folyamatának vázlata (Selex módszer).
Louis Pasteur (1822-1895) volt az első, aki felfedezte, hogy ugyanazon anyag - a borkősav - kristályai két tükörszimmetrikus térbeli konfigurációval rendelkezhetnek.
Az 1950-es évek elején Stanley Miller, a Chicagói Egyetem (USA) munkatársa végezte el az első kísérletet, amely azokat a kémiai reakciókat szimulálta, amelyek egy fiatal Föld körülményei között lejátszódhatnak.
A királis molekulák, mint például az aminosavak, tükörszimmetrikusak, mint a bal és a jobb kéz. Maga a "kiralitás" kifejezés a görög "chiros" szóból származik - kéz.
Az RNS-világ elmélete.
Tudomány és élet // Illusztrációk
A történelem minden szakaszában az emberek saját megoldást kínáltak az élet bolygónkon való megjelenésének talányára. A régiek, akik nem ismerték a "tudomány" szót, egyszerű és hozzáférhető magyarázatot találtak az ismeretlenre: "Mindent, ami körül van, valamikor valaki teremtett." Így jelentek meg az istenek.
Az ókori civilizációk születésétől Egyiptomban, Kínában, majd a modern tudomány bölcsőjében - Görögországban - a középkorig a "hatóságok" megfigyelései és véleményei szolgálták a világ megismerésének fő módszerét. Az állandó megfigyelések egyértelműen bizonyították, hogy az élő bizonyos körülmények között az élettelenből kerül elő: a szúnyogok és krokodilok - a mocsári iszapból, a legyek - a rothadó táplálékból, az egerek pedig a búzával meghintett szennyesből. Csak bizonyos hőmérséklet és páratartalom betartása fontos.

A középkori európai "tudósok" a világ teremtésének vallási dogmáira és az isteni tervek érthetetlenségére támaszkodva csak a Biblia és a vallási írások keretein belül tartották lehetségesnek az élet eredetéről vitatkozni. A lényeget, amit Isten teremtett, nem lehet felfogni, csak „meghatározható” a szent szövegekből származó információk vagy az isteni ihlet hatására. A hipotézisek tesztelése akkoriban rossz modornak számított, a szentegyház véleményének megkérdőjelezésére tett kísérletet pedig kellemetlen tettnek, eretnekségnek és szentségtörésnek tekintették.
Az élet ismerete víztaposó volt. Az ókori Görögország filozófusainak eredményei kétezer évig a tudományos gondolkodás csúcsát képezték. Közülük a legjelentősebbek Platón (i. e. 428/427 - 347) és tanítványa, Arisztotelész (Kr. e. 384 - 322) voltak. Platón többek között felvetette az eredetileg élettelen anyag megelevenítésének ötletét egy halhatatlan nem anyagi lélek - "psziché" - beolvadása miatt. Így jelent meg az élőlények nem élő dolgokból való spontán keletkezésének elmélete.
A tudományos „kísérlet” szó nagy szó a reneszánsz korszakban jött létre. Kétezer évnek kellett eltelnie ahhoz, hogy az ember kétségbe vonja az ókori tudósok mérvadó állításainak megváltoztathatatlanságát. Az egyik első általunk ismert vakmerő Francisco Redi olasz orvos (1626-1698). Rendkívül egyszerű, de hatékony kísérletet hajtott végre: egy darab húst több edénybe helyezett, az egyiket sűrű ruhával, a másikat gézzel takarták le, a harmadikat pedig nyitva hagyták. Az a tény, hogy a légylárvák csak nyitott edényekben fejlődtek ki (amelyekre a legyek leszállhattak), de nem zárt edényekben (amelyek még mindig hozzáfértek a levegőhöz), élesen ellentmondott Platón és Arisztotelész támogatóinak egy felfoghatatlan életerőről szóló hiedelmeinek. a levegőt és az élettelen anyagot élő anyaggá alakítva.
Ezzel és hasonló kísérletekkel kezdődött a heves harcok időszaka a tudósok két csoportja között: a vitalisták és a gépészek között. A vita lényege a következő kérdés volt: "Megmagyarázható-e az élőlények működése (és megjelenése) olyan fizikai törvényekkel, amelyek az élettelen anyagra is vonatkoznak?" A vitalisták nemmel válaszoltak rá. "Sejt - csak sejtből, minden élőlény - csak élőből!" Ez a 19. század közepén megfogalmazott álláspont a vitalizmus zászlaja lett. A legparadoxabb ebben a vitában az, hogy a tudósok még ma sem rendelkeznek kísérleti megerősítéssel az eredet lehetőségére, ismerve a testünket alkotó atomok és molekulák "élettelen" természetét, és általában egyetértenek a mechanikai nézőponttal. sejtes élet élettelen anyagból. Még a legprimitívebb sejtet sem sikerült még senkinek sem "összeállítani" az élő szervezeteken kívüli "szervetlen" "részletekből". Tehát a végső pontot ebben a korszakalkotó vitában még meg kell határozni.
Hogyan keletkezhetett tehát élet a Földön? Osztozva a gépészek álláspontját, minden bizonnyal a legkönnyebb elképzelni, hogy az életnek először valami nagyon egyszerű, primitíven elrendezett formában kellett kialakulnia. De a szerkezet egyszerűsége ellenére is életnek kell lennie, vagyis valaminek, aminek van egy minimális tulajdonságkészlete, amely megkülönbözteti az élőt az élettelentől.
Mik ezek, ezek az élet szempontjából kritikus tulajdonságok? Mi különbözteti meg valójában az élőket az élettelenektől?
A 19. század végéig a tudósok meg voltak győződve arról, hogy minden élőlény sejtekből épül fel, és ez a legszembetűnőbb különbség közte és az élettelen anyag között. Ezt a vírusok felfedezése előtt is mérlegelték, amelyek bár kisebbek, mint az összes ismert sejt, de aktívan megfertőzhetnek más élőlényeket, szaporodhatnak bennük, és ugyanolyan (vagy nagyon hasonló) biológiai tulajdonságokkal rendelkező utódokat hozhatnak létre. Az első felfedezett vírust, a dohánymozaikvírust Dmitrij Ivanovszkij (1864-1920) orosz tudós írta le 1892-ben. Azóta világossá vált, hogy a sejteknél primitívebb lények is igényt tarthatnak arra, hogy Életnek hívják őket.
A vírusok, majd az élőlények még primitívebb formáinak – a viroidoknak – felfedezése végül lehetővé tette azoknak a minimális tulajdonságoknak a megfogalmazását, amelyek szükségesek és elegendőek ahhoz, hogy a vizsgált objektumot élőnek nevezzük. Először is képesnek kell lennie a saját fajtájának reprodukálására. Ez azonban nem az egyetlen feltétel. Ha az élet feltételezett ősanyaga (például egy primitív sejt vagy molekula) csak egyszerűen pontos másolatokat tudna előállítani önmagáról, akkor végső soron nem tudna életben maradni a fiatal Föld változó környezeti viszonyai között és más sejtek kialakulásában. , bonyolultabb formák (evolúció) lehetetlenné válnának. Ezért feltételezett primitív "első élet anyagunk" úgy definiálható, mint ami a lehető legegyszerűbben van elrendezve, de ugyanakkor képes megváltoztatni és átadni tulajdonságait az utódoknak.
Az RNS rendszerint egyetlen szálból áll, amely egy spirálba van csavarva. A vírusok kétszálú RNS-sel rendelkeznek. Az RNS a sejtmagban, sejtmagban, citoplazmában, riboszómákban található. Az RNS-molekulák rövidebbek, mint a DNS-molekulák.
RNS típusok
Háromféle RNS létezik: riboszómális, hírvivő (mRNS) és transzport (tRNS). Eltérnek egymástól a sejtben való elhelyezkedés, méret, nukleotid-összetétel és funkcionális tulajdonságok szerint.
Enzimek által szintetizált RNS RNS polimerázok a DNS molekulán. A DNS-molekula egy szakaszának nukleotidszekvenciája határozza meg, hogy a nukleotidok milyen sorrendben helyezkednek el egy RNS-molekulában.
A legtöbb sejtben az RNS-tartalom sokkal magasabb (5-10-szer), mint a DNS-tartalom. Az RNS nagy része riboszómális.
RNS funkciók
RNS funkciók: örökletes információkat valósít meg, részt vesz a fehérjék szintézisében.
Tájékoztató(mátrix) Az RNS (mRNS) a DNS egy szakaszának, azaz egy vagy több génnek a másolata. Genetikai információt továbbít a polipeptidlánc szintézisének helyére, és közvetlenül részt vesz benne. A DNS-szakasz hossza szerint, amelyet az RNS másol, 300-30 000 nukleotidból áll. A sejtben lévő rész és RNS a teljes mennyiségnek körülbelül 5%-a. A molekulák és az RNS viszonylag instabilak – gyorsan nukleotidokká bomlanak. Élettartamuk eukarióta sejtekben akár több óra, mikroorganizmusokban - néhány perc.
A DNS-molekulához hasonlóan az RNS-nek is vannak másodlagos és harmadlagos szerkezetei, amelyek hidrogénkötések, hidrofób, elektrosztatikus kölcsönhatások stb.
Riboszomális Az RNS a riboszómák tömegének 60%-át, a sejtben lévő RNS teljes mennyiségének körülbelül 85%-át teszi ki. 3000-5000 nukleotidot tartalmaz. Nem vesz részt az örökletes információk továbbításában. A riboszóma része, és kölcsönhatásba lép a fehérjéivel, amelyekből az eukariótákban körülbelül 100. Az eukarióták négyféle riboszómális RNS-t tartalmaznak, míg a prokarióták három. Szerkezeti funkciót lát el: az mRNS és a tRNS bizonyos térbeli elrendezését biztosítja a riboszómán.
Szállítás (tRNS) - aminosavakat szállít a fehérjeszintézis helyére. A komplementaritás elve szerint felismeri az mRNS azon régióját, amely megfelel a szállított aminosavnak. Mindegyik aminosavat saját tRNS-e szállítja a fehérjeszintézis helyére. A tRNS-eket a sejt citoszkeleton elemei szállítják.
Alakja lóhere (lóherelevél) - egy állandó másodlagos szerkezet, amelyet hidrogénkötések biztosítanak. A tRNS tetején az mRNS kodonnak megfelelő nukleotidhármas található, amelyet ún antikodon . A bázis közelében van egy hely, amelyhez kovalens kötés következtében egy aminosav molekula kapcsolódik. 70-90 nukleotid tRNS-t tartalmaz. Az RNS teljes mennyiségének legfeljebb 10%-át teszi ki. A tRNS-nek körülbelül 60 típusa ismert.
A tRNS meglehetősen kompakt L-szerű szabálytalan alakú lehet harmadlagos szerkezet.
Dinukleotidok
Két nukleotidból állnak, de szerkezeti jellemzőkkel rendelkeznek. A leghíresebbek a következők: nikotinamid-adenin-dinukleotid (NAD +), nikotinamid-adenin-dinukleotid-foszfát (NADP +). A fő funkció az elektronok (2) és a hidrogénionok (1) átvitele. Lehet helyreállítani:
OVER + + 2e - + H + → NADH;
NADP + + 2e - + H + → NADPH.
Egyes reakciók bizonyos helyén ezek a vegyületek hidrogén protont, elektronokat adnak át:
NADH → OVER + + 2e - + H + ;
NADPH → NADP + + 2e - + H +
Attól függően, hogy melyik monoszacharidot tartalmazza a polinukleotid szerkezeti egysége - ribóz vagy 2-dezoxiribóz, megkülönböztetni
- ribonukleinsavak(RNS) és
- dezoxiribonukleinsavak(DNS).
A DNS-makromolekulák nukleotidegységei tartalmazhatnak adenin, guanin, citozinés timin. Az RNS összetétele abban különbözik ahelyett timin jelenlegi uracil.
A DNS molekulatömege eléri a több tízmillió amu-t. Ezek a leghosszabb ismert makromolekulák. Az RNS molekulatömege sokkal kisebb (több száztól több tízezerig). A DNS főként a sejtek magjában, az RNS - a sejtek riboszómáiban és protoplazmájában található.
A nukleinsavak szerkezetének leírásakor a makromolekulák különböző szerveződési szintjeit veszik figyelembe: elsődlegesés másodlagos szerkezet.
- Elsődleges szerkezet A nukleinsavak a nukleotid-összetétel és a nukleotidegységek bizonyos szekvenciája a polimer láncban.
A rövidített egybetűs jelölésben ez a szerkezet így van írva ...– A – G – C –...
- Alatt másodlagos szerkezet a nukleinsavak megértik a polinukleotid láncok térben rendezett formáit.

Ezt a háromdimenziós szerkezetet számos hidrogénkötés tartja meg, amelyeket nitrogéntartalmú bázisok képeznek, amelyek a hélixbe befelé irányulnak. Hidrogénkötések jönnek létre az egyik lánc purinbázisa és a másik lánc pirimidinbázisa között. Ezek az alapok komplementer párokat alkotnak (a lat. komplementum- kiegészítés). A komplementer bázispárok közötti hidrogénkötések kialakulása azok térbeli megfelelésének köszönhető. A pirimidin bázis komplementer a purinbázissal:

Más bázispárok közötti hidrogénkötések nem teszik lehetővé, hogy beilleszkedjenek a kettős hélix szerkezetbe. Ily módon
- A TIMIN (T) az adenin (A) kiegészítője,
- A citozin (C) a GUANIN (G) kiegészítője.

A polinukleotid láncok komplementaritása a DNS tárolásának és az örökletes tulajdonságok átvitelének fő funkciójának kémiai alapja.
A DNS képességét nem csak a genetikai információ tárolására, hanem felhasználására is a következő tulajdonságai határozzák meg:
Az RNS másodlagos szerkezete. A DNS-től eltérően az RNS-molekulák egyetlen polinukleotid láncból állnak, és nincs szigorúan meghatározott térbeli alakjuk (az RNS másodlagos szerkezete biológiai funkcióiktól függ).
Az RNS fő szerepe a fehérjebioszintézisben való közvetlen részvétel. A celluláris RNS-nek három típusa ismert, amelyek különböznek egymástól a sejtben elfoglalt helyükben, összetételükben, méretükben és tulajdonságaikban, amelyek meghatározzák a fehérje makromolekulák képződésében betöltött specifikus szerepüket:
- Az információs (mátrix) RNS-ek a DNS-ben kódolt információkat a fehérje szerkezetéről továbbítják a sejtmagból a riboszómákba, ahol a fehérjeszintézis zajlik;
- A transzfer RNS-ek aminosavakat gyűjtenek össze a sejt citoplazmájában, és továbbítják a riboszómába; Az ilyen típusú RNS-molekulák „megtanulják” a hírvivő RNS-lánc megfelelő szakaszaiból, hogy mely aminosavaknak kell részt venniük a fehérjeszintézisben;
- A riboszómális RNS egy bizonyos szerkezetű fehérjeszintézist biztosít, információt olvas ki az információs (mátrix) RNS-ből.