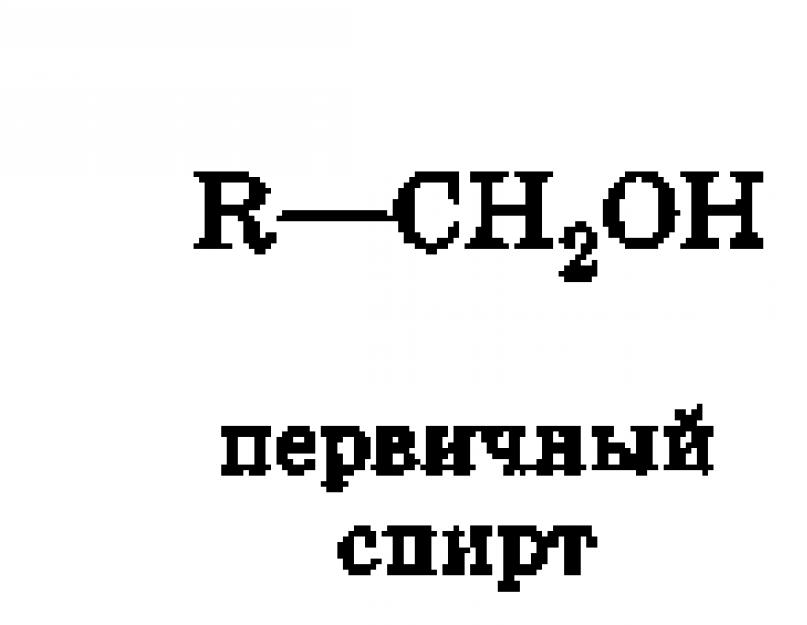MEGHATÁROZÁS
Korlátozza az egyértékű alkoholokat a metán sorozat szénhidrogéneinek származékainak tekinthetők, amelyek molekuláiban egy hidrogénatomot hidroxilcsoport helyettesít.
Tehát a telített egyértékű alkoholok egy szénhidrogén gyökből és egy -OH funkciós csoportból állnak. Az alkoholok nevében a hidroxilcsoportot -ol utótag jelöli.
A korlátozó egyatomos alkoholok általános képlete: C n H 2 n +1 OH vagy R-OH vagy C n H 2 n +2 O. Az alkohol molekulaképlete nem tükrözi a molekula szerkezetét, mivel két teljesen különböző anyag képes ugyanannak a bruttó képletnek felel meg, például a C 2 H 5 OH molekulaképlet közös mind az etil-alkoholra, mind az acetonra (dimetil-ketonra):
CH3-CH2-OH (etanol);
CH3-O-CH3 (aceton).
A metánsorozat szénhidrogéneihez hasonlóan a telített egyértékű alkoholok is a metanol homológ sorozatát alkotják.
Állítsuk össze ezt a homológ sorozatot, és vegyük figyelembe a sorozatba tartozó vegyületek fizikai tulajdonságaiban bekövetkezett változások mintázatait a szénhidrogéngyök növekedésétől függően (1. táblázat).
Telített egyértékű alkoholok homológ sorozata (nem teljes).
1. táblázat: Telített egyértékű alkoholok homológ sorozata (nem teljes).
A limitált egyértékű alkoholok könnyebbek, mint a víz, mivel sűrűségük kisebb, mint egységnyi. Az alacsonyabb szénatomszámú alkoholok minden tekintetben elegyednek vízzel, a szénhidrogéngyök növekedésével ez a képesség csökken. A legtöbb alkohol jól oldódik szerves oldószerekben. Az alkoholok forrás- és olvadáspontja magasabb, mint a megfelelő szénhidrogéneké vagy halogénszármazékoké, mivel intermolekuláris kötések képződhetnek bennük.
A telített egyértékű alkoholok legfontosabb képviselői a metanol (CH 3 OH) és az etanol (C 2 H 5 OH).
Példák problémamegoldásra
1. PÉLDA
| Gyakorlat | A természetes gyöngyökben a kalcium, a szén és az oxigén tömegaránya 10:3:12. Mi a legegyszerűbb gyöngy formula? |
| Megoldás | Ahhoz, hogy megtudjuk, milyen kapcsolatban állnak a kémiai elemek egy molekula összetételében, meg kell találni az anyagmennyiségüket. Ismeretes, hogy az anyag mennyiségének meghatározásához a képletet kell használni: Keressük meg a kalcium, a szén és az oxigén moláris tömegét (a D. I. Mengyelejev periódusos rendszeréből vett relatív atomtömegek értékeit egész számokra kerekítjük). Ismeretes, hogy M = Mr, tehát M(Ca) = 40 g/mol, Ar(C) = 12 g/mol és M(O) = 32 g/mol. Ezután ezen elemek anyagának mennyisége egyenlő: n (Ca) = m (Ca)/M (Ca); n (Ca) = 10/40 \u003d 0,25 mol. n(C)=m(C)/M(C); n(C)=3/12=0,25 mol. n(O)=m(O)/M(O); n (O) = 12/16 \u003d 0,75 mol. Keresse meg a mólarányt: n(Ca):n(C):n(O)=0,25:0,25:0,75=1:1:3, azok. a gyöngyvegyület képlete a CaCO 3. |
| Válasz | CaCO3 |
2. PÉLDA
| Gyakorlat | A nitrogén-monoxid 63,2% oxigént tartalmaz. Mi az oxid képlete |
| Megoldás | Az X elem tömeghányadát a HX összetétel molekulájában a következő képlettel számítjuk ki: ω (X) = n × Ar (X) / M (HX) × 100%. Számítsuk ki a nitrogén tömeghányadát az oxidban: ω (N) \u003d 100% - ω (O) \u003d 100% - 63,2% \u003d 36,8%. Jelöljük a vegyületet alkotó elemek móljainak számát "x" (nitrogén) és "y" (oxigén) alakban. Ekkor a mólarány így fog kinézni (a D. I. Mengyelejev periódusos rendszeréből vett relatív atomtömegek értékeit egész számokra kerekítjük): x:y = ω(N)/Ar(N): ω(O)/Ar(O); x:y= 36,8/14: 63,2/16; x:y= 2,6:3,95 = 1:2. Tehát a nitrogén és oxigén vegyületének képlete NO 2 lesz. Ez a nitrogén-monoxid (IV). |
| Válasz | NEM 2 |
A cikk tartalma
ALKOHOL(alkoholok) - egy vagy több C-OH csoportot tartalmazó szerves vegyületek osztálya, míg az OH hidroxilcsoport egy alifás szénatomhoz kapcsolódik (olyan vegyületek, amelyekben a C-OH csoport szénatomja az aromás mag része, fenoloknak nevezik)
Az alkoholok osztályozása változatos, és attól függ, hogy a szerkezet melyik jellemzőjét veszik alapul.
1. A molekulában lévő hidroxilcsoportok számától függően az alkoholokat a következőkre osztják:
a) egyatomos (egy hidroxil-OH csoportot tartalmaz), például metanol CH 3 OH, etanol C 2 H 5 OH, propanol C 3 H 7 OH
b) többatomos (két vagy több hidroxilcsoport), például etilénglikol
HO-CH 2 -CH 2 -OH, glicerin HO-CH 2 -CH (OH) -CH 2 -OH, pentaeritrit C (CH 2 OH) 4.
Azok a vegyületek, amelyekben egy szénatom két hidroxilcsoportot tartalmaz, a legtöbb esetben instabilak és könnyen aldehidekké alakulnak, miközben leválasztják a vizet: RCH (OH) 2 ® RCH \u003d O + H 2 O
2. A szénatom típusa szerint, amelyhez az OH-csoport kapcsolódik, az alkoholokat a következőkre osztják:
a) primer, amelyben az OH csoport a primer szénatomhoz kapcsolódik. Az elsődleges szénatomot hívják (pirossal kiemelve), amely csak egy szénatomhoz kapcsolódik. Példák primer alkoholokra - etanol CH 3 - C H 2 -OH, propanol CH 3 -CH 2 - C H2-OH.
b) szekunder, amelyben az OH-csoport egy szekunder szénatomhoz kapcsolódik. A szekunder szénatom (kék színnel kiemelve) egyidejűleg két szénatomhoz kötődik, például szekunder propanolhoz, szekunder butanolhoz (1. ábra).
Rizs. egy. A SZEKunder alkoholok SZERKEZETE
c) tercier, amelyben az OH-csoport a tercier szénatomhoz kapcsolódik. A tercier szénatom (zölddel kiemelve) egyidejűleg három szomszédos szénatomhoz kötődik, például tercier butanolhoz és pentanolhoz (2. ábra).
Rizs. 2. A TERCIER ALKOHOLMOK SZERKEZETE
A hozzá kapcsolódó alkoholcsoportot a szénatom típusától függően primernek, szekundernek vagy terciernek is nevezik.
A két vagy több OH csoportot tartalmazó többértékű alkoholokban primer és szekunder HO csoportok is jelen lehetnek egyidejűleg, például a glicerinben vagy a xilitben (3. ábra).
Rizs. 3. PRIMER ÉS SZEKunder OH-CSOPORTOK KOMBINÁCIÓJA A POLIATOM ALKOHOLMOK SZERKEZETÉBEN.
3. Az OH csoporttal összekapcsolt szerves csoportok szerkezete szerint az alkoholokat telítettekre (metanol, etanol, propanol), telítetlenekre osztják, például allil-alkohol CH 2 \u003d CH - CH 2 -OH, aromás (pl. , benzil-alkohol C 6 H 5 CH 2 OH), amely az R csoportban aromás csoportot tartalmaz.
Telítetlen alkoholok, amelyekben az OH csoport "csatlakozik" a kettős kötéshez, pl. olyan szénatomhoz kötődnek, amely egyidejűleg részt vesz a kettős kötés kialakulásában (például vinil-alkohol CH 2 \u003d CH–OH), rendkívül instabilak és azonnal izomerizálódnak ( cm.IZOMERIZÁCIÓ) aldehidekké vagy ketonokká:
CH 2 \u003d CH–OH ® CH 3 -CH \u003d O
Az alkoholok nómenklatúrája.
Az egyszerű szerkezetű általános alkoholok esetében egyszerűsített nómenklatúrát használnak: a szerves csoport nevét melléknévvé alakítják (az utótag és a "végződés" használatával új) és adjuk hozzá az „alkohol” szót:
Abban az esetben, ha a szerves csoport szerkezete összetettebb, akkor az összes szerves kémiára vonatkozó szabályokat alkalmazzuk. Az ilyen szabályok szerint összeállított neveket szisztematikusnak nevezzük. E szabályok szerint a szénhidrogénláncot attól a végétől kell számozni, amelyikhez az OH-csoport a legközelebb van. Ezen túlmenően ez a számozás a különböző szubsztituensek helyzetének jelzésére szolgál a főlánc mentén, a név végére az „ol” utótag és az OH csoport helyzetét jelző szám kerül (4. ábra):
Rizs. négy. AZ ALKOHOLOK RENDSZERES MEGNEVEZÉSE. A funkcionális (OH) és a szubsztituens (CH 3) csoportok, valamint a hozzájuk tartozó digitális indexek különböző színekkel vannak kiemelve.
A legegyszerűbb alkoholok szisztematikus nevei ugyanazon szabályok szerint készülnek: metanol, etanol, butanol. Egyes alkoholok esetében megmaradtak a történelmileg kialakult triviális (leegyszerűsített) elnevezések: propargil-alkohol HCє C–CH 2 –OH, glicerin HO–CH 2 –CH (OH)–CH 2 –OH, pentaeritrit C (CH 2 OH) 4, fenetil-alkohol C6H5-CH2-CH2-OH.
Az alkoholok fizikai tulajdonságai.
Az alkoholok a legtöbb szerves oldószerben oldódnak, az első három legegyszerűbb képviselő - a metanol, az etanol és a propanol, valamint a tercier butanol (H 3 C) 3 COH - bármilyen arányban elegyedik vízzel. A szerves csoportban lévő C atomok számának növekedésével a hidrofób (vízlepergető) hatás kezd hatni, a vízben való oldhatóság korlátozottá válik, 9 szénatomot meghaladó R-nél pedig gyakorlatilag megszűnik.
Az OH-csoportok jelenléte miatt az alkoholmolekulák között hidrogénkötések jönnek létre.
Rizs. 5. HIDROGÉN KÖTÉSEK ALKOHOLMAKBAN(szaggatott vonallal jelölve)
Ennek eredményeként minden alkoholnak magasabb a forráspontja, mint a megfelelő szénhidrogéneké, például a T. kip. etanol + 78 °C, és T. kip. etán –88,63 °C; T. kip. butanol és bután +117,4°C, illetve –0,5°C.
Az alkoholok kémiai tulajdonságai.
Az alkoholokat különféle átalakulások különböztetik meg. Az alkoholok reakcióinak van néhány általános mintázata: a primer egyértékű alkoholok reakcióképessége nagyobb, mint a szekunder alkoholoké, viszont a szekunder alkoholok kémiailag aktívabbak, mint a tercier alkoholok. A kétértékű alkoholok esetében abban az esetben, ha az OH-csoportok a szomszédos szénatomokon helyezkednek el, fokozott (az egyértékű alkoholokhoz képest) reaktivitás figyelhető meg ezen csoportok kölcsönös befolyása miatt. Az alkoholok esetében olyan reakciók lehetségesek, amelyek a C–O és az O–H kötések felhasadásával mennek végbe.
1. Az О–Н kötésen keresztül lezajló reakciók.
Az aktív fémekkel (Na, K, Mg, Al) való kölcsönhatás során az alkoholok gyenge savak tulajdonságait mutatják, és alkoholátoknak vagy alkoxidoknak nevezett sókat képeznek:
2CH 3OH + 2Na® 2CH 3 OK + H 2
Az alkoholok kémiailag instabilak és víz hatására hidrolizálnak alkoholt és fém-hidroxidot képezve:
C 2 H 5 OK + H 2 O ® C 2 H 5 OH + KOH
Ez a reakció azt mutatja, hogy az alkoholok gyengébb savak a vízhez képest (az erős sav kiszorítja a gyengét), ráadásul lúgoldatokkal való kölcsönhatás során az alkoholok nem képeznek alkoholátokat. A többértékű alkoholokban azonban (ha a szomszédos szénatomokhoz OH csoportok kapcsolódnak) az alkoholcsoportok savassága sokkal nagyobb, és nem csak fémekkel, hanem lúgokkal is kölcsönhatásba lépve alkoholátokat képezhetnek:
HO–CH 2 –CH 2 –OH + 2NaOH ® NaO–CH 2 –CH 2 –ONa + 2H 2 O
Ha a többértékű alkoholokban a HO csoportok nem szomszédos C atomokhoz kapcsolódnak, az alkoholok tulajdonságai közel állnak az egyértékűhez, mivel a HO csoportok kölcsönös hatása nem jelenik meg.
Amikor ásványi vagy szerves savakkal kölcsönhatásba lépnek, az alkoholok észtereket képeznek - az R-O-A fragmentumot tartalmazó vegyületeket (A a savmaradék). Az alkoholok karbonsavak anhidridjeivel és savkloridjaival való kölcsönhatás során is észterek keletkeznek (6. ábra).
Az oxidálószerek (K 2 Cr 2 O 7, KMnO 4) hatására a primer alkoholokból aldehidek, a szekunder alkoholokból ketonok képződnek (7. ábra)
Rizs. 7. ALDEHIDEK ÉS KETONOK KÉPZÉS AZ ALKOHOLMOK OXIDÁLÁSA ALATT
Az alkoholok redukciója a kiindulási alkoholmolekulával megegyező számú C atomot tartalmazó szénhidrogének képződéséhez vezet (8. ábra).
Rizs. nyolc. A BUTANOL VISSZANYERÉSE
2. A C–O kötésnél lezajló reakciók.
Katalizátorok vagy erős ásványi savak jelenlétében az alkoholok dehidratálódnak (a víz leválik), miközben a reakció két irányba mehet:
a) intermolekuláris dehidratáció két alkoholmolekula részvételével, miközben az egyik molekulában a C–O kötések megszakadnak, ami éterek képződését eredményezi – az R–O–R fragmentumot tartalmazó vegyületek (9A. ábra).
b) az intramolekuláris dehidratáció során alkének képződnek - kettős kötéssel rendelkező szénhidrogének. Gyakran mindkét folyamat – egy éter és egy alkén képződése – párhuzamosan megy végbe (9B. ábra).
A szekunder alkoholok esetében alkén képződése során a reakció két iránya lehetséges (9C. ábra), előnyös az az irány, amelyben a kondenzáció során a hidrogén a legkevésbé hidrogénezett szénatomról válik le (jelölve: 3. szám), azaz kevesebb hidrogénatom veszi körül (az 1. atomhoz képest). ábrán látható. 10 reakciót alkalmaznak alkének és éterek előállítására.
Az alkoholokban a C–O kötés felszakadása akkor is megtörténik, ha az OH csoportot halogénnel vagy aminocsoporttal helyettesítjük (10. ábra).
Rizs. tíz. AZ OH-CSOPORT CSERÉJE HALOGÉN- VAGY AMINO CSOPORTRA
ábrán látható reakciók. 10-ből halogénezett szénhidrogéneket és aminokat állítanak elő.
Alkohol beszerzése.
A fent bemutatott reakciók egy része (6., 9., 10. ábra) reverzibilis, és változó körülmények között ellentétes irányba is lezajlik, például észterek és halogénezett szénhidrogének hidrolízise során alkoholok képződéséhez vezet. 11A. és B. ábra), valamint hidratációs alkének - víz hozzáadásával (11B. ábra).
Rizs. tizenegy. AKOHOLMOK ELŐÁLLÍTÁSA SZERVES VEGYÜLETEK HIDROLÍZISÉVEL ÉS HIDRÁLTÁSÁVAL
Az alkének hidrolízisreakciója (11. ábra, B séma) a legfeljebb 4 szénatomos rövid szénláncú alkoholok ipari előállításának hátterében áll.
Etanol képződik a cukrok, például a glükóz C 6 H 12 O 6 úgynevezett alkoholos fermentációja során is. A folyamat élesztőgombák jelenlétében megy végbe, és etanol és CO 2 képződéséhez vezet:
C 6 H 12 O 6 ® 2C 2 H 5 OH + 2CO 2
Az erjesztés legfeljebb 15%-os vizes alkohololdatot tud előállítani, mivel az élesztőgombák elpusztulnak magasabb alkoholkoncentrációnál. A nagyobb koncentrációjú alkoholos oldatokat desztillációval állítják elő.
A metanolt iparilag szén-monoxid redukciójával állítják elő 400°C-on, 20-30 MPa nyomáson, réz-, króm- és alumínium-oxidokból álló katalizátor jelenlétében:
CO + 2 H 2 ® H 3 SON
Ha az alkének hidrolízise helyett (11. ábra) oxidációt végzünk, akkor kétértékű alkoholok képződnek (12. ábra).
Rizs. 12. DIATÓMÁS AKOHOLMOK BESZERZÉSE
Az alkoholok használata.
Az alkoholok azon képessége, hogy különféle kémiai reakciókban részt vesznek, lehetővé teszi, hogy felhasználják őket mindenféle szerves vegyület előállítására: aldehidek, ketonok, karbonsavak, éterek és észterek szerves oldószerként, polimerek, színezékek és gyógyszerek előállításában.
Oldószerként metanol CH 3 OH-t használnak, és a fenol-formaldehid gyanták előállításához használt formaldehid előállítása során a metanolt a közelmúltban ígéretes motorüzemanyagnak tekintik. A földgáz előállítása és szállítása során nagy mennyiségű metanolt használnak fel. A metanol az összes alkohol közül a legmérgezőbb vegyület, szájon át szedve a halálos adag 100 ml.
Az etanol C 2 H 5 OH kiindulási vegyület acetaldehid, ecetsav, valamint oldószerként használt karbonsav-észterek előállításához. Ezen túlmenően az etanol minden alkoholos ital fő összetevője, az orvostudományban is széles körben használják fertőtlenítőként.
A butanolt zsírok és gyanták oldószereként használják, emellett alapanyagként szolgál aromás anyagok (butil-acetát, butil-szalicilát stb.) előállításához. A samponokban olyan komponensként használják, amely növeli az oldatok átlátszóságát.
A benzil-alkohol C 6 H 5 -CH 2 -OH szabad állapotban (és észterek formájában) megtalálható a jázmin és a jácint illóolajában. Antiszeptikus (fertőtlenítő) tulajdonságokkal rendelkezik, kozmetikában tartósítószerként krémekhez, testápolókhoz, fogászati elixírekhez, illatszerként illatanyagként használják.
A C 6 H 5 -CH 2 -CH 2 -OH fenetil-alkohol rózsaillatú, a rózsaolajban található, és az illatszeriparban használják.
Az etilénglikol HOCH 2 -CH 2 OH-t műanyagok gyártásában és fagyállóként (a vizes oldatok fagyáspontját csökkentő adalékanyagként) használják, emellett textil- és nyomdafestékek gyártásában.
A HOCH 2 -CH 2 OCH 2 -CH 2 OH dietilén-glikolt hidraulikus fékberendezések feltöltésére, valamint a textiliparban szövetek kidolgozására és festésére használják.
A glicerin HOCH 2 -CH(OH) -CH 2 OH poliészter gliptálgyanták előállítására szolgál, emellett számos kozmetikai készítmény összetevője. A bányászatban és a vasútépítésben robbanóanyagként használt dinamit fő alkotóeleme a nitroglicerin (6. ábra).
A pentaeritrit (HOCH 2) 4 C poliészterek (pentaftálgyanták) előállítására, műgyanták keményítőjeként, polivinil-klorid lágyítójaként, valamint tetranitropentaeritrit robbanóanyag gyártásánál használatos.
A xilit HOCH2–(CHOH)3–CH2OH és szorbit HOCH2– (CHOH)4–CH2OH többértékű alkoholok édes ízűek, és cukor helyett cukorbetegek és elhízottak számára készült édességek gyártásában használják. A szorbit a berkenye és a cseresznye bogyóiban található.
Mihail Levitsky
Az alkoholok egy vagy több -OH csoportot tartalmazó szénhidrogének származékai, amelyeket hidroxilcsoportnak vagy hidroxilcsoportnak neveznek.
Az alkoholok osztályozása:
1. A molekulában található hidroxilcsoportok száma szerint az alkoholokat egyatomos (egy hidroxilcsoporttal), kétatomos (két hidroxilcsoporttal), háromértékű (három hidroxilcsoporttal) és többértékű alkoholra osztják.
A telített szénhidrogénekhez hasonlóan az egyértékű alkoholok is szabályosan felépített homológok sorozatát alkotják:
Más homológ sorozatokhoz hasonlóan az alkoholsorozat minden tagja összetételében különbözik az előző és az azt követő tagoktól a homológ különbséggel (-CH 2 -).
2. Attól függően, hogy a hidroxilcsoport melyik szénatomon található, megkülönböztetünk primer, szekunder és tercier alkoholokat. A primer alkoholok molekulái tartalmaznak egy -CH 2 OH csoportot, amely egy gyökkel vagy a metanolnál hidrogénatommal (az elsődleges szénatomon hidroxilcsoport) kapcsolódik. A szekunder alkoholokat egy >CHOH csoport jellemzi, amely két gyökkel társul (hidroxil a szekunder szénatomon). A tercier alkoholok molekuláiban egy >C-OH csoport három gyökhöz kapcsolódik (a tercier szénatomon hidroxil). A gyököt R-vel jelölve felírhatjuk ezeknek az alkoholoknak a képleteit általános formában: 
Az IUPAC-nómenklatúrával összhangban az egyértékű alkohol nevének megalkotásakor az -ol utótagot adják hozzá az eredeti szénhidrogén nevéhez. Ha a vegyületben magasabb funkciós csoportok vannak, a hidroxilcsoportot a hidroxi- előtaggal jelöljük (oroszul gyakran használják az oxi- előtagot). Főláncként a szénatomok leghosszabb el nem ágazó láncát választjuk, amely egy hidroxilcsoporthoz kapcsolódó szénatomot tartalmaz; ha a vegyület telítetlen, akkor a többszörös kötés is ebbe a láncba tartozik. Megjegyzendő, hogy a számozás kezdetének meghatározásakor a hidroxil funkció általában elsőbbséget élvez a halogénnel, kettős kötéssel és alkilcsoporttal szemben, ezért a számozás a lánc végétől kezdődik, amelyhez közelebb van a hidroxilcsoport:

A legegyszerűbb alkoholokat a hidroxilcsoporthoz kapcsolódó gyökök alapján nevezzük el: (CH 3) 2 CHOH - izopropil-alkohol, (CH 3) 3 COH - terc-butil-alkohol.
Gyakran használják az alkoholok racionális nómenklatúráját. E nómenklatúra szerint az alkoholokat a metil-alkohol - karbinol származékainak tekintik:

Ez a rendszer olyan esetekben kényelmes, amikor a gyök neve egyszerű és könnyen megszerkeszthető.
2. Az alkoholok fizikai tulajdonságai
Az alkoholok forráspontja magasabb, és lényegesen kevésbé illékonyak, magasabb az olvadáspontjuk, és jobban oldódnak vízben, mint a megfelelő szénhidrogének; a különbség azonban csökken a molekulatömeg növekedésével.
A fizikai tulajdonságok különbsége a hidroxilcsoport nagy polaritásából adódik, ami hidrogénkötésen keresztül alkoholmolekulák asszociációjához vezet:

Így az alkoholok magasabb forráspontjai a megfelelő szénhidrogének forráspontjaihoz képest abból adódnak, hogy a molekulák gázfázisba való átmenete során meg kell szakítani a hidrogénkötéseket, ami további energiát igényel. Másrészt ez a fajta asszociáció mintegy a molekulatömeg növekedéséhez vezet, ami természetesen a volatilitás csökkenéséhez vezet.
A kis molekulatömegű alkoholok jól oldódnak vízben, ami érthető, ha a vízmolekulákkal hidrogénkötések alakulhatnak ki (maga a víz nagyon nagy mértékben kapcsolódik). A metil-alkoholban a hidroxilcsoport a molekula tömegének csaknem felét teszi ki; ezért nem csoda, hogy a metanol minden tekintetben elegyedik vízzel. Az alkoholban lévő szénhidrogénlánc méretének növekedésével a hidroxilcsoport hatása az alkoholok tulajdonságaira csökken, illetve az anyagok vízben való oldhatósága csökken, és szénhidrogénben való oldhatóságuk nő. A nagy molekulatömegű egyértékű alkoholok fizikai tulajdonságai már nagyon hasonlóak a megfelelő szénhidrogénekéihez.

A szerves oxigéntartalmú vegyületek, amelyek közül az egyik a különféle alkoholok, a szénhidrogének fontos funkcionális származékai. Egyatomosak, két- és többatomosak. Az egyértékű alkoholok valójában szénhidrogének származékai, amelyek molekuláris komponensében egy hidroxilcsoport ("-OH") telített szénatomokhoz kapcsolódik.
Terítés
Az egyértékű alkoholok széles körben elterjedtek a természetben. Tehát a metil-alkohol kis mennyiségben megtalálható számos növény (például disznófű) levében. Az etil-alkohol, amely szerves vegyületek alkoholos erjesztésének terméke, savanyított gyümölcsökben és bogyókban található. A cetil-alkohol a bálnaolajban található. A méhviasz magában foglalja a ceril- és miricil-alkoholokat. A rózsaszirom 2-fenil-etanolt tartalmaz. A terpénalkoholok illatos anyagok formájában számos fűszer-aromás kultúrában jelen vannak.
Osztályozás
Az alkoholokat a hidroxilcsoportok molekulaszáma szerint osztályozzák. Először is:
- egyértékű alkoholok (pl. etanol);
- kétatomos (etándiol);
- többatomos (glicerin).
A szénhidrogén gyök természete szerint az alkoholokat aromás, alifás és ciklusosra osztják. A hidroxilcsoporthoz kötődő szénatom típusától függően az alkoholokat primer, szekunder és terciernek tekintjük. Az egyértékű alkohol általános képletét az egyértékű alkoholokra alkalmazva a következő értékkel fejezzük ki: C n H 2n + 2 O.

Elnevezéstan
Az alkoholok elnevezése a gyök-funkcionális nómenklatúra szerint a gyök hidroxilcsoportjához kapcsolódó névből és az "alkohol" szóból alakul ki. Az IUPAC szisztematikus nómenklatúrája szerint az alkohol nevét a megfelelő alkánból alakítják ki, az "-ol" végződés hozzáadásával. Például:
- metanol - metil-alkohol;
- metil-propanol-1-2-izobutil (terc-butil);
- etanol - etil;
- butanol-1-2-butil (szek-butil);
- propanol-1-2-propil (izopropil).
Az IUPAC-szabályok szerinti számozás a hidroxilcsoport helyzete szerint van osztályozva, alacsonyabb számot kap. Például: pentándiol-2-4, 4-metil-pentanol-2 stb.
izoméria
A limitált egyértékű alkoholok a következő típusú szerkezeti és térbeli izomériákkal rendelkeznek. Például:
- Szénváz.
- Izomer éterek.
- A funkcionális csoport pozíciói.
Az alkoholok térbeli izomériáját az optikai izoméria képviseli. Optikai izoméria lehetséges aszimmetrikus szénatom jelenlétében (amely négy különböző szubsztituenst tartalmaz) a molekulában.

Módszerek egyértékű alkoholok előállítására
Az egyértékű alkohol korlátozását többféle módon is beszerezheti:
- Halogén-alkánok hidrolízise.
- Alkének hidratálása.
- Aldehidek és ketonok csökkentése.
- szerves magnézium szintézis.
A halogén-alkánok hidrolízise az egyik leggyakoribb laboratóriumi módszer az alkoholok előállítására. Vízzel (alternatívaként - lúg vizes oldatával) végzett kezeléssel elsődleges és másodlagos alkoholokat kapnak:
CH 3 - CH 2 -Br + NaOH → CH 3 - CH 2 - OH + NaBr.
A tercier halogén-alkánok még könnyebben hidrolizálódnak, de könnyebb az eliminációs mellékreakciójuk. Ezért a tercier alkoholokat más módszerekkel állítják elő.
Az alkéneket úgy hidratálják, hogy vizet adnak az alkénekhez savtartalmú katalizátorok (H 3 PO 4) jelenlétében. Az eljárás olyan alkoholok ipari előállítására épül, mint az etil-, izopropil-, terc-butil-alkohol.
A karbonilcsoport redukcióját hidrogénnel hajtjuk végre hidrogénező katalizátor (Ni vagy Pt) jelenlétében. Ebben az esetben ketonokból szekunder alkoholok, aldehidekből pedig primer telített egyértékű alkoholok keletkeznek. A folyamat képlete:
CH 3 - C = O (-H) + H 2 (etanol) → CH 3 - CH 2 - OH (etanol).
A szerves magnéziumvegyületeket alkilmagnézium-halogenidek aldehidekhez és ketonokhoz való hozzáadásával állítják elő. A reakciót száraz dietil-éterben hajtjuk végre. A szerves magnéziumvegyületek ezt követő hidrolízise egyértékű alkoholokat képez.
Primer alkoholok a Grignard-reakció során csak formaldehidből és bármilyen alkil-magnézium-halogenidből keletkeznek. Más aldehidek szekunder alkoholokat adnak ezzel a reakcióval, ketonok - tercier alkoholokat.

Metanol ipari szintézise
Az ipari módszerek általában folyamatos eljárások, amelyekben nagy tömegű reagensek többszörös recirkulációját hajtják végre, gázfázisban. Iparilag fontos alkoholok a metanol és az etanol.
A metanolt (termelési mennyisége az alkoholok közül a legnagyobb) 1923-ig a fa száraz desztillációjával (levegő hozzáférés nélküli fűtéssel) nyerték. Ma szintetikus gázból (CO és H 2 keverékéből) állítják elő. Az eljárást 5-10 MPa nyomáson, oxidkatalizátorok (ZnO + Cr 2 O 3, CuO + ZnO + Al 2 O 3 és mások) alkalmazásával, 250-400 ˚C hőmérséklet-tartományban hajtják végre, ennek eredményeként telített egyértékű alkoholokat kaptunk. A reakció képlete: CO + 2H 2 → CH 3 OH.
Az 1980-as években ennek a folyamatnak a mechanizmusának tanulmányozásakor azt találták, hogy a metanol nem szén-monoxidból, hanem szén-dioxidból keletkezik, amely a szén-monoxid és a víznyomok kölcsönhatása eredménye.

Az etanol ipari szintézise
A műszaki etanol szintézisének általános előállítási módja az etilén hidratálása. Az egyértékű alkohol etanol képlete a következő formában lesz:
CH 2 \u003d CH 2 + H 2 O → CH 3 - CH 2 OH.
Az eljárást 6-7 MPa nyomáson végezzük gázfázisban, etilént és vízgőzt vezetve át a katalizátoron. A katalizátor szilikagélen leválasztott foszforsav vagy kénsav.
Az élelmiszer- és gyógyászati etil-alkoholt a szőlőben, bogyós gyümölcsben, gabonafélékben, burgonyában található cukrok enzimatikus hidrolízisével állítják elő, majd a keletkező glükóz erjesztésével. A cukros anyagok fermentációját az enzimek csoportjába tartozó élesztőgombák okozzák. A folyamathoz a legkedvezőbb hőmérséklet 25-30˚С. Az ipari vállalkozásoknál etanolt használnak, amelyet a fa és a cellulóz- és papírgyártásból származó hulladékok hidrolízise során keletkező szénhidrátok fermentációjával nyernek.

Az egyértékű alkoholok fizikai tulajdonságai
Az alkoholmolekulákban hidrogénatomok kapcsolódnak egy elektronegatív elemhez - oxigénhez, amely gyakorlatilag elektronmentes. Ezen hidrogénatomok és az egyedül álló elektronpárokat tartalmazó oxigénatomok között intermolekuláris hidrogénkötések jönnek létre.
A hidrogénkötés a hidrogénatom sajátos tulajdonságainak köszönhető:
- Amikor a kötő elektronokat egy elektronegatívabb atomhoz húzzuk, a hidrogénatom magja „csupasz”, és más elektronok által árnyékolatlan proton keletkezik. Ha bármely más atom ionizálódik, az elektronhéj továbbra is megmarad, és átvilágítja az atommagot.
- A hidrogénatom a többi atomhoz képest kis méretű, aminek következtében elég mélyen képes behatolni a szomszédos, negatívan polarizált atom elektronhéjába anélkül, hogy kovalens kötéssel kapcsolódna hozzá.
A hidrogénkötés körülbelül 10-szer gyengébb, mint a szokásos kovalens kötés. A hidrogénkötés energiája 4-60 kJ/mol, alkoholmolekulák esetében 25 kJ/mol. A közönséges s-kötésektől hosszabb hosszban (0,166 nm) különbözik az O-H kötés hosszához képest (0,107 nm).
Kémiai tulajdonságok
Az egyértékű alkoholok kémiai reakcióit az határozza meg, hogy molekuláikban jelen van egy hidroxilcsoport, amely funkcionális. Az oxigénatom sp3 hibrid állapotban van. A kötési szög közel van a tetraéderhez. Két sp3-hibrid pálya kötést hoz létre más atomokkal, a másik két pálya pedig magányos elektronpárokat tartalmaz. Ennek megfelelően egy részleges negatív töltés az oxigénatomon, a részleges pozitív töltés pedig a hidrogén- és szénatomon koncentrálódik.
A C-O és C-H kötések kovalens polárisak (az utóbbi polárisabb). Az O-H kötés heterolitikus hasítása H + képződésével meghatározza az egyértékű alkoholok savas tulajdonságait. A részlegesen pozitív töltésű szénatomot nukleofil reagens támadhatja meg.

Savas tulajdonságok
Az alkoholok nagyon gyenge savak, gyengébbek, mint a víz, de erősebbek, mint az acetilén. Nem változtatják meg az indikátor színét. Az egyértékű alkoholok oxidációja akkor nyilvánul meg, amikor aktív fémekkel (alkáli és alkáliföldfém) kölcsönhatásba lépnek hidrogén felszabadulásával és alkoholátok képződésével:
2ROH + 2Na → 2RONa + H2.
Az alkálifém-alkoholátok olyan anyagok, amelyek oxigén és nátrium között ionos kötéssel rendelkeznek; egyértékű alkohol oldatában disszociálva alkoxidionokat képeznek:
CH 3 ONa → CH 3 O - + Na + (metoxidion).
Az alkoholátok képzése az alkohol és nátrium-amid reakciójával is végrehajtható:
C 2 H 5 OH + NaNH 2 → C 2 H 5 ONa + NH 3.
Az etanol reagál lúggal? Szinte soha. A víz erősebb sav, mint az etil-alkohol, ezért itt egyensúly jön létre. Az alkoholmolekulában lévő szénhidrogén gyök hosszának növekedésével a savas tulajdonságok csökkennek. Ezenkívül a telített egyértékű alkoholokat a savasság csökkenése jellemzi a következő sorozatban: primer → szekunder → tercier.
Nukleofil szubsztitúciós reakció
Az alkoholokban a C-O kötés polarizálódik, és egy részleges pozitív töltés koncentrálódik a szénatomon. Ennek eredményeként a szénatomot nukleofil részecskék támadják meg. A C-O kötés felszakítása során egy másik nukleofil helyettesíti a hidroxilcsoportot.
Az egyik ilyen reakció az alkoholok kölcsönhatása hidrogén-halogenidekkel vagy azok koncentrált oldatával. Reakció egyenlet:
C 2 H 5 OH + HBr → C 2 H 5 Br + H 2 O.
A hidroxilcsoport eltávolításának megkönnyítésére tömény kénsavat használnak katalizátorként. Protonálja az oxigénatomot, ezáltal aktiválja az egyértékű alkohol molekulát.
A primer alkoholok, mint a primer halogén-alkánok, az SN 2 mechanizmusnak megfelelően cserereakciókba lépnek. A szekunder egyértékű alkoholok, mint a szekunder halogén-alkánok, reakcióba lépnek hidrogén-halogenidekkel. Az alkoholok kölcsönhatásának feltételei a reagáló komponensek természetétől függenek. Az alkoholok reakcióképessége a következő mintának engedelmeskedik:
R 3 COH → R 2 CHOH → RCH 2 OH.
Oxidáció
Enyhe körülmények között (semleges vagy lúgos kálium-permanganát oldat, króm keverék 40-50 ° C hőmérsékleten) a primer alkoholok aldehidekké oxidálódnak, magasabb hőmérsékletre melegítve pedig savakká. A szekunder alkoholok ketonokká oxidálódnak. A tercierek sav jelenlétében oxidálódnak nagyon kemény körülmények között (például króm keverékkel 180 ° C hőmérsékleten). A tercier alkoholok oxidációs reakciója az alkohol dehidratálásával alkén képződésével, az utóbbi oxidációjával pedig a kettős kötés felszakadásával megy végbe.
Amelyek összetételükben egy vagy több hidroxilcsoportot tartalmaznak. Az OH-csoportok számától függően ezeket egyértékű alkoholokra, háromértékű alkoholokra stb. Leggyakrabban ezeket az összetett anyagokat szénhidrogének származékainak tekintik, amelyek molekulái megváltoztak, mert. egy vagy több hidrogénatomot hidroxilcsoport helyettesített.
Ennek az osztálynak a legegyszerűbb képviselői az egyértékű alkoholok, amelyek általános képlete a következő: R-OH ill.

Cn + H 2n + 1OH.
- A legfeljebb 15 szénatomot tartalmazó alkoholok folyékonyak, 15 vagy annál több szénatomot tartalmazó alkoholok.
- A vízben való oldhatóság a molekulatömegtől függ, minél nagyobb, annál rosszabbul oldódik az alkohol vízben. Így a kis szénatomszámú alkoholok (propanolig) bármilyen arányban elegyednek vízzel, míg a magasabbak gyakorlatilag oldhatatlanok.
- A forráspont is növekszik az atomtömeg növekedésével, például t kip. CH3OH \u003d 65 ° С, és t bp. С2Н5ОН = 78 °С.
- Minél magasabb a forráspont, annál kisebb az illékonyság, azaz. az anyag nem párolog el jól.
Az egy hidroxilcsoportot tartalmazó telített alkoholok fizikai tulajdonságai azzal magyarázhatók, hogy a vegyület vagy az alkohol és a víz egyes molekulái között intermolekuláris hidrogénkötés jön létre.
Az egyértékű alkoholok ilyen kémiai reakciókba léphetnek be:

Az alkoholok kémiai tulajdonságait figyelembe véve megállapíthatjuk, hogy az egyértékű alkoholok amfoter vegyületek, mert. reakcióba léphetnek gyenge tulajdonságokat mutató alkálifémekkel és bázikus tulajdonságokat mutató hidrogén-halogenidekkel. Minden kémiai reakció magában foglalja az O-H vagy a C-O kötés megszakítását.
Így a telített egyértékű alkoholok egy OH-csoporttal rendelkező összetett vegyületek, amelyeknek nincs szabad vegyértékük a C-C kötés kialakulása után, és mind a savak, mind a bázisok gyenge tulajdonságait mutatják. Fizikai és kémiai tulajdonságaik miatt széles körben alkalmazzák szerves szintézisben, oldószerek, üzemanyag-adalékanyagok előállításában, valamint élelmiszeriparban, gyógyászatban, kozmetológiában (etanol).